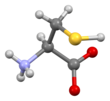
Цистеин
 Скелетная формула L - цистеина
| |||
| |||
| Имена | |||
|---|---|---|---|
| Название ИЮПАК
Цистеин
| |||
Другие имена
| |||
| Идентификаторы | |||
3D model ( JSmol )
|
|||
| Сокращения | Цис , С | ||
| КЭБ | |||
| ХЭМБЛ | |||
| ХимическийПаук | |||
| Информационная карта ECHA | 100.000.145 | ||
| Номер ЕС |
| ||
| номер Е | E920 (глянцеватели, ...) | ||
| КЕГГ | |||
ПабХим CID
|
|||
| НЕКОТОРЫЙ |
| ||
Панель управления CompTox ( EPA )
|
|||
| Характеристики [ 4 ] | |||
| С 3 Н 7 Н О 2 С | |||
| Молярная масса | 121.15 g·mol −1 | ||
| Появление | белые кристаллы или порошок | ||
| Температура плавления | 240 ° C (464 ° F; 513 К) разлагается. | ||
| 277 г/л (при 25 °C) [ 1 ] | |||
| Растворимость | 1,5 г/100 г этанола 19 °C [ 2 ] | ||
| Кислотность ( pKa ) | 1,71 ( сопряженная кислота ), 8,33 ( тиол ), 10,78 [ 3 ] | ||
Хиральное вращение ([α] D )
|
+9,4° (Н 2 О, с = 1,3) | ||
| Страница дополнительных данных | |||
| Цистеин (страница данных) | |||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |||
Цистеин (символ Cys или C ; [ 5 ] / ˈ s ɪ s t ɪ iː n / ) [ 6 ] является полуважным [ 7 ] аминокислота формулы протеиногенная HOOC-CH(-NH 2 )-CH 2 -SH . Тиоловая ферментативных боковая цепь цистеина часто участвует в реакциях в качестве нуклеофила . Цистеин хиральный, но как D , так и L в природе встречаются -цистеин. L -Цистеин является белковым мономером во всей биоте, а D -цистеин действует как сигнальная молекула в нервной системе млекопитающих. [ 8 ] Цистеин назван в честь его открытия в моче, которая поступает из мочевого пузыря или кисты, от греческого κύστη kýsti , «мочевой пузырь». [ 9 ]
Тиол подвержен окислению с образованием дисульфидного производного цистина , который играет важную структурную роль во многих белках . символ Cyx . В этом случае иногда используется [ 10 ] [ 11 ] обычно может быть описана символом Cym . Депротонированная форма также [ 11 ] [ 12 ]
При использовании в качестве пищевой добавки цистеин имеет номер E E920.
Цистеин кодируется кодонами UGU и UGC.
Структура
[ редактировать ]Как и другие аминокислоты (не как остаток белка), цистеин существует в виде цвиттер-иона . Цистеин имеет л хиральность в старшем д / l обозначения, основанные на гомологии с д - и л -глицеральдегид. В новой системе обозначения хиральности R / S , основанной на атомных номерах атомов вблизи асимметричного углерода, цистеин (и селеноцистеин) имеют R- хиральность из-за присутствия серы (или селена) в качестве второго соседа асимметричного углерода. атом. Остальные хиральные аминокислоты, имеющие в этом положении более легкие атомы, имеют S- хиральность. Замена серы селеном дает селеноцистеин .
Диетические источники
[ редактировать ]Цистеинил является остатком в продуктах с высоким содержанием белка . Некоторые продукты, которые считаются богатыми цистеином, включают домашнюю птицу, яйца, говядину и цельнозерновые продукты. В диетах с высоким содержанием белка цистеин может быть частично ответственен за снижение артериального давления и риск инсульта. [ 13 ] Несмотря на то, что он классифицируется как незаменимая аминокислота , [ 14 ] в редких случаях цистеин может быть необходим младенцам, пожилым людям и людям с определенными метаболическими заболеваниями или страдающим мальабсорбции синдромом . Цистеин обычно может синтезироваться организмом человека в нормальных физиологических условиях, если достаточное количество метионина имеется .
Промышленные источники
[ редактировать ]Большинство L -цистеин получают промышленным путем гидролиза материалов животного происхождения, таких как перья птицы или свиная шерсть. Несмотря на широко распространенные слухи, [ 15 ] человеческие волосы редко являются исходным материалом. [ нужна ссылка ] Действительно, производители пищевых добавок или косметических продуктов не могут по закону использовать человеческие волосы в Европейском Союзе. [ 16 ] [ 17 ]
Некоторые источники животного происхождения L -цистеин в качестве пищевой добавки противоречит кошерной, халяльной, веганской или вегетарианской диете. [ 15 ] Чтобы избежать этой проблемы, синтетические L -цистеин, соответствующий еврейским законам о кошерности и мусульманским законам о халяле , также доступен, хотя и по более высокой цене. [ 18 ] Типичный синтетический путь включает ферментацию искусственным штаммом E. coli . [ 19 ]
В качестве альтернативы компания Evonik (ранее Degussa) представила вариант, основанный на замещенных тиазолинах . [ 20 ] Pseudomonas thiazolinophilum гидролизует рацемическую 2‑амино-Δ 2 ‑тиазолин-4‑карбоновая кислота в л- цистеин. [ 19 ]
Биосинтез
[ редактировать ]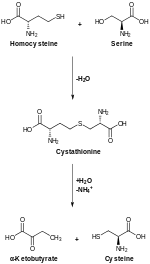
У животных биосинтез начинается с аминокислоты серина . Сера образуется из метионина , который превращается в гомоцистеин через промежуточный S -аденозилметионин . Цистатионин-бета-синтаза затем объединяет гомоцистеин и серин с образованием асимметричного тиоэфира цистатионина . Фермент цистатионин-гамма-лиаза превращает цистатионин в цистеин и альфа-кетобутират . У растений и бактерий биосинтез цистеина также начинается с серина, который превращается в О -ацетилсерин под действием фермента серинтрансацетилазы . Фермент цистеинсинтаза , используя сульфидные источники, превращает этот эфир в цистеин, высвобождая ацетат. [ 21 ]
Биологические функции
[ редактировать ]Сульфгидрильная группа цистеина нуклеофильна и легко окисляется. Реактивность повышается, когда тиол ионизирован, а остатки цистеина в белках имеют значения pK a в реакционноспособной тиолатной форме. , близкие к нейтральным, поэтому часто находятся в клетке [ 22 ] Благодаря своей высокой реакционной способности сульфгидрильная группа цистеина выполняет многочисленные биологические функции.
Предшественник антиоксиданта глутатиона
[ редактировать ]Благодаря способности тиолов вступать в окислительно-восстановительные реакции, остатки цистеина и цистеинила обладают антиоксидантными свойствами. Его антиоксидантные свойства обычно выражаются в трипептиде глутатионе , который встречается в организме человека и других организмах. Системная доступность перорального глутатиона (GSH) незначительна; поэтому он должен быть биосинтезирован из составляющих его аминокислот, цистеина, глицина и глутаминовой кислоты . Хотя глутаминовой кислоты обычно достаточно, поскольку аминокислотный азот перерабатывается через глутамат в качестве посредника, пищевые добавки с цистеином и глицином могут улучшить синтез глутатиона. [ 23 ]
Предшественник железо-серных кластеров
[ редактировать ]Цистеин является важным источником сульфидов в метаболизме человека . Сульфид в железо-серных кластерах и в нитрогеназе экстрагируется из цистеина, который превращается в аланин . при этом [ 24 ]
Связывание ионов металлов
[ редактировать ]Помимо железо-серных белков, многие другие кофакторы металлов в ферментах связаны с тиолатным заместителем цистеинильных остатков. Примеры включают цинк в цинковых пальцах и алкогольдегидрогеназе , медь в белках синей меди , железо в цитохроме P450 и никель в [NiFe] -гидрогеназах . [ 25 ] Сульфгидрильная группа также имеет высокое сродство к тяжелым металлам , поэтому белки, содержащие цистеин, такие как металлотионеин , прочно связывают такие металлы, как ртуть, свинец и кадмий. [ 26 ]
Роли в структуре белка
[ редактировать ]При трансляции молекул информационной РНК с образованием полипептидов цистеин кодируется кодонами UGU и UGC .
Цистеин традиционно считался гидрофильной аминокислотой, в основном на основании химической параллели между его сульфгидрильной группой и гидроксильными группами в боковых цепях других полярных аминокислот. Однако было показано, что боковая цепь цистеина стабилизирует гидрофобные взаимодействия в мицеллах в большей степени, чем боковая цепь неполярной аминокислоты глицина и полярной аминокислоты серина. [ 27 ] При статистическом анализе частоты появления аминокислот в различных белках было обнаружено, что остатки цистеина связаны с гидрофобными участками белков. Их гидрофобная тенденция была эквивалентна таковой у известных неполярных аминокислот, таких как метионин и тирозин (тирозин является полярным ароматическим, но также и гидрофобным соединением). [ 28 ] ), те из которых были намного больше, чем у известных полярных аминокислот, таких как серин и треонин . [ 29 ] Шкалы гидрофобности , которые ранжируют аминокислоты от наиболее гидрофобных до наиболее гидрофильных, последовательно относят цистеин к гидрофобному концу спектра, даже если они основаны на методах, на которые не влияет склонность цистеинов образовывать дисульфидные связи в белках. Поэтому цистеин сейчас часто относят к гидрофобным аминокислотам. [ 30 ] [ 31 ] хотя иногда его также классифицируют как слегка полярный, [ 32 ] или полярный. [ 7 ]
Большинство остатков цистеина ковалентно связаны с другими остатками цистеина с образованием дисульфидных связей , которые играют важную роль в сворачивании и стабильности некоторых белков, обычно белков, секретируемых во внеклеточную среду. [ 33 ] Поскольку большинство клеточных компартментов представляют собой восстановительную среду обычно нестабильны, , дисульфидные связи в цитозоле за некоторыми исключениями, как указано ниже.

Дисульфидные связи в белках образуются путем окисления сульфгидрильной группы остатков цистеина. Другая серосодержащая аминокислота — метионин — не может образовывать дисульфидные связи. Более агрессивные окислители превращают цистеин в соответствующие сульфиновую кислоту и сульфоновую кислоту . Остатки цистеина играют ценную роль, сшивая белки, что увеличивает жесткость белков, а также обеспечивает протеолитическую устойчивость (поскольку экспорт белка является дорогостоящим процессом, сведение к минимуму его необходимости выгодно). Внутри клетки дисульфидные мостики между остатками цистеина внутри полипептида поддерживают третичную структуру белка. Инсулин является примером белка со сшивкой цистина, в котором две отдельные пептидные цепи соединены парой дисульфидных связей.
Белковые дисульфид-изомеразы катализируют правильное образование дисульфидных связей ; клетка переносит дегидроаскорбиновую кислоту в эндоплазматический ретикулум , который окисляет окружающую среду. В этой среде цистеины, как правило, окисляются до цистина и больше не действуют как нуклеофилы.
Помимо окисления до цистина, цистеин участвует в многочисленных посттрансляционных модификациях . Нуклеофильная . группа позволяет цистеину конъюгировать с другими группами, например, при пренилировании сульфгидрильная Убиквитинлигазы переносят убиквитин к его подвеске , белкам и каспазам , которые участвуют в протеолизе в апоптотическом цикле. Интеины часто функционируют с помощью каталитического цистеина. Эти роли обычно ограничиваются внутриклеточной средой, где среда восстанавливается и цистеин не окисляется до цистина.
Эволюционная роль цистеина
[ редактировать ]Цистеин считается «новой» аминокислотой, поскольку он является 17-й аминокислотой, включенной в генетический код . [ 34 ] [ 35 ] Подобно другим добавленным позже аминокислотам, таким как метионин , тирозин и триптофан , цистеин проявляет сильные нуклеофильные и окислительно-восстановительные свойства. [ 36 ] [ 37 ] Эти свойства способствуют истощению цистеина из комплексов дыхательной цепи , таких как комплексы I и IV . [ 38 ] поскольку активные формы кислорода ( АФК ), вырабатываемые дыхательной цепью, могут вступать в реакцию с остатками цистеина в этих комплексах, что приводит к дисфункции белков и потенциально способствует старению. Первичной реакцией белка на АФК является окисление цистеина и потеря свободных тиоловых групп. [ 39 ] что приводит к увеличению количества тиильных радикалов и связанному с ними перекрестному сшиванию белков. [ 40 ] [ 41 ] Напротив, другая серосодержащая редокс-активная аминокислота, метионин, не проявляет этих биохимических свойств, и ее содержание относительно регулируется в митохондриально- кодируемых белках. [ 42 ]
Приложения
[ редактировать ]Цистеин, главным образом L - энантиомер , является предшественником в пищевой, фармацевтической промышленности и производстве средств личной гигиены. Одним из крупнейших применений является производство ароматизаторов. Например, реакция цистеина с сахарами в реакции Майяра дает мясной вкус. [ 43 ] l -Цистеин также используется в качестве технологической добавки при выпечке. [ 44 ]
В сфере личной гигиены цистеин используется для перманентной завивки , преимущественно в Азии. Опять же, цистеин используется для разрушения дисульфидных связей волос кератине в .
Цистеин является очень популярной мишенью для экспериментов по сайт-направленному мечению для изучения биомолекулярной структуры и динамики. Малеимиды избирательно прикрепляются к цистеину с помощью ковалентного присоединения по Михаэлю . Сайт-направленное спиновое мечение для ЭПР или ЯМР, усиленного парамагнитной релаксацией, также широко использует цистеин.
Снижение токсического воздействия алкоголя
[ редактировать ]Цистеин был предложен в качестве профилактического средства или противоядия при некоторых негативных последствиях алкоголя, включая повреждение печени и похмелье . Он противодействует ядовитому воздействию ацетальдегида . [ 45 ] Он связывается с ацетальдегидом с образованием малотоксичного гетероцикла метилтиопролина . [ 46 ]
В исследовании на крысах подопытные животные получали LD 90 дозу ацетальдегида . У тех, кто получал цистеин, выживаемость составляла 80%; и цистеин, и тиамин когда вводили , все животные выжили. В контрольной группе выживаемость составила 10%. [ 47 ]
В 2020 году была опубликована статья, в которой предполагается, что L-цистеин может действовать и на людей. [ 48 ]
N -ацетилцистеин
[ редактировать ]N -Ацетил- L -цистеин представляет собой производное цистеина, в котором ацетильная группа присоединена к атому азота. Это соединение продается как пищевая добавка и используется в качестве противоядия в случаях передозировки ацетаминофена . [ 49 ]
Овца
[ редактировать ]Цистеин необходим овцам для производства шерсти. Это незаменимая аминокислота, которую они получают с кормом. Как следствие, в условиях засухи овцы производят меньше шерсти; однако были разработаны трансгенные овцы, способные вырабатывать собственный цистеин. [ 50 ]
Химические реакции
[ редактировать ]Будучи многофункциональным, цистеин вступает в разнообразные реакции. Большое внимание было сосредоточено на защите сульфгидрильной группы. [ 51 ] Метилирование цистеина дает S-метилцистеин . Лечение формальдегидом дает тиазолидин тиопролин . Цистеин образует разнообразные координационные комплексы при обработке ионами металлов. [ 52 ]
Безопасность
[ редактировать ]По сравнению с большинством других аминокислот цистеин гораздо более токсичен. [ 53 ]
История
[ редактировать ]Этот раздел нуждается в расширении . Вы можете помочь, добавив к нему . ( январь 2023 г. ) |
В 1884 году немецкий химик Ойген Бауман обнаружил, что при обработке цистина восстановителем цистин оказался димером мономера , который он назвал «цистеином». [ 54 ]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ «Данные PubChem» .
- ^ Белиц, Х.-Д; Грош, Вернер; Шиберле, Питер (27 февраля 2009 г.). Пищевая химия . Спрингер. ISBN 9783540699330 .
- ↑ Кирсте, Буркхард (23 января 1998 г.). « Цистеин ». Обзор аминокислот . Кафедра Свободного университета Берлина . биологии, химии и фармации. Архивировано 10 ноября 2016 г. в Wayback Machine.
- ^ Уэст, Роберт С., изд. (1981). Справочник CRC по химии и физике (62-е изд.). Бока-Ратон, Флорида: CRC Press. п. С-259. ISBN 0-8493-0462-8 . .
- ^ «Номенклатура и символика аминокислот и пептидов (Рекомендации IUPAC-IUB, 1983 г.)», Pure Appl. хим. , 56 (5): 595–624, 1984, doi : 10.1351/pac198456050595.
- ^ «Цистеин - Определение цистеина на английском языке в Оксфордских словарях» . Оксфордские словари — английский язык . Архивировано из оригинала 25 сентября 2016 года . Проверено 15 апреля 2018 г.
- ^ Перейти обратно: а б «Первичной структурой белков является последовательность аминокислот» . Микробный мир . Кафедра бактериологии Университета Висконсин-Мэдисон. Архивировано из оригинала 25 мая 2013 года . Проверено 16 сентября 2012 г.
- ^ Семенца, Эван Р.; Харраз, Магед М.; Абрамсон, Эфрат; Малла, Адарша П.; Васавда, Чираг; Гадалла, Моатаз М.; Корнберг, Майкл Д.; Снайдер, Соломон Х.; Ройчаудхури, Робин (23 сентября 2021 г.) [18 августа 2021 г.]. «D-цистеин является эндогенным регулятором динамики нервных клеток-предшественников в мозге млекопитающих» . ПНАС . 118 (39): e2110610118. Бибкод : 2021PNAS..11810610S . дои : 10.1073/pnas.2110610118 . ПМЦ 8488618 . ПМИД 34556581 .
- ^ Шафран, М. (апрель 1998 г.). «Названия аминокислот и комнатные игры: от тривиальных названий до однобуквенного кода, названия аминокислот напрягают память студентов. Возможна ли более рациональная номенклатура?» . Биохимическое образование . 26 (2): 116–118. дои : 10.1016/s0307-4412(97)00167-2 . ISSN 0307-4412 .
- ^ «Amber Workshop — Учебное пособие A1 — Раздел 1. Отредактируйте файл PDB» . ambermd.org . Архивировано из оригинала 22 мая 2022 г. Проверено 2 июня 2022 г.
- ^ Перейти обратно: а б Ли, Джумин; Хитценбергер, Мануэль; Ригер, Мануэль; Керн, Натан Р.; Захариас, Мартин; Им, Вонпиль (21 июля 2020 г.). «CHARMM-GUI поддерживает силовые поля Янтаря» . Журнал химической физики . 153 (3): 035103. дои : 10.1063/5.0012280 . ПМИД 32716185 . S2CID 220796795 .
- ^ «Amber Workshop — Учебное пособие A1 — Раздел 1. Отредактируйте файл PDB» . ambermd.org . Архивировано из оригинала 22 мая 2022 г. Проверено 2 июня 2022 г.
- ^ Ларссон, Сюзанна К.; Хоканссон, Никлас; Волк, Алисия (апрель 2015 г.). «Диетический цистеин и другие аминокислоты и частота инсульта у женщин» . Гладить . 46 (4): 922–926. дои : 10.1161/СТРОКЕАХА.114.008022 . PMID 25669310 . S2CID 14895681 .
- ^ «Цистеин — Энциклопедия здоровья — Медицинский центр Рочестерского университета» . www.urmc.rochester.edu . Проверено 13 мая 2024 г.
- ^ Перейти обратно: а б См., например, Блех, Зуше Йосеф (май 2003 г.). «Как горы, висящие на волоске: кошерные проблемы в L-цистеине (Комментарий к Чагиге I:8)» . Новости МК и мнения . Том. IV, нет. 6. Монреальский кошерный – через kashrut.com. Раввин Блех не упоминает цистеин, полученный из свиной шерсти, который почти наверняка является трейфом .
- ^ «Требования ЕС к химическим веществам» . Проверено 24 мая 2020 г.
...L-цистеина гидрохлорид или гидрохлорид моногидрат. Человеческие волосы не могут использоваться в качестве источника этого вещества.
- ^ «Регламент (ЕС) № 1223/2009 Европейского парламента и Совета от 30 ноября 2009 г. о косметической продукции» . Проверено 28 июля 2021 г.
...ПРИЛОЖЕНИЕ II ПЕРЕЧЕНЬ ВЕЩЕСТВ, ЗАПРЕЩЕННЫХ В КОСМЕТИЧЕСКОЙ ПРОДУКЦИИ...416 Клетки, ткани или продукты человеческого происхождения
- ^ «Вопросы о пищевых ингредиентах: что такое L-цистеин/цистеин/цистин?» . Вегетарианская ресурсная группа.
- ^ Перейти обратно: а б Драуз, Карлхайнц; Грейсон, Ян; Климанн, Аксель; Криммер, Ганс Петер; Лейхтенбергер, Вольфганг; Векбекер, Кристоф (2007). «Аминокислоты». Энциклопедия промышленной химии Ульмана . дои : 10.1002/14356007.a02_057.pub2 . ISBN 978-3-527-30673-2 .
- ^ Мартенс, Юрген; Офферманнс, Гериберт ; Шерберих, Пол (1981). «Легкий синтез рацемических цистеинов». Международное издание «Прикладная химия» на английском языке . 20 (8): 668. doi : 10.1002/anie.198106681 .
- ^ Ад Р (1997). «Молекулярная физиология обмена серы растений». Планта . 202 (2): 138–48. Бибкод : 1997Plant.202..138H . дои : 10.1007/s004250050112 . ПМИД 9202491 . S2CID 2539629 .
- ^ Булай Г., Кортемме Т., Гольденберг Д.П. (июнь 1998 г.). «Взаимосвязь ионизации и реакционной способности тиолов цистеина в полипептидах». Биохимия . 37 (25): 8965–72. дои : 10.1021/bi973101r . ПМИД 9636038 .
- ^ Сехар, Раджагопал V; Патель, Санджит Дж. (2011). «Дефицитный синтез глутатиона лежит в основе окислительного стресса при старении и может быть исправлен с помощью пищевых добавок с цистеином и глицином» . Американский журнал клинического питания . 94 (3): 847–853. дои : 10.3945/ajcn.110.003483 . ПМК 3155927 . ПМИД 21795440 .

- ^ Лилль Р., Мюленхофф У (2006). «Биогенез железо-серных белков у эукариот: компоненты и механизмы» . Анну. Преподобный Cell Dev. Биол . 22 : 457–86. doi : 10.1146/annurev.cellbio.22.010305.104538 . ПМИД 16824008 .
- ^ Липпард, Стивен Дж.; Берг, Джереми М. (1994). Основы бионеорганической химии . Милл-Вэлли, Калифорния: Университетские научные книги. ISBN 978-0-935702-73-6 . [ нужна страница ]
- ^ Бейкер Д.Х., Чарнецкий-Молден Г.Л. (июнь 1987 г.). «Фармакологическая роль цистеина в уменьшении или обострении минеральной токсичности» . Дж. Нутр . 117 (6): 1003–10. дои : 10.1093/jn/117.6.1003 . ПМИД 3298579 .
- ^ Хайтманн П. (январь 1968 г.). «Модель сульфгидрильных групп в белках. Гидрофобные взаимодействия боковой цепи цистеина в мицеллах» . Евро. Дж. Биохим . 3 (3): 346–50. дои : 10.1111/j.1432-1033.1968.tb19535.x . ПМИД 5650851 .
- ^ «Обзор аминокислот (учебник)» . Университет Кертина. Архивировано из оригинала 7 сентября 2015 г. Проверено 9 сентября 2015 г.
- ^ Нагано Н., Ота М., Нисикава К. (сентябрь 1999 г.). «Сильная гидрофобная природа остатков цистеина в белках» . ФЭБС Летт . 458 (1): 69–71. Бибкод : 1999FEBSL.458...69N . дои : 10.1016/S0014-5793(99)01122-9 . ПМИД 10518936 . S2CID 34980474 .
- ^ Беттс, MJ; Р.Б. Рассел (2003). «Гидрофобные аминокислоты» . Свойства аминокислот и последствия замен, В кн.: Биоинформатика для генетиков . Уайли . Проверено 16 сентября 2012 г.
- ^ Горга, Фрэнк Р. (1998–2001). «Введение в структуру белка - неполярные аминокислоты» . Архивировано из оригинала 5 сентября 2012 г. Проверено 16 сентября 2012 г.
- ^ «Виртуальная химическая книга — структура аминокислот» . Элмхерстский колледж. Архивировано из оригинала 2 октября 2012 г. Проверено 16 сентября 2012 г.
- ^ Sevier CS, Kaiser CA (ноябрь 2002 г.). «Образование и перенос дисульфидных связей в живых клетках» . Нат. Преподобный мол. Клеточная Биол . 3 (11): 836–47. дои : 10.1038/nrm954 . ПМИД 12415301 . S2CID 2885059 .
- ^ Осава, С; Джукс, TH; Ватанабэ, К; Муто, А. (март 1992 г.). «Недавние доказательства эволюции генетического кода» . Микробиологические обзоры . 56 (1): 229–264. дои : 10.1128/мр.56.1.229-264.1992 . ISSN 0146-0749 . ПМЦ 372862 . ПМИД 1579111 .
- ^ Трифонов, Эдвард Н. (сентябрь 2009 г.). «Происхождение генетического кода и самых ранних олигопептидов» . Исследования в области микробиологии . 160 (7): 481–486. дои : 10.1016/j.resmic.2009.05.004 . ПМИД 19524038 .
- ^ Полсен, Кэндис Э.; Кэрролл, Кейт С. (10 июля 2013 г.). «Цистеин-опосредованная окислительно-восстановительная передача сигналов: химия, биология и инструменты для открытий» . Химические обзоры . 113 (7): 4633–4679. дои : 10.1021/cr300163e . ISSN 0009-2665 . ПМК 4303468 . ПМИД 23514336 .
- ^ Джайлз, Нирошини М; Уоттс, Аарон Б; Джайлз, Грегори I; Фрай, Фиона Х; Литлчайлд, Дженнифер А; Джейкоб, Клаус (август 2003 г.). «Металлическая и окислительно-восстановительная модуляция функции белка-цистеина» . Химия и биология . 10 (8): 677–693. дои : 10.1016/s1074-5521(03)00174-1 . ISSN 1074-5521 . ПМИД 12954327 .
- ^ Моосманн, Бернд; Бел, Кристиан (февраль 2008 г.). «Цистеин, кодируемый митохондриями, предсказывает продолжительность жизни животных» . Стареющая клетка . 7 (1): 32–46. дои : 10.1111/j.1474-9726.2007.00349.x . ISSN 1474-9718 . ПМИД 18028257 .
- ^ Сохал, Раджиндар С (1 июля 2002 г.). «Роль окислительного стресса и окисления белков в процессе старения1, 2» . Свободнорадикальная биология и медицина . 33 (1): 37–44. дои : 10.1016/S0891-5849(02)00856-0 . ISSN 0891-5849 . ПМИД 12086680 .
- ^ Джейкоб, Клаус; Джайлз, Грегори И.; Джайлз, Нирошини М.; Сис, Хельмут (13 октября 2003 г.). «Сера и селен: роль степени окисления в структуре и функции белка» . Angewandte Chemie, международное издание . 42 (39): 4742–4758. дои : 10.1002/anie.200300573 . ISSN 1433-7851 . ПМИД 14562341 .
- ^ Наузер, Томас; Пеллинг, Джилл; Шенайх, Кристиан (1 октября 2004 г.). «Реакция тиильного радикала с боковыми цепями аминокислот: константы скорости переноса водорода и значимость для посттрансляционной модификации белка» . Химические исследования в токсикологии . 17 (10): 1323–1328. дои : 10.1021/tx049856y . ISSN 0893-228X . ПМИД 15487892 .
- ^ Моосманн, Бернд; Хаджиева, Парвана; Бел, Кристиан (2006), «Антиоксидантная функция белка метионина объясняет эволюцию нестандартного генетического кода в митохондриях», Free Radical Biology and Medicine , 41 402: S149–S150, doi : 10.1016/j.freeradbiomed. 2006.10.015
- ^ Хуан, Цзоу-Чи; Хо, Чи-Тан (27 июля 2001 г.). Хуэй, Ю. Х.; Нип, Вай-Кит; Роджерс, Роберт (ред.). Наука и применение мяса, гл. Вкус мясных продуктов . КПР. стр. 71–102. ISBN 978-0-203-90808-2 .
- ^ «Пищевые ингредиенты и красители» . Управление по контролю за продуктами и лекарствами США. Ноябрь 2004 г. Архивировано из оригинала 12 мая 2009 г. Проверено 6 сентября 2009 г.
- ^ Отояма, Хиронобу, Тацуши; Секикава, Киёкадзу; Кадзивара, Теруки; Сато, Ёсинобу М. (2019) . ослабление ацетальдегидом: оценка in vitro» . PLOS ONE . 14 (3): e0214585. Bibcode : 2019PLoSO..1414585O . doi : /journal.pone.0214585 . PMC 6440629. 10.1371 PMID 30925182 .
- ^ Саласпуро, Вилле (2006). Взаимодействие алкоголя и курения в патогенезе рака верхних отделов пищеварительного тракта: возможности химиопрофилактики цистеином (Ученая диссертация). Университет Хельсинки . стр. 41–44. hdl : 10138/22689 . URN:ISBN:952-10-3056-9 .
- ^ Спринс Х., Паркер К.М., Смит Г.Г., Гонсалес Л.Дж. (апрель 1974 г.). «Защита крыс от токсичности ацетальдегида с помощью L-цистеина, тиамина и L-2-метилтиазолидин-4-карбоновой кислоты». Действия агентов . 4 (2): 125–30. дои : 10.1007/BF01966822 . ПМИД 4842541 . S2CID 5924137 .
- ^ Эрикссон, CJ Питер; Метсала, Маркус; Мейкинен, Томми; Мякисало, Хейкки; Кярккяйнен, Олли; Пальмен, Мария; Салминен, Йоонас Э; Кауханен, Юсси (20 октября 2020 г.). «L-цистеин, содержащая витаминную добавку, которая предотвращает или облегчает симптомы похмелья, связанные с алкоголем: тошноту, головную боль, стресс и беспокойство». Алкоголь и алкоголизм . 55 (6): 660–666. дои : 10.1093/alcalc/agaa082 . hdl : 10138/339340 . ПМИД 32808029 .
- ^ Кантер М.З. (октябрь 2006 г.). «Сравнение перорального и внутривенного ацетилцистеина при лечении отравления ацетаминофеном». Am J Health Syst Pharm . 63 (19): 1821–7. дои : 10.2146/ajhp060050 . ПМИД 16990628 . S2CID 9209528 .
- ^ Пауэлл Б.С., Уокер С.К., Бауден К.С., Сивапрасад А.В., Роджерс Г.Е. (1994). «Выращивание трансгенных овец и шерсти: возможности и текущий статус». Репродукция. Плодородный. Дев . 6 (5): 615–23. дои : 10.1071/RD9940615 . ПМИД 7569041 .
- ^ Милковски, Джон Д.; Вебер, Дэниел Ф.; Хиршманн, Ральф (1979). «Тиоловая защита с помощью ацетамидометильной группы: S-ацетамидометил-L-цистеина гидрохлорид». Органические синтезы . 59 : 190. дои : 10.15227/orgsyn.059.0190 .
- ^ Арнольд, Алан П.; Джексон, В. Грегори (1990). «Стереоспецифичность в синтезе ионов трис(( R )-цистеинато- N,S )- и трис(( R )-цистеинсульфинато-N,S)кобальтата(III)». Неорганическая химия . 29 (18): 3618–3620. дои : 10.1021/ic00343a061 .
- ^ Андерсон, Мэри Э.; Мейстер, Альтон (1987). «Внутриклеточная доставка цистеина». Сера и серные аминокислоты . Методы энзимологии. Том. 143. стр. 313–325. дои : 10.1016/0076-6879(87)43059-0 . ISBN 9780121820435 . ПМИД 3309557 .
- ^ Бауманн, Э. (1884). «Ueber Cystin und Cystein» [О цистине и цистеине]. Zeitschrift für физиологической химии (на немецком языке). 8 : 299–305. Со стр. 301-302: «Die Analysis der Substanz ergibt Werthe, welche den vom Cystin (C 6 H 12 N 2 S 2 O 4 ) verlangten sich nähern, […] nenne ich dieses Reduktionsprodukt des Cystins: Cystein». (Анализ вещества [цистеин] показывает значения, которые приближаются к тем, [которые] необходимы для цистина (C 6 H 12 N 2 S 2 O 4 ), однако новое основание [цистеин] можно явно признать продуктом восстановления цистина. , которому [эмпирическая] формула C 3 H 7 NSO 2 , [которая] ранее [приписывалась] цистину, [теперь] приписывается, чтобы указать на отношения этого вещества с цистином, я называю этот продукт восстановления. цистина: «цистеин».) Примечание: Предложенные Бауманом структуры цистеина и цистина (см. стр. 302) неверны: для цистеина он предложил CH 3 CNH 2 (SH)COOH.
Дальнейшее чтение
[ редактировать ]- Нагано Н., Ота М., Нисикава К. (сентябрь 1999 г.). «Сильная гидрофобная природа остатков цистеина в белках» . ФЭБС Летт . 458 (1): 69–71. Бибкод : 1999FEBSL.458...69N . дои : 10.1016/S0014-5793(99)01122-9 . ПМИД 10518936 . S2CID 34980474 .
Внешние ссылки
[ редактировать ]- Холли (2005). Информационный центр по цистинурии
- Цистеин МС Спектр
- Международный институт камней в почках. Архивировано 13 мая 2019 г. в Wayback Machine.