Генная инженерия
| Часть серии о |
| Генная инженерия |
|---|
 |
| Генетически модифицированные организмы |
| История и регулирование |
| Process |
| Applications |
| Controversies |
Генная инженерия , также называемая генетической модификацией или генетическими манипуляциями организма , представляет собой модификацию и манипулирование генами с использованием технологий . Это набор технологий, используемых для изменения генетического состава клеток, включая перенос генов внутри видов и за их пределы для создания улучшенных или новых организмов .
Новую ДНК получают либо путем выделения и копирования интересующего генетического материала с использованием рекомбинантной ДНК методов , либо путем искусственного синтеза ДНК. для Обычно создается и используется конструкция вставки этой ДНК в организм хозяина. Первую рекомбинантную молекулу ДНК создал Пол Берг в 1972 году путем объединения ДНК обезьяньего вируса SV40 с вирусом лямбда .
Помимо вставки генов , этот процесс можно использовать для удаления или « выключения » генов. Новая ДНК может быть вставлена случайным образом или нацелена на определенную часть генома . [1]
An organism that is generated through genetic engineering is considered to be genetically modified (GM) and the resulting entity is a genetically modified organism (GMO). The first GMO was a bacterium generated by Herbert Boyer and Stanley Cohen in 1973. Rudolf Jaenisch created the first GM animal when he inserted foreign DNA into a mouse in 1974. The first company to focus on genetic engineering, Genentech, was founded in 1976 and started the production of human proteins. Genetically engineered human insulin was produced in 1978 and insulin-producing bacteria were commercialised in 1982. Genetically modified food has been sold since 1994, with the release of the Flavr Savr tomato. The Flavr Savr was engineered to have a longer shelf life, but most current GM crops are modified to increase resistance to insects and herbicides. GloFish, the first GMO designed as a pet, was sold in the United States in December 2003. In 2016 salmon modified with a growth hormone were sold.
Genetic engineering has been applied in numerous fields including research, medicine, industrial biotechnology and agriculture. In research, GMOs are used to study gene function and expression through loss of function, gain of function, tracking and expression experiments. By knocking out genes responsible for certain conditions it is possible to create animal model organisms of human diseases. As well as producing hormones, vaccines and other drugs, genetic engineering has the potential to cure genetic diseases through gene therapy. Chinese hamster ovary (CHO) cells are used in industrial genetic engineering. Additionally mRNA vaccines are made through genetic engineering to treat viruses such as COVID-19. The same techniques that are used to produce drugs can also have industrial applications such as producing enzymes for laundry detergent, cheeses and other products.
The rise of commercialised genetically modified crops has provided economic benefit to farmers in many different countries, but has also been the source of most of the controversy surrounding the technology. This has been present since its early use; the first field trials were destroyed by anti-GM activists. Although there is a scientific consensus that currently available food derived from GM crops poses no greater risk to human health than conventional food, critics consider GM food safety a leading concern. Gene flow, impact on non-target organisms, control of the food supply and intellectual property rights have also been raised as potential issues. These concerns have led to the development of a regulatory framework, which started in 1975. It has led to an international treaty, the Cartagena Protocol on Biosafety, that was adopted in 2000. Individual countries have developed their own regulatory systems regarding GMOs, with the most marked differences occurring between the United States and Europe.
Genetic engineering: Process of inserting new genetic information into existing cells in order to modify a specific organism for the purpose of changing its characteristics.
Overview
[edit]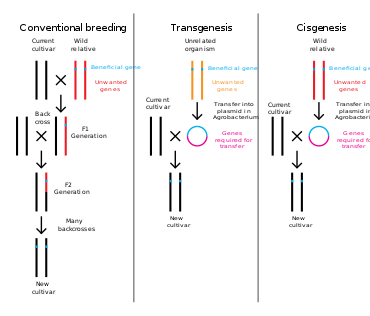
Genetic engineering is a process that alters the genetic structure of an organism by either removing or introducing DNA, or modifying existing genetic material in situ. Unlike traditional animal and plant breeding, which involves doing multiple crosses and then selecting for the organism with the desired phenotype, genetic engineering takes the gene directly from one organism and delivers it to the other. This is much faster, can be used to insert any genes from any organism (even ones from different domains) and prevents other undesirable genes from also being added.[4]
Genetic engineering could potentially fix severe genetic disorders in humans by replacing the defective gene with a functioning one.[5] It is an important tool in research that allows the function of specific genes to be studied.[6] Drugs, vaccines and other products have been harvested from organisms engineered to produce them.[7] Crops have been developed that aid food security by increasing yield, nutritional value and tolerance to environmental stresses.[8]
The DNA can be introduced directly into the host organism or into a cell that is then fused or hybridised with the host.[9] This relies on recombinant nucleic acid techniques to form new combinations of heritable genetic material followed by the incorporation of that material either indirectly through a vector system or directly through micro-injection, macro-injection or micro-encapsulation.
Genetic engineering does not normally include traditional breeding, in vitro fertilisation, induction of polyploidy, mutagenesis and cell fusion techniques that do not use recombinant nucleic acids or a genetically modified organism in the process.[9] However, some broad definitions of genetic engineering include selective breeding.[10] Cloning and stem cell research, although not considered genetic engineering,[11] are closely related and genetic engineering can be used within them.[12] Synthetic biology is an emerging discipline that takes genetic engineering a step further by introducing artificially synthesised material into an organism.[13]
Plants, animals or microorganisms that have been changed through genetic engineering are termed genetically modified organisms or GMOs.[14] If genetic material from another species is added to the host, the resulting organism is called transgenic. If genetic material from the same species or a species that can naturally breed with the host is used the resulting organism is called cisgenic.[15] If genetic engineering is used to remove genetic material from the target organism the resulting organism is termed a knockout organism.[16] In Europe genetic modification is synonymous with genetic engineering while within the United States of America and Canada genetic modification can also be used to refer to more conventional breeding methods.[17][18][19]
History
[edit]Humans have altered the genomes of species for thousands of years through selective breeding, or artificial selection[20]: 1 [21]: 1 as contrasted with natural selection. More recently, mutation breeding has used exposure to chemicals or radiation to produce a high frequency of random mutations, for selective breeding purposes. Genetic engineering as the direct manipulation of DNA by humans outside breeding and mutations has only existed since the 1970s. The term "genetic engineering" was coined by the Russian-born geneticist Nikolay Timofeev-Ressovsky in his 1934 paper "The Experimental Production of Mutations", published in the British journal Biological Reviews.[22] Jack Williamson used the term in his science fiction novel Dragon's Island, published in 1951[23] – one year before DNA's role in heredity was confirmed by Alfred Hershey and Martha Chase,[24] and two years before James Watson and Francis Crick showed that the DNA molecule has a double-helix structure – though the general concept of direct genetic manipulation was explored in rudimentary form in Stanley G. Weinbaum's 1936 science fiction story Proteus Island.[25][26]

In 1972, Paul Berg created the first recombinant DNA molecules by combining DNA from the monkey virus SV40 with that of the lambda virus.[27] In 1973 Herbert Boyer and Stanley Cohen created the first transgenic organism by inserting antibiotic resistance genes into the plasmid of an Escherichia coli bacterium.[28][29] A year later Rudolf Jaenisch created a transgenic mouse by introducing foreign DNA into its embryo, making it the world's first transgenic animal[30] These achievements led to concerns in the scientific community about potential risks from genetic engineering, which were first discussed in depth at the Asilomar Conference in 1975. One of the main recommendations from this meeting was that government oversight of recombinant DNA research should be established until the technology was deemed safe.[31][32]
In 1976 Genentech, the first genetic engineering company, was founded by Herbert Boyer and Robert Swanson and a year later the company produced a human protein (somatostatin) in E. coli. Genentech announced the production of genetically engineered human insulin in 1978.[33] In 1980, the U.S. Supreme Court in the Diamond v. Chakrabarty case ruled that genetically altered life could be patented.[34] The insulin produced by bacteria was approved for release by the Food and Drug Administration (FDA) in 1982.[35]
In 1983, a biotech company, Advanced Genetic Sciences (AGS) applied for U.S. government authorisation to perform field tests with the ice-minus strain of Pseudomonas syringae to protect crops from frost, but environmental groups and protestors delayed the field tests for four years with legal challenges.[36] In 1987, the ice-minus strain of P. syringae became the first genetically modified organism (GMO) to be released into the environment[37] when a strawberry field and a potato field in California were sprayed with it.[38] Both test fields were attacked by activist groups the night before the tests occurred: "The world's first trial site attracted the world's first field trasher".[37]
The first field trials of genetically engineered plants occurred in France and the US in 1986, tobacco plants were engineered to be resistant to herbicides.[39] The People's Republic of China was the first country to commercialise transgenic plants, introducing a virus-resistant tobacco in 1992.[40] In 1994 Calgene attained approval to commercially release the first genetically modified food, the Flavr Savr, a tomato engineered to have a longer shelf life.[41] In 1994, the European Union approved tobacco engineered to be resistant to the herbicide bromoxynil, making it the first genetically engineered crop commercialised in Europe.[42] In 1995, Bt potato was approved safe by the Environmental Protection Agency, after having been approved by the FDA, making it the first pesticide producing crop to be approved in the US.[43] In 2009 11 transgenic crops were grown commercially in 25 countries, the largest of which by area grown were the US, Brazil, Argentina, India, Canada, China, Paraguay and South Africa.[44]
In 2010, scientists at the J. Craig Venter Institute created the first synthetic genome and inserted it into an empty bacterial cell. The resulting bacterium, named Mycoplasma laboratorium, could replicate and produce proteins.[45][46] Four years later this was taken a step further when a bacterium was developed that replicated a plasmid containing a unique base pair, creating the first organism engineered to use an expanded genetic alphabet.[47][48] In 2012, Jennifer Doudna and Emmanuelle Charpentier collaborated to develop the CRISPR/Cas9 system,[49][50] a technique which can be used to easily and specifically alter the genome of almost any organism.[51]
Process
[edit]
Creating a GMO is a multi-step process. Genetic engineers must first choose what gene they wish to insert into the organism. This is driven by what the aim is for the resultant organism and is built on earlier research. Genetic screens can be carried out to determine potential genes and further tests then used to identify the best candidates. The development of microarrays, transcriptomics and genome sequencing has made it much easier to find suitable genes.[52] Luck also plays its part; the Roundup Ready gene was discovered after scientists noticed a bacterium thriving in the presence of the herbicide.[53]
Gene isolation and cloning
[edit]The next step is to isolate the candidate gene. The cell containing the gene is opened and the DNA is purified.[54] The gene is separated by using restriction enzymes to cut the DNA into fragments[55] or polymerase chain reaction (PCR) to amplify up the gene segment.[56] These segments can then be extracted through gel electrophoresis. If the chosen gene or the donor organism's genome has been well studied it may already be accessible from a genetic library. If the DNA sequence is known, but no copies of the gene are available, it can also be artificially synthesised.[57] Once isolated the gene is ligated into a plasmid that is then inserted into a bacterium. The plasmid is replicated when the bacteria divide, ensuring unlimited copies of the gene are available.[58] The RK2 plasmid is notable for its ability to replicate in a wide variety of single-celled organisms, which makes it suitable as a genetic engineering tool.[59]
Before the gene is inserted into the target organism it must be combined with other genetic elements. These include a promoter and terminator region, which initiate and end transcription. A selectable marker gene is added, which in most cases confers antibiotic resistance, so researchers can easily determine which cells have been successfully transformed. The gene can also be modified at this stage for better expression or effectiveness. These manipulations are carried out using recombinant DNA techniques, such as restriction digests, ligations and molecular cloning.[60]
Inserting DNA into the host genome
[edit]
There are a number of techniques used to insert genetic material into the host genome. Some bacteria can naturally take up foreign DNA. This ability can be induced in other bacteria via stress (e.g. thermal or electric shock), which increases the cell membrane's permeability to DNA; up-taken DNA can either integrate with the genome or exist as extrachromosomal DNA. DNA is generally inserted into animal cells using microinjection, where it can be injected through the cell's nuclear envelope directly into the nucleus, or through the use of viral vectors.[61]
Plant genomes can be engineered by physical methods or by use of Agrobacterium for the delivery of sequences hosted in T-DNA binary vectors. In plants the DNA is often inserted using Agrobacterium-mediated transformation,[62] taking advantage of the Agrobacteriums T-DNA sequence that allows natural insertion of genetic material into plant cells.[63] Other methods include biolistics, where particles of gold or tungsten are coated with DNA and then shot into young plant cells,[64] and electroporation, which involves using an electric shock to make the cell membrane permeable to plasmid DNA.
As only a single cell is transformed with genetic material, the organism must be regenerated from that single cell. In plants this is accomplished through the use of tissue culture.[65][66] In animals it is necessary to ensure that the inserted DNA is present in the embryonic stem cells.[67] Bacteria consist of a single cell and reproduce clonally so regeneration is not necessary. Selectable markers are used to easily differentiate transformed from untransformed cells. These markers are usually present in the transgenic organism, although a number of strategies have been developed that can remove the selectable marker from the mature transgenic plant.[68]

Further testing using PCR, Southern hybridization, and DNA sequencing is conducted to confirm that an organism contains the new gene.[69] These tests can also confirm the chromosomal location and copy number of the inserted gene. The presence of the gene does not guarantee it will be expressed at appropriate levels in the target tissue so methods that look for and measure the gene products (RNA and protein) are also used. These include northern hybridisation, quantitative RT-PCR, Western blot, immunofluorescence, ELISA and phenotypic analysis.[70]
The new genetic material can be inserted randomly within the host genome or targeted to a specific location. The technique of gene targeting uses homologous recombination to make desired changes to a specific endogenous gene. This tends to occur at a relatively low frequency in plants and animals and generally requires the use of selectable markers. The frequency of gene targeting can be greatly enhanced through genome editing. Genome editing uses artificially engineered nucleases that create specific double-stranded breaks at desired locations in the genome, and use the cell's endogenous mechanisms to repair the induced break by the natural processes of homologous recombination and nonhomologous end-joining. There are four families of engineered nucleases: meganucleases,[71][72] zinc finger nucleases,[73][74] transcription activator-like effector nucleases (TALENs),[75][76] and the Cas9-guideRNA system (adapted from CRISPR).[77][78] TALEN and CRISPR are the two most commonly used and each has its own advantages.[79] TALENs have greater target specificity, while CRISPR is easier to design and more efficient.[79] In addition to enhancing gene targeting, engineered nucleases can be used to introduce mutations at endogenous genes that generate a gene knockout.[80][81]
Applications
[edit]Genetic engineering has applications in medicine, research, industry and agriculture and can be used on a wide range of plants, animals and microorganisms. Bacteria, the first organisms to be genetically modified, can have plasmid DNA inserted containing new genes that code for medicines or enzymes that process food and other substrates.[82][83] Plants have been modified for insect protection, herbicide resistance, virus resistance, enhanced nutrition, tolerance to environmental pressures and the production of edible vaccines.[84] Most commercialised GMOs are insect resistant or herbicide tolerant crop plants.[85] Genetically modified animals have been used for research, model animals and the production of agricultural or pharmaceutical products. The genetically modified animals include animals with genes knocked out, increased susceptibility to disease, hormones for extra growth and the ability to express proteins in their milk.[86]
Medicine
[edit]Genetic engineering has many applications to medicine that include the manufacturing of drugs, creation of model animals that mimic human conditions and gene therapy. One of the earliest uses of genetic engineering was to mass-produce human insulin in bacteria.[33] This application has now been applied to human growth hormones, follicle stimulating hormones (for treating infertility), human albumin, monoclonal antibodies, antihemophilic factors, vaccines and many other drugs.[87][88] Mouse hybridomas, cells fused together to create monoclonal antibodies, have been adapted through genetic engineering to create human monoclonal antibodies.[89] Genetically engineered viruses are being developed that can still confer immunity, but lack the infectious sequences.[90]
Genetic engineering is also used to create animal models of human diseases. Genetically modified mice are the most common genetically engineered animal model.[91] They have been used to study and model cancer (the oncomouse), obesity, heart disease, diabetes, arthritis, substance abuse, anxiety, aging and Parkinson disease.[92] Potential cures can be tested against these mouse models.
Gene therapy is the genetic engineering of humans, generally by replacing defective genes with effective ones. Clinical research using somatic gene therapy has been conducted with several diseases, including X-linked SCID,[93] chronic lymphocytic leukemia (CLL),[94][95] and Parkinson's disease.[96] In 2012, Alipogene tiparvovec became the first gene therapy treatment to be approved for clinical use.[97][98] In 2015 a virus was used to insert a healthy gene into the skin cells of a boy suffering from a rare skin disease, epidermolysis bullosa, in order to grow, and then graft healthy skin onto 80 percent of the boy's body which was affected by the illness.[99]
Germline gene therapy would result in any change being inheritable, which has raised concerns within the scientific community.[100][101] In 2015, CRISPR was used to edit the DNA of non-viable human embryos,[102][103] leading scientists of major world academies to call for a moratorium on inheritable human genome edits.[104] There are also concerns that the technology could be used not just for treatment, but for enhancement, modification or alteration of a human beings' appearance, adaptability, intelligence, character or behavior.[105] The distinction between cure and enhancement can also be difficult to establish.[106] In November 2018, He Jiankui announced that he had edited the genomes of two human embryos, to attempt to disable the CCR5 gene, which codes for a receptor that HIV uses to enter cells. The work was widely condemned as unethical, dangerous, and premature.[107] Currently, germline modification is banned in 40 countries. Scientists that do this type of research will often let embryos grow for a few days without allowing it to develop into a baby.[108]
Researchers are altering the genome of pigs to induce the growth of human organs, with the aim of increasing the success of pig to human organ transplantation.[109] Scientists are creating "gene drives", changing the genomes of mosquitoes to make them immune to malaria, and then looking to spread the genetically altered mosquitoes throughout the mosquito population in the hopes of eliminating the disease.[110]
Research
[edit]
Genetic engineering is an important tool for natural scientists, with the creation of transgenic organisms one of the most important tools for analysis of gene function.[111] Genes and other genetic information from a wide range of organisms can be inserted into bacteria for storage and modification, creating genetically modified bacteria in the process. Bacteria are cheap, easy to grow, clonal, multiply quickly, relatively easy to transform and can be stored at -80 °C almost indefinitely. Once a gene is isolated it can be stored inside the bacteria providing an unlimited supply for research.[112]
Organisms are genetically engineered to discover the functions of certain genes. This could be the effect on the phenotype of the organism, where the gene is expressed or what other genes it interacts with. These experiments generally involve loss of function, gain of function, tracking and expression.
- Loss of function experiments, such as in a gene knockout experiment, in which an organism is engineered to lack the activity of one or more genes. In a simple knockout a copy of the desired gene has been altered to make it non-functional. Embryonic stem cells incorporate the altered gene, which replaces the already present functional copy. These stem cells are injected into blastocysts, which are implanted into surrogate mothers. This allows the experimenter to analyse the defects caused by this mutation and thereby determine the role of particular genes. It is used especially frequently in developmental biology.[113] When this is done by creating a library of genes with point mutations at every position in the area of interest, or even every position in the whole gene, this is called "scanning mutagenesis". The simplest method, and the first to be used, is "alanine scanning", where every position in turn is mutated to the unreactive amino acid alanine.[114]
- Gain of function experiments, the logical counterpart of knockouts. These are sometimes performed in conjunction with knockout experiments to more finely establish the function of the desired gene. The process is much the same as that in knockout engineering, except that the construct is designed to increase the function of the gene, usually by providing extra copies of the gene or inducing synthesis of the protein more frequently. Gain of function is used to tell whether or not a protein is sufficient for a function, but does not always mean it is required, especially when dealing with genetic or functional redundancy.[113]
- Tracking experiments, which seek to gain information about the localisation and interaction of the desired protein. One way to do this is to replace the wild-type gene with a 'fusion' gene, which is a juxtaposition of the wild-type gene with a reporting element such as green fluorescent protein (GFP) that will allow easy visualisation of the products of the genetic modification. While this is a useful technique, the manipulation can destroy the function of the gene, creating secondary effects and possibly calling into question the results of the experiment. More sophisticated techniques are now in development that can track protein products without mitigating their function, such as the addition of small sequences that will serve as binding motifs to monoclonal antibodies.[113]
- Expression studies aim to discover where and when specific proteins are produced. In these experiments, the DNA sequence before the DNA that codes for a protein, known as a gene's promoter, is reintroduced into an organism with the protein coding region replaced by a reporter gene such as GFP or an enzyme that catalyses the production of a dye. Thus the time and place where a particular protein is produced can be observed. Expression studies can be taken a step further by altering the promoter to find which pieces are crucial for the proper expression of the gene and are actually bound by transcription factor proteins; this process is known as promoter bashing.[115]
Industrial
[edit]Organisms can have their cells transformed with a gene coding for a useful protein, such as an enzyme, so that they will overexpress the desired protein. Mass quantities of the protein can then be manufactured by growing the transformed organism in bioreactor equipment using industrial fermentation, and then purifying the protein.[116] Some genes do not work well in bacteria, so yeast, insect cells or mammalian cells can also be used.[117] These techniques are used to produce medicines such as insulin, human growth hormone, and vaccines, supplements such as tryptophan, aid in the production of food (chymosin in cheese making) and fuels.[118] Other applications with genetically engineered bacteria could involve making them perform tasks outside their natural cycle, such as making biofuels,[119] cleaning up oil spills, carbon and other toxic waste[120] and detecting arsenic in drinking water.[121] Certain genetically modified microbes can also be used in biomining and bioremediation, due to their ability to extract heavy metals from their environment and incorporate them into compounds that are more easily recoverable.[122]
In materials science, a genetically modified virus has been used in a research laboratory as a scaffold for assembling a more environmentally friendly lithium-ion battery.[123][124] Bacteria have also been engineered to function as sensors by expressing a fluorescent protein under certain environmental conditions.[125]
Agriculture
[edit]
One of the best-known and controversial applications of genetic engineering is the creation and use of genetically modified crops or genetically modified livestock to produce genetically modified food. Crops have been developed to increase production, increase tolerance to abiotic stresses, alter the composition of the food, or to produce novel products.[127]
The first crops to be released commercially on a large scale provided protection from insect pests or tolerance to herbicides. Fungal and virus resistant crops have also been developed or are in development.[128][129] This makes the insect and weed management of crops easier and can indirectly increase crop yield.[130][131] GM crops that directly improve yield by accelerating growth or making the plant more hardy (by improving salt, cold or drought tolerance) are also under development.[132] In 2016 Salmon have been genetically modified with growth hormones to reach normal adult size much faster.[133]
GMOs have been developed that modify the quality of produce by increasing the nutritional value or providing more industrially useful qualities or quantities.[132] The Amflora potato produces a more industrially useful blend of starches. Soybeans and canola have been genetically modified to produce more healthy oils.[134][135] The first commercialised GM food was a tomato that had delayed ripening, increasing its shelf life.[136]
Plants and animals have been engineered to produce materials they do not normally make. Pharming uses crops and animals as bioreactors to produce vaccines, drug intermediates, or the drugs themselves; the useful product is purified from the harvest and then used in the standard pharmaceutical production process.[137] Cows and goats have been engineered to express drugs and other proteins in their milk, and in 2009 the FDA approved a drug produced in goat milk.[138][139]
Other applications
[edit]Genetic engineering has potential applications in conservation and natural area management. Gene transfer through viral vectors has been proposed as a means of controlling invasive species as well as vaccinating threatened fauna from disease.[140] Transgenic trees have been suggested as a way to confer resistance to pathogens in wild populations.[141] With the increasing risks of maladaptation in organisms as a result of climate change and other perturbations, facilitated adaptation through gene tweaking could be one solution to reducing extinction risks.[142] Applications of genetic engineering in conservation are thus far mostly theoretical and have yet to be put into practice.
Genetic engineering is also being used to create microbial art.[143] Some bacteria have been genetically engineered to create black and white photographs.[144] Novelty items such as lavender-colored carnations,[145] blue roses,[146] and glowing fish[147][148] have also been produced through genetic engineering.
Regulation
[edit]The regulation of genetic engineering concerns the approaches taken by governments to assess and manage the risks associated with the development and release of GMOs. The development of a regulatory framework began in 1975, at Asilomar, California.[149] The Asilomar meeting recommended a set of voluntary guidelines regarding the use of recombinant technology.[31] As the technology improved the US established a committee at the Office of Science and Technology,[150] which assigned regulatory approval of GM food to the USDA, FDA and EPA.[151] The Cartagena Protocol on Biosafety, an international treaty that governs the transfer, handling, and use of GMOs,[152] was adopted on 29 January 2000.[153] One hundred and fifty-seven countries are members of the Protocol, and many use it as a reference point for their own regulations.[154]
The legal and regulatory status of GM foods varies by country, with some nations banning or restricting them, and others permitting them with widely differing degrees of regulation.[155][156][157][158] Some countries allow the import of GM food with authorisation, but either do not allow its cultivation (Russia, Norway, Israel) or have provisions for cultivation even though no GM products are yet produced (Japan, South Korea). Most countries that do not allow GMO cultivation do permit research.[159] Some of the most marked differences occur between the US and Europe. The US policy focuses on the product (not the process), only looks at verifiable scientific risks and uses the concept of substantial equivalence.[160] The European Union by contrast has possibly the most stringent GMO regulations in the world.[161] All GMOs, along with irradiated food, are considered "new food" and subject to extensive, case-by-case, science-based food evaluation by the European Food Safety Authority. The criteria for authorisation fall in four broad categories: "safety", "freedom of choice", "labelling", and "traceability".[162] The level of regulation in other countries that cultivate GMOs lie in between Europe and the United States.
| Region | Regulators | Notes |
|---|---|---|
| US | USDA, FDA and EPA[151] | |
| Europe | European Food Safety Authority[162] | |
| Canada | Health Canada and the Canadian Food Inspection Agency[163][164] | Regulated products with novel features regardless of method of origin[165][166] |
| Africa | Common Market for Eastern and Southern Africa[167] | Final decision lies with each individual country.[167] |
| China | Office of Agricultural Genetic Engineering Biosafety Administration[168] | |
| India | Institutional Biosafety Committee, Review Committee on Genetic Manipulation and Genetic Engineering Approval Committee[169] | |
| Argentina | National Agricultural Biotechnology Advisory Committee (environmental impact), the National Service of Health and Agrifood Quality (food safety) and the National Agribusiness Direction (effect on trade)[170] | Final decision made by the Secretariat of Agriculture, Livestock, Fishery and Food.[170] |
| Brazil | National Biosafety Technical Commission (environmental and food safety) and the Council of Ministers (commercial and economical issues)[170] | |
| Australia | Office of the Gene Technology Regulator (oversees all GM products), Therapeutic Goods Administration (GM medicines) and Food Standards Australia New Zealand (GM food).[171][172] | The individual state governments can then assess the impact of release on markets and trade and apply further legislation to control approved genetically modified products.[172] |
One of the key issues concerning regulators is whether GM products should be labeled. The European Commission says that mandatory labeling and traceability are needed to allow for informed choice, avoid potential false advertising[173] and facilitate the withdrawal of products if adverse effects on health or the environment are discovered.[174] The American Medical Association[175] and the American Association for the Advancement of Science[176] say that absent scientific evidence of harm even voluntary labeling is misleading and will falsely alarm consumers. Labeling of GMO products in the marketplace is required in 64 countries.[177] Labeling can be mandatory up to a threshold GM content level (which varies between countries) or voluntary. In Canada and the US labeling of GM food is voluntary,[178] while in Europe all food (including processed food) or feed which contains greater than 0.9% of approved GMOs must be labelled.[161]
Споры
[ редактировать ]Критики возражали против использования генной инженерии по нескольким причинам, включая этические, экологические и экономические соображения. Многие из этих проблем связаны с ГМ-культурами, безопасностью продуктов питания, произведенных из них, и тем, какое влияние их выращивание окажет на окружающую среду. Эти разногласия привели к судебным разбирательствам, международным торговым спорам и протестам, а также к ограничительному регулированию коммерческой продукции в некоторых странах. [179]
обвинения в том, что ученые « играют в Бога » и другие религиозные вопросы . С самого начала этой технологии приписывали [180] Другие поднятые этические вопросы включают патентование жизни , [181] использование прав интеллектуальной собственности , [182] уровень маркировки продукции, [183] [184] контроль поставок продуктов питания [185] и объективность процесса регулирования. [186] Хоть и были сомнения, [187] с экономической точки зрения большинство исследований показали, что выращивание ГМ-культур приносит пользу фермерам. [188] [189] [190]
Поток генов между ГМ-культурами и совместимыми растениями, наряду с более широким использованием селективных гербицидов , может увеличить риск развития « суперсорняков ». [191] Другие экологические проблемы включают потенциальное воздействие на нецелевые организмы, включая почвенные микробы , [192] и увеличение числа вторичных и устойчивых насекомых-вредителей. [193] [194] Для понимания многих последствий воздействия ГМ-культур на окружающую среду может потребоваться много лет, и они также очевидны в традиционных методах ведения сельского хозяйства. [192] [195] В связи с коммерциализацией генетически модифицированной рыбы возникают опасения по поводу того, какими будут последствия для окружающей среды, если она исчезнет. [196]
Существует три основных опасения по поводу безопасности генетически модифицированных продуктов питания: могут ли они спровоцировать аллергическую реакцию ; могут ли гены переноситься из пищи в клетки человека; и могут ли гены, не одобренные для потребления человеком, передаться другим культурам. [197] Существует научный консенсус [198] [199] [200] [201] что доступные в настоящее время продукты питания, полученные из ГМ-культур, не представляют большего риска для здоровья человека, чем обычные продукты питания, [202] [203] [204] [205] [206] но каждый ГМ-продукт перед внедрением необходимо тестировать в каждом конкретном случае. [207] [208] [209] Тем не менее, представители общественности менее склонны, чем ученые, воспринимать ГМ-продукты как безопасные. [210] [211] [212] [213]
В популярной культуре
[ редактировать ]Генная инженерия присутствует во многих научно-фантастических рассказах. [214] Фрэнка Герберта В романе «Белая чума» описывается преднамеренное использование генной инженерии для создания патогена , специально убивающего женщин. [214] Еще одно творение Герберта, серия романов «Дюна» , использует генную инженерию для создания могущественного Тлейлакса . [215] Лишь немногие фильмы информировали зрителей о генной инженерии, за исключением « Мальчиков из Бразилии» 1978 года и « Парка Юрского периода» 1993 года , в обоих из которых используются урок, демонстрация и отрывок из научного фильма. [216] [217] Методы генной инженерии в кино представлены слабо; Майкл Кларк, пишущий для Wellcome Trust , называет изображение генной инженерии и биотехнологии «серьезно искаженным». [217] в таких фильмах, как «Шестой день» . По мнению Кларка, биотехнологии обычно «придаются фантастические, но визуально захватывающие формы», в то время как наука либо отодвигается на второй план, либо выдумывается, чтобы удовлетворить интерес молодой аудитории. [217]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ «Генная инженерия» . Genome.gov . Проверено 20 февраля 2022 г.
- ^ «Термины и сокращения» . Агентство по охране окружающей среды США онлайн . Проверено 16 июля 2015 г.
- ^ Верт М., Дой И., Хеллвич К.Х., Хесс М., Ходж П., Кубиса П., Ринаудо М., Шуэ Ф (2012). «Терминология биородственных полимеров и их применение (Рекомендации ИЮПАК 2012 г.)» . Чистая и прикладная химия . 84 (2): 377–410. doi : 10.1351/PAC-REC-10-12-04 . S2CID 98107080 .
- ^ «Чем ГМ отличается от традиционной селекции растений?» . royalsociety.org . Проверено 14 ноября 2017 г.
- ^ Эрвин Э., Гендин С., Клейман Л. (22 декабря 2015 г.). Этические проблемы научных исследований: Антология . Рутледж. п. 338. ИСБН 978-1-134-81774-0 .
- ^ Александр ДР (май 2003 г.). «Использование и злоупотребление генной инженерией» . Последипломный медицинский журнал . 79 (931): 249–51. дои : 10.1136/pmj.79.931.249 . ПМЦ 1742694 . ПМИД 12782769 .
- ^ Нильсен Дж. (1 июля 2013 г.). «Производство биофармацевтических белков дрожжами: достижения метаболической инженерии» . Биоинженерия . 4 (4): 207–11. дои : 10.4161/bioe.22856 . ПМЦ 3728191 . ПМИД 23147168 .
- ^ Каим М., Коузер С. (5 июня 2013 г.). «Генетически модифицированные сельскохозяйственные культуры и продовольственная безопасность» . ПЛОС ОДИН . 8 (6): e64879. Бибкод : 2013PLoSO...864879Q . дои : 10.1371/journal.pone.0064879 . ПМК 3674000 . ПМИД 23755155 .
- ^ Jump up to: а б Европейский парламент и Совет Европейского Союза (12 марта 2001 г.). «Директива о выпуске генетически модифицированных организмов (ГМО) Директива 2001/18/EC, ПРИЛОЖЕНИЕ I A» . Официальный журнал Европейских сообществ .
- ^ «Экономическое воздействие генетически модифицированных культур на агропродовольственный сектор; стр. 42 Глоссарий – термины и определения» (PDF) . Генеральный директорат по сельскому хозяйству Европейской комиссии . Архивировано из оригинала (PDF) 14 мая 2013 года.
Генная инженерия: манипулирование генетическими ресурсами организма путем введения или удаления определенных генов с помощью современных методов молекулярной биологии. Широкое определение генной инженерии также включает в себя селекцию и другие средства искусственного отбора.
- ^ Ван Эненнаам А. «Является ли клонирование домашнего скота еще одной формой генной инженерии?» (PDF) . агбиотех. Архивировано из оригинала (PDF) 11 мая 2011 года.
- ^ Сутер Д.М., Дюбуа-Дофин М., Краузе К.Х. (июль 2006 г.). «Генная инженерия эмбриональных стволовых клеток» (PDF) . Швейцарский медицинский еженедельник . 136 (27–28): 413–5. дои : 10.4414/smw.2006.11406 . ПМИД 16897894 . S2CID 4945176 . Архивировано из оригинала (PDF) 7 июля 2011 года.
- ^ Андрианантоандро Э., Басу С., Кариг Д.К., Вайс Р. (16 мая 2006 г.). «Синтетическая биология: новые инженерные правила для новой дисциплины» . Молекулярная системная биология . 2 (2006.0028): 2006.0028. дои : 10.1038/msb4100073 . ПМК 1681505 . ПМИД 16738572 .
- ^ «Что такое генетическая модификация (ГМ)?» . ЦСИРО .
- ^ Якобсен Э., Схоутен Х.Дж. (2008). «Цисгенезис, новый инструмент традиционной селекции растений, должен быть освобожден от регулирования в отношении генетически модифицированных организмов при поэтапном подходе» . Картофельные исследования . 51 : 75–88. дои : 10.1007/s11540-008-9097-y . S2CID 38742532 .
- ^ Капечки М.Р. (октябрь 2001 г.). «Создание мышей с целевыми мутациями». Природная медицина . 7 (10): 1086–90. дои : 10.1038/нм1001-1086 . ПМИД 11590420 . S2CID 14710881 .
- ^ Биотехнология персонала - Глоссарий терминов сельскохозяйственной биотехнологии. Архивировано 30 августа 2014 года в Wayback Machine, Министерство сельского хозяйства США, «Генетическая модификация: производство наследственных улучшений растений или животных для конкретных целей с помощью генной инженерии или других более традиционных методов. Некоторые страны, кроме США, используют этот термин конкретно для обозначения генной инженерии». Проверено 5 ноября 2012 г.
- ^ Марьянский Дж. Х. (19 октября 1999 г.). «Генетически модифицированные продукты» . Центр безопасности пищевых продуктов и прикладного питания при Управлении по контролю за продуктами и лекарствами .
- ↑ Сотрудники (28 ноября 2005 г.) Health Canada – Правила использования генетически модифицированных пищевых продуктов. Архивировано 10 июня 2017 г. в глоссарии Wayback Machine. Определение генетически модифицированных: «Организм, такой как растение, животное или бактерия, считается генетически модифицированным, если его генетический код материал был изменен любым методом, включая традиционное разведение. «ГМО» — это генетически модифицированный организм». Проверено 5 ноября 2012 г.
- ^ Корень С (2007). Одомашнивание . Издательские группы Гринвуда.
- ^ Зохари Д., Хопф М., Вайс Э. (2012). Одомашнивание растений в Старом Свете: Происхождение и распространение растений в Старом Свете . Издательство Оксфордского университета.
- ^ Тимофеев-Ресовский Н.З. (октябрь 1934 г.). «Экспериментальное производство мутаций» . Биологические обзоры . 9 (4): 411–457. дои : 10.1111/j.1469-185X.1934.tb01255.x . S2CID 86396986 .
- ^ Стейблфорд Б.М. (2004). Исторический словарь научно-фантастической литературы . Пугало Пресс. п. 133. ИСБН 978-0-8108-4938-9 .
- ^ Херши А.Д., Чейз М. (май 1952 г.). «Независимые функции вирусного белка и нуклеиновой кислоты в росте бактериофага» . Журнал общей физиологии . 36 (1): 39–56. дои : 10.1085/jgp.36.1.39 . ПМК 2147348 . ПМИД 12981234 .
- ^ «Генная инженерия» . Энциклопедия научной фантастики . 2 апреля 2015 г.
- ^ Шив Кант Прасад; Аджай Дэш (2008). Современные концепции в нанотехнологиях, Том 5 . Издательство Дискавери. ISBN 978-81-8356-296-6 .
- ^ Джексон Д.А., Саймонс Р.Х., Берг П. (октябрь 1972 г.). «Биохимический метод внедрения новой генетической информации в ДНК вируса обезьян 40: кольцевые молекулы ДНК SV40, содержащие гены фага лямбда и галактозный оперон Escherichia coli» . Труды Национальной академии наук Соединенных Штатов Америки . 69 (10): 2904–9. Бибкод : 1972PNAS...69.2904J . дои : 10.1073/pnas.69.10.2904 . ПМК 389671 . ПМИД 4342968 .
- ^ Арнольд П. (2009). «История генетики: хронология генной инженерии» .
- ^ Гучи С., Герман В., Стенцль В., Челисснигг К.Х. (1 мая 1973 г.). «[Смещение электродов у пациентов с кардиостимулятором (перевод автора)]». Центральный журнал хирургии . 104 (2): 100–4. ПМИД 433482 .
- ^ Йениш Р., Минц Б. (апрель 1974 г.). «Последовательности ДНК обезьяньего вируса 40 в ДНК здоровых взрослых мышей, полученные из преимплантационных бластоцист, которым инъецировали вирусную ДНК» . Труды Национальной академии наук Соединенных Штатов Америки . 71 (4): 1250–4. Бибкод : 1974PNAS...71.1250J . дои : 10.1073/pnas.71.4.1250 . ПМЦ 388203 . ПМИД 4364530 .
- ^ Jump up to: а б Берг П., Балтимор Д., Бреннер С., Роблин Р.О., Сингер М.Ф. (июнь 1975 г.). «Итоговое заявление Асиломарской конференции по рекомбинантным молекулам ДНК» . Труды Национальной академии наук Соединенных Штатов Америки . 72 (6): 1981–4. Бибкод : 1975ПНАС...72.1981Б . дои : 10.1073/пнас.72.6.1981 . ПМК 432675 . ПМИД 806076 .
- ^ «Руководство Национального института здравоохранения США по исследованиям рекомбинантных молекул ДНК» . Управление биотехнологической деятельности . Министерство здравоохранения и социальных служб США. Архивировано из оригинала 10 сентября 2012 года.
- ^ Jump up to: а б Гёддел Д.В., Клейд Д.Г., Боливар Ф., Хейнекер Х.Л., Янсура Д.Г., Креа Р., Хиросе Т., Крашевски А., Итакура К., Риггс А.Д. (январь 1979 г.). «Экспрессия в Escherichia coli химически синтезированных генов человеческого инсулина» . Труды Национальной академии наук Соединенных Штатов Америки . 76 (1): 106–10. Бибкод : 1979ПНАС...76..106Г . дои : 10.1073/pnas.76.1.106 . ПМЦ 382885 . ПМИД 85300 .
- ^ Дела Верховного суда США от Justia & Oyez (16 июня 1980 г.). «Даймонд V Чакрабарти» . Юстиа . Проверено 17 июля 2010 г.
- ^ «Искусственные гены» . Время . 15 ноября 1982 года. Архивировано из оригинала 27 октября 2011 года . Проверено 17 июля 2010 г.
- ^ Братспис Р. (2007). «Некоторые мысли об американском подходе к регулированию генетически модифицированных организмов». Канзасский журнал права и государственной политики . 16 (3): 101–31. ССНН 1017832 .
- ^ Jump up to: а б «ГМ-культуры: горький урожай?» . 14 июня 2002 года . Проверено 30 марта 2023 г.
- ^ Мо, Томас Х. II (9 июня 1987 г.). «Измененная бактерия выполняет свою работу: мороз не смог повредить опрысканный тестовый урожай, заявляет компания» . Лос-Анджелес Таймс .
- ^ Джеймс С. (1996). «Глобальный обзор полевых испытаний и коммерциализации трансгенных растений: 1986–1995 годы» (PDF) . Международная служба по приобретению агробиотехнологических приложений. Архивировано (PDF) из оригинала 16 июня 2010 года . Проверено 17 июля 2010 г.
- ^ Джеймс С. (1997). «Глобальный статус трансгенных культур в 1997 году» (PDF) . ISAAA Briefs No. 5 .: 31. Архивировано (PDF) из оригинала 16 января 2009 г.
- ^ Брюнинг Г., Лайонс Дж. М. (2000). «Дело о томате ФЛАВР САВР» . Калифорнийское сельское хозяйство . 54 (4): 6–7. дои : 10.3733/ca.v054n04p6 .
- ^ Маккензи Д. (18 июня 1994 г.). «Трансгенный табак – прежде всего в Европе» . Новый учёный .
- ^ «Lawrence Journal-World — Поиск в архиве новостей Google» . новости.google.com . Проверено 30 марта 2023 г.
- ^ «Краткий обзор: Глобальный статус коммерциализации биотехнологических/ГМ-культур: 2009 г. - Краткий обзор ISAAA 41-2009 | ISAAA.org» . www.isaaa.org . Проверено 30 марта 2023 г.
- ^ Пенниси Э (май 2010 г.). «Геномика. Синтетический геном дарит бактериям новую жизнь» . Наука . 328 (5981): 958–9. дои : 10.1126/science.328.5981.958 . ПМИД 20488994 .
- ^ Гибсон Д.Г., Гласс Дж.И., Лартиг С., Носков В.Н., Чуанг Р.Ю., Алгир М.А. и др. (июль 2010 г.). «Создание бактериальной клетки, управляемой химически синтезированным геномом». Наука . 329 (5987): 52–6. Бибкод : 2010Sci...329...52G . CiteSeerX 10.1.1.167.1455 . дои : 10.1126/science.1190719 . ПМИД 20488990 . S2CID 7320517 .
- ^ Малышев Д.А., Дхами К., Лавернь Т., Чен Т., Дай Н., Фостер Дж.М., Корреа И.Р., Ромесберг Ф.Е. (май 2014 г.). «Полусинтетический организм с расширенным генетическим алфавитом» . Природа . 509 (7500): 385–8. Бибкод : 2014Natur.509..385M . дои : 10.1038/nature13314 . ПМК 4058825 . ПМИД 24805238 .
- ^ Тайер Р., Эллефсон Дж. (май 2014 г.). «Синтетическая биология: Новые буквы алфавита жизни» . Природа . 509 (7500): 291–2. Бибкод : 2014Natur.509..291T . дои : 10.1038/nature13335 . ПМИД 24805244 . S2CID 4399670 .
- ^ Поллак А (11 мая 2015 г.). «Дженнифер Дудна, пионер, который помог упростить редактирование генома» . Нью-Йорк Таймс . Архивировано из оригинала 2 января 2022 года . Проверено 15 ноября 2017 г.
- ^ Джинек М., Чилински К., Фонфара И., Хауэр М., Дудна Дж.А., Шарпантье Э. (август 2012 г.). «Программируемая ДНК-эндонуклеаза, управляемая двойной РНК, в адаптивном бактериальном иммунитете» . Наука . 337 (6096): 816–21. Бибкод : 2012Sci...337..816J . дои : 10.1126/science.1225829 . ПМК 6286148 . ПМИД 22745249 .
- ^ Ледфорд Х (март 2016 г.). «CRISPR: редактирование генов — это только начало» . Природа . 531 (7593): 156–9. Бибкод : 2016Natur.531..156L . дои : 10.1038/531156а . ПМИД 26961639 .
- ^ Ко Х.Дж., Квон С.Ю., Томсон М. (26 августа 2015 г.). Современные технологии в молекулярной селекции растений: Путеводитель по молекулярной селекции растений для исследователей . Спрингер. п. 242. ИСБН 978-94-017-9996-6 .
- ^ «Как сделать ГМО» . Наука в новостях . 9 августа 2015 года . Проверено 29 апреля 2017 г.
- ^ Николл, Десмонд С.Т. (29 мая 2008 г.). Введение в генную инженерию . Издательство Кембриджского университета. п. 34. ISBN 978-1-139-47178-7 .
- ^ Альбертс Б., Джонсон А., Льюис Дж. и др. (2002). «Выделение, клонирование и секвенирование ДНК» . Молекулярная биология клетки (4-е изд.). Нью-Йорк: Garland Science. ISBN 0-8153-3218-1 .
- ^ Кауфман Р.И., Никсон Б.Т. (июль 1996 г.). «Использование ПЦР для выделения генов, кодирующих сигма54-зависимые активаторы, из различных бактерий» . Журнал бактериологии . 178 (13): 3967–70. дои : 10.1128/jb.178.13.3967-3970.1996 . ПМК 232662 . ПМИД 8682806 .
- ^ Лян Дж, Ло Ю, Чжао Х (2011). «Синтетическая биология: введение синтеза в биологию» . Междисциплинарные обзоры Wiley: системная биология и медицина . 3 (1): 7–20. дои : 10.1002/wsbm.104 . ПМК 3057768 . ПМИД 21064036 .
- ^ «5. Процесс генетической модификации» . www.фао.орг . Проверено 29 апреля 2017 г.
- ^ Дж. М. Блатни, Т. Браутасет, К. Х. Винтер-Ларсен, К. Хауган и С. Валла: «Создание и использование универсального набора векторов клонирования и экспрессии широкого диапазона хозяев на основе репликона RK2», Appl. Окружающая среда. Микробиол. 1997, Том 63, Выпуск 2, с. 370
- ^ Берг П., Мерц Дж.Э. (январь 2010 г.). «Личные размышления о происхождении и появлении технологии рекомбинантной ДНК» . Генетика . 184 (1): 9–17. дои : 10.1534/genetics.109.112144 . ПМЦ 2815933 . ПМИД 20061565 .
- ^ Чен И, Дубнау Д (март 2004 г.). «Поглощение ДНК во время бактериальной трансформации». Обзоры природы. Микробиология . 2 (3): 241–9. дои : 10.1038/nrmicro844 . ПМИД 15083159 . S2CID 205499369 .
- ^ Комитет Национального исследовательского совета (США) по выявлению и оценке непреднамеренного воздействия генно-инженерных продуктов на здоровье человека (1 января 2004 г.). Методы и механизмы генетического манипулирования растениями, животными и микроорганизмами . Издательство национальных академий (США).
- ^ Гельвин С.Б. (март 2003 г.). «Трансформация растений с помощью агробактерий: биология, лежащая в основе инструмента «генной игры»» . Обзоры микробиологии и молекулярной биологии . 67 (1): 16–37, оглавление. дои : 10.1128/ММБР.67.1.16-37.2003 . ПМК 150518 . ПМИД 12626681 .
- ^ Руководитель G, Халл Р.Х., Цотзос Г.Т. (2009 г.). Генетически модифицированные растения: оценка безопасности и управление рисками . Лондон: Академический проф. п. 244 . ISBN 978-0-12-374106-6 .
- ^ Туомела М., Станеску И., Крон К. (октябрь 2005 г.). «Обзор валидации биоаналитических методов». Генная терапия . 12 Приложение 1 (S1): S131-8. дои : 10.1038/sj.gt.3302627 . ПМИД 16231045 . S2CID 23000818 .
- ^ Нараянасвами, С. (1994). Культура растительных клеток и тканей . Тата МакГроу-Хилл Образование. п. VI. ISBN 978-0-07-460277-5 .
- ^ Комитет Национального исследовательского совета (США) по выявлению и оценке непреднамеренного воздействия генно-инженерных продуктов на здоровье человека (2004). Методы и механизмы генетического манипулирования растениями, животными и микроорганизмами . Издательство национальных академий (США).
- ^ Хон Б., Леви А.А., Пухта Х (апрель 2001 г.). «Устранение маркеров селекции из трансгенных растений». Современное мнение в области биотехнологии . 12 (2): 139–43. дои : 10.1016/S0958-1669(00)00188-9 . ПМИД 11287227 .
- ^ Сетлоу Дж. К. (31 октября 2002 г.). Генная инженерия: принципы и методы . Springer Science & Business Media. п. 109. ИСБН 978-0-306-47280-0 .
- ^ Дипак С., Коттапалли К., Раквал Р., Орос Г., Рангаппа К., Ивахаши Х., Масуо Ю., Агравал Г. (июнь 2007 г.). «ПЦР в реальном времени: революция в обнаружении и анализе экспрессии генов» . Современная геномика . 8 (4): 234–51. дои : 10.2174/138920207781386960 . ПМК 2430684 . ПМИД 18645596 .
- ^ Гризо С., Смит Дж., Дабусси Ф., Прието Дж., Редондо П., Мерино Н., Виллате М., Томас С., Лемэр Л., Монтойя Дж., Бланко Ф.Дж., Пакес Ф., Дюшато П. (сентябрь 2009 г.). «Эффективное нацеливание на ген SCID с помощью сконструированной одноцепочечной эндонуклеазы самонаведения» . Исследования нуклеиновых кислот . 37 (16): 5405–19. дои : 10.1093/нар/gkp548 . ПМЦ 2760784 . ПМИД 19584299 .
- ^ Гао Х., Смит Дж., Ян М., Джонс С., Джуканович В., Николсон М.Г., Вест А., Бидни Д., Фалько С.С., Янц Д., Лызник Л.А. (январь 2010 г.). «Наследственный целевой мутагенез кукурузы с использованием разработанной эндонуклеазы». Заводской журнал . 61 (1): 176–87. дои : 10.1111/j.1365-313X.2009.04041.x . ПМИД 19811621 .
- ^ Таунсенд Дж.А., Райт Д.А., Уинфри Р.Дж., Фу Ф., Мэдер М.Л., Йонг Дж.К., Войтас Д.Ф. (май 2009 г.). «Высокочастотная модификация генов растений с использованием сконструированных нуклеаз с цинковыми пальцами» . Природа . 459 (7245): 442–5. Бибкод : 2009Natur.459..442T . дои : 10.1038/nature07845 . ПМЦ 2743854 . ПМИД 19404258 .
- ^ Шукла В.К., Дойон Ю., Миллер Дж.С., ДеКелвер Р.К., Мёле Э.А., Уорден С.Э., Митчелл Дж.К., Арнольд Н.Л., Гопалан С., Мэн Х, Чой В.М., Рок Дж.М., Ву Ю., Катиба Г.Е., Чжифан Г., Маккаскилл Д., Симпсон М.А. , Блейксли Б., Гринвалт С.А., Батлер Х.Дж., Хинкли С.Дж., Чжан Л., Ребар Э.Дж., Грегори П.Д., Урнов Ф.Д. (май 2009 г.). «Точная модификация генома сельскохозяйственных культур Zea mays с использованием нуклеаз с цинковыми пальцами». Природа . 459 (7245): 437–41. Бибкод : 2009Natur.459..437S . дои : 10.1038/nature07992 . ПМИД 19404259 . S2CID 4323298 .
- ^ Кристиан М., Чермак Т., Дойл Э.Л., Шмидт С., Чжан Ф., Хаммел А., Богданове А.Дж., Войтас Д.Ф. (октябрь 2010 г.). «Нацеливание на двухцепочечные разрывы ДНК с помощью эффекторных нуклеаз TAL» . Генетика . 186 (2): 757–61. дои : 10.1534/genetics.110.120717 . ПМЦ 2942870 . ПМИД 20660643 .
- ^ Ли Т., Хуан С., Цзян В.З., Райт Д., Сполдинг М.Х., Уикс Д.П., Ян Б. (январь 2011 г.). «Нуклеазы TAL (TALN): гибридные белки, состоящие из эффекторов TAL и домена расщепления ДНК FokI» . Исследования нуклеиновых кислот . 39 (1): 359–72. дои : 10.1093/nar/gkq704 . ПМК 3017587 . ПМИД 20699274 .
- ^ Эсвелт К.М., Ван Х.Х. (2013). «Геномная инженерия для системной и синтетической биологии» . Молекулярная системная биология . 9 : 641. дои : 10.1038/msb.2012.66 . ПМЦ 3564264 . ПМИД 23340847 .
- ^ Тан В.С., Карлсон Д.Ф., Уолтон М.В., Фаренкруг СК, Хакетт П.Б. (2012). «Точное редактирование геномов крупных животных». Достижения в области генетики, том 80 . Том. 80. стр. 37–97. дои : 10.1016/B978-0-12-404742-6.00002-8 . ISBN 978-0-12-404742-6 . ПМЦ 3683964 . ПМИД 23084873 .
- ^ Jump up to: а б Мальзан А., Лоудер Л., Ци Ю (24 апреля 2017 г.). «Редактирование генома растений с помощью TALEN и CRISPR» . Клетка и биологические науки . 7:21 . дои : 10.1186/s13578-017-0148-4 . ПМЦ 5404292 . ПМИД 28451378 .
- ^ Эккер СК (2008). «Нокаутирующие удары цинковыми пальцами по генам рыбок данио» . Рыбка данио . 5 (2): 121–3. дои : 10.1089/zeb.2008.9988 . ПМЦ 2849655 . ПМИД 18554175 .
- ^ Гертс А.М., Кост Г.Дж., Фрейверт Ю., Зейтлер Б., Миллер Дж.К., Чой В.М., Дженкинс С.С., Вуд А., Куи Х, Менг Х., Винсент А., Лам С., Михалкевич М., Шиллинг Р., Фоклер Дж., Каллоуэй С., Вейлер Х. , Меноре С., Анегон И., Дэвис Г.Д., Чжан Л., Ребар Э.Дж., Грегори П.Д., Урнов Ф.Д., Джейкоб Х.Дж., Бюлов Р. (июль 2009 г.). «Нокаут крыс посредством микроинъекции эмбрионам нуклеаз с цинковыми пальцами» . Наука . 325 (5939): 433. Бибкод : 2009Sci...325..433G . дои : 10.1126/science.1172447 . ПМЦ 2831805 . ПМИД 19628861 .
- ^ «Генетическая модификация бактерий» . Фонд Анненберга . Архивировано из оригинала 24 декабря 2013 года . Проверено 4 октября 2012 г.
- ^ Панесар, Памит и др. (2010) «Ферменты в пищевой промышленности: основы и потенциальные применения», глава 10, Международное издательство IK, ISBN 978-93-80026-33-6
- ^ «Список качеств ГМ» . Международная служба по приобретению агробиотехнологических приложений.
- ^ «ISAAA Brief 43-2011: Краткое содержание» . Международная служба по приобретению агробиотехнологических приложений.
- ^ Коннор С. (2 ноября 2007 г.). «Мышь, которая потрясла мир» . Независимый .
- ^ Авизе Дж.К. (2004). Надежда, шумиха и реальность генной инженерии: замечательные истории из сельского хозяйства, промышленности, медицины и окружающей среды . Издательство Оксфордского университета, США. п. 22. ISBN 978-0-19-516950-8 .
- ^ «Инженерные водоросли для создания сложного противоракового «дизайнерского» лекарства» . ФизОрг . 10 декабря 2012 года . Проверено 15 апреля 2013 г.
- ^ Роке AC, Лоу CR, Тайпа MA (2004). «Антитела и родственные им генно-инженерные молекулы: производство и очистка». Биотехнологический прогресс . 20 (3): 639–54. дои : 10.1021/bp030070k . PMID 15176864 . S2CID 23142893 .
- ^ Родригес Л.Л., Грубман М.Дж. (ноябрь 2009 г.). «Вакцины против вируса ящура». Вакцина . 27 (Приложение 4): Д90-4. doi : 10.1016/j.vaccine.2009.08.039 . ПМИД 19837296 .
- ^ «Предпосылки: клонированные и генетически модифицированные животные» . Центр генетики и общества. 14 апреля 2005 г. Архивировано из оригинала 23 ноября 2016 г. Проверено 9 июля 2010 г.
- ^ «Нокаутирующие мыши» . Национальный институт исследования генома человека. 2009.
- ^ Фишер А., Хасейн-Бей-Абина С., Каваццана-Кальво М. (июнь 2010 г.). «20 лет генной терапии ТКИН». Природная иммунология . 11 (6): 457–60. дои : 10.1038/ni0610-457 . ПМИД 20485269 . S2CID 11300348 .
- ^ Ледфорд Х (2011). «Клеточная терапия борется с лейкемией». Природа . дои : 10.1038/news.2011.472 .
- ^ Брентдженс Р.Дж., Давила М.Л., Ривьер И., Парк Дж., Ван Х., Коуэлл Л.Г. и др. (март 2013 г.). «Т-клетки, нацеленные на CD19, быстро вызывают молекулярную ремиссию у взрослых с острым лимфобластным лейкозом, резистентным к химиотерапии» . Наука трансляционной медицины . 5 (177): 177ра38. doi : 10.1126/scitranslmed.3005930 . ПМЦ 3742551 . ПМИД 23515080 .
- ^ Левитт П.А., Резай А.Р., Лихи М.А., Ожеманн С.Г., Флаэрти А.В., Эскандар Э.Н. и др. (апрель 2011 г.). «Генная терапия AAV2-GAD при прогрессирующей болезни Паркинсона: двойное слепое рандомизированное исследование, контролируемое ложной хирургической операцией». «Ланцет». Неврология . 10 (4): 309–19. дои : 10.1016/S1474-4422(11)70039-4 . ПМИД 21419704 . S2CID 37154043 .
- ^ «Генная терапия: Glybera одобрена Европейской Комиссией» . Новости Би-би-си . 2 ноября 2012 года . Проверено 30 марта 2023 г.
- ^ Ричардс С. «Генная терапия приходит в Европу» . Ученый . Проверено 16 ноября 2012 г.
- ^ «Генетически измененная кожа спасает мальчика, умирающего от редкой болезни» . NPR.org . Проверено 15 ноября 2017 г.
- ^ «Декларация Инуямы 1990 года» . 5 августа 2001 г. Архивировано из оригинала 5 августа 2001 г.
{{cite web}}: CS1 maint: bot: исходный статус URL неизвестен ( ссылка ) - ^ Смит К.Р., Чан С., Харрис Дж. (октябрь 2012 г.). «Генетическая модификация зародышевой линии человека: научные и биоэтические перспективы». Архивы медицинских исследований . 43 (7): 491–513. doi : 10.1016/j.arcmed.2012.09.003 . ПМИД 23072719 .
- ^ Колата Г (23 апреля 2015 г.). «Китайские ученые редактируют гены человеческих эмбрионов, вызывая обеспокоенность» . Нью-Йорк Таймс . Архивировано из оригинала 2 января 2022 года . Проверено 24 апреля 2015 г.
- ^ Лян П., Сюй Ю, Чжан Х, Дин С., Хуан Р., Чжан З. и др. (май 2015 г.). «CRISPR/Cas9-опосредованное редактирование генов в трехпронуклеарных зиготах человека» . Белок и клетка . 6 (5): 363–372. дои : 10.1007/s13238-015-0153-5 . ПМЦ 4417674 . ПМИД 25894090 .
- ^ Уэйд Н. (3 декабря 2015 г.). «Ученые вводят мораторий на изменения генома человека, которые могут передаваться по наследству» . Нью-Йорк Таймс . Архивировано из оригинала 2 января 2022 года . Проверено 3 декабря 2015 г.
- ^ Бергесон Э.Р. (1997). «Этика генной терапии» .
- ^ Ханна КЕ. «Генетическое улучшение» . Национальный институт исследования генома человека.
- ^ Бегли С. (28 ноября 2018 г.). «На фоне шума китайский ученый защищает создание детей с отредактированными генами – STAT» . СТАТ .
- ^ Ли, Эмили (31 июля 2020 г.). «Диагностическая ценность расширенного сканирования спиральной КТ грудной клетки» . Журнал клинических и сестринского исследования .
- ^ «ГМ-свиньи — лучший выбор для трансплантации органов» . Медицинские новости сегодня . 21 сентября 2003 г. Архивировано из оригинала 10 мая 2011 г. Проверено 9 июля 2010 г.
- ^ Хармон А (26 ноября 2015 г.). «Открытый сезон наблюдается в редактировании генов животных» . Нью-Йорк Таймс . ISSN 0362-4331 . Архивировано из оригинала 2 января 2022 года . Проверено 27 сентября 2017 г.
- ^ Прайтис В., Мадуро М.Ф. (2011). «Трансгенез у C. elegans». Caenorhabditis elegans: молекулярная генетика и развитие . Методы клеточной биологии. Том. 106. стр. 161–85. дои : 10.1016/B978-0-12-544172-8.00006-2 . ISBN 978-0-12-544172-8 . ПМИД 22118277 .
- ^ «Открытие биологии заново – онлайн-учебник: Глава 13: Генетически модифицированные организмы» . www.learner.org . Архивировано из оригинала 3 декабря 2019 года . Проверено 18 августа 2017 г.
- ^ Jump up to: а б с Альбертс Б., Джонсон А., Льюис Дж., Рафф М., Робертс К., Уолтер П. (2002). «Изучение экспрессии и функции генов». Молекулярная биология клетки (4-е изд.). Нью-Йорк: Garland Science. ISBN 0-8153-3218-1 .
- ^ Пак С.Дж., Кокран-младший (25 сентября 2009 г.). Белковая инженерия и дизайн . ЦРК Пресс. ISBN 978-1-4200-7659-2 .
- ^ Курназ И.А. (8 мая 2015 г.). Методы генной инженерии . ЦРК Пресс. ISBN 978-1-4822-6090-8 .
- ^ «Применение генной инженерии» . Микробиологическая процедура. Архивировано из оригинала 14 июля 2011 года . Проверено 9 июля 2010 г.
- ^ «Биотехнологии: что такое трансгенные организмы?» . Легкая наука. 2002. Архивировано из оригинала 27 мая 2010 года . Проверено 9 июля 2010 г.
- ^ Сэвидж Н. (1 августа 2007 г.). «Изготовление бензина из бактерий: биотехнологический стартап хочет получить топливо из искусственно созданных микробов» . Обзор технологий Массачусетского технологического института . Архивировано из оригинала 9 апреля 2020 года . Проверено 16 июля 2015 г.
- ^ Саммерс Р. (24 апреля 2013 г.). «Бактерии производят первое в истории биотопливо, подобное бензину» . Новый учёный . Проверено 27 апреля 2013 г.
- ^ «Применение некоторых генно-инженерных бактерий» . Архивировано из оригинала 27 ноября 2010 года . Проверено 9 июля 2010 г.
- ^ Сандерсон К. (24 февраля 2012 г.). «Новый портативный комплект обнаруживает мышьяк в колодцах» . Новости химии и техники . Проверено 23 января 2013 г.
- ^ Рис Дж.Б., Урри Л.А., Кейн М.Л., Вассерман С.А., Минорский П.В., Джексон Р.Б. (2011). Кэмпбелл Биология, девятое издание . Сан-Франциско: Пирсон Бенджамин Каммингс. п. 421 . ISBN 978-0-321-55823-7 .
- ^ «Новая батарея, созданная вирусом, может питать автомобили и электронные устройства» . Web.mit.edu. 2 апреля 2009 года . Проверено 17 июля 2010 г.
- ^ «Скрытый ингредиент новой, более экологичной батареи: вирус» . Нпр.орг . Проверено 17 июля 2010 г.
- ^ «Исследователи синхронизируют мигающие «генетические часы» — генно-инженерные бактерии, которые следят за временем» . ScienceDaily . 24 января 2010 г.
- ^ Сушкив Дж. (ноябрь 1999 г.). «Тифтон, Джорджия: борьба с вредителями арахиса» . Сельскохозяйственные исследования . Проверено 23 ноября 2008 г.
- ^ Маганья-Гомес Х.А., де ла Барка А.М. (январь 2009 г.). «Оценка риска генетически модифицированных культур для питания и здоровья» . Обзоры питания . 67 (1): 1–16. дои : 10.1111/j.1753-4887.2008.00130.x . ПМИД 19146501 .
- ^ Ислам А (2008). «Трансгенные растения, устойчивые к грибкам: стратегии, прогресс и извлеченные уроки» . Культура тканей растений и биотехнология . 16 (2): 117–38. дои : 10.3329/ptcb.v16i2.1113 .
- ^ «Устойчивые к болезням культуры» . ГМО Компас. Архивировано из оригинала 3 июня 2010 года.
- ^ Демонт М., Толленс Э. (2004). «Первое влияние биотехнологии в ЕС: внедрение Bt-кукурузы в Испании». Анналы прикладной биологии . 145 (2): 197–207. дои : 10.1111/j.1744-7348.2004.tb00376.x .
- ^ Чивиан Э., Бернштейн А (2008). Поддержание жизни . Издательство Оксфордского университета, Inc. ISBN 978-0-19-517509-7 .
- ^ Jump up to: а б Уитмен Д.Б. (2000). «Генетически модифицированные продукты: вредны или полезны?» . Архивировано из оригинала 16 февраля 2015 года . Проверено 9 июля 2010 г.
- ^ Поллак А (19 ноября 2015 г.). «Генетически модифицированный лосось, разрешенный к употреблению» . Нью-Йорк Таймс . Проверено 21 апреля 2016 г.
- ^ Рапс (канола) был генетически модифицирован с целью изменения содержания в нем масла с помощью гена, кодирующего фермент «12:0 тиоэстераза» (TE) из растения калифорнийского залива ( Umbellularia California ), чтобы увеличить количество жирных кислот средней длины, см.: Geo-pie. .cornell.edu. Архивировано 5 июля 2009 г. в Wayback Machine.
- ^ Бомгарднер М.М. (2012). «Замена трансжиров: новые культуры от Dow Chemical и DuPont нацелены на производителей продуктов питания, которым нужны стабильные, полезные для сердца масла» . Новости химии и техники . 90 (11): 30–32. doi : 10.1021/cen-09011-bus1 .
- ^ Крамер М.Г., Реденбо К. (1 января 1994 г.). «Коммерциализация помидоров с антисмысловым геном полигалактуроназы: история томатов FLAVR SAVR™». Эвфитика . 79 (3): 293–97. дои : 10.1007/BF00022530 . ISSN 0014-2336 . S2CID 45071333 .
- ^ Марвье М (2008). «Фармацевтические культуры в Калифорнии, преимущества и риски. Обзор» (PDF) . Агрономия для устойчивого развития . 28 (1): 1–9. дои : 10.1051/агро:2007050 . S2CID 29538486 . Архивировано (PDF) из оригинала 19 июля 2018 года.
- ^ «FDA одобрило первый биологический препарат для человека, произведенный GE Animals» . Управление по контролю за продуктами и лекарствами США.
- ^ Ребело П. (15 июля 2004 г.). «ГМ-коровье молоко «может лечить заболевания крови» » . Научные Разработчики.
- ^ Ангуло Э., Кук Б. (декабрь 2002 г.). «Сначала синтезируйте новые вирусы, а затем регулируйте их выпуск? Случай с диким кроликом». Молекулярная экология . 11 (12): 2703–9. Бибкод : 2002MolEc..11.2703A . дои : 10.1046/j.1365-294X.2002.01635.x . hdl : 10261/45541 . ПМИД 12453252 . S2CID 23916432 .
- ^ Адамс Дж. М., Пиовесан Г., Штраус С., Браун С. (2 августа 2002 г.). «Дело в пользу генной инженерии местных и ландшафтных деревьев против интродуцированных вредителей и болезней». Биология сохранения . 16 (4): 874–79. Бибкод : 2002ConBi..16..874A . дои : 10.1046/j.1523-1739.2002.00523.x . S2CID 86697592 .
- ^ Томас М.А., Ремер Г.В., Донлан С.Дж., Диксон Б.Г., Маток М., Малани Дж. (сентябрь 2013 г.). «Экология: настройка генов для сохранения природы» . Природа . 501 (7468): 485–6. дои : 10.1038/501485a . ПМИД 24073449 .
- ^ Пасько Дж. М. (4 марта 2007 г.). «Биохудожники устраняют разрыв между искусством и наукой: использование живых организмов привлекает внимание и вызывает споры» . MSNBC. Архивировано из оригинала 4 октября 2013 года.
- ^ Джексон Дж. (6 декабря 2005 г.). «Генетически модифицированные бактерии создают живые фотографии» . Национальные географические новости. Архивировано из оригинала 16 декабря 2005 года.
- ^ «Замена генов растений привела к появлению единственной в мире голубой розы» . физ.орг . Проверено 30 марта 2023 г.
- ^ Кацумото Ю, Фукучи-Мизутани М, Фукуи Ю, Брюльера Ф, Холтон Т.А., Каран М, Накамура Н, Ёнекура-Сакакибара К, Тогами Дж, Пигер А, Тао GQ, Нехра Н.С., Лу Сай, Дайсон Б.К., Цуда С, Ашикари Т., Кусуми Т., Мейсон Дж.Г., Танака Ю. (ноябрь 2007 г.). «Разработка пути биосинтеза флавоноидов розы успешно позволила получить голубые цветы, накапливающие дельфинидин». Физиология растений и клеток . 48 (11): 1589–600. CiteSeerX 10.1.1.319.8365 . дои : 10.1093/pcp/pcm131 . ПМИД 17925311 .
- ^ «ВОИС – Поиск в международных и национальных патентных коллекциях» . Patentscope.wipo.int . Проверено 30 марта 2023 г.
- ^ Стюарт CN (апрель 2006 г.). «Идите вместе со светом: флуоресцентные белки для освещения трансгенных организмов» (PDF) . Тенденции в биотехнологии . 24 (4): 155–62. дои : 10.1016/j.tibtech.2006.02.002 . ПМИД 16488034 . Архивировано из оригинала (PDF) 3 июля 2010 года . Проверено 25 октября 2017 г.
- ^ Берг П., Балтимор Д., Бойер Х.В., Коэн С.Н., Дэвис Р.В., Хогнесс Д.С., Натанс Д., Роблин Р., Уотсон Дж.Д., Вайсман С., Зиндер Н.Д. (июль 1974 г.). «Письмо: Потенциальная биологическая опасность молекул рекомбинантной ДНК» (PDF) . Наука . 185 (4148): 303. Бибкод : 1974Sci...185..303B . дои : 10.1126/science.185.4148.303 . ПМЦ 388511 . ПМИД 4600381 . Архивировано из оригинала (PDF) 12 августа 2011 года . Проверено 3 мая 2017 г.
- ^ МакХьюген А., Смит С. (январь 2008 г.). «Система регулирования США для генетически модифицированных [генетически модифицированных организмов (ГМО), рДНК или трансгенных] сортов сельскохозяйственных культур» . Журнал биотехнологии растений . 6 (1): 2–12. дои : 10.1111/j.1467-7652.2007.00300.x . ПМИД 17956539 .
- ^ Jump up to: а б Управление по науке и технологической политике США (июнь 1986 г.). «Скоординированная основа регулирования биотехнологии; объявление политики; уведомление для общественного обсуждения» (PDF) . Федеральный реестр . 51 (123): 23302–23350. ПМИД 11655807 . Архивировано из оригинала (PDF) 16 мая 2011 года.
{{cite journal}}:|author1=имеет общее имя ( справка ) - ^ Редик, Т.П. (2007). «Картахенский протокол по биобезопасности: приоритет предосторожности при одобрении биотехнологических культур и сдерживании поставок товаров, 2007 г.». Колорадский журнал международного экологического права и политики . 18 : 51–116.
- ^ «О протоколе» . Механизм посредничества по биобезопасности (МПБ) . 29 мая 2012 г.
- ^ «AgBioForum 13 (3): Последствия правил импорта и информационных требований в соответствии с Картахенским протоколом по биобезопасности ГМ-товаров в Кении» . 28 октября 2010 г. Архивировано из оригинала 4 марта 2016 г. Проверено 3 мая 2017 г.
- ^ Ограничения на генетически модифицированные организмы. Библиотека Конгресса, март 2014 г. (файл LL № 2013-009894). Краткое описание ряда стран. с помощью
- ^ Башшур Р. (февраль 2013 г.). «FDA и регулирование ГМО» . Американская ассоциация адвокатов. Архивировано из оригинала 29 сентября 2016 года . Проверено 24 февраля 2016 г. .
- ^ Сифферлин А. (3 октября 2015 г.). «Более половины стран ЕС отказываются от ГМО» . Время .
- ^ Линч Д., Фогель Д. (5 апреля 2001 г.). «Регулирование ГМО в Европе и США: пример современной европейской политики регулирования» . Совет по международным отношениям. Архивировано из оригинала 29 сентября 2016 года . Проверено 24 февраля 2016 г. .
- ^ «Ограничения на использование генетически модифицированных организмов - Юридическая библиотека Конгресса» . Библиотека Конгресса . 22 января 2017 г.
- ^ Марден, Эмили (1 мая 2003 г.). «Риск и регулирование: политика регулирования США в отношении генетически модифицированных продуктов питания и сельского хозяйства» . Обзор права Бостонского колледжа . 44 (3): 733.
- ^ Jump up to: а б Дэвисон Дж (2010). «ГМ-растения: наука, политика и правила ЕС». Наука о растениях . 178 (2): 94–98. doi : 10.1016/j.plantsci.2009.12.005 .
- ^ Jump up to: а б ГМО-Компас: Европейская система регулирования. Архивировано 14 августа 2012 года в Wayback Machine. Проверено 28 июля 2012 года.
- ^ Правительство Канады, Канадское агентство по инспекции пищевых продуктов (20 марта 2015 г.). «Информация для широкой публики» . www.inspection.gc.ca .
- ^ Форсберг, Сесил В. (23 апреля 2013 г.). «Генетически модифицированные продукты» . Канадская энциклопедия . Архивировано из оригинала 18 сентября 2013 года . Проверено 4 октября 2017 г.
- ^ Эванс, Брент и Лупеску, Михай (15 июля 2012 г.) Канада - Ежегодник сельскохозяйственной биотехнологии - 2012. Архивировано 15 декабря 2013 г. в отчете Wayback Machine GAIN (Глобальная сельскохозяйственная информационная сеть) CA12029, Министерство сельского хозяйства США, Внешняя сельскохозяйственная служба, получено 5. ноябрь 2012 г.
- ^ МакХьюген А. (14 сентября 2000 г.). «Глава 1: Закуски и первые блюда/Что такое генетическая модификация? Что такое ГМО?» . Корзина для пикника Пандоры . Издательство Оксфордского университета. ISBN 978-0-19-850674-4 .
- ^ Jump up to: а б «Редакционная статья: Трансгенный урожай» . Природа . 467 (7316): 633–634. 2010. Бибкод : 2010Natur.467R.633. . дои : 10.1038/467633b . ПМИД 20930796 .
- ^ «AgBioForum 5 (4): Развитие и политика сельскохозяйственных биотехнологий в Китае» . 5 сентября 2003 г. Архивировано из оригинала 25 июля 2016 г. Проверено 3 мая 2017 г.
- ^ «Агротех-портал ТНАУ :: Биотехнологии» . agritech.tnau.ac.in .
- ^ Jump up to: а б с «Презентация BASF» (PDF) . Архивировано из оригинала (PDF) 28 сентября 2011 года.
- ^ Сельское хозяйство - Департамент первичной промышленности. Архивировано 29 марта 2011 г. в Wayback Machine.
- ^ Jump up to: а б «Добро пожаловать на веб-сайт Управления регулятора генных технологий» . Управление регулятора генных технологий . Проверено 25 марта 2011 г.
- ^ «Регламент (ЕС) № 1829/2003 Европейского парламента и Совета от 22 сентября 2003 г. о генетически модифицированных продуктах питания и кормах» (PDF) . Официальный журнал Европейского Союза . Европейский Парламент и Совет Европейского Союза. 2003. Архивировано из оригинала (PDF) 20 января 2014 года.
Маркировка должна включать объективную информацию о том, что продукт питания или корм состоит из ГМО, содержит их или произведен из них. Четкая маркировка, независимо от возможности обнаружения ДНК или белка, возникшего в результате генетической модификации конечного продукта, отвечает требованиям, выраженным в многочисленных опросах подавляющего большинства потребителей, облегчает осознанный выбор и исключает потенциальное введение потребителей в заблуждение относительно методов производства или производство.
- ^ «Регламент (ЕС) № 1830/2003 Европейского парламента и Совета от 22 сентября 2003 г., касающийся отслеживания и маркировки генетически модифицированных организмов, а также отслеживания пищевых и кормовых продуктов, произведенных из генетически модифицированных организмов, и вносящий поправки в Директиву 2001/18/ ЭК» . Официальный журнал Л 268 . Европейский Парламент и Совет Европейского Союза. 2003. стр. 24–28.
(3) Требования к отслеживаемости ГМО должны способствовать как изъятию продуктов, в которых установлено непредвиденное неблагоприятное воздействие на здоровье человека, животных или окружающую среду, включая экосистемы, так и целенаправленному мониторингу для изучения потенциального воздействия, в частности, на окружающую среду. . Прослеживаемость должна также способствовать осуществлению мер по управлению рисками в соответствии с принципом предосторожности. (4) Должны быть установлены требования к отслеживаемости продуктов питания и кормов, произведенных из ГМО, чтобы облегчить точную маркировку таких продуктов.
- ^ «Отчет 2 Совета по науке и общественному здравоохранению: маркировка биоинженерных продуктов питания» (PDF) . Американская медицинская ассоциация. 2012. Архивировано из оригинала (PDF) 7 сентября 2012 года.
- ^ Американская ассоциация развития науки (AAAS), Совет директоров (2012). Заявление Совета директоров AAAS о маркировке генетически модифицированных продуктов питания и связанный с ним пресс-релиз: Юридическое требование маркировки ГМ-продуктов может вводить в заблуждение и ложно тревожить потребителей. Архивировано 4 ноября 2013 г. на Wayback Machine.
- ^ Халленбек Т. (27 апреля 2014 г.). «Как в Вермонте появилась маркировка ГМО» . Берлингтон Фри Пресс . Проверено 28 мая 2014 г.
- ^ «Регулирование генетически модифицированных продуктов питания» . Архивировано из оригинала 10 июня 2017 года . Проверено 5 ноября 2012 г.
- ^ Шелдон И.М. (1 марта 2002 г.). «Регулирование биотехнологии: будем ли мы когда-нибудь «свободно» торговать ГМО?». Европейский обзор экономики сельского хозяйства . 29 (1): 155–76. CiteSeerX 10.1.1.596.7670 . дои : 10.1093/erae/29.1.155 . ISSN 0165-1587 .
- ^ Даброк П. (декабрь 2009 г.). «Игра в Бога? Синтетическая биология как богословский и этический вызов» . Системы и синтетическая биология . 3 (1–4): 47–54. дои : 10.1007/s11693-009-9028-5 . ПМЦ 2759421 . ПМИД 19816799 .
- ^ Браун С. (октябрь 2000 г.). «Патентование жизни: генетически измененные мыши — изобретение», — заявил суд . CMAJ . 163 (7): 867–8. ПМК 80518 . ПМИД 11033718 .
- ^ Чжоу В (10 августа 2015 г.). «Патентный ландшафт генетически модифицированных организмов» . Наука в новостях . Проверено 5 мая 2017 г.
- ^ Пакетт Л. (20 апреля 2016 г.). «Почему новый закон о маркировке продуктов питания с ГМО настолько противоречив» . Хаффингтон Пост . Проверено 5 мая 2017 г.
- ^ Миллер Х. (12 апреля 2016 г.). «Этикетки на продуктах с ГМО бессмысленны» . Лос-Анджелес Таймс . ISSN 0458-3035 . Проверено 5 мая 2017 г.
- ^ Сэвидж С. «Кто контролирует поставки продовольствия?» . Форбс . Проверено 5 мая 2017 г.
- ^ Найт AJ (14 апреля 2016 г.). Наука, риск и политика . Рутледж. п. 156. ИСБН 978-1-317-28081-1 .
- ^ Хаким Д. (29 октября 2016 г.). «Сомнения в обещанной награде за генетически модифицированные культуры» . Нью-Йорк Таймс . ISSN 0362-4331 . Архивировано из оригинала 2 января 2022 года . Проверено 5 мая 2017 г.
- ^ Ареал Ф.Д., Рисго Л., Родригес-Сересо Е (1 февраля 2013 г.). «Экономическое и агрономическое воздействие коммерциализированных ГМ-культур: метаанализ». Журнал сельскохозяйственной науки . 151 (1): 7–33. дои : 10.1017/S0021859612000111 . S2CID 85891950 .
- ^ Фингер Р., Эль Бенни Н., Капенгст Т., Эванс С., Герберт С., Леманн Б., Морс С., Ступак Н. (10 мая 2011 г.). «Метаанализ затрат и преимуществ ГМ-культур на уровне ферм» (PDF) . Устойчивость . 3 (5): 743–62. дои : 10.3390/su3050743 . Архивировано (PDF) из оригинала 19 июля 2018 года.
- ^ Клюмпер В., Каим М. (3 ноября 2014 г.). «Метаанализ воздействия генетически модифицированных культур» . ПЛОС ОДИН . 9 (11): e111629. Бибкод : 2014PLoSO...9k1629K . дои : 10.1371/journal.pone.0111629 . ПМК 4218791 . ПМИД 25365303 .
- ^ Цю Дж (2013). «Генетически модифицированные культуры приносят пользу сорнякам» . Природа . дои : 10.1038/nature.2013.13517 . S2CID 87415065 .
- ^ Jump up to: а б «ГМО и окружающая среда» . www.фао.орг . Проверено 7 мая 2017 г.
- ^ Дайвли GP, Венугопал П.Д., Финкенбиндер С. (30 декабря 2016 г.). «Развившаяся в полевых условиях устойчивость кукурузного ушного червя к белкам Cry, экспрессируемым трансгенной сладкой кукурузой» . ПЛОС ОДИН . 11 (12): e0169115. Бибкод : 2016PLoSO..1169115D . дои : 10.1371/journal.pone.0169115 . ПМК 5201267 . ПМИД 28036388 .
- ^ Цю, Джейн (13 мая 2010 г.). «Использование ГМ-культур делает мелких вредителей серьезной проблемой». Новости природы . CiteSeerX 10.1.1.464.7885 . дои : 10.1038/news.2010.242 .
- ^ Гилберт Н. (май 2013 г.). «Тематические исследования: тщательный взгляд на ГМ-культуры». Природа . 497 (7447): 24–6. Бибкод : 2013Natur.497...24G . дои : 10.1038/497024а . ПМИД 23636378 . S2CID 4417399 .
- ^ «Безопасна ли рыба с ГМО для окружающей среды? | Накопление ошибок | Изучайте науку в Scitable» . www.nature.com . Проверено 7 мая 2017 г.
- ^ «Вопросы и ответы: генетически модифицированные продукты питания» . Всемирная организация здравоохранения . Проверено 7 мая 2017 г.
- ^ Николия А., Манзо А., Веронези Ф., Роселлини Д. (март 2014 г.). «Обзор последних 10 лет исследований безопасности генетически модифицированных сельскохозяйственных культур». Критические обзоры по биотехнологии . 34 (1): 77–88. дои : 10.3109/07388551.2013.823595 . ПМИД 24041244 . S2CID 9836802 .
Мы проанализировали научную литературу по безопасности ГМ-культур за последние 10 лет, которая отражает научный консенсус, сложившийся с тех пор, как ГМ-растения стали широко культивироваться во всем мире, и можем заключить, что научные исследования, проведенные до сих пор, не выявили какой-либо значительной опасности, непосредственно связанной с использование ГМ-культур. Литература о биоразнообразии и потреблении ГМ-продуктов/кормов иногда приводила к оживленным дебатам относительно пригодности экспериментальных планов, выбора статистических методов или публичной доступности данных. Такие дебаты, даже если они позитивны и являются частью естественного процесса рассмотрения научным сообществом, часто искажаются средствами массовой информации и часто используются политически и ненадлежащим образом в кампаниях против ГМ-культур.
- ^ «Состояние продовольствия и сельского хозяйства в 2003–2004 гг. Сельскохозяйственная биотехнология: удовлетворение потребностей бедных слоев населения. Воздействие трансгенных культур на здоровье и окружающую среду» . Продовольственная и сельскохозяйственная организация Объединенных Наций . Проверено 8 февраля 2016 г.
Доступные в настоящее время трансгенные культуры и продукты, полученные из них, признаны безопасными для употребления в пищу, а методы, использованные для проверки их безопасности, признаны подходящими. Эти выводы представляют собой консенсус научных данных, исследованных МСНС (2003 г.), и согласуются с мнением Всемирной организации здравоохранения (ВОЗ, 2002 г.). Эти продукты питания были оценены на предмет повышенного риска для здоровья человека несколькими национальными регулирующими органами (в частности, Аргентиной, Бразилией, Канадой, Китаем, Великобританией и США) с использованием своих национальных процедур безопасности пищевых продуктов (ICSU). На сегодняшний день нигде в мире не обнаружено никаких поддающихся проверке неблагоприятных токсических или вредных для питания последствий употребления продуктов, полученных из генетически модифицированных культур (GM Science Review Panel). Многие миллионы людей потребляли продукты, полученные из ГМ-растений – в основном кукурузы, сои и рапса – без каких-либо наблюдаемых побочных эффектов (ICSU).
- ^ Рональд П. (май 2011 г.). «Генетика растений, устойчивое сельское хозяйство и глобальная продовольственная безопасность» . Генетика . 188 (1): 11–20. дои : 10.1534/genetics.111.128553 . ПМК 3120150 . ПМИД 21546547 .
Существует широкий научный консенсус в отношении того, что генетически модифицированные культуры, представленные в настоящее время на рынке, безопасны для употребления в пищу. После 14 лет выращивания и общей засеянной площади в 2 миллиарда акров коммерциализация генно-инженерных культур не привела к каким-либо неблагоприятным последствиям для здоровья или окружающей среды (Совет по сельскому хозяйству и природным ресурсам, Комитет по воздействию на окружающую среду, связанному с коммерциализацией трансгенных растений, Национальное исследование). Совет и Отдел исследований Земли и жизни, 2002). И Национальный исследовательский совет США, и Объединенный исследовательский центр (научно-техническая исследовательская лаборатория Европейского Союза и неотъемлемая часть Европейской комиссии) пришли к выводу, что существует всеобъемлющий массив знаний, который адекватно решает проблему безопасности пищевых продуктов, связанных с генетически модифицированными культурами. (Комитет по выявлению и оценке непреднамеренного воздействия генетически модифицированных продуктов питания на здоровье человека и Национальный исследовательский совет, 2004 г.; Объединенный исследовательский центр Европейской комиссии, 2008 г.). В этих и других недавних отчетах делается вывод, что процессы генной инженерии и традиционной селекции ничем не отличаются с точки зрения непредвиденных последствий для здоровья человека и окружающей среды (Генеральный директорат по исследованиям и инновациям Европейской комиссии, 2010).
- ^ Но см. также: Доминго Дж. Л., Джине Бордонаба Дж. (май 2011 г.). «Обзор литературы по оценке безопасности генетически модифицированных растений». Интернационал окружающей среды . 37 (4): 734–42. Бибкод : 2011EnInt..37..734D . дои : 10.1016/j.envint.2011.01.003 . ПМИД 21296423 .
Несмотря на это, количество исследований, специально посвященных оценке безопасности ГМ-растений, по-прежнему ограничено. Однако важно отметить, что впервые наблюдается определенное равновесие в количестве исследовательских групп, предполагающих на основе своих исследований, что ряд разновидностей ГМ-продуктов (в основном кукурузы и соевых бобов) столь же безопасны и питательны. как соответствующие обычные растения, не содержащие ГМО, так и растения, вызывающие по-прежнему серьезные опасения. Более того, стоит отметить, что большинство исследований, демонстрирующих, что ГМ-продукты столь же питательны и безопасны, как и те, что получены путем традиционной селекции, были проведены биотехнологическими компаниями или их партнерами, которые также несут ответственность за коммерциализацию этих ГМ-растений. В любом случае, это представляет собой заметный прогресс по сравнению с отсутствием исследований, опубликованных в последние годы в научных журналах этими компаниями.
Крымский С (2015). «Иллюзорный консенсус по оценке здоровья ГМО» (PDF) . Наука, технологии и человеческие ценности . 40 (6): 883–914. дои : 10.1177/0162243915598381 . S2CID 40855100 . Архивировано из оригинала (PDF) 7 февраля 2016 года . Проверено 30 октября 2016 г.Я начал эту статью с свидетельств уважаемых ученых о том, что фактически не существует научных разногласий по поводу воздействия ГМО на здоровье. Мое исследование научной литературы рассказывает другую историю.
И контраст: Панчин А.Ю., Тужиков А.И. (март 2017 г.). «Опубликованные исследования ГМО не обнаруживают никаких доказательств вреда с поправкой на множественные сравнения». Критические обзоры по биотехнологии . 37 (2): 213–217. дои : 10.3109/07388551.2015.1130684 . ПМИД 26767435 . S2CID 11786594 .Здесь мы показываем, что ряд статей, некоторые из которых сильно и негативно повлияли на общественное мнение о ГМ-культурах и даже спровоцировали политические действия, такие как эмбарго на ГМО, имеют общие недостатки в статистической оценке данных. Учтя эти недостатки, мы приходим к выводу, что данные, представленные в этих статьях, не предоставляют каких-либо существенных доказательств вреда ГМО. Представленные статьи, предполагающие возможный вред ГМО, вызвали большой общественный резонанс. Однако, несмотря на свои заявления, они фактически ослабляют доказательства вреда и отсутствия существенной эквивалентности изучаемых ГМО. Мы подчеркиваем, что, учитывая более 1783 опубликованных статей о ГМО за последние 10 лет, ожидается, что некоторые из них должны были сообщать о нежелательных различиях между ГМО и обычными сельскохозяйственными культурами, даже если таких различий в действительности не существует.
и Ян Ю.Т., Чен Б. (апрель 2016 г.). «Регулирование ГМО в США: наука, право и общественное здравоохранение». Журнал науки о продовольствии и сельском хозяйстве . 96 (6): 1851–5. Бибкод : 2016JSFA...96.1851Y . дои : 10.1002/jsfa.7523 . ПМИД 26536836 .Поэтому неудивительно, что усилия по требованию маркировки и запрету ГМО стали растущей политической проблемой в США (цитата по Доминго и Бордонаба, 2011) . В целом, широкий научный консенсус заключается в том, что продаваемые в настоящее время ГМО-продукты не представляют большего риска, чем обычные продукты питания. рассмотрел литературу на сегодняшний день. Несмотря на различные опасения, сегодня Американская ассоциация содействия развитию науки, Всемирная организация здравоохранения и многие независимые международные научные организации согласны с тем, что ГМО так же безопасны, как и другие продукты питания. По сравнению с традиционными методами селекции генная инженерия гораздо более точна и в большинстве случаев с меньшей вероятностью приведет к неожиданному результату.
- ^ «Заявление совета директоров AAAS о маркировке генетически модифицированных продуктов питания» (PDF) . Американская ассоциация содействия развитию науки. 20 октября 2012 года . Проверено 8 февраля 2016 г.
ЕС, например, инвестировал более 300 миллионов евро в исследования биобезопасности ГМО. В его недавнем отчете говорится: «Основной вывод, который можно сделать на основе усилий более 130 исследовательских проектов, охватывающих период более 25 лет исследований и с участием более 500 независимых исследовательских групп, заключается в том, что биотехнология, и в частности ГМО, сами по себе не более рискованны, чем, например, традиционные технологии селекции растений». Всемирная организация здравоохранения, Американская медицинская ассоциация, Национальная академия наук США, Британское королевское общество и все другие уважаемые организации, исследовавшие доказательства, пришли к одному и тому же выводу: употребление продуктов, содержащих ингредиенты, полученные из ГМ-культур, не является более рискованным. чем потреблять те же продукты, содержащие ингредиенты из сельскохозяйственных культур, модифицированных традиционными методами улучшения растений.
Пинхолстер Дж. (25 октября 2012 г.). «Совет директоров AAAS: Законодательное введение маркировки ГМ-продуктов может «ввести в заблуждение и вызвать ложную тревогу потребителей» » . Американская ассоциация содействия развитию науки . Проверено 8 февраля 2016 г. - ^ Европейская комиссия. Главное управление исследований (2010 г.). Десятилетие исследований ГМО, финансируемых ЕС (2001–2010 гг.) (PDF) . Главное управление исследований и инноваций. Биотехнологии, Сельское хозяйство, Продукты питания. Европейская Комиссия, Европейский Союз. дои : 10.2777/97784 . ISBN 978-92-79-16344-9 . Архивировано (PDF) из оригинала 24 декабря 2010 года . Проверено 8 февраля 2016 г.
- ^ «Отчет AMA о генетически модифицированных культурах и продуктах питания (онлайн-резюме)» . Американская медицинская ассоциация. Январь 2001 года . Проверено 19 марта 2016 г.
В отчете, опубликованном научным советом Американской медицинской ассоциации (АМА), говорится, что не было обнаружено никаких долгосрочных последствий для здоровья от использования трансгенных культур и генетически модифицированных продуктов, и что эти продукты по существу эквивалентны своим традиционным аналогам. (из онлайн-сводки, подготовленной ISAAA ) ««Урожайные культуры и продукты питания, произведенные с использованием методов рекомбинантной ДНК, доступны менее 10 лет, и на сегодняшний день не обнаружено никаких долгосрочных последствий. Эти продукты по существу эквивалентны своим обычным аналогам.
«Отчет 2 Совета по науке и общественному здравоохранению (A-12): Маркировка биоинженерных продуктов питания» (PDF) . Американская медицинская ассоциация. 2012. Архивировано из оригинала 7 сентября 2012 года . Проверено 19 марта 2016 г.Биоинженерные продукты употребляются в пищу уже около 20 лет, и за это время в рецензируемой литературе не сообщалось и/или не подтверждалось никаких явных последствий для здоровья человека.
{{cite web}}: CS1 maint: bot: исходный статус URL неизвестен ( ссылка ) - ^ «Ограничения на генетически модифицированные организмы: США. Общественное и научное мнение» . Библиотека Конгресса. 9 июня 2015 года . Проверено 8 февраля 2016 г.
Несколько научных организаций в США опубликовали исследования или заявления относительно безопасности ГМО, указывающие на отсутствие доказательств того, что ГМО представляют собой уникальные риски для безопасности по сравнению с продуктами, выведенными традиционным способом. К ним относятся Национальный исследовательский совет, Американская ассоциация содействия развитию науки и Американская медицинская ассоциация. Группы в США, выступающие против ГМО, включают некоторые экологические организации, организации органического земледелия и организации потребителей. Значительное количество ученых-юристов раскритиковали подход США к регулированию ГМО.
- ^ Национальные академии наук, инженерия; Отдел исследований земной жизни; Совет по природным ресурсам сельского хозяйства; Комитет по генетически модифицированным культурам: прошлый опыт и перспективы на будущее (2016). Генно-инженерные культуры: опыт и перспективы . Национальные академии наук, техники и медицины (США). п. 149. дои : 10.17226/23395 . ISBN 978-0-309-43738-7 . ПМИД 28230933 . Проверено 19 мая 2016 г.
Общий вывод о предполагаемом неблагоприятном воздействии пищевых продуктов, полученных из ГМ-культур, на здоровье человека: На основе детального изучения сравнений коммерциализированных в настоящее время ГМ-продуктов с не-ГМ-продуктами при композиционном анализе, тестах на острую и хроническую токсичность на животных, долгосрочных данных о здоровье. среди животных, скармливаемых ГМ-продуктами, и эпидемиологических данных человека, комитет не обнаружил различий, которые указывали бы на более высокий риск для здоровья человека от ГМ-продуктов, чем от их не-ГМ-продуктов.
- ^ «Часто задаваемые вопросы о генетически модифицированных продуктах» . Всемирная организация здравоохранения . Проверено 8 февраля 2016 г.
Различные ГМ-организмы включают разные гены, вставленные разными способами. Это означает, что отдельные ГМ-продукты и их безопасность должны оцениваться в каждом конкретном случае и что невозможно сделать общие заявления о безопасности всех ГМ-продуктов. ГМ-продукты, доступные в настоящее время на международном рынке, прошли оценку безопасности и вряд ли представляют риск для здоровья человека. Кроме того, не было выявлено никакого воздействия на здоровье человека в результате потребления таких продуктов населением в странах, где они были одобрены. Постоянное применение оценок безопасности, основанных на принципах Кодекса Алиментариус, и, при необходимости, адекватный постмаркетинговый мониторинг, должно формировать основу для обеспечения безопасности ГМ-продуктов.
- ^ Haslberger AG (июль 2003 г.). «Руководства Кодекса по ГМ-продуктам включают анализ непредвиденных эффектов». Природная биотехнология . 21 (7): 739–41. дои : 10.1038/nbt0703-739 . ПМИД 12833088 . S2CID 2533628 .
Эти принципы диктуют необходимость проведения предрыночной оценки в каждом конкретном случае, которая включает в себя оценку как прямых, так и непредвиденных последствий.
- ^ Некоторые медицинские организации, в том числе Британская медицинская ассоциация , выступают за дополнительную осторожность, основанную на принципе предосторожности : «Генетически модифицированные продукты и здоровье: второе промежуточное заявление» (PDF) . Британская медицинская ассоциация. Март 2004 г. Архивировано (PDF) из оригинала 22 марта 2014 г. Проверено 21 марта 2016 г.
По нашему мнению, потенциальная возможность вредного воздействия ГМ-продуктов на здоровье очень мала, и многие из высказанных опасений в равной степени применимы и к продуктам, полученным традиционным способом. Однако на основании имеющейся в настоящее время информации пока нельзя полностью отмахиваться от проблем безопасности. Стремясь оптимизировать баланс между выгодами и рисками, разумно проявить осторожность и, прежде всего, учиться на накопленных знаниях и опыте. Любая новая технология, такая как генетическая модификация, должна быть проверена на предмет возможных преимуществ и рисков для здоровья человека и окружающей среды. Как и в случае со всеми новыми продуктами питания, оценка безопасности ГМ-продуктов должна проводиться в каждом конкретном случае. Члены жюри проекта GM были проинформированы о различных аспектах генетической модификации разнообразной группой признанных экспертов в соответствующих областях. Жюри по ГМ пришло к выводу, что продажа имеющихся в настоящее время ГМ-продуктов должна быть остановлена, а мораторий на коммерческое выращивание ГМ-культур должен быть продлен. Эти выводы были основаны на принципе предосторожности и отсутствии доказательств какой-либо пользы. Жюри выразило обеспокоенность по поводу воздействия ГМ-культур на сельское хозяйство, окружающую среду, безопасность пищевых продуктов и другие потенциальные последствия для здоровья. Обзор Королевского общества (2002) пришел к выводу, что риски для здоровья человека, связанные с использованием специфических последовательностей вирусной ДНК в ГМ-растениях, незначительны, и, призывая к осторожности при внесении потенциальных аллергенов в продовольственные культуры, подчеркнул отсутствие доказательств того, что коммерчески доступные ГМ-продукты вызывают клинические аллергические проявления. BMA разделяет мнение, что не существует убедительных доказательств того, что ГМ-продукты небезопасны, но мы поддерживаем призыв к дальнейшим исследованиям и надзору, чтобы предоставить убедительные доказательства безопасности и пользы.
- ^ Фанк С., Рэйни Л. (29 января 2015 г.). «Взгляды общественности и ученых на науку и общество» . Исследовательский центр Пью. Архивировано из оригинала 9 января 2019 года . Проверено 24 февраля 2016 г. .
Самые большие различия между общественностью и учеными AAAS обнаруживаются в убеждениях о безопасности употребления в пищу генетически модифицированных (ГМ) продуктов. Почти девять из десяти (88%) ученых говорят, что употребление ГМ-продуктов в целом безопасно, по сравнению с 37% населения в целом, разница составляет 51 процентный пункт.
- ^ Маррис С. (июль 2001 г.). «Общественные взгляды на ГМО: деконструкция мифов. Участники дебатов о ГМО часто называют общественное мнение иррациональным. Но действительно ли они понимают общественность?» . Отчеты ЭМБО . 2 (7): 545–8. doi : 10.1093/embo-reports/kve142 . ПМЦ 1083956 . ПМИД 11463731 .
- ^ Заключительный отчет исследовательского проекта PABE (декабрь 2001 г.). «Общественное восприятие сельскохозяйственных биотехнологий в Европе» . Комиссия европейских сообществ . Проверено 24 февраля 2016 г. .
- ^ Скотт С.Э., Инбар Ю., Розин П. (май 2016 г.). «Доказательства абсолютного морального противодействия генетически модифицированным продуктам питания в Соединенных Штатах». Перспективы психологической науки . 11 (3): 315–324. дои : 10.1177/1745691615621275 . ПМИД 27217243 . S2CID 261060 .
- ^ Jump up to: а б «Генная инженерия» . Энциклопедия научной фантастики . 15 мая 2017 года . Проверено 19 июля 2018 г.
- ^ Кобольдт Д. (29 августа 2017 г.). «Наука научной фантастики: как научная фантастика предсказала будущее генетики» . Внешние места . Архивировано из оригинала 19 июля 2018 года . Проверено 19 июля 2018 г.
- ^ Морага Р. (ноябрь 2009 г.). «Современная генетика в мире художественной литературы» . Журнал Clarkesworld (38). Архивировано из оригинала 19 июля 2018 года.
- ^ Jump up to: а б с Кларк М. «Генетические темы в художественных фильмах: генетика встречается с Голливудом» . Велком Траст . Архивировано из оригинала 18 мая 2012 года . Проверено 19 июля 2018 г.
Дальнейшее чтение
[ редактировать ]- Британская медицинская ассоциация (1999). Влияние генетической модификации на сельское хозяйство, продовольствие и здоровье . Книги БМЖ. ISBN 0-7279-1431-6 .
- Доннеллан, Крейг (2004). Генетическая модификация (проблемы) . Независимое образовательное издательство. ISBN 1-86168-288-3 .
- Морган С. (1 января 2009 г.). Суперпродукты: генетическая модификация продуктов . Библиотека Хайнемана. ISBN 978-1-4329-2455-3 .
- Смайли, Софи (2005). Генетическая модификация: Учебное пособие (Изучение проблем) . Независимое образовательное издательство. ISBN 1-86168-307-3 .
- Уотсон Джей Ди (2007). Рекомбинантная ДНК: гены и геномы: краткий курс . Сан-Франциско: WH Freeman. ISBN 978-0-7167-2866-5 .
- Уивер С., Майкл М. (2003). Аннотированная библиография научных публикаций о рисках, связанных с генетической модификацией (отчет). Веллингтон, Новая Зеландия: Университет Виктории.
- Заид А., Хьюз Х.Г., Порседду Э., Николас Ф. (2001). Глоссарий по биотехнологии для производства продовольствия и сельского хозяйства – переработанное и дополненное издание Глоссария по биотехнологии и генной инженерии . Рим, Италия: ФАО . ISBN 92-5-104683-2 .

