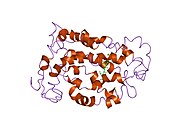
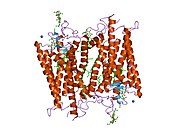
Родопсин
| РО | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | RHO , CSNBAD1, OPN2, RP4, родопсин, родопсин, зрительный пурпур | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | Опустить : 180380 ; МГИ : 97914 ; Гомологен : 68068 ; GeneCards : RHO ; ОМА : РО – ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Родопсин , также известный как зрительный пурпур , представляет собой белок, кодируемый геном RHO. [ 5 ] и рецептор, связанный с G-белком (GPCR). Это опсин палочек , сетчатки и светочувствительный . рецепторный белок который запускает зрительную фототрансдукцию в палочках Родопсин обеспечивает зрение при тусклом свете и, следовательно, чрезвычайно чувствителен к свету. [ 6 ] Когда родопсин подвергается воздействию света, он немедленно фотообесцвечивается . У человека он полностью регенерирует примерно за 30 минут, после чего палочки становятся более чувствительными. [ 7 ] Дефекты гена родопсина вызывают такие заболевания глаз, как пигментный ретинит и врожденную стационарную куриную слепоту .
Имена
[ редактировать ]Родопсин был открыт Францем Кристианом Боллом в 1876 году. [ 8 ] [ 9 ] [ 10 ] Название родоспсин происходит от древнегреческого ῥόδον ( rhódon ) — «роза» из-за его розоватого цвета и ὄψις ( ópsis ) — «зрение». [ 11 ] Его придумал в 1878 году немецкий физиолог Вильгельм Фридрих Кюне (1837–1900). [ 12 ] [ 13 ]
Когда Джордж Уолд обнаружил, что родопсин представляет собой голопротеин , состоящий из ретиналя и апопротеина , он назвал его опсином, который сегодня можно было бы описать более узко как апородопсин. [ 14 ] Сегодня термин опсин относится в более широком смысле к классу рецепторов, связанных с G-белком , которые связывают ретиналь и в результате становятся светочувствительным фоторецептором , включая все близкородственные белки. [ 15 ] [ 16 ] [ 17 ] [ а ] Когда Уолд и его коллеги позже выделили йодопсин из сетчатки курицы, открыв тем самым первый известный опсин колбочки , они назвали апо-йодопсин фотопсином (из-за его связи со фотопическим зрением ) и апо-родопсин скотопсином (из-за его использования в скотопическом зрении ). [ 18 ]
Общий
[ редактировать ]Родопсин — белок, обнаруженный во внешних сегментах дисков палочек . Он обеспечивает скотопическое зрение , то есть монохроматическое зрение в тусклом свете. [ 7 ] [ 19 ] Родопсин наиболее сильно поглощает зелено-синий свет (~500 нм). [ 20 ] [ 21 ] поэтому он выглядит красновато-фиолетовым, отсюда и архаичный термин «визуальный пурпур».
Несколько близкородственных опсинов различаются лишь несколькими аминокислотами и длинами волн света, которые они поглощают наиболее сильно. У человека имеются, включая родопсин, девять опсинов, [ 15 ] а также криптохром (светочувствительный, но не опсин). [ 22 ]
Структура
[ редактировать ]
Родопсин, как и другие опсины, представляет собой рецептор, связанный с G-белком (GPCR). [ 23 ] [ 24 ] GPCR представляют собой хеморецепторы , которые встроены в липидный бислой клеточных мембран и имеют семь трансмембранных доменов, образующих карман связывания для лиганда. [ 25 ] [ 26 ] Лигандом родопсина является витамина на основе хромофор 11- цис - ретиналь А. [ 27 ] [ 28 ] [ 29 ] [ 30 ] [ 31 ] лежащий горизонтально относительно клеточной мембраны [ 32 ] и ковалентно связан с остатком лизина (lys296) [ 33 ] в седьмом трансмембранном домене [ 34 ] [ 32 ] через Шиффову базу . [ 35 ] [ 36 ] Однако 11- цис -ретиналь только блокирует связывающий карман и не активирует родопсин. Он активируется только тогда, когда 11- цис -ретиналь поглощает фотон света и изомеризуется в полностью транс -ретиналь. [ 37 ] [ 38 ] форма, активирующая рецептор, [ 39 ] [ 40 ] вызывая конформные изменения родопсина (обесцвечивание), [ 39 ] которые активируют каскад фототрансдукции . [ 41 ] Таким образом, хеморецептор преобразуется в световой или фото(n)рецептор . [ 16 ]
Лизин, связывающий сетчатку, консервативен почти во всех опсинах, лишь немногие опсины утратили его в ходе эволюции . [ 16 ] Опсины без лизина не светочувствительны. [ 42 ] [ 43 ] [ 44 ] включая родопсин. делают родопсин конститутивно (постоянно) активным даже без света. Некоторые из этих мутаций [ 45 ] [ 46 ] [ 47 ] Также родопсин дикого типа конститутивно активен, если 11- цис -ретиналь не связан, но в гораздо меньшей степени. [ 48 ] Следовательно, 11- цис -ретинал является обратным агонистом . Такие мутации являются одной из причин аутосомно-доминантного пигментного ретинита . [ 47 ] Искусственно связывающий ретинал лизин можно сместить в другие положения, даже в другие трансмембранные домены, без изменения активности. [ 49 ]
Родопсин крупного рогатого скота содержит 348 аминокислот , лизин, связывающийся с сетчаткой, представляет собой Lys296. Это был первый опсин, которого аминокислотная последовательность [ 50 ] и 3D-структура . [ 32 ] Его структура подробно изучена методом рентгеновской кристаллографии на кристаллах родопсина. [ 51 ] Некоторые модели (например, механизм велосипедной педали , механизм хула-поворота ) пытаются объяснить, как группа сетчатки может менять свою конформацию, не конфликтуя с обволакивающим белковым карманом родопсина. [ 52 ] [ 53 ] [ 54 ] Недавние данные подтверждают, что родопсин является функциональным мономером, а не димером, который был парадигмой рецепторов, связанных с G-белком, в течение многих лет. [ 55 ]
Внутри собственной мембраны родопсин имеет высокую плотность, что облегчает его способность захватывать фотоны. Из-за его плотной упаковки внутри мембраны вероятность захвата белков родопсином выше. Однако высокая плотность также создает недостаток, когда дело касается передачи сигналов G-белком, поскольку диффузия становится более сложной в переполненной мембране, заполненной рецептором родопсином. [ 56 ]
Фототрансдукция
[ редактировать ]
Родопсин является важным рецептором, связанным с G-белком, при фототрансдукции .
Активация
[ редактировать ]В родопсине альдегидная группа ретиналя ковалентно связана с аминогруппой остатка лизина белка в протонированном основании Шиффа (-NH + =СН-). [ 33 ] Когда родопсин поглощает свет, его кофактор сетчатки изомеризуется из 11-цис-конфигурации в полностью транс-конфигурацию, а белок впоследствии подвергается серии релаксаций, чтобы приспособиться к измененной форме изомеризованного кофактора. Образующиеся в ходе этого процесса интермедиаты были впервые исследованы в лаборатории Джорджа Уолда , получившего за это исследование Нобелевскую премию в 1967 году. [ 57 ] Динамика фотоизомеризации впоследствии была исследована с помощью ИК-спектроскопии с временным разрешением и УФ/Вид -спектроскопии. Первый фотопродукт, называемый фотородопсином, образуется в течение 200 фемтосекунд после облучения, за ним в течение пикосекунд следует второй, называемый батородопсином, с искаженными полностью транс-связями. Этот промежуточный продукт можно поймать и изучить при криогенных температурах, и первоначально он назывался прелюмирродопсин. [ 58 ] В последующих промежуточных продуктах люмирродопсине и метародопсине I связь основания Шиффа с полностью транс-ретиналем остается протонированной, и белок сохраняет свой красноватый цвет. Критическое изменение, которое инициирует возбуждение нейронов, включает преобразование метародопсина I в метародопсин II , что связано с депротонированием основания Шиффа и изменением цвета с красного на желтый. [ 59 ]
Каскад фототрансдукции
[ редактировать ]Продукт световой активации, метародопсин II, инициирует зрительной фототрансдукции путь вторичного мессенджера путем стимуляции G-белка трансдуцина (Gt ) , что приводит к высвобождению его α-субъединицы. Эта GTP-связанная субъединица, в свою очередь, активирует цГМФ -фосфодиэстеразу . Фосфодиэстераза цГМФ гидролизует (разрушает) цГМФ , снижая его локальную концентрацию, поэтому он больше не может активировать цГМФ-зависимые катионные каналы . Это приводит к гиперполяризации фоторецепторных клеток, изменяя скорость, с которой они выделяют передатчики. [ 60 ] [ 41 ]
Деактивация
[ редактировать ]Мета II (метародопсин II) быстро деактивируется после активации трансдуцина родопсинкиназой и аррестином . [ 61 ] Пигмент родопсин должен быть регенерирован для дальнейшей фототрансдукции. Это означает, что замена полностью транс-ретиналя на 11-цис-ретиналь, и распад Мета II имеет решающее значение в этом процессе. Во время распада Мета II звено основания Шиффа, которое обычно содержит полностью транс-ретиналь и апопротеин опсин (апорходопсин), гидролизуется и становится Мета III. Во внешнем сегменте палочки Мета III распадается на отдельные полностью транс-ретиналь и опсин. [ 61 ] Вторым продуктом распада Meta II является полностью транс-ретиналь-опсиновый комплекс, в котором полностью транс-ретиналь перемещен во вторые сайты связывания. Переходит ли распад Мета II в Мета III или полностью транс-ретинальный комплекс опсина, по-видимому, зависит от pH реакции. Более высокий pH имеет тенденцию стимулировать реакцию распада в сторону Мета III. [ 61 ]
Заболевания сетчатки
[ редактировать ]Мутации в гене родопсина в основном способствуют развитию различных заболеваний сетчатки, таких как пигментный ретинит . В целом дефектный родопсин агрегирует с убиквитином в тельцах включения, разрушает сеть промежуточных филаментов и ухудшает способность клетки расщеплять нефункционирующие белки, что приводит к апоптозу фоторецепторов . [ 62 ] Другие мутации родопсина приводят к Х-сцепленной врожденной стационарной куриной слепоте , в основном из-за конститутивной активации, когда мутации возникают вокруг хромофорсвязывающего кармана родопсина. [ 63 ] Было обнаружено несколько других патологических состояний, связанных с родопсином, включая плохой трафик после Гольджи, дисрегуляторную активацию, нестабильность внешнего сегмента стержня и связывание аррестина. [ 63 ]
См. также
[ редактировать ]- Бактериородопсин , используемый в некоторых галобактериях управляемого светом в качестве протонного насоса, .
Пояснительные примечания
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а б с GRCh38: Версия Ensembl 89: ENSG00000163914 – Ensembl , май 2017 г.
- ^ Jump up to: а б с GRCm38: выпуск Ensembl 89: ENSMUSG00000030324 – Ensembl , май 2017 г.
- ^ «Ссылка на Human PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Ссылка на Mouse PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «РО родопсин [Homo sapiens (человек)]» . НКБИ . Проверено 16 ноября 2017 г.
- ^ Литманн Б.Дж., Митчелл, округ Колумбия (1996). «Структура и функция родопсина». В Ли А.Г. (ред.). Рецепторы, связанные с родопсином и G-белком, часть A (том 2, 1996 г.) (набор из 2 томов) . Биомембраны: многотомный трактат. Том. 2. Гринвич, Коннектикут: JAI Press. стр. 1–32. дои : 10.1016/S1874-5342(07)80004-3 . ISBN 978-1-55938-659-3 .
- ^ Jump up to: а б Стюарт Дж. А., Бриге Р. Р. (1996). «Характеристика первичных фотохимических событий в бактериородопсине и родопсине». В Ли А.Г. (ред.). Рецепторы, связанные с родопсином и G-белком, часть A (том 2, 1996 г.) (набор из 2 томов) . Биомембраны: многотомный трактат. Том. 2. Гринвич, Коннектикут: JAI Press. стр. 33–140. дои : 10.1016/S1874-5342(07)80005-5 . ISBN 978-1-55938-659-3 .
- ^ Энциклопедия неврологических наук . Академическая пресса. 29 апреля 2014 г. стр. 441–. ISBN 978-0-12-385158-1 .
- ^ Гизе AC (24 сентября 2013 г.). Фотофизиология: Общие принципы; Действие света на растения . Эльзевир. п. 9. ISBN 978-1-4832-6227-7 . Проверено 23 сентября 2015 г.
- ^ Болл Ф (1877 г.). «Об анатомии и физиологии сетчатки» . Архив анатомии и физиологии физиологического факультета (на немецком языке): 4–35.
- ^ «Родопсин: история и этимология родопсина» . Онлайн-словарь Мерриам-Вебстера .
- ^ См.:
- Онлайн-словарь Merriam-Webster : Родопсин: история и этимология родопсина
- Эвальд А., Кюне В. (1878). «Исследования родопсина». Исследования Физиологического института Гейдельбергского университета (на немецком языке). 1 : 139-218. Из стр. 181: «То, что изменяет зрительный пурпур в темноте, имеет тенденцию наш делать это так же, как свет, то есть производить сначала желтую материю, а затем бесцветную субстанцию. Для краткости и ради чуждости Чтобы сделать имена доступными, можно сказать, что родопсин сначала расщепляется на ксантопсин, который затем расщепляется на лейкопсин». (То, что изменяет зрительный пурпур в темноте, обычно действует до некоторой степени так же, как свет, т. е. образует сначала желтое вещество, затем бесцветное вещество. Для краткости и для того, чтобы сделать наши обозначения более доступными иностранцам мы можем сказать, что родопсин сначала расщепляется до ксантопсина [- зрительного желтого], а [затем] он распадается до лейкопсина [- зрительного белого].)
- ^ Уэйд, штат Нью-Джерси (ноябрь 2008 г.). «Визуальный фиолетовый (сехпурпур)». Восприятие . 37 (11): 1617–1620. дои : 10.1068/p3711ed . ПМИД 19189727 . S2CID 19145558 .
- ^ Уолд Г. (декабрь 1951 г.). «Фотохимическая основа палочечного зрения». Журнал Оптического общества Америки . 41 (12): 949–956. Бибкод : 1951JOSA...41..949W . дои : 10.1364/josa.41.000949 . ПМИД 14908734 .
- ^ Jump up to: а б Теракита А (2005). «Опсины» . Геномная биология . 6 (3): 213. doi : 10.1186/gb-2005-6-3-213 . ПМЦ 1088937 . ПМИД 15774036 .
- ^ Jump up to: а б с Гюманн М., Портер М.Л., Бок М.Дж. (август 2022 г.). «Глюопсины: опсины без лизина, связывающего сетчатку» . Клетки . 11 (15): 2441. doi : 10.3390/cells11152441 . ПМЦ 9368030 . ПМИД 35954284 .
 Материал был скопирован и адаптирован из этого источника, который доступен по международной лицензии Creative Commons Attribution 4.0 .
Материал был скопирован и адаптирован из этого источника, который доступен по международной лицензии Creative Commons Attribution 4.0 .
- ^ Jump up to: а б Хофманн КП, Ламб ТД (март 2023 г.). «Родопсин, светочувствитель зрения» . Прогресс в исследованиях сетчатки и глаз . 93 : 101116. doi : 10.1016/j.preteyeres.2022.101116 . ПМИД 36273969 . S2CID 253041556 .
- ^ Уолд Дж., Браун П.К., Смит П.Х. (май 1955 г.). «Йодопсин» . Журнал общей физиологии . 38 (5): 623–681. дои : 10.1085/jgp.38.5.623 . ПМК 2147498 . ПМИД 14367777 .
- ^ Роджерс К. «Родопсин» . Британская энциклопедия . Britannica.com . Проверено 30 января 2016 г.
- ^ Уолд Дж., Браун П.К. (январь 1958 г.). «Человеческий родопсин». Наука . 127 (3292): 222–226. Бибкод : 1958Sci...127..222W . дои : 10.1126/science.127.3292.222 . ПМИД 13495499 . S2CID 45459123 .
- ^ Боумейкер Дж.К., Дартналл Х.Дж. (январь 1980 г.). «Зрительные пигменты палочек и колбочек сетчатки человека» . Журнал физиологии . 298 (1): 501–511. дои : 10.1113/jphysicalol.1980.sp013097 . ПМЦ 1279132 . ПМИД 7359434 .
- ^ Фоли Л.Е., Гегер Р.Дж., Репперт С.М. (июнь 2011 г.). «Человеческий криптохром проявляет светозависимую магниточувствительность» . Природные коммуникации . 2 : 356. Бибкод : 2011NatCo...2..356F . дои : 10.1038/ncomms1364 . ПМК 3128388 . ПМИД 21694704 .
- ^ Кейси П.Дж., Gilman AG (февраль 1988 г.). «Участие G-белка в соединении рецептор-эффектор» . Журнал биологической химии . 263 (6): 2577–2580. дои : 10.1016/s0021-9258(18)69103-3 . ПМИД 2830256 . S2CID 38970721 .
- ^ Эттвуд Т.К., Финдли Дж.Б. (февраль 1994 г.). «Отпечатки пальцев, связанные с G-белком рецепторы». Белковая инженерия . 7 (2): 195–203. дои : 10.1093/белок/7.2.195 . ПМИД 8170923 .
- ^ Диксон Р.А., Кобилка Б.К., Страдер Д.Д., Бенович Дж.Л., Долман Х.Г., Фрилль Т. и др. (май 1986 г.). «Клонирование гена и кДНК бета-адренергического рецептора млекопитающих и гомология с родопсином». Природа . 321 (6065): 75–79. Бибкод : 1986Natur.321...75D . дои : 10.1038/321075a0 . ПМИД 3010132 . S2CID 4324074 .
- ^ Диксон Р.А., Сигал И.С., Рэндс Е., Регистр Р.Б., Канделор М.Р., Блейк А.Д. и др. (март 1987 г.). «Связывание лиганда с бета-адренергическим рецептором включает его родопсин-подобное ядро». Природа . 326 (6108): 73–77. Бибкод : 1987Natur.326...73D . дои : 10.1038/326073a0 . ПМИД 2881211 . S2CID 4352920 .
- ^ Вальд Г. (июль 1934 г.). «Каротиноиды и цикл витамина А в зрении» . Природа . 134 (3376): 65. Бибкод : 1934Natur.134...65W . дои : 10.1038/134065a0 . S2CID 4022911 .
- ^ Уолд Г., Браун П.К., Хаббард Р., Орошник В. (июль 1955 г.). «Затрудненные цис-изомеры витамина А и ретинена: структура изомера Neo-B» . Труды Национальной академии наук Соединенных Штатов Америки . 41 (7): 438–451. Бибкод : 1955PNAS...41..438W . дои : 10.1073/pnas.41.7.438 . ПМК 528115 . ПМИД 16589696 .
- ^ Браун П.К., Уолд Г. (октябрь 1956 г.). «Нео-b-изомер витамина А и ретинена» . Журнал биологической химии . 222 (2): 865–877. дои : 10.1016/S0021-9258(20)89944-X . ПМИД 13367054 .
- ^ Орошник В. (июнь 1956 г.). «Синтез и конфигурация нео-витамина А и неоретинина b». Журнал Американского химического общества . 78 (11): 2651–2652. дои : 10.1021/ja01592a095 .
- ^ Орошник В., Браун П.К., Хаббард Р., Уолд Г. (сентябрь 1956 г.). «ЗАПРЕЩЕННЫЕ ЦИСА-ИЗОМЕРЫ ВИТАМИНА А И РЕТИНЕНА: СТРУКТУРА ИЗОМЕРА NEO-b» . Труды Национальной академии наук Соединенных Штатов Америки . 42 (9): 578–580. Бибкод : 1956PNAS...42..578O . дои : 10.1073/pnas.42.9.578 . ПМК 534254 . ПМИД 16589909 .
- ^ Jump up to: а б с Пальчевски К., Кумасака Т., Хори Т., Бенке К.А., Мотошима Х., Фокс Б.А. и др. (август 2000 г.). «Кристаллическая структура родопсина: рецептор, связанный с белком AG». Наука . 289 (5480): 739–745. Бибкод : 2000Sci...289..739P . CiteSeerX 10.1.1.1012.2275 . дои : 10.1126/science.289.5480.739 . ПМИД 10926528 .
- ^ Jump up to: а б Баундс Д. (декабрь 1967 г.). «Место прикрепления сетчатки к родопсину». Природа . 216 (5121): 1178–1181. Бибкод : 1967Natur.216.1178B . дои : 10.1038/2161178a0 . ПМИД 4294735 . S2CID 1657759 .
- ^ Харгрейв П.А., Макдауэлл Дж.Х., Кертис Д.Р., Ван Дж.К., Ющак Э., Фонг С.Л. и др. (1983). «Структура бычьего родопсина». Биофизика структуры и механизма . 9 (4): 235–244. дои : 10.1007/BF00535659 . ПМИД 6342691 . S2CID 20407577 .
- ^ Коллинз Ф.Д. (март 1953 г.). «Родопсин и индикаторный желтый». Природа . 171 (4350): 469–471. Бибкод : 1953Natur.171..469C . дои : 10.1038/171469a0 . ПМИД 13046517 . S2CID 4152360 .
- ^ Питт Г.А., Коллинз Ф.Д., Мортон Р.А., Сток П. (январь 1955 г.). «Исследования родопсина. VIII. Ретинилиденметиламин, аналог индикаторного желтого» . Биохимический журнал . 59 (1): 122–128. дои : 10.1042/bj0590122 . ПМК 1216098 . ПМИД 14351151 .
- ^ Хаббард Р., Кропф А. (февраль 1958 г.). «Действие света на родопсин» . Труды Национальной академии наук Соединенных Штатов Америки . 44 (2): 130–139. Бибкод : 1958PNAS...44..130H . дои : 10.1073/pnas.44.2.130 . ПМК 335377 . ПМИД 16590155 .
- ^ Кропф А., Хаббард Р. (ноябрь 1959 г.). «Механизм обесцвечивания родопсина». Анналы Нью-Йоркской академии наук . 74 (2): 266–280. Бибкод : 1959NYASA..74..266K . дои : 10.1111/j.1749-6632.1958.tb39550.x . ПМИД 13627857 . S2CID 45830716 .
- ^ Jump up to: а б Чой Х.В., Ким Ю.Дж., Пак Дж.Х., Моризуми Т., Пай Э.Ф., Краусс Н. и др. (март 2011 г.). «Кристаллическая структура метародопсина II». Природа . 471 (7340): 651–655. Бибкод : 2011Natur.471..651C . дои : 10.1038/nature09789 . ПМИД 21389988 . S2CID 4302421 .
- ^ Уолд Дж. (октябрь 1968 г.). «Молекулярные основы зрительного возбуждения». Наука . 162 (3850): 230–239. Бибкод : 1968Sci...162..230W . дои : 10.1126/science.162.3850.230 . ПМИД 4877437 .
- ^ Jump up to: а б Трактор А, Кавано-Ямасита Э, Коянаги М (январь 2012 г.). «Эволюция и разнообразие опсинов» . Междисциплинарные обзоры Wiley: мембранный транспорт и передача сигналов . 1 (1): 104–111. дои : 10.1002/wmts.6 .
- ^ Катана Р., Гуан С., Занини Д., Ларсен М.Е., Хиральдо Д., Гертен Б.Р. и др. (сентябрь 2019 г.). «Независимая от хромофора роль опсин-апопротеинов в механорецепторах дрозофилы» . Современная биология . 29 (17): 2961–2969.е4. Бибкод : 2019CBio...29E2961K . дои : 10.1016/j.cub.2019.07.036 . ПМИД 31447373 . S2CID 201420079 .
- ^ Люнг Нью-Йорк, Тхакур Д.П., Гурав А.С., Ким Ш., Ди Пизио А., Нив М.Ю. и др. (апрель 2020 г.). «Функции опсинов во вкусе дрозофилы» . Современная биология . 30 (8): 1367–1379.e6. Бибкод : 2020CBio...30E1367L . дои : 10.1016/j.cub.2020.01.068 . ПМЦ 7252503 . ПМИД 32243853 .
- ^ Кумбаласири Т., Роллаг М.Д., Изольди М.К., Каструччи А.М., Провенсио I (март 2007 г.). «Меланопсин запускает высвобождение внутренних запасов кальция в ответ на свет». Фотохимия и фотобиология . 83 (2): 273–279. дои : 10.1562/2006-07-11-RA-964 . ПМИД 16961436 . S2CID 23060331 .
- ^ Робинсон П.Р., Коэн Г.Б., Жуковский Е.А., Оприан Д.Д. (октябрь 1992 г.). «Конститутивно активные мутанты родопсина». Нейрон . 9 (4): 719–725. дои : 10.1016/0896-6273(92)90034-б . ПМИД 1356370 . S2CID 13172583 .
- ^ Ян Т., Снайдер Б.Б., Оприан Д.Д. (декабрь 1997 г.). «Синтез и характеристика нового аналога ретиниламина-ингибитора конститутивно активных мутантов родопсина, обнаруженных у пациентов с аутосомно-доминантным пигментным ретинитом» . Труды Национальной академии наук Соединенных Штатов Америки . 94 (25): 13559–13564. Бибкод : 1997PNAS...9413559Y . дои : 10.1073/pnas.94.25.13559 . ПМК 28345 . ПМИД 9391065 .
- ^ Jump up to: а б Парк ПС (2014). «Конститутивно активный родопсин и заболевания сетчатки». Фармакология и терапия конститутивно активных рецепторов . Достижения фармакологии. Том. 70. стр. 1–36. дои : 10.1016/B978-0-12-417197-8.00001-8 . ISBN 978-0-12-417197-8 . ПМК 4120657 . ПМИД 24931191 .
- ^ Мелиа Т.Дж., Коуэн К.В., Энглсон Дж.К., Венсель Т.Г. (декабрь 1997 г.). «Сравнение эффективности активации G-белка безлигандными и светоактивируемыми формами родопсина» . Биофизический журнал . 73 (6): 3182–3191. Бибкод : 1997BpJ....73.3182M . дои : 10.1016/S0006-3495(97)78344-9 . ПМЦ 1181221 . ПМИД 9414230 .
- ^ Дивайн Э.Л., Оприан Д.Д., Теобальд Д.Л. (август 2013 г.). «Перемещение лизина активного центра в родопсине и последствия для эволюции ретинилиденовых белков» . Труды Национальной академии наук Соединенных Штатов Америки . 110 (33): 13351–13355. Бибкод : 2013PNAS..11013351D . дои : 10.1073/pnas.1306826110 . ПМЦ 3746867 . ПМИД 23904486 .
- ^ Овчинников Ю.А. (ноябрь 1982 г.). «Родопсин и бактериородопсин: структурно-функциональные взаимоотношения» . Письма ФЭБС . 148 (2): 179–191. дои : 10.1016/0014-5793(82)80805-3 . ПМИД 6759163 . S2CID 85819100 .
- ^ Гулати С., Ястржебска Б., Банерджи С., Пласерес А.Л., Мишта П., Гао С. и др. (март 2017 г.). «Фотоциклическое поведение родопсина, вызванное атипичным механизмом изомеризации» . Труды Национальной академии наук Соединенных Штатов Америки . 114 (13): Е2608–Е2615. Бибкод : 2017PNAS..114E2608G . дои : 10.1073/pnas.1617446114 . ПМК 5380078 . ПМИД 28289214 .
- ^ Накамичи Х., Окада Т. (июнь 2006 г.). «Кристаллографический анализ первичной визуальной фотохимии». Ангеванде Хеми . 45 (26): 4270–4273. дои : 10.1002/anie.200600595 . ПМИД 16586416 .
- ^ Шрайбер М., Сугихара М., Окада Т., Басс В. (июнь 2006 г.). «Квантово-механические исследования на кристаллографической модели батородопсина». Ангеванде Хеми . 45 (26): 4274–4277. дои : 10.1002/anie.200600585 . ПМИД 16729349 .
- ^ Вайнгарт О. (сентябрь 2007 г.). «Скрученная связь C11 = C12 хромофора родопсина - фотохимическая горячая точка». Журнал Американского химического общества . 129 (35): 10618–10619. дои : 10.1021/ja071793t . ПМИД 17691730 .
- ^ Шабре М., Ле Мэр М. (июль 2005 г.). «Мономерный рецептор, связанный с G-белком, как функциональная единица». Биохимия . 44 (27): 9395–9403. дои : 10.1021/bi050720o . ПМИД 15996094 .
- ^ Парк ПС (октябрь 2019 г.). «Олигомеризация и агрегация родопсина» . Журнал мембранной биологии . 252 (4–5): 413–423. дои : 10.1007/s00232-019-00078-1 . ПМК 6790290 . ПМИД 31286171 .
- ^ Нобелевский фонд. «Нобелевская премия по физиологии и медицине 1967 года» . Нобелевская премия.org . Нобель Медиа АБ 2014 . Проверено 12 декабря 2015 г.
- ^ Ёсидзава Т., Вальд Г. (март 1963 г.). «Прелюмирродопсин и обесцвечивание зрительных пигментов». Природа . 197 (30 марта): 1279–1286. Бибкод : 1963Natur.197.1279Y . дои : 10.1038/1971279a0 . ПМИД 14002749 . S2CID 4263392 .
- ^ Мэтьюз Р.Г., Хаббард Р., Браун П.К., Уолд Дж. (ноябрь 1963 г.). «Таутомерные формы метародопсина» . Журнал общей физиологии . 47 (2): 215–240. дои : 10.1085/jgp.47.2.215 . ПМК 2195338 . ПМИД 14080814 .
- ^ Хофманн КП, Хек М (1996). «Свет-индуцированные белок-белковые взаимодействия на мембране диска фоторецептора палочки». В Ли А.Г. (ред.). Рецепторы, связанные с родопсином и G-белком, часть A (том 2, 1996 г.) (набор из 2 томов) . Биомембраны: многотомный трактат. Том. 2. Гринвич, Коннектикут: JAI Press. стр. 141–198. дои : 10.1016/S1874-5342(07)80006-7 . ISBN 978-1-55938-659-3 .
- ^ Jump up to: а б с Хек М., Шедель С.А., Марецки Д., Бартл Ф.Дж., Риттер Э., Пальчевски К. и др. (январь 2003 г.). «Сигнальные состояния родопсина. Образование запасной формы метародопсина III из активного метародопсина II» . Журнал биологической химии . 278 (5): 3162–3169. дои : 10.1074/jbc.M209675200 . ПМЦ 1364529 . ПМИД 12427735 .
- ^ Салиба Р.С., Манро П.М., Лютерт П.Дж., Читэм М.Э. (июль 2002 г.). «Клеточная судьба мутантного родопсина: контроль качества, деградация и образование агресом» . Журнал клеточной науки . 115 (Часть 14): 2907–2918. дои : 10.1242/jcs.115.14.2907 . ПМИД 12082151 .
- ^ Jump up to: а б Мендес Х.Ф., ван дер Спай Дж., Чаппл Дж.П., Читэм М.Э. (апрель 2005 г.). «Механизмы гибели клеток при родопсиновом пигментном ретините: значение для терапии». Тенденции молекулярной медицины . 11 (4): 177–185. doi : 10.1016/j.molmed.2005.02.007 . ПМИД 15823756 .
Дальнейшее чтение
[ редактировать ]- Хамфрис П., Кенна П., Фаррар Г.Дж. (май 1992 г.). «К молекулярной генетике пигментного ретинита». Наука . 256 (5058): 804–808. Бибкод : 1992Sci...256..804H . дои : 10.1126/science.1589761 . ПМИД 1589761 .
- Эдвардс СК (июль 1995 г.). «Участие цГМФ и кальция в фотоответе фоторецепторных клеток позвоночных». Журнал Медицинской ассоциации Флориды . 82 (7): 485–488. ПМИД 7673885 .
- аль-Магте М., Грегори С., Инглхерн С., Хардкасл А., Бхаттачарья С. (1993). «Мутации родопсина при аутосомно-доминантном пигментном ретините» . Человеческая мутация . 2 (4): 249–255. дои : 10.1002/humu.1380020403 . ПМИД 8401533 . S2CID 28459589 .
- Гаррига П., Маньоса Дж. (сентябрь 2002 г.). «Белок фоторецептора глаза родопсин. Структурные последствия заболеваний сетчатки» . Письма ФЭБС . 528 (1–3): 17–22. дои : 10.1016/S0014-5793(02)03241-6 . ПМИД 12297272 . S2CID 41860711 .
- Инглхерн К.Ф., Кин Т.Дж., Башир Р., Джей М., Фитцке Ф., Бёрд А.С. и др. (апрель 1992 г.). «Завершенный скрининг мутаций гена родопсина у группы пациентов с аутосомно-доминантным пигментным ретинитом». Молекулярная генетика человека . 1 (1): 41–45. дои : 10.1093/hmg/1.1.41 . ПМИД 1301135 .
- Фаррар Г.Дж., Финдли Дж.Б., Кумар-Сингх Р., Кенна П., Хамфрис М.М., Шарп Э. и др. (декабрь 1992 г.). «Аутосомно-доминантный пигментный ретинит: новая мутация гена родопсина в исходной семье, сцепленной с 3q». Молекулярная генетика человека . 1 (9): 769–771. дои : 10.1093/hmg/1.9.769 . ПМИД 1302614 .
- Робинсон П.Р., Коэн Г.Б., Жуковский Е.А., Оприан Д.Д. (октябрь 1992 г.). «Конститутивно активные мутанты родопсина». Нейрон . 9 (4): 719–725. дои : 10.1016/0896-6273(92)90034-B . ПМИД 1356370 . S2CID 13172583 .
- Фуджики К., Хотта Ю., Хаякава М., Сакума Х., Шионо Т., Норо М. и др. (июнь 1992 г.). «Точковые мутации гена родопсина обнаружены в японских семьях с аутосомно-доминантным пигментным ретинитом (ADRP)» . Японский журнал генетики человека . 37 (2): 125–132. дои : 10.1007/BF01899733 . ПМИД 1391967 .
- Олссон Дж.Э., Гордон Дж.В., Павлик Б.С., Руф Д., Хейс А., Молдей Р.С. и др. (ноябрь 1992 г.). «Трансгенные мыши с мутацией родопсина (Pro23His): мышиная модель аутосомно-доминантного пигментного ретинита». Нейрон . 9 (5): 815–830. дои : 10.1016/0896-6273(92)90236-7 . ПМИД 1418997 . S2CID 37524461 .
- Андреассон С., Эхингер Б., Абрахамсон М., Фекс Г. (сентябрь 1992 г.). «Семья из шести поколений с аутосомно-доминантным пигментным ретинитом и мутацией гена родопсина (аргинин-135-лейцин)». Офтальмопедиатрия и генетика . 13 (3): 145–153. дои : 10.3109/13816819209046483 . ПМИД 1484692 .
- Инглхерн К.Ф., Лестер Д.Х., Башир Р., Атиф У., Кин Т.Дж., Сертедаки А. и др. (март 1992 г.). «Рекомбинация между родопсином и локусом D3S47 (C17) в семействах родопсина пигментного ретинита» . Американский журнал генетики человека . 50 (3): 590–597. ПМЦ 1684283 . ПМИД 1539595 .
- Фишман Г.А., Стоун Э.М., Гилберт Л.Д., Шеффилд ВК (май 1992 г.). «Очевидные данные, связанные с мутацией кодона 106 гена родопсина. Изменение глицина на аргинин при аутосомно-доминантном пигментном ретините». Архив офтальмологии . 110 (5): 646–653. doi : 10.1001/archopht.1992.01080170068026 . ПМИД 1580841 .
- Кин Т.Дж., Инглхерн К.Ф., Лестер Д.Х., Башир Р., Джей М., Берд А.С. и др. (сентябрь 1991 г.). «Аутосомно-доминантный пигментный ретинит: четыре новые мутации в родопсине, одна из них в месте прикрепления сетчатки». Геномика . 11 (1): 199–205. дои : 10.1016/0888-7543(91)90119-Y . ПМИД 1765377 .
- Дрия Т.П., Хан Л.Б., Коули Г.С., МакГи Т.Л., Берсон Э.Л. (октябрь 1991 г.). «Мутационный спектр гена родопсина у больных аутосомно-доминантным пигментным ретинитом» . Труды Национальной академии наук Соединенных Штатов Америки . 88 (20): 9370–9374. Бибкод : 1991PNAS...88.9370D . дои : 10.1073/pnas.88.20.9370 . ПМК 52716 . ПМИД 1833777 .
- Гал А., Артлих А., Людвиг М., Нимейер Г., Олек К., Швингер Э. и др. (октябрь 1991 г.). «Мутация Pro-347-Arg гена родопсина при аутосомно-доминантном пигментном ретините». Геномика . 11 (2): 468–470. дои : 10.1016/0888-7543(91)90159-C . ПМИД 1840561 .
- Сунг Ч., Давенпорт К.М., Хеннесси Дж.К., Момени И.Х., Джейкобсон С.Г., Хекенливли Дж.Р. и др. (август 1991 г.). «Мутации родопсина при аутосомно-доминантном пигментном ретините» . Труды Национальной академии наук Соединенных Штатов Америки . 88 (15): 6481–6485. Бибкод : 1991PNAS...88.6481S . дои : 10.1073/pnas.88.15.6481 . ПМК 52109 . ПМИД 1862076 .
- Джейкобсон С.Г., Кемп К.М., Сунг Ч.Х., Натанс Дж. (сентябрь 1991 г.). «Функция сетчатки и уровни родопсина при аутосомно-доминантном пигментном ретините с мутациями родопсина» . Американский журнал офтальмологии . 112 (3): 256–271. дои : 10.1016/s0002-9394(14)76726-1 . ПМИД 1882937 .
- Шеффилд В.К., Фишман Г.А., Бек Дж.С., Кимура А.Э., Стоун Э.М. (октябрь 1991 г.). «Идентификация новых мутаций родопсина, связанных с пигментным ретинитом, с помощью электрофореза в денатурирующем градиентном геле с зажимом GC» . Американский журнал генетики человека . 49 (4): 699–706. ПМЦ 1683182 . ПМИД 1897520 .
Внешние ссылки
[ редактировать ]- Родопсин в Национальной медицинской библиотеке США по медицинским предметным рубрикам (MeSH)
- Колб Х., Фернандес Э., Нельсон Р., Джонс Б.В. (1 марта 2010 г.). «Домашняя страница Webvision: организация сетчатки и зрительной системы» . Университет Юты.
- Белок родопсин
- Фотоизомеризация родопсина , анимация.
- Родопсин и глаз , краткое содержание с картинками.