Abiogenesis

Abiogenesis is the natural process by which life arises from non-living matter, such as simple organic compounds. The prevailing scientific hypothesis is that the transition from non-living to living entities on Earth was not a single event, but a process of increasing complexity involving the formation of a habitable planet, the prebiotic synthesis of organic molecules, molecular self-replication, self-assembly, autocatalysis, and the emergence of cell membranes. The transition from non-life to life has never been observed experimentally, but many proposals have been made for different stages of the process.
The study of abiogenesis aims to determine how pre-life chemical reactions gave rise to life under conditions strikingly different from those on Earth today. It primarily uses tools from biology and chemistry, with more recent approaches attempting a synthesis of many sciences. Life functions through the specialized chemistry of carbon and water, and builds largely upon four key families of chemicals: lipids for cell membranes, carbohydrates such as sugars, amino acids for protein metabolism, and nucleic acid DNA and RNA for the mechanisms of heredity. Any successful theory of abiogenesis must explain the origins and interactions of these classes of molecules.
Many approaches to abiogenesis investigate how self-replicating molecules, or their components, came into existence. Researchers generally think that current life descends from an RNA world, although other self-replicating and self-catalyzing molecules may have preceded RNA. Other approaches ("metabolism-first" hypotheses) focus on understanding how catalysis in chemical systems on the early Earth might have provided the precursor molecules necessary for self-replication. The classic 1952 Miller–Urey experiment demonstrated that most amino acids, the chemical constituents of proteins, can be synthesized from inorganic compounds under conditions intended to replicate those of the early Earth. External sources of energy may have triggered these reactions, including lightning, radiation, atmospheric entries of micro-meteorites and implosion of bubbles in sea and ocean waves.
While the last universal common ancestor of all modern organisms (LUCA) is thought to have been quite different from the origin of life, investigations into LUCA can guide research into early universal characteristics. A genomics approach has sought to characterise LUCA by identifying the genes shared by Archaea and Bacteria, members of the two major branches of life (with Eukaryotes included in the archaean branch in the two-domain system). It appears there are 355 genes common to all life; their functions imply that the LUCA was anaerobic with the Wood–Ljungdahl pathway, deriving energy by chemiosmosis, and maintaining its hereditary material with DNA, the genetic code, and ribosomes. Although the LUCA lived over 4 billion years ago (4 Gya), researchers believe it was far from the first form of life. Earlier cells might have had a leaky membrane and been powered by a naturally occurring proton gradient near a deep-sea white smoker hydrothermal vent.
Earth remains the only place in the universe known to harbor life. Geochemical and fossil evidence from the Earth informs most studies of abiogenesis. The Earth was formed at 4.54 Gya, and the earliest evidence of life on Earth dates from at least 3.8 Gya from Western Australia. Fossil micro-organisms appear to have lived within hydrothermal vent precipitates dated 3.77 to 4.28 Gya from Quebec, soon after ocean formation 4.4 Gya during the Hadean.
Overview
[edit]
Life consists of reproduction with (heritable) variations.[3] NASA defines life as "a self-sustaining chemical system capable of Darwinian [i.e., biological] evolution."[4] Such a system is complex; the last universal common ancestor (LUCA), presumably a single-celled organism which lived some 4 billion years ago, already had hundreds of genes encoded in the DNA genetic code that is universal today. That in turn implies a suite of cellular machinery including messenger RNA, transfer RNA, and ribosomes to translate the code into proteins. Those proteins included enzymes to operate its anaerobic respiration via the Wood–Ljungdahl metabolic pathway, and a DNA polymerase to replicate its genetic material.[5][6]
The challenge for abiogenesis (origin of life)[7][8][9] researchers is to explain how such a complex and tightly interlinked system could develop by evolutionary steps, as at first sight all its parts are necessary to enable it to function. For example, a cell, whether the LUCA or in a modern organism, copies its DNA with the DNA polymerase enzyme, which is in turn produced by translating the DNA polymerase gene in the DNA. Neither the enzyme nor the DNA can be produced without the other.[10] The evolutionary process could have involved molecular self-replication, self-assembly such as of cell membranes, and autocatalysis.[5][6][11] Nonetheless, the transition of non-life to life has never been observed experimentally.[12]
The precursors to the development of a living cell like the LUCA are clear enough, if disputed in their details: a habitable world is formed with a supply of minerals and liquid water. Prebiotic synthesis creates a range of simple organic compounds, which are assembled into polymers such as proteins and RNA. The process after the LUCA is readily understood: biological evolution caused the development of a wide range of species with varied forms and biochemical capabilities. The derivation of living things such as the LUCA from simple components, however, is far from understood.[1]
Although Earth remains the only place where life is known,[13][14] the science of astrobiology seeks evidence of life on other planets. The 2015 NASA strategy on the origin of life aimed to solve the puzzle by identifying interactions, intermediary structures and functions, energy sources, and environmental factors that contributed to the diversity, selection, and replication of evolvable macromolecular systems,[2] and mapping the chemical landscape of potential primordial informational polymers. The advent of polymers that could replicate, store genetic information, and exhibit properties subject to selection was, it suggested, most likely a critical step in the emergence of prebiotic chemical evolution.[2] Those polymers derived, in turn, from simple organic compounds such as nucleobases, amino acids, and sugars that could have been formed by reactions in the environment.[15][8][16][17] A successful theory of the origin of life must explain how all these chemicals came into being.[18]
Pre-1960s conceptual history
[edit]
Spontaneous generation
[edit]One ancient view of the origin of life, from Aristotle until the 19th century, is of spontaneous generation.[19] This theory held that "lower" animals such as insects were generated by decaying organic substances, and that life arose by chance.[20][21] This was questioned from the 17th century, in works like Thomas Browne's Pseudodoxia Epidemica.[22][23] In 1665, Robert Hooke published the first drawings of a microorganism. In 1676, Antonie van Leeuwenhoek drew and described microorganisms, probably protozoa and bacteria.[24] Van Leeuwenhoek disagreed with spontaneous generation, and by the 1680s convinced himself, using experiments ranging from sealed and open meat incubation and the close study of insect reproduction, that the theory was incorrect.[25] In 1668 Francesco Redi showed that no maggots appeared in meat when flies were prevented from laying eggs.[26] By the middle of the 19th century, spontaneous generation was considered disproven.[27][28]
Panspermia
[edit]Another ancient idea dating back to Anaxagoras in the 5th century BC is panspermia,[29] the idea that life exists throughout the universe, distributed by meteoroids, asteroids, comets[30] and planetoids.[31] It does not attempt to explain how life originated in itself, but shifts the origin of life on Earth to another heavenly body. The advantage is that life is not required to have formed on each planet it occurs on, but rather in a more limited set of locations, or even a single location, and then spread about the galaxy to other star systems via cometary or meteorite impact.[32] Panspermia did not get much scientific support because it was largely used to deflect the need of an answer instead of explaining observable phenomena. Although the interest in panspermia grew when the study of meteorites found traces of organic materials in them, it is currently accepted that life started locally on Earth.[33]
"A warm little pond": primordial soup
[edit]The idea that life originated from non-living matter in slow stages appeared in Herbert Spencer's 1864–1867 book Principles of Biology, and in William Turner Thiselton-Dyer's 1879 paper "On spontaneous generation and evolution". On 1 February 1871 Charles Darwin wrote about these publications to Joseph Hooker, and set out his own speculation, suggesting that the original spark of life may have begun in a "warm little pond, with all sorts of ammonia and phosphoric salts, light, heat, electricity, &c., present, that a proteine compound was chemically formed ready to undergo still more complex changes." Darwin went on to explain that "at the present day such matter would be instantly devoured or absorbed, which would not have been the case before living creatures were formed."[34][35][36]
Alexander Oparin in 1924 and J. B. S. Haldane in 1929 proposed that the first molecules constituting the earliest cells slowly self-organized from a primordial soup, and this theory is called the Oparin–Haldane hypothesis.[37][38] Haldane suggested that the Earth's prebiotic oceans consisted of a "hot dilute soup" in which organic compounds could have formed.[21][39] J. D. Bernal showed that such mechanisms could form most of the necessary molecules for life from inorganic precursors.[40] In 1967, he suggested three "stages": the origin of biological monomers; the origin of biological polymers; and the evolution from molecules to cells.[41][42]
Miller–Urey experiment
[edit]In 1952, Stanley Miller and Harold Urey carried out a chemical experiment to demonstrate how organic molecules could have formed spontaneously from inorganic precursors under prebiotic conditions like those posited by the Oparin–Haldane hypothesis. It used a highly reducing (lacking oxygen) mixture of gases—methane, ammonia, and hydrogen, as well as water vapor—to form simple organic monomers such as amino acids.[43][44] Bernal said of the Miller–Urey experiment that "it is not enough to explain the formation of such molecules, what is necessary, is a physical-chemical explanation of the origins of these molecules that suggests the presence of suitable sources and sinks for free energy."[45] However, current scientific consensus describes the primitive atmosphere as weakly reducing or neutral,[46][47] diminishing the amount and variety of amino acids that could be produced. The addition of iron and carbonate minerals, present in early oceans, however, produces a diverse array of amino acids.[46] Later work has focused on two other potential reducing environments: outer space and deep-sea hydrothermal vents.[48][49][50]
Producing a habitable Earth
[edit]Origin of life timeline | ||||||||||||||||||||||||
−13 — – −12 — – −11 — – −10 — – −9 — – −8 — – −7 — – −6 — – −5 — – −4 — – −3 — – −2 — – −1 — – 0 — |
| |||||||||||||||||||||||
Evolutionary history
[edit]Early universe with first stars
[edit]Soon after the Big Bang, which occurred roughly 14 Gya, the only chemical elements present in the universe were hydrogen, helium, and lithium, the three lightest atoms in the periodic table. These elements gradually accreted and began orbiting in disks of gas and dust. Gravitational accretion of material at the hot and dense centers of these protoplanetary disks formed stars by the fusion of hydrogen.[51] Early stars were massive and short-lived, producing all the heavier elements through stellar nucleosynthesis. Element formation through stellar nucleosynthesis proceeds to its most stable element Iron-56. Heavier elements were formed during supernovae at the end of a stars lifecycle. Carbon, currently the fourth most abundant chemical element in the universe (after hydrogen, helium, and oxygen), was formed mainly in white dwarf stars, particularly those bigger than twice the mass of the sun.[52] As these stars reached the end of their lifecycles, they ejected these heavier elements, among them carbon and oxygen, throughout the universe. These heavier elements allowed for the formation of new objects, including rocky planets and other bodies.[53] According to the nebular hypothesis, the formation and evolution of the Solar System began 4.6 Gya with the gravitational collapse of a small part of a giant molecular cloud. Most of the collapsing mass collected in the center, forming the Sun, while the rest flattened into a protoplanetary disk out of which the planets, moons, asteroids, and other small Solar System bodies formed.[54]
Emergence of Earth
[edit]The age of the Earth is 4.54 Gya as found by radiometric dating of calcium-aluminium-rich inclusions in carbonaceous chrondrite meteorites, the oldest material in the Solar System.[55][56] The Hadean Earth (from its formation until 4 Gya) was at first inhospitable to any living organisms. During its formation, the Earth lost a significant part of its initial mass, and consequentially lacked the gravity to hold molecular hydrogen and the bulk of the original inert gases.[57] Soon after initial accretion of Earth at 4.48 Ga, its collision with Theia, a hypothesised impactor, is thought to have created the ejected debris that would eventually form the Moon.[58] This impact would have removed the Earth's primary atmosphere, leaving behind clouds of viscous silicates and carbon dioxide. This unstable atmosphere was short-lived and condensed shortly after to form the bulk silicate Earth, leaving behind an atmosphere largely consisting of water vapor, nitrogen, and carbon dioxide, with smaller amounts of carbon monoxide, hydrogen, and sulfur compounds.[59][60] The solution of carbon dioxide in water is thought to have made the seas slightly acidic, with a pH of about 5.5.[61]
Condensation to form liquid oceans is theorised to have occurred as early as the Moon-forming impact.[62][63] This scenario has found support from the dating of 4.404 Gya zircon crystals with high δ18O values from metamorphosed quartzite of Mount Narryer in Western Australia.[64][65] The Hadean atmosphere has been characterized as a "gigantic, productive outdoor chemical laboratory," similar to volcanic gases today which still support some abiotic chemistry. Despite the likely increased volcanism from early plate tectonics, the Earth may have been a predominantly water world between 4.4 and 4.3 Gya. It is debated whether or not crust was exposed above this ocean due to uncertainties of what early plate tectonics looked like. For early life to have developed, it is generally thought that a land setting is required, so this question is essential to determining when in Earth's history life evolved.[66] The post-Moon-forming impact Earth likely existed with little if any continental crust, a turbulent atmosphere, and a hydrosphere subject to intense ultraviolet light from a T Tauri stage Sun, from cosmic radiation, and from continued asteroid and comet impacts.[67] Despite all this, niche environments likely existed conducive to life on Earth in the Late-Hadean to Early-Archaean.
The Late Heavy Bombardment hypothesis posits that a period of intense impact occurred at ~3.9 Gya during the Hadean.[68][69] A cataclysmic impact event would have had the potential to sterilise all life on Earth by volatilising liquid oceans and blocking the Sun needed for photosynthesising primary producers, pushing back the earliest possible emergence of life to after Late Heavy Bombardment.[70] Recent research questions both the intensity of the Late Heavy Bombardment as well as its potential for sterilisation. Uncertainties as to whether Late Heavy Bombardment was one giant impact or a period of greater impact rates greatly changed the implication of its destructive power.[71][72] The 3.9 Ga date arises from dating of Apollo mission sample returns collected mostly near the Imbrium Basin, biasing the age of recorded impacts.[73] Impact modelling of the lunar surface reveals that rather than a cataclysmic event at 3.9 Ga, multiple small-scale, short-lived periods of bombardment likely occurred.[74] Terrestrial data backs this idea by showing multiple periods of ejecta in the rock record both before and after the 3.9 Ga marker, suggesting that the early Earth was subject to continuous impacts that would not have had as great an impact on extinction as previously thought.[75] If the Late Heavy Bombardment did not take place, this allows for the emergence of life to have taken place far before 3.9 Ga.
If life evolved in the ocean at depths of more than ten meters, it would have been shielded both from late impacts and the then high levels of ultraviolet radiation from the sun. Geothermically heated oceanic crust could have yielded far more organic compounds through deep hydrothermal vents than the Miller–Urey experiments indicated.[76] The available energy is maximized at 100–150 °C, the temperatures at which hyperthermophilic bacteria and thermoacidophilic archaea live.[77]
Earliest evidence of life
[edit]The exact timing at which life emerged on Earth is unknown. Minimum age estimates are based on evidence from the geologic rock record. The earliest physical evidence of life so far found consists of microbialites in the Nuvvuagittuq Greenstone Belt of Northern Quebec, in banded iron formation rocks at least 3.77 and possibly as old as 4.32 Gya. The micro-organisms lived within hydrothermal vent precipitates, soon after the 4.4 Gya formation of oceans during the Hadean. The microbes resembled modern hydrothermal vent bacteria, supporting the view that abiogenesis began in such an environment.[78]
Biogenic graphite has been found in 3.7 Gya metasedimentary rocks from southwestern Greenland[79] and in microbial mat fossils from 3.49 Gya cherts in the Pilbara region of Western Australia.[80] Evidence of early life in rocks from Akilia Island, near the Isua supracrustal belt in southwestern Greenland, dating to 3.7 Gya, have shown biogenic carbon isotopes.[81] In other parts of the Isua supracrustal belt, graphite inclusions trapped within garnet crystals are connected to the other elements of life: oxygen, nitrogen, and possibly phosphorus in the form of phosphate, providing further evidence for life 3.7 Gya.[82] In the Pilbara region of Western Australia, compelling evidence of early life was found in pyrite-bearing sandstone in a fossilized beach, with rounded tubular cells that oxidized sulfur by photosynthesis in the absence of oxygen.[83][84] Carbon isotope ratios on graphite inclusions from the Jack Hills zircons suggest that life could have existed on Earth from 4.1 Gya.[85]
The Pilbara region of Western Australia contains the Dresser Formation with rocks 3.48 Gya, including layered structures called stromatolites. Their modern counterparts are created by photosynthetic micro-organisms including cyanobacteria.[86] These lie within undeformed hydrothermal-sedimentary strata; their texture indicates a biogenic origin. Parts of the Dresser formation preserve hot springs on land, but other regions seem to have been shallow seas.[87] A molecular clock analysis suggests the LUCA emerged prior to the Late Heavy Bombardment (3.9 Gya).[88]
-
Stromatolites in the Siyeh Formation, Glacier National Park, dated 3.5 Gya, placing them among the earliest life-forms
-
Modern stromatolites in Shark Bay, created by photosynthetic cyanobacteria
Producing molecules: prebiotic synthesis
[edit]All chemical elements except for hydrogen and helium derive from stellar nucleosynthesis. The basic chemical ingredients of life – the carbon-hydrogen molecule (CH), the carbon-hydrogen positive ion (CH+) and the carbon ion (C+) – were produced by ultraviolet light from stars.[89] Complex molecules, including organic molecules, form naturally both in space and on planets.[90] Organic molecules on the early Earth could have had either terrestrial origins, with organic molecule synthesis driven by impact shocks or by other energy sources, such as ultraviolet light, redox coupling, or electrical discharges; or extraterrestrial origins (pseudo-panspermia), with organic molecules formed in interstellar dust clouds raining down on to the planet.[91][92]
Observed extraterrestrial organic molecules
[edit]An organic compound is a chemical whose molecules contain carbon. Carbon is abundant in the Sun, stars, comets, and in the atmospheres of most planets.[93] Organic compounds are relatively common in space, formed by "factories of complex molecular synthesis" which occur in molecular clouds and circumstellar envelopes, and chemically evolve after reactions are initiated mostly by ionizing radiation.[90][94][95] Purine and pyrimidine nucleobases including guanine, adenine, cytosine, uracil, and thymine have been found in meteorites. These could have provided the materials for DNA and RNA to form on the early Earth.[96] The amino acid glycine was found in material ejected from comet Wild 2; it had earlier been detected in meteorites.[97] Comets are encrusted with dark material, thought to be a tar-like organic substance formed from simple carbon compounds under ionizing radiation. A rain of material from comets could have brought such complex organic molecules to Earth.[98][99][60] It is estimated that during the Late Heavy Bombardment, meteorites may have delivered up to five million tons of organic prebiotic elements to Earth per year.[60]
PAH world hypothesis
[edit]
Green areas show regions where radiation from hot stars collided with large molecules and small dust grains called "polycyclic aromatic hydrocarbons" (PAHs), causing them to fluoresce. Spitzer Space Telescope, 2018.
Polycyclic aromatic hydrocarbons (PAH) are the most common and abundant polyatomic molecules in the observable universe, and are a major store of carbon.[93][100][101][102] They seem to have formed shortly after the Big Bang,[103][101][102] and are associated with new stars and exoplanets.[93] They are a likely constituent of Earth's primordial sea.[103][101][102] PAHs have been detected in nebulae,[104] and in the interstellar medium, in comets, and in meteorites.[93]
The PAH world hypothesis posits PAHs as precursors to the RNA world.[105] A star, HH 46-IR, resembling the sun early in its life, is surrounded by a disk of material which contains molecules including cyanide compounds, hydrocarbons, and carbon monoxide. PAHs in the interstellar medium can be transformed through hydrogenation, oxygenation, and hydroxylation to more complex organic compounds used in living cells.[106]
Nucleobases and nucleotides
[edit]The majority of organic compounds introduced on Earth by interstellar dust particles have helped to form complex molecules, thanks to their peculiar surface-catalytic activities.[107][108] Studies of the 12C/13C isotopic ratios of organic compounds in the Murchison meteorite suggest that the RNA component uracil and related molecules, including xanthine, were formed extraterrestrially.[109] NASA studies of meteorites suggest that all four DNA nucleobases (adenine, guanine and related organic molecules) have been formed in outer space.[107][110][111] The cosmic dust permeating the universe contains complex organics ("amorphous organic solids with a mixed aromatic–aliphatic structure") that could be created rapidly by stars.[112] Glycolaldehyde, a sugar molecule and RNA precursor, has been detected in regions of space including around protostars and on meteorites.[113][114]
Laboratory synthesis
[edit]As early as the 1860s, experiments demonstrated that biologically relevant molecules can be produced from interaction of simple carbon sources with abundant inorganic catalysts. The spontaneous formation of complex polymers from abiotically generated monomers under the conditions posited by the "soup" theory is not straightforward. Besides the necessary basic organic monomers, compounds that would have prohibited the formation of polymers were also formed in high concentration during the Miller–Urey and Joan Oró experiments.[115] Biology uses essentially 20 amino acids for its coded protein enzymes, representing a very small subset of the structurally possible products. Since life tends to use whatever is available, an explanation is needed for why the set used is so small.[116] Formamide is attractive as a medium that potentially provided a source of amino acid derivatives from simple aldehyde and nitrile feedstocks.[117]
Sugars
[edit]
Alexander Butlerov showed in 1861 that the formose reaction created sugars including tetroses, pentoses, and hexoses when formaldehyde is heated under basic conditions with divalent metal ions like calcium. R. Breslow proposed that the reaction was autocatalytic in 1959.[118]
Nucleobases
[edit]Nucleobases, such as guanine and adenine, can be synthesized from simple carbon and nitrogen sources, such as hydrogen cyanide (HCN) and ammonia.[119] Formamide produces all four ribonucleotides when warmed with terrestrial minerals. Formamide is ubiquitous in the Universe, produced by the reaction of water and HCN. It can be concentrated by the evaporation of water.[120][121] HCN is poisonous only to aerobic organisms (eukaryotes and aerobic bacteria), which did not yet exist. It can play roles in other chemical processes such as the synthesis of the amino acid glycine.[60]
DNA and RNA components including uracil, cytosine and thymine can be synthesized under outer space conditions, using starting chemicals such as pyrimidine found in meteorites. Pyrimidine may have been formed in red giant stars or in interstellar dust and gas clouds.[122] All four RNA-bases may be synthesized from formamide in high-energy density events like extraterrestrial impacts.[123]
Other pathways for synthesizing bases from inorganic materials have been reported.[124] Freezing temperatures are advantageous for the synthesis of purines, due to the concentrating effect for key precursors such as hydrogen cyanide.[125] However, while adenine and guanine require freezing conditions for synthesis, cytosine and uracil may require boiling temperatures.[126] Seven amino acids and eleven types of nucleobases formed in ice when ammonia and cyanide were left in a freezer for 25 years.[127][128] S-triazines (alternative nucleobases), pyrimidines including cytosine and uracil, and adenine can be synthesized by subjecting a urea solution to freeze-thaw cycles under a reductive atmosphere, with spark discharges as an energy source.[129] The explanation given for the unusual speed of these reactions at such a low temperature is eutectic freezing, which crowds impurities in microscopic pockets of liquid within the ice, causing the molecules to collide more often.[130]
Peptides
[edit]Prebiotic peptide synthesis is proposed to have occurred through a number of possible routes. Some center on high temperature/concentration conditions in which condensation becomes energetically favorable, while others focus on the availability of plausible prebiotic condensing agents.[131][further explanation needed]
Experimental evidence for the formation of peptides in uniquely concentrated environments is bolstered by work suggesting that wet-dry cycles and the presence of specific salts can greatly increase spontaneous condensation of glycine into poly-glycine chains.[132] Other work suggests that while mineral surfaces, such as those of pyrite, calcite, and rutile catalyze peptide condensation, they also catalyze their hydrolysis. The authors suggest that additional chemical activation or coupling would be necessary to produce peptides at sufficient concentrations. Thus, mineral surface catalysis, while important, is not sufficient alone for peptide synthesis.[133]
Many prebiotically plausible condensing/activating agents have been identified, including the following: cyanamide, dicyanamide, dicyandiamide, diaminomaleonitrile, urea, trimetaphosphate, NaCl, CuCl2, (Ni,Fe)S, CO, carbonyl sulfide (COS), carbon disulfide (CS2), SO2, and diammonium phosphate (DAP).[131]
An experiment reported in 2024 used a saffire substrate with a web of thin cracks under a heat flow, similar to the environment of deep-ocean vents, as a mechanism to separate and concentrate prebiotically relevant building blocks from a dilute mixture, purifying their concentration by up to three orders of magnitude. The authors propose this as a plausible model for the origin of complex biopolymers.[134] This presents another physical process that allows for concentrated peptide precursors to combine in the right conditions. A similar role of increasing amino acid concentration has been suggested for clays as well.[135]
While all of these scenarios involve the condensation of amino acids, the prebiotic synthesis of peptides from simpler molecules such as CO, NH3 and C, skipping the step of amino acid formation, is very efficient.[136][137]
Producing suitable vesicles
[edit]
The largest unanswered question in evolution is how simple protocells first arose and differed in reproductive contribution to the following generation, thus initiating the evolution of life. The lipid world theory postulates that the first self-replicating object was lipid-like.[138][139] Phospholipids form lipid bilayers in water while under agitation—the same structure as in cell membranes. These molecules were not present on early Earth, but other amphiphilic long-chain molecules also form membranes. These bodies may expand by insertion of additional lipids, and may spontaneously split into two offspring of similar size and composition. Lipid bodies may have provided sheltering envelopes for information storage, allowing the evolution and preservation of polymers like RNA that store information. Only one or two types of amphiphiles have been studied which might have led to the development of vesicles.[140] There is an enormous number of possible arrangements of lipid bilayer membranes, and those with the best reproductive characteristics would have converged toward a hypercycle reaction,[141][142] a positive feedback composed of two mutual catalysts represented by a membrane site and a specific compound trapped in the vesicle. Such site/compound pairs are transmissible to the daughter vesicles leading to the emergence of distinct lineages of vesicles, which would have allowed natural selection.[143]
A protocell is a self-organized, self-ordered, spherical collection of lipids proposed as a stepping-stone to the origin of life.[140] A functional protocell has (as of 2014) not yet been achieved in a laboratory setting.[144][145][146] Self-assembled vesicles are essential components of primitive cells.[140] The theory of classical irreversible thermodynamics treats self-assembly under a generalized chemical potential within the framework of dissipative systems.[147][148][149] The second law of thermodynamics requires that overall entropy increases, yet life is distinguished by its great degree of organization. Therefore, a boundary is needed to separate ordered life processes from chaotic non-living matter.[150]
Irene Chen and Jack W. Szostak suggest that elementary protocells can give rise to cellular behaviors including primitive forms of differential reproduction, competition, and energy storage.[145] Competition for membrane molecules would favor stabilized membranes, suggesting a selective advantage for the evolution of cross-linked fatty acids and even the phospholipids of today.[145] Such micro-encapsulation would allow for metabolism within the membrane and the exchange of small molecules, while retaining large biomolecules inside. Such a membrane is needed for a cell to create its own electrochemical gradient to store energy by pumping ions across the membrane.[151][152] Fatty acid vesicles in conditions relevant to alkaline hydrothermal vents can be stabilized by isoprenoids which are synthesized by the formose reaction; the advantages and disadvantages of isoprenoids incorporated within the lipid bilayer in different microenvironments might have led to the divergence of the membranes of archaea and bacteria.[153]
Laboratory experiments have shown that vesicles can undergo an evolutionary process under pressure cycling conditions.[154] Simulating the systemic environment in tectonic fault zones within the Earth's crust, pressure cycling leads to the periodic formation of vesicles.[155] Under the same conditions, random peptide chains are being formed, which are being continuously selected for their ability to integrate into the vesicle membrane. A further selection of the vesicles for their stability potentially leads to the development of functional peptide structures,[156][157][158] associated with an increase in the survival rate of the vesicles.
Producing biology
[edit]Energy and entropy
[edit]Life requires a loss of entropy, or disorder, as molecules organize themselves into living matter. At the same time, the emergence of life is associated with the formation of structures beyond a certain threshold of complexity.[159] The emergence of life with increasing order and complexity does not contradict the second law of thermodynamics, which states that overall entropy never decreases, since a living organism creates order in some places (e.g. its living body) at the expense of an increase of entropy elsewhere (e.g. heat and waste production).[160][161][162]
Multiple sources of energy were available for chemical reactions on the early Earth. Heat from geothermal processes is a standard energy source for chemistry. Other examples include sunlight, lightning,[60] atmospheric entries of micro-meteorites,[163] and implosion of bubbles in sea and ocean waves.[164] This has been confirmed by experiments[165][166] and simulations.[167] Unfavorable reactions can be driven by highly favorable ones, as in the case of iron-sulfur chemistry. For example, this was probably important for carbon fixation.[a] Carbon fixation by reaction of CO2 with H2S via iron-sulfur chemistry is favorable, and occurs at neutral pH and 100 °C. Iron-sulfur surfaces, which are abundant near hydrothermal vents, can drive the production of small amounts of amino acids and other biomolecules.[60]
Chemiosmosis
[edit]
In 1961, Peter Mitchell proposed chemiosmosis as a cell's primary system of energy conversion. The mechanism, now ubiquitous in living cells, powers energy conversion in micro-organisms and in the mitochondria of eukaryotes, making it a likely candidate for early life.[168][169] Mitochondria produce adenosine triphosphate (ATP), the energy currency of the cell used to drive cellular processes such as chemical syntheses. The mechanism of ATP synthesis involves a closed membrane in which the ATP synthase enzyme is embedded. The energy required to release strongly bound ATP has its origin in protons that move across the membrane.[170] In modern cells, those proton movements are caused by the pumping of ions across the membrane, maintaining an electrochemical gradient. In the first organisms, the gradient could have been provided by the difference in chemical composition between the flow from a hydrothermal vent and the surrounding seawater,[152] or perhaps meteoric quinones that were conducive to the development of chemiosmotic energy across lipid membranes if at a terrestrial origin.[171]

The RNA world
[edit]The RNA world hypothesis describes an early Earth with self-replicating and catalytic RNA but no DNA or proteins.[172] Many researchers concur that an RNA world must have preceded the DNA-based life that now dominates.[173] However, RNA-based life may not have been the first to exist.[174][175] Another model echoes Darwin's "warm little pond" with cycles of wetting and drying.[176]
RNA is central to the translation process. Small RNAs can catalyze all the chemical groups and information transfers required for life.[175][177] RNA both expresses and maintains genetic information in modern organisms; and the chemical components of RNA are easily synthesized under the conditions that approximated the early Earth, which were very different from those that prevail today. The structure of the ribosome has been called the "smoking gun", with a central core of RNA and no amino acid side chains within 18 Å of the active site that catalyzes peptide bond formation.[178][174][179]
The concept of the RNA world was proposed in 1962 by Alexander Rich,[180] and the term was coined by Walter Gilbert in 1986.[175][181] There were initial difficulties in the explanation of the abiotic synthesis of the nucleotides cytosine and uracil.[182] Subsequent research has shown possible routes of synthesis; for example, formamide produces all four ribonucleotides and other biological molecules when warmed in the presence of various terrestrial minerals.[120][121]
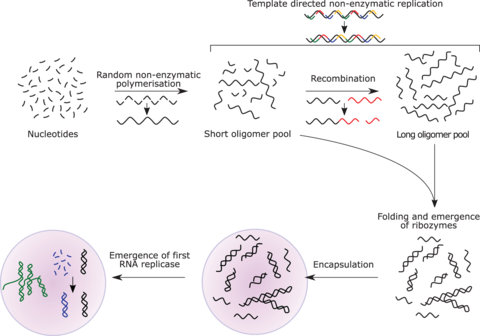
RNA replicase can function as both code and catalyst for further RNA replication, i.e. it can be autocatalytic. Jack Szostak has shown that certain catalytic RNAs can join smaller RNA sequences together, creating the potential for self-replication. The RNA replication systems, which include two ribozymes that catalyze each other's synthesis, showed a doubling time of the product of about one hour, and were subject to natural selection under the experimental conditions.[183][184][174] If such conditions were present on early Earth, then natural selection would favor the proliferation of such autocatalytic sets, to which further functionalities could be added.[185][186][187] Self-assembly of RNA may occur spontaneously in hydrothermal vents.[188][189][190] A preliminary form of tRNA could have assembled into such a replicator molecule.[191]
Possible precursors to protein synthesis include the synthesis of short peptide cofactors or the self-catalysing duplication of RNA. It is likely that the ancestral ribosome was composed entirely of RNA, although some roles have since been taken over by proteins. Major remaining questions on this topic include identifying the selective force for the evolution of the ribosome and determining how the genetic code arose.[192]
Eugene Koonin has argued that "no compelling scenarios currently exist for the origin of replication and translation, the key processes that together comprise the core of biological systems and the apparent pre-requisite of biological evolution. The RNA World concept might offer the best chance for the resolution of this conundrum but so far cannot adequately account for the emergence of an efficient RNA replicase or the translation system."[193]
From RNA to directed protein synthesis
[edit]In line with the RNA world hypothesis, much of modern biology's templated protein biosynthesis is done by RNA molecules—namely tRNAs and the ribosome (consisting of both protein and rRNA components). The most central reaction of peptide bond synthesis is understood to be carried out by base catalysis by the 23S rRNA domain V.[194] Experimental evidence has demonstrated successful di- and tripeptide synthesis with a system consisting of only aminoacyl phosphate adaptors and RNA guides, which could be a possible stepping stone between an RNA world and modern protein synthesis.[194][195] Aminoacylation ribozymes that can charge tRNAs with their cognate amino acids have also been selected in in vitro experimentation.[196] The authors also extensively mapped fitness landscapes within their selection to find that chance emergence of active sequences was more important that sequence optimization.[196]
Early functional peptides
[edit]The first proteins would have had to arise without a fully-fledged system of protein biosynthesis. As discussed above, numerous mechanisms for the prebiotic synthesis of polypeptides exist. However, these random sequence peptides would not have likely had biological function. Thus, significant study has gone into exploring how early functional proteins could have arisen from random sequences. First, some evidence on hydrolysis rates shows that abiotically plausible peptides likely contained significant "nearest-neighbor" biases.[197] This could have had some effect on early protein sequence diversity. In other work by Anthony Keefe and Jack Szostak, mRNA display selection on a library of 6*1012 80-mers was used to search for sequences with ATP binding activity. They concluded that approximately 1 in 1011 random sequences had ATP binding function.[198] While this is a single example of functional frequency in the random sequence space, the methodology can serve as a powerful simulation tool for understanding early protein evolution.[199]
Phylogeny and LUCA
[edit]Starting with the work of Carl Woese from 1977, genomics studies have placed the last universal common ancestor (LUCA) of all modern life-forms between Bacteria and a clade formed by Archaea and Eukaryota in the phylogenetic tree of life. It lived over 4 Gya.[200][201] A minority of studies have placed the LUCA in Bacteria, proposing that Archaea and Eukaryota are evolutionarily derived from within Eubacteria;[202] Thomas Cavalier-Smith suggested in 2006 that the phenotypically diverse bacterial phylum Chloroflexota contained the LUCA.[203]
-
Phylogenetic tree showing the last universal common ancestor (LUCA) at the root. The major clades are the Bacteria on one hand, and the Archaea and Eukaryota on the other.
In 2016, a set of 355 genes likely present in the LUCA was identified. A total of 6.1 million prokaryotic genes from Bacteria and Archaea were sequenced, identifying 355 protein clusters from among 286,514 protein clusters that were probably common to the LUCA. The results suggest that the LUCA was anaerobic with a Wood–Ljungdahl (reductive Acetyl-CoA) pathway, nitrogen- and carbon-fixing, thermophilic. Its cofactors suggest dependence upon an environment rich in hydrogen, carbon dioxide, iron, and transition metals. Its genetic material was probably DNA, requiring the 4-nucleotide genetic code, messenger RNA, transfer RNA, and ribosomes to translate the code into proteins such as enzymes. LUCA likely inhabited an anaerobic hydrothermal vent setting in a geochemically active environment. It was evidently already a complex organism, and must have had precursors; it was not the first living thing.[10][204] The physiology of LUCA has been in dispute.[205][206][207]
-
LUCA systems and environment included the Wood–Ljungdahl pathway.[10]
Leslie Orgel argued that early translation machinery for the genetic code would be susceptible to error catastrophe. Geoffrey Hoffmann however showed that such machinery can be stable in function against "Orgel's paradox".[208][209][210] Metabolic reactions that have also been inferred in LUCA are the incomplete reverse Krebs cycle, gluconeogenesis, the pentose phosphate pathway, glycolysis, reductive amination, and transamination.[211][212]
Suitable geological environments
[edit]A variety of geologic and environmental settings have been proposed for an origin of life. These theories are often in competition with one another as there are many differing views of prebiotic compound availability, geophysical setting, and early life characteristics. The first organism on Earth likely looked different from LUCA. Between the first appearance of life and where all modern phylogenies began branching, an unknown amount of time passed, with unknown gene transfers, extinctions, and evolutionary adaptation to various environmental niches.[213] One major shift is believed to be from the RNA world to an RNA-DNA-protein world. Modern phylogenies provide more pertinent genetic evidence about LUCA than about its precursors.[214]
The most popular hypotheses for settings for the origin of life are deep sea hydrothermal vents and surface bodies of water. Surface waters can be classified into hot springs, moderate temperature lakes and ponds, and cold settings.
Deep sea hydrothermal vents
[edit]Hot fluids
[edit]
Early micro-fossils may have come from a hot world of gases such as methane, ammonia, carbon dioxide, and hydrogen sulfide, toxic to much current life.[215] Analysis of the tree of life places thermophilic and hyperthermophilic bacteria and archaea closest to the root, suggesting that life may have evolved in a hot environment.[216] The deep sea or alkaline hydrothermal vent theory posits that life began at submarine hydrothermal vents.[217][218] William Martin and Michael Russell have suggested "that life evolved in structured iron monosulphide precipitates in a seepage site hydrothermal mound at a redox, pH, and temperature gradient between sulphide-rich hydrothermal fluid and iron(II)-containing waters of the Hadean ocean floor. The naturally arising, three-dimensional compartmentation observed within fossilized seepage-site metal sulphide precipitates indicates that these inorganic compartments were the precursors of cell walls and membranes found in free-living prokaryotes. The known capability of FeS and NiS to catalyze the synthesis of the acetyl-methylsulphide from carbon monoxide and methylsulphide, constituents of hydrothermal fluid, indicates that pre-biotic syntheses occurred at the inner surfaces of these metal-sulphide-walled compartments".[219]
These form where hydrogen-rich fluids emerge from below the sea floor, as a result of serpentinization of ultra-mafic olivine with seawater and a pH interface with carbon dioxide-rich ocean water. The vents form a sustained chemical energy source derived from redox reactions, in which electron donors (molecular hydrogen) react with electron acceptors (carbon dioxide); see iron–sulfur world theory. These are exothermic reactions.[217][b]
Chemiosmotic gradient
[edit]
Russell demonstrated that alkaline vents created an abiogenic proton motive force chemiosmotic gradient,[219] ideal for abiogenesis. Their microscopic compartments "provide a natural means of concentrating organic molecules," composed of iron-sulfur minerals such as mackinawite, endowed these mineral cells with the catalytic properties envisaged by Günter Wächtershäuser.[220] This movement of ions across the membrane depends on a combination of two factors:
- Diffusion force caused by concentration gradient—all particles including ions tend to diffuse from higher concentration to lower.
- Electrostatic force caused by electrical potential gradient—cations like protons H+ tend to diffuse down the electrical potential, anions in the opposite direction.
These two gradients taken together can be expressed as an electrochemical gradient, providing energy for abiogenic synthesis. The proton motive force can be described as the measure of the potential energy stored as a combination of proton and voltage gradients across a membrane (differences in proton concentration and electrical potential).[152]
The surfaces of mineral particles inside deep-ocean hydrothermal vents have catalytic properties similar to those of enzymes and can create simple organic molecules, such as methanol (CH3OH) and formic, acetic, and pyruvic acids out of the dissolved CO2 in the water, if driven by an applied voltage or by reaction with H2 or H2S.[221][222]
The research reported by Martin in 2016 supports the thesis that life arose at hydrothermal vents,[223][224] that spontaneous chemistry in the Earth's crust driven by rock–water interactions at disequilibrium thermodynamically underpinned life's origin[225][226] and that the founding lineages of the archaea and bacteria were H2-dependent autotrophs that used CO2 as their terminal acceptor in energy metabolism.[227] Martin suggests, based upon this evidence, that the LUCA "may have depended heavily on the geothermal energy of the vent to survive".[10] Pores at deep sea hydrothermal vents are suggested to have been occupied by membrane-bound compartments which promoted biochemical reactions.[228][229] Metabolic intermediates in the Krebs cycle, gluconeogenesis, amino acid bio-synthetic pathways, glycolysis, the pentose phosphate pathway, and including sugars like ribose, and lipid precursors can occur non-enzymatically at conditions relevant to deep-sea alkaline hydrothermal vents.[230]
If the deep marine hydrothermal setting was the site for the origin of life, then abiogenesis could have happened as early as 4.0-4.2 Gya. If life evolved in the ocean at depths of more than ten meters, it would have been shielded both from impacts and the then high levels of ultraviolet radiation from the sun. The available energy in hydrothermal vents is maximized at 100–150 °C, the temperatures at which hyperthermophilic bacteria and thermoacidophilic archaea live.[231][232] Arguments against a hydrothermal origin of life state that hyperthermophily was a result of convergent evolution in bacteria and archaea, and that a mesophilic environment would have been more likely.[233][234] This hypothesis, suggested in 1999 by Galtier, was proposed one year before the discovery of the Lost City Hydrothermal Field, where white-smoker hydrothermal vents average ~45-90 °C.[235] Moderate temperatures and alkaline seawater at Lost City are now the favoured hydrothermal vent setting in contrast to acidic, high temperature (~350 °C) black-smokers.
Arguments against a vent setting
[edit]Production of prebiotic organic compounds at hydrothermal vents is estimated to be 1x108 kg yr−1.[236] While a large amount of key prebiotic compounds, such as methane, are found at vents, they are in far lower concentrations than estimates of a Miller-Urey Experiment environment. In the case of methane, the production rate at vents is around 2-4 orders of magnitude lower than predicted amounts in a Miller-Urey Experiment surface atmosphere.[236][237]
Other arguments against an oceanic vent setting for the origin of life include the inability to concentrate prebiotic materials due to strong dilution from seawater. This open-system cycles compounds through minerals that make up vents, leaving little residence time to accumulate.[238] All modern cells rely on phosphates and potassium for nucleotide backbone and protein formation respectively, making it likely that the first life forms also shared these functions. These elements were not available in high quantities in the Archaean oceans as both primarily come from the weathering of continental rocks on land, far from vent settings. Submarine hydrothermal vents are not conducive to condensation reactions needed for polymerisation to form macromolecules.[239][240]
An older argument was that key polymers were encapsulated in vesicles after condensation, which supposedly would not happen in saltwater because of the high concentrations of ions. However, while it is true that salinity inhibits vesicle formation from low-diversity mixtures of fatty acids,[241] vesicle formation from a broader, more realistic mix of fatty-acid and 1-alkanol species is more resilient.[242][241]
Surface bodies of water
[edit]Surface bodies of water provide environments able to dry out and be rewetted. Continued wet-dry cycles allow the concentration of prebiotic compounds and condensation reactions to polymerise macromolecules. Moreover, lake and ponds on land allow for detrital input from the weathering of continental rocks which contain apatite, the most common source of phosphates needed for nucleotide backbones. The amount of exposed continental crust in the Hadean is unknown, but models of early ocean depths and rates of ocean island and continental crust growth make it plausible that there was exposed land.[243] Another line of evidence for a surface start to life is the requirement for UV for organism function. UV is necessary for the formation of the U+C nucleotide base pair by partial hydrolysis and nucleobase loss.[244] Simultaneously, UV can be harmful and sterilising to life, especially for simple early lifeforms with little ability to repair radiation damage. Radiation levels from a young Sun were likely greater, and, with no ozone layer, harmful shortwave UV rays would reach the surface of Earth. For life to begin, a shielded environment with influx from UV-exposed sources is necessary to both benefit and protect from UV. Shielding under ice, liquid water, mineral surfaces (e.g. clay) or regolith is possible in a range of surface water settings. While deep sea vents may have input from raining down of surface exposed materials, the likelihood of concentration is lessened by the ocean's open system.[245]
Hot springs
[edit]Most branching phylogenies are thermophilic or hyperthermophilic, making it possible that the Last universal common ancestor (LUCA) and preceding lifeforms were similarly thermophilic. Hot springs are formed from the heating of groundwater by geothermal activity. This intersection allows for influxes of material from deep penetrating waters and from surface runoff that transports eroded continental sediments. Interconnected groundwater systems create a mechanism for distribution of life to wider area.[246]
Mulkidjanian and co-authors argue that marine environments did not provide the ionic balance and composition universally found in cells, or the ions required by essential proteins and ribozymes, especially with respect to high K+/Na+ ratio, Mn2+, Zn2+ and phosphate concentrations. They argue that the only environments that mimic the needed conditions on Earth are hot springs similar to ones at Kamchatka.[247] Mineral deposits in these environments under an anoxic atmosphere would have suitable pH (while current pools in an oxygenated atmosphere would not), contain precipitates of photocatalytic sulfide minerals that absorb harmful ultraviolet radiation, have wet-dry cycles that concentrate substrate solutions to concentrations amenable to spontaneous formation of biopolymers[248][249] created both by chemical reactions in the hydrothermal environment, and by exposure to UV light during transport from vents to adjacent pools that would promote the formation of biomolecules.[250] The hypothesized pre-biotic environments are similar to hydrothermal vents, with additional components that help explain peculiarities of the LUCA.[247][171]
A phylogenomic and geochemical analysis of proteins plausibly traced to the LUCA shows that the ionic composition of its intracellular fluid is identical to that of hot springs. The LUCA likely was dependent upon synthesized organic matter for its growth.[247] Experiments show that RNA-like polymers can be synthesized in wet-dry cycling and UV light exposure. These polymers were encapsulated in vesicles after condensation.[241] Potential sources of organics at hot springs might have been transport by interplanetary dust particles, extraterrestrial projectiles, or atmospheric or geochemical synthesis. Hot springs could have been abundant in volcanic landmasses during the Hadean.[171]
Temperate surface bodies of water
[edit]A mesophilic start in surface bodies of waters hypothesis has evolved from Darwin's concept of a 'warm little pond' and the Oparin-Haldane hypothesis. Freshwater bodies under temperate climates can accumulate prebiotic materials while providing suitable environmental conditions conducive to simple life forms. The climate during the Archaean is still a highly debated topic, as there is uncertainty about what continents, oceans, and the atmosphere looked like then. Atmospheric reconstructions of the Archaean from geochemical proxies and models state that sufficient greenhouse gases were present to maintain surface temperatures between 0-40 °C. Under this assumption, there is a greater abundance of moderate temperature niches in which life could begin.[251]
Strong lines of evidence for mesophily from biomolecular studies include Galtier's G+C nucleotide thermometer. G+C are more abundant in thermophiles due to the added stability of an additional hydrogen bond not present between A+T nucleotides. rRNA sequencing on a diverse range of modern lifeforms show that LUCA's reconstructed G+C content was likely representative of moderate temperatures.[234]
Although most modern phylogenies are thermophilic or hyperthermophilic, it is possible that their widespread diversity today is a product of convergent evolution and horizontal gene transfer rather than an inherited trait from LUCA.[252] The reverse gyrase topoisomerase is found exclusively in thermophiles and hyperthermophiles as it allows for coiling of DNA.[253] The reverse gyrase enzyme requires ATP to function, both of which are complex biomolecules. If an origin of life is hypothesised to involve a simple organism that had not yet evolved a membrane, let alone ATP, this would make the existence of reverse gyrase improbable. Moreover, phylogenetic studies show that reverse gyrase had an archaeal origin, and that it was transferred to bacteria by horizontal gene transfer. This implies that reverse gyrase was not present in the LUCA.[254]
Icy surface bodies of water
[edit]Cold-start origin of life theories stem from the idea there may have been cold enough regions on the early Earth that large ice cover could be found. Stellar evolution models predict that the Sun's luminosity was ~25% weaker than it is today. Fuelner states that although this significant decrease in solar energy would have formed an icy planet, there is strong evidence for liquid water to be present, possibly driven by a greenhouse effect. This would create an early Earth with both liquid oceans and icy poles.[255]
Ice melts that form from ice sheets or glaciers melts create freshwater pools, another niche capable of experiencing wet-dry cycles. While these pools that exist on the surface would be exposed to intense UV radiation, bodies of water within and under ice are sufficiently shielded while remaining connected to UV exposed areas through ice cracks. Suggestions of impact melting of ice allow freshwater paired with meteoritic input, a popular vessel for prebiotic components.[256] Near-seawater levels of sodium chloride are found to destabilize fatty acid membrane self-assembly, making freshwater settings appealing for early membranous life.[257]
Icy environments would trade the faster reaction rates that occur in warm environments for increased stability and accumulation of larger polymers.[258] Experiments simulating Europa-like conditions of ~20 °C have synthesised amino acids and adenine, showing that Miller-Urey type syntheses can still occur at cold temperatures.[259] In an RNA world, the ribozyme would have had even more functions than in a later DNA-RNA-protein-world. For RNA to function, it must be able to fold, a process that is hindered by temperatures above 30 °C. While RNA folding in psychrophilic organisms is slower, the process is more successful as hydrolysis is also slower. Shorter nucleotides would not suffer from higher temperatures.[260][261]
Inside the continental crust
[edit]An alternative geological environment has been proposed by the geologist Ulrich Schreiber and the physical chemist Christian Mayer: the continental crust.[262] Tectonic fault zones could present a stable and well-protected environment for long-term prebiotic evolution. Inside these systems of cracks and cavities, water and carbon dioxide present the bulk solvents. Their phase state would depend on the local temperature and pressure conditions and could vary between liquid, gaseous and supercritical. When forming two separate phases (e.g., liquid water and supercritical carbon dioxide in depths of little more than 1 km), the system provides optimal conditions for phase transfer reactions. Concurrently, the contents of the tectonic fault zones are being supplied by a multitude of inorganic educts (e.g., carbon monoxide, hydrogen, ammonia, hydrogen cyanide, nitrogen, and even phosphate from dissolved apatite) and simple organic molecules formed by hydrothermal chemistry (e.g. amino acids, long-chain amines, fatty acids, long-chain aldehydes).[263][264] Finally, the abundant mineral surfaces provide a rich choice of catalytic activity.
An especially interesting section of the tectonic fault zones is located at a depth of approximately 1000 m. For the carbon dioxide part of the bulk solvent, it provides temperature and pressure conditions near the phase transition point between the supercritical and the gaseous state. This leads to a natural accumulation zone for lipophilic organic molecules that dissolve well in supercritical CO2, but not in its gaseous state, leading to their local precipitation.[265] Periodic pressure variations such as caused by geyser activity or tidal influences result in periodic phase transitions, keeping the local reaction environment in a constant non-equilibrium state. In presence of amphiphilic compounds (such as the long chain amines and fatty acids mentioned above), subsequent generations of vesicles are being formed[266] that are constantly and efficiently being selected for their stability.[267] The resulting structures could provide hydrothermal vents as well as hot springs with raw material for further development.
Homochirality
[edit]
Homochirality is the geometric uniformity of materials composed of chiral (non-mirror-symmetric) units. Living organisms use molecules that have the same chirality (handedness): with almost no exceptions,[269] amino acids are left-handed while nucleotides and sugars are right-handed. Chiral molecules can be synthesized, but in the absence of a chiral source or a chiral catalyst, they are formed in a 50/50 (racemic) mixture of both forms. Known mechanisms for the production of non-racemic mixtures from racemic starting materials include: asymmetric physical laws, such as the electroweak interaction; asymmetric environments, such as those caused by circularly polarized light, quartz crystals, or the Earth's rotation, statistical fluctuations during racemic synthesis,[268] and spontaneous symmetry breaking.[270][271][272]
Once established, chirality would be selected for.[273] A small bias (enantiomeric excess) in the population can be amplified into a large one by asymmetric autocatalysis, such as in the Soai reaction.[274] In asymmetric autocatalysis, the catalyst is a chiral molecule, which means that a chiral molecule is catalyzing its own production. An initial enantiomeric excess, such as can be produced by polarized light, then allows the more abundant enantiomer to outcompete the other.[275]
Homochirality may have started in outer space, as on the Murchison meteorite the amino acid L-alanine (left-handed) is more than twice as frequent as its D (right-handed) form, and L-glutamic acid is more than three times as abundant as its D counterpart.[276][277] Amino acids from meteorites show a left-handed bias, whereas sugars show a predominantly right-handed bias: this is the same preference found in living organisms, suggesting an abiogenic origin of these compounds.[278]
In a 2010 experiment by Robert Root-Bernstein, "two D-RNA-oligonucleotides having inverse base sequences (D-CGUA and D-AUGC) and their corresponding L-RNA-oligonucleotides (L-CGUA and L-AUGC) were synthesized and their affinity determined for Gly and eleven pairs of L- and D-amino acids". The results suggest that homochirality, including codon directionality, might have "emerged as a function of the origin of the genetic code".[279]
See also
[edit]- Autopoiesis
- Formamide-based prebiotic chemistry – Scientific efforts aimed at reconstructing the beginnings of life
- Proto-metabolism
- GADV-protein world hypothesis – A hypothetical stage of abiogenesis
- Genetic recombination – Production of offspring with combinations of traits that differ from those found in either parent
- Shadow biosphere – Hypothetical biosphere of Earth
- Manganese metallic nodules
Notes
[edit]- ^ The reactions are:
- FeS + H2S → FeS2 + 2H+ + 2e−
- FeS + H2S + CO2 → FeS2 + HCOOH
- ^ The reactions are:
Reaction 1: Fayalite + water → magnetite + aqueous silica + hydrogen- 3Fe2SiO4 + 2H2O → 2Fe3O4 + 3SiO2 + 2H2
- 3Mg2SiO4 + SiO2 + 4H2O → 2Mg3Si2O5(OH)4
- 2Mg2SiO4 + 3H2O → Mg3Si2O5(OH)4 + Mg(OH)2
- 2 Ca2SiO4 + 4 H2O → 3 CaO · 2 SiO2 · 3 H2O + Ca(OH)2
References
[edit]- ^ Jump up to: a b Walker, Sara I.; Packard, N.; Cody, G. D. (13 November 2017). "Re-conceptualizing the origins of life". Philosophical Transactions of the Royal Society A. 375 (2109): 20160337. Bibcode:2017RSPTA.37560337W. doi:10.1098/rsta.2016.0337. PMC 5686397. PMID 29133439.
- ^ Jump up to: a b c "NASA Astrobiology Strategy" (PDF). NASA. 2015. Archived from the original (PDF) on 22 December 2016. Retrieved 24 September 2017.
- ^ Trifonov, Edward N. (17 March 2011). "Vocabulary of Definitions of Life Suggests a Definition". Journal of Biomolecular Structure and Dynamics. 29 (2): 259–266. doi:10.1080/073911011010524992. ISSN 0739-1102. PMID 21875147. S2CID 38476092.
- ^ Voytek, Mary A. (6 March 2021). "About Life Detection". NASA. Archived from the original on 16 August 2021. Retrieved 8 March 2021.
- ^ Jump up to: a b Witzany, Guenther (2016). "Crucial steps to life: From chemical reactions to code using agents" (PDF). BioSystems. 140: 49–57. Bibcode:2016BiSys.140...49W. doi:10.1016/j.biosystems.2015.12.007. PMID 26723230. S2CID 30962295. Archived (PDF) from the original on 31 October 2018. Retrieved 30 October 2018.
- ^ Jump up to: a b Howell, Elizabeth (8 December 2014). "How Did Life Become Complex, And Could It Happen Beyond Earth?". Astrobiology Magazine. Archived from the original on 15 February 2018. Retrieved 14 April 2022.
{{cite web}}: CS1 maint: unfit URL (link) - ^ Oparin, Aleksandr Ivanovich (2003) [1938]. The Origin of Life. Translated by Morgulis, Sergius (2 ed.). Mineola, New York: Courier. ISBN 978-0-486-49522-4. Archived from the original on 2 April 2023. Retrieved 16 June 2018.
- ^ Jump up to: a b Peretó, Juli (2005). "Controversies on the origin of life" (PDF). International Microbiology. 8 (1): 23–31. PMID 15906258. Archived from the original (PDF) on 24 August 2015. Retrieved 1 June 2015.
- ^ Compare: Scharf, Caleb; et al. (18 December 2015). "A Strategy for Origins of Life Research". Astrobiology. 15 (12): 1031–1042. Bibcode:2015AsBio..15.1031S. doi:10.1089/ast.2015.1113. PMC 4683543. PMID 26684503.
What do we mean by the origins of life (OoL)? ... Since the early 20th century the phrase OoL has been used to refer to the events that occurred during the transition from non-living to living systems on Earth, i.e., the origin of terrestrial biology (Oparin, 1924; Haldane, 1929). The term has largely replaced earlier concepts such as abiogenesis (Kamminga, 1980; Fry, 2000).
- ^ Jump up to: a b c d Weiss, M. C.; Sousa, F. L.; Mrnjavac, N.; Neukirchen, S.; Roettger, M.; Nelson-Sathi, S.; Martin, W.F. (2016). "The physiology and habitat of the last universal common ancestor" (PDF). Nature Microbiology. 1 (9): 16116. doi:10.1038/NMICROBIOL.2016.116. PMID 27562259. S2CID 2997255. Archived (PDF) from the original on 29 January 2023. Retrieved 21 September 2022.
- ^ Tirard, Stephane (20 April 2015). "Abiogenesis". Encyclopedia of Astrobiology. p. 1. doi:10.1007/978-3-642-27833-4_2-4. ISBN 978-3-642-27833-4.
Thomas Huxley (1825–1895) used the term abiogenesis in an important text published in 1870. He strictly made the difference between spontaneous generation, which he did not accept, and the possibility of the evolution of matter from inert to living, without any influence of life. ... Since the end of the nineteenth century, evolutive abiogenesis means increasing complexity and evolution of matter from inert to living state in the abiotic context of evolution of primitive Earth.
- ^ Luisi, Pier Luigi (2018). The Emergence of Life: From Chemical Origins to Synthetic Biology. Cambridge University Press. p. 416. ISBN 9781108735506.
However, the turning point of non-life to life has never been put into one experimental set up. There are, of course, several hypotheses, and this plethora of ideas means already that we do not have a convincing one.
- ^ Graham, Robert W. (February 1990). "Extraterrestrial Life in the Universe" (PDF). NASA (NASA Technical Memorandum 102363). Lewis Research Center, Cleveland, Ohio. Archived (PDF) from the original on 3 September 2014. Retrieved 2 June 2015.
- ^ Altermann 2009, p. xvii
- ^ Oparin 1953, p. vi
- ^ Warmflash, David; Warmflash, Benjamin (November 2005). "Did Life Come from Another World?". Scientific American. 293 (5): 64–71. Bibcode:2005SciAm.293e..64W. doi:10.1038/scientificamerican1105-64. PMID 16318028.
- ^ Yarus 2010, p. 47
- ^ Ward, Peter; Kirschvink, Joe (2015). A New History of Life: the radical discoveries about the origins and evolution of life on earth. Bloomsbury Press. pp. 39–40. ISBN 978-1-60819-910-5.
- ^ Sheldon 2005
- ^ Lennox 2001, pp. 229–258
- ^ Jump up to: a b Bernal 1967
- ^ Balme, D. M. (1962). "Development of Biology in Aristotle and Theophrastus: Theory of Spontaneous Generation". Phronesis. 7 (1–2): 91–104. doi:10.1163/156852862X00052.
- ^ Ross 1652
- ^ Dobell 1960
- ^ Bondeson 1999
- ^ Levine, R.; Evers, C. "The Slow Death of Spontaneous Generation (1668-1859)". Archived from the original on 26 April 2008. Retrieved 18 April 2013.
- ^ Oparin 1953, p. 196
- ^ Tyndall 1905, IV, XII (1876), XIII (1878)
- ^ Horneck, Gerda; Klaus, David M.; Mancinelli, Rocco L. (March 2010). "Space Microbiology". Microbiology and Molecular Biology Reviews. 74 (1): 121–156. Bibcode:2010MMBR...74..121H. doi:10.1128/MMBR.00016-09. PMC 2832349. PMID 20197502.
- ^ Wickramasinghe, Chandra (2011). "Bacterial morphologies supporting cometary panspermia: a reappraisal". International Journal of Astrobiology. 10 (1): 25–30. Bibcode:2011IJAsB..10...25W. CiteSeerX 10.1.1.368.4449. doi:10.1017/S1473550410000157. S2CID 7262449.
- ^ Rampelotto, P. H. (2010). "Panspermia: A promising field of research". In: Astrobiology Science Conference. Abs 5224.
- ^ Chang, Kenneth (12 September 2016). "Visions of Life on Mars in Earth's Depths". The New York Times. Archived from the original on 12 September 2016. Retrieved 12 September 2016.
- ^ Aguilera Mochón, Juan Antonio (2016). El origen de la vida en la tierra [The origin of life on Earth] (in Spanish). Spain: RBA. ISBN 978-84-473-8386-3.
- ^ "Letter no. 7471, Charles Darwin to Joseph Dalton Hooker, 1 February (1871)". Darwin Correspondence Project. Archived from the original on 7 July 2020. Retrieved 7 July 2020.
- ^ Priscu, John C. "Origin and Evolution of Life on a Frozen Earth". Arlington County, Virginia: National Science Foundation. Archived from the original on 18 December 2013. Retrieved 1 March 2014.
- ^ Marshall, Michael (11 November 2020). "Charles Darwin's hunch about early life was probably right". BBC News. Archived from the original on 11 November 2020. Retrieved 11 November 2020.
- ^ Bahadur, Krishna (1973). "Photochemical Formation of Self–sustaining Coacervates" (PDF). Proceedings of the Indian National Science Academy. 39 (4): 455–467. doi:10.1016/S0044-4057(75)80076-1. PMID 1242552. Archived from the original (PDF) on 19 October 2013.
- ^ Bahadur, Krishna (1975). "Photochemical Formation of Self-Sustaining Coacervates". Zentralblatt für Bakteriologie, Parasitenkunde, Infektionskrankheiten und Hygiene (Central Journal for Bacteriology, Parasitology, Infectious Diseases and Hygiene). 130 (3): 211–218. doi:10.1016/S0044-4057(75)80076-1. OCLC 641018092. PMID 1242552. Archived from the original on 13 December 2022. Retrieved 13 December 2022.
- ^ Bryson 2004, pp. 300–302
- ^ Bernal 1951
- ^ Martin, William F. (January 2003). "On the origins of cells: a hypothesis for the evolutionary transitions from abiotic geochemistry to chemoautotrophic prokaryotes, and from prokaryotes to nucleated cells". Phil. Trans. R. Soc. Lond. A. 358 (1429): 59–83. doi:10.1098/rstb.2002.1183. PMC 1693102. PMID 12594918.
- ^ Bernal, John Desmond (September 1949). "The Physical Basis of Life". Proceedings of the Physical Society, Section A. 62 (9): 537–558. Bibcode:1949PPSA...62..537B. doi:10.1088/0370-1298/62/9/301. S2CID 83754271.
- ^ Miller, Stanley L. (15 May 1953). "A Production of Amino Acids Under Possible Primitive Earth Conditions". Science. 117 (3046): 528–529. Bibcode:1953Sci...117..528M. doi:10.1126/science.117.3046.528. PMID 13056598.
- ^ Parker, Eric T.; Cleaves, Henderson J.; Dworkin, Jason P.; et al. (5 April 2011). "Primordial synthesis of amines and amino acids in a 1958 Miller H2S-rich spark discharge experiment". PNAS. 108 (14): 5526–5531. Bibcode:2011PNAS..108.5526P. doi:10.1073/pnas.1019191108. PMC 3078417. PMID 21422282.
- ^ Bernal 1967, p. 143
- ^ Jump up to: a b Cleaves, H. James; Chalmers, John H.; Lazcano, Antonio; et al. (April 2008). "A Reassessment of Prebiotic Organic Synthesis in Neutral Planetary Atmospheres". Origins of Life and Evolution of Biospheres. 38 (2): 105–115. Bibcode:2008OLEB...38..105C. doi:10.1007/s11084-007-9120-3. PMID 18204914. S2CID 7731172.
- ^ Chyba, Christopher F. (13 May 2005). "Rethinking Earth's Early Atmosphere". Science. 308 (5724): 962–963. doi:10.1126/science.1113157. PMID 15890865. S2CID 93303848.
- ^ Barton et al. 2007, pp. 93–95
- ^ Bada & Lazcano 2009, pp. 56–57
- ^ Bada, Jeffrey L.; Lazcano, Antonio (2 May 2003). "Prebiotic Soup – Revisiting the Miller Experiment" (PDF). Science. 300 (5620): 745–746. doi:10.1126/science.1085145. PMID 12730584. S2CID 93020326. Archived (PDF) from the original on 4 March 2016. Retrieved 13 June 2015.
- ^ Madau, Piero; Dickinson, Mark (18 August 2014). "Cosmic Star-Formation History". Annual Review of Astronomy and Astrophysics. 52 (1): 415–486. arXiv:1403.0007. Bibcode:2014ARA&A..52..415M. doi:10.1146/annurev-astro-081811-125615. S2CID 658354. Archived from the original on 1 July 2022. Retrieved 8 December 2023.
- ^ Marigo, Paola; et al. (6 July 2020). "Carbon star formation as seen through the non-monotonic initial–final mass relation". Nature Astronomy. 152 (11): 1102–1110. arXiv:2007.04163. Bibcode:2020NatAs...4.1102M. doi:10.1038/s41550-020-1132-1. S2CID 220403402. Archived from the original on 16 February 2023. Retrieved 7 July 2020.
- ^ "WMAP- Life in the Universe". Archived from the original on 29 January 2023. Retrieved 27 September 2019.
- ^ "Formation of Solar Systems: Solar Nebular Theory". University of Massachusetts Amherst. Archived from the original on 27 September 2019. Retrieved 27 September 2019.
- ^ "Age of the Earth". United States Geological Survey. 9 July 2007. Archived from the original on 23 December 2005. Retrieved 10 January 2006.
- ^ Dalrymple 2001, pp. 205–221
- ^ Fesenkov 1959, p. 9
- ^ Bottke, W. F.; Vokrouhlický, D.; Marchi, S.; Swindle, T.; Scott, E. R. D.; Weirich, J. R.; Levison, H. (17 April 2015). "Dating the Moon-forming impact event with asteroidal meteorites". Science. 348 (6232): 321–323. Bibcode:2015Sci...348..321B. doi:10.1126/science.aaa0602. PMID 25883354. S2CID 206632612.
- ^ Kasting, James F. (12 February 1993). "Earth's Early Atmosphere" (PDF). Science. 259 (5097): 920–926. Bibcode:1993Sci...259..920K. doi:10.1126/science.11536547. PMID 11536547. S2CID 21134564. Archived from the original (PDF) on 10 October 2015. Retrieved 28 July 2015.
- ^ Jump up to: a b c d e f Follmann, Hartmut; Brownson, Carol (November 2009). "Darwin's warm little pond revisited: from molecules to the origin of life". Naturwissenschaften. 96 (11): 1265–1292. Bibcode:2009NW.....96.1265F. doi:10.1007/s00114-009-0602-1. PMID 19760276. S2CID 23259886.
- ^ Morse, John (September 1998). "Hadean Ocean Carbonate Geochemistry". Aquatic Geochemistry. 4 (3/4): 301–319. Bibcode:1998MinM...62.1027M. doi:10.1023/A:1009632230875. S2CID 129616933.
- ^ Sleep, Norman H.; Zahnle, Kevin J.; Lupu, Roxana E. (13 September 2014). "Terrestrial aftermath of the Moon-forming impact". Philosophical Transactions of the Royal Society A: Mathematical, Physical and Engineering Sciences. 372 (2024): 20130172. Bibcode:2014RSPTA.37230172S. doi:10.1098/rsta.2013.0172. PMID 25114303. S2CID 6902632.
- ^ Morse, John W.; Mackenzie, Fred T. (1998). "[No title found]". Aquatic Geochemistry. 4 (3/4): 301–319. doi:10.1023/A:1009632230875. S2CID 129616933. Archived from the original on 31 January 2024. Retrieved 8 December 2023.
- ^ Crowley, James L.; Myers, John S.; Sylvester, Paul J; Cox, Richard A. (May 2005). "Detrital Zircon from the Jack Hills and Mount Narryer, Western Australia: Evidence for Diverse >4.0 Ga Source Rocks". The Journal of Geology. 113 (3): 239–263. Bibcode:2005JG....113..239C. doi:10.1086/428804. S2CID 140715676. Archived from the original on 16 December 2023. Retrieved 8 December 2023.
- ^ Wilde, Simon A.; Valley, John W.; Peck, William H.; Graham, Colin M. (11 January 2001). "Evidence from detrital zircons for the existence of continental crust and oceans on the Earth 4.4 Gyr ago" (PDF). Nature. 409 (6817): 175–178. Bibcode:2001Natur.409..175W. doi:10.1038/35051550. PMID 11196637. S2CID 4319774. Archived (PDF) from the original on 5 June 2015. Retrieved 3 June 2015.
- ^ Korenaga, Jun (December 2008). "Plate tectonics, flood basalts and the evolution of Earth's oceans". Terra Nova. 20 (6): 419–439. Bibcode:2008TeNov..20..419K. doi:10.1111/j.1365-3121.2008.00843.x. S2CID 36766331.
- ^ Rosing, Minik T.; Bird, Dennis K.; Sleep, Norman H.; et al. (22 March 2006). "The rise of continents – An essay on the geologic consequences of photosynthesis". Palaeogeography, Palaeoclimatology, Palaeoecology. 232 (2–4): 99–113. Bibcode:2006PPP...232...99R. doi:10.1016/j.palaeo.2006.01.007. Archived (PDF) from the original on 14 July 2015. Retrieved 8 June 2015.
- ^ Tera, Fouad; Papanastassiou, D.A.; Wasserburg, G.J. (April 1974). "Isotopic evidence for a terminal lunar cataclysm". Earth and Planetary Science Letters. 22 (1): 1–21. Bibcode:1974E&PSL..22....1T. doi:10.1016/0012-821x(74)90059-4. Archived from the original on 31 January 2024. Retrieved 8 December 2023.
- ^ Stoffler, D. (1 January 2006). "Cratering History and Lunar Chronology". Reviews in Mineralogy and Geochemistry. 60 (1): 519–596. Bibcode:2006RvMG...60..519S. doi:10.2138/rmg.2006.60.05. Archived from the original on 31 January 2024. Retrieved 8 December 2023.
- ^ Sleep, Norman H.; Zahnle, Kevin J.; Kasting, James F.; Morowitz, Harold J. (December 1989). "Annihilation of ecosystems by large asteroid impacts on the early Earth". Nature. 342 (6246): 139–142. Bibcode:1989Natur.342..139S. doi:10.1038/342139a0. PMID 11536616. S2CID 1137852. Archived from the original on 31 January 2024. Retrieved 8 December 2023.
- ^ Fassett, Caleb I.; Minton, David A. (23 June 2013). "Impact bombardment of the terrestrial planets and the early history of the Solar System". Nature Geoscience. 6 (7): 520–524. Bibcode:2013NatGe...6..520F. doi:10.1038/ngeo1841. Archived from the original on 31 January 2024. Retrieved 8 December 2023.
- ^ Abramov, Oleg; Mojzsis, Stephen J. (May 2009). "Microbial habitability of the Hadean Earth during the late heavy bombardment". Nature. 459 (7245): 419–422. Bibcode:2009Natur.459..419A. doi:10.1038/nature08015. PMID 19458721. S2CID 3304147. Archived from the original on 31 January 2024. Retrieved 8 December 2023.
- ^ Бенке, Патрик; Харрисон, Т. Марк (12 сентября 2016 г.). «Иллюзорные поздние тяжелые бомбардировки» . Труды Национальной академии наук . 113 (39): 10802–10806. Бибкод : 2016PNAS..11310802B . дои : 10.1073/pnas.1611535113 . ПМК 5047187 . ПМИД 27621460 .
- ^ Зеллнер, Николь Э.Б. (3 мая 2017 г.). «Катаклизма больше нет: новые взгляды на время и доставку лунных ударников» . Происхождение жизни и эволюция биосфер . 47 (3): 261–280. arXiv : 1704.06694 . Бибкод : 2017OLEB...47..261Z . дои : 10.1007/s11084-017-9536-3 . ПМК 5602003 . ПМИД 28470374 . Архивировано из оригинала 31 января 2024 года . Проверено 8 декабря 2023 г.
- ^ Лоу, Дональд Р.; Байерли, Гэри Р. (1 апреля 2018 г.). «Земные записи поздней тяжелой бомбардировки» . Новые обзоры астрономии . 81 : 39–61. Бибкод : 2018НовыйAR..81...39L . дои : 10.1016/j.newar.2018.03.002 .
- ^ Дэвис 1999 , с. 155
- ^ Бок и Гуд 1996
- ^ Jump up to: а б Додд, Мэтью С.; Папино, Доминик; Гренне, Тор; и др. (1 марта 2017 г.). «Доказательства ранней жизни в старейших гидротермальных источниках Земли выпадают» . Природа . 543 (7643): 60–64. Бибкод : 2017Natur.543...60D . дои : 10.1038/nature21377 . ПМИД 28252057 . Архивировано из оригинала 8 сентября 2017 года . Проверено 2 марта 2017 г.
- ^ Отомо, Йоко; Какегава, Такеши; Исида, Акизуми; и др. (январь 2014 г.). «Доказательства наличия биогенного графита в метаосадочных породах раннего архейского периода Иисуса». Природа Геонауки . 7 (1): 25–28. Бибкод : 2014NatGe...7... 25O дои : 10.1038/ngeo2025 .
- ^ Ноффке, Нора ; Кристиан, Дэниел; Уэйси, Дэвид; Хейзен, Роберт М. (16 ноября 2013 г.). «Микробно-индуцированные осадочные структуры, фиксирующие древнюю экосистему в возраст около формации Гё Дрессер, Пилбара, Западная Австралия, 3,48 года» . Астробиология . 13 (12): 1103–1124. Бибкод : 2013AsBio..13.1103N . дои : 10.1089/ast.2013.1030 . ПМК 3870916 . ПМИД 24205812 .
- ^ Дэвис 1999
- ^ Хасенкам, Т.; Андерссон, член парламента; Далби, КНЦ; Маккензи, DMA; Розинг, Монтана (2017). «Элементы эоархейской жизни, заключенные в минеральных включениях». Природа . 548 (7665): 78–81. Бибкод : 2017Natur.548...78H . дои : 10.1038/nature23261 . ПМИД 28738409 . S2CID 205257931 .
- ^ О'Донохью, Джеймс (21 августа 2011 г.). «Самые старые достоверные окаменелости показывают, что ранняя жизнь была на пляже» . Новый учёный . 211 : 13. дои : 10.1016/S0262-4079(11)62064-2 . Архивировано из оригинала 30 июня 2015 года.
- ^ Уэйси, Дэвид; Килберн, Мэтт Р.; Сондерс, Мартин; и др. (октябрь 2011 г.). «Микроокаменелости клеток, метаболизирующих серу, в породах Западной Австралии возрастом 3,4 миллиарда лет». Природа Геонауки . 4 (10): 698–702. Бибкод : 2011NatGe...4..698W . дои : 10.1038/ngeo1238 .
- ^ Белл, Элизабет А.; Бенке, Патрик; Харрисон, Т. Марк; Мао, Венди Л. (24 ноября 2015 г.). «Потенциально биогенный углерод сохранился в цирконе возрастом 4,1 миллиарда лет» . Труды Национальной академии наук . 112 (47): 14518–14521. Бибкод : 2015PNAS..11214518B . дои : 10.1073/pnas.1517557112 . ПМЦ 4664351 . ПМИД 26483481 .
- ^ Баумгартнер, Рафаэль; Ван Кранендонк, Мартин; Уэйси, Дэвид; и др. (2019). «Нанопористый пирит и органическое вещество в строматолитах возрастом 3,5 миллиарда лет свидетельствуют о первозданной жизни» (PDF) . Геология . 47 (11): 1039–1043. Бибкод : 2019Geo....47.1039B . дои : 10.1130/G46365.1 . S2CID 204258554 . Архивировано (PDF) из оригинала 5 декабря 2020 года . Проверено 10 января 2021 г.
- ^ Джокич, Тара; Ван Кранендонк, Мартин Дж.; Кэмпбелл, Кэтлин А.; Уолтер, Малкольм Р.; Уорд, Колин Р. (9 мая 2017 г.). «Самые ранние признаки жизни на суше сохранились в отложениях горячих источников примерно 3,5 Гао» . Природные коммуникации . 8 : 15263. Бибкод : 2017NatCo...815263D . дои : 10.1038/ncomms15263 . ПМК 5436104 . ПМИД 28486437 .
- ^ Беттс, Холли С.; Путтик, Марк Н.; Кларк, Джеймс В.; Уильямс, Том А.; Донохью, Филип CJ; Пизани, Давиде (20 августа 2018 г.). «Комплексные геномные и ископаемые данные проливают свет на раннюю эволюцию жизни и происхождение эукариот» . Экология и эволюция природы . 2 (10): 1556–1562. Бибкод : 2018NatEE...2.1556B . дои : 10.1038/s41559-018-0644-x . ПМК 6152910 . ПМИД 30127539 .
- ^ Ландау, Элизабет (12 октября 2016 г.). «Строительные блоки жизни» исходят из звездного света . НАСА . Архивировано из оригинала 13 октября 2016 года . Проверено 13 октября 2016 г.
- ^ Jump up to: а б Эренфройнд, Паскаль; Ками, Ян (декабрь 2010 г.). «Космическая химия углерода: от межзвездной среды до ранней Земли» . Перспективы Колд-Спринг-Харбор в биологии . 2 (12): а002097. doi : 10.1101/cshperspect.a002097 . ПМЦ 2982172 . ПМИД 20554702 .
- ^ Гебалле, Томас Р.; Нахарро, Франциско; Файгер, Дональд Ф .; и др. (10 ноября 2011 г.). «Инфракрасные диффузные межзвездные полосы в районе центра Галактики». Природа . 479 (7372): 200–202. arXiv : 1111.0613 . Бибкод : 2011Natur.479..200G . дои : 10.1038/nature10527 . ПМИД 22048316 . S2CID 17223339 .
- ^ Клайце 2001
- ^ Jump up to: а б с д Гувер, Рэйчел (21 февраля 2014 г.). «Нужно отслеживать органические наночастицы по всей Вселенной? У НАСА есть для этого приложение» . Исследовательский центр Эймса . НАСА . Архивировано из оригинала 6 сентября 2015 года . Проверено 22 июня 2015 г.
- ^ Гончарук Владислав В.; Зуй, О.В. (февраль 2015 г.). «Вода и углекислый газ как основные предшественники органического вещества на Земле и в космосе». Журнал химии воды и технологий . 37 (1): 2–3. Бибкод : 2015JWCT...37....2G . дои : 10.3103/S1063455X15010026 . S2CID 97965067 .
- ^ Абу Мрад, Нинетт; Виноградов, Василиса; Дюверне, Фабрис; и др. (2015). «Лабораторное экспериментальное моделирование: химическая эволюция органического вещества из аналогов межзвездного и кометного льда» . Бюллетень Королевского общества наук Льежа . 84 : 21–32. Бибкод : 2015BSRSL..84...21A . Архивировано из оригинала 13 апреля 2015 года . Проверено 6 апреля 2015 г.
- ^ Оба, Ясухиро; и др. (26 апреля 2022 г.). «Идентификация широкого разнообразия внеземных пуриновых и пиримидиновых азотистых оснований в углеродистых метеоритах» . Природные коммуникации . 13 (2008): 2008. Бибкод : 2022NatCo..13.2008O . дои : 10.1038/s41467-022-29612-x . ПМЦ 9042847 . ПМИД 35473908 . S2CID 248402205 .
- ^ « В комете обнаружен «химикат жизни»» . Новости Би-би-си . Лондон. 18 августа 2009 года. Архивировано из оригинала 25 мая 2015 года . Проверено 23 июня 2015 г.
- ^ Томпсон, Уильям Рид; Мюррей, Б.Г.; Кхаре, Бишун Нараин ; Саган, Карл (30 декабря 1987 г.). «Окраска и потемнение клатрата метана и других льдов в результате облучения заряженными частицами: применение во внешней солнечной системе». Журнал геофизических исследований . 92 (А13): 14933–14947. Бибкод : 1987JGR....9214933T . дои : 10.1029/JA092iA13p14933 . ПМИД 11542127 .
- ^ Гольдман, Нир; Тэмблин, Исаак (20 июня 2013 г.). «Химия пребиотиков в простой ледяной смеси» . Журнал физической химии А. 117 (24): 5124–5131. Бибкод : 2013JPCA..117.5124G . дои : 10.1021/jp402976n . ПМИД 23639050 . S2CID 5144843 . Архивировано из оригинала 21 июля 2018 года . Проверено 29 августа 2019 г.
- ^ «База данных ИК-спектроскопии НАСА Эймса PAH» . НАСА. Архивировано из оригинала 29 июня 2015 года . Проверено 17 июня 2015 г.
- ^ Jump up to: а б с Хаджинс, Дуглас М.; Баушлихер, Чарльз В. младший; Аламандола, Луи Дж. (10 октября 2005 г.). «Вариации положения пика особенности межзвездного излучения 6,2 мкм: индикатор N в межзвездной популяции полициклических ароматических углеводородов». Астрофизический журнал . 632 (1): 316–332. Бибкод : 2005ApJ...632..316H . CiteSeerX 10.1.1.218.8786 . дои : 10.1086/432495 . S2CID 7808613 .
- ^ Jump up to: а б с Де Марэ, Дэвид Дж.; Аламандола, Луи Дж.; Сэндфорд, Скотт ; и др. (2009). «Космическое распределение химической сложности» . Исследовательский центр Эймса . Маунтин-Вью, Калифорния: НАСА. Архивировано из оригинала 27 февраля 2014 года . Проверено 24 июня 2015 г.
- ^ Jump up to: а б Кэри, Бьорн (18 октября 2005 г.). «Строительные блоки жизни «в изобилии в космосе» » . Space.com . Уотсонвилл, Калифорния: Имагинова . Архивировано из оригинала 26 июня 2015 года . Проверено 23 июня 2015 г.
- ^ Гарсия-Эрнандес, воскресенье. А.; В пятнах, Артур; Гарсиа-Ларио, Питер; и др. (20 ноября 2010 г.). «Образование фуллеренов в H-содержащих планетарных туманностях». Письма астрофизического журнала . 724 (1):L39–L43. arXiv : 1009.4357 . Бибкод : 2010ApJ...724L..39G . дои : 10.1088/2041-8205/724/1/L39 . S2CID 119121764 .
- ^ д'Искья, Марко; Манини, Паола; Мораччи, Марко; и др. (21 августа 2019 г.). «Астрохимия и астробиология: материаловедение в стране чудес?» . Международный журнал молекулярных наук . 20 (17): 4079. doi : 10.3390/ijms20174079 . ПМК 6747172 . ПМИД 31438518 .
- ^ Гудипати, Мурти С.; Ян, Жуй (1 сентября 2012 г.). «Изучение на месте радиационно-индуцированной обработки органических веществ в астрофизических аналогах льда - новые времяпролетные масс-спектроскопические исследования с лазерной десорбцией и лазерной ионизацией». Письма астрофизического журнала . 756 (1): Л24. Бибкод : 2012ApJ...756L..24G . дои : 10.1088/2041-8205/756/1/L24 . S2CID 5541727 .
- ^ Jump up to: а б Галлори, Энцо (июнь 2011 г.). «Астрохимия и происхождение генетического материала». Линцианские счета . 22 (2): 113–118. дои : 10.1007/s12210-011-0118-4 . S2CID 96659714 . «Доклад, представленный на симпозиуме «Астрохимия: молекулы в пространстве и времени» (Рим, 4–5 ноября 2010 г.), спонсируемом Фондом «Гвидо Донегани», Национальной академией Линчеи».
- ^ Мартинс, Зита (февраль 2011 г.). «Органическая химия углеродистых метеоритов». Элементы . 7 (1): 35–40. Бибкод : 2011Элеме...7...35М . дои : 10.2113/gselements.7.1.35 .
- ^ Мартинс, Зита; Ботта, Оливер; Фогель, Мэрилин Л.; и др. (15 июня 2008 г.). «Внеземные азотистые основания в метеорите Мерчисон». Письма о Земле и планетологии . 270 (1–2): 130–136. arXiv : 0806.2286 . Бибкод : 2008E&PSL.270..130M . дои : 10.1016/j.epsl.2008.03.026 . S2CID 14309508 .
- ^ Каллахан, Майкл П.; Смит, Карен Э.; Кливс, Х. Джеймс II; и др. (23 августа 2011 г.). «Углеродистые метеориты содержат широкий спектр внеземных азотистых оснований» . ПНАС . 108 (34): 13995–13998. Бибкод : 2011PNAS..10813995C . дои : 10.1073/pnas.1106493108 . ПМК 3161613 . ПМИД 21836052 .
- ^ Штайгервальд, Джон (8 августа 2011 г.). «Исследователи НАСА: строительные блоки ДНК можно создавать в космосе» . Центр космических полетов Годдарда . НАСА. Архивировано из оригинала 23 июня 2015 года . Проверено 23 июня 2015 г.
- ^ Квок, Вс ; Чжан, Юн (3 ноября 2011 г.). «Смешанные ароматико-алифатические органические наночастицы как носители неидентифицированных свойств инфракрасного излучения». Природа . 479 (7371): 80–83. Бибкод : 2011Природа.479...80К . дои : 10.1038/nature10542 . ПМИД 22031328 . S2CID 4419859 .
- ^ Йоргенсен, Джес К.; Фавр, Сесиль; Бишоп, Сюзанна Э.; и др. (2012). «Обнаружение простейшего сахара, гликоляльдегида, в протозвезде солнечного типа с ALMA» (PDF) . Письма астрофизического журнала . 757 (1): Л4. arXiv : 1208.5498 . Бибкод : 2012ApJ...757L...4J . дои : 10.1088/2041-8205/757/1/L4 . S2CID 14205612 . Архивировано (PDF) из оригинала 24 сентября 2015 г. Проверено 23 июня 2015 г.
- ^ Фурукава, Ёсихиро; Чикараиси, Ёсито; Окоучи, Наахико; и др. (13 ноября 2019 г.). «Внеземные рибоза и другие сахара в примитивных метеоритах» . ПНАС . 116 (49): 24440–24445. Бибкод : 2019PNAS..11624440F . дои : 10.1073/pnas.1907169116 . ПМК 6900709 . ПМИД 31740594 .
- ^ Оро, Джоан; Кимбалл, Обри П. (февраль 1962 г.). «Синтез пуринов в возможных примитивных земных условиях: II. Пуриновые полупродукты из цианида водорода». Архив биохимии и биофизики . 96 (2): 293–313. дои : 10.1016/0003-9861(62)90412-5 . ПМИД 14482339 .
- ^ Кливс II, Хендерсон (2010). «Происхождение биологически кодируемых аминокислот». Журнал теоретической биологии . 263 (4): 490–498. Бибкод : 2010JThBi.263..490C . дои : 10.1016/j.jtbi.2009.12.014 . ПМИД 20034500 .
- ^ Грин, Нью-Джерси, Рассел, Д.А., Таннер, С.Х., Сазерленд, Дж.Д. (2023). «Пребиотический синтез N-формиламинонитрилов и их производных в формамиде» . Журнал Американского химического общества . 145 (19): 10533–10541. дои : 10.1021/jacs.2c13306 . ПМЦ 10197134 . ПМИД 37146260 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Бреслоу, Р. (1959). «О механизме формозной реакции». Буквы тетраэдра . 1 (21): 22–26. дои : 10.1016/S0040-4039(01)99487-0 .
- ^ Оро, Жоан (16 сентября 1961 г.). «Механизм синтеза аденина из циановодорода в возможных условиях примитивной Земли». Природа . 191 (4794): 1193–1194. Бибкод : 1961Natur.191.1193O . дои : 10.1038/1911193a0 . ПМИД 13731264 . S2CID 4276712 .
- ^ Jump up to: а б Саладино, Рафаэле; Крестини, Клаудия; Пино, Саманта; и др. (март 2012 г.). «Формамид и происхождение жизни» (PDF) . Обзоры физики жизни . 9 (1): 84–104. Бибкод : 2012PhLRv...9...84S . дои : 10.1016/j.plrev.2011.12.002 . hdl : 2108/85168 . ПМИД 22196896 . Архивировано (PDF) из оригинала 27 января 2023 года . Проверено 29 августа 2019 г.
- ^ Jump up to: а б Саладино, Рафаэле; Ботта, Джорджия; Пино, Саманта; и др. (июль 2012 г.). «От одноуглеродного амид-формамида до РНК все этапы возможны с пребиотической точки зрения». Биохимия . 94 (7): 1451–1456. дои : 10.1016/j.biochi.2012.02.018 . hdl : 11573/515604 . ПМИД 22738728 .
- ^ Марлер, Рут, изд. (3 марта 2015 г.). «НАСА Эймс воспроизводит строительные блоки жизни в лаборатории» . Исследовательский центр Эймса . НАСА. Архивировано из оригинала 5 марта 2015 года . Проверено 5 марта 2015 г.
- ^ Ферус, Мартин; Несворный, Давид; Шпонер, Иржи; и др. (2015). «Химия высоких энергий формамида: единый механизм образования нуклеиновых оснований» . ПНАС . 112 (3): 657–662. Бибкод : 2015PNAS..112..657F . дои : 10.1073/pnas.1412072111 . ПМЦ 4311869 . ПМИД 25489115 .
- ^ Базиль, Бренда; Ласкано, Антонио ; Оро, Джоан (1984). «Пребиотические синтезы пуринов и пиримидинов». Достижения в космических исследованиях . 4 (12): 125–131. Бибкод : 1984АдСпР...4л.125Б . дои : 10.1016/0273-1177(84)90554-4 . ПМИД 11537766 .
- ^ Оргел, Лесли Э. (август 2004 г.). «Возвращение к пребиотику аденину: эвтектика и фотохимия». Происхождение жизни и эволюция биосфер . 34 (4): 361–369. Бибкод : 2004OLEB...34..361O . doi : 10.1023/B:ORIG.0000029882.52156.c2 . ПМИД 15279171 . S2CID 4998122 .
- ^ Робертсон, Майкл П.; Миллер, Стэнли Л. (29 июня 1995 г.). «Эффективный пребиотический синтез цитозина и урацила». Природа . 375 (6534): 772–774. Бибкод : 1995Natur.375..772R . дои : 10.1038/375772a0 . ПМИД 7596408 . S2CID 4351012 .
- ^ Фокс, Дуглас (1 февраля 2008 г.). «Развилась ли жизнь во льду?» . Обнаружить . Архивировано из оригинала 30 июня 2008 года . Проверено 3 июля 2008 г.
- ^ Леви, Мэтью; Миллер, Стэнли Л.; Бринтон, Карен; Бада, Джеффри Л. (июнь 2000 г.). «Пребиотический синтез аденина и аминокислот в условиях Европы». Икар . 145 (2): 609–613. Бибкод : 2000Icar..145..609L . дои : 10.1006/icar.2000.6365 . ПМИД 11543508 .
- ^ Менор-Сальван, Сезар; Руис-Бермехо, Марта; Гусман, Марсело И.; и др. (20 апреля 2009 г.). «Синтез пиримидинов и триазинов во льду: значение для пребиотической химии азотистых оснований». Химия: Европейский журнал . 15 (17): 4411–4418. дои : 10.1002/chem.200802656 . ПМИД 19288488 .
- ^ Рой, Деджани; Наджафян, Катаюн; фон Раге Шлейер, Пол (30 октября 2007 г.). «Химическая эволюция: Механизм образования аденина в пребиотических условиях» . ПНАС . 104 (44): 17272–17277. Бибкод : 2007PNAS..10417272R . дои : 10.1073/pnas.0708434104 . ПМК 2077245 . ПМИД 17951429 .
- ^ Jump up to: а б Френкель-Пинтер, Моран; Саманта, Моусуми; Ашкенаси, Гонен; Леман, Люк Дж. (10 июня 2020 г.). «Пребиотические пептиды: молекулярные центры происхождения жизни» . Химические обзоры . 120 (11): 4707–4765. doi : 10.1021/acs.chemrev.9b00664 . ISSN 0009-2665 . ПМИД 32101414 .
- ^ Кэмпбелл, Томас Д.; февраль, Рио; Маккарти, Джек Т.; Кляйншмидт, Холли Э.; Форсайт, Джей Г.; Брейчер, Пол Дж. (2019). «Конденсация пребиотиков посредством циклического цикла влажно-сухой жизни, регулируемого расплыванием» . Природные коммуникации . 10 (1): 4508. Бибкод : 2019NatCo..10.4508C . дои : 10.1038/s41467-019-11834-1 . ПМК 6778215 . ПМИД 31586058 .
- ^ Маршалл-Боуман, Карина; Охара, Сёхей; Сверженский, Дмитрий А.; Хейзен, Роберт М.; Кливс, Х. Джеймс (октябрь 2010 г.). «Каталитический гидролиз пептидов минеральной поверхностью: значение для химии пребиотиков» . Geochimica et Cosmochimica Acta . 74 (20): 5852–5861. Бибкод : 2010GeCoA..74.5852M . дои : 10.1016/j.gca.2010.07.009 . ISSN 0016-7037 .
- ^ Матрё, Томас; Айккила, Паула; Шой, Беттина; Браун, Дитер; Маст, Кристоф Б. (апрель 2024 г.). «Тепловые потоки обогащают пребиотические строительные блоки и повышают их реакционную способность» . Природа . 628 (8006): 110–116. Бибкод : 2024Natur.628..110M . дои : 10.1038/s41586-024-07193-7 . ISSN 1476-4687 . ПМЦ 10990939 . ПМИД 38570715 .
- ^ Пахт-Горовиц, Мелла (1 января 1974 г.). «Возможная роль глин в синтезе пребиотических пептидов» . Истоки жизни . 5 (1): 173–187. Бибкод : 1974OrLi....5..173P . дои : 10.1007/BF00927022 . ISSN 1573-0875 . ПМИД 4842069 .
- ^ Краснокутский С.А.; Чуанг, К.-Дж.; Ягер, К.; Юбершаар, Н.; Хеннинг, Т. (10 февраля 2022 г.). «Путь к пептидам в космосе через конденсацию атомарного углерода» . Природная астрономия . 6 (3): 381–386. arXiv : 2202.12170 . Бибкод : 2022НатАс...6..381К . дои : 10.1038/s41550-021-01577-9 . ISSN 2397-3366 .
- ^ Краснокутский, Серж А.; Ягер, Корнелия; Хеннинг, Томас; Жеффруа, Клод; Ремори, Квентин Б.; Пуано, Полина (19 апреля 2024 г.). «Образование внеземных пептидов и их производных» . Достижения науки . 10 (16): eadj7179. arXiv : 2405.00744 . Бибкод : 2024SciA...10J7179K . дои : 10.1126/sciadv.adj7179 . ISSN 2375-2548 . ПМК 11023503 . ПМИД 38630826 .
- ^ Ланцет, Дорон (30 декабря 2014 г.). «Системная пребиология-Исследование происхождения жизни» . Лаборатория «Ланцет» . Реховот, Израиль: Отдел молекулярной генетики; Институт науки Вейцмана . Архивировано из оригинала 26 июня 2015 года . Проверено 26 июня 2015 г.
- ^ Сегре, Даниэль; Бен-Эли, Дафна; Димер, Дэвид В.; Ланцет, Дорон (февраль 2001 г.). «Липидный мир» (PDF) . Происхождение жизни и эволюция биосфер . 31 (1–2): 119–145. Бибкод : 2001OLEB...31..119S . дои : 10.1023/А:1006746807104 . ПМИД 11296516 . S2CID 10959497 . Архивировано (PDF) из оригинала 26 июня 2015 года.
- ^ Jump up to: а б с Чен, Ирен А.; Вальде, Питер (июль 2010 г.). «От самособирающихся везикул к протоклеткам» . Перспективы Колд-Спринг-Харбор в биологии . 2 (7): а002170. doi : 10.1101/cshperspect.a002170 . ПМК 2890201 . ПМИД 20519344 .
- ^ Эйген, Манфред ; Шустер, Питер (ноябрь 1977 г.). «Гиперцикл. Принцип естественной самоорганизации. Часть A: Возникновение гиперцикла» (PDF) . Naturwissenschaften . 64 (11): 541–65. Бибкод : 1977NW.....64..541E . дои : 10.1007/bf00450633 . ПМИД 593400 . S2CID 42131267 . Архивировано из оригинала (PDF) 3 марта 2016 года.
- Эйген, Манфред ; Шустер, Питер (1978). «Гиперцикл. Принцип естественной самоорганизации. Часть B: абстрактный гиперцикл» (PDF) . Naturwissenschaften . 65 (1): 7–41. Бибкод : 1978NW.....65....7E . дои : 10.1007/bf00420631 . S2CID 1812273 . Архивировано из оригинала (PDF) 3 марта 2016 года.
- Эйген, Манфред ; Шустер, Питер (июль 1978 г.). «Гиперцикл. Принцип естественной самоорганизации. Часть C: Реалистичный гиперцикл» (PDF) . Naturwissenschaften . 65 (7): 341–369. Бибкод : 1978NW.....65..341E . дои : 10.1007/bf00439699 . S2CID 13825356 . Архивировано из оригинала (PDF) 16 июня 2016 года.
- ^ Маркович, Омер; Ланцет, Дорон (лето 2012 г.). «Для эффективной эволюции необходим избыточный взаимный катализ» . Искусственная жизнь . 18 (3): 243–266. дои : 10.1162/artl_a_00064 . ПМИД 22662913 . S2CID 5236043 .
- ^ Тессера, Марк (2011). «Происхождение эволюции против происхождения жизни: сдвиг парадигмы» . Международный журнал молекулярных наук . 12 (6): 3445–3458. дои : 10.3390/ijms12063445 . ПМК 3131571 . ПМИД 21747687 . Спецвыпуск: «Происхождение жизни 2011».
- ^ «Протоклетки» . Исследование истоков жизни: виртуальная выставка . Округ Арлингтон, Вирджиния: Национальный научный фонд . Архивировано из оригинала 28 февраля 2014 года . Проверено 13 сентября 2023 г.
- ^ Jump up to: а б с Чен, Ирен А. (8 декабря 2006 г.). «Появление клеток в процессе зарождения жизни» . Наука . 314 (5805): 1558–1559. дои : 10.1126/science.1137541 . ПМИД 17158315 .
- ^ Циммер, Карл (26 июня 2004 г.). «Что было до ДНК?» . Обнаружить . Архивировано из оригинала 19 марта 2014 года.
- ^ Онсагер, Ларс (1931). «Взаимные связи в необратимых процессах I» . Физический обзор . 37 (4): 405. Бибкод : 1931ФРв...37..405О . дои : 10.1103/PhysRev.37.405 .
- ^ Онсагер, Ларс (1931). «Взаимные отношения в необратимых процессах II» . Физический обзор . 38 (12): 2265. Бибкод : 1931PhRv...38.2265O . дои : 10.1103/PhysRev.38.2265 .
- ^ Пригожин, Илья (1967). Введение в термодинамику необратимых процессов . Нью-Йорк: Уайли .
- ^ Шапиро, Роберт (июнь 2007 г.). «Простое происхождение жизни» . Научный американец . 296 (6): 46–53. Бибкод : 2007SciAm.296f..46S . doi : 10.1038/scientificamerican0607-46 . ПМИД 17663224 . Архивировано из оригинала 14 июня 2015 года.
- ^ Чанг 2007
- ^ Jump up to: а б с д Лейн, Ник (2015). Жизненно важный вопрос: почему жизнь такая, какая она есть? . Профильные книги . стр. 129–140. ISBN 978-1-78125-036-5 .
- ^ Джордан, Шон Ф.; Нет, Элоиза; Лейн, Ник (6 декабря 2019 г.). «Изопреноиды повышают стабильность мембран жирных кислот при зарождении жизни, что потенциально может привести к раннему разделению липидов» . Фокус на интерфейсе . 9 (6): 20190067. doi : 10.1098/rsfs.2019.0067 . ПМК 6802135 . ПМИД 31641436 .
- ^ Майер, Кристиан; Шрайбер, Ульрих; Давила, Мария Х.; Шмитц, Оливер Дж.; Броня, Амелия; Мейер, Мартин; Кляйн, Джулия; Меккельманн, Свен В. (2018). «Молекулярная эволюция в системе пептид-везикула» . Жизнь . 8 (2): 16. Бибкод : 2018Жизнь....8...16М . дои : 10.3390/life8020016 . ISSN 2075-1729 . ПМК 6027363 . ПМИД 29795023 .
- ^ Майер, Кристиан; Шрайбер, Ульрих; Давила, Мария Х. (1 июня 2015 г.). «Периодическое образование пузырьков в зонах тектонических разломов — идеальный сценарий молекулярной эволюции» . Происхождение жизни и эволюция биосфер . 45 (1): 139–148. Бибкод : 2015ОЛЕВ...45..139М . дои : 10.1007/s11084-015-9411-z . ISSN 1573-0875 . ПМЦ 4457167 . ПМИД 25716918 .
- ^ Давила, Мария Х.; Майер, Кристиан (2022). «Мембранная структура, полученная в ходе экспериментального процесса эволюции» . Жизнь . 12 (2): 145. Бибкод : 2022Life...12..145D . дои : 10.3390/life12020145 . ISSN 2075-1729 . ПМЦ 8875328 . ПМИД 35207433 .
- ^ Майер, Кристиан (2022). «Спонтанное формирование функциональных структур в беспорядочной среде» . Жизнь . 12 (5): 720. Бибкод : 2022Жизнь...12..720М . дои : 10.3390/life12050720 . ISSN 2075-1729 . ПМЦ 9148140 . ПМИД 35629387 .
- ^ Давила, Мария Х.; Майер, Кристиан (2023). «Структурные явления в мембране пузырька, полученные в ходе эволюционного эксперимента: исследование, основанное на моделировании МД» . Жизнь . 13 (8): 1735. Бибкод : 2023Life...13.1735D . дои : 10.3390/life13081735 . ISSN 2075-1729 . ПМЦ 10455627 . ПМИД 37629592 .
- ^ Майер, Кристиан (18 января 2020 г.). «Жизнь в контексте порядка и сложности» . Жизнь . 10 (1): 5. Бибкод : 2020Жизнь...10....5М . дои : 10.3390/life10010005 . ISSN 2075-1729 . ПМЦ 7175320 . ПМИД 31963637 .
- ^ Шаров, Алексей А.; Гордон, Ричард (2018). «Жизнь до Земли» . Обитаемость Вселенной до Земли: Жизнь до Земли . Астробиология, изучающая жизнь на Земле и за ее пределами. Академическая пресса . стр. 265–296. дои : 10.1016/B978-0-12-811940-2.00011-3 . ISBN 978-0-12-811940-2 . S2CID 117048600 . Архивировано из оригинала 30 апреля 2022 года . Проверено 30 апреля 2022 г.
- ^ Ледиман, Дж.; Ламберт, Дж.; Вайснер, КБ (2013). «Что такое сложная система?». Европейский журнал философии науки . 3 : 33–67. дои : 10.1007/s13194-012-0056-8 . S2CID 18787276 .
- ^ Эспозито, М.; Линденберг, Катя ; Ван ден Брук, К. (2010). «Производство энтропии как взаимосвязь между системой и резервуаром». Новый журнал физики . 12 (1): 013013. arXiv : 0908.1125 . Бибкод : 2010NJPh...12a3013E . дои : 10.1088/1367-2630/12/1/013013 . S2CID 26657293 .
- ^ Бар-Нун, А.; Бар-Нун, Н.; Бауэр, С.Х.; Саган, Карл (24 апреля 1970 г.). «Ударный синтез аминокислот в моделируемых примитивных средах». Наука . 168 (3930): 470–473. Бибкод : 1970Sci...168..470B . дои : 10.1126/science.168.3930.470 . ПМИД 5436082 . S2CID 42467812 .
- ^ Анбар, Майкл (27 сентября 1968 г.). «Кавитация при воздействии жидкой воды на воду: геохимические последствия». Наука . 161 (3848): 1343–1344. Бибкод : 1968Sci...161.1343A . дои : 10.1126/science.161.3848.1343 . ПМИД 17831346 .
- ^ Дхармаратне, Лина; Гризер, Франц (7 января 2016 г.). «Образование аминокислот при сонолизе водных растворов, содержащих уксусную кислоту, метан или углекислый газ, в присутствии газообразного азота». Журнал физической химии А. 120 (2): 191–199. Бибкод : 2016JPCA..120..191D . дои : 10.1021/acs.jpca.5b11858 . ПМИД 26695890 .
- ^ Патехебике, Йерсен; Чжао, Зе-Рун; Ван, Су; Сюй, Хао-Син; Чен, Цянь-Цянь; Ван, Сяо (2021). «Кавитация как возможная движущая сила пребиотического образования пуриновых нуклеозидов N9» . Отчеты о клетках Физические науки . 2 (3): 100375. Бибкод : 2021CRPS....200375P . дои : 10.1016/j.xcrp.2021.100375 . S2CID 233662126 .
- ^ Кальсон, Натан-Хаим; Фурман, Дэвид; Зейри, Иегуда (11 сентября 2017 г.). «Кавитационный синтез биогенных молекул на первичной Земле» . Центральная научная служба ACS . 3 (9): 1041–1049. дои : 10.1021/accentsci.7b00325 . ПМК 5620973 . ПМИД 28979946 . S2CID 21409351 .
- ^ Мюллер, Энтони WJ (1995). «Были ли первые организмы тепловыми двигателями? Новая модель биогенеза и ранняя эволюция преобразования биологической энергии» . Прогресс биофизики и молекулярной биологии . 63 (2): 193–231. дои : 10.1016/0079-6107(95)00004-7 . ПМИД 7542789 .
- ^ Мюллер, Энтони У.Дж.; Шульце-Макух, Дирк (2006). «Тепловая энергия и происхождение жизни». Происхождение жизни и эволюция биосфер . 36 (2): 77–189. Бибкод : 2006ОЛЕВ...36..177М . дои : 10.1007/s11084-005-9003-4 . ПМИД 16642267 . S2CID 22179552 .
- ^ Юнге, Вольфганг; Нельсон, Натан (2 июня 2015 г.). «АТФ-синтаза» . Ежегодный обзор биохимии . 84 (1): 631–657. doi : 10.1146/annurev-biochem-060614-034124 . ПМИД 25839341 .
- ^ Jump up to: а б с Дамер, Брюс; Димер, Дэвид (1 апреля 2020 г.). «Гипотеза происхождения жизни из горячих источников» . Астробиология . 20 (4): 429–452. Бибкод : 2020AsBio..20..429D . дои : 10.1089/ast.2019.2045 . ПМЦ 7133448 . ПМИД 31841362 .
- ^ Беннер, ЮАР; Белл, Э.А.; Бионди, Э.; Брассер, Р.; Карелл, Т.; Ким, Х.-Дж.; Мойжис, С.Дж.; Омран, А.; Пасек, Массачусетс; Трейл, Д. (2020). «Когда жизнь, вероятно, возникла на Земле в результате процесса, основанного на РНК?» . ХимСистемыХим . 2 (2). arXiv : 1908.11327 . дои : 10.1002/syst.201900035 .
- ^ * Копли, Шелли Д.; Смит, Эрик; Моровиц, Гарольд Дж. (декабрь 2007 г.). «Происхождение мира РНК: коэволюция генов и метаболизма» (PDF) . Биоорганическая химия . 35 (6): 430–443. дои : 10.1016/j.bioorg.2007.08.001 . ПМИД 17897696 . Архивировано (PDF) из оригинала 5 сентября 2013 года . Проверено 8 июня 2015 г.
Предположение о том, что жизнь на Земле возникла из мира РНК, широко распространено.
- Оргел, Лесли Э. (апрель 2003 г.). «Некоторые следствия гипотезы мира РНК». Происхождение жизни и эволюция биосфер . 33 (2): 211–218. Бибкод : 2003OLEB...33..211O . дои : 10.1023/A:1024616317965 . ПМИД 12967268 . S2CID 32779859 .
Теперь кажется весьма вероятным, что нашему знакомому миру ДНК/РНК/белков предшествовал мир РНК...
- Робертсон и Джойс 2012 : «В настоящее время имеются убедительные доказательства того, что мир РНК действительно существовал до того, как жизнь на основе ДНК и белков».
- Неве, Ким и Беннер, 2013 : «[Существование мира РНК] сегодня пользуется широкой поддержкой в обществе».
- Оргел, Лесли Э. (апрель 2003 г.). «Некоторые следствия гипотезы мира РНК». Происхождение жизни и эволюция биосфер . 33 (2): 211–218. Бибкод : 2003OLEB...33..211O . дои : 10.1023/A:1024616317965 . ПМИД 12967268 . S2CID 32779859 .
- ^ Jump up to: а б с Робертсон, Майкл П.; Джойс, Джеральд Ф. (май 2012 г.). «Происхождение мира РНК» . Перспективы Колд-Спринг-Харбор в биологии . 4 (5): а003608. doi : 10.1101/cshperspect.a003608 . ПМК 3331698 . ПМИД 20739415 .
- ^ Jump up to: а б с Чех, Томас Р. (июль 2012 г.). «Миры РНК в контексте» . Перспективы Колд-Спринг-Харбор в биологии . 4 (7): а006742. doi : 10.1101/cshperspect.a006742 . ПМЦ 3385955 . ПМИД 21441585 .
- ^ Пирс, Бен К.Д.; Пудриц, Ральф Э.; Семенов Дмитрий А.; Хеннинг, Томас К. (24 октября 2017 г.). «Происхождение мира РНК: судьба нуклеиновых оснований в теплых прудах» . ПНАС . 114 (43): 11327–11332. arXiv : 1710.00434 . Бибкод : 2017PNAS..11411327P . дои : 10.1073/pnas.1710339114 . ПМК 5664528 . ПМИД 28973920 .
- ^ Ярус, Майкл (апрель 2011 г.). «Пройдя через мир РНК: первоначальный дарвиновский предок» . Перспективы Колд-Спринг-Харбор в биологии . 3 (4): а003590. doi : 10.1101/cshperspect.a003590 . ПМК 3062219 . ПМИД 20719875 .
- ^ Foot & Foot 2004 , с. 29
- ^ Фокс, Джордж.Э. (9 июня 2010 г.). «Происхождение и эволюция рибосомы» . Перспективы Колд-Спринг-Харбор в биологии . 2 (9(а003483)): а003483. doi : 10.1101/cshperspect.a003483 . ПМЦ 2926754 . ПМИД 20534711 .
- ^ Невё, Марк; Ким, Хё Чжун; Беннер, Стивен А. (22 апреля 2013 г.). «Гипотеза о мире сильных РНК: пятьдесят лет». Астробиология . 13 (4): 391–403. Бибкод : 2013AsBio..13..391N . дои : 10.1089/ast.2012.0868 . ПМИД 23551238 .
- ^ Гилберт, Уолтер (20 февраля 1986 г.). «Происхождение жизни: мир РНК» . Природа . 319 (6055): 618. Бибкод : 1986Natur.319..618G . дои : 10.1038/319618a0 . S2CID 8026658 .
- ^ Оргел, Лесли Э. (октябрь 1994 г.). «Происхождение жизни на Земле». Научный американец . 271 (4): 76–83. Бибкод : 1994SciAm.271d..76O . doi : 10.1038/scientificamerican1094-76 . ПМИД 7524147 .
- ^ Линкольн, Трейси А.; Джойс, Джеральд Ф. (27 февраля 2009 г.). «Самоподдерживающаяся репликация фермента РНК» . Наука . 323 (5918): 1229–1232. Бибкод : 2009Sci...323.1229L . дои : 10.1126/science.1167856 . ПМК 2652413 . ПМИД 19131595 .
- ^ Джойс, Джеральд Ф. (2009). «Эволюция в мире РНК» . Перспективы Колд-Спринг-Харбор в биологии . 74 (Эволюция: Молекулярный ландшафт): 17–23. дои : 10.1101/sqb.2009.74.004 . ПМЦ 2891321 . ПМИД 19667013 .
- ^ Шостак, Джек В. (5 февраля 2015 г.). «Происхождение функций биологических нуклеиновых кислот, белков и мембран» . Чеви Чейз, Мэриленд: Медицинский институт Говарда Хьюза . Архивировано из оригинала 14 июля 2015 года . Проверено 16 июня 2015 г.
- ^ Бернштейн, Харрис; Байерли, Генри К.; Хопф, Фредерик А.; и др. (июнь 1983 г.). «Дарвиновская динамика». Ежеквартальный обзор биологии . 58 (2): 185–207. дои : 10.1086/413216 . JSTOR 2828805 . S2CID 83956410 .
- ^ Мишо 1999
- ^ Паласек, Стэн (23 мая 2013 г.). «Изначальная репликация РНК и применение в технологии ПЦР». arXiv : 1305.5581v1 [ q-bio.BM ].
- ^ Власов Александр Васильевич; Казаков Сергей А.; Джонстон, Брайан Х.; и др. (август 2005 г.). «Мир РНК на льду: новый сценарий появления информации о РНК». Журнал молекулярной эволюции . 61 (2): 264–273. Бибкод : 2005JMolE..61..264В . дои : 10.1007/s00239-004-0362-7 . ПМИД 16044244 . S2CID 21096886 .
- ^ Нусинов, Марк Д.; Отрощенко Владимир А.; Сантоли, Сальваторе (1997). «Зарождение неклеточной фазы жизни на мелкозернистых глинистых частицах раннего реголита Земли». БиоСистемы . 42 (2–3): 111–118. Бибкод : 1997BiSys..42..111N . дои : 10.1016/S0303-2647(96)01699-1 . ПМИД 9184757 .
- ^ Кюнляйн, Александра; Ланцмих, Саймон А.; Брун, Дитер (2 марта 2021 г.). «Последовательности тРНК могут собираться в репликатор» . электронная жизнь . 10 . doi : 10.7554/eLife.63431 . ПМЦ 7924937 . ПМИД 33648631 .
- ^ Ноллер, Гарри Ф. (апрель 2012 г.). «Эволюция синтеза белков из мира РНК» . Перспективы Колд-Спринг-Харбор в биологии . 4 (4): а003681. doi : 10.1101/cshperspect.a003681 . ПМЦ 3312679 . ПМИД 20610545 .
- ^ Кунин, Евгений В. (31 мая 2007 г.). «Космологическая модель вечной инфляции и переход от случайности к биологической эволюции в истории жизни» . Биология Директ . 2:15 . дои : 10.1186/1745-6150-2-15 . ЧВК 1892545 . ПМИД 17540027 .
- ^ Jump up to: а б Тамура, К.; Александр, RW (1 мая 2004 г.). «Синтез пептидов путем эволюции» . Клеточные и молекулярные науки о жизни . 61 (11): 1317–1330. дои : 10.1007/s00018-004-3449-9 . ISSN 1420-9071 . ПМЦ 11138682 . ПМИД 15170510 .
- ^ Тамура, Кодзи; Шиммель, Пол (22 июля 2003 г.). «Синтез пептидов с помощью матричной РНК-гида и аминоацилфосфатных адаптеров» . Труды Национальной академии наук . 100 (15): 8666–8669. Бибкод : 2003PNAS..100.8666T . дои : 10.1073/pnas.1432909100 . ISSN 0027-8424 . ПМК 166369 . ПМИД 12857953 .
- ^ Jump up to: а б Прессман, Эйб Д.; Лю, Цивэй; Янзен, Эван; Бланко, Селия; Мюллер, Ульрих Ф.; Джойс, Джеральд Ф.; Паскаль, Роберт; Чен, Ирен А. (17 апреля 2019 г.). «Картирование систематического ландшафта пригодности рибозимов показывает разочарованную эволюционную сеть самоаминоацилирующей РНК» . Журнал Американского химического общества . 141 (15): 6213–6223. дои : 10.1021/jacs.8b13298 . ISSN 0002-7863 . ПМК 6548421 . ПМИД 30912655 .
- ^ Тьяги, Санджай; Поннамперума, Сирил (1 мая 1990 г.). «Неслучайность в синтезе пребиотических пептидов» . Журнал молекулярной эволюции . 30 (5): 391–399. Бибкод : 1990JMolE..30..391T . дои : 10.1007/BF02101111 . ISSN 1432-1432 . ПМИД 2111852 .
- ^ Киф, Энтони Д.; Шостак, Джек В. (2001). «Функциональные белки из библиотеки случайных последовательностей» . Природа . 410 (6829): 715–718. Бибкод : 2001Natur.410..715K . дои : 10.1038/35070613 . ПМЦ 4476321 . ПМИД 11287961 .
- ^ Тонг, Шер Линг; Ли, Кун-Хва; Зеилиг, Буркхард (июнь 2021 г.). «Белки de novo из случайных последовательностей в результате эволюции in vitro» . Современное мнение в области структурной биологии . 68 : 129–134. дои : 10.1016/j.sbi.2020.12.014 . ПМЦ 8222087 . ПМИД 33517151 .
- ^ Бун, Дэвид Р.; Кастенхольц, Ричард В.; Гаррити, Джордж М., ред. (2001). Археи . и глубоко ветвящиеся и бактерии фототрофные Руководство Берджи по систематической бактериологии. Спрингер . ISBN 978-0-387-21609-6 . Архивировано из оригинала 25 декабря 2014 года. [ нужна страница ]
- ^ Вёзе, ЧР; Фокс, GE (1977). «Филогенетическая структура прокариотического домена: первичные царства» . ПНАС . 7 (11): 5088–5090. Бибкод : 1977PNAS...74.5088W . дои : 10.1073/pnas.74.11.5088 . ПМК 432104 . ПМИД 270744 .
- ^ Валас, Р.Э.; Борн, ЧП (2011). «Происхождение производного суперцарства: как грамположительная бактерия пересекла пустыню и стала археем» . Биология Директ . 6:16 . дои : 10.1186/1745-6150-6-16 . ПМК 3056875 . ПМИД 21356104 .
- ^ Кавальер-Смит, Томас (2006). «Укоренение древа жизни посредством анализа переходов» . Биология Директ . 1:19 . дои : 10.1186/1745-6150-1-19 . ПМК 1586193 . ПМИД 16834776 .
- ^ «В молодости нравилось погорячее» . Природа . 535 (7613): 468. 2016. doi : 10.1038/535468b . S2CID 49905802 .
- ^ Гогартен, Иоганн Петер; Димер, Дэвид (25 ноября 2016 г.). «Является ли LUCA термофильным предшественником?» . Природная микробиология . 1 (12): 16229. doi : 10.1038/nmicrobiol.2016.229 . ПМИД 27886195 . S2CID 205428194 . Архивировано из оригинала 3 апреля 2020 года . Проверено 21 сентября 2022 г.
- ^ Кэтчпол, Райан; Фортерре, Патрик (2019). «Эволюция обратной гиразы предполагает наличие негипертермофильного последнего универсального общего предка» . Молекулярная биология и эволюция . 36 (12): 2737–2747. дои : 10.1093/molbev/msz180 . ПМК 6878951 . ПМИД 31504731 . Архивировано из оригинала 27 января 2023 года . Проверено 18 сентября 2022 г.
- ^ Беркемер, Сара Дж.; МакГлинн, Шон Э (8 августа 2020 г.). «Новый анализ разделения доменов архей и бактерий: переменное филогенетическое расстояние и темп ранней эволюции» . Молекулярная биология и эволюция . 37 (8): 2332–2340. дои : 10.1093/molbev/msaa089 . ПМЦ 7403611 . ПМИД 32316034 . Архивировано из оригинала 27 января 2023 года . Проверено 21 сентября 2022 г.
- ^ Хоффманн, Джеффри В. (25 июня 1974 г.). «О происхождении генетического кода и стабильности аппарата трансляции». Журнал молекулярной биологии . 86 (2): 349–362. дои : 10.1016/0022-2836(74)90024-2 . ПМИД 4414916 .
- ^ Оргел, Лесли Э. (апрель 1963 г.). «Поддержание точности синтеза белка и его значение для старения» . ПНАС . 49 (4): 517–521. Бибкод : 1963PNAS...49..517O . дои : 10.1073/pnas.49.4.517 . ПМЦ 299893 . ПМИД 13940312 .
- ^ Хоффманн, Джеффри В. (октябрь 1975 г.). «Стохастическая теория происхождения генетического кода». Ежегодный обзор физической химии . 26 : 123–144. Бибкод : 1975ARPC...26..123H . дои : 10.1146/annurev.pc.26.100175.001011 .
- ^ Харрисон, Стюарт А.; Палмейра, Ракель Нуньес; Халперн, Аарон; Лейн, Ник (1 ноября 2022 г.). «Биофизическая основа возникновения генетического кода в протоклетках» . Biochimica et Biophysica Acta (BBA) — Биоэнергетика . 1863 (8): 148597. doi : 10.1016/j.bbabio.2022.148597 . PMID 35868450 . S2CID 250707510 .
- ^ Харрисон, Стюарт А.; Лейн, Ник (12 декабря 2018 г.). «Жизнь как руководство к синтезу пребиотических нуклеотидов» . Природные коммуникации . 9 (1): 5176. Бибкод : 2018NatCo...9.5176H . дои : 10.1038/s41467-018-07220-y . ПМК 6289992 . ПМИД 30538225 .
- ^ Кантин, Марджори Д.; Фурнье, Грегори П. (1 марта 2018 г.). «Адаптация окружающей среды от зарождения жизни до последнего вселенского общего предка» . Происхождение жизни и эволюция биосфер . 48 (1): 35–54. Бибкод : 2018OLEB...48...35C . дои : 10.1007/s11084-017-9542-5 . hdl : 1721.1/114219 . ПМИД 28685374 . S2CID 254888920 . Архивировано из оригинала 31 января 2024 года . Проверено 8 декабря 2023 г.
- ^ Мэт, Вай-Кин (1 мая 2008 г.). «Геномика LUCA» (PDF) . Границы бионауки . 13 (14): 5605–5613. дои : 10.2741/3103 . ПМИД 18508609 . Архивировано (PDF) из оригинала 16 июня 2022 года . Проверено 8 декабря 2023 г.
- ^ Брейзер, доктор медицины (2012). Тайные камеры: внутренняя история клеток и сложной жизни . Издательство Оксфордского университета. п. 298.
- ^ Уорд, Питер и Киршвинк, Джо , цит., стр. 42
- ^ Jump up to: а б Колин-Гарсия, М.; Эредиа, А.; Кордеро, Г.; и др. (2016). «Гидротермальные источники и пребиотическая химия: обзор» . Бюллетень Мексиканского геологического общества . 68 (3): 599–620. дои : 10.18268/BSGM2016v68n3a13 . Архивировано из оригинала 18 августа 2017 года.
- ^ Ширбер, Майкл (24 июня 2014 г.). «Гидротермальные источники могут объяснить появление химических предшественников жизни» . Астробиология НАСА: Жизнь во Вселенной . НАСА. Архивировано из оригинала 29 ноября 2014 года . Проверено 19 июня 2015 г.
- ^ Jump up to: а б Мартин, Уильям ; Рассел, Майкл Дж. (29 января 2003 г.). «О происхождении клеток: гипотеза эволюционных переходов от абиотической геохимии к хемоавтотрофным прокариотам и от прокариотов к ядросодержащим клеткам» . Философские труды Королевского общества Б. 358 (1429): 59–83, обсуждение 83–85. дои : 10.1098/rstb.2002.1183 . ПМК 1693102 . ПМИД 12594918 .
- ^ Лейн 2009
- ^ Ашер, Оли (27 апреля 2015 г.). «Химия горячих источников морского дна может объяснить возникновение жизни» (Пресс-релиз). Университетский колледж Лондона . Архивировано из оригинала 20 июня 2015 года . Проверено 19 июня 2015 г.
- ^ Ролдан, Альберто; Холлингсворт, Натан; Роффи, Анна; и др. (май 2015 г.). «Биологическая конверсия CO2 с помощью катализаторов на основе сульфида железа в устойчивых условиях» . Химические коммуникации . 51 (35): 7501–7504. дои : 10.1039/C5CC02078F . ПМИД 25835242 . Архивировано из оригинала 20 июня 2015 года . Проверено 19 июня 2015 г.
- ^ Баросс, Дж.А.; Хоффман, SE (1985). «Подводные гидротермальные источники и связанная с ними градиентная среда как места зарождения и эволюции жизни». Происхождение жизни и эволюция биосфер . 15 (4): 327–345. Бибкод : 1985OrLi...15..327B . дои : 10.1007/bf01808177 . S2CID 4613918 .
- ^ Рассел, MJ; Холл, Эй Джей (1997). «Появление жизни из пузырьков моносульфида железа на подводном гидротермальном окислительно-восстановительном фронте и фронте pH». Журнал Геологического общества . 154 (3): 377–402. Бибкод : 1997JGSoc.154..377R . дои : 10.1144/gsjgs.154.3.0377 . ПМИД 11541234 . S2CID 24792282 .
- ^ Поправка, JP; ЛаРоу, Делавэр; Макколлом, ТМ; Шок, Э.Л. (2013). «Энергетика органического синтеза внутри и вне клетки» . Философские труды Королевского общества Б. 368 (1622): 20120255. doi : 10.1098/rstb.2012.0255 . ПМЦ 3685458 . ПМИД 23754809 .
- ^ Шок, EL; Бойд, ES (2015). «Геомикробиология и микробная геохимия: принципы геобиохимии». Элементы . 11 : 389–394. дои : 10.2113/gselements.11.6.395 .
- ^ Мартин, В.; Рассел, MJ (2007). «О происхождении биохимии на щелочно-гидротермальном источнике» . Философские труды Королевского общества Б. 362 (1486): 1887–1925. дои : 10.1098/rstb.2006.1881 . ПМЦ 2442388 . ПМИД 17255002 .
- ^ Лейн, Ник; Мартин, Уильям Ф. (21 декабря 2012 г.). «Происхождение мембранной биоэнергетики» . Клетка . 151 (7): 1406–1416. дои : 10.1016/j.cell.2012.11.050 . ПМИД 23260134 . S2CID 15028935 .
- ^ Бааске, Филипп; Вайнерт, Франц М.; Дур, Стефан; Лемке, Коно Х.; Рассел, Майкл Дж.; Браун, Дитер (29 мая 2007 г.). «Чрезвычайное накопление нуклеотидов в смоделированных гидротермальных поровых системах» . Труды Национальной академии наук . 104 (22): 9346–9351. дои : 10.1073/pnas.0609592104 . ПМК 1890497 . ПМИД 17494767 .
- ^ Нуньес Палмейра, Ракель; Колнаги, Марко; Харрисон, Стюарт А.; Помянковский, Эндрю; Лейн, Ник (9 ноября 2022 г.). «Границы метаболической наследственности в протоклетках» . Труды Королевского общества B: Биологические науки . 289 (1986). дои : 10.1098/rspb.2022.1469 . ПМЦ 9653231 . ПМИД 36350219 .
- ^ Вёзе, Карл Р. (1987). «Бактериальная эволюция» . Микробиологические обзоры . 51.2 (1987) (2): 221–271. дои : 10.1128/мр.51.2.221-271.1987 . ПМК 373105 . ПМИД 2439888 . S2CID 734579 .
- ^ Рассел, Майкл Дж.; Холл, Аллан Дж. (2006), «Зарождение и ранняя эволюция жизни» , Эволюция атмосферы, гидросферы и биосферы ранней Земли - ограничения, обусловленные рудными месторождениями , Геологическое общество Америки, номер документа : 10.1130/2006.1198(01) , ISBN 9780813711980 , заархивировано из оригинала 31 января 2024 года , получено 30 ноября 2023 года.
- ^ Буссау, Бастьен; Бланкар, Самуэль; Нексулея, Анамария; Лартильо, Николя; Гуи, Маноло (декабрь 2008 г.). «Параллельные адаптации к высоким температурам в архейском эоне» . Природа . 456 (7224): 942–945. Бибкод : 2008Natur.456..942B . дои : 10.1038/nature07393 . ПМИД 19037246 . S2CID 4348746 . Архивировано из оригинала 16 декабря 2023 года . Проверено 8 декабря 2023 г.
- ^ Jump up to: а б Галтье, Николя; Турасс, Николя; Гуи, Маноло (8 января 1999 г.). «Негипертермофильный общий предок существующих форм жизни» . Наука . 283 (5399): 220–221. дои : 10.1126/science.283.5399.220 . ПМИД 9880254 . Архивировано из оригинала 31 января 2024 года . Проверено 8 декабря 2023 г.
- ^ Келли, Дебора С.; Карсон, Джеффри А.; Блэкман, Донна К.; Фрю-Грин, Гретхен Л.; Баттерфилд, Дэвид А.; Лилли, Марвин Д.; Олсон, Эрик Дж.; Шренк, Мэтью О.; Роу, Кевин К.; Лебон, Джефф Т.; Ривизиньо, Пит (июль 2001 г.). «Внеосевое гидротермальное поле возле Срединно-Атлантического хребта на 30 ° с.ш.» . Природа . 412 (6843): 145–149. Бибкод : 2001Natur.412..145K . дои : 10.1038/35084000 . ПМИД 11449263 . S2CID 4407013 . Архивировано из оригинала 31 января 2024 года . Проверено 8 декабря 2023 г.
- ^ Jump up to: а б Эренфройнд, П.; Ирвин, В.; Беккер, Л.; Бланк, Дж.; Брукато-младший; и др. (август 2002 г.). «Астрофизические и астрохимические открытия о происхождении жизни» . Отчеты о прогрессе в физике . 65 (10): 1427. Бибкод : 2002РПФ...65.1427Е . дои : 10.1088/0034-4885/65/10/202 . S2CID 250904448 .
- ^ Чиба, CF; Чиба, CF; Хэнд, КП (2006). «Кометы и пребиотические органические молекулы на ранней Земле». Кометы и происхождение и эволюция жизни . Достижения астробиологии и биогеофизики. Шпрингер Берлин Гейдельберг. стр. 169–206. дои : 10.1007/3-540-33088-7_6 . ISBN 978-3-540-33086-8 . Архивировано из оригинала 31 января 2024 года . Проверено 30 ноября 2023 г.
- ^ Чаттерджи, Санкар (2023), Чаттерджи, Санкар (редактор), «Колыбель жизни» , От звездной пыли до первых клеток: происхождение и эволюция ранней жизни , Чам: Springer International Publishing, стр. 43–66, doi : 10.1007/978-3-031-23397-5_6 , ISBN 978-3-031-23397-5 , заархивировано из оригинала 31 января 2024 года , получено 5 декабря 2023 года.
- ^ Димер, Дэвид В. (7 февраля 2019 г.). «Перспективы жизни на других планетах». Сборка жизни . Издательство Оксфордского университета . дои : 10.1093/oso/9780190646387.003.0017 . ISBN 978-0-19-064638-7 . Архивировано из оригинала 31 января 2024 года . Проверено 6 декабря 2023 г.
- ^ Пирс, Бен К.Д.; Пудриц, Ральф Э.; Семенов Дмитрий А.; Хеннинг, Томас К. (2 октября 2017 г.). «Происхождение мира РНК: судьба нуклеиновых оснований в теплых прудах» . Труды Национальной академии наук . 114 (43): 11327–11332. arXiv : 1710.00434 . Бибкод : 2017PNAS..11411327P . дои : 10.1073/pnas.1710339114 . ПМК 5664528 . ПМИД 28973920 .
- ^ Jump up to: а б с Димер, Дэвид (10 февраля 2021 г.). «Где началась жизнь? Тестирование идей в условиях аналогов пребиотиков» . Жизнь . 11 (2): 134. Бибкод : 2021Life...11..134D . дои : 10.3390/life11020134 . ПМЦ 7916457 . ПМИД 33578711 .
- ^ Джордан, Шон Ф.; Рамму, Ханади; Желудев Иван Н.; Хартли, Эндрю М.; Марешаль, Амандин; Лейн, Ник (2019). «Стимулирование самосборки протоклеток из смешанных амфифилов при зарождении жизни» . Экология и эволюция природы . 3 (12): 1705–1714. Бибкод : 2019NatEE...3.1705J . дои : 10.1038/s41559-019-1015-y . ПМИД 31686020 .
- ^ Коренага, июнь (ноябрь 2021 г.). «Была ли земля на ранней Земле?» . Жизнь . 11 (11): 1142. Бибкод : 2021Жизнь...11.1142К . дои : 10.3390/life11111142 . ПМЦ 8623345 . ПМИД 34833018 .
- ^ Пауэр, Мэтью В.; Жерланд, Беатрис; Сазерленд, Джон Д. (май 2009 г.). «Синтез активированных пиримидинрибонуклеотидов в пребиотически приемлемых условиях» . Природа . 459 (7244): 239–242. Бибкод : 2009Natur.459..239P . дои : 10.1038/nature08013 . ПМИД 19444213 . S2CID 4412117 . Архивировано из оригинала 12 ноября 2023 года . Проверено 8 декабря 2023 г.
- ^ Занле, Кевин; Арндт, Ник; Кокелл, Чарльз; Холлидей, Алекс; Нисбет, Юан; Селсис, Франк; Сон, Норман Х. (1 марта 2007 г.). «Появление обитаемой планеты» . Обзоры космической науки . 129 (1): 35–78. Бибкод : 2007ССРв..129...35З . дои : 10.1007/s11214-007-9225-z . S2CID 12006144 . Архивировано из оригинала 31 января 2024 года . Проверено 8 декабря 2023 г.
- ^ Вёзе, ЧР (июнь 1987 г.). «Бактериальная эволюция» . Микробиологические обзоры . 51 (2): 221–271. дои : 10.1128/мр.51.2.221-271.1987 . ПМК 373105 . ПМИД 2439888 .
- ^ Jump up to: а б с Мулкиджанян Армен Ю.; Бычков Андрей Ю.; Диброва Дарья Викторовна; Гальперин, Михаил Юрьевич; Кунин, Евгений В. (3 апреля 2012 г.). «Происхождение первых клеток на земных бескислородных геотермальных полях» . Труды Национальной академии наук . 109 (14): Е821-30. Бибкод : 2012PNAS..109E.821M . дои : 10.1073/pnas.1117774109 . ПМЦ 3325685 . ПМИД 22331915 .
- ^ Чандру, Кухан; Гуттенберг, Николас; Гири, Чайтанья; и др. (31 мая 2018 г.). «Простой пребиотический синтез динамических комбинаторных полиэфирных библиотек большого разнообразия» . Химия связи . 1 (1). дои : 10.1038/s42004-018-0031-1 .
- ^ Форсайт, Джей Г.; Ю, Шэн-Шэн; Мамаджанов, Ирена; и др. (17 августа 2015 г.). «Опосредованное эфиром образование амидной связи, вызванное циклами влажно-сухой: возможный путь к полипептидам на пребиотической Земле» . Angewandte Chemie International Edition на английском языке . 54 (34): 9871–9875. дои : 10.1002/anie.201503792 . ПМЦ 4678426 . ПМИД 26201989 .
- ^ Патель, Бхавеш Х.; Персиваль, Клаудия; Ритсон, Дугал Дж.; Даффи, Колм. Д.; Сазерленд, Джон Д. (16 марта 2015 г.). «Общее происхождение предшественников РНК, белков и липидов в цианосульфидном протометаболизме» . Природная химия . 7 (4): 301–307. Бибкод : 2015НатЧ...7..301П . дои : 10.1038/nchem.2202 . ПМЦ 4568310 . ПМИД 25803468 .
- ^ Кэтлинг, Дэвид К.; Занле, Кевин Дж. (28 февраля 2020 г.). «Архейская атмосфера» . Достижения науки . 6 (9): eaax1420. Бибкод : 2020SciA....6.1420C . дои : 10.1126/sciadv.aax1420 . ПМК 7043912 . ПМИД 32133393 .
- ^ Миллер, Стэнли Л.; Ласкано, Антонио (декабрь 1995 г.). «Происхождение жизни? Происходило ли оно при высоких температурах?» . Журнал молекулярной эволюции . 41 (6): 689–692. Бибкод : 1995JMolE..41..689M . дои : 10.1007/bf00173146 . hdl : 2060/19980211388 . ПМИД 11539558 . S2CID 25141419 . Архивировано из оригинала 31 января 2024 года . Проверено 8 декабря 2023 г.
- ^ Фортерре, Патрик; Бержера, Агнес; Лопекс-Гарсия, Purificacion (май 1996 г.). «Уникальная топология ДНК и ДНК-топоизомеразы гипертермофильных архей» . Обзоры микробиологии FEMS . 18 (2–3): 237–248. дои : 10.1111/j.1574-6976.1996.tb00240.x . ПМИД 8639331 . S2CID 6001830 .
- ^ Брошье-Армане, Селин; Фортерре, Патрик (май 2006 г.). «Широко распространенное распространение архейной обратной гиразы в термофильных бактериях предполагает сложную историю вертикального наследования и латерального переноса генов» . Архея . 2 (2): 83–93. дои : 10.1155/2006/582916 . ПМК 2686386 . ПМИД 17350929 .
- ^ Фойлнер, Георг (июнь 2012 г.). «Проблема слабого молодого Солнца» . Обзоры геофизики . 50 (2). arXiv : 1204.4449 . Бибкод : 2012RvGeo..50.2006F . дои : 10.1029/2011RG000375 . S2CID 119248267 . Архивировано из оригинала 8 декабря 2023 года . Проверено 8 декабря 2023 г.
- ^ Бада, Дж.Л.; Бигэм, К.; Миллер, С.Л. (15 февраля 1994 г.). «Воздействие таяния замерзших океанов на раннюю Землю: последствия для происхождения жизни» . Труды Национальной академии наук . 91 (4): 1248–1250. Бибкод : 1994PNAS...91.1248B . дои : 10.1073/pnas.91.4.1248 . ПМЦ 43134 . ПМИД 11539550 .
- ^ Моннар, Пьер-Ален; Апель, Чарльз Л.; Канавариоти, Анастасия; Димер, Дэвид В. (июнь 2002 г.). «Влияние ионных неорганических растворов на процессы самосборки и полимеризации, связанные с ранними формами жизни: последствия для пребиотической водной среды» . Астробиология . 2 (2): 139–152. Бибкод : 2002AsBio...2..139M . дои : 10.1089/15311070260192237 . ПМИД 12469365 . Архивировано из оригинала 31 января 2024 года . Проверено 8 декабря 2023 г.
- ^ Аттуотер, Джеймс; Вокнер, Аниела; Холлигер, Филипп (декабрь 2013 г.). «Эволюция рибозимной активности РНК-полимеразы во льду» . Природная химия . 5 (12): 1011–1018. Бибкод : 2013НатЧ...5.1011А . дои : 10.1038/nchem.1781 . ПМК 3920166 . ПМИД 24256864 .
- ^ Леви, Мэтью; Миллер, Стэнли Л.; Бринтон, Карен; Бада, Джеффри Л. (1 июня 2000 г.). «Пребиотический синтез аденина и аминокислот в условиях Европы» . Икар . 145 (2): 609–613. Бибкод : 2000Icar..145..609L . дои : 10.1006/icar.2000.6365 . ПМИД 11543508 .
- ^ Моултон, Винсент; Гарднер, Пол П.; Пойнтон, Роберт Ф.; Кример, Лоуренс К.; Джеймсон, Джеффри Б.; Пенни, Дэвид (1 октября 2000 г.). «Складывание РНК выступает против возникновения жизни с горячим стартом» . Журнал молекулярной эволюции . 51 (4): 416–421. Бибкод : 2000JMolE..51..416M . дои : 10.1007/s002390010104 . ПМИД 11040293 . S2CID 20787323 . Архивировано из оригинала 31 января 2024 года . Проверено 8 декабря 2023 г.
- ^ Земора, Джорджета; Вальдсих, Кристина (ноябрь 2010 г.). «Сворачивание РНК в живых клетках» . Биология РНК . 7 (6): 634–641. дои : 10.4161/rna.7.6.13554 . ПМК 3073324 . ПМИД 21045541 . Архивировано из оригинала 31 января 2024 года . Проверено 8 декабря 2023 г.
- ^ Шрайбер, Ульрих; Локер-Грютен, Оливер; Майер, Кристиан (2012). «Гипотеза: происхождение жизни в глубоких тектонических разломах» . Происхождение жизни и эволюция биосфер . 42 (1): 47–54. Бибкод : 2012OLEB...42...47S . дои : 10.1007/s11084-012-9267-4 . ISSN 0169-6149 . ПМИД 22373604 .
- ^ Шрайбер, Ульрих; Майер, Кристиан; Шмитц, Оливер Дж.; Розендаль, Пиа; Бронха, Амела; Греле, Маркус; Кепплер, Фрэнк; Малдер, Инес; Саттлер, Тобиас; Шёлер, Хайнц Ф. (14 июня 2017 г.). Стюкен, Ева Элизабет (ред.). «Органические соединения во флюидных включениях архейского кварца — аналоги пребиотической химии на ранней Земле» . ПЛОС ОДИН . 12 (6): e0177570. Бибкод : 2017PLoSO..1277570S . дои : 10.1371/journal.pone.0177570 . ISSN 1932-6203 . ПМК 5470662 . ПМИД 28614348 .
- ^ Гроссманн, Йилдиз; Шрайбер, Ульрих; Майер, Кристиан; Шмитц, Оливер Дж. (21 июня 2022 г.). «Алифатические альдегиды в земной коре — остатки пребиотической химии?» . Жизнь . 12 (7): 925. Бибкод : 2022Life...12..925G . дои : 10.3390/life12070925 . ISSN 2075-1729 . ПМЦ 9319801 . ПМИД 35888015 .
- ^ Майер, Кристиан; Шрайбер, Ульрих; Давила, Мария (7 января 2017 г.). «Выбор пребиотических молекул в амфифильных средах» . Жизнь . 7 (1): 3. Бибкод : 2017Жизнь....7....3М . дои : 10.3390/life7010003 . ISSN 2075-1729 . ПМК 5370403 . ПМИД 28067845 .
- ^ Майер, Кристиан; Шрайбер, Ульрих; Давила, Мария Дж. (2015). «Периодическое образование пузырьков в зонах тектонических разломов — идеальный сценарий молекулярной эволюции» . Происхождение жизни и эволюция биосфер . 45 (1–2): 139–148. Бибкод : 2015ОЛЕВ...45..139М . дои : 10.1007/s11084-015-9411-z . ISSN 0169-6149 . ПМЦ 4457167 . ПМИД 25716918 .
- ^ Майер, Кристиан; Шрайбер, Ульрих; Давила, Мария; Шмитц, Оливер; Бронха, Амела; Мейер, Мартин; Кляйн, Джулия; Меккельманн, Свен (24 мая 2018 г.). «Молекулярная эволюция в системе пептид-везикула» . Жизнь . 8 (2): 16. Бибкод : 2018Жизнь....8...16М . дои : 10.3390/life8020016 . ISSN 2075-1729 . ПМК 6027363 . ПМИД 29795023 .
- ^ Jump up to: а б Плассон, Рафаэль; Кондепуди, Дилип К.; Берсини, Хьюз; и др. (август 2007 г.). «Появление гомохиральности в системах, далеких от равновесия: механизмы и роль в химии пребиотиков». Хиральность . 19 (8): 589–600. дои : 10.1002/чир.20440 . ПМИД 17559107 . «Специальный выпуск: материалы восемнадцатого международного симпозиума по хиральности (ISCD-18), Пусан, Корея, 2006 г.»
- ^ Чайчян, Рохас и Туреану, 2014 , стр. 353–364.
- ^ Джафарпур, Фаршид; Бьянкалани, Томмазо; Голденфельд, Найджел (2017). «Вызванное шумом нарушение симметрии вдали от равновесия и возникновение биологической гомохиральности» (PDF) . Физический обзор E . 95 (3): 032407. Бибкод : 2017PhRvE..95c2407J . дои : 10.1103/PhysRevE.95.032407 . ПМИД 28415353 . Архивировано из оригинала 2 апреля 2023 года . Проверено 29 августа 2019 г.
- ^ Джафарпур, Фаршид; Бьянкалани, Томмазо; Голденфельд, Найджел (2015). «Индуцированный шумом механизм биологической гомохиральности саморепликаторов раннего возраста». Письма о физических отзывах . 115 (15): 158101. arXiv : 1507.00044 . Бибкод : 2015PhRvL.115o8101J . doi : 10.1103/PhysRevLett.115.158101 . ПМИД 26550754 . S2CID 9775791 .
- ^ Франк, ФК (1953). «О спонтанном асимметричном синтезе». Биохимика и биофизика Acta . 11 (4): 459–463. дои : 10.1016/0006-3002(53)90082-1 . ПМИД 13105666 .
- ^ Кларк, Стюарт (июль – август 1999 г.). «Поляризованный звездный свет и направленность жизни». Американский учёный . 87 (4): 336. Бибкод : 1999AmSci..87..336C . дои : 10.1511/1999.4.336 . S2CID 221585816 .
- ^ Сибата, Таканори; Мориока, Хироши; Хаясе, Тадакацу; и др. (17 января 1996 г.). «Высокоэнантиоселективное каталитическое асимметричное автоумножение хирального пиримидилового спирта». Журнал Американского химического общества . 118 (2): 471–472. дои : 10.1021/ja953066g .
- ^ Соаи, Кенсо; Сато, Итару; Сибата, Таканори (2001). «Асимметричный автокатализ и происхождение хиральной гомогенности в органических соединениях». Химическая запись . 1 (4): 321–332. дои : 10.1002/tcr.1017 . ПМИД 11893072 .
- ^ Хазен 2005 , с. 184
- ^ Мейеренрих, Уве (2008). Аминокислоты и асимметрия жизни, пойманная в процессе формирования . Берлин: Шпрингер. стр. 76–79. ISBN 978-3-540-76886-9 .
- ^ Маллен, Лесли (5 сентября 2005 г.). «Строим жизнь из звездного материала» . Журнал астробиологии . Архивировано из оригинала 14 июля 2015 года.
{{cite journal}}: CS1 maint: неподходящий URL ( ссылка ) - ^ Рут-Бернштейн, Роберт (23 июня 2010 г.). «Экспериментальный тест связывания L- и D-аминокислот с L- и D-кодонами позволяет предположить, что гомохиральность и направленность кодонов возникли вместе с генетическим кодом» . Симметрия . 2 (2): 1180–1200. Бибкод : 2010Symm....2.1180R . дои : 10.3390/sym2021180 .
Источники
[ редактировать ]- Альтерманн, Владислав (2009). «Введение: дорожная карта к Фата Моргане?». В Зекбахе, Йозеф; Уолш, Мод (ред.). От окаменелостей к астробиологии: записи жизни на Земле и поиск внеземных биосигнатур . Клеточное происхождение, жизнь в экстремальных средах обитания и астробиология. Том. 12. Дордрехт, Нидерланды; Лондон: Спрингер. ISBN 978-1-4020-8836-0 .
- Бада, Джеффри Л .; Ласкано, Антонио (2009). «Происхождение жизни» . В Русе, Майкл ; Трэвис, Джозеф (ред.). Эволюция: первые четыре миллиарда лет . Предисловие Эдварда О. Уилсона . Кембридж: Belknap Press издательства Гарвардского университета . ISBN 978-0-674-03175-3 . OCLC 225874308 .
- Бартон, Николас Х .; Бриггс, Дерек Э.Г .; Эйзен, Джонатан А .; и др. (2007). Эволюция . Колд-Спринг-Харбор, Нью-Йорк: Лабораторное издательство Колд-Спринг-Харбор. ISBN 978-0-87969-684-9 . ОСЛК 86090399 .
- Бастиан, Х. Чарльтон (1871). Способы происхождения низших организмов . Лондон; Нью-Йорк: Макмиллан и компания . OCLC 42959303 . Проверено 6 июня 2015 г.
- Бернал, доктор юридических наук (1951). Физическая основа жизни . Лондон: Рутледж и Кеган Пол.
- Бернал, доктор юридических наук (1960). «Проблема стадий в биопоэзе» . Флоркин М. (ред.). Аспекты происхождения жизни . Международная серия монографий по чистой и прикладной биологии. Оксфорд, Великобритания; Нью-Йорк: Пергамон Пресс . ISBN 978-1-4831-3587-8 .
- Бернал, JD (1967) [Перепечатанная работа А. И. Опарина, первоначально опубликованная в 1924 году; Москва: Московский рабочий . Происхождение жизни . Естественная история Вайденфельда и Николсона. Перевод «Опарина» Энн Синг. Лондон: Вайденфельд и Николсон .
- Бок, Грегори Р.; Гуд, Джейми А., ред. (1996). Эволюция гидротермальных экосистем на Земле (и Марсе?) . Симпозиум Фонда Ciba. Том. 202. Чичестер, Великобритания; Нью-Йорк: Джон Уайли и сыновья . ISBN 978-0-471-96509-1 .
- Бондесон, январь (1999). Русалка Фиджи и другие очерки естественной и неестественной истории . Итака, Нью-Йорк: Издательство Корнельского университета . ISBN 978-0-8014-3609-3 .
- Брайсон, Билл (2004). Краткая история почти всего . Лондон: Черный лебедь . ISBN 978-0-552-99704-1 . OCLC 55589795 .
- Кальвин, Мелвин (1969). Химическая эволюция: молекулярная эволюция на пути к происхождению живых систем на Земле и в других местах . Оксфорд, Великобритания: Clarendon Press . ISBN 978-0-19-855342-7 . OCLC 25220 .
- Чайчян, Масуд; Рохас, Уго Перес; Туряну, Анка (2014). «Физика и жизнь». Основные понятия физики . Конспекты лекций бакалавриата по физике. Берлин; Гейдельберг: Springer Berlin Heidelberg . стр. 353–364. дои : 10.1007/978-3-642-19598-3_12 . ISBN 978-3-642-19597-6 . OCLC 900189038 . S2CID 115247432 .
- Чанг, Томас Минг Сви (2007). Искусственные клетки: биотехнология, наномедицина, регенеративная медицина, кровезаменители, биоинкапсуляция и терапия клетками/стволовыми клетками . Регенеративная медицина, искусственные клетки и наномедицина. Том. 1. Хакенсак, Нью-Джерси: World Scientific . ISBN 978-981-270-576-1 . OCLC 173522612 .
- Далримпл, Дж. Брент (2001). «Возраст Земли в двадцатом веке: проблема (в основном) решена». В Льюисе, CLE; Нелл, С.Дж. (ред.). Возраст Земли: с 4004 г. до н.э. по 2002 г. н.э. Специальное издание Геологического общества. Том. 190. Лондон: Лондонское геологическое общество . стр. 205–221. Бибкод : 2001GSLSP.190..205D . дои : 10.1144/gsl.sp.2001.190.01.14 . ISBN 978-1-86239-093-5 . ОСЛК 48570033 . S2CID 130092094 .
- Дарвин, Чарльз (1887). Дарвин, Фрэнсис (ред.). Жизнь и письма Чарльза Дарвина, включая автобиографическую главу . Том. 3 (3-е изд.). Лондон: Джон Мюррей . OCLC 834491774 .
- Дэвис, Пол (1999). Пятое чудо: поиски происхождения жизни . Лондон: Книги Пингвинов . ISBN 978-0-14-028226-9 .
- Добелл, Клиффорд (1960) [Первоначально опубликовано в 1932 году; Нью-Йорк: Harcourt, Brace & Company ]. Антоний ван Левенгук и его «Маленькие животные» . Нью-Йорк: Dover Publications .
- Дайсон, Фриман (1999). Происхождение жизни (пересмотренная ред.). Кембридж, Великобритания; Нью-Йорк: Издательство Кембриджского университета . ISBN 978-0-521-62668-2 .
- Фесенков, В.Г. (1959). «Некоторые соображения о первобытном состоянии Земли» . В Опарин А.И .; и др. (ред.). Происхождение жизни на Земле . Серия симпозиумов IUB. Том. для Международного союза биохимии 1. Под редакцией Фрэнка Кларка и RLM Synge (англо-французско-немецкое издание). Лондон; Нью-Йорк: Пергамон Пресс . ISBN 978-1-4832-2240-0 . Международный симпозиум по происхождению жизни на Земле (Москва, 19–24 августа 1957 г.)
- Хейзен, Роберт М. (2005). Бытие: научные поиски происхождения жизни . Вашингтон, округ Колумбия: Джозеф Генри Пресс . ISBN 978-0-309-09432-0 . ОСЛК 60321860 .
- Хаксли, Томас Генри (1968) [1897]. «VIII Биогенез и Абиогенез [1870]» . Дискурсы биологические и геологические . Сборник сочинений. Том. VIII (Переиздание). Нью-Йорк: Гринвуд Пресс . OCLC 476737627 . Архивировано из оригинала 7 мая 2015 года . Проверено 19 мая 2014 г.
- Клайце, Бриг (22 января 2001 г.). Кингсли, Стюарт А .; Бхатхал, Рагбир (ред.). Панспермия ставит новые вопросы . Поиски внеземного разума (SETI) в оптическом спектре III . Том. 4273. Беллингем, Вашингтон: SPIE . дои : 10.1117/12.435366 . ISBN 0-8194-3951-7 . Архивировано из оригинала 3 сентября 2013 года . Проверено 9 июня 2015 г. Материалы SPIE состоялись в Сан-Хосе, Калифорния, 22–24 января 2001 г.
- Лейн, Ник (2009). Жизнь по восходящей: 10 великих изобретений эволюции (1-е американское изд.). Нью-Йорк: WW Norton & Company. ISBN 978-0-393-06596-1 . OCLC 286488326 .
- Леннокс, Джеймс Г. (2001). Философия биологии Аристотеля: исследования истоков науки о жизни . Кембриджские исследования по философии и биологии. Кембридж, Великобритания; Нью-Йорк: Издательство Кембриджского университета. ISBN 978-0-521-65976-5 .
- Мишод, Ричард Э. (1999). Дарвиновская динамика: эволюционные переходы в приспособленности и индивидуальности . Принстон, Нью-Джерси: Издательство Принстонского университета . ISBN 978-0-691-02699-2 . OCLC 38948118 .
- Опарин, А.И. (1953) [Первоначально опубликовано в 1938 году; Нью-Йорк: Компания Macmillan ]. Происхождение жизни . Перевод и новое введение Сергия Моргулиса (2-е изд.). Минеола, Нью-Йорк: Dover Publications. ISBN 978-0-486-49522-4 .
- Росс, Александр (1652). Арканы Микрокосма . Том. II. Лондон. OCLC 614453394 . Архивировано из оригинала 24 февраля 2024 года . Проверено 14 июля 2015 г.
- Шелдон, Роберт Б. (22 сентября 2005 г.). «Историческое развитие различия между био- и абиогенезом» (PDF) . В Гувере, Ричард Б .; Левин, Гилберт В .; Розанов Алексей Юрьевич; Гладстон, Дж. Рэндалл (ред.). Астробиология и планетарные миссии . Астробиология и планетарные миссии . Том. 5906. Беллингем, Вашингтон: SPIE. стр. 59061И. дои : 10.1117/12.663480 . ISBN 978-0-8194-5911-4 . Архивировано (PDF) из оригинала 13 апреля 2015 г. Проверено 13 апреля 2015 г. Слушания SPIE состоялись в Сан-Диего, Калифорния, 31 июля – 2 августа 2005 г.
- Тиндаль, Джон (1905) [Первоначально опубликовано в 1871 году; Лондон; Нью-Йорк: Longmans , Green & Co.; Д. Эпплтон и компания ]. Фрагменты науки . Том. 2 (6-е изд.). Нью-Йорк: PF Collier & Sons . OCLC 726998155 .
- Воэт, Дональд ; Фут, Джудит Г. (2004). Биохимия . Том. 1 (3-е изд.). Нью-Йорк: Джон Уайли и сыновья. ISBN 978-0-471-19350-0 .
- Ярус, Майкл (2010). Жизнь из мира РНК: Внутренний предок . Кембридж, Массачусетс: Издательство Гарвардского университета . п. 287. ИСБН 978-0-674-05075-4 .
Внешние ссылки
[ редактировать ]- Прогресс в раскрытии тайн происхождения жизни – Адам Манн ( PNAS ; 14 апреля 2021 г.)
- Исследование истоков жизни. Архивировано 8 апреля 2023 года в Wayback Machine виртуальной выставке в Музее науки (Бостон).
- Как началась жизнь на Земле - Марсия Мэлори (Факты о Земле; 2015)
- Происхождение жизни - Ричард Докинз и др. ( Радио Би-би-си ; 2004)
- Жизнь во Вселенной - эссе Стивена Хокинга (1996)


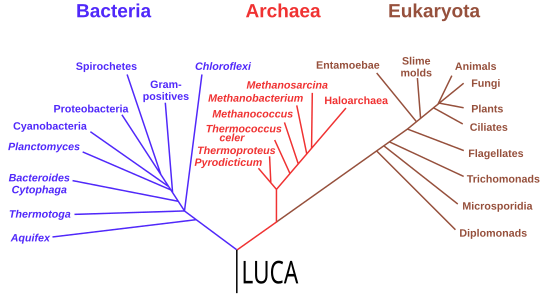
![LUCA systems and environment included the Wood–Ljungdahl pathway.[10]](http://upload.wikimedia.org/wikipedia/commons/thumb/e/ed/LUCA_systems_and_environment.svg/622px-LUCA_systems_and_environment.svg.png)
