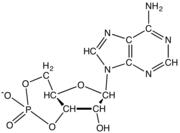
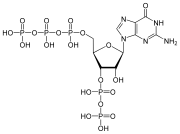
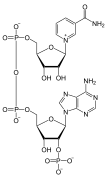
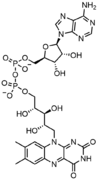
Нуклеотид
| Часть серии о |
| Генетика |
|---|
 |
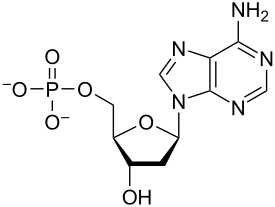
Нуклеотиды – это органические молекулы, состоящие из азотистого основания, пентозного сахара и фосфата . Они служат мономерными единицами нуклеиновых кислот полимеров – дезоксирибонуклеиновой кислоты (ДНК) и рибонуклеиновой кислоты (РНК), которые являются важными биомолекулами во всех формах жизни на Земле . Нуклеотиды поступают с пищей, а также синтезируются печенью из веществ питательных . обычных [1]
Нуклеотиды состоят из трех молекул-субъединиц: азотистого основания , пятиуглеродного сахара ( рибозы или дезоксирибозы ) и фосфатной группы, состоящей из одного-трех фосфатов . Четырьмя азотистыми основаниями в ДНК являются гуанин , аденин , цитозин и тимин ; в РНК урацил вместо тимина используется .
Нуклеотиды также играют центральную роль в метаболизме на фундаментальном клеточном уровне. Они обеспечивают химическую энергию — в форме нуклеозидтрифосфатов , аденозинтрифосфата ( АТФ), гуанозинтрифосфата (ГТФ), цитидинтрифосфата (ЦТФ) и уридинтрифосфата (УТФ) — по всей клетке для многих клеточных функций, требующих энергии. в том числе: синтез аминокислот , белков и клеточных мембран , перемещение клетки и ее частей (как внутри, так и межклеточно), деление клеток и т. д. [2] Кроме того, нуклеотиды участвуют в передаче сигналов в клетке ( циклический гуанозинмонофосфат или цГМФ и циклический аденозинмонофосфат или цАМФ) и включаются в важные кофакторы ферментативных реакций (например, кофермент А , ФАД , ФМН , НАД и НАДФ). + ).
В экспериментальной биохимии нуклеотиды можно пометить радиоактивным изотопом с помощью радионуклидов для получения радионуклеотидов.
5-нуклеотиды также используются в усилителях вкуса в качестве пищевой добавки для улучшения вкуса умами , часто в форме дрожжевого экстракта. [3]
Структура
[ редактировать ]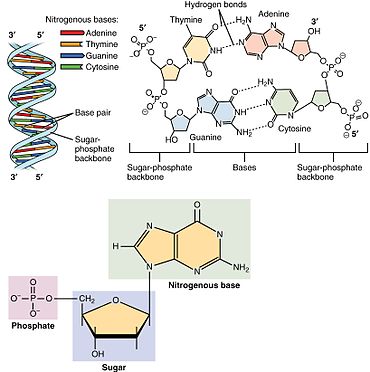
Нуклеотид фосфатной состоит из трех различных химических субъединиц: пятиуглеродной молекулы сахара, нуклеинового основания (два из которых вместе называются нуклеосайдом ) и одной группы . Когда все три соединены, нуклеотид также называют «нуклеозидмонофосфатом » , «нуклеозиддифосфатом » или «нуклеозидтрифосфатом » , в зависимости от того, сколько фосфатов составляют фосфатную группу. [4]
В нуклеиновых кислотах нуклеотиды содержат либо пуриновое , либо пиримидиновое основание, то есть молекулу азотистого основания, также известную как азотистое основание, и называются рибонуклеотидами , если сахар представляет собой рибозу, или дезоксирибонуклеотидами , если сахар представляет собой дезоксирибозу. Отдельные молекулы фосфата периодически соединяют молекулы сахарного кольца в двух соседних нуклеотидных мономерах, тем самым соединяя нуклеотидные мономеры нуклеиновой кислоты конец в конец в длинную цепь. Эти соединения молекул сахара и фосфата образуют «основную» цепь одинарной или двойной спирали . В любой цепи химическая ориентация ( направленность ) соединений цепи проходит от 5'-конца к 3'-концу ( читай : от 5 простых концов к 3 основным концам) – имея в виду пять углеродных участков на молекулы сахара в соседних нуклеотидах. В двойной спирали две цепи ориентированы в противоположных направлениях, что обеспечивает спаривание оснований и комплементарность между парами оснований, что важно для репликации или транскрипции закодированной информации, содержащейся в ДНК. [ нужна ссылка ]
Нуклеиновые кислоты представляют собой полимерные макромолекулы, собранные из нуклеотидов, мономерных единиц нуклеиновых кислот . Пуриновые основания аденин и гуанин и пиримидиновое основание цитозин встречаются как в ДНК, так и в РНК, тогда как пиримидиновые основания тимин (в ДНК) и урацил (в РНК) встречаются только в одном. Аденин образует пару оснований с тимином с двумя водородными связями, а гуанин образует пару оснований с цитозином с тремя водородными связями.
Помимо того, что они являются строительными блоками для построения полимеров нуклеиновых кислот, отдельные нуклеотиды играют роль в хранении и обеспечении клеточной энергии, клеточной передаче сигналов, в качестве источника фосфатных групп, используемых для модуляции активности белков и других сигнальных молекул, а также в качестве ферментативных кофакторов. , часто осуществляя окислительно-восстановительные реакции. Сигнальные циклические нуклеотиды образуются путем двукратного связывания фосфатной группы с одной и той же молекулой сахара , соединяя 5'- и 3'- гидроксильные группы сахара. [2] Некоторые сигнальные нуклеотиды отличаются от стандартной конфигурации с одной фосфатной группой тем, что имеют несколько фосфатных групп, прикрепленных к разным положениям сахара. [5] Нуклеотидные кофакторы включают более широкий спектр химических групп, присоединенных к сахару посредством гликозидной связи , включая никотинамид и флавин , и в последнем случае сахар рибозы является линейным, а не образует кольцо, как в других нуклеотидах.

- цАМФ , сигнальная молекула циклического нуклеотида с одним фосфатом, связанным как с 5-м, так и с 3-м положениями.
- pppGpp , нуклеотидная сигнальная молекула, содержащая как 5'-, так и 3'-фосфаты.
- FAD , динуклеотидный ферментативный кофактор, в котором один из сахаров рибозы имеет линейную конфигурацию, а не кольцевую.
Синтез
[ редактировать ]Нуклеотиды можно синтезировать различными способами как in vitro , так и in vivo . [ нужна ссылка ]
In vitro защитные группы можно использовать при лабораторном производстве нуклеотидов. Очищенный нуклеозид защищают для создания фосфорамидита , который затем можно использовать для получения аналогов, не встречающихся в природе, и/или для синтеза олигонуклеотида . [ нужна ссылка ]
In vivo нуклеотиды могут быть синтезированы de novo или переработаны путем утилизации . [1] Компоненты, используемые в синтезе нуклеотидов de novo, получены из биосинтетических предшественников метаболизма углеводов и аминокислот , а также из аммиака и диоксида углерода. Недавно также было продемонстрировано, что клеточный метаболизм бикарбоната может регулироваться с помощью передачи сигналов mTORC1. [6] Печень является основным органом синтеза всех четырех нуклеотидов de novo. Синтез пиримидинов и пуринов de novo происходит двумя разными путями. Пиримидины синтезируются сначала из аспартата и карбамоилфосфата в цитоплазме до общей кольцевой структуры-предшественника оротовой кислоты, с которой ковалентно связана фосфорилированная рибозильная единица. Однако пурины сначала синтезируются из сахарной матрицы, на которой происходит синтез кольца. Для справки: синтез пуриновых и пиримидиновых нуклеотидов осуществляется несколькими ферментами в цитоплазме клетки, а не внутри конкретной органеллы . Нуклеотиды подвергаются расщеплению, поэтому полезные части можно повторно использовать в реакциях синтеза для создания новых нуклеотидов. [ нужна ссылка ]
Синтез пиримидинрибонуклеотидов
[ редактировать ]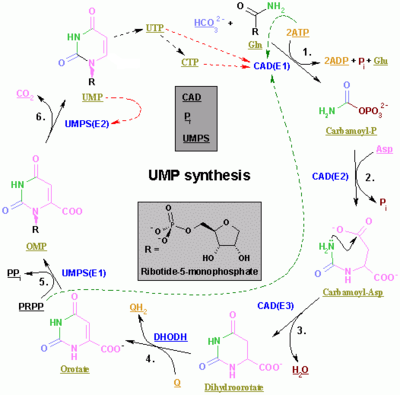
Синтез пиримидинов ЦТФ и УТФ происходит в цитоплазме и начинается с образования карбамоилфосфата из глутамина и СО 2 . Затем аспартаткарбамоилтрансфераза катализирует реакцию конденсации между аспартатом и карбамоилфосфатом с образованием карбамоиласпарагиновой кислоты , которая циклизуется в 4,5-дигидрооротовую кислоту под действием дигидрооротазы . Последний превращается в оротат под действием дигидрооротатоксидазы . Чистая реакция:
- ( S )-Дигидрооротат + O 2 → Оротат + H 2 O 2
Оротат ковалентно связан с фосфорилированной рибозильной единицей. Ковалентная связь между рибозой и пиримидином происходит в положении C 1. [7] рибозного 1 звена, содержащего пирофосфат , и N пиримидинового кольца. Оротатфосфорибозилтрансфераза (PRPP трансфераза) катализирует конечную реакцию с образованием оротидинмонофосфата (OMP):
- Оротат + 5-Фосфо-α-D-рибозо-1-дифосфат (PRPP) → Оротидин-5'-фосфат + Пирофосфат
Оротидин-5'-монофосфат декарбоксилируется оротидин-5'-фосфатдекарбоксилазой с образованием уридинмонофосфата (UMP). Трансфераза PRPP катализирует реакции как рибозилирования, так и декарбоксилирования, образуя UMP из оротовой кислоты в присутствии PRPP. Именно из UMP происходят другие пиримидиновые нуклеотиды. UMP фосфорилируется двумя киназами до уридинтрифосфата (UTP) посредством двух последовательных реакций с АТФ. Сначала образуется дифосфат из УДФ, который, в свою очередь, фосфорилируется до УТФ. Оба этапа подпитываются гидролизом АТФ:
- АТФ + УМП → АДФ + UDP
- UDP + АТФ → UTP + АДФ
CTP впоследствии образуется путем аминирования UTP под действием каталитической активности CTP-синтетазы . Глютамин является донором NH 3 , и реакция также подпитывается гидролизом АТФ:
- УТФ + Глутамин + АТФ + Н 2 О → ЦТФ + АДФ + Ф i
Цитидинмонофосфат (ЦМП) получается из цитидинтрифосфата (ЦТФ) с последующей потерей двух фосфатов. [8] [9]
Синтез пуриновых рибонуклеотидов
[ редактировать ]Атомы, которые используются для построения пуриновых нуклеотидов, происходят из разных источников:

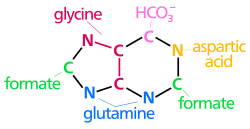 | Биосинтетическое пуринового кольца происхождение атомов N 1 возникает из аминной группы Asp C 2 и C 8 происходят из формиата N 3 и N 9 представлены амидной группой Gln. C 4 , C 5 и N 7 происходят из Gly C 6 происходит от HCO 3 − (СО 2 ) |
Синтез de novo пуриновых нуклеотидов , с помощью которого эти предшественники включаются в пуриновое кольцо, происходит по 10-ступенчатому пути к промежуточному соединению точки ветвления IMP , нуклеотиду основания гипоксантина . AMP и GMP впоследствии синтезируются из этого промежуточного продукта отдельными двухэтапными путями. Таким образом, пуриновые фрагменты первоначально образуются как часть рибонуклеотидов, а не как свободные основания .
В синтезе ИМФ принимают участие шесть ферментов. Три из них многофункциональные:
Путь начинается с образования PRPP . PRPS1 - это фермент , который активирует R5P , который образуется в основном по пентозофосфатному пути , в PRPP путем реакции его с АТФ . Реакция необычна тем, что пирофосфорильная группа напрямую переносится от АТФ к C 1 R5P и что продукт имеет α- конфигурацию относительно C1. Эта реакция также является общей для путей синтеза Trp , His и пиримидиновых нуклеотидов . Поскольку эта реакция находится на главном метаболическом перекрестке и требует много энергии, она строго регулируется.
В первой реакции, уникальной для биосинтеза пуриновых нуклеотидов, PPAT катализирует замещение пирофосфатной группы PRPP (PP i ) амидным азотом, полученным из глутамина (N), глицина (N&C), аспартата (N), фолиевой кислоты (C 1 ). , или CO 2 . Это важный шаг в синтезе пуринов. Реакция протекает с инверсией конфигурации рибозы С 1 , в результате чего образуется β- 5 -фосфорибозиламин (5-ПРА) и устанавливается аномерная форма будущего нуклеотида.
Далее в результате гидролиза АТФ включается глицин, и карбоксильная группа образует аминную связь с ранее введенным NH 2 . одноуглеродное звено кофермента N 10 Затем к аминогруппе замещенного глицина присоединяется фолиевой кислоты -формил-ТГФ с последующим замыканием имидазольного кольца. Затем вторая группа NH 2 переносится от глутамина к первому атому углерода глициновой единицы. Одновременно добавляется карбоксилирование второго атома углерода глициновой единицы. Этот новый углерод модифицируется добавлением третьего звена NH 2 , на этот раз перенесенного из аспартатного остатка. Наконец, к азотистой группе добавляется второе одноуглеродное звено формил-ТГФ, и кольцо ковалентно замыкается с образованием общего предшественника пурина инозинмонофосфата (ИМФ).
Инозинмонофосфат превращается в аденозинмонофосфат в два этапа. Во-первых, гидролиз GTP способствует присоединению аспартата к IMP с помощью аденилсукцинатсинтазы, заменяя азот карбонильным кислородом и образуя промежуточный аденилосукцинат. Затем фумарат отщепляется с образованием аденозинмонофосфата. Этот этап катализируется аденилосукцинатлиазой.
Инозинмонофосфат превращается в гуанозинмонофосфат путем окисления ИМФ с образованием ксантилата с последующим присоединением аминогруппы к С2 . НАД + является акцептором электронов в реакции окисления. Перенос амидной группы от глутамина происходит за счет гидролиза АТФ.
Распад пиримидинов и пуринов
[ редактировать ]У человека пиримидиновые кольца (C, T, U) могут полностью разлагаться до CO 2 и NH 3 (выведение мочевины). При этом пуриновые кольца (G, A) не могут. Вместо этого они разлагаются до метаболически инертной мочевой кислоты , которая затем выводится из организма. Мочевая кислота образуется при расщеплении ГМФ на основные гуанин и рибозу. Гуанин дезаминируется до ксантина, который, в свою очередь, окисляется до мочевой кислоты. Последняя реакция необратима. Аналогичным образом, мочевая кислота может образовываться при дезаминировании АМФ до ИМФ, из которого удаляется рибозная единица с образованием гипоксантина. Гипоксантин окисляется до ксантина и, наконец, до мочевой кислоты. Вместо секреции мочевой кислоты гуанин и ИМФ могут использоваться для целей рециркуляции и синтеза нуклеиновых кислот в присутствии PRPP и аспартата (донора NH 3 ). [ нужна ссылка ]
Пребиотический синтез нуклеотидов
[ редактировать ]Теории о происхождении жизни требуют знания химических путей, которые позволяют формировать ключевые строительные блоки жизни в вероятных пребиотических условиях. Гипотеза мира РНК утверждает, что в первичном бульоне существовали свободно плавающие рибонуклеотиды — фундаментальные молекулы, которые последовательно соединяются, образуя РНК . Сложные молекулы, такие как РНК, должны были возникнуть из небольших молекул, реакционная способность которых определялась физико-химическими процессами. РНК состоит из пуриновых и пиримидиновых нуклеотидов, оба из которых необходимы для надежной передачи информации и, следовательно, для дарвиновской эволюции . Беккер и др. показали, как пиримидиновые нуклеозиды могут быть синтезированы из небольших молекул и рибозы исключительно за счет циклов влажно-сухого состояния. [10] Пуриновые нуклеозиды могут быть синтезированы аналогичным путем. 5'-моно- и дифосфаты также избирательно образуются из фосфатсодержащих минералов, что позволяет одновременно образовывать полирибонуклеотиды как с пуриновыми, так и с пиримидиновыми основаниями. Таким образом, можно создать сеть реакций на пуриновые и пиримидиновые строительные блоки РНК, начиная с простых атмосферных или вулканических молекул. [10]
Неестественная пара оснований (UBP)
[ редактировать ]Неестественная пара оснований (UBP) — это спроектированная субъединица (или азотистое основание ) ДНК , созданная в лаборатории и не встречающаяся в природе. [11] Примеры включают d5SICS и dNaM . Эти искусственные нуклеотиды, несущие гидрофобные азотистые основания , имеют два слитых ароматических кольца , которые образуют комплекс (d5SICS – dNaM) или пару оснований в ДНК. [12] [13] E. coli была вынуждена реплицировать плазмиду, содержащую UBP, в нескольких поколениях. [14] Это первый известный пример передачи живым организмом расширенного генетического кода последующим поколениям. [12] [15]
Медицинское применение синтетических нуклеотидов
[ редактировать ]Применение синтетических нуклеотидов широко варьируется и включает диагностику заболеваний, лечение или точную медицину.
- Противовирусные или антиретровирусные средства: несколько производных нуклеотидов использовались для лечения гепатита и ВИЧ . [16] [17] Примеры прямых нуклеозидных аналогов ингибиторов обратной транскриптазы ( НИОТ ) включают тенофовир дизопроксил , тенофовир алафенамид и софосбувир . С другой стороны, такие агенты, как Мерицитабин , Ламивудин , Энтекавир и Телбивудин, должны сначала пройти метаболизацию посредством фосфорилирования, чтобы активироваться.
- Антисмысловые олигонуклеотиды (АСО) : синтетические олигонуклеотиды используются при лечении редких наследственных заболеваний, поскольку они могут связывать специфические транскрипты РНК и в конечном итоге модулировать экспрессию белка. Спинальная мышечная атрофия , боковой амиотрофический склероз , гомозиготная семейная гиперхолестеринемия и первичная гипероксалурия 1 типа поддаются терапии на основе АСО. [18] Применение олигонуклеотидов — это новый рубеж в точной медицине и лечении неизлечимых состояний.
- Синтетическая направляющая РНК (гРНК) : синтетические нуклеотиды можно использовать для создания гРНК , которые необходимы для правильного функционирования технологий редактирования генов, таких как CRISPR-Cas9 .
Единица длины
[ редактировать ]Нуклеотид (сокращенно «нт») — это общепринятая единица длины одноцепочечных нуклеиновых кислот, аналогично тому, как пара оснований является единицей длины двухцепочечных нуклеиновых кислот. [19]
Коды сокращений для вырожденных оснований
[ редактировать ]IUPAC . обозначил символы для нуклеотидов [20] Помимо пяти оснований (A, G, C, T/U), часто используются вырожденные основания, особенно для создания праймеров для ПЦР . Эти нуклеотидные коды перечислены здесь. Некоторые последовательности праймеров могут также включать символ «I», который кодирует нестандартный нуклеотид инозин . Инозин встречается в тРНК и образует пару с аденином, цитозином или тимином. Однако этот символ не фигурирует в следующей таблице, поскольку он не представляет собой вырождение. Хотя инозин может выполнять ту же функцию, что и вырождение «D», это настоящий нуклеотид, а не смесь нуклеотидов, охватывающая каждую возможную необходимую пару.
| Символ [20] | Описание | Представленные базы | ||||
|---|---|---|---|---|---|---|
| А | Денин | А | 1 | |||
| С | цитозин | С | ||||
| Г | г уанин | Г | ||||
| Т | т химин | Т | ||||
| В | ты расовый | В | ||||
| В | слабый | А | Т | 2 | ||
| С | сильный | С | Г | |||
| М | а мино | А | С | |||
| К | к это | Г | Т | |||
| Р | чистота | А | Г | |||
| И | пи римидин | С | Т | |||
| Б | не А ( Б идет после А) | С | Г | Т | 3 | |
| Д | не C ( D идет после C) | А | Г | Т | ||
| ЧАС | не G ( H идет после G) | А | С | Т | ||
| V | не T ( V идет после T и U) | А | С | Г | ||
| Н | любая база ( не пробел) | А | С | Г | Т | 4 |
См. также
[ редактировать ]- Биология
- хромосома
- Ген
- Генетика
- Аналог нуклеиновой кислоты - соединение, аналогичное встречающимся в природе РНК и ДНК.
- Последовательность нуклеиновой кислоты - последовательность нуклеотидов в нуклеиновой кислоте.
- Нуклеобазы – азотсодержащие биологические соединения, образующие нуклеозиды.
Ссылки
[ редактировать ]- ^ Jump up to: а б Захаревиц Д.В., Андерсон Л.В., Малиновский Н.М., Хайман Р., Стронг Дж.М., Цисик Р.Л. (ноябрь 1992 г.). «Вклад синтеза de novo и спасения в пул урациловых нуклеотидов в тканях и опухолях мышей in vivo» . Европейский журнал биохимии . 210 (1): 293–6. дои : 10.1111/j.1432-1033.1992.tb17420.x . ПМИД 1446677 .
- ^ Jump up to: а б Альбертс Б., Джонсон А., Льюис Дж., Рафф М., Робертс К. и Уолтер П. (2002). Молекулярная биология клетки (4-е изд.). Гирляндная наука. ISBN 0-8153-3218-1 . стр. 120–121.
- ^ Абд Эль-Алим Ф.С., Тахер М.С., Лотфи С.Н., Эль-Массири К.Ф., Фадель Х.Х. (18 декабря 2017 г.). «Влияние экстрагированных 5-нуклеотидов на ароматические соединения и вкусовую приемлемость настоящего говяжьего супа» . Международный журнал пищевых свойств . 20 (sup1): S1182–S1194. дои : 10.1080/10942912.2017.1286506 . S2CID 100497537 .
- ^ Уайли (9 сентября 2005 г.). Энциклопедия наук о жизни (1-е изд.). Уайли. дои : 10.1002/9780470015902.a0001333.pub3 . ISBN 978-0-470-01617-6 .
- ^ Смит А.Д., изд. (2000). Оксфордский словарь биохимии и молекулярной биологии (пересмотренная редакция). Оксфорд: Издательство Оксфордского университета. п. 460.
- ^ Али Э., Липонска А., О'Хара Б., Амичи Д., Торно М., Гао П. и др. (июнь 2022 г.). «Ось mTORC1-SLC4A7 стимулирует импорт бикарбоната для усиления синтеза нуклеотидов de novo» . Молекулярная клетка . 82 (1): 3284–3298.e7. doi : 10.1016/j.molcel.2022.06.008 . ПМЦ 9444906 . ПМИД 35772404 .
- ^ см . в номенклатуре органической химии ИЮПАК. Подробную информацию о нумерации углеродных остатков
- ^ Джонс М.Э. (1980). «Биосинтез пиримидиннуклеотидов у животных: гены, ферменты и регуляция биосинтеза UMP». Ежегодный обзор биохимии . 49 (1): 253–79. дои : 10.1146/annurev.bi.49.070180.001345 . ПМИД 6105839 .
- ^ Макмерри Дж. Э., Бегли Т. П. (2005). Органическая химия биологических путей . Робертс и компания. ISBN 978-0-9747077-1-6 .
- ^ Jump up to: а б Беккер С., Фельдманн Дж., Видеманн С., Окамура Х., Шнайдер С., Иван К. и др. (октябрь 2019 г.). «Единый пребиотически возможный синтез пиримидиновых и пуриновых РНК-рибонуклеотидов». Наука . 366 (6461): 76–82. Бибкод : 2019Sci...366...76B . дои : 10.1126/science.aax2747 . ПМИД 31604305 . S2CID 203719976 .
- ^ Малышев Д.А., Дхами К., Куах Х.Т., Лавернь Т., Ордуханян П., Торкамани А. и др. (июль 2012 г.). «Эффективная и независимая от последовательности репликация ДНК, содержащей третью пару оснований, создает функциональный шестибуквенный генетический алфавит» . Труды Национальной академии наук Соединенных Штатов Америки . 109 (30): 12005–10. Бибкод : 2012PNAS..10912005M . дои : 10.1073/pnas.1205176109 . ПМК 3409741 . ПМИД 22773812 .
- ^ Jump up to: а б Малышев Д.А., Дхами К., Лавернь Т., Чен Т., Дай Н., Фостер Дж.М. и др. (май 2014 г.). «Полусинтетический организм с расширенным генетическим алфавитом» . Природа . 509 (7500): 385–8. Бибкод : 2014Natur.509..385M . дои : 10.1038/nature13314 . ПМК 4058825 . ПМИД 24805238 .
- ^ Каллауэй Э (7 мая 2014 г.). «Ученые создали первый живой организм с «искусственной» ДНК» . Новости природы . Хаффингтон Пост . Проверено 8 мая 2014 г.
- ^ Файкс Би Джей (8 мая 2014 г.). «Жизнь создана с использованием расширенного генетического кода» . Сан-Диего Юнион Трибьюн . Проверено 8 мая 2014 г.
- ^ Образец I (7 мая 2014 г.). «Первые формы жизни, передавшие искусственную ДНК, созданную американскими учеными» . Хранитель . Проверено 8 мая 2014 г.
- ^ Рамеш Д., Виджаякумар Б.Г., Каннан Т. (декабрь 2020 г.). «Терапевтический потенциал урацила и его производных в борьбе с патогенными и физиологическими нарушениями». Европейский журнал медицинской химии . 207 : 112801. doi : 10.1016/j.ejmech.2020.112801 . ПМИД 32927231 . S2CID 221724578 .
- ^ Рамеш Д., Виджаякумар Б.Г., Каннан Т. (май 2021 г.). «Достижения в области нуклеозидов и аналогов нуклеотидов в борьбе с инфекциями, вызванными вирусом иммунодефицита человека и вирусом гепатита» . ХимМедХим . 16 (9): 1403–1419. дои : 10.1002/cmdc.202000849 . ПМИД 33427377 . S2CID 231576801 . Архивировано из оригинала 14 декабря 2021 года . Проверено 13 марта 2021 г.
- ^ Лауффер MC, ван Роон-Мом W, Аартсма-Рус A (январь 2024 г.). «Возможности и ограничения терапии антисмысловыми олигонуклеотидами для лечения моногенных заболеваний» . Коммуникационная медицина . 4 (1): 6. дои : 10.1038/s43856-023-00419-1 . ПМК 10770028 . ПМИД 38182878 .
- ^ «Словарь биологических терминов: nt» . ГенСкрипт . Проверено 31 июля 2023 г.
- ^ Jump up to: а б Номенклатурный комитет Международного биохимического союза (NC-IUB) (1984). «Номенклатура не полностью определенных оснований в последовательностях нуклеиновых кислот» . Проверено 4 февраля 2008 г.
Дальнейшее чтение
[ редактировать ]- Сигель А., Operschall BP, Сигель Х. (2017). «Глава 11. Комплексообразование свинца(II) с нуклеотидами и их составляющими». В Астрид С., Хельмут С., Сигел Р.К. (ред.). Свинец: его влияние на окружающую среду и здоровье . Ионы металлов в науках о жизни. Том. 17. де Грюйтер. стр. 319–402. дои : 10.1515/9783110434330-011 . ISBN 9783110434330 . ПМИД 28731304 .
- Фрейзингер Э., Сигель Р.К. (июль 2007 г.). «От нуклеотидов к рибозимам — сравнение их свойств связывания ионов металлов» (PDF) . Обзоры координационной химии . 251 (13–14): 1834–1851. дои : 10.1016/j.ccr.2007.03.008 .
- Комиссия IUPAC-IUB по биохимической номенклатуре (CBN) (14 февраля 1971 г.). «Сокращения и символы нуклеиновых кислот, полинуклеотидов и их составляющих». Журнал молекулярной биологии . 55 (3): 299–310. дои : 10.1016/0022-2836(71)90319-6 . ПМИД 5551389 .
- Фавр Х.А., Пауэлл У.Х., ред. (2014). «Глава P-10 Родительские структуры натуральных продуктов и родственных соединений» (PDF) . Номенклатура органической химии: Рекомендации ИЮПАК и предпочтительные названия 2013 . Кембридж: Royal Soc. химии. ISBN 978-0-85404-182-4 .
- Бендер Х, изд. (2003). «Нуклеотидная структура» . Общественный колледж Клакамаса . Архивировано из оригинала 1 сентября 2006 г. Проверено 21 апреля 2020 г.