Гуманизированное антитело
Гуманизированные антитела — это антитела нечеловеческих видов, белковые последовательности которых были модифицированы для увеличения их сходства с вариантами антител, естественным образом вырабатываемыми у человека. [ 1 ] [ 2 ] Процесс «гуманизации» обычно применяется к моноклональным антителам, разработанным для введения людям (например, антителам, разработанным в качестве противораковых препаратов). Гуманизация может быть необходима, когда процесс разработки специфического антитела включает генерацию в иммунной системе, отличной от человека (например, у мышей). Белковые последовательности антител, полученных таким способом, частично отличаются от гомологичных антител, встречающихся в природе у людей, и поэтому потенциально иммуногенны при введении пациентам-людям (см. также Человеческие антимышиные антитела ). Международные непатентованные названия гуманизированных антител заканчиваются на -зумаб , как и омализумаб (см. Номенклатуру моноклональных антител ).
Гуманизированные антитела отличаются от химерных антител . Белковые последовательности последних также более похожи на человеческие антитела, но содержат больший участок нечеловеческого белка.
Существуют и другие способы разработки моноклональных антител. Этот список охватывает многие моноклональные соединения, разработанные для использования на людях.
Использование рекомбинантной ДНК в процессе гуманизации
[ редактировать ]Процесс гуманизации использует тот факт, что производство моноклональных антител может быть осуществлено с использованием рекомбинантной ДНК для создания конструкций. [ 3 ] способны к экспрессии в млекопитающих культуре клеток . То есть сегменты генов, способные продуцировать антитела, выделяются и клонируются в клетки, которые можно выращивать в биореакторе, так что белки антител, продуцируемые из ДНК клонированных генов, можно собирать в массовом порядке . Этап с использованием рекомбинантной ДНК обеспечивает точку вмешательства, которую можно легко использовать для изменения белковой последовательности экспрессируемого антитела. Таким образом, все изменения в структуре антител, достигаемые в процессе гуманизации, осуществляются с помощью методов на уровне ДНК. Не все методы получения антител, предназначенных для терапии человека, требуют стадии гуманизации (например, фагового дисплея ), но по существу все они зависят от методов, которые аналогичным образом позволяют «вставлять» или «заменять» части молекулы антитела.
Отличие от «химерного антитела».
[ редактировать ]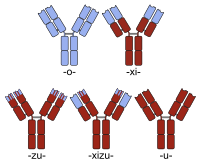
Гуманизацию обычно рассматривают как отличие от создания химеры антител мыши и человека . Таким образом, хотя создание химеры антитела обычно предпринимается для получения антитела, более похожего на человеческое (путем замены константной области мышиного антитела на человеческое), простые химеры этого типа обычно не называют гуманизированными. Скорее, белковая последовательность гуманизированного антитела по существу идентична последовательности человеческого варианта, несмотря на нечеловеческое происхождение некоторых сегментов его области, определяющей комплементарность (CDR), ответственных за способность антитела связываться с его целевым антигеном. .
Названия химерных антител содержат основу -xi- . Примеры химерных антител, одобренных для терапии у людей, включают абциксимаб (ReoPro), базиликсимаб (Simulect), цетуксимаб (Erbitux), инфликсимаб (Remicade) и ритуксимаб (MabThera). Есть также несколько примеров химерных препаратов, которые в настоящее время проходят клинические испытания (например, бавитуксимаб , в сортируемом списке дополнительные примеры см. ).
Гуманизация через химерное промежуточное соединение
[ редактировать ]Процесс гуманизации может также включать в себя создание химеры человек-мышь в качестве начального шага. В этом случае вариабельная область мыши соединяется с константной областью человека. Затем химера может быть дополнительно гуманизирована путем избирательного изменения последовательности аминокислот в вариабельной области молекулы.
Процесс изменения должен быть «избирательным», чтобы сохранить специфичность, для которой антитело было первоначально разработано. То есть, поскольку части CDR вариабельной области необходимы для способности антитела связываться с намеченной мишенью, аминокислоты в этих частях не могут быть изменены без риска подорвать цель разработки. Помимо сегментов CDR, части вариабельных областей, которые отличаются от таковых у человека, можно исправить путем замены соответствующих отдельных аминокислот. Это достигается на уровне ДНК посредством мутагенеза .
Именование гуманизированных химер включает основу обоих обозначений ( -xi- + -zu- ). Отеликсизумаб является примером гуманизированной химеры, которая в настоящее время проходит клинические испытания для лечения ревматоидного артрита и сахарного диабета . [ 4 ]
Гуманизация путем внедрения соответствующих CDR в «каркас» человеческих антител.
[ редактировать ]Можно получить гуманизированное антитело без создания химерного промежуточного продукта. «Прямое» создание гуманизированного антитела может быть осуществлено путем вставки соответствующих сегментов, кодирующих CDR (так называемый «донор», ответственный за желаемые свойства связывания) в «каркас» человеческого антитела (так называемый «акцептор»). Как обсуждалось выше, это достигается с помощью методов рекомбинантной ДНК с использованием соответствующего вектора. [ 3 ] и экспрессия в клетках млекопитающих. То есть после того, как антитело будет получено с желаемыми свойствами у мыши (или другого человека, не являющегося человеком), ДНК, кодирующая это антитело, может быть выделена, клонирована в вектор и секвенирована (или ДНК может быть секвенирована непосредственно с использованием одного -клеточные методы). Затем можно определить последовательность ДНК, соответствующую CDR антитела. Как только станет известна точная последовательность желаемых CDR, можно разработать стратегию соответствующей вставки этих последовательностей в конструкцию, содержащую ДНК для варианта человеческого антитела. [ 5 ] [ 6 ] [ 7 ] [ 8 ] [ 9 ] Эта стратегия может также использовать синтез линейных фрагментов ДНК на основе считывания последовательностей CDR. Для этого процесса требуется программное обеспечение для компьютерного моделирования, чтобы определить, какие из аминокислот антитела могут быть изменены с мышиной последовательности на человеческую последовательность без изменений, ставящих под угрозу конформацию сайта связывания. В США это программное обеспечение было разработано, запатентовано и продемонстрировано компанией Protein Design Labs, Inc. в Маунтин-Вью, Калифорния, в 1980-х и 1990-х годах. [ 10 ]
Алемтузумаб является ранним примером антитела, гуманизация которого не включала химерное промежуточное соединение. В этом случае был разработан моноклональный препарат, получивший название «Campath-1», для связывания CD52 с использованием мышиной системы. Гипервариабельные петли Campath-1 (которые содержат его CDR и тем самым придают ему способность связывать CD52) затем были извлечены и вставлены в каркас человеческого антитела. [ 1 ] Алемтузумаб одобрен для лечения В-клеточного хронического лимфоцитарного лейкоза [ 11 ] и в настоящее время проходит клинические испытания при ряде других заболеваний, включая рассеянный склероз . [ 12 ]
Получение из источников, отличных от мышей
[ редактировать ]Существуют технологии, которые полностью исключают использование мышей или других млекопитающих, кроме человека, в процессе поиска антител для терапии человека. Примеры таких систем включают различные методы «дисплея» (в первую очередь фаговый дисплей ), а также методы, которые используют повышенные уровни B-клеток, которые возникают во время иммунного ответа человека.
Методы отображения
[ редактировать ]В них используются селективные принципы производства специфических антител, но используются микроорганизмы (как при фаговом дисплее ) или даже бесклеточные экстракты (как при рибосомном дисплее ). Эти системы основаны на создании «библиотек» генов антител , которые могут быть полностью получены из человеческой РНК, выделенной из периферической крови . Непосредственными продуктами этих систем являются фрагменты антител, обычно Fab или scFv .
Это означает, что хотя фрагменты антител, созданные с помощью методов отображения, имеют полностью человеческую последовательность, они не являются полноценными антителами. Таким образом, процессы, по сути идентичные гуманизации, используются для включения и экспрессии полученных аффинностей в полном антителе.
Адалимумаб (Хумира) является примером антитела, одобренного для терапии человека и созданного с помощью фагового дисплея. [ 13 ] [ 14 ]
Антитела от пациентов-людей или получателей вакцины
[ редактировать ]Можно использовать иммунную реакцию человека для открытия моноклональных антител. Проще говоря, иммунный ответ человека работает так же, как у мыши или другого млекопитающего, не являющегося человеком. Таким образом, люди, испытывающие угрозу своей иммунной системе, например, инфекционное заболевание, рак или вакцинация, являются потенциальным источником моноклональных антител, направленных на эту проблему. Этот подход кажется особенно подходящим для разработки противовирусной терапии, основанной на принципах пассивного иммунитета . Варианты этого подхода были продемонстрированы в принципе. [ 15 ] а некоторые находят путь к коммерческому развитию. [ 16 ]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Перейти обратно: а б Рихманн Л., Кларк М., Вальдманн Х., Винтер Дж. (1988). «Изменение человеческих антител для терапии» . Природа . 332 (6162): 323–7. Бибкод : 1988Natur.332..323R . дои : 10.1038/332323a0 . ПМИД 3127726 . S2CID 4335569 .
- ^ Куин С, Шнайдер В.П., Селик Х.Э., Пейн П.В., Ландольфи Н.Ф., Дункан Дж.Ф., Авдалович Н.М., Левитт М., Юнгханс Р.П., Вальдманн Т.А. (декабрь 1989 г.). «Гуманизированное антитело, которое связывается с рецептором интерлейкина 2» . Proc Natl Acad Sci США . 86 (24): 10029–33. Бибкод : 1989PNAS...8610029Q . дои : 10.1073/pnas.86.24.10029 . ПМК 298637 . ПМИД 2513570 . (Это ранний пример использования термина «гуманизированное антитело».)
- ^ Перейти обратно: а б Нордерхауг Л., Олафсен Т., Михаэльсен Т.Е., Сэндли И. (май 1997 г.). «Универсальные векторы для временной и стабильной экспрессии молекул рекомбинантных антител в клетках млекопитающих». J Иммуноловые методы . 204 (1): 77–87. дои : 10.1016/S0022-1759(97)00034-3 . ПМИД 9202712 .
- ^ Список страниц клинических исследований отельиксизумаба
- ^ Кашмири С.В., Де Паскалис Р., Гонсалес Н.Р., Шлом Дж. (май 2005 г.). «Прививка SDR - новый подход к гуманизации антител». Методы . 36 (1): 25–34. дои : 10.1016/j.ymeth.2005.01.003 . ПМИД 15848072 .
- ^ Хоу С, Ли Б, Ван Л, Цянь В, Чжан Д, Хун Х, Ван Х, Го Ю (июль 2008 г.). «Гуманизация моноклонального антитела против CD34 путем прививки области, определяющей комплементарность, на основе компьютерного молекулярного моделирования». Дж. Биохим . 144 (1): 115–20. дои : 10.1093/jb/mvn052 . ПМИД 18424812 .
- ^ Чжан, И-Фань; Хо, Митчелл (26 сентября 2016 г.). «Гуманизация высокоаффинных антител, нацеленных на глипикан-3 при гепатоцеллюлярной карциноме» . Научные отчеты . 6 : 33878. дои : 10.1038/srep33878 . ISSN 2045-2322 . ПМК 5036187 . ПМИД 27667400 .
- ^ Чжан, И-Фань; Хо, Митчелл (апрель 2017 г.). «Гуманизация кроличьих моноклональных антител посредством прививки комбинированных областей, определяющих комплементарность Kabat/IMGT/Paratome: обоснование и примеры» . МАБ . 9 (3): 419–429. дои : 10.1080/19420862.2017.1289302 . ISSN 1942-0870 . ПМЦ 5384799 . ПМИД 28165915 .
- ^ Чжан, И-Фань; Солнце, Япин; Хонг, Джессика; Хо, Митчелл (январь 2023 г.). «Гуманизация однодоменного антитела Shark VNAR с использованием прививки CDR» . Текущие протоколы . 3 (1): е630. дои : 10.1002/cpz1.630 . ISSN 2691-1299 . ПМЦ 9813873 . ПМИД 36594750 .
- ^ Флетчер, Технология mAb L. PDL находит правильное время. Nat Biotechnol 19, 395–396 (2001). https://doi.org/10.1038/88010
- ^ Запись в DrugBank об алемтузумабе
- ^ Страницы клинических испытаний алемтузумаба.
- ^ Кемпени Дж. (ноябрь 1999 г.). «Предварительные результаты ранних клинических испытаний полностью человеческого моноклонального антитела D2E7 против TNF-альфа» . Энн Реум Дис . 58 (Приложение 1): I70–2. дои : 10.1136/ard.58.2008.i70 . ПМК 1766582 . ПМИД 10577977 .
- ^ Рау Р. (ноябрь 2002 г.). «Адалимумаб (полностью человеческое моноклональное антитело против фактора некроза опухоли альфа) в лечении активного ревматоидного артрита: первоначальные результаты пяти исследований» . Энн Реум Дис . 61 (Приложение 2): 70–3. дои : 10.1136/ard.61.suppl_2.ii70 . ПМЦ 1766697 . ПМИД 12379628 .
- ^ Стейси Дж. Э., Каусмалли Л., Симонсен Б., Нордгард С.Х., Алсе Л., Михаэльсен Т.Э., Брекке О.Г. (декабрь 2003 г.). «Прямое выделение рекомбинантных человеческих антител против Neisseria meningitidis группы B из библиотек экспрессии scFv». J Иммуноловые методы . 283 (1–2): 247–59. дои : 10.1016/j.jim.2003.09.015 . ПМИД 14659916 .
- ^ http://www.theraclone-sciences.com/pdf/Theraclone_ISTAR.pdf. Архивировано 3 марта 2016 г. в Wayback Machine. Пример метода с использованием пациентов-людей в качестве источника моноклональных антител.