PD-L1
| CD274 | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | CD274 , B7-H, B7H1, PD-L1, PDCD1L1, PDCD1LG1, PDL1, CD274 молекула, запрограммированная лиганд гибели клеток 1, HPD-L1 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | Омим : 605402 ; MGI : 1926446 ; Гомологен : 8560 ; GeneCards : CD274 ; OMA : CD274 - Ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Викидид | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Запрограммированная лиганда смерти 1 (PD-L1), также известная как кластер дифференцировки 274 (CD274) или B7-гомолога 1 (B7-H1), является белком , который у людей кодируется CD274 геном . [ 5 ]
Запрограммированная смерть-лиганда 1 (PD-L1) представляет собой трансмембранное белок типа 1 40 кДа , который, как предполагается, играет важную роль в подавлении адаптивного подразделения иммунной системы во время конкретных событий, таких как беременность , тканевые аллотрансплантаты , аутоиммунные заболевания и другие заболевания. такие как гепатит . Обычно адаптивная иммунная система реагирует на антигены , которые связаны с активацией иммунной системы с помощью экзогенных или эндогенных сигналов опасности . В свою очередь, клональное расширение антиген -специфических CD8+ T -клеток и/или CD4+ Helper -клеток распространяется. Связывание PD-L1 с ингибирующей молекулой контрольной точки PD-1 передает ингибирующий сигнал, основанный на взаимодействии с фосфатазами ( SHP-1 или SHP-2 ) посредством мотива переключателя на основе тирозина иммунорецептора (ITSM). [ 6 ] Это уменьшает пролиферацию антиген-специфических Т-клеток в лимфатических узлах, одновременно снижая апоптоз в регуляторных Т-клетках (противовоспалительные, подавляющие Т-клетки), что еще больше опосредовано более низкой регуляцией гена BCL-2 . [ Цитация необходима ] Полем PD-L1 экспрессируется как в гематопоэтических , так и в негематопоэтических клетках в тканях. Тем не менее, точная роль PD-L1 в гематопоэтических и негематопоэтических клетках в модуляции иммунных ответов неясна. [ 7 ]
История
[ редактировать ]PD-L1, также известный как B7-H1, был охарактеризован в клинике Майо в 1999 году как молекула иммунной регуляции. [ 8 ] В то время был сделан вывод, что B7-H1 помогает опухолевым клеткам уклоняться от антиопухолевого иммунитета. [ 9 ] В 2003 году было показано, что B7-H1 экспрессируется на миелоидных клетках в качестве белка контрольной точки и был предложен в качестве потенциальной мишени при иммунотерапии рака в клинике человека. [ 10 ]
Связывание
[ редактировать ]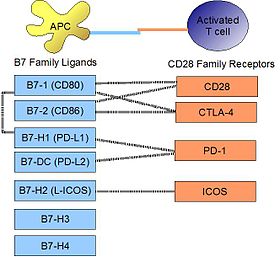
PD-L1 связывается с его рецептором, PD-1 , обнаруженным на активированных Т-клетках, В-клетках и миелоидных клетках, для модуляции активации или ингибирования. Сродство между PD-L1 и PD-1, как определено константой диссоциации K D , составляет 770 нм . PD-L1 также имеет заметное сродство к костимуляторной молекуле CD80 (B7-1), но не CD86 (B7-2). [ 11 ] Аффинность CD80 к PD-L1, 1,4 мкм, является промежуточным между его аффинностью к CD28 и CTLA-4 (4,0 мкм и 400 нм соответственно). Связанная молекула PD-L2 не имеет такой сродства к CD80 или CD86, но имеет PD-1 в качестве рецептора (с более сильным K D 140 нм). Сказал и соавт. показал, что PD-1, активированный на активированных CD4-Т-клетках, может связываться с PD-L1, экспрессируемым на моноцитах, и индуцирует выработку IL-10 последним. [ 12 ]
Сигнализация
[ редактировать ]Вовлечение PD-L1 с его рецептором PD-1 на Т-клетках обеспечивает сигнал, который ингибирует TCR -опосредованную активацию продукции IL-2 и пролиферации Т-клеток. Механизм включает ингибирование фосфорилирования ZAP70 и его связь с CD3ζ . [ 13 ] Передача сигналов PD-1 ослабляет PKC-θ фосфорилирование активации (возникающее в результате передачи сигналов TCR), необходимого для активации факторов транскрипции NF-κB и AP-1 , а также для производства IL-2. Связывание PD-L1 с PD-1 также способствует индуцированной лиганд-индуцированной модуляции TCR во время представления антигена в наивных Т-клетках , индуцируя повышенную регуляцию убиквитиновой лигазы E3 CBL-B . [ 14 ]
Регулирование
[ редактировать ]Интерферонами
[ редактировать ]При стимуляции IFN-γ PD-L1 экспрессируется на Т-клетках, NK-клетках, макрофагах, миелоидных DC , В-клетках, эпителиальных клетках и эндотелиальных клетках сосудов . [ 15 ] PD-L1 Область промотора гена имеет элемент ответа на IRF-1 , регуляторный фактор интерферона . [ 16 ] Интерфероны типа I могут также активировать PD-L1 на мышиных гепатоцитах, моноцитах, DC и опухолевых клетках. [ 17 ]
На макрофагах и моноцитах
[ редактировать ]PD-L1 заметно экспрессируется на макрофагах . У мыши было показано, что классически активированные макрофаги (индуцированные вспомогательными Т-клетками I типа или комбинация LPS и интерферон-гамма ) значительно активируют PD-L1. [ 18 ] Альтернативно, макрофаги, активируемые IL-4 (альтернативные макрофаги), слегка активируют PD-L1, одновременно активируя PD-L2. Это было показано, что STAT1 мыши с дефицитом , нокаутированные , что STAT1 в основном ответственен за активацию PD-L1 на макрофагах LPS или интерферон-гамма, но вовсе не несет ответственности за его конститутивную экспрессию до активации у этих мышей. Также было показано, что PD-L1 конституционно экспрессируется на мыши LY6C это Неклассические моноциты в устойчивом состоянии. [ 19 ]
Роль микроРНК
[ редактировать ]Укаживающиеся человеческие холангиоциты экспрессируют мРНК PD-L1 , но не белок, из-за трансляционного подавления микроРНК MIR-513. [ 20 ] После лечения интерфероном-гамма miR-513 понижали, тем самым поднимая подавление белка PD-L1. Таким образом, интерферон-гамма может индуцировать экспрессию белка PD-L1, ингибируя опосредованную геном подавление трансляции мРНК. , что вирусный вирусный (LMP1) вирусный (EBV мембранный мембранный белок-1 ) является известным мощным индуктором PD-L1, фрагмент miRNA miRNA miRNA-bamh1 h вправо . Принимая во внимание Регулировать индуцированную LMP1 экспрессию PD-L1. [ 21 ]
Эпигенетическая регуляция
[ редактировать ]ПД-L1 Промотор ДНК метилирование может предсказать выживаемость при некоторых видах рака после операции. [ 22 ]
Клиническое значение
[ редактировать ]Рак
[ редактировать ]
Показано, что PD-L1 высоко экспрессируется при различных злокачественных новообразованиях, особенно рак легких. Чтобы предвидеть эффективность генной терапии или системной иммунотерапии при блокировании контрольных точек PD-1 и PD-L1, PD-L1 может использоваться в качестве прогностического маркера и мишени для противоракового иммунитета. [ 23 ] Т.е. повышение регуляции PD-L1 может позволить раку уклоняться от иммунной системы хозяина. Например, анализ 196 образцов опухолей у пациентов с почечным раком карциномы показал, что высокая экспрессия опухоли PD-L1 была связана с повышенной агрессивностью опухоли и повышенным риском смерти в 4,5 раза. [ 24 ] В модели клеток лейкоза A20 , введенных в мышей F1, NK-клетки убивали гранки опухолевые клетки с аналогичной эффективностью независимо от экспрессии PD-L1, тогда как экспрессия PD-L1 на опухолевых клетках A2 коал-ингибирующего рецептора PD-1 в модуляции их цитотоксической активности. [ 25 ]
Многие ингибиторы PD-L1 находятся в разработке в качестве иммуноонкологической терапии и показывают хорошие результаты в клинических испытаниях. [ 26 ] Клинически доступные примеры включают дрвалумаб , атезолизумаб и авелумаб . [ 27 ] В нормальной ткани обратная связь между факторами транскрипции, такими как STAT3 и NF-κB, ограничивает иммунный ответ для защиты ткани хозяина и ограничить воспаление. При раке потеря обратной связи между факторами транскрипции может привести к повышению локальной экспрессии PD-L1, что может ограничить эффективность системного лечения агентами, нацеленными на PD-L1. [ 28 ] Автомобиль [ 29 ] и NK -клетки [ 30 ] Нацеливание PD-L1 оценивается на лечение рака. Выражения PSTAT-1 и PDL-1 также сильно коррелируют при раке простаты. [ 31 ]
Повышенная регуляция PD-L1 на иммунных клетках (особенно миелоидных клетках) также может привести к образованию иммуносупрессивной среды высоко локализованным образом, что также позволяет раковым клеткам пролиферировать. [ 32 ]
Анализ PD-L1 в TNBC необходим для выбора пациентов, имеющих право на иммунотерапию. Было обнаружено, что соглашение между патологами между наблюдателями и внутриодернизметистом между патологами является существенным. Случаи вокруг 1% отсечки являются специально сложными. [ 33 ]
Listeria monocytogenes
[ редактировать ]На мышиной модели внутриклеточной инфекции L. Monocytogenes индуцировали экспрессию белка PD-L1 в Т-клетках, NK-клетках и макрофагах. Блокада PD-L1 (с использованием блокирующих антител) привела к повышению смертности для инфицированных мышей. Блокада снижала выработку TNFα и оксида азота макрофагами, снижала продукцию гранзима B с помощью NK-клеток и снижала пролиферацию L. monocytogenes антиген-специфические CD8 T-клетки (но не CD4 T-клетки). [ 34 ] Эти данные свидетельствуют о том, что PD-L1 действует как положительная костимуляторная молекула при внутриклеточной инфекции.
Аутоиммунитет
[ редактировать ]Считается, что взаимодействие PD-1/PD-L1 играет роль в предотвращении разрушительного аутоиммунитета, особенно во время воспалительных условий. Лучший пример-в желудке, где экспрессия PD-1 защищает гастрин, экспрессирующие G-клетки из иммунной системы во время Helicobacter Pylori . воспаления [ 35 ] Но также и различные преклинические исследования подтверждают представление о том, что взаимодействие PD-1/PD-L1 связано с аутоиммунитетом. NOD MICE , модель животных для аутоиммунитета, которая проявляет восприимчивость к спонтанному развитию диабета I типа и других аутоиммунных заболеваний, было показано, что развивается ускоренное начало диабета из блокады PD-1 или PD-L1 (но не PD-L2) PD-L2) Полем [ 36 ]
У людей было обнаружено, что PD-L1 имеет измененную экспрессию у педиатрических пациентов с системной волчанкой эритематозу (SLE). Изучение изолированного PBMC у здоровых детей, незрелых миелоидных дендритных клеток и моноцитов экспрессировали небольшую PD-L1 при начальной изоляции, но спонтанно повышали PD-L1 на 24 часа. Напротив, как MDC, так и моноциты от пациентов с активным SLE не смогли повысить регуляцию PD-L1 в течение 5-дневного временного курса, экспрессируя этот белок только во время ремиссии заболевания. [ 37 ] Это может быть один механизм, посредством которого периферическая толерантность теряется в СКВ.
Смотрите также
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а беременный в GRCH38: Ensembl Release 89: ENSG00000120217 - ENSEMBL , май 2017 г.
- ^ Jump up to: а беременный в GRCM38: Ensembl Release 89: Ensmusg00000016496 - Ensembl , май 2017 г.
- ^ «Человеческая PubMed ссылка:» . Национальный центр информации о биотехнологии, Национальная медицина США .
- ^ «Мышь Pubmed ссылка:» . Национальный центр информации о биотехнологии, Национальная медицина США .
- ^ «Ген Entrez: CD274 CD274 молекула» .
- ^ Chemnitz JM, Parry RV, Nichols Ke, June Ch, Riley JL (июль 2004 г.). «SHP-1 и SHP-2 связываются с иммунорецептором тирозином мотива программированной смерти 1 при первичной стимуляции Т-клеток человека, но только перевязывание рецепторов предотвращает активацию Т-клеток» . Журнал иммунологии . 173 (2): 945–954. doi : 10.4049/jimmunol.173.2.945 . PMID 15240681 .
- ^ Мюллер С.Н., Вангури В.К., Ха С.Дж., Уэст Э.Е., Кейр М.Е., Гликман Дж.Н. и др. (Июль 2010). «PD-L1 обладает различными функциями в гематопоэтических и негематопоэтических клетках в регуляции реакций Т-клеток во время хронической инфекции у мышей» . Журнал клинических исследований . 120 (7): 2508–2515. doi : 10.1172/jci40040 . PMC 2898584 . PMID 20551512 .
- ^ Донг Х, Чжу Г., Тамада К, Чен Л (декабрь 1999 г.). «B7-H1, третий член семейства B7, совместно стимулирует пролиферацию Т-клеток и секрецию интерлейкина-10». Природная медицина . 5 (12): 1365–1369. doi : 10.1038/70932 . PMID 10581077 . S2CID 21397460 .
- ^ Dong H, Strome SE, Salomao DR, Tamura H, Hirano F, Flies DB, et al. (Август 2002). «Ассоциированный опухоль B7-H1 способствует апоптозу Т-клеток: потенциальный механизм уклонения от иммунитета». Природная медицина . 8 (8): 793–800. doi : 10.1038/nm730 . PMID 12091876 . S2CID 27694471 .
- ^ Curiel TJ, Wei S, Dong H, Alvarez X, Cheng P, Mottram P, et al. (Май 2003 г.). «Блокада B7-H1 улучшает миелоидную дендритную клеточную, опосредованную противоопухолевым иммунитетом». Природная медицина . 9 (5): 562–567. doi : 10.1038/nm863 . PMID 12704383 . S2CID 12499214 .
- ^ Butte MJ, Peña-Cruz V, Kim MJ, Freeman GJ, Sharpe AH (август 2008 г.). «Взаимодействие человека PD-L1 и B7-1» . Молекулярная иммунология . 45 (13): 3567–3572. doi : 10.1016/j.molimm.2008.05.014 . PMC 3764616 . PMID 18585785 .
- ^ Сказал EA, Dupuy FP, Trautmann L, Zhang Y, Shi Y, El-Far M, et al. (Апрель 2010). «Программированная производство интерлейкина-10, индуцированное DEATH-1 с помощью моноцитов, нарушает активацию CD4+ Т-клеток во время ВИЧ-инфекции» . Природная медицина . 16 (4): 452–459. doi : 10.1038/nm.2106 . PMC 4229134 . PMID 20208540 .
- ^ Шеппард К.А., Фитц Л.Дж., Ли Дж. М., Бенандер С., Джордж Дж.А., Вутерс Дж. И др. (Сентябрь 2004 г.). «PD-1 ингибирует T-клеточный рецептор, индуцированное фосфорилированием сигнальной сигнала ZAP70/CD3ZETA и передачи сигналов нижней части PKCTHETA». Письма Febs . 574 (1–3): 37–41. Bibcode : 2004febsl.574 ... 37S . doi : 10.1016/j.febslet.2004.07.083 . PMID 15358536 . S2CID 85034305 .
- ^ Karwacz K, Bricogne C, Macdonald D, Arce F, Bennett CL, Collins M, et al. (Октябрь 2011). «Костимуляция PD-L1 способствует модуляции рецептора Т-клеток, индуцированной лиганд, на CD8+ T-клетках» . Эмбо Молекулярная медицина . 3 (10): 581–592. doi : 10.1002/emmm.201100165 . PMC 3191120 . PMID 21739608 .
- ^ Мухи Д.Б., Чен Л (апрель 2007 г.). «Новые B7S: сыграть ключевую роль в иммунитете опухоли». Журнал иммунотерапии . 30 (3): 251–260. doi : 10.1097/cji.0b013e31802e085a . PMID 17414316 .
- ^ Lee SJ, Jang BC, Lee SW, Yang Yi, Suh Si, Park YM, et al. (Февраль 2006 г.). «Регуляторный фактор-1 интерферона 1 является обязательным условием для конститутивной экспрессии и индуцированной IFN-гамма активации B7-H1 (CD274)» . Письма Febs . 580 (3): 755–762. Bibcode : 2006 Febsl.580..755L . doi : 10.1016/j.febslet.2005.12.093 . PMID 16413538 . S2CID 11169726 .
- ^ Yamazaki T, Akba H, Iwai H, Matsuda H, Aoki M, Tanno Y, et al. (Ноябрь 2002). «Экспрессия запрограммированной смерти 1 лиганды Т -клетками мурина и АПК » Журнал иммунологии 169 (10): 5538–5545. Doi : 10.4049/ jimmmunol.169.10.5 12421930PMID
- ^ Локе П., Эллисон Дж.П. (апрель 2003 г.). «PD-L1 и PD-L2 дифференциально регулируются клетками TH1 и TH2» . Труды Национальной академии наук Соединенных Штатов Америки . 100 (9): 5336–5341. Bibcode : 2003pnas..100.5336L . doi : 10.1073/pnas.0931259100 . PMC 154346 . PMID 12697896 .
- ^ Bianchini M, Duchêne J, Santovito D, Schloss MJ, Evrard M, Winkels H, et al. (Июнь 2019). «Экспрессия PD-L1 на неклассических моноцитах выявляет их происхождение и иммунорегуляторную функцию» . Научная иммунология . 4 (36): EAAR3054. doi : 10.1126/sciimmunol.aar3054 . PMID 31227596 . S2CID 195259881 .
- ^ Gong AY, Zhou R, Hu G, Li X, Splinter PL, O'hara SP, et al. (Февраль 2009 г.). «Microrna-513 регулирует трансляцию B7-H1 и участвует в индуцированной IFN-гамма экспрессии B7-H1 в холангиоцитах» . Журнал иммунологии . 182 (3): 1325–1333. doi : 10.4049/jimmunol.182.3.1325 . PMC 2652126 . PMID 19155478 .
- ^ Кристино А.С., Нурс Дж., Вест Р.А., Сабдия М.Б., Лоу С.К., Гунавардана Дж. И др. (Декабрь 2019). «EBV Microrna-BHRF1-2-5P нацелен на 3'UTR иммунных контрольных точек лигандов PD-L1 и PD-L2» . Кровь . 134 (25): 2261–2270. doi : 10.1182/blood.2019000889 . PMC 6923667 . PMID 31856276 .
- ^ Gevensleben H, Holmes EE, Goltz D, Dietrich J, Sailer V, Ellinger J, et al. (Ноябрь 2016). «Метилирование промотора PD-L1 является прогностическим биомаркером для выживаемости без биохимического рецидивов у пациентов с раком простаты после радикальной простатэктомии» . Oncotarget . 7 (48): 79943–79955. doi : 10.18632/oncotarget.13161 . PMC 5346762 . PMID 27835597 .
- ^ Razaghi A, Mansouri L, Brodin O, Björnstedt M, Lundahl J (2022-06-02). «Растворимый экспрессия PD-L1 после внутривенного введения лечения раковых больных с селенитом в клинических исследованиях I фазы» . Границы в онкологии . 12 : 906134. DOI : 10.3389/fonc.2022.906134 . PMC 9203154 . PMID 35720000 .
- ^ Thompson RH, Gillett MD, Cheville JC, Lohse CM, Dong H, Webster WS, et al. (Декабрь 2004 г.). «Костимуляторный B7-H1 у пациентов с карциномой почечного рака: показатель агрессивности опухоли и потенциальной терапевтической мишени» . Труды Национальной академии наук Соединенных Штатов Америки . 101 (49): 17174–17179. Bibcode : 2004pnas..10117174T . doi : 10.1073/pnas.0406351101 . PMC 534606 . PMID 15569934 .
- ^ Del Rio ML, Perez-Simon JA, Rodriguez-Barbosa Ji (2022-06-20). «Дифференциальное приживление родительских клеток A20 PD-L1 WT и PD-L1 KO лейкоза у полуаллогенных реципиентов в контексте взаимодействия PD-L1/PD-1 и NK-опосредованной гибридной резистентности» . Границы в иммунологии . 13 : 887348. DOI : 10.3389/fimmu.2022.887348 . PMC 9251058 . PMID 35795681 .
- ^ Velcheti V, Schalper KA, Carvajal DE, Anagnostou VK, Syrigos KN, Sznol M, et al. (Январь 2014). «Запрограммированная экспрессия смерти лиганд-1 при немелкоклеточном раке легких» . Лабораторное расследование; Журнал технических методов и патологии . 94 (1): 107–116. doi : 10.1038/labinvest.2013.130 . PMC 6125250 . PMID 24217091 .
- ^ «Иммунные ингибиторы контрольно -пропускного пункта для лечения рака» . www.cancer.org . Получено 2017-03-27 .
- ^ Vlahopoulos SA (август 2017 г.). «Аберрантный контроль NF-κB при раке позволяет транскрипционной и фенотипической пластичности, ограничивает зависимость от ткани хозяина: молекулярная мода» . Биология рака и медицина . 14 (3): 254–270. doi : 10.20892/j.issn.2095-3941.2017.0029 . PMC 5570602 . PMID 28884042 .
- ^ Xie YJ, Dougan M, Jailhhani N, Ingram J, Fang T, Kummer L, et al. (Апрель 2019). «Т-клетки на основе нанободий, которые нацелены на микроокружение опухоли, ингибируют рост твердых опухолей у иммунокомпетентных мышей» . Труды Национальной академии наук Соединенных Штатов Америки . 116 (16): 7624–7631. Bibcode : 2019pnas..116.7624x . doi : 10.1073/pnas.1817147116 . PMC 6475367 . PMID 30936321 .
- ^ Fabian KP, Padget MR, Donahue RN, Solocinski K, Robbins Y, Allen CT, et al. (Май 2020). «Клетки PD-L1, нацеленные на высокоаффинные NK (T-HANC), индуцируют прямые противоопухолевые эффекты и популяции MDSC подавляющих мишеней» . Журнал для иммунотерапии рака . 8 (1): E000450. doi : 10.1136/jitc-2019-000450 . PMC 7247398 . PMID 32439799 .
- ^ Казан О., Кир Г., Калпан М., Сесикоглу Г.Е., Атис Г, Йилдирим А (июль 2022 г.). «Связь между PI3K, Jak/Stat-путями с экспрессией PDL-1 при раке простаты». Andrologia . 54 (E14541): E14541. doi : 10.1111/и.14541 . PMID 35880672 . S2CID 251068796 .
- ^ Nirmal AJ, Maliga Z, Vallius T, Quattrochi B, Chen AA, Jacobson CA, et al. (Июнь 2022 г.). «Пространственный ландшафт прогрессирования и иммуноэдиназии при первичной меланоме при разрешении с одним клетками» . Открытие рака . 12 (6): 1518–1541. doi : 10.1158/2159-8290.CD-21-1357 . PMC 9167783 . PMID 35404441 . S2CID 248083925 .
- ^ Zaakouk, M.; Ван Бокстал, М.; Galant, C.; Callagy, G.; Provenzano, E.; Охота, Р.; Д'Арриго, C.; Badr, NM; О'Салливан, Б.; Starczynski, J.; Tanchel, B.; Mir, y.; Льюис, П.; Shaaban, AM Inter- и Intra-observer Соглашение PD-L1 SP142, оценка карциномы молочной железы-крупное мультиинституциональное международное исследование. Раковые заболевания 2023, 15, 1511. https://doi.org/10.3390/cancers15051511
- ^ Seo SK, Jeong HY, Park SG, Lee SW, Choi IW, Chen L, et al. (Январь 2008 г.). «Блокада эндогенной B7-H1 подавляет антибактериальную защиту после первичной инфекции Listeria Monocytogenes» . Иммунология . 123 (1): 90–99. doi : 10.1111/j.1365-2567.2007.02708.x . PMC 2433284 . PMID 17971153 .
- ^ Mommersteeg MC, Yu BT, Van Den Bosch TP, Von Der Thüsen JH, Kuipers EJ, Doukas M, et al. (Октябрь 2022). «Конститутивный запрограммированный экспрессия смерти 1 защищает желудочные G-клетки от Helicobacter pylor-индуцированного воспаления» . Helicobacter . 27 (5): E12917. doi : 10.1111/hel.12917 . PMC 9542424 . PMID 35899973 .
- ^ Ansari MJ, Salama AD, Chitnis T, Smith RN, Yagita H, Akiba H, et al. (Июль 2003 г.). «Программированный путь Death-1 (PD-1) регулирует аутоиммунный диабет у мышей без ожирения (NOD)» . Журнал экспериментальной медицины . 198 (1): 63–69. doi : 10.1084/jem.20022125 . PMC 2196083 . PMID 12847137 .
- ^ Мозаффарян Н., Видеман А.Е., Стивенс А.М. (сентябрь 2008 г.). «Активная системная волчанка эритематозу связана с неспособностью антиген-презентативных клеток экспрессировать запрограммированный лиганд-1 смерти» . Ревматология . 47 (9): 1335–1341. doi : 10.1093/ревматология/ken256 . PMC 2722808 . PMID 18650228 .
Внешние ссылки
[ редактировать ]- CD274+белок,+человек в Национальной библиотеке медицины Медицинской библиотеки США (Mesh)
- Обзор всей структурной информации, доступной в PDB для Uniprot : Q9NZQ7 (запрограммированная гибель клеток 1 лиганд 1) в PDBE-KB .



