Креатинкиназа
| Креатинкиназа | |||
|---|---|---|---|
 | |||
| Идентификаторы | |||
| Номер ЕС. | 2.7.3.2 | ||
| Номер CAS. | 9001-15-4 | ||
| Базы данных | |||
| ИнтЭнк | вид IntEnz | ||
| БРЕНДА | БРЕНДА запись | ||
| Экспаси | Просмотр NiceZyme | ||
| КЕГГ | КЕГГ запись | ||
| МетаЦик | метаболический путь | ||
| ПРЯМОЙ | профиль | ||
| PDB Структуры | RCSB PDB PDBe PDBsum | ||
| Генная онтология | АмиГО / QuickGO | ||
| |||
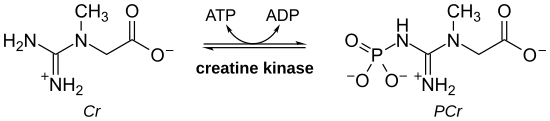
Креатинкиназа ( CK ), также известная как креатинфосфокиназа ( CPK ) или фосфокреатинкиназа , представляет собой фермент ( EC 2.7.3.2 ), экспрессируемый различными тканями и типами клеток. СК катализирует превращение креатина и использует аденозинтрифосфат (АТФ) для создания фосфокреатина (ФКр) и аденозиндифосфата (АДФ). Эта ферментативная реакция CK обратима, и, таким образом, АТФ может образовываться из PCr и ADP.
В тканях и клетках, которые быстро потребляют АТФ, особенно скелетных мышцах , а также в головном мозге, фоторецепторных клетках сетчатки в , волосковых клетках внутреннего уха , сперматозоидах и гладких мышцах , ПЦР служит энергетическим резервуаром для быстрой буферизации и регенерации АТФ в организме. situ , а также для внутриклеточного транспорта энергии с помощью челнока или цепи PCr. [ 2 ] Таким образом, креатинкиназа является важным ферментом в таких тканях. [ 3 ]
Клинически креатинкиназа оценивается в анализах крови как маркер повреждения тканей, богатых ЦК, например, при инфаркте миокарда (сердечный приступ), рабдомиолизе (тяжелом распаде мышц), мышечной дистрофии , аутоиммунных миозитах и остром повреждении почек . [ 4 ]
Типы
[ редактировать ]В клетках цитозольные ферменты ЦК состоят из двух субъединиц, которые могут быть либо В (мозгового типа), либо М (мышечного типа). Таким образом, существует три разных изофермента : CK-MM, CK-BB и CK-MB. Гены этих субъединиц расположены на разных хромосомах : B на 14q32 и M на 19q13. В дополнение к этим трем цитозольным изоформам ЦК существуют два изофермента митохондриальной креатинкиназы: повсеместная форма и саркомерная форма. Функциональной единицей митохондриальных изоформ ЦК является октамер, состоящий из четырех димеров каждый. [ 5 ]
В то время как митохондриальная креатинкиназа непосредственно участвует в образовании фосфокреатина из митохондриального АТФ, цитозольный СК регенерирует АТФ из АДФ с помощью ПЦР. Это происходит во внутриклеточных участках, где АТФ используется в клетке, при этом ЦК действует как регенератор АТФ in situ .
| ген | белок |
|---|---|
| ЦКБ | креатинкиназа, мозг, BB-CK |
| КБЕ | креатинкиназа, эктопическая экспрессия |
| СКМ | креатинкиназа, мышцы, MM-CK |
| СКМТ1А , СКМТ1Б | креатинкиназа митохондриальной 1; вездесущий МТК; или ты МТК |
| СКМТ2 | митохондриальная креатинкиназа 2; саркомерный мтСК; или s mtck |
Паттерны изоферментов различаются в тканях. Скелетные мышцы экспрессируют CK-MM (98%) и низкие уровни CK-MB (1%). Миокард . (сердечная мышца), напротив, экспрессирует CK-MM в 70% и CK-MB в 25–30% CK-BB преимущественно экспрессируется в мозге и гладких мышцах, включая сосудистую ткань и ткань матки.
Структура белка
[ редактировать ]Первой структурой креатинкиназы, определенной с помощью рентгеновской кристаллографии белка, была структура октамерной саркомерной митохондриальной CK мышечного типа (s-mtCK) в 1996 году. [ 6 ] за которым последовала структура повсеместного митохондриального CK (u-mtCK) в 2000 году. [ 7 ] [ 8 ] Атомная структура бананообразного димерного цитозольного цитозольного мозгового типа BB-CK была расшифрована в 1999 году с разрешением 1,4 Å . [ 9 ] Цитозольный BB-CK, а также MM-CK мышечного типа образуют симметричные димеры банановой формы с одним каталитическим активным центром в каждой субъединице. [ 10 ]
Функции
[ редактировать ]Митохондриальная креатинкиназа (CK m ) присутствует в межмембранном пространстве митохондрий , где она регенерирует фосфокреатин (PCr) из митохондриально генерируемого АТФ и креатина (Cr), импортируемого из цитозоля . Помимо двух митохондриальных изоферментных форм ЦК, то есть повсеместно встречающегося мтКК (присутствующего в немышечных тканях) и саркомерного мтКК (присутствующего в саркомерных мышцах), в цитозоле присутствуют три цитозольные изоформы ЦК, в зависимости от ткани. В то время как MM-CK экспрессируется в саркомерных мышцах, то есть в скелетных и сердечных мышцах, MB-CK экспрессируется в сердечной мышце, а BB-CK экспрессируется в гладких мышцах и в большинстве немышечных тканей.
Митохондриальные мтКК и цитозольные КК соединены в так называемый PCr/Cr-челночный или контур. ПЦР, генерируемый мтКК в митохондриях, переносится в цитозольную ЦК, которая связана с АТФ-зависимыми процессами, например АТФазами, такими как актомиозиновая АТФаза и кальциевая АТФаза, участвующие в сокращении мышц, и натрий/калиевая АТФаза, участвующая в задержке натрия в почках. Связанная цитозольная CK принимает PCr, проходящий через клетку, и использует ADP для регенерации АТФ, которая затем может использоваться АТФазами в качестве источника энергии (CK тесно связана с АТФазами, образуя функционально связанный микрокомпартмент ). PCr является не только энергетическим буфером, но и формой клеточного транспорта энергии между субклеточными участками производства энергии (АТФ) (митохондрии и гликолиз) и местами использования энергии (АТФазы). [ 2 ]
Таким образом, КК усиливает сократимость скелетных, сердечных и гладких мышц и участвует в формировании артериального давления . [ 11 ] Кроме того, действие креатинкиназы по улавливанию АДФ связано с нарушениями свертываемости крови : люди с высоким уровнем КФК в плазме могут быть склонны к сильным кровотечениям. [ 12 ]
Лабораторные испытания
[ редактировать ]| Сывороточная креатинкиназа | |
|---|---|
| Референсный диапазон | 60 и 400 МЕ/л |
| Цель | Обнаружение повреждений мышц . [ 13 ] |
| Тест | Количество креатинкиназы в крови. [ 13 ] |
КК часто определяется в плановом порядке в медицинской лаборатории . Раньше его определяли специально у пациентов с болью в груди для распознавания острого инфаркта миокарда, но сейчас этот тест в значительной степени заменен тропонином . Нормальные значения в состоянии покоя обычно составляют от 60 до 400 МЕ/ л . [ 14 ] где одна единица представляет собой активность фермента , точнее количество фермента, которое будет катализировать 1 мкмоль субстрата в минуту при определенных условиях (температура, pH, концентрации субстрата и активаторов). [ 15 ] ) Этот тест не специфичен для типа повышенного уровня КФК.
Уровень креатинкиназы в крови может быть высоким как у здоровых, так и при болезнях. Физические упражнения увеличивают отток креатинкиназы в кровоток на срок до недели, и это наиболее распространенная причина высокого уровня КК в крови. [ 16 ] Более того, высокий уровень КК в крови может быть связан с высоким уровнем внутриклеточного КК, например, у лиц африканского происхождения. [ 17 ]
Наконец, высокий уровень КК в крови может быть признаком повреждения тканей, богатых КК, например, при рабдомиолизе , инфаркте миокарда , миозите и миокардите . Это означает, что уровень креатинкиназы в крови может повышаться при широком спектре клинических состояний, включая прием таких лекарств, как статины ; эндокринные расстройства, такие как гипотиреоз ; [ 18 ] и заболевания и расстройства скелетных мышц, включая злокачественную гипертермию , [ 19 ] и злокачественный нейролептический синдром . [ 20 ]
Более того, определение изоферментов в прошлом широко использовалось в качестве индикатора повреждения миокарда при сердечных приступах. Измерение тропонина в значительной степени заменило это измерение во многих больницах, хотя некоторые центры по-прежнему полагаются на CK-MB.

Номенклатура
[ редактировать ]Этот фермент часто упоминается в медицинской литературе под неправильным названием «креатининкиназа». Креатинин не является субстратом или продуктом фермента. [ 21 ]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Бонг С.М., Мун Дж.Х., Нам К.Х., Ли К.С., Чи Ю.М., Хван Кюй (ноябрь 2008 г.). «Структурные исследования креатинкиназы головного мозга человека в комплексе с аналоговым комплексом переходного состояния креатина ADP-Mg2 + -NO3-». Письма ФЭБС . 582 (28): 3959–65. дои : 10.1016/j.febslet.2008.10.039 . ПМИД 18977227 . S2CID 21911841 .
- ^ Jump up to: а б Валлиманн Т., Висс М., Брдичка Д., Николай К., Эппенбергер Х.М. (январь 1992 г.). «Внутриклеточная компартментация, структура и функция изоферментов креатинкиназы в тканях с высокими и нестабильными энергетическими потребностями: «фосфокреатиновый контур» для клеточного энергетического гомеостаза» . Биохимический журнал . 281 (Часть 1) (1): 21–40. дои : 10.1042/bj2810021 . ПМЦ 1130636 . ПМИД 1731757 .
- ^ Валлиманн Т., Хеммер В. (1994). «Креатинкиназа в немышечных тканях и клетках». Молекулярная и клеточная биохимия . 133–134 (1): 193–220. дои : 10.1007/BF01267955 . eISSN 1573-4919 . ПМИД 7808454 . S2CID 10404672 .
- ^ Могадам-Киа С., Оддис К.В., Аггарвал Р. (январь 2016 г.). «Подход к бессимптомному повышению креатинкиназы» . Медицинский журнал Кливлендской клиники . 83 (1): 37–42. дои : 10.3949/ccjm.83a.14120 . ПМЦ 4871266 . ПМИД 26760521 .
- ^ Шлаттнер У, Токарска-Шлаттнер М, Валлиманн Т (февраль 2006 г.). «Митохондриальная креатинкиназа в здоровье и болезнях человека». Биохимия и биофизика Acta (BBA) - Молекулярные основы болезней . 1762 (2): 164–80. дои : 10.1016/j.bbadis.2005.09.004 . ПМИД 16236486 .
- ^ Фриц-Вольф К., Шнайдер Т., Валлиманн Т. и В. Кабш 1996 http://publicationslist.org/data/theo.wallimann/ref-135/Fritz-Wolf-sMtCK%20structure.pdf
- ^ Эдер М., Шлаттнер У., Беккер А., Валлиманн Т., Кабш В. и К. Фротц-Вольф 2000 http://publicationslist.org/data/theo.wallimann/ref-101/Eder-X- ray.uMtCK.pdf . Обе изоформы mt-CK образуют октамерные структуры (построенные из 4 бананоподобных димеров) с четырехкратной симметрией и центральным каналом.
- ^ Шнайдер Т., Винклер Х., Гросс, Х. Эппенбергер Х.М. и Т. Валлиманн, 1991 http://publicationslist.org/data/theo.wallimann/ref-180/SchnyderT_Gross-MtCK-crystal-EMs.pdf
- ^ Эдер М, Шлаттнер Ю, Валлиманн Т, Беккер А, Кабш В, Фриц-Вольф К (31 декабря 2008 г.). «Кристаллическая структура креатинкиназы мозгового типа с разрешением 1,41 Å» . Белковая наука . 8 (11). Уайли: 2258–2269. дои : 10.1110/пс.8.11.2258 . ISSN 0961-8368 . ПМК 2144193 . ПМИД 10595529 .
- ^ Хорнеманн и др. 2000 http://publicationslist.org/data/theo.wallimann/ref-96/Hornmann-CK-dimer.pdf
- ^ Брюстер Л.М., Майруху Г., Биндрабан Н.Р., Купманс Р.П., Кларк Дж.Ф., ван Монфранс Г.А. (ноябрь 2006 г.). «Активность креатинкиназы связана с артериальным давлением». Тираж . 114 (19): 2034–9. doi : 10.1161/CIRCULATIONAHA.105.584490 . ПМИД 17075013 . S2CID 6006006 .
- ^ Брюстер Л.М. (июнь 2020 г.). «Креатиновая внеклеточная креатинкиназа может модулировать пуринергическую передачу сигналов» . Пуринергическая сигнализация . 16 (3): 305–312. дои : 10.1007/s11302-020-09707-0 . ПМЦ 7524943 . ПМИД 32572751 .
- ^ Jump up to: а б «Креатинкиназа (КК)» . labtestsonline.org . Проверено 24 декабря 2019 г.
- ^ Армстронг AW, Голаны DE (2008). «Фармакология гемостаза и тромбозов» . На Голанах Д.Э., Ташджян А.Х., Армстронг Э.Дж., Армстронг А.В. (ред.). Основы фармакологии: патофизиологические основы лекарственной терапии . Филадельфия : Липпинкотт Уильямс и Уилкинс . п. 388. ИСБН 978-0-7817-8355-2 . OCLC 76262148 .
- ^ Бишоп М.Л., Фоди Э.П., Шефф Л.Е., ред. (2004). Клиническая химия: принципы, процедуры, корреляции . Филадельфия : Липпинкотт Уильямс и Уилкинс . п. 243. ИСБН 978-0-7817-4611-3 . OCLC 56446391 .
- ^ Джонсен С.Х., Лилленг Х., Вилсгаард Т., Беккелунд С.И. (январь 2011 г.). «Активность креатинкиназы и артериальное давление у нормального населения: исследование Тромсё». Журнал гипертонии . 29 (1): 36–42. дои : 10.1097/HJH.0b013e32834068e0 . ПМИД 21063205 . S2CID 7188988 .
- ^ Брюстер Л.М., Коронель К.М., Слюйтер В., Кларк Дж.Ф., ван Монфранс Г.А. (16 марта 2012 г.). Сакс В. (ред.). «Этнические различия в активности тканевой креатинкиназы: обсервационное исследование» . ПЛОС ОДИН . 7 (3): e32471. Бибкод : 2012PLoSO...732471B . дои : 10.1371/journal.pone.0032471 . ПМК 3306319 . ПМИД 22438879 .
- ^ Хекимсой З, Октем ИК (2005). «Уровни креатинкиназы сыворотки при явном и субклиническом гипотиреозе». Эндокринные исследования . 31 (3): 171–5. дои : 10.1080/07435800500371706 . ПМИД 16392619 . S2CID 5619524 .
- ^ Йохансен С., Берберих С., Меттерляйн Т., Рот С., Райнерс К., Рёвер Н., Шустер Ф. (май 2013 г.). «Скрининговый тест на злокачественную гипертермию у пациентов со стойкой гиперКемией: пилотное исследование». Мышцы и нервы . 47 (5): 677–81. дои : 10.1002/mus.23633 . ПМИД 23400941 . S2CID 5126493 .
- ^ О'Дуайер А.М., Шеппард Н.П. (май 1993 г.). «Роль креатинкиназы в диагностике злокачественного нейролептического синдрома». Психологическая медицина . 23 (2): 323–6. дои : 10.1017/s0033291700028415 . ПМИД 8101383 . S2CID 10818939 .
- ^ Ник Флинн (2021). «СК – Что это означает?» . Американский журнал неотложной медицины . 45 : 647. doi : 10.1016/j.ajem.2020.11.015 . ПМЦ 7656996 . ПМИД 33214021 .
Внешние ссылки
[ редактировать ]- Просто указано на mdausa.org
- Креатин + киназа Национальной медицинской библиотеки США в медицинских предметных рубриках (MeSH)
- Тест на изоферменты КФК Энциклопедия MedlinePlus : 003504
- CK в лабораторных тестах онлайн