Фактор некроза опухоли
| ФНО | ||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | TNF , DIF, TNF-альфа, TNFA, TNFSF2, фактор некроза опухоли, TNF-α, фактор некроза опухоли, TNLG1F, фактор некроза опухоли альфа | |||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | ОМИМ : 191160 ; МГИ : 104798 ; Гомологен : 496 ; Генные карты : TNF ; ОМА : TNF – ортологи | |||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | ||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||
Фактор некроза опухоли ( TNF ), ранее известный как TNF-α , представляет собой воспалительный белок и основной медиатор врожденного иммунного ответа . TNF вырабатывается преимущественно макрофагами в ответ на антигены и активирует воспалительные пути через два своих рецептора: TNFR1 и TNFR2 . [ 5 ] Он является членом суперсемейства факторов некроза опухоли , семейства трансмембранных белков типа II, которые действуют как цитокины . [ 6 ] Избыточное производство TNF играет решающую роль в патологии некоторых воспалительных заболеваний, и терапия против TNF . для лечения этих заболеваний часто применяется [ 7 ]
TNF экспрессируется преимущественно макрофагами, но также экспрессируется и в некоторых других типах клеток, таких как Т-клетки , В-клетки , дендритные клетки и тучные клетки . Он экспрессируется в ответ на патогены, другие цитокины и стрессоры окружающей среды. [ 8 ] TNF первоначально вырабатывается как трансмембранный белок типа II (tmTNF) и собирается в виде гомотримера , который затем расщепляется TNF-альфа-превращающим ферментом (TACE) в растворимую форму (sTNF), что позволяет ему секретироваться во внеклеточное пространство . [ 9 ] И tmTNF, и sTNF могут активировать TNFR1, тогда как только tmTNF может активировать TNFR2. [ 5 ]
TNFR1 может запускать воспалительные пути, вызывая такие эффекты, как выживание и пролиферация клеток, а также гибель клеток, если воспалительные пути нарушены. TNFR2 может только запускать выживание и пролиферацию клеток, но может косвенно вызывать гибель клеток, разрушая TNFR1. [ 5 ] tmTNF также посылает обратные сигналы в свою собственную клетку, что приводит к гибели или выживанию клетки в зависимости от обстоятельств. [ 10 ] Воздействие TNF на иммунную систему включает, среди прочего, активацию лейкоцитов, свертывание крови , секрецию цитокинов и лихорадку . [ 11 ] Активность TNF выходит за пределы иммунной системы, внося вклад в поддержание гомеостаза в центральной нервной системе . [ 12 ]
Известно, что избыточное производство TNF является ключевым фактором воспалительных заболеваний, таких как ревматоидный артрит и воспалительные заболевания кишечника , а ингибирование TNF часто является эффективным лечением. [ 7 ] TNF также участвует в патологии других заболеваний, включая рак , фиброз печени и болезнь Альцгеймера , хотя ингибирование TNF еще не продемонстрировало явных преимуществ. [ 13 ] Из-за важной роли TNF во врожденном иммунитете и гомеостазе ингибирование TNF может привести к повышенному риску инфекций и новых «парадоксальных» аутоиммунитетов. [ 14 ]
История
[ редактировать ]Открытие
[ редактировать ]В 1890-х годах Уильям Б. Коли , основываясь на анекдотах о больных раком, излечившихся от внезапных приступов рожи , выдвинул теорию, что бактериальные инфекции оказывают благотворное влияние на опухоли, особенно саркомы . Коли смог успешно лечить больных раком, вводя им смесь бактериальных токсинов из стерилизованных нагреванием Streptococcus и Bacillus prodigiosus в опухоли и вокруг них, вызывая кровотечение из опухолей. Однако эффективность этого лечения была непостоянной, а повторные инъекции вызывали серьезные побочные эффекты, такие как озноб и лихорадка, в результате чего лечение было прекращено. [ 15 ]
В 1930-х и 1940-х годах Шир и др. выделил активный опухолекровоизлияющий агент из бактериальных токсинов Escherichia coli и Serratia marcescens . Они продемонстрировали, что этот агент, эндотоксин , при введении мышам с саркомами может ингибировать рост опухоли или вызывать регрессию опухоли. [ 16 ] Однако регрессия опухоли была весьма вариабельной: меньшие дозы эндотоксина часто имели большую эффективность, чем большие дозы, или целые партии мышей были устойчивы к эндотоксину. [ 17 ]
В 1975 году Элизабет Карсвелл и Ллойд Олд и др. исследовали противоопухолевые свойства эндотоксина, вводя сыворотку обработанных эндотоксином мышей другим мышам. Они обнаружили, что мыши, инфицированные Bacillus Calmette Guerin (BCG), при воздействии эндотоксина производят сыворотку, которая может убивать саркомы у других мышей. Между тем, у неинфицированных мышей при воздействии эндотоксина вырабатывалась сыворотка, которая не убивала опухоли. Это привело авторов к выводу, что сыворотка, убивающая опухоль, содержит отдельный цитотоксический фактор, который не является эндотоксином, а вырабатывается хозяином, и называется фактором некроза опухоли (TNF). Поскольку у мышей, инфицированных БЦЖ, селезенка была увеличена из-за повышенного производства макрофагов , авторы пришли к выводу, что TNF высвобождается макрофагами при воздействии эндотоксинов. [ 18 ]
Помимо того, что TNF вызывал кровоизлияния в саркомах in vivo , он также был цитотоксичен для клеток L-929, трансформированной клеточной линии, in vitro . Цитотоксичность по отношению к клеткам L-929 in vitro стала стандартным методом обнаружения TNF. [ 19 ] TNF был цитотоксичен для раковых и трансформированных клеточных линий, но не для нормальных, нетрансформированных клеточных линий, что вселяет надежду на то, что его можно будет использовать в качестве лечения рака. [ 18 ]
Выделение, секвенирование и экспрессия
[ редактировать ]В августе 1984 года Бхарат Аггарвал и др. в Genentech очистили и охарактеризовали человеческий TNF. TNF был получен путем культивирования HL-60 , линии клеток человека, с форболмиристатацетатом (PMA), стимулятором фагоцитов, подобным эндотоксину. TNF очищали с использованием стеклянных шариков с контролируемыми порами , DEAE -хроматографии, Mono Q-хроматографии и обращенно-фазовой ВЭЖХ . Было установлено, что TNF, очищенный с помощью обращенно-фазовой ВЭЖХ, имеет молекулярную массу 17 000 кДа с помощью SDS-PAGE , тогда как TNF, очищенный с помощью TSK-HPLC в неденатурирующих условиях, имеет приблизительную молекулярную массу 45 000 кДа, что позволяет предположить, что TNF существует в природе в виде олигомер . Аминокислотную последовательность TNF определяли с помощью деградации по Эдману , выявив последовательность из 157 аминокислот со значительной гомологией с аминокислотной последовательностью лимфотоксина-α . [ 20 ]
В том же месяце Пенника и др., также из Genentech, секвенировали кДНК человеческого TNF. Библиотеку кДНК конструировали из мРНК клеток HL-60, индуцированных PMA. длиной 42 основания ДНК-зонд , сконструированный путем угадывания кодонов части аминокислотной последовательности TNF, использовался для скрининга библиотеки кДНК. Соответствующую кДНК секвенировали, обнаружив предпоследовательность из 76 аминокислот, за которой следовали 157 аминокислот зрелого TNF. Авторы пришли к выводу, что TNF сначала синтезируется в более крупную форму-предшественник, содержащую сигнальный пептид , а затем процессируется и высвобождается в виде более мелкой зрелой формы. Авторы также синтезировали TNF в E. coli и подтвердили его цитотоксичность в отношении клеток L-929 in vitro и против сарком мышей in vivo . [ 21 ]
Физиологические эффекты
[ редактировать ]В июне 1981 года Ян А. Кларк и др. обнаружили, что у здоровых мышей, инфицированных Plasmodium vinckei , паразитом, вызывающим малярию , при воздействии эндотоксина развивались малярийно-подобные симптомы, такие как повреждение печени, гипогликемия и свертывание крови, а также высвобождались медиаторы, включая TNF. Неинфицированные мыши не выделяли эти медиаторы при инъекции эндотоксина. Эти результаты в сочетании с данными о наличии эндотоксинов в сыворотке больных малярией позволили авторам предположить, что такие медиаторы, как TNF, присутствуют при острых малярийных инфекциях и что они играют роль в возникновении симптомов малярии. [ 22 ]
В 1985 году Кевин Дж. Трейси , Ян Милсарк и Энтони Керами обнаружили, что мыши, иммунизированные TNF с помощью антисыворотки к TNF, были устойчивы к летальному воздействию эндотоксина, что указывает на то, что TNF является одним из медиаторов летальности эндотоксина. [ 23 ] В 1986 году это было подтверждено Кевином Дж. Трейси и Брюсом Бейтлером , когда они продемонстрировали, что у мышей, которым вводили TNF, наблюдались общие симптомы отравления эндотоксинами, такие как гипотония , метаболический ацидоз , гемоконцентрация и смерть. [ 24 ]
В 1991 году Майкл Гудман продемонстрировал, что мыши, которым вводили TNF, высвобождали повышенные уровни тирозина и 3-метил-L-гистидина в скелетных мышцах, что указывает на то, что TNF вызывает распад мышц. [ 25 ] В 1996 году Штефферл и др. продемонстрировали, что у мышей, которым вводили мышиный TNF, развивается лихорадка, окончательно доказав, что TNF является пирогеном . Предыдущие исследования показали неубедительные результаты из-за использования на мышах человеческого TNF, а не мышиного TNF. [ 26 ]
Наблюдение того, что TNF вызывает истощение и эндотоксический шок, привело к переосмыслению его потенциальной роли в терапии рака. [ 19 ]
Идентификация с кахектином
[ редактировать ]В сентябре 1981 года Масанобу Каваками и Энтони Черами исследовали склонность эндотоксинов вызывать высокий уровень жира в крови, известную как гипертриглицеридемия , при введении животным. Известно, что это состояние вызвано дефицитом липопротеинлипазы (ЛПЛ), фермента, ответственного за расщепление жира в кровотоке. Они вводили сыворотку мышей, обработанных эндотоксином, другим мышам и обнаружили, что сыворотка снижает активность ЛПЛ у мышей-реципиентов, даже если мыши-реципиенты были устойчивы к самому эндотоксину. Это привело авторов к выводу, что гипертриглицеридемия вызвана не эндотоксином, а опосредующим фактором, вырабатываемым хозяином в ответ на эндотоксин, называемым кахектином. Авторы также обнаружили, что инкубированные с эндотоксином клетки экссудата , состоящие в основном из макрофагов, продуцируют среду, которая также снижает активность ЛПЛ у мышей. Это указывало на то, что кахектин секретируется макрофагами в ответ на эндотоксин. [ 27 ]
В 1985 году Бейтлер и др. продемонстрировали, что мышиный кахектин обладает такой же цитотоксичностью в отношении клеток L-929, как и TNF, а также имеет почти идентичную N-концевую аминокислотную последовательность с человеческим TNF, что указывает на то, что кахектин и TNF представляют собой один и тот же белок. Поскольку известно, что кахектин (теперь TNF) подавляет биосинтез специфического белка, липопротеинлипазы, авторы пришли к выводу, что цитотоксический механизм TNF действует аналогичным образом. [ 28 ]
Номенклатура
[ редактировать ]В 1968 году был открыт лимфотоксин — цитотоксин, секретируемый лимфоцитами . TNF и лимфотоксин имели несколько общих черт: оба были обнаружены на основе их способности убивать клетки L-929; оба были способны связываться с двумя известными рецепторами TNF, TNFR1 и TNFR2 ; и оба белка имели значительную генетическую и аминокислотную гомологию. Сходство между TNF и лимфотоксином привело к неофициальному переименованию TNF в TNF-α, а лимфотоксина в TNF-β, причем опубликованное обоснование заключалось в том, что оба были обнаружены с помощью одного и того же метода. [ 19 ]
В 1993 году было обнаружено, что лимфотоксин, который не является трансмембранным белком , присутствует на клеточной мембране путем образования комплекса с отдельным трансмембранным гликопротеином , названным лимфотоксином-β . [ 29 ] Также было обнаружено, что лимфотоксин играет решающую роль в развитии лимфоидных органов , что отличает его биологическую функцию от TNF. В результате этих разработок TNF-β был переименован в лимфотоксин-α, а TNF-α снова переименован в TNF. [ 19 ] Тем не менее, в некоторых работах продолжают использовать термин TNF-α. [ 30 ]
Ген
[ редактировать ]TNF человека Ген картирован на хромосоме 6p21.3 , расположенной в класса III регионе главного комплекса гистосовместимости . Его центромерная длина составляет 250 тыс. нуклеотидов локуса HLA-B, теломерная длина 850 килобаз локуса HLA-DR и 1100 пар оснований ниже гена лимфотоксина-α . [ 31 ] Ген TNF имеет длину 2762 пары оснований, в результате чего образуется зрелая мРНК, состоящая из 1669 нуклеотидов. [ 32 ] Проксимальная область промотора имеет длину примерно 200 пар оснований. [ 8 ] TNF обозначается как TNFSF2 в суперсемействе факторов некроза опухоли . [ 6 ]
Транскрибируемый регион
[ редактировать ]
Транскрибируемая область содержит 4 экзона, разделенных 3 интронами , что в общей сложности составляет 2762 пары оснований в первичном транскрипте и 1669 пар оснований в мРНК. мРНК состоит из четырех участков: 5'-нетранслируемого участка , не включенного в состав белка TNF; трансмембранная часть, которая присутствует в трансмембранном TNF, но не присутствует в растворимом TNF; растворимая часть; и 3'-нетранслируемая область .
Первый экзон содержит 5'-нетранслируемую область и большую часть трансмембранной части. Второй экзон содержит меньшую часть трансмембранной части и меньшую часть растворимой части. Третий экзон содержит меньшую часть растворимой части. Четвертый экзон содержит большую часть растворимой части и 3'-нетранслируемую область и имеет значительную гомологию с лимфотоксином-α. [ 33 ]
3'-нетранслируемая область содержит богатый AU элемент (ARE), который регулирует репрессию трансляции и стабильность мРНК. Удаление этой последовательности у мышей приводит к повышению уровня TNF, артриту и фенотипу, подобному болезни Крона. [ 31 ]
Выражение
[ редактировать ]Ген TNF экспрессируется преимущественно в макрофагах , но может также экспрессироваться в Т-клетках , В-клетках , естественных клетках-киллерах , тучных клетках , дендритных клетках и фибробластах . [ 8 ] Ген TNF также является геном немедленного раннего ответа ; его активация быстрая и не зависит от синтеза других белков.
TNF активируется в ответ на сигналы инфекции, воспаления или стресса. Такие стимулы часто являются патогенными, например, бактериальные эндотоксины , вирусы, простейшие , суперантигены , полигидроксиалканоаты и вирусная РНК. Стимулы также могут быть непатогенными, включая ионофоры , митогены , анти-CD3 и частицы кремнезема. TNF также активируется другими цитокинами, такими как интерлейкин-1 , интерлейкин-2 , GM-CSF и сам TNF, а также стрессами окружающей среды, такими как радиация , осмотический стресс и высокий уровень глюкозы. [ 8 ]
Эти стимулы вызывают активацию различных факторов транскрипции, таких как NF-κB , NFAT , c-jun , ATF-2 , Ets , Elk-1 и Sp1 , которые перемещаются в ядро, чтобы начать транскрипцию TNF. Факторы транскрипции, регулирующие экспрессию TNF, различаются в зависимости от типа клеток и задействованного стимула. [ 8 ]
Энхансосомная транскрипция
[ редактировать ]
Экспрессия гена TNF регулируется посредством энхансосом , где множество факторов транскрипции и коактиваторов собираются в структуры высокого порядка для активации транскрипции. Проксимальная область промотора, охватывающая примерно 200 пар оснований перед транскрипционной областью, содержит множество сайтов связывания транскрипционных факторов, многие из которых могут распознавать более одного типа транскрипционных факторов. [ 8 ]
Состав энхансосомы зависит от окружающей концентрации NFAT в ядре . Если уровни NFAT высоки, например, в Т-клетках при стимуляции иономицином, энхансосома будет состоять в основном из NFAT, связанных с сайтами связывания NFAT. Если уровни NFAT низкие, энхансосома будет состоять в основном из белков Sp1 и Ets/Elk, связанных в совместимых сайтах связывания. [ 8 ]
Кроме того, проксимальная область промотора содержит элемент ответа циклического AMP (CRE), сайт связывания гетеродимера белков ATF -2 и c-jun , который имеет решающее значение для активации TNF во всех типах клеток и состояниях. CRE и близлежащие факторы транскрипции образуют основные составные комплексы, тогда как удаленные факторы транскрипции образуют якорные комплексы. Вместе коровый комплекс и якорные комплексы стабилизируют взаимодействия с коактиваторами и транскрипционным аппаратом. Проксимальная область промотора также содержит ТАТА-бокс, способствующий транскрипции. [ 8 ]
Гибкость энхансосомы позволяет активировать ген TNF широким спектром типов клеток и стимулов. [ 8 ]
Другие факторы транскрипции
[ редактировать ]транскрипционный фактор NF-κB Было показано, что играет важную роль в регуляции экспрессии гена TNF. Однако неясно, активирует ли NF-κB транскрипцию TNF путем непосредственного связывания с сайтами в промоторной области или посредством вторичных эффектов. Из шести последовательностей, идентифицированных как потенциальные сайты связывания NF-κB в области промотора TNF человека, только одна находится в проксимальной области промотора. Более того, делеция или мутация этих сайтов связывания не влияет на активацию гена TNF путем индукции эндотоксина, что указывает на то, что NF-κB может не влиять на экспрессию TNF путем прямого связывания с промотором. [ 8 ]
Было обнаружено, что другие факторы транскрипции потенциально влияют на экспрессию гена TNF, такие как белки семейств bZIP , STAT и IRF , а также индуцируемый эндотоксином фактор TNF-α (LIPAF). Однако их влияние на экспрессию гена TNF еще полностью не изучено. [ 8 ]
Регуляция через структуру хроматина
[ редактировать ]Экспрессия гена TNF регулируется модификациями гистонов, вокруг которых обернута ДНК. Активация TNF связана с несколькими гистон-ацетилтрансферазами , белками, которые расслабляют структуру ДНК для увеличения экспрессии генов, такими как ATF-2, CBP/p300 , p/CAF и GCN5 . Также было показано, что метилирование гистонов регулирует экспрессию гена TNF, например, метилирование лизина 4 гистона H3 на промоторе TNF после стимуляции клеток, экспрессирующих TNF. [ 8 ]
Экспрессия гена TNF также контролируется наличием участков сверхчувствительности к ДНКазе (HSS), участков хроматина, которые неконденсированы и, следовательно, доступны для ДНК-связывающих белков. Несколько исследований показали, что HSS присутствуют в промоторе TNF и области гена в клетках, экспрессирующих TNF, и отсутствуют в клетках, которые не экспрессируют TNF. Другие исследования также показали, что HSS присутствуют в промоторе TNF и областях генов в зависимости от стимулятора, используемого для индукции клетки. [ 8 ]
Также было обнаружено, что долгосрочные внутрихромосомные и межхромосомные взаимодействия регулируют экспрессию гена TNF. Например, в активированных Т-клетках промотор TNF взаимодействует с HSS+3 и HSS-9, приближая дистальные энхансеры к промотору TNF и увеличивая локальную концентрацию комплексов энхансеров. Эти взаимодействия также сделают ген TNF кольцевым и позволят повторно использовать транскрипционный аппарат, обеспечивая быструю и раннюю экспрессию TNF в Т-клетках. [ 8 ]
Эволюция
[ редактировать ]Считается, что гены TNF и лимфотоксина-α произошли от общего предкового гена, который развился на ранних этапах эволюции позвоночных, до разделения Agnatha и Gnathostomata . Этот предковый ген был исключен из предка Agnatha, но сохранился у предка Gnathostomata. В ходе эволюции челюстноротых этот предковый ген был дублирован в гены TNF и лимфотоксина-α. [ 6 ]
Таким образом, хотя предковый ген TNF/лимфотоксина-α обнаружен у множества видов челюстноротых, только часть видов челюстноротых содержат ген TNF. Ген TNF был обнаружен у рыб, млекопитающих, птиц и амфибий. Было обнаружено, что некоторые виды рыб, такие как данио , содержат дубликаты гена TNF. [ 6 ]
Ген TNF очень похож у млекопитающих и содержит от 233 до 235 аминокислот. [ 34 ] Область проксимального промотора TNF также высоко консервативна у млекопитающих и почти идентична у высших приматов . [ 8 ] Сходство гена TNF у рыб ниже и составляет от 226 до 256 аминокислот. как и TNF млекопитающих, ген TNF рыб стимулируется в макрофагах антигенами Было показано, что , . [ 34 ] Все гены TNF имеют высококонсервативный С-концевой модуль, известный как домен гомологии TNF, из-за его важной роли в связывании TNF с его рецепторами. [ 6 ]
Белок
[ редактировать ]Человеческий TNF первоначально вырабатывается как трансмембранный белок типа II , обозначаемый tmTNF, который расщепляется ферментом, превращающим TNF-альфа (TACE), в растворимую форму, обозначаемую sTNF. И tmTNF, и sTNF биоактивны и представляют собой гомотримеры . [ 9 ] Мономер TNF также биоактивен, но в гораздо меньшей степени. [ 35 ]
Трансмембранная форма
[ редактировать ]tmTNF состоит из 233 аминокислот, весит 26 кДа и представляет собой гомотример. tmTNF передает двунаправленный сигнал как в клетку-мишень, так и в собственную клетку, связываясь с рецепторами TNF при межклеточном контакте. tmTNF связывается как с TNFR1, так и с TNFR2, но его активность в основном опосредована TNFR2. Как и все трансмембранные белки типа II, tmTNF устроен таким образом, что N-конец направлен внутрь клетки, а С-конец направлен наружу из клетки. [ 9 ]
tmTNF состоит из внутриклеточной части из 30 аминокислот, трансмембранной части из 26 аминокислот и внеклеточной части из 177 аминокислот. Остаток цистеина на границе внутриклеточной и трансмембранной частей пальмитоилируется , что делает его более гидрофобным и притягивает к клеточной мембране. Внутриклеточная часть содержит остатки серина, которые высоко консервативны между видами и необходимы для передачи сигналов в клетку. Эти остатки серина также фосфорилируются , хотя неясно, какую роль это играет. [ 9 ]
При расщеплении ТАСЕ секретируются концевые 157 аминокислот внеклеточной части, образующие sTNF. Оставшийся tmTNF снова расщепляется SPPL2b , вызывая перемещение внутриклеточного домена в ядро, где, как полагают, он регулирует выработку цитокинов, например, запуская экспрессию интерлейкина-12 . [ 9 ]
Растворимая форма
[ редактировать ]
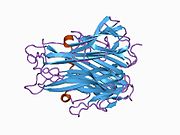
sTNF состоит из 157 аминокислот, весит 17 кДа и имеет форму треугольного клина. Вторичная структура sTNF состоит из 10 β-нитей и одной α-спирали . Третичная структура состоит из двух антипараллельных β-листов, расположенных в виде антипараллельного β-сэндвича , аналогично структурному мотиву «желеобразного рулета» белков вирусной оболочки . Верхний β-лист состоит из трех длинных β-тяжей, дополненных петлей из двух дополнительных β-нитей, а нижний β-лист состоит из пяти β-тяжей постепенно уменьшающейся длины. Средняя β-цепь нижнего β-листа содержит последние 9 остатков С-конца, фиксирующих его в нужном положении. Было показано, что полный С-конец жизненно важен для биологической активности, тогда как с N-конца можно удалить до восьми остатков без потери биоактивности. Дисульфидный мостик соединяет две самые длинные межлистные петли. [ 36 ]
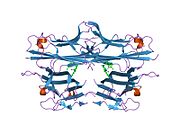
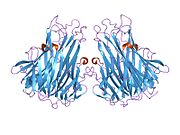
Подобно tmTNF, sTNF также представляет собой гомотример, образующий коническую форму. Три мономера sTNF соединяются друг с другом с помощью упаковки от края к лицу. Верхние листы мономеров sTNF образуют внешнюю поверхность конуса тримера, а нижние листы — внутреннюю поверхность. Наружная поверхность содержит заряженные и полярные боковые цепи, а внутренняя поверхность имеет преимущественно полярный характер. [ 36 ]
Сборка и разборка
[ редактировать ]Мономеры TNF образуют тримеры TNF, сначала образуя частично развернутый тример, также известный как тримерная расплавленная глобула , которая затем сворачивает свои третичные структуры в компактный биоактивный тример TNF. [ 37 ] Сборка и разборка тримеров TNF обратима и включает накопление димеров TNF. [ 38 ]
Разборка тримеров TNF происходит с постоянной скоростью, независимой от концентрации TNF, тогда как сборка тримеров TNF увеличивается с увеличением концентрации TNF. Таким образом, при высоких концентрациях ФНО выше концентрация тримеров ФНО, а при низких концентрациях ФНО выше концентрация мономеров и димеров ФНО. [ 39 ]
Были обнаружены небольшие молекулы , которые образуют стабильные димеры TNF, форма которых препятствует переходу в тримеры TNF. Ингибирование образования тримеров TNF путем изменения формы неактивных мономеров и димеров TNF представляет собой альтернативный механизм ингибирования TNF, в отличие от современных блокаторов TNF, которые связываются с активными тримерами TNF. [ 40 ]
Способность TNF образовывать функционально различные димеры и тримеры, сосуществующие в равновесии, позволяет предположить, что TNF является морфеином . Однако не установлено, полностью ли TNF удовлетворяет критериям морфеина, таким как требование, чтобы переходы между олигомерными формами включали диссоциацию на субъединицы перед повторной ассоциацией в новую олигомерную форму. [ 41 ]
Функция
[ редактировать ]организма TNF является центральным медиатором врожденного иммунного ответа . Связываясь с рецепторами TNFR1 и TNFR2 , TNF может индуцировать либо выживание клеток, либо гибель клеток в клетке-мишени. Реакция выживания клеток включает пролиферацию клеток и активацию воспалительных сигналов, в то время как реакция гибели клеток может быть либо апоптозом , контролируемой гибелью клетки, либо некроптозом , менее контролируемой смертью, вызывающей воспаление и вмешательство в окружающие ткани. TNF по умолчанию индуцирует выживание клеток, но гибель клеток может быть вызвана такими факторами, как нарушение воспалительных путей патогенами, костимуляция другими цитокинами и перекрестные помехи между TNFR1 и TNFR2. [ 5 ] Кроме того, трансмембранный TNF (tmTNF) действует как обратный сигнализатор, запуская различные реакции в собственной клетке в зависимости от типа клетки и стимулятора. [ 42 ]
Передача сигналов TNFR1
[ редактировать ]
TNFR1 существует в большинстве типов клеток и связывается как с tmTNF, так и с sTNF. TNFR1 содержит домен смерти в цитоплазматическом хвосте, что позволяет ему запускать гибель клеток. [ 42 ] Запускает ли активация TNFR1 выживание клеток или гибель клеток, опосредовано образованием белковых комплексов: комплекса I, который приводит к выживанию клеток, и комплекса II, который приводит к гибели клеток. По умолчанию активация TNFR1 вызывает пролиферацию и воспаление клеток, а не их гибель. Эти воспалительные пути содержат три контрольные точки гибели клеток, каждая из которых имеет решающее значение для предотвращения гибели клеток. [ 5 ]
При активации TNF TNFR1 тримеризуется и образует комплекс I, рекрутируя RIPK1 и TRADD , которые рекрутируют TRAF2 , cIAP1 и cIAP2 и LUBAC . cIAP1 и cIAP2 представляют собой убиквитинлигазы , которые образуют K63-связанные убиквитиновые цепи, которые рекрутируют TAK1 через TAB2 и TAB3 . LUBAC также представляет собой убиквитинлигазу , которая образует M1-связанные цепи убиквитина, которые привлекают IKK через NEMO . TAK1 активирует пути MAPK , а также IKK, который, в свою очередь, активирует канонический путь NF-κB . Пути MAPK и путь NF-κB активируют множественные факторы транскрипции в ядре, что приводит к выживанию клеток, пролиферации и воспалительной реакции. Комплекс I отрицательно регулируется деубиквитиназами, такими как А20 , CYLD и OTULIN , которые дестабилизируют комплекс I. [ 5 ]
Комплекс II образуется, когда RIPK1 и/или TRADD отделяются от комплекса I и связываются с FADD , активируя каспазу 8 , что приводит к гибели клеток. Комплекс IIa включает TRADD и может активировать каспазу 8 без RIPK1, тогда как комплекс IIb не включает TRADD, поэтому он зависит от RIPK1 для активации каспазы 8. Пути комплекса I индуцируют три контрольные точки, которые не позволяют комплексу II вызывать гибель клеток. [ 5 ]
На первой контрольной точке IKK отключает RIPK1 посредством фосфорилирования , пока он присоединен к комплексу I. Это отключает комплекс IIb, который зависит от RIPK1. Поскольку IKK зависит от убиквитинирования комплекса I, условия, влияющие на убиквитинирование, такие как ингибирование cIAP1/2 и LUBAC, мутация акцепторного сайта убиквитина RIPK1 или дефицит A20 и OUTLIN, могут отключить эту контрольную точку. Отключение контрольной точки IKK активирует комплекс IIb, что приводит к апоптозу или пироптозу за счет расщепления GSDMD . Отключение контрольной точки IKK также может косвенно активировать комплекс IIa путем отключения пути NF-κB, который контролирует вторую контрольную точку. [ 5 ]
Во второй контрольной точке путь NF-κB способствует экспрессии генов, способствующих выживанию, таких как FLIP , который противодействует активации каспазы 8 в комплексе IIa. Эту контрольную точку можно отключить с помощью ингибиторов трансляции, таких как циклогексимид , а также путем отключения комплекса IKK, который контролирует путь NF-κB. Отключение этой контрольной точки активирует комплекс IIa, что приводит к апоптозу. [ 5 ]
В третьей контрольной точке нелетальная каспаза 8 активируется посредством передачи сигналов TNFR1, которая связывается с комплексом IIb и расщепляет RIPK1, отключая его. Неизвестно, почему эта форма каспазы 8 не вызывает гибели клеток. Отключение этой контрольной точки посредством инактивации каспазы 8 приводит к тому, что RIPK1 из комплекса IIb связывается с RIPK3 и MLKL , образуя комплекс IIc, также называемый некросомой. Некросома затем вызывает некроптоз. [ 5 ]
Передача сигналов TNFR2
[ редактировать ]
В отличие от TNFR1, TNFR2 экспрессируется в ограниченных типах клеток, включая эндотелиальные клетки , фибробласты , а также подгруппы нейронов и иммунных клеток . TNFR2 полностью активируется tmTNF, тогда как активация sTNF частично ингибируется. В отличие от TNFR1, TNFR2 не обладает доменом смерти, поэтому он не способен напрямую вызывать гибель клеток. Таким образом, активация TNFR2 чаще всего приводит к выживанию клеток. Выживание клеток может привести либо к воспалительной реакции посредством канонической активации NF-κB, либо к пролиферации клеток посредством неканонической активации NF-κB, в зависимости от внутриклеточных условий и сигнального процесса TNFR1. TNFR2 также может косвенно вызывать гибель клеток, нарушая контрольные точки гибели клеток TNFR1. [ 42 ]
При связывании с tmTNF TNFR2 тримеризуется и напрямую рекрутирует TRAF2, а также TRAF1 или TRAF3. TRAF2 занимает центральное место в сигнальном комплексе TNFR2 и рекрутирует cIAP1/2. Если внутри клетки происходит накопление NIK , TRAF2/3 и cIAP1/2 могут образовываться в виде комплекса с неактивным NIK. Когда TRAF2/3 связывается с TNFR2, активируется присоединенный NIK, который, в свою очередь, активирует IKKα . Это позволяет p100 и RelB процессироваться в гетеродимер , который активирует неканонический путь NF-κB, что приводит к пролиферации клеток. Экспрессия p100 и RelB усиливается за счет активации канонического пути NF-κB с помощью TNFR1. Таким образом, неканоническая активация NF-κB TNFR2 зависит от канонической активации NF-κB с помощью TNFR1, а также от накопления NIK внутри клетки. [ 42 ]
TNFR2 также может активировать канонический путь NF-κB, хотя это встречается реже, чем неканоническая активация NF-κB. Детали активации TNFR2 канонического пути NF-κB неизвестны. Предположительно, TAK1 и IKK рекрутируются сигнальным комплексом TRAF2/TRAF1/3/cIAP1/2, который, в свою очередь, активирует канонический путь NF-κB. [ 42 ]
TNFR2 может косвенно вызывать гибель клеток, разрушая cIAP1/2 как часть неканонического пути NF-κB. Деградация cIAP1/2 влияет на убиквитинирование сигнального комплекса TNFR1, что ингибирует функцию IKK. Это отключает контрольную точку гибели клеток IKK в TNFR1, вызывая гибель клеток. [ 5 ]
Обратная сигнализация
[ редактировать ]tmTNF может действовать как рецептор, активируя пути внутри собственной клетки при связывании с TNFR1 или TNFR2. Обратная передача сигналов tmTNF может индуцировать апоптоз, устойчивость к апоптозу, воспаление или устойчивость к воспалению в зависимости от лиганда и типа клеток. [ 10 ]
в опухолевых клетках, таких как клетки В-лимфомы Было показано, что , обратная передача сигналов tmTNF увеличивает активность NF-κB, повышая выживаемость клеток и устойчивость к апоптозу. В естественных клетках-киллерах обратная передача сигнала tmTNF увеличивает цитотоксическую активность за счет увеличения экспрессии перфорина , гранзима B , лиганда Fas и TNF. В Т-клетках активация пути JNK посредством обратной передачи сигналов tmTNF может привести к ингибированию клеточного цикла и апоптозу. [ 10 ]
Было показано, что в моноцитах tmTNF играет двойную роль в опосредовании воспалительного ответа моноцитов на sTNF. Если обратная передача сигнала tmTNF происходит до того, как моноцит активируется sTNF, то воспалительная реакция моноцита на sTNF усиливается. Если обратная передача сигнала tmTNF происходит после активации моноцита sTNF, то воспалительная реакция снижается. [ 10 ] Между тем, обратная передача сигналов tmTNF снижает воспалительную реакцию моноцитов на эндотоксин . Этот эффект вызван тем, что tmTNF активирует пути JNK и p38 , что индуцирует выработку TGF-β , что затем вмешивается в сигнальный путь эндотоксина. [ 10 ]
Иммунный ответ
[ редактировать ]Врожденная иммунная система активируется, когда патоген-ассоциированные молекулярные структуры (PAMP), такие как эндотоксины и двухцепочечная вирусная РНК , связываются с рецепторами распознавания образов (PRR) иммунных клеток, заставляя их секретировать иммунорегулирующие цитокины. Эти цитокины, такие как IL-1 , IL-6 , IL-8 и TNF, в основном секретируются мононуклеарными фагоцитами, такими как макрофаги и дендритные клетки . В основном они действуют на лейкоциты , также известные как лейкоциты, а также на эндотелиальные клетки кровеносных сосудов, способствуя ранней воспалительной реакции. [ 11 ]
TNF является основным цитокином, регулирующим острое воспаление, хотя многие из его функций совпадают с другими цитокинами, особенно с IL-1. Связываясь с рецепторами TNF, TNF может выполнять следующие функции: стимулировать эндотелиальные клетки, вызывая коагуляцию , которая препятствует кровотоку и предотвращает распространение микробов; стимуляция эндотелиальных клеток и макрофагов для секреции хемокинов , привлекающих лейкоциты; стимуляция секреции других цитокинов, таких как IL-1; активация нейтрофилов и макрофагов; стимуляция печени для выработки белков острой фазы , таких как С-реактивный белок ; стимулирование катаболизма мышц и жира для производства энергии; и стимуляция образования рубцовой ткани, также известной как фиброз . Помимо индукции секреции цитокинов, сам TNF может индуцироваться цитокинами, обеспечивая каскад воспалительных сигналов. Чрезмерное количество TNF может вызвать септический шок . [ 11 ]
Большая часть функций TNF опосредована воспалительными сигнальными путями, такими как MAPK и NF-κB. Многие патогены пытаются предотвратить иммунный ответ, захватывая клетки и нарушая их воспалительные пути. В ответ на это сигнальный путь TNFR1 имеет пути гибели клеток, которые ингибируются активностью воспалительных путей. Если воспалительные пути клетки нарушаются, пути гибели клеток не подавляются, что приводит к гибели клеток. Это предотвращает репликацию патогена внутри клетки, а также предупреждает иммунную систему. [ 5 ]
Кроме того, TNF вызывает лихорадку , помогая организму бороться с инфекциями. TNF может вызывать лихорадку, вызывая высвобождение цитокинов интерлейкина-1 и интерлейкина-6 или через другие медиаторы, такие как PLA2 . ФНО или его медиаторы могут достигать гипоталамуса либо посредством кровообращения, либо посредством секреции макрофагами и эндотелиальными клетками вблизи гипоталамуса. TNF также может вызывать лихорадку, стимулируя первичные терминали блуждающего нерва в печени, которые подают сигнал нейронам о секреции норадреналина . Все эти пути завершаются синтезом простагландинов , которые взаимодействуют с OVLT в гипоталамусе, повышая целевую температуру тела. [ 43 ]
Центральная нервная система
[ редактировать ]TNF экспрессируется в различных клетках центральной нервной системы , включая глиальные клетки , микроглию , астроциты и нейроны , и играет решающую роль в поддержании гомеостаза. [ 12 ]
Посредством передачи сигналов TNFR1 TNF может увеличивать поверхностную экспрессию рецепторов AMPA и рецепторов NDMA в нейронах, усиливая синаптическую передачу. TNF также снижает поверхностную экспрессию рецепторов ГАМКА , снижая активность тормозных синапсов. TNF также может модулировать высвобождение глутамата , возбуждающего нейротрансмиттера, и S100B астроцитами , цинк-связывающего белка. Модуляция возбуждения и торможения нейронов с помощью TNF указывает на то, что TNF играет роль в синаптическом масштабировании и пластичности. [ 12 ]
Посредством передачи сигналов TNFR2 TNF способствует пролиферации и созреванию олигодендроцитов , которые образуют защитные миелиновые оболочки вокруг нервных клеток. С другой стороны, TNF становится цитотоксичным для клеток-предшественников олигодендроцитов, когда клетки контактируют с астроцитами. [ 12 ]
Вкусовое восприятие
[ редактировать ]Чрезмерные уровни воспалительных цитокинов, например, во время инфекции или аутоиммунитета, связаны с анорексией и снижением потребления пищи. Предполагается, что TNF снижает потребление пищи за счет повышения чувствительности к горькому вкусу, хотя точные механизмы этого неизвестны. [ 44 ]
Клиническое значение
[ редактировать ]Аутоиммунитет
[ редактировать ]Избыточное производство TNF играет ключевую роль в патологии аутоиммунных заболеваний , таких как ревматоидный артрит , воспалительные заболевания кишечника , псориатический артрит , псориаз и неинфекционный увеит . [ 7 ] При этих заболеваниях TNF ошибочно секретируется иммунными клетками в ответ на факторы окружающей среды или генетические мутации. Затем TNF вызывает воспалительную реакцию, повреждающую нормальные ткани. Блокаторы TNF используются для лечения этих заболеваний, часто с высокой эффективностью. [ 5 ]
TNF способствует воспалительным заболеваниям как путем активации воспалительных путей в клетках-мишенях, так и путем запуска клеточной гибели. Гибель клеток вызывает воспаление, подвергая внутриклеточные компоненты умирающих клеток воздействию соседних клеток. Кроме того, гибель эпителиальных клеток кожи или кишечника может повлиять на целостность барьера, позволяя микробам проникать в ткани и вызывать воспаление. Считается, что TNF вызывает гибель клеток при воспалительных заболеваниях из-за повышенных уровней интерферирующих цитокинов, повышенных уровней передачи сигналов TNFR2 или генетических мутаций, которые отключают контрольные точки гибели клеток. В моделях на животных одной только активации гибели клеток достаточно, чтобы вызвать аутовоспалительные заболевания. Лекарства, нацеленные конкретно на путь клеточной гибели TNF, оцениваются на предмет их эффективности против аутовоспалительных заболеваний. [ 5 ]
Рак
[ редактировать ]Первоначально TNF был обнаружен как агент, убивающий опухоли, особенно саркомы . Однако теперь известно, что TNF играет двойную роль при раке: как промотор и как ингибитор, благодаря своей способности индуцировать либо пролиферацию, либо гибель опухолевых клеток. Точные механизмы, определяющие роль TNF в развитии рака, неясны. В целом TNF считается промотором рака. [ 45 ]
Было показано, что при некоторых видах рака TNF играет ингибирующую роль, прежде всего при местном, многократном введении и в высоких концентрациях. Из-за неблагоприятных побочных эффектов TNF потенциальные методы лечения рака TNF стремятся максимизировать цитотоксичность опухолей, одновременно сводя к минимуму воздействие на весь организм. Некоторые методы лечения повышают цитотоксичность за счет ингибирования путей выживания клеток опухолей до лечения TNF. Другие методы лечения локализуют активность TNF с помощью слияний антитело-TNF, также известных как иммуноцитокины . Было показано, что местное лечение TNF вызывает регрессию опухоли, хотя оно редко вызывает полную ремиссию . Введение TNF в организм показало низкую эффективность и высокие побочные эффекты. [ 45 ]
Считается, что при многих видах рака TNF играет вспомогательную роль. Высокие уровни экспрессии TNF связаны с более поздними стадиями рака, а экспрессия TNF обнаруживается в опухолевых клетках на ранних стадиях заболевания. Экспрессия TNF может привести к привлечению лейкоцитов , которые способствуют метастазированию , а также к прямой активации путей, которые способствуют выживанию, инвазии и метастазированию опухоли. Блокаторы TNF, такие как инфликсимаб и этанерцепт, не вызывали ответа при большинстве распространенных или метастатических видов рака, но некоторые исследования показали стабилизацию заболевания. [ 45 ]
Инфекции
[ редактировать ]TNF играет решающую роль во врожденном иммунном ответе на инфекции. Соответственно, использование блокаторов TNF связано с повышенным риском заражения, например, вирусом Varicella-zoster , вирусом Эпштейна-Барр и цитомегаловирусом . [ 46 ]
И наоборот, TNF играет роль в прогрессировании ВИЧ , индуцируя апоптоз Т-клеток у ВИЧ-инфицированных людей. Сообщается, что блокада TNF привела к клиническому улучшению течения ВИЧ без ухудшения течения инфекции, хотя данные ограничены. [ 46 ]
Сепсис
[ редактировать ]Считается, что TNF вносит важный вклад в сепсис из-за его способности активировать врожденную иммунную систему и свертывание крови. У животных инъекция TNF может вызвать дисфункцию сердца, легких, почек и печени, аналогичную сепсису. Однако у людей, страдающих сепсисом, уровень TNF не повышен постоянно. [ 47 ]
Хотя блокаторы TNF показали эффективность при лечении сепсиса у мышей, они показали неоднозначные результаты при лечении сепсиса у людей. Считается, что это связано с двойной ролью, которую TNF играет в иммунной системе; блокирование TNF уменьшает тяжелое воспаление, вызывающее сепсис, но также снижает способность иммунной системы противостоять инфекции. Предполагается, что блокаторы ФНО более эффективны в случаях тяжелого сепсиса, когда вероятность смерти выше. [ 47 ]
Фиброз печени
[ редактировать ]TNF играет ключевую роль в повреждении и воспалении печени, но его роль в фиброзе печени противоречива. TNF способствует активации и выживанию звездчатых клеток печени (ЗКП), которые, как полагают, вносят основной вклад в фиброз печени. С другой стороны, TNF подавляет экспрессию коллагена альфа-1 типа 1 и пролиферацию ЗКП in vitro , что должно ингибировать фиброз печени. В целом считается, что TNF способствует фиброзу печени, способствуя выживанию HSC. [ 48 ]
Кроме того, гибель гепатоцитов , первоначальное событие, которое приводит к повреждению печени и фиброзу, может быть вызвано TNF, хотя эта связь неясна. Инъекция TNF сама по себе не вызывает гибель гепатоцитов in vivo . Однако когда инъекция TNF сочетается с ингибированием путей выживания, например, при инфекции вирусом гепатита С , TNF вызывает гибель гепатоцитов и острую печеночную недостаточность. Остатки погибших гепатоцитов потребляются ЗКП и клетками Купфера, которые затем секретируют факторы, способствующие фиброзу, такие как TGF-β , а также способствуют дальнейшей гибели гепатоцитов. [ 48 ]
Блокаторы TNF не используются для лечения фиброза печени. В клинических исследованиях алкогольного гепатита блокаторы ФНО не оказали существенного эффекта. [ 48 ]
Инсулинорезистентность
[ редактировать ]TNF способствует резистентности к инсулину , ингибируя субстрат 1 инсулинового рецептора (IRS1). В нормальных условиях IRS1 при активации инсулином подвергается фосфорилированию тирозина и увеличивает поглощение глюкозы в клетке. Этот процесс нарушается, когда TNF индуцирует сериновое фосфорилирование IRS1, превращая IRS1 в ингибитор инсулина. Инсулиновая резистентность, вызванная TNF, часто встречается при ожирении и может привести к диабету II типа . Было обнаружено, что уровень TNF повышается в жировой ткани людей и животных с ожирением, хотя остается неясным, почему ожирение вызывает высокие уровни TNF. [ 49 ]
Неалкогольная жировая болезнь печени
[ редактировать ]ФНО играет ключевую роль в патогенезе неалкогольной жировой болезни печени (НАЖБП). Когда жир накапливается в печени (так называемый стеатоз) , гепатоциты, клетки Купфера и инфильтрирующие иммунные клетки секретируют TNF. Предполагается, что ФНО способствует развитию НАЖБП, способствуя накоплению жира в печени, длительному воспалению и резистентности к инсулину. Клинические исследования показали, что уровни TNF коррелируют с тяжестью НАЖБП, хотя некоторые исследования показали обратное. Фармакологические стратегии, подавляющие TNF, показали благоприятное воздействие на НАЖБП, тогда как эффективность блокаторов TNF еще предстоит оценить. [ 50 ]
Мышечная атрофия
[ редактировать ]Состояния, вызывающие воспаление, такие как рак, могут повышать уровень TNF, что способствует атрофии мышц . TNF способствует атрофии мышц, активируя путь NF-κB, который активирует путь убиквитин-протеасома для разрушения белка, и ингибируя активацию сателлитных клеток , которые отвечают за регенерацию белка. Однако в клинических исследованиях блокаторы TNF оказали ограниченное влияние на атрофию мышц, вероятно, из-за многофакторной природы атрофии мышц. [ 51 ]
Упражнение
[ редактировать ]Во время физических упражнений быстро повышается уровень IL-6 , ингибитора TNF, что приводит к противовоспалительному эффекту. За этим следует последующее увеличение уровней IL-10 и растворимых рецепторов TNF, которые также ингибируют TNF. Хотя умеренные физические нагрузки не повышают уровень TNF, было показано, что напряженные упражнения повышают уровень TNF в два раза, вызывая провоспалительный эффект. Однако этот провоспалительный эффект перевешивается противовоспалительным действием IL-6, которое может усиливаться в 50 раз. Было доказано, что регулярные физические упражнения снижают базовый уровень TNF в долгосрочной перспективе. Таким образом, обычно считается, что упражнения ингибируют TNF, что способствует общему противовоспалительному эффекту упражнений. [ 52 ]
Нейровоспаление
[ редактировать ]В центральной нервной системе TNF в первую очередь продуцируется микроглией (типом макрофагов), а также нейронами , эндотелиальными клетками и иммунными клетками. Избыточный TNF способствует нейровоспалению , вызывая эксайтотоксичную гибель нейронов, повышая уровень глутамата , активируя микроглиальные клетки и разрушая гематоэнцефалический барьер . В результате показано, что TNF играет важную роль в заболеваниях центральной нервной системы, связанных с нейровоспалениями, включая нейросаркоидоз , рассеянный склероз , болезнь Нейро-Бехчета . [ 53 ]
Парадоксально, но блокаторы TNF могут вызывать демиелинизацию нейронов и ухудшать симптомы рассеянного склероза. Считается, что это связано с гомеостатической ролью TNF в центральной нервной системе, особенно в миелинизации нейронов посредством TNFR2. Селективная блокада TNFR1 показала положительные результаты на животных моделях. [ 53 ]
Нейровоспаление, индуцированное TNF, также связано с болезнью Альцгеймера и, как предполагается, способствует гиперфосфорилированию β-амилоидных бляшек и тау-белка, обнаруженному в мозге пациентов с болезнью Альцгеймера. Блокаторы TNF связаны со снижением риска развития болезни Альцгеймера. Некоторые исследования показали, что блокаторы TNF немного улучшают когнитивные функции у пациентов с болезнью Альцгеймера, хотя необходимы более масштабные исследования. Поскольку блокаторы ФНО не могут проникать через гематоэнцефалический барьер, считается, что снижение уровня ФНО в организме также снижает уровни ФНО в мозге. [ 54 ]
ЛОВУШКИ
[ редактировать ]При периодическом синдроме, связанном с рецептором TNF (TRAPS), генетические мутации в TNFR1 приводят к дефектному связыванию TNFR1 с TNF, а также к дефектному выделению TNFR1 - механизму, который ослабляет передачу сигналов TNFR1. Это вызывает периодическое воспаление, хотя точный механизм неизвестен. Блокаторы ФНО, такие как этанерцепт, показали частичную эффективность в уменьшении симптомов, в то время как другие блокаторы ФНО, такие как адалимумаб и инфликсимаб, ухудшают симптомы. [ 55 ]
Фармакология
[ редактировать ]Блокаторы ФНО
[ редактировать ]Блокаторы TNF действуют путем связывания с одной или обеими формами TNF, чтобы предотвратить его связывание с рецепторами. Кроме того, они могут запускать обратную передачу сигналов tmTNF, вызывая апоптоз, уничтожая клетки, экспрессирующие TNF. [ 53 ] Некоторые из них представляют собой моноклональные антитела , такие как инфликсимаб, адалимумаб, цертолизумаб пегол и голимумаб , тогда как другие, такие как этанерцепт, представляют собой слитые белки-ловушки , содержащие области связывания TNFR2. [ 7 ]
Разрабатываются новые блокаторы ФНО, в том числе небольшие соединения , которые могут специфически воздействовать на ФНО, а также моноклональные антитела с более низким потенциалом иммуногенности , такие как озорализумаб . [ 7 ]
Редко подавление ФНО может привести к развитию новой формы «парадоксального» аутоиммунитета. Предполагается, что отсутствие TNF способствует парадоксальному аутоиммунитету, вызывая сверхэкспрессию других цитокинов и увеличивая распространенность Т-клеток. [ 14 ]
Ссылки
[ редактировать ]- ^ Перейти обратно: а б с ENSG00000230108, ENSG00000223952, ENSG00000204490, ENSG00000228321, ENSG00000232810, ENSG00000228849, ENSG00000206439 GRCh38: выпуск ансамбля 89: ENSG00000228978, ENSG00000230108, ENSG00000223952, ENSG00000204490, ENSG00000228321, ENSG00000232810, ENSG00000228849, ENSG00000206439 – Ансамбль , май 2017 г.
- ^ Перейти обратно: а б с GRCm38: выпуск Ensembl 89: ENSMUSG00000024401 – Ensembl , май 2017 г.
- ^ «Ссылка на Human PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Ссылка на Mouse PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ Перейти обратно: а б с д и ж г час я дж к л м н ван Лоо Дж., Бертран М.Дж. (май 2023 г.). «Смерть от TNF: путь к воспалению» . Нат Рев Иммунол . 23 (5): 289–303. дои : 10.1038/s41577-022-00792-3 . ПМК 9665039 . ПМИД 36380021 .
- ^ Перейти обратно: а б с д и Марин I (ноябрь 2020 г.). «Суперсемейство факторов некроза опухоли: наследственные функции и ремоделирование в ранней эволюции позвоночных» . Геном Биол Эвол . 12 (11): 2074–2092. дои : 10.1093/gbe/evaa140 . ПМЦ 7674686 . ПМИД 33210144 .
- ^ Перейти обратно: а б с д и Чан Ди, Ли А.Х., Шин ХИ, Сон Х.Р., Пак Дж.Х., Кан ТБ и др. (март 2021 г.). «Роль фактора некроза опухоли альфа (TNF-α) в аутоиммунных заболеваниях и современные ингибиторы TNF-α в терапии» . Int J Mol Sci . 22 (5): 2719. doi : 10.3390/ijms22052719 . ПМЦ 7962638 . ПМИД 33800290 .
- ^ Перейти обратно: а б с д и ж г час я дж к л м н тот Фальво Ю.В., Цыцыкова А.В., Гольдфельд А.Е. (2010). «Транскрипционный контроль гена TNF». Патофизиология ФНО . Современные направления в области аутоиммунитета. Том. 11. Каргер. стр. 27–60. дои : 10.1159/000289196 . ISBN 978-3-8055-9384-7 . ПМЦ 4785889 . ПМИД 20173386 .
- ^ Перейти обратно: а б с д и Хориучи Т., Митома Х., Харашима С., Цукамото Х., Симода Т. (июль 2010 г.). «Трансмембранный ФНО-альфа: структура, функции и взаимодействие с агентами против ФНО» . Ревматология . 49 (7): 1215–1228. doi : 10.1093/ревматология/keq031 . ПМК 2886310 . ПМИД 20194223 .
- ^ Перейти обратно: а б с д и Сонди С., Паллай А. (январь 2017 г.). «Трансмембранная обратная передача сигналов TNF-альфа, ведущая к выработке TGF-бета, избирательно активируется молекулами, нацеленными на TNF: терапевтические последствия» . Фармакологические исследования . 115 : 124–132. дои : 10.1016/J.phrs.2016.11.025 . ПМИД 27888159 .
- ^ Перейти обратно: а б с Кайзер Г (21 ноября 2013 г.). «11.3C: Цитокины, важные для врожденного иммунитета». Микробиология . Свободные тексты.
- ^ Перейти обратно: а б с д Кальдито Н.Г. (июль 2023 г.). «Роль фактора некроза опухоли-альфа в центральной нервной системе: фокус на аутоиммунные нарушения» . Фронт Иммунол . 14 . дои : 10.3389/fimmu.2023.1213448 . ПМЦ 10360935 . ПМИД 37483590 .
- ^ Сетхи Дж. К., Хотамислигил Г. С. (октябрь 2021 г.). «Метаболические мессенджеры: фактор некроза опухоли» . Нат. Метаб . 3 (10): 1302–1312. дои : 10.1038/s42255-021-00470-z . ПМИД 34650277 .
- ^ Перейти обратно: а б Лопетузо Л.Р., Куомо С., Миньини I, Гасбаррини А., Папа А. (май 2023 г.). «В центре внимания аутоиммунные заболевания, связанные с фактором некроза опухоли (TNF)-α» . Int J Mol Sci 24 9):8187.doi : ( 10.3390/ijms24098187 . ПМЦ 10179362 . ПМИД 37175894 .
- ^ Лундин Дж.И., Чековей Х. (сентябрь 2009 г.). «Эндотоксин и рак» . Перспективы гигиены окружающей среды . 117 (9): 1344–1350. дои : 10.1289/ehp.0800439 . ПМК 225248 . ПМИД 19750096 .
- ^ Шир М.Дж., Перро А. (апрель 1944 г.). «Химическое лечение опухолей. IX. Реакции мышей с первичными подкожными опухолями на введение кровоизлиятельного бактериального полисахарида». Журнал Национального института рака . 4 (5): 461–476. дои : 10.1093/jnci/4.5.461 .
- ^ Шир М.Дж., Перро А. (август 1943 г.). «Химическое лечение опухолей. VI. Метод определения активности кровоизлиятельных бактериальных препаратов». Журнал Национального института рака . 4 (1): 99–105. дои : 10.1093/jnci/4.1.99 .
- ^ Перейти обратно: а б Карсвелл Э.А., Олд Л.Дж., Кассель Р.Л., Грин С., Фиоре Н., Уильямсон Б. (сентябрь 1975 г.). «Вызванный эндотоксином сывороточный фактор, вызывающий некроз опухолей» . Труды Национальной академии наук Соединенных Штатов Америки . 72 (9): 3666–3670. Бибкод : 1975PNAS...72.3666C . дои : 10.1073/pnas.72.9.3666 . ПМК 433057 . ПМИД 1103152 .
- ^ Перейти обратно: а б с д Раддл, Нью-Хэмпшир (апрель 2014 г.). «Лимфотоксин и ФНО: Как все начиналось – дань памяти путешественникам» . Обзоры цитокинов и факторов роста . 25 (2): 83–89. doi : 10.1016/j.cytogfr.2014.02.001 . ПМК 4027955 . ПМИД 24636534 .
- ^ Аггарвал Б.Б., Кор В.Дж., Хасс П.Е., Моффат Б., Спенсер С.А., Хензель В.Дж. и др. (февраль 1985 г.). «Фактор некроза опухолей человека. Производство, очистка и характеристика» . Журнал биологической химии . 260 (4): 2345–2354. дои : 10.1016/S0021-9258(18)89560-6 . ПМИД 3871770 .
- ^ Пенника Д., Недвин Дж.Э., Хейфлик Дж.С., Сибург П.Х., Деринк Р., Палладино М.А. и др. (декабрь 1985 г.). «Фактор некроза опухоли человека: структура предшественника, экспрессия и гомология с лимфотоксином». Природа . 312 (5996): 724–729. дои : 10.1038/312724a0 . ПМИД 6392892 .
- ^ Кларк И.А., Вирелизье Дж.Л., Карсвелл Э.А., Вуд PR (июнь 1981 г.). «Возможная важность медиаторов макрофагального происхождения при острой малярии» . Инфекция и иммунитет . 32 (3): 1058–1066. дои : 10.1128/iai.32.3.1058-1066.1981 . ПМК 351558 . ПМИД 6166564 .
- ^ Бейтлер Б., Милсарк И.В., Черами AC (август 1985 г.). «Пассивная иммунизация против кахектина/фактора некроза опухоли защищает мышей от летального действия эндотоксина». Наука . 229 (4716): 869–871. Бибкод : 1985Sci...229..869B . дои : 10.1126/science.3895437 . ПМИД 3895437 .
- ^ Трейси К.Дж., Бейтлер Б., Лоури С.Ф., Мерриуэзер Дж., Вулпе С., Милсарк И.В. и др. (октябрь 1986 г.). «Шок и повреждение тканей, вызванные рекомбинантным человеческим кахектином». Наука . 234 (4775): 470–474. Бибкод : 1986Sci...234..470T . дои : 10.1126/science.3764421 . ПМИД 3764421 .
- ^ Гудман М.Н. (май 1991 г.). «Фактор некроза опухоли вызывает распад белка скелетных мышц у крыс». Американский журнал физиологии . 260 (5, ч. 1): 727–730. дои : 10.1152/ajpendo.1991.260.5.E727 . ПМИД 2035628 .
- ^ Стефферл А., Хопкинс С.Дж., Ротвелл Нью-Джерси, Лухеши Г.Н. (август 1996 г.). «Роль TNF-альфа при лихорадке: противоположные действия человеческого и мышиного TNF-альфа и взаимодействие с IL-бета у крыс» . Британский журнал фармакологии . 118 (8): 1919–1924. дои : 10.1111/j.1476-5381.1996.tb15625.x . ПМК 1909906 . PMID 8864524 .
- ^ Каваками М., Керами А. (сентябрь 1981 г.). «Исследование эндотоксин-индуцированного снижения активности липопротеинлипазы» . Журнал экспериментальной медицины . 154 (3): 631–639. дои : 10.1084/jem.154.3.631 . ПМК 2186462 . PMID 7276825 .
- ^ Бейтлер Б., Гринвальд Д., Халмс Дж.Д., Чанг М., Пан Ю.К., Мэтисон Дж. и др. (август 1985 г.). «Идентичность фактора некроза опухоли и фактора кахектина, секретируемого макрофагами». Природа . 316 (6028): 552–554. Бибкод : 1985Natur.316..552B . дои : 10.1038/316552a0 . ПМИД 2993897 .
- ^ Браунинг Дж.Л., Нгам-ек А., Лоутон П., ДеМаринис Дж., Тизард Р., Чоу Э.П. и др. (март 1993 г.). «Лимфотоксин бета, новый член семейства TNF, который образует гетеромерный комплекс с лимфотоксином на поверхности клетки». Клетка . 72 (6): 847–856. дои : 10.1016/0092-8674(93)90574-а . ПМИД 7916655 .
- ^ Гримстад Ø (май 2016 г.). «Фактор некроза опухоли и живучий α». JAMA Дерматология . 152 (6): 557. doi : 10.1001/jamadermatol.2015.4322 . hdl : 10037/10660 . ПМИД 27168212 .
- ^ Перейти обратно: а б Пападакис К.А., Тарган С.Р. (октябрь 2000 г.). «Фактор некроза опухоли: биология и терапевтические ингибиторы» . Гастроэнтерология . 119 (4): 1148–1157. дои : 10.1053/gast.2000.18160 . ПМИД 11040201 .
- ^ Чен Ф (июнь 2004 г.). «TNF (фактор некроза опухоли (суперсемейство TNF, член 2))» . Атлас Генет Цитогенет Онкол Гематол .
- ^ Недвин Дж.Э., Нейлор С.Л., Сакагути А.Ю., Смит Д., Джарретт-Недвин Дж., Пенника Д. и др. (сентябрь 1985 г.). «Гены лимфотоксина человека и фактора некроза опухолей: структура, гомология и хромосомная локализация» . Исследования нуклеиновых кислот . 13 (17): 6361–6373. дои : 10.1093/нар/13.17.6361 . ПМК 321958 . ПМИД 2995927 .
- ^ Перейти обратно: а б Гетц Ф.В., Планас СП, Маккензи С.И. (май 2004 г.). «Факторы некроза опухоли». Развитие и сравнительная иммунология . 28 (5): 487–497. дои : 10.1016/j.dci.2003.09.008 . ПМИД 15062645 .
- ^ Смит Р.А., Бальони С. (май 1987 г.). «Активной формой фактора некроза опухоли является тример» . Журнал биологической химии . 262 (15): 6951–6954. дои : 10.1016/S0021-9258(18)48183-5 . ПМК 2886310 . ПМИД 20194223 .
- ^ Перейти обратно: а б Джонс Э., Стюарт Д., Уокер Н. (март 1989 г.). «Структура фактора некроза опухоли». Природа . 338 (6212): 225–228. Бибкод : 1989Natur.338..225J . дои : 10.1038/338225a0 . ПМИД 2922050 .
- ^ Хлодан Р., Пейн Р.Х. (июль 1995 г.). «Путь сворачивания и сборки фактора некроза опухоли TNF-альфа, глобулярного тримерного белка». Eur J Biochem . 231 (2): 381–387. doi : 10.1111/j.1432-1033.1995.tb20710.x (неактивен 31 августа 2024 г.). ПМИД 7635149 .
{{cite journal}}: CS1 maint: DOI неактивен по состоянию на август 2024 г. ( ссылка ) - ^ Селвуд Т., Яффе Е.К. (март 2012 г.). «Динамическая диссоциация гомоолигомеров и контроль функции белка» . Арх Биохим Биофиз . 519 (2): 131–143. дои : 10.1016/j.abb.2011.11.020 . ПМЦ 3298769 . ПМИД 22182754 .
- ^ ван Ши К.А., Ойеваар-де Хир П., Дейк Л., Круитхоф С., Волбинк Г., Риспенс Т. (сентябрь 2016 г.). «Терапевтические ингибиторы TNF могут дифференциально стабилизировать тримерный TNF, ингибируя обмен мономеров» . Научный представитель . 6 : 32747. Бибкод : 2016NatSR...632747V . дои : 10.1038/srep32747 . ПМК 5015024 . ПМИД 27605058 .
- ^ Яффе ЭК (январь 2013 г.). «Влияние динамики четвертичной структуры на открытие аллостерических лекарств» . Curr Top Med Chem . 13 (1): 55–63. дои : 10.2174/1568026611313010006 . ПМЦ 3631351 . ПМИД 23409765 .
- ^ Лоуренс С.Х., Яффе Е.К. (январь 2013 г.). «Расширение представлений о структурно-функциональных отношениях белка и кинетике ферментов: обучение с использованием морфеинов» . Биохим Мол Биол Образование . 36 (4): 274–283. дои : 10.1002/bmb.20211 . ПМЦ 2575429 . ПМИД 19578473 .
- ^ Перейти обратно: а б с д и Гоф П., Майлз И.А. (ноябрь 2020 г.). «Рецепторы фактора некроза опухоли: плейотропные сигнальные комплексы и их дифференциальные эффекты» . Фронт Иммунол . 11 . дои : 10.3389/fimmu.2020.585880 . ПМЦ 7723893 . ПМИД 33324405 .
- ^ Нетеа М.Г., Куллберг Б.Дж., Ван дер Меер Дж.В. (октябрь 2000 г.). «Циркулирующие цитокины как медиаторы лихорадки» . Клинические инфекционные болезни . 31 : 178–184. дои : 10.1086/317513 . ПМИД 11113021 .
- ^ Роджерс Н. (апрель 2015 г.). «Почему болезнь может оставлять горечь во рту» . Природа . дои : 10.1038/nature.2015.17415 .
- ^ Перейти обратно: а б с Бен-Барух А (май 2022 г.). «Фактор некроза опухоли α: индивидуальный подход к терапии рака» . Границы в иммунологии . 13 . дои : 10.3389/fimmu.2022.903679 . ПМЦ 9157545 . ПМИД 35663982 .
- ^ Перейти обратно: а б Ким С.Ю., Соломон Д.Х. (февраль 2010 г.). «Блокада фактора некроза опухоли и риск вирусной инфекции» . Обзоры природы Ревматология . 6 (3): 165–174. дои : 10.1038/nrheum.2009.279 . ПМК 3155180 . ПМИД 20142812 .
- ^ Перейти обратно: а б Цю П, Цуй X, Барочия А, Ли Ю, Натансон С, Эйхакер PQ (ноябрь 2011 г.). «Развивающийся опыт терапевтического ингибирования ФНО при сепсисе: рассмотрение потенциального влияния риска смерти» . Экспертное заключение по исследованию наркотиков . 20 (11): 1555–1564. дои : 10.1517/13543784.2011.623125 . ПМК 3523300 . ПМИД 21961576 .
- ^ Перейти обратно: а б с Ян Ю.М., Секи Э (декабрь 2015 г.). «TNFα при фиброзе печени» . Карр Патобиол Rep . 3 (4): 253–261. дои : 10.1007/s40139-015-0093-z . ПМК 4693602 . ПМИД 26726307 .
- ^ Бордон Ю. (июнь 2021 г.). «ФНО вызывает короткое замыкание рецептора инсулина» . Вехи природы .
- ^ Вахлиотис И.Д., Polyzos SA (июль 2023 г.). «Роль фактора некроза опухоли-Альфа в патогенезе и лечении неалкогольной жировой болезни печени» . Текущие отчеты об ожирении . 12 (3): 191–206. дои : 10.1007/s13679-023-00519-y . ПМЦ 10482776 . ПМИД 37407724 .
- ^ Чжоу Дж, Лю Б, Лян С, Ли Ю, Сун Ю (май 2016 г.). «Цитокиновая передача сигналов при атрофии скелетных мышц» . Тенденции в эндокринологии и обмене веществ . 27 (5): 335–347. дои : 10.1016/j.tem.2016.03.002 . ПМИД 27025788 .
- ^ Дочерти С., Харли Р., Маколи Дж.Дж. и др. (январь 2022 г.). «Влияние физических упражнений на цитокины: последствия для здоровья опорно-двигательного аппарата: обзор повествования» . BMC Sports Sci Med Rehabil . 14 (1): 5. дои : 10.1186/s13102-022-00397-2 . ПМК 8740100 . ПМИД 34991697 .
- ^ Перейти обратно: а б с Кальдито Н.Г. (июль 2023 г.). «Роль фактора некроза опухоли-альфа в центральной нервной системе: фокус на аутоиммунные нарушения» . Границы в иммунологии . 14 . дои : 10.3389/fimmu.2023.1213448 . ПМЦ 10360935 . ПМИД 37483590 .
- ^ Торрес-Акоста Н., О'Киф Дж.Х., О'Киф Э.Л., Исааксон Р., Смолл Дж. (ноябрь 2020 г.). «Терапевтический потенциал ингибирования TNF-α для профилактики болезни Альцгеймера» . Дж. Альцгеймер Дис . 78 (2): 619–626. дои : 10.3233/JAD-200711 . ПМЦ 7739965 . ПМИД 33016914 .
- ^ Кудричи С., Дойч Н., Аксентьевич И. (май 2020 г.). «Возвращаясь к периодическому синдрому, связанному с рецептором TNF (TRAPS): текущие перспективы» . Int J Mol Sci . 21 (9): 3263. doi : 10.3390/ijms21093263 . ПМЦ 7246474 . ПМИД 32380704 .
Внешние ссылки
[ редактировать ]- Фактор некроза опухоли-альфа в Национальной медицинской библиотеке США по медицинским предметным рубрикам (MeSH)
- Обзор всей структурной информации, доступной в PDB для UniProt : P01375 (фактор некроза опухоли) в PDBe-KB .