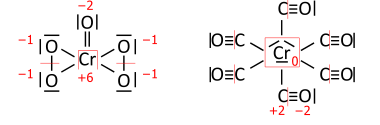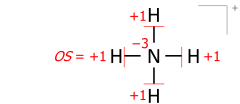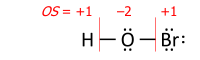Степень окисления
В химии степень окисления или степень окисления — это гипотетический заряд атома, если все его связи с другими атомами полностью ионные . Он описывает степень окисления (потерю электронов ) атома в химическом соединении . Концептуально степень окисления может быть положительной, отрицательной или нулевой. Хотя полностью ионные связи не встречаются в природе, многие связи обладают сильной ионностью, что делает степень окисления полезным показателем заряда.
Степень окисления атома не отражает «реальный» заряд этого атома или какое-либо другое фактическое свойство атома. Это особенно верно для высоких степеней окисления, когда энергия ионизации, необходимая для образования многократно положительного иона, намного превышает энергии, доступные в химических реакциях. Кроме того, степени окисления атомов в данном соединении могут различаться в зависимости от выбора шкалы электроотрицательности, используемой при их расчете. Таким образом, степень окисления атома в соединении — это чисто формализм. Тем не менее, это важно для понимания номенклатуры неорганических соединений . Кроме того, некоторые наблюдения, касающиеся химических реакций, можно объяснить на базовом уровне с точки зрения степеней окисления.
Oxidation states are typically represented by integers which may be positive, zero, or negative. In some cases, the average oxidation state of an element is a fraction, such as 8/3 для железа в магнетите Fe 3 O 4 ( см. ниже ). Сообщается, что самая высокая известная степень окисления равна +9, что проявляется иридием в катионе тетроксоиридия (IX) ( IrO + 4 ). [1] Прогнозируется, что даже степень окисления +10 может быть достигнута платиной в тетроксоплатине (X), ПтО 2+ 4 . [2] Самая низкая степень окисления — −5, как и у бора в Ал 3 г. до н.э. [3] и галлий в дигаллиде пентамагния ( Mg 5 Ga 2 ).
In inorganic nomenclature, the oxidation state is represented by a Roman numeral placed after the element name inside parentheses or as a superscript after the element symbol, e.g. Iron(III) oxide.
The term oxidation was first used by Antoine Lavoisier to signify the reaction of a substance with oxygen. Much later, it was realized that the substance, upon being oxidized, loses electrons, and the meaning was extended to include other reactions in which electrons are lost, regardless of whether oxygen was involved.The increase in the oxidation state of an atom, through a chemical reaction, is known as oxidation; a decrease in oxidation state is known as a reduction. Such reactions involve the formal transfer of electrons: a net gain in electrons being a reduction, and a net loss of electrons being oxidation. For pure elements, the oxidation state is zero.
IUPAC definition
[edit]IUPAC has published a "Comprehensive definition of oxidation state (IUPAC Recommendations 2016)".[4] It is a distillation of an IUPAC technical report "Toward a comprehensive definition of oxidation state" from 2014.[5] The current IUPAC Gold Book definition of oxidation state is:
The oxidation state of an atom is the charge of this atom after ionic approximation of its heteronuclear bonds.
— IUPAC[6]
and the term oxidation number is nearly synonymous.[7]
The ionic approximation means extrapolating bonds to ionic. Several criteria[8] were considered for the ionic approximation:
- Extrapolation of the bond's polarity;
- from the electronegativity difference,
- from the dipole moment, and
- from quantum‐chemical calculations of charges.
- Assignment of electrons according to the atom's contribution to the bonding Molecular orbital (MO)[8][9] or the electron's allegiance in a LCAO–MO model.[10]
In a bond between two different elements, the bond's electrons are assigned to its main atomic contributor typically of higher electronegativity; in a bond between two atoms of the same element, the electrons are divided equally. This is because most electronegativity scales depend on the atom's bonding state, which makes the assignment of the oxidation state a somewhat circular argument. For example, some scales may turn out unusual oxidation states, such as −6 for platinum in PtH2−4, for Pauling and Mulliken scales.[5] The dipole moments would, sometimes, also turn out abnormal oxidation numbers, such as in CO and NO, whichare oriented with their positive end towards oxygen. Therefore, this leaves the atom's contribution to thebonding MO, the atomic-orbital energy, and from quantum-chemical calculations of charges, as the only viable criteria with cogent values for ionic approximation. However, for a simple estimate for the ionic approximation, we can use Allen electronegativities,[5] as only that electronegativity scale is truly independent of the oxidation state, as it relates to the average valence‐electron energy of the free atom:
| Group → | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ↓ Period | ||||||||||||||||||
| 1 | H 2.300 | He 4.160 | ||||||||||||||||
| 2 | Li 0.912 | Be 1.576 | B 2.051 | C 2.544 | N 3.066 | O 3.610 | F 4.193 | Ne 4.787 | ||||||||||
| 3 | Na 0.869 | Mg 1.293 | Al 1.613 | Si 1.916 | P 2.253 | S 2.589 | Cl 2.869 | Ar 3.242 | ||||||||||
| 4 | K 0.734 | Ca 1.034 | Sc 1.19 | Ti 1.38 | V 1.53 | Cr 1.65 | Mn 1.75 | Fe 1.80 | Co 1.84 | Ni 1.88 | Cu 1.85 | Zn 1.588 | Ga 1.756 | Ge 1.994 | As 2.211 | Se 2.424 | Br 2.685 | Kr 2.966 |
| 5 | Rb 0.706 | Sr 0.963 | Y 1.12 | Zr 1.32 | Nb 1.41 | Mo 1.47 | Tc 1.51 | Ru 1.54 | Rh 1.56 | Pd 1.58 | Ag 1.87 | Cd 1.521 | In 1.656 | Sn 1.824 | Sb 1.984 | Te 2.158 | I 2.359 | Xe 2.582 |
| 6 | Cs 0.659 | Ba 0.881 | Lu 1.09 | Hf 1.16 | Ta 1.34 | W 1.47 | Re 1.60 | Os 1.65 | Ir 1.68 | Pt 1.72 | Au 1.92 | Hg 1.765 | Tl 1.789 | Pb 1.854 | Bi 2.01 | Po 2.19 | At 2.39 | Rn 2.60 |
| 7 | Fr 0.67 | Ra 0.89 | ||||||||||||||||
| See also: Electronegativities of the elements (data page) | ||||||||||||||||||
Determination
[edit]While introductory levels of chemistry teaching use postulated oxidation states, the IUPAC recommendation[4] and the Gold Book entry[6] list two entirely general algorithms for the calculation of the oxidation states of elements in chemical compounds.
Simple approach without bonding considerations
[edit]Introductory chemistry uses postulates: the oxidation state for an element in a chemical formula is calculated from the overall charge and postulated oxidation states for all the other atoms.
A simple example is based on two postulates,
where OS stands for oxidation state. This approach yields correct oxidation states in oxides and hydroxides of any single element, and in acids such as sulfuric acid (H2SO4) or dichromic acid (H2Cr2O7). Its coverage can be extended either by a list of exceptions or by assigning priority to the postulates. The latter works for hydrogen peroxide (H2O2) where the priority of rule 1 leaves both oxygens with oxidation state −1.
Additional postulates and their ranking may expand the range of compounds to fit a textbook's scope. As an example, one postulatory algorithm from many possible; in a sequence of decreasing priority:
- An element in a free form has OS = 0.
- In a compound or ion, the sum of the oxidation states equals the total charge of the compound or ion.
- Fluorine in compounds has OS = −1; this extends to chlorine and bromine only when not bonded to a lighter halogen, oxygen or nitrogen.
- Group 1 and group 2 metals in compounds have OS = +1 and +2, respectively.
- Hydrogen has OS = +1 but adopts −1 when bonded as a hydride to metals or metalloids.
- Oxygen in compounds has OS = −2 but only when not bonded to oxygen (e.g. in peroxides) or fluorine.
This set of postulates covers oxidation states of fluorides, chlorides, bromides, oxides, hydroxides, and hydrides of any single element. It covers all oxoacids of any central atom (and all their fluoro-, chloro-, and bromo-relatives), as well as salts of such acids with group 1 and 2 metals. It also covers iodides, sulfides, and similar simple salts of these metals.
Algorithm of assigning bonds
[edit]This algorithm is performed on a Lewis structure (a diagram that shows all valence electrons). Oxidation state equals the charge of an atom after each of its heteronuclear bonds has been assigned to the more electronegative partner of the bond (except when that partner is a reversibly bonded Lewis-acid ligand) and homonuclear bonds have been divided equally:
where each "—" represents an electron pair (either shared between two atoms or solely on one atom), and "OS" is the oxidation state as a numerical variable.
After the electrons have been assigned according to the vertical red lines on the formula, the total number of valence electrons that now "belong" to each atom is subtracted from the number N of valence electrons of the neutral atom (such as 5 for nitrogen in group 15) to yield that atom's oxidation state.
This example shows the importance of describing the bonding. Its summary formula, HNO3, corresponds to two structural isomers; the peroxynitrous acid in the above figure and the more stable nitric acid. With the formula HNO3, the simple approach without bonding considerations yields −2 for all three oxygens and +5 for nitrogen, which is correct for nitric acid. For the peroxynitrous acid, however, both oxygens in the O–O bond have OS = −1, and the nitrogen has OS = +3, which requires a structure to understand.
Organic compounds are treated in a similar manner; exemplified here on functional groups occurring in between methane (CH4) and carbon dioxide (CO2):
Analogously for transition-metal compounds; CrO(O2)2 on the left has a total of 36 valence electrons (18 pairs to be distributed), and hexacarbonylchromium (Cr(CO)6) on the right has 66 valence electrons (33 pairs):
A key step is drawing the Lewis structure of the molecule (neutral, cationic, anionic): Atom symbols are arranged so that pairs of atoms can be joined by single two-electron bonds as in the molecule (a sort of "skeletal" structure), and the remaining valence electrons are distributed such that sp atoms obtain an octet (duet for hydrogen) with a priority that increases in proportion with electronegativity. In some cases, this leads to alternative formulae that differ in bond orders (the full set of which is called the resonance formulas). Consider the sulfate anion (SO2−4) with 32 valence electrons; 24 from oxygens, 6 from sulfur, 2 of the anion charge obtained from the implied cation. The bond orders to the terminal oxygens do not affect the oxidation state so long as the oxygens have octets. Already the skeletal structure, top left, yields the correct oxidation states, as does the Lewis structure, top right (one of the resonance formulas):
The bond-order formula at the bottom is closest to the reality of four equivalent oxygens each having a total bond order of 2. That total includes the bond of order 1/2 to the implied cation and follows the 8 − N rule[5] requiring that the main-group atom's bond-order total equals 8 − N valence electrons of the neutral atom, enforced with a priority that proportionately increases with electronegativity.
This algorithm works equally for molecular cations composed of several atoms. An example is the ammonium cation of 8 valence electrons (5 from nitrogen, 4 from hydrogens, minus 1 electron for the cation's positive charge):
Drawing Lewis structures with electron pairs as dashes emphasizes the essential equivalence of bond pairs and lone pairs when counting electrons and moving bonds onto atoms. Structures drawn with electron dot pairs are of course identical in every way:
The algorithm's caveat
[edit]The algorithm contains a caveat, which concerns rare cases of transition-metal complexes with a type of ligand that is reversibly bonded as a Lewis acid (as an acceptor of the electron pair from the transition metal); termed a "Z-type" ligand in Green's covalent bond classification method. The caveat originates from the simplifying use of electronegativity instead of the MO-based electron allegiance to decide the ionic sign.[4] One early example is the O2S−RhCl(CO)(PPh3)2 complex[11] with sulfur dioxide (SO2) as the reversibly-bonded acceptor ligand (released upon heating). The Rh−S bond is therefore extrapolated ionic against Allen electronegativities of rhodium and sulfur, yielding oxidation state +1 for rhodium:
Algorithm of summing bond orders
[edit]This algorithm works on Lewis structures and bond graphs of extended (non-molecular) solids:
Oxidation state is obtained by summing the heteronuclear-bond orders at the atom as positive if that atom is the electropositive partner in a particular bond and as negative if not, and the atom’s formal charge (if any) is added to that sum. The same caveat as above applies.
Applied to a Lewis structure
[edit]An example of a Lewis structure with no formal charge,
illustrates that, in this algorithm, homonuclear bonds are simply ignored (the bond orders are in blue).
Carbon monoxide exemplifies a Lewis structure with formal charges:
To obtain the oxidation states, the formal charges are summed with the bond-order value taken positively at the carbon and negatively at the oxygen.
Applied to molecular ions, this algorithm considers the actual location of the formal (ionic) charge, as drawn in the Lewis structure. As an example, summing bond orders in the ammonium cation yields −4 at the nitrogen of formal charge +1, with the two numbers adding to the oxidation state of −3:
The sum of oxidation states in the ion equals its charge (as it equals zero for a neutral molecule).
Also in anions, the formal (ionic) charges have to be considered when nonzero. For sulfate this is exemplified with the skeletal or Lewis structures (top), compared with the bond-order formula of all oxygens equivalent and fulfilling the octet and 8 − N rules (bottom):
Applied to bond graph
[edit]A bond graph in solid-state chemistry is a chemical formula of an extended structure, in which direct bonding connectivities are shown. An example is the AuORb3 perovskite, the unit cell of which is drawn on the left and the bond graph (with added numerical values) on the right:
We see that the oxygen atom bonds to the six nearest rubidium cations, each of which has 4 bonds to the auride anion. The bond graph summarizes these connectivities. The bond orders (also called bond valences) sum up to oxidation states according to the attached sign of the bond's ionic approximation (there are no formal charges in bond graphs).
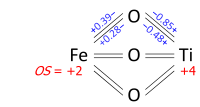
Determination of oxidation states from a bond graph can be illustrated on ilmenite, FeTiO3. We may ask whether the mineral contains Fe2+ and Ti4+, or Fe3+ and Ti3+. Its crystal structure has each metal atom bonded to six oxygens and each of the equivalent oxygens to two irons and two titaniums, as in the bond graph below. Experimental data show that three metal-oxygen bonds in the octahedron are short and three are long (the metals are off-center). The bond orders (valences), obtained from the bond lengths by the bond valence method, sum up to 2.01 at Fe and 3.99 at Ti; which can be rounded off to oxidation states +2 and +4, respectively:
Balancing redox
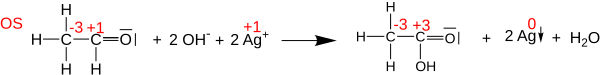
[edit]Oxidation states can be useful for balancing chemical equations for oxidation-reduction (or redox) reactions, because the changes in the oxidized atoms have to be balanced by the changes in the reduced atoms. For example, in the reaction of acetaldehyde with Tollens' reagent to form acetic acid (shown below), the carbonyl carbon atom changes its oxidation state from +1 to +3 (loses two electrons). This oxidation is balanced by reducing two Ag+ cations to Ag0 (gaining two electrons in total).
An inorganic example is the Bettendorf reaction using tin dichloride (SnCl2) to prove the presence of arsenite ions in a concentrated HCl extract. When arsenic(III) is present, a brown coloration appears forming a dark precipitate of arsenic, according to the following simplified reaction:
Here three tin atoms are oxidized from oxidation state +2 to +4, yielding six electrons that reduce two arsenic atoms from oxidation state +3 to 0. The simple one-line balancing goes as follows: the two redox couples are written down as they react;
One tin is oxidized from oxidation state +2 to +4, a two-electron step, hence 2 is written in front of the two arsenic partners. One arsenic is reduced from +3 to 0, a three-electron step, hence 3 goes in front of the two tin partners. An alternative three-line procedure is to write separately the half-reactions for oxidation and reduction, each balanced with electrons, and then to sum them up such that the electrons cross out. In general, these redox balances (the one-line balance or each half-reaction) need to be checked for the ionic and electron charge sums on both sides of the equation being indeed equal. If they are not equal, suitable ions are added to balance the charges and the non-redox elemental balance.
Appearances
[edit]Nominal oxidation states
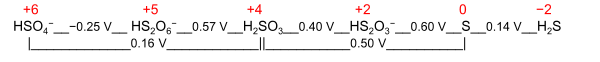
[edit]A nominal oxidation state is a general term with two different definitions:
- Electrochemical oxidation state[5]: 1060 represents a molecule or ion in the Latimer diagram or Frost diagram for its redox-active element. An example is the Latimer diagram for sulfur at pH 0 where the electrochemical oxidation state +2 for sulfur puts HS
2O−
3 between S and H2SO3:
- Systematic oxidation state is chosen from close alternatives as a pedagogical description. An example is the oxidation state of phosphorus in H3PO3 (structurally diprotic HPO(OH)2) taken nominally as +3, while Allen electronegativities of phosphorus and hydrogen suggest +5 by a narrow margin that makes the two alternatives almost equivalent:
- Both alternative oxidation numbers for phosphorus make chemical sense, depending on which chemical property or reaction is emphasized. By contrast, a calculated alternative, such as the average (+4) does not.
Ambiguous oxidation states
[edit]Lewis formulae are rule-based approximations of chemical reality, as are Allen electronegativities. Still, oxidation states may seem ambiguous when their determination is not straightforward. If only an experiment can determine the oxidation state, the rule-based determination is ambiguous (insufficient). There are also truly dichotomous values that are decided arbitrarily.
Oxidation-state determination from resonance formulas
[edit]Seemingly ambiguous oxidation states are derived from a set of resonance formulas of equal weights for a molecule having heteronuclear bonds where the atom connectivity does not correspond to the number of two-electron bonds dictated by the 8 − N rule.[5]: 1027 An example is S2N2 where four resonance formulas featuring one S=N double bond have oxidation states +2 and +4 for the two sulfur atoms, which average to +3 because the two sulfur atoms are equivalent in this square-shaped molecule.
A physical measurement is needed to determine oxidation state
[edit]- when a non-innocent ligand is present, of hidden or unexpected redox properties that could otherwise be assigned to the central atom. An example is the nickel dithiolate complex, Ni(S
2C
2H
2)2−
2.[5]: 1056–1057 - when the redox ambiguity of a central atom and ligand yields dichotomous oxidation states of close stability, thermally induced tautomerism may result, as exemplified by manganese catecholate, Mn(C6H4O2)3.[5]: 1057–1058 Assignment of such oxidation states requires spectroscopic,[12] magnetic or structural data.
- when the bond order has to be ascertained along with an isolated tandem of a heteronuclear and a homonuclear bond. An example is thiosulfate S
2O2−
3 having two possible oxidation states (bond orders are in blue and formal charges in green):
- The S–S distance measurement in thiosulfate is needed to reveal that this bond order is very close to 1, as in the formula on the left.
Ambiguous/arbitrary oxidation states
[edit]- when the electronegativity difference between two bonded atoms is very small (as in H3PO3). Two almost equivalent pairs of oxidation states, arbitrarily chosen, are obtained for these atoms.
- when an electronegative p-block atom forms solely homonuclear bonds, the number of which differs from the number of two-electron bonds suggested by rules. Examples are homonuclear finite chains like N−
3 (the central nitrogen connects two atoms with four two-electron bonds while only three two-electron bonds[13] are required by the 8 − N rule[5]: 1027 ) or I−
3 (the central iodine connects two atoms with two two-electron bonds while only one two-electron bond fulfills the 8 − N rule). A sensible approach is to distribute the ionic charge over the two outer atoms.[5] Such a placement of charges in a polysulfide S2−
n (where all inner sulfurs form two bonds, fulfilling the 8 − N rule) follows already from its Lewis structure.[5] - when the isolated tandem of a heteronuclear and a homonuclear bond leads to a bonding compromise in between two Lewis structures of limiting bond orders. An example is N2O:
- The typical oxidation state of nitrogen in N2O is +1, which also obtains for both nitrogens by a molecular orbital approach.[8] The formal charges on the right comply with electronegativities, which implies an added ionic bonding contribution. Indeed, the estimated N−N and N−O bond orders are 2.76 and 1.9, respectively,[5] approaching the formula of integer bond orders that would include the ionic contribution explicitly as a bond (in green):
- Conversely, formal charges against electronegativities in a Lewis structure decrease the bond order of the corresponding bond. An example is carbon monoxide with a bond-order estimate of 2.6.[14]
Fractional oxidation states
[edit]Fractional oxidation states are often used to represent the average oxidation state of several atoms of the same element in a structure. For example, the formula of magnetite is Fe
3O
4, implying an average oxidation state for iron of +8/3.[15]: 81–82 However, this average value may not be representative if the atoms are not equivalent. In a Fe
3O
4 crystal below 120 K (−153 °C), two-thirds of the cations are Fe3+
and one-third are Fe2+
, and the formula may be more clearly represented as FeO·Fe
2O
3.[16]
Likewise, propane, C
3H
8, has been described as having a carbon oxidation state of −8/3.[17] Again, this is an average value since the structure of the molecule is H
3C−CH
2−CH
3, with the first and third carbon atoms each having an oxidation state of −3 and the central one −2.
An example with true fractional oxidation states for equivalent atoms is potassium superoxide, KO
2. The diatomic superoxide ion O−
2 has an overall charge of −1, so each of its two equivalent oxygen atoms is assigned an oxidation state of −1/2. This ion can be described as a resonance hybrid of two Lewis structures, where each oxygen has an oxidation state of 0 in one structure and −1 in the other.
For the cyclopentadienyl anion C
5H−
5, the oxidation state of C is −1 + −1/5 = −6/5. The −1 occurs because each carbon is bonded to one hydrogen atom (a less electronegative element), and the −1/5 because the total ionic charge of −1 is divided among five equivalent carbons. Again this can be described as a resonance hybrid of five equivalent structures, each having four carbons with oxidation state −1 and one with −2.
Examples of fractional oxidation states for carbon Oxidation state Example species −6/5 C
5H−
5−6/7 C
7H+
7+3/2 C
4O2−
4
Finally, fractional oxidation numbers are not used in the chemical nomenclature.[18]: 66 For example the red lead Pb
3O
4 is represented as lead(II,IV) oxide, showing the oxidation states of the two nonequivalent lead atoms.
Elements with multiple oxidation states
[edit]Most elements have more than one possible oxidation state. For example, carbon has nine possible integer oxidation states from −4 to +4:
Integer oxidation states of carbon Oxidation state Example compound −4 CH
4−3 C
2H
6−2 C
2H
4, CH
3Cl−1 C
2H
2, C
6H
6, (CH
2OH)
20 HCHO, CH
2Cl
2+1 OCHCHO, CHCl
2CHCl
2+2 HCOOH, CHCl
3+3 HOOCCOOH, C
2Cl
6+4 CCl
4, CO
2
Oxidation state in metals
[edit]Many compounds with luster and electrical conductivity maintain a simple stoichiometric formula, such as the golden TiO, blue-black RuO2 or coppery ReO3, all of obvious oxidation state. Ultimately, assigning the free metallic electrons to one of the bonded atoms is not comprehensive and can yield unusual oxidation states. Examples are the LiPb and Cu
3Au ordered alloys, the composition and structure of which are largely determined by atomic size and packing factors. Should oxidation state be needed for redox balancing, it is best set to 0 for all atoms of such an alloy.
List of oxidation states of the elements
[edit]This is a list of known oxidation states of the chemical elements, excluding nonintegral values. The most common states appear in bold. The table is based on that of Greenwood and Earnshaw,[19] with additions noted. Every element exists in oxidation state 0 when it is the pure non-ionized element in any phase, whether monatomic or polyatomic allotrope. The column for oxidation state 0 only shows elements known to exist in oxidation state 0 in compounds.
| Element | Negative states | Positive states | Group | Notes | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| −5 | −4 | −3 | −2 | −1 | 0 | +1 | +2 | +3 | +4 | +5 | +6 | +7 | +8 | +9 | |||||
| Z | |||||||||||||||||||
| 1 | hydrogen | H | −1 | 0 | +1 | 1 | [20] | ||||||||||||
| 2 | helium | He | 0 | 18 | [21] | ||||||||||||||
| 3 | lithium | Li | 0 | +1 | 1 | [22][23] | |||||||||||||
| 4 | beryllium | Be | 0 | +1 | +2 | 2 | [24][25] | ||||||||||||
| 5 | boron | B | −5 | −1 | 0 | +1 | +2 | +3 | 13 | [26][27][28] | |||||||||
| 6 | carbon | C | −4 | −3 | −2 | −1 | 0 | +1 | +2 | +3 | +4 | 14 | |||||||
| 7 | nitrogen | N | −3 | −2 | −1 | 0 | +1 | +2 | +3 | +4 | +5 | 15 | [29] | ||||||
| 8 | oxygen | O | −2 | −1 | 0 | +1 | +2 | 16 | |||||||||||
| 9 | fluorine | F | −1 | 0 | 17 | [30][31] | |||||||||||||
| 10 | neon | Ne | 0 | 18 | [32] | ||||||||||||||
| 11 | sodium | Na | −1 | 0 | +1 | 1 | [22][33] | ||||||||||||
| 12 | magnesium | Mg | 0 | +1 | +2 | 2 | [34][35] | ||||||||||||
| 13 | aluminium | Al | −2 | −1 | 0 | +1 | +2 | +3 | 13 | [36][37][38][39] | |||||||||
| 14 | silicon | Si | −4 | −3 | −2 | −1 | 0 | +1 | +2 | +3 | +4 | 14 | [40] | ||||||
| 15 | phosphorus | P | −3 | −2 | −1 | 0 | +1 | +2 | +3 | +4 | +5 | 15 | [41] | ||||||
| 16 | sulfur | S | −2 | −1 | 0 | +1 | +2 | +3 | +4 | +5 | +6 | 16 | |||||||
| 17 | chlorine | Cl | −1 | 0 | +1 | +2 | +3 | +4 | +5 | +6 | +7 | 17 | [42][43] | ||||||
| 18 | argon | Ar | 0 | 18 | [44] | ||||||||||||||
| 19 | potassium | K | −1 | +1 | 1 | [22] | |||||||||||||
| 20 | calcium | Ca | +1 | +2 | 2 | [45][46] | |||||||||||||
| 21 | scandium | Sc | 0 | +1 | +2 | +3 | 3 | [47][48][49] | |||||||||||
| 22 | titanium | Ti | −2 | −1 | 0 | +1 | +2 | +3 | +4 | 4 | [50][51][52][53] | ||||||||
| 23 | vanadium | V | −3 | −1 | 0 | +1 | +2 | +3 | +4 | +5 | 5 | [51] | |||||||
| 24 | chromium | Cr | −4 | −2 | −1 | 0 | +1 | +2 | +3 | +4 | +5 | +6 | 6 | [51] | |||||
| 25 | manganese | Mn | −3 | −1 | 0 | +1 | +2 | +3 | +4 | +5 | +6 | +7 | 7 | [54][55] | |||||
| 26 | iron | Fe | −4 | −2 | −1 | 0 | +1 | +2 | +3 | +4 | +5 | +6 | +7 | 8 | [56][57][58] | ||||
| 27 | cobalt | Co | −3 | −1 | 0 | +1 | +2 | +3 | +4 | +5 | 9 | [51] | |||||||
| 28 | nickel | Ni | −2 | −1 | 0 | +1 | +2 | +3 | +4 | 10 | [59] | ||||||||
| 29 | copper | Cu | −2 | 0 | +1 | +2 | +3 | +4 | 11 | [58][60] | |||||||||
| 30 | zinc | Zn | −2 | 0 | +1 | +2 | 12 | [58][61][62][63] | |||||||||||
| 31 | gallium | Ga | −5 | −4 | −3 | −2 | −1 | 0 | +1 | +2 | +3 | 13 | [37][64][65][66] | ||||||
| 32 | germanium | Ge | −4 | −3 | −2 | −1 | 0 | +1 | +2 | +3 | +4 | 14 | [67][40] | ||||||
| 33 | arsenic | As | −3 | −2 | −1 | 0 | +1 | +2 | +3 | +4 | +5 | 15 | [37][68][69][70] | ||||||
| 34 | selenium | Se | −2 | −1 | 0 | +1 | +2 | +3 | +4 | +5 | +6 | 16 | [71][72][73][74][75] | ||||||
| 35 | bromine | Br | −1 | 0 | +1 | +2 | +3 | +4 | +5 | +7 | 17 | [76][77] | |||||||
| 36 | krypton | Kr | 0 | +1 | +2 | 18 | |||||||||||||
| 37 | rubidium | Rb | −1 | +1 | 1 | [22] | |||||||||||||
| 38 | strontium | Sr | +1 | +2 | 2 | [78][46] | |||||||||||||
| 39 | yttrium | Y | 0 | +1 | +2 | +3 | 3 | [79][80][81] | |||||||||||
| 40 | zirconium | Zr | −2 | 0 | +1 | +2 | +3 | +4 | 4 | [51][82][83] | |||||||||
| 41 | niobium | Nb | −3 | −1 | 0 | +1 | +2 | +3 | +4 | +5 | 5 | [51][84][85] | |||||||
| 42 | molybdenum | Mo | −4 | −2 | −1 | 0 | +1 | +2 | +3 | +4 | +5 | +6 | 6 | [51] | |||||
| 43 | technetium | Tc | −1 | 0 | +1 | +2 | +3 | +4 | +5 | +6 | +7 | 7 | [86] | ||||||
| 44 | ruthenium | Ru | −4 | −2 | 0 | +1 | +2 | +3 | +4 | +5 | +6 | +7 | +8 | 8 | [51][58] | ||||
| 45 | rhodium | Rh | −3 | −1 | 0 | +1 | +2 | +3 | +4 | +5 | +6 | +7 | 9 | [51][87][88] | |||||
| 46 | palladium | Pd | 0 | +1 | +2 | +3 | +4 | +5 | 10 | [89][90][91][92] | |||||||||
| 47 | silver | Ag | −2 | −1 | 0 | +1 | +2 | +3 | 11 | [58][93][94] | |||||||||
| 48 | cadmium | Cd | −2 | +1 | +2 | 12 | [58][95] | ||||||||||||
| 49 | indium | In | −5 | −2 | −1 | 0 | +1 | +2 | +3 | 13 | [37][96][97][98] | ||||||||
| 50 | tin | Sn | −4 | −3 | −2 | −1 | 0 | +1 | +2 | +3 | +4 | 14 | [37][99][100][40] | ||||||
| 51 | antimony | Sb | −3 | −2 | −1 | 0 | +1 | +2 | +3 | +4 | +5 | 15 | [37][101][102][103][104] | ||||||
| 52 | tellurium | Te | −2 | −1 | 0 | +1 | +2 | +3 | +4 | +5 | +6 | 16 | [37][105][106][107][108] | ||||||
| 53 | iodine | I | −1 | 0 | +1 | +2 | +3 | +4 | +5 | +6 | +7 | 17 | [109][110][111][112] | ||||||
| 54 | xenon | Xe | 0 | +2 | +4 | +6 | +8 | 18 | [113][114][115] | ||||||||||
| 55 | caesium | Cs | −1 | +1 | 1 | [22] | |||||||||||||
| 56 | barium | Ba | +1 | +2 | 2 | [116][46] | |||||||||||||
| 57 | lanthanum | La | 0 | +1 | +2 | +3 | f-block groups | [79][117] | |||||||||||
| 58 | cerium | Ce | +2 | +3 | +4 | f-block groups | |||||||||||||
| 59 | praseodymium | Pr | 0 | +1 | +2 | +3 | +4 | +5 | f-block groups | [79][118][119][120] | |||||||||
| 60 | neodymium | Nd | 0 | +2 | +3 | +4 | f-block groups | [79][121] | |||||||||||
| 61 | promethium | Pm | +2 | +3 | f-block groups | [122] | |||||||||||||
| 62 | samarium | Sm | 0 | +1 | +2 | +3 | f-block groups | [123] | |||||||||||
| 63 | europium | Eu | 0 | +2 | +3 | f-block groups | [79] | ||||||||||||
| 64 | gadolinium | Gd | 0 | +1 | +2 | +3 | f-block groups | [79] | |||||||||||
| 65 | terbium | Tb | 0 | +1 | +2 | +3 | +4 | f-block groups | [79][117][122] | ||||||||||
| 66 | dysprosium | Dy | 0 | +2 | +3 | +4 | f-block groups | [79][124] | |||||||||||
| 67 | holmium | Ho | 0 | +2 | +3 | f-block groups | [79][122] | ||||||||||||
| 68 | erbium | Er | 0 | +2 | +3 | f-block groups | [79][122] | ||||||||||||
| 69 | thulium | Tm | 0 | +1 | +2 | +3 | f-block groups | [79][117] | |||||||||||
| 70 | ytterbium | Yb | 0 | +1 | +2 | +3 | f-block groups | [79][117] | |||||||||||
| 71 | lutetium | Lu | 0 | +2 | +3 | 3 | [79][122] | ||||||||||||
| 72 | hafnium | Hf | −2 | 0 | +1 | +2 | +3 | +4 | 4 | [51][83][125] | |||||||||
| 73 | tantalum | Ta | −3 | −1 | 0 | +1 | +2 | +3 | +4 | +5 | 5 | [51][85] | |||||||
| 74 | tungsten | W | −4 | −2 | −1 | 0 | +1 | +2 | +3 | +4 | +5 | +6 | 6 | [51] | |||||
| 75 | rhenium | Re | −3 | −1 | 0 | +1 | +2 | +3 | +4 | +5 | +6 | +7 | 7 | [126] | |||||
| 76 | osmium | Os | −4 | −2 | −1 | 0 | +1 | +2 | +3 | +4 | +5 | +6 | +7 | +8 | 8 | [58][127] | |||
| 77 | iridium | Ir | −3 | −2 | −1 | 0 | +1 | +2 | +3 | +4 | +5 | +6 | +7 | +8 | +9 | 9 | [128][129][130][131][132] | ||
| 78 | platinum | Pt | −3 | −2 | −1 | 0 | +1 | +2 | +3 | +4 | +5 | +6 | 10 | [58][133][134] | |||||
| 79 | gold | Au | −3 | −2 | −1 | 0 | +1 | +2 | +3 | +5 | 11 | [58][135] | |||||||
| 80 | mercury | Hg | −2 | +1 | +2 | 12 | [58][136] | ||||||||||||
| 81 | thallium | Tl | −5 | −2 | −1 | +1 | +2 | +3 | 13 | [37][137][138][139] | |||||||||
| 82 | lead | Pb | −4 | −2 | −1 | 0 | +1 | +2 | +3 | +4 | 14 | [37][140][141][142] | |||||||
| 83 | bismuth | Bi | −3 | −2 | −1 | 0 | +1 | +2 | +3 | +4 | +5 | 15 | [143][144][145][146][147] | ||||||
| 84 | polonium | Po | −2 | +2 | +4 | +5 | +6 | 16 | [148] | ||||||||||
| 85 | astatine | At | −1 | +1 | +3 | +5 | +7 | 17 | |||||||||||
| 86 | radon | Rn | +2 | +6 | 18 | [149][150][151] | |||||||||||||
| 87 | francium | Fr | +1 | 1 | |||||||||||||||
| 88 | radium | Ra | +2 | 2 | |||||||||||||||
| 89 | actinium | Ac | +3 | f-block groups | |||||||||||||||
| 90 | thorium | Th | −1 | +1 | +2 | +3 | +4 | f-block groups | [152][153][154] | ||||||||||
| 91 | protactinium | Pa | +2 | +3 | +4 | +5 | f-block groups | [155] | |||||||||||
| 92 | uranium | U | −1 | +1 | +2 | +3 | +4 | +5 | +6 | f-block groups | [156][157][158] | ||||||||
| 93 | neptunium | Np | +2 | +3 | +4 | +5 | +6 | +7 | f-block groups | [159] | |||||||||
| 94 | plutonium | Pu | +2 | +3 | +4 | +5 | +6 | +7 | +8 | f-block groups | [160][161] | ||||||||
| 95 | americium | Am | +2 | +3 | +4 | +5 | +6 | +7 | f-block groups | [162] | |||||||||
| 96 | curium | Cm | +3 | +4 | +5 | +6 | f-block groups | [163][164][165][166] | |||||||||||
| 97 | berkelium | Bk | +2 | +3 | +4 | +5 | f-block groups | [163][164][167][168][169] | |||||||||||
| 98 | californium | Cf | +2 | +3 | +4 | +5 | f-block groups | [163][164] | |||||||||||
| 99 | einsteinium | Es | +2 | +3 | +4 | f-block groups | [170] | ||||||||||||
| 100 | fermium | Fm | +2 | +3 | f-block groups | ||||||||||||||
| 101 | mendelevium | Md | +2 | +3 | f-block groups | ||||||||||||||
| 102 | nobelium | No | +2 | +3 | f-block groups | ||||||||||||||
| 103 | lawrencium | Lr | +3 | 3 | |||||||||||||||
| 104 | rutherfordium | Rf | +4 | 4 | |||||||||||||||
| 105 | dubnium | Db | +5 | 5 | [171] | ||||||||||||||
| 106 | seaborgium | Sg | 0 | +6 | 6 | [172][173] | |||||||||||||
| 107 | bohrium | Bh | +7 | 7 | [174] | ||||||||||||||
| 108 | hassium | Hs | +8 | 8 | [175] | ||||||||||||||
| 109 | meitnerium | Mt | 9 | ||||||||||||||||
| 110 | darmstadtium | Ds | 10 | ||||||||||||||||
| 111 | roentgenium | Rg | 11 | ||||||||||||||||
| 112 | copernicium | Cn | +2 | 12 | [176] | ||||||||||||||
| 113 | nihonium | Nh | 13 | ||||||||||||||||
| 114 | flerovium | Fl | 14 | ||||||||||||||||
| 115 | moscovium | Mc | 15 | ||||||||||||||||
| 116 | livermorium | Lv | 16 | ||||||||||||||||
| 117 | tennessine | Ts | 17 | ||||||||||||||||
| 118 | oganesson | Og | 18 | ||||||||||||||||
Early forms (octet rule)
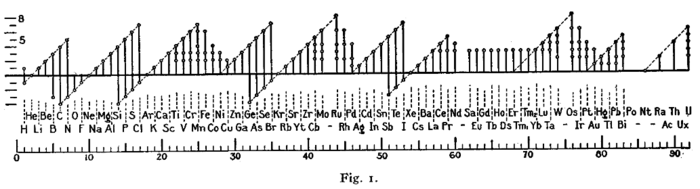
[edit]A figure with a similar format was used by Irving Langmuir in 1919 in one of the early papers about the octet rule.[177] The periodicity of the oxidation states was one of the pieces of evidence that led Langmuir to adopt the rule.
Use in nomenclature
[edit]The oxidation state in compound naming for transition metals and lanthanides and actinides is placed either as a right superscript to the element symbol in a chemical formula, such as FeIII or in parentheses after the name of the element in chemical names, such as iron(III). For example, Fe
2(SO
4)
3 is named iron(III) sulfate and its formula can be shown as FeIII
2(SO
4)
3. This is because a sulfate ion has a charge of −2, so each iron atom takes a charge of +3.
History of the oxidation state concept
[edit]Early days
[edit]Oxidation itself was first studied by Antoine Lavoisier, who defined it as the result of reactions with oxygen (hence the name).[178][179] The term has since been generalized to imply a formal loss of electrons. Oxidation states, called oxidation grades by Friedrich Wöhler in 1835,[180] were one of the intellectual stepping stones that Dmitri Mendeleev used to derive the periodic table. William B. Jensen[181] gives an overview of the history up to 1938.
Use in nomenclature
[edit]Когда стало понятно, что некоторые металлы образуют два разных бинарных соединения с одним и тем же неметаллом, эти два соединения часто различали, используя окончание -ic для более высокой степени окисления металла и окончание -ous для более низкой. Например, FeCl 3 — хлорид железа , а FeCl 2 — хлорид железа . Эта система не очень удовлетворительна (хотя иногда все еще используется), поскольку разные металлы имеют разные степени окисления, которые необходимо изучить: железо и железо имеют +3 и +2 соответственно, но медь и медь +2 и +1, а олово и +2 соответственно. олово +4 и +2. Также не учитывались металлы с более чем двумя степенями окисления, например ванадий со степенями окисления +2, +3, +4 и +5. [15] : 84
Эта система была в значительной степени заменена системой, предложенной Альфредом Стоком в 1919 году. [182] и принял [183] ИЮПАК в 1940 году . Таким образом, FeCl 2 записывался как хлорид железа(II), а не как хлорид железа. Римскую цифру II у центрального атома стали называть « запасным числом » (теперь устаревший термин), и ее значение было получено как заряд центрального атома после удаления его лигандов вместе с электронными парами . общими с ним [18] : 147
Развитие в направлении текущей концепции
[ редактировать ]Термин «состояние окисления» в английской химической литературе был популяризирован Уэнделлом Митчеллом Латимером в его книге 1938 года об электрохимических потенциалах. [184] Он использовал его для значения (синонима немецкого термина Wertigkeit ), ранее называвшегося «валентностью», «полярной валентностью» или «полярным числом». [185] по-английски, или "стадия окисления" или вообще [186] [187] «состояние окисления». С 1938 года термин «степень окисления» связывают с электрохимическими потенциалами и электронами, обменивающимися в окислительно-восстановительных парах, участвующих в окислительно-восстановительных реакциях. К 1948 году ИЮПАК использовал правила номенклатуры 1940 года с термином «степень окисления». [188] [189] вместо оригинала [183] валентность . В 1948 году Лайнус Полинг предположил, что степень окисления можно определить путем экстраполяции связей до полностью ионных в направлении электроотрицательности . [190] Полное принятие этого предположения осложнялось тем фактом, что электроотрицательности Полинга как таковые зависят от степени окисления и могут приводить к необычным значениям степеней окисления для некоторых переходных металлов. В 1990 году ИЮПАК прибег к постулированному (основанному на правилах) методу определения степени окисления. [191] Это было дополнено синонимичным термином «степень окисления» как потомком числа запаса, введенного в номенклатуру в 1940 году. Однако терминология, использующая « лиганды » [18] : 147 Создавалось впечатление, что степень окисления может быть чем-то специфичным для координационных комплексов . Эта ситуация и отсутствие реального единого определения породили многочисленные споры о значении степени окисления, предложения о методах ее получения и ее определениях. Чтобы решить эту проблему, в 2008 году был начат проект IUPAC (2008-040-1-200) «Комплексное определение состояния окисления», который завершился двумя отчетами. [5] [4] и измененными записями «Степень окисления». [6] и «Число окисления» [7] в Золотой книге ИЮПАК . Результатом стало единое определение степени окисления и два алгоритма для ее расчета в молекулярных и твердых соединениях, основанных на электроотрицательности Аллена , которые не зависят от степени окисления.
См. также
[ редактировать ]- Электроотрицательность
- Электрохимия
- Атомная орбиталь
- Атомная оболочка
- Квантовые числа
- Принцип конструкции
- Энергия ионизации
- Сродство к электрону
- Ионный потенциал
- Ионы
- Ковалентная связь
- Металлическое соединение
- Гибридизация
Ссылки
[ редактировать ]- ^ Ван, Г.; Чжоу, М.; Геттель, GT; Шробильген, Г.Дж.; Су, Дж.; Ли, Дж.; Шлёдер, Т.; Ридель, С. (2014). «Идентификация иридийсодержащего соединения с формальной степенью окисления IX». Природа . 514 (7523): 475–477. Бибкод : 2014Natur.514..475W . дои : 10.1038/nature13795 . ПМИД 25341786 . S2CID 4463905 .
- ^ Ю, Хаоюй С.; Трулар, Дональд Г. (2016). «Существует степень окисления 10» . Angewandte Chemie, международное издание . 55 (31): 9004–9006. дои : 10.1002/anie.201604670 . ПМИД 27273799 .
- ^ Шредер, Мелани, Свойства боридов с высоким содержанием бора и карбидов оксида алюминия скандия (на немецком языке), стр. 139, заархивировано из оригинала 06 августа 2020 г. , получено 24 февраля 2020 г.
- ^ Перейти обратно: а б с д Карен, П.; Макардл, П.; Такац, Дж. (2016). «Комплексное определение степени окисления (Рекомендации ИЮПАК 2016 г.)». Чистое приложение. Хим . 88 (8): 831–839. дои : 10.1515/pac-2015-1204 . HDL : 10852/59520 . S2CID 99403810 .
- ^ Перейти обратно: а б с д и ж г час я дж к л м Карен, П.; Макардл, П.; Такац, Дж. (2014). «К всестороннему определению степени окисления (Технический отчет ИЮПАК)» . Чистое приложение. Хим . 86 (6): 1017–1081. дои : 10.1515/pac-2013-0505 .
- ^ Перейти обратно: а б с ИЮПАК , Сборник химической терминологии , 2-е изд. («Золотая книга») (1997). Интернет-исправленная версия: (2006–) « Статус окисления ». два : 10.1351/goldbook.O04365
- ^ Перейти обратно: а б ИЮПАК , Сборник химической терминологии , 2-е изд. («Золотая книга») (1997). Интернет-исправленная версия: (2006–) « Числа окисления ». два : 10.1351/goldbook.O04363
- ^ Перейти обратно: а б с Карен, Павел (2015). «Состояние окисления — давняя проблема!» . Angewandte Chemie, международное издание . 54 (16): 4716–4726. дои : 10.1002/anie.201407561 . ПМК 4506524 . ПМИД 25757151 .
- ^ Хойдонк, Г. Ван (1 мая 1974 г.). «Об ионном приближении к химической связи» . Журнал естественных исследований А. 29 (5): 763–767. Бибкод : 1974ZNatA..29..763H . дои : 10.1515/zna-1974-0517 . ISSN 1865-7109 .
- ^ «Статус окисления». Сборник химической терминологии ИЮПАК: Золотая книга . 2009. doi : 10.1351/goldbook.O04365 . ISBN 978-0-9678550-9-7 .
- ^ Мьюир, КВ; Иберс, Дж. А. (1969). «Структура хлоркарбонила (диоксида серы) бис (трифенилфосфин) родия, (RhCl (CO) (SO2) (P (C6H5)3 2)». Inorg. Chem . 8 (9): 1921–1928. doi : 10.1021 / ic50079a024 .
- ^ Йоргенсен, КК (1966). «Электрическая поляризуемость, невинные лиганды и спектроскопические состояния окисления». Структура и связь . Том. 1. Берлин: Шпрингер-Верлаг. стр. 234–248.
- ^ «Двухэлектронная связь» . Химия LibreTexts . 25 июня 2016 г. Архивировано из оригинала 9 февраля 2021 г. Проверено 1 сентября 2020 г.
- ^ Мартини, Р.Дж.; Бултема, Джей Джей; Уол, МНВ; Беркхарт, Б.Дж.; Грайнд, ДАВ; Декок, Р.Л. (2011). «Порядок связи и химические свойства BF, CO и N 2 ». Дж. Хим. Образование . 88 (8): 1094–1097. Бибкод : 2011ЖЧЭд..88.1094М . дои : 10.1021/ed100758t .
- ^ Перейти обратно: а б Петруччи, Р.Х.; Харвуд, Вашингтон; Сельдь, ФГ (2002). Общая химия (8-е изд.). Прентис-Холл. ISBN 978-0-13-033445-9 . [ ISBN отсутствует ]
- ^ Сенн, MS; Райт, JP; Аттфилд, JP (2012). «Порядок заряда и трехпозиционные искажения в структуре Вервея магнетита» (PDF) . Природа . 481 (7380): 173–6. Бибкод : 2012Natur.481..173S . дои : 10.1038/nature10704 . hdl : 20.500.11820/1b3bb558-52d5-419f-9944-ab917dc95f5e . ПМИД 22190035 . S2CID 4425300 . Архивировано (PDF) из оригинала 9 октября 2022 г.
- ^ Уиттен, КВ; Галлей, К.Д.; Дэвис, Р.Э. (1992). Общая химия (4-е изд.). Сондерс. п. 147 . ISBN 978-0-03-075156-1 . [ ISBN отсутствует ]
- ^ Перейти обратно: а б с Коннелли, Нью-Йорк; Дамхус, Т.; Хартсхорн, РМ; Хаттон, AT Номенклатура неорганической химии (Рекомендации IUPAC 2005 г.) (PDF) . Издательство РСК. Архивировано (PDF) из оригинала 9 октября 2022 г.
- ^ Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . стр. 27–28. ISBN 978-0-08-037941-8 .
- ^ H(0) встречается в диводородных комплексах .
- ^ Звуки динатрия, (Na + ) 2 He(e - ) 2 , синтезирован при высоком давлении, см. Донг, Сяо; Оганов Артем Р.; Гончаров Александр Ф.; Ставру, Элиссайос; Лобанов Сергей; Салех, Габриэле; Цянь, Гуан-Жуй; Чжу, Цян; Гатти, Карло; Дерингер, Волкер Л.; Дронсковский, Ричард; Чжоу, Сян-Фэн; Прокопенко Виталий Борисович; Конопкова, Зузана; Попов Иван А.; Болдырев Александр Иванович; Ван, Хуэй-Тянь (6 февраля 2017 г.). «Стабильное соединение гелия и натрия при высоком давлении». Природная химия . 9 (5): 440–445. arXiv : 1309.3827 . Бибкод : 2017НатЧ...9..440Д . дои : 10.1038/nchem.2716 . ПМИД 28430195 . S2CID 20459726 .
- ^ Перейти обратно: а б с д и Na(-1), K(-1), Rb(-1) и Cs(-1) известны в щелочах ; таблица Гринвуда и Эрншоу показывает −1 только для Na и также ошибочно для Li; литиды не описаны.
- ^ Атомы Li (0) наблюдались в различных небольших кластерах хлорида лития ; видеть Милованович, Милан; Величкович, Сюзана; Вельковичб, Филип; Еросимич, Станка (30 октября 2017 г.). «Структура и стабильность малых хлоридов лития Li n Cl m (0,1+) (n ≥ m, n = 1–6, m = 1–3) кластеры» . Physical Chemistry Chemical Physics . 19 (45): 30481–30497. doi : 10.1039/C7CP04181K . PMID 29114648 .
- ^ Be(0) наблюдался; видеть «Обнаружен комплекс бериллия (0)» . Химия Европы . 13 июня 2016 г.
- ^ Be(I) наблюдался в моногидриде бериллия (BeH); видеть Шайесте, А.; Терещук, К.; Бернат, ПФ; Колин, Р. (2003). «Спектры инфракрасного излучения BeH и BeD» (PDF) . Дж. Хим. Физ . 118 (3): 1158. Бибкод : 2003JChPh.118.1158S . дои : 10.1063/1.1528606 . Архивировано из оригинала (PDF) 2 декабря 2007 г. Проверено 10 декабря 2007 г. и в [(CAAC) 2 Be] +• [CAAC = циклический (алкил)(амино)карбен], см. Ван, Гокан; Уолли, Джейкоб Э.; Дикки, Дайан Э.; Пан, Судип; Фрекинг, Гернот; Жильярд-младший, Роберт Г. (2020). «Стабильный кристаллический катион-радикал бериллия» . Дж. Ам. хим. Соц . 142 (10): 4560–4. дои : 10.1021/jacs.9b13777 . ПМИД 32088963 . S2CID 211262005 . Проверено 17 ноября 2020 г.
- ^ B(-5) наблюдался в Al 3 до н. э., см. Шредер, Мелани. «Свойства богатых бором боридов и карбидов оксида алюминия скандия» (на немецком языке). п. 139.
- ^ B(-1) наблюдался в дибориде магния (MgB 2 ), см. Килер, Джеймс; Уотерс, Питер (2014). Химическая структура и реакционная способность: комплексный подход . Издательство Оксфордского университета. ISBN 9780199604135 .
- ^ B(0) наблюдался у диборинов , см. Брауншвейг, Х.; Дьюхерст, РД; Хаммонд, К.; Мис, Дж.; Радацкий, К.; Варгас, А. (2012). «Изоляция соединения с тройной связью бор-бор при температуре окружающей среды». Наука . 336 (6087): 1420–1422. Бибкод : 2012Sci...336.1420B . дои : 10.1126/science.1221138 . ПМИД 22700924 . S2CID 206540959 .
- ^ Тетразолы содержат в кольце пару атомов азота с двойной связью со степенью окисления 0. Синтез исходного 1H-тетразола CH 2 N 4 (два атома N(0)) приведен в Генри, Рональд А.; Финнеган, Уильям Г. (1954). «Улучшенная процедура дезаминирования 5-аминотетразола». Дж. Ам. хим. Соц . 76 (1): 290–291. дои : 10.1021/ja01630a086 .
- ^ Гептафторид золота рассчитан как пентафторид с молекулярным лигандом F 2 . Химмель, Даниэль; Ридель, Себастьян (2007). «Спустя 20 лет теоретические доказательства того, что «AuF 7 » на самом деле является AuF 5 •F 2 ». Неорганическая химия . 46 (13): 5338–5342. дои : 10.1021/ic700431s . ПМИД 17511450 .
- ^ Группа неуловимого SF 6 + с атомами гелия , как известно, имеет атом фтора (0) в качестве лиганда; видеть Альбертини, Симон; Бергмейстер, Стефан; Лаймер, Феликс; Мартини, Пол; Грубер, Элизабет; Заппа, Фабио; Ончак, Милан; Шайер, Пол; Эхт, Олоф (22 апреля 2021 г.). «SF 6 +: Стабилизация переходных ионов в нанокаплях гелия» . Журнал физической химии . 12 (17): 4112–4117. doi : 10.1021/acs.jpclett.1c01024 . ISSN 1948-7185 . ПМЦ 8154854 . ПМИД 33886323 .
- ^ Ne(0) наблюдался в Cr(CO) 5 Ne. Перуц, Робин Н.; Тернер, Джеймс Дж. (август 1975 г.). «Фотохимия гексакарбонилов 6 группы в низкотемпературных матрицах. III. Взаимодействие пентакарбонилов с благородными газами и другими матрицами». Журнал Американского химического общества . 97 (17): 4791–4800. дои : 10.1021/ja00850a001 .
- ^ соединение NaCl В экспериментах было показано, что существует в нескольких необычных стехиометриях под высоким давлением, включая Na 3 Cl, в котором содержится слой атомов натрия (0); видеть Чжан, В.; Оганов А.Р.; Гончаров А.Ф.; Чжу, К.; Бульфельфель, SE; Ляхов, АО; Ставру, Э.; Сомаязулу, М.; Прокопенко В.Б.; Конопкова, З. (2013). «Неожиданная стабильная стехиометрия хлоридов натрия». Наука . 342 (6165): 1502–1505. arXiv : 1310.7674 . Бибкод : 2013Sci...342.1502Z . дои : 10.1126/science.1244989 . ПМИД 24357316 . S2CID 15298372 .
- ^ низковалентные соединения магния С использованием объемистых лигандов получены с Mg(I); видеть Грин, СП; Джонс С.; Сташ А. (декабрь 2007 г.). «Стабильные соединения магния (I) со связями Mg-Mg». Наука . 318 (5857): 1754–1757. Бибкод : 2007Sci...318.1754G . дои : 10.1126/science.1150856 . ПМИД 17991827 . S2CID 40657565 .
- ^ Mg(0) был синтезирован в соединении, содержащем Na 2 Mg 2 2+ кластер, координированный с объемистым органическим лигандом; видеть Рёш, Б.; Гентнер, Техас; Эйселейн, Дж.; Лангер, Дж.; Элсен, Х.; Ли, В.; Хардер, С. (2021). «Сильно восстанавливающие комплексы магния (0)». Природа . 592 (7856): 717–721. Бибкод : 2021Natur.592..717R . doi : 10.1038/s41586-021-03401-w . ПМИД 33911274 . S2CID 233447380
- ^ Al(II) наблюдался в оксиде алюминия(II) (AlO); видеть Тайт, округ Колумбия (1964). «Красная (B2Π – A2σ) полосовая система монооксида алюминия». Природа . 202 (4930): 383–384. Бибкод : 1964Natur.202..383T . дои : 10.1038/202383a0 . S2CID 4163250 и в диаланах (R 2 Al-AlR 2 ); видеть Уль, Вернер (2004). «Элементоорганические соединения, имеющие одинарные связи Al—Al, Ga—Ga, In—In и Tl—Tl». Достижения металлоорганической химии . 51 : 53–108. дои : 10.1016/S0065-3055(03)51002-4 .
- ^ Перейти обратно: а б с д и ж г час я могут возникать отрицательные степени окисления металлов p-блока (Al, Ga, In, Sn, Tl, Pb, Bi, Po) и металлоидов (Si, Ge, As, Sb, Te, At) В фазах Цинтла , см.: Ридель, Эрвин, изд. Современная неорганическая химия (на немецком языке). п. 259 и т. д. «Лекция Интерметаллические фазы § 6.2 Бинарные фазы Цинтля» (на немецком языке).
- ^ Нестабильный карбонил Al(0) обнаружен в реакции Al 2 (CH 3 ) 6 с окисью углерода; видеть Санчес, Рамиро; Аррингтон, Калеб; Аррингтон-младший, Калифорния (1 декабря 1989 г.). «Реакция триметилалюминия с окисью углерода в низкотемпературных матрицах» . Американское химическое общество . 111 (25): 9110-9111. дои : 10.1021/ja00207a023 . ОСТИ 6973516 .
- ^ Al(-2) наблюдался в Sr 14 [Al 4 ] 2 [Ge] 3 , см. Вемдорф, Марко; Рёр, Кэролайн (2007). «Sr 14 [Al 4 ] 2 [Ge] 3 : фаза Цинтля с изолированным [Ge] 4– - и [Al 4 ] 8– -Анионы / Sr 14 [Al 4 ] 2 [Ge] 3 : фаза Цинтла с изолированным [Ge] 4– - и [Al 4 ] 8– Анионы». Журнал Nature Research B (на немецком языке). 62 (10): 1227. doi : 10.1515/znb-2007-1001 . S2CID 94972243 .
- ^ Перейти обратно: а б с «Новый тип соединения нуль-валентного олова» . Химия Европы . 27 августа 2016 г.
- ^ P(0) наблюдался, см. Ван, Юйчжун; Се, Яомин; Вэй, Пинжун; Кинг, Р. Брюс; Шефер, III; Шлейер, Пол против Р.; Робинсон, Грегори Х. (2008). «Карбен-стабилизированный дифосфор». Журнал Американского химического общества . 130 (45): 14970–1. дои : 10.1021/ja807828t . ПМИД 18937460 .
- ^ Хлор (0) присутствует в виде дихлора в {SnCl 6 2- -Cl 2 } x и {PbCl 6 2- -Cl 2 } x полимерные анионные комплексы см. Усольцев Андрей Н.; Коробейников Никита А.; Колесов Борис А.; Новиков Александр С.; Самсоненко Денис Георгиевич; Федин Владимир П.; Соколов Максим Н.; Адонин Сергей Александрович (24 февраля 2021 г.). «Правило, не исключение: образование дихлорсодержащих супрамолекулярных комплексов с хлорметаллатами (IV)». Неорг. Хим . 60 (6): 4171–4177. doi : 10.1021/acs.inorgchem.1c00436 . ПМИД 33626273 . S2CID 232047538 .
- ^ Равновесие Cl 2 O 6 ⇌2ClO 3 упоминается Гринвудом и Эрншоу, но оно опровергнуто, см. Лопес, Мария; Хуан Э. Сикре (1990). «Физико-химические свойства оксидов хлора. 1. Состав, ультрафиолетовый спектр и кинетика термолиза газообразного дихлоргексана». Дж. Физ. Хим . 94 (9): 3860–3863. дои : 10.1021/j100372a094 . , а Cl 2 O 6 на самом деле представляет собой оксид хлора(V,VII). Однако ClO 3 , см. наблюдалось присутствие Гроте, Хинрих; Виллнер, Хельге (1994). «Триоксид хлора: спектроскопические свойства, молекулярная структура и фотохимическое поведение». Энджью. хим. Межд. Эд . 33 (14): 1482–1484. дои : 10.1002/anie.199414821 .
- ^ Ar(0) наблюдался во фторгидриде аргона (HArF) и ArCF 2. 2+ , видеть Локьер, Дж. Ф.; Дуглас, К.; Цена, SD; Карвовска, М.; и др. (2010). «Поколение ArCF 2 2+ Дикация». Journal of Physical Chemistry Letters . 1 : 358. doi : 10.1021/jz900274p .
- ^ Обнаружен Ca(I); видеть Крик, Свен; Гёрлс, Хельмар; Вестерхаузен, Матиас (2010). «Механистическое объяснение образования обратного сэндвич-комплекса Ca(I) [(thf) 3 Ca(μ-C 6 H 3 -1,3,5-Ph 3 )Ca(thf) 3 ] и стабильности арилзамещенных Фенилкальциевые комплексы». Журнал Американского химического общества . 132 (35): 12492–501. дои : 10.1021/ja105534w . ПМИД 20718434 .
- ^ Перейти обратно: а б с Октакарбонильные комплексы, выделенные из Ca, Sr, Ba, наблюдались в неоновой матрице, но остается неясным, являются ли это комплексами металла (0), поскольку расчеты расходятся во мнениях, связан ли металл с лигандами ковалентно или ионно; видеть Ву, Х.; Чжао, Л.; Джин, Дж.; Пан, С.; Ли, В.; Джин, X.; Ван, Г.; Чжоу, М.; Френкинг, Г. (2018). «Наблюдение щелочноземельных комплексов M (CO) 8 (M = Ca, Sr или Ba), имитирующих переходные металлы». Наука . 361 (6405): 912–916. Бибкод : 2018Sci...361..912W . дои : 10.1126/science.aau0839 . ПМИД 30166489 . S2CID 52131470
- ^ Обнаружено Sc(0); видеть Ф. Джеффри Н. Клок; Карл Хан и Робин Н. Перуц (1991). «η-Ареновые комплексы скандия (0) и скандия (II)». Дж. Хим. Соц., хим. Коммун. (19): 1372–1373. дои : 10.1039/C39910001372 .
- ^ Обнаружен Sc(I); видеть Полли Л. Арнольд; Ф. Джеффри; Н. Клок; Питер Б. Хичкок и Джон Ф. Никсон (1996). «Первый пример формального комплекса скандия (I): синтез и молекулярная структура 22-электронного трехэтажного скандия, включающего новое 1,3,5-трифосфабензольное кольцо». Дж. Ам. хим. Соц . 118 (32): 7630–7631. дои : 10.1021/ja961253o .
- ^ Обнаружен Sc(II); видеть Воэн, Дэвид Х.; Чен, Го П.; Циллер, Джозеф В.; Бойл, Тимоти Дж.; Фурче, Филипп; Эванс, Уильям Дж. (январь 2017 г.). «Синтез раствора, структура и реакционная способность комплекса скандия (II) по восстановлению CO». Angewandte Chemie, международное издание . 56 (8): 2050–2053. дои : 10.1002/anie.201611758 . ПМИД 28097771 .
- ^ Ti(I) наблюдался в [Ti(η 6 -1,3,5-С 6 Н 3 я Pr 3 )2][BAr 4 ] (Ar = C 6 H 5 , p -C 6 H 4 F, 3,5-C 6 H 3 (CF 3 ) 2 ); видеть Кальдераццо, Фауст; Ферри, Изабелла; Пампалони, Гвидо; Энглерт, Вул; Грин, Малкольм Л.Х. (1997). «Синтез [Ti(η 6 -1,3,5-C 6 H 3 i Pr 3 ) 2 ][BAr 4 ] (Ar = C 6 H 5 , pC 6 H 4 F, 3,5-C 6 H 3 (CF 3 ) 2 ), Первые производные титана (I)». Металлоорганические соединения . 16 (14): 3100–3101. doi : 10.1021/om970155o .
- ^ Перейти обратно: а б с д и ж г час я дж к л Ti(-2), V(-3), Cr(-4), Co(-3), Zr(-2), Nb(-3), Mo(-4), Ru(-2), Rh( -3), Hf(-2), Ta(-3) и W(-4) встречаются в анионных бинарных карбонилах металлов ; видеть Кристиан Бах (январь 1999 г.). Carbonylkomplexe der Platinmetalle [ Карбонильные комплексы платиновых металлов ] (доктор наук) (на немецком языке). п. 4. ; Вернер, Хельмут (2008). Вехи в химии органопереходных металлов: личный взгляд . Springer Science & Business Media. стр. 97–100. ISBN 978-0-387-09848-7 . ; Хайдук, Ионел; Цукерман, Джерри Дж. (2011). Основная металлоорганическая химия: содержащая обширную библиографию . Вальтер де Грютер. п. 239. ИСБН 978-0-89925-006-9 .
- ^ сообщается в [Ti bipy ) ( Ti(-1 ) − , но позже было показано, что это Ti(+3); видеть Боуман, AC; Англия, Дж.; Спроулс, С.; Вейхемюллер, Т.; Вигхардт, К. (2013). «Электронные структуры гомолептических [трис(2,2'-бипиридин)M]n комплексов ранних переходных металлов (M = Sc, Y, Ti, Zr, Hf, V, Nb, Ta; n = 1+, 0, 1-, 2-, 3-): экспериментальное исследование и теоретическое исследование функционала плотности». Неорганическая химия . 52 (4): 2242–2256. дои : 10.1021/ic302799s . ПМИД 23387926 . Однако Ti(−1) встречается в [Ti(η-C 6 H 6 ] − и [Ti(η-C 6 H 5 CH 3 )] − , видеть Бэнди, Дж.А.; Берри, А.; Грин, MLH; Перуц, Р.Н.; Праут, К.; Верпоц, Ж.-Н. (1984). «Синтез анионных сэндвичевых соединений: [Ti(η-C 6 H 5 R) 2 ] – и кристаллическая структура [K(18-краун-6)(μ-H)Mo(η-C 5 H 5 ) 2 ]». Inorganic Chemistry . 52 (4): 729–731. doi : 10.1039/C39840000729 .
- ^ Джилек, Роберт Э.; Трипепи, Джованна; Урнезиус, Евгений; Бреннессел, Уильям В.; Янг, Виктор Дж. младший; Эллис, Джон Э. (2007). «Нульвалентные комплексы титан-сера. Новые дитиокарбаматные производные Ti(CO) 6 : [Ti(CO) 4 (S 2 CNR 2 )] − ". Chem. Commun. (25): 2639–2641. doi : 10.1039/B700808B . PMID 17579764 .
- ^ Mn(–3) и Mn(–1) встречаются в Mn(NO) 3 (CO) и HMn(CO) 5 соответственно; видеть Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . п. 1046. ИСБН 978-0-08-037941-8 .
- ^ Mn(–2) был ошибочно описан Гринвудом как [MnPc] 2– ; правильное объяснение см. Гсинека Мбамбиса; Пруденс Тау; Эдит Антунес; Тебело Нёконг (2007). «Синтез и электрохимические свойства фталоцианиновых комплексов пурпурного марганца (III) и красного титана (IV), октазамещенных в непериферических положениях пентилтиогруппами». Многогранник . 26 (18): 5355–5364. дои : 10.1016/j.poly.2007.08.007 .
- ^ Fe(VII) наблюдался в [FeO 4 ] − ; видеть Лу, Джун-Бо; Цзянь, Дживэнь; Хуан, Вэй; Лин, Хайлу; Чжоу, Минфэй (2016). «Экспериментальная и теоретическая идентификация степени окисления Fe(VII) в FeO 4 − ". Физическая химия Химическая физика . 18 (45): 31125–31131. Бибкод : 2016PCCP...1831125L . doi : 10.1039/C6CP06753K . PMID 27812577 .
- ^ Сообщалось о Fe (VIII); видеть Юрий Дмитриевич Перфильев; Вирендер К. Шарма (2008). «Высшие степени окисления железа в твердом состоянии: синтез и их мессбауэровская характеристика - ферраты - серия симпозиумов ACS (публикации ACS)». Обзор платиновых металлов . 48 (4): 157–158. дои : 10.1021/bk-2008-0985.ch007 . Однако его существование оспаривается.
- ^ Перейти обратно: а б с д и ж г час я дж Fe(-4), Ru(-4) и Os(-4) обнаружены в богатых металлами соединениях, содержащих октаэдрические комплексы [MIN 6- x Sn x ]; Pt(−3) (как димерный анион [Pt–Pt] 6− ), Cu(-2), Zn(-2), Ag(-2), Cd(-2), Au(-2) и Hg(-2) наблюдались (в виде димерных и мономерных анионов; димерные ионы первоначально сообщалось, что это [T – T] 2− для Zn, Cd, Hg, но позже было показано, что это [T – T] 4− для всех этих элементов) в La 2 Pt 2 In, La 2 Cu 2 In, Ca 5 Au 3 , Ca 5 Ag 3 , Ca 5 Hg 3 , Sr 5 Cd 3 , Ca 5 Zn 3 (строение (АЭ 2+ ) 5 (Т – Т) 4− Т 2− ⋅4e − ), Yb 3 Ag 2 , Ca 5 Au 4 и Ca 3 Hg 2 ; Au(–3) наблюдался в ScAuSn и других 18-электронных полугейслеровских соединениях. Видеть Чанхун Ли; Мён Хван Вангбо (2008). «Анионы поздних переходных металлов, действующие как элементы p-металлов». Науки о твердом теле . 10 (4): 444–449. Бибкод : 2008SSSci..10..444K . doi : 10.1016/j.solidstatesciences.2007.12.001 . и Чанхун Ли; Мён Хван Вангбо; Юрген Кёлер (2010). «Анализ электронной структуры и химической связи металлосодержащих соединений. 2. Наличие димера (Т – Т)». 4– и изолированный Т 2– Анионы в полярных интерметаллидах Cr 5 B 3 -соединения типа AE 5 T 3 (AE = Ca, Sr; T = Au, Ag, Hg, Cd, Zn)". Журнал неорганической и общей химии . 636 (1): 36 –40 дои : 10.1002/zaac.200900421 .
- ^ Ni(-2) наблюдался в Li 2 [Ni( 1,5-COD ) 2 ], см. Йонас, Клаус (1975). «Комплексы дилития-никеля-олефина. Новые биметаллические комплексы, содержащие переходный металл и металл основной группы». Энджью. хим. Межд. Эд . 14 (11): 752–753. дои : 10.1002/anie.197507521 . и Эллис, Джон Э. (2006). «Приключения с веществами, содержащими металлы в отрицательных состояниях окисления». Неорганическая химия . 45 (8): 3167–86. дои : 10.1021/ic052110i . ПМИД 16602773 .
- ^ Cu(0) наблюдалась в Cu(трис[2-(диизопропилфосфино)-фенил]боран), см. Море, Марк-Этьен; Чжан, Лимей; Питерс, Джонас К. (2013). «Полярная одноэлектронная σ-связь медь-бор» . Дж. Ам. хим. Соц . 135 (10): 3792–3795. дои : 10.1021/ja4006578 . ПМИД 23418750 .
- ^ Zn(0) наблюдался; видеть Сингх, Амит Пратап; Сэмюэл, Принсон П.; Роски, Герберт В.; Шварцер, Мартин С.; Фрекинг, Гернот; Сидху, Навдип С.; Диттрих, Биргер (2013). «Синглетное бирадикалоидное соединение цинка и его нерадикальный аналог». Дж. Ам. хим. Соц . 135 (19): 7324–9. дои : 10.1021/ja402351x . ПМИД 23600486 . и Солейхавуп, Мишель; Бертран, Гай (2015). «Циклические (алкил)(амино)карбены (CAAC): стабильные карбены на подъеме». Акк. хим. Рез . 48 (2): 256–266. дои : 10.1021/ar5003494 . ПМИД 25515548 .
- ^ Zn(I) наблюдался в декаметилдизинкоцене (Zn 2 (η 5 –C 5 Me 5 ) 2 ); видеть Реза, И.; Кармона, Э.; Гутьеррес-Пуэбла, Э.; Монж, А. (2004). «Декаметилдизинкоцен, стабильное соединение Zn (I) со связью Zn-Zn». Наука . 305 (5687): 1136–8. Бибкод : 2004Sci...305.1136R . дои : 10.1126/science.1101356 . ПМИД 15326350 . S2CID 38990338 .
- ^ Было предсказано, что Zn(III) стабилен в соединениях с высокостабилизированными трианионами на основе борана, но экспериментально не известны кандидаты на Zn(III); видеть Хун Фан; Хута Банджаде; Дипика; Пуру Йена (2021). «Реализация степени окисления Zn3+». Наномасштаб . 13 (33): 14041–14048. дои : 10.1039/D1NR02816B . ПМИД 34477685 . S2CID 237400349 .
- ^ Ga(-2), Ga(-4) и Ga(-5) наблюдались в галлидах магния MgGa, Mg 2 Ga и Mg 5 Ga 2 соответственно; видеть Патрик Хофманн. «Colture. Программа для интерактивной визуализации твердотельных структур, а также синтеза, строения и свойств бинарных и тройных галлидов щелочных и щелочноземельных металлов» (PDF) (на немецком языке). п. 72.
- ^ Ga(-3) наблюдался в LaGa, см. Дюрр, Инес; Бауэр, Бритта; Рёр, Кэролайн (2011). «Триэль/тетрел-ид лантана La(Al,Ga) x (Si,Ge) 1- x . Экспериментальные и теоретические исследования стабильности интерметаллических фаз 1:1» (PDF) . З. Исследователь-естествоиспытатель (на немецком языке). 66б : 1107–1121.
- ^ Ga(0) наблюдался в монойодиде галлия среди других степеней окисления галлия.
- ^ Ge(-1), Ge(-2) и Ge(-3) наблюдались в германидах ; видеть Холлеман, Арнольд Ф.; Виберг, Эгон; Виберг, Нильс (1995). «Германий». Учебник неорганической химии (на немецком языке) (101 изд.). Вальтер де Грютер. стр. 953–959. ISBN 978-3-11-012641-9 .
- ^ Было обнаружено As(0); видеть Авраам, Мэрихам Ю.; Ван, Юйчжун; Се, Яомин; Вэй, Пинжун; Шефер III, Генри Ф.; Шлейер, П. фон Р.; Робинсон, Грегори Х. (2010). «Карбеновая стабилизация диарсеника: от гипервалентности к аллотропии». Химия: Европейский журнал . 16 (2): 432–5. дои : 10.1002/chem.200902840 . ПМИД 19937872 .
- ^ As(I) наблюдался в йодиде мышьяка(I) (AsI); видеть Эллис, Бобби Д.; Макдональд, Чарльз Л.Б. (2004). «Стабилизированный йодид мышьяка (I): готовый источник фрагментов йодида мышьяка и полезный реагент для создания кластеров». Неорганическая химия . 43 (19): 5981–6. дои : 10.1021/ic049281s . ПМИД 15360247 .
- ^ As(IV) наблюдался в гидроксиде мышьяка(IV) (As(OH) 4 ) и ХАСО − ; видеть Кленинг, Ульрик К.; Бельски, Бенон Х.Дж.; Сехестед, К. (1989). «Мышьяк (IV). Исследование импульсного радиолиза». Неорганическая химия . 28 (14): 2717–24. дои : 10.1021/ic00313a007 .
- ^ Se(-1) наблюдался в диселенидах (2-) (Se 2 2− ).
- ^ Атом Se(0) был идентифицирован с помощью DFT в [ReOSe(2-pySe) 3 ]; видеть Каргнелутти, Роберта; Ланг, Эрнесто С.; Пикини, Пауло; Абрам, Ульрих (2014). «Синтез и структура [ReOSe(2-Se-py)3]: комплекс рения (V) с селеном (0) в качестве лиганда». Неорганическая химия . 45 : 48–50. дои : 10.1016/j.inoche.2014.04.003 . ISSN 1387-7003 .
- ^ Se(I) наблюдался в хлориде селена(I) (Se 2 Cl 2 ); видеть «Селен: данные о соединениях хлорида селена (I)» . WebElements.com . Проверено 10 декабря 2007 г.
- ^ Se(III) наблюдался в Se 2 NBr 3 ; видеть Лау, Карстен; Ноймюллер, Бернхард; Выборщиков Сергей Ф.; Фрекинг, Гернот; Денике, Курт; Хиллер, Вольфганг; Херкер, Мартин (1996). «Se 2 NBr 3 , Se 2 NCl 5 , Se 2 NCl − 6 : Новые нитрид-галогениды селена (III) и селена (IV)». Химия: Европейский журнал . 2 (11): 1393–1396. doi : 10.1002/chem.19960021108 .
- ^ Se(V) наблюдался в SeO − 3 и HSeO 2- 4 ; видеть Кленинг, Ульрик К.; Сехестед, К. (1986). «Селен (V). Исследование импульсного радиолиза» . Неорганическая химия . 90 (21): 5460–4. дои : 10.1021/j100412a112 .
- ^ Бром (0) присутствует в виде аддукта в медно-бромном комплексе, см. Окрут, Александр; Фельдманн, Клаус (5 марта 2008 г.). «{[P(o-tolyl)3]Br}2[Cu2Br6](Br2) — ионное соединение, содержащее молекулярный бром». Неорганическая химия . 47 (8): 3084–3087. дои : 10.1021/ic7021038 . ПМИД 18318489 .
- ^ Известно, что Br(II) встречается в радикале монооксида брома ; см . [1]
- ^ Sr(I) наблюдался в монофториде стронция (SrF); видеть Коларуссо, П.; Го, Б.; Чжан, К.-Ц.; Бернат, ПФ (1996). «Спектр инфракрасного излучения монофторида стронция высокого разрешения» (PDF) . Журнал молекулярной спектроскопии . 175 (1): 158–171. Бибкод : 1996JMoSp.175..158C . дои : 10.1006/jmsp.1996.0019 . Архивировано из оригинала (PDF) 8 марта 2012 г.
- ^ Перейти обратно: а б с д и ж г час я дж к л м Иттрий и все лантаноиды, кроме Ce и Pm, обнаружены в степени окисления 0 в бис(1,3,5-три-т-бутилбензольных) комплексах, см. Клок, Ф. Джеффри Н. (1993). «Соединения скандия, иттрия и лантаноидов в нулевом состоянии окисления». хим. Соц. Преподобный . 22 : 17–24. дои : 10.1039/CS9932200017 . и Арнольд, Полли Л.; Петрухина Марина Александровна; Боченков Владимир Евгеньевич; Шабатина Татьяна И.; Загорский Вячеслав В.; Клок (15 декабря 2003 г.). «Ареновое комплексообразование атомов Sm, Eu, Tm и Yb: спектроскопическое исследование при переменной температуре». Журнал металлоорганической химии . 688 (1–2): 49–55. doi : 10.1016/j.jorganchem.2003.08.028 .
- ^ Y (I) наблюдался в бромиде иттрия (I) (YBr); видеть Кейли А. Уокер; Майкл С.Л. Джерри (1998). «Чистый вращательный спектр монобромида иттрия». Журнал химической физики . 109 (13): 5439–5445. дои : 10.1063/1.477162 .
- ^ Y(II) наблюдался в [(18-краун-6)K][(C 5 H 4 SiMe 3 ) 3 Y]; видеть Макдональд, MR; Циллер, Дж.В.; Эванс, WJ (2011). «Синтез кристаллического молекулярного комплекса Y 2+ , [(18-краун-6)K][(C 5 H 4 SiMe 3 ) 3 Y]". J. Am. Chem. Soc . 133 (40): 15914–17. doi : 10.1021/ja207151y . PMID 21919538 .
- ^ Zr(-1) описан в [Zr( bipy ) 3 ] − (видеть Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . п. 960. ИСБН 978-0-08-037941-8 . и Холлеман, Арнольд Ф.; Виберг, Эгон; Виберг, Нильс (1995). "Цирконий". Учебник неорганической химии (на немецком языке) (101 изд.). Вальтер де Грютер. п. 1413. ИСБН 978-3-11-012641-9 . ), но позже было показано, что это Zr(+4); видеть Боуман, AC; Англия, Дж.; Спроулс, С.; Вейхемюллер, Т.; Вигхардт, К. (2013). «Электронные структуры гомолептических [трис(2,2'-бипиридин)M]n комплексов ранних переходных металлов (M = Sc, Y, Ti, Zr, Hf, V, Nb, Ta; n = 1+, 0, 1-, 2-, 3-): экспериментальное исследование и теоретическое исследование функционала плотности». Неорганическая химия . 52 (4): 2242–56. дои : 10.1021/ic302799s . ПМИД 23387926 .
- ^ Перейти обратно: а б Zr(0) и Hf(0) встречаются в (η 6 -(1,3,5- т Bu) 3 C 6 H 3 ) 2 M (M=Zr, Hf) и [(η 5 -C 5 R 5 M(CO) 4 ] − , видеть Чирик, П.Дж.; Брэдли, Калифорния (2007). «4.06 – Комплексы циркония и гафния в степенях окисления от 0 до ii». Комплексная металлоорганическая химия III. От основ к приложениям . Том. 4. Elsevier Ltd., стр. 697–739. дои : 10.1016/B0-08-045047-4/00062-5 . ISBN 9780080450476 .
- ^ Были обнаружены комплексы Nb (0) и Ta (0), см. Холлеман, Арнольд Ф.; Виберг, Эгон; Виберг, Нильс (2003). «4.5.7. Ниобий(0) и тантал(0)». В Дж. А. Макклеверти; Ти Джей Мейер (ред.). Комплексная координационная химия II: от биологии к нанотехнологиям . Том. 4 (2-е изд.). Ньюнес. стр. 297–299. ISBN 978-0-08-091316-2 .
- ^ Перейти обратно: а б Nb(I) и Ta(I) встречаются в Cp Nb(CO) 4 и Cp Ta(CO) 4 , см. Холлеман, Арнольд Ф.; Виберг, Эгон; Виберг, Нильс (1995). «Тантал». Учебник неорганической химии (на немецком языке) (101 изд.). Вальтер де Грютер. п. 1430. ИСБН 978-3-11-012641-9 . и Кинг, Р. Брюс (1969). Металлоорганическая химия переходных металлов: Введение . Академическая пресса. п. 11. ISBN 978-0-32-315996-8 .
- ^ Tc(–1) встречается в HTc(CO) 5 ; видеть Джон Э. Эллис (2003). «Анионы карбонила металлов: из [Fe(CO) 4 ] 2 - [Hf(CO) 6 ] 2 - и за ее пределам膻. Organometallics . 22 (17): 3322–3338. doi : 10.1021/om030105l . Гринвуд ошибочно сообщил о Tc(–3).
- ^ Джордж, Дж.Н.; Кляйн, С.И.; Никсон, Дж. Ф. (1984). «Спектроскопические исследования электронного парамагнитного резонанса комплекса нульвалентного родия [Rh(P(OPr я ) 3 ) 4 ] на частотах X- и Q-диапазона». Chemical Physics Letters . 108 (6): 627–630. Бибкод : 1984CPL...108..627G . doi : 10.1016/0009-2614(84)85069 -1 .
- ^ Rh(VII) известен в составе RhO 3 + катион, см. да Силва Сантос, Майара; Штюкер, Тони; Флах, Макс; Аблясова Олеся С.; Тимм, Мартин; фон Иссендорф, Бернд; Хирш, Константин; Самудио-Байер, Висенте; Ридель, Себастьян; Лау, Дж. Тобиас (2022). «Высшая степень окисления родия: родий (VII) в [RhO3] +». Энджью. хим. Межд. Эд . 61 (38). дои : 10.1002/anie.202207688 . ПМИД 35818987 . S2CID 250455408 .
- ^ Pd(I) наблюдался; видеть Крэбтри, Р.Х. (2002). «ХИМИЯ: новая степень окисления палладия?». Наука . 295 (5553): 288–289. дои : 10.1126/science.1067921 . ПМИД 11786632 . S2CID 94579227 .
- ^ Pd(III) наблюдался; видеть Пауэрс, DC; Риттер, Т. (2011). «Палладий (III) в синтезе и катализе» (PDF) . Химия высших окислительных состояний. Органопалладий и платина . Темы металлоорганической химии. Том. 35. С. 129–156. Бибкод : 2011hoso.book..129P . дои : 10.1007/978-3-642-17429-2_6 . ISBN 978-3-642-17428-5 . ПМК 3066514 . ПМИД 21461129 . Архивировано из оригинала (PDF) 12 июня 2013 года.
- ^ Палладий (V) идентифицирован в комплексах с кремнийорганическими соединениями, содержащими пентакоординированный палладий; видеть Симада, Сигеру; Ли, Юн-Хуа; Чхве, Юн-Ки; Танака, Масато; Бао, Мин; Учимару, Тадафуми (2007). «Многоядерные соединения палладия, содержащие палладиевые центры, лигированные пятью атомами кремния» . Труды Национальной академии наук . 104 (19): 7758–7763. дои : 10.1073/pnas.0700450104 . ПМК 1876520 . ПМИД 17470819 .
- ^ Утверждается, что палладий (VI) существует в Дагани, РОН (2002). «Новое состояние окисления палладия?». хим. англ. Новости . 80 (2): 8. doi : 10.1021/cen-v080n002.p008 . , но это было опровергнуто, доказав, что это палладий(II).
- ^ Аг − ион наблюдался в растворах аммиака металлов: см. Тран, Северная Каролина; Лаговский, Джей Джей (2001). «Растворы металлического аммиака: растворы, содержащие ионы аргентида». Неорганическая химия . 40 (5): 1067–68. дои : 10.1021/ic000333x .
- ^ Ag(0) наблюдался в карбонильных комплексах в низкотемпературных матрицах: см. Макинтош, Д.; Озин, Г.А. (1976). «Синтез с использованием паров металлов. Карбонилы серебра. Матричные инфракрасные, ультрафиолето-видимые и электронные спектры спинового резонанса, структуры и связывание трикарбонила серебра, дикарбонила серебра, монокарбонила серебра и гексакарбонила дисеребра». Дж. Ам. хим. Соц . 98 (11): 3167–75. дои : 10.1021/ja00427a018 . Также Ag(0) наблюдался в [Ag 4 py 2 ] n , см. Хой Ри Мун; Чеол Хо Чой; Мёнхён Пайк Со (2008). «Цепочка из молекулярного серебра (0) в форме лестницы». Angewandte Chemie, международное издание . 47 (44): 8390–93. дои : 10.1002/anie.200803465 . ПМИД 18830949 .
- ^ Cd(I) наблюдался в тетрахлоралюминате кадмия (I) (Cd 2 (AlCl 4 ) 2 ); видеть Холлеман, Арнольд Ф.; Виберг, Эгон; Виберг, Нильс (1985). "Кадмий". Учебник неорганической химии (на немецком языке) (91–100 изд.). Вальтер де Грютер. стр. 1056–1057. ISBN 978-3-11-007511-3 .
- ^ In(–5) наблюдался в La 3 InGe, см. Гулой А.М.; Корбетт, доктор медицинских наук (1996). «Синтез, структура и соединение двух германидов лантана и индия с новой структурой и свойствами». Неорганическая химия . 35 (9): 2616–22. дои : 10.1021/ic951378e . ПМИД 11666477 .
- ^ In(-2) наблюдался в Na 2 In, см. [2] , с. 69.
- ^ Обнаружены нестабильные карбонилы и кластеры In(0), см. [3] , с. 6.
- ^ Sn(-3) наблюдался в [Sn 2 ] 6− , например, в (Ba 2 ) 4+ (Мг 4 ) 8+ Сн 4− (Сн 2 ) 6− Сн 2− (с квадратом (Sn 2− ) n листов), см. Папоян, Гарегин А.; Хоффманн, Роальд (2000). «Гипервалентная связь в одном, двух и трех измерениях: распространение концепции Цинтля-Клемма на неклассические богатые электронами сети» . Энджью. хим. Межд. Эд . 2000 (39): 2408–2448. doi : 10.1002/1521-3773(20000717)39:14<2408::aid-anie2408>3.0.co;2-u . ПМИД 10941096 . Проверено 23 февраля 2015 г.
- ^ Sn(I) и Sn(III) наблюдались в оловоорганических соединениях .
- ^ Sb(−2) наблюдался в [Sb 2 ] 4− , например, в RbBa 4 [Sb 2 ][Sb][O], см. Босс, Майкл; Петри, Денис; Пикхард, Фрэнк; Цённхен, Питер; Рёр, Кэролайн (2005). «Новые оксиды антимонида бария с ионами Цинтла [Sb] 3− , [Сб 2 ] 4− и 1 ∞ [Сб н ] п- / Новые оксиды антимонида бария, содержащие ионы Цинтла [Sb] 3− , [Сб 2 ] 4− и 1 ∞ [Сб н ] п- ". Журнал неорганической и общей химии (на немецком языке). 631 (6–7): 1181–1190. doi : 10.1002/zaac.200400546 .
- ^ Sb(0) наблюдался, см. Анастас Сидиропулос (2019). «Исследование N-гетероциклических карбеновых (NHC) комплексов элементов основной группы» (PDF) . п. 39. дои : 10.4225/03/5B0F4BDF98F60 . S2CID 132399530 .
- ^ Sb(I) и Sb(II) наблюдались в сурьмяорганических соединениях ; о Sb(I) см. Саймон, Питер; де Профт, Франк; Джамбор, Роман; Ружичка, Алеш; Досталь, Либор (2010). «Мономерные соединения сурьмы (I) и висмута (I), стабилизированные NCN-хелатирующим лигандом: синтезы и структуры». Angewandte Chemie, международное издание . 49 (32): 5468–5471. дои : 10.1002/anie.201002209 . ПМИД 20602393 .
- ^ Sb(IV) наблюдался в [SbCl 6 ] 2− , видеть Нобуёси Синохара; Масааки Осима (2000). «Получение хлорокомплекса Sb(IV) путем флэш-фотолиза соответствующих комплексов Sb(III) и Sb(V) в CH3CN и CHCl3». Бюллетень Химического общества Японии . 73 (7): 1599–1604. дои : 10.1246/bcsj.73.1599 .
- ^ Te(0) наблюдался в теллуролатах.
- ^ Te(I) наблюдался в иодиде теллура (TeI), см. «Теллур: йодид теллура» . WebElements.com . Проверено 23 февраля 2015 г.
- ^ Te(III) наблюдался в [Te(N(Si Me 3 ) 2 ) 2 ] + , видеть Хайнце, Торстен; Роски, Герберт В.; Пауэр, Фрэнк; Сталке, Дитмар; Шелдрик, Джордж М. (1991). «Синтез и структура первого катион-радикала теллура (III)» . Angewandte Chemie, международное издание . 30 (12): 1678. doi : 10.1002/anie.199116771 . Проверено 23 февраля 2015 г.
- ^ Te(V) упоминается Гринвудом и Эрншоу, но они не приводят ни одного примера соединения Te(V). То, что долгое время считалось декафторидом дителлура (Te 2 F 10 ), на самом деле является оксидом бис(пентафторотеллурила) F 5 TeOTeF 5 : см. Уоткинс, премьер-министр (1974). «Дителлур декафторид - продолжающийся миф». Журнал химического образования . 51 (9): 520–521. Бибкод : 1974JChEd..51..520W . дои : 10.1021/ed051p520 . Однако Te(V) наблюдался в HTeO − , ТеО − , HTeO - 2 и ТеО - 3 ; видеть Кленинг, Ульрик К.; Сехестед, К. (2001). «Теллур (V). Исследование импульсного радиолиза» . Журнал физической химии А. 105 (27): 6637–45. Бибкод : 2001JPCA..105.6637K . дои : 10.1021/jp010577i .
- ^ Йод (0) появляется как I 2 в полимерных {Sb 2 I 9 3- -I 2 } x и {Bi 2 I 9 3- -I 2 } x полимерные комплексные анионы: см. Коробейников Никита А; Усольцев Андрей Н; Абрамов Павел А; Соколов Максим Н; Адонин Сергей А (2 декабря 2022 г.). «Одномерные супрамолекулярные гибриды йодоантимоната(III) и йодовисмутата(III) с дийодом: структурные особенности, стабильность и оптические свойства» . Молекулы . 27 (23): 8487. doi : 10,3390/molecules27238487 . ПМЦ 9735928 . ПМИД 36500578 .
- ^ Известно, что I (II) существует в монооксиде (IO); видеть Никитин, И.В. (31 августа 2008 г.). «Монооксиды галогенов». Российское химическое обозрение . 77 (8): 739–749. Бибкод : 2008RuCRv..77..739N . дои : 10.1070/RC2008v077n08ABEH003788 . S2CID 250898175 .
- ^ I(IV) наблюдался в диоксиде йода (IO 2 ); видеть Полинг, Лайнус (1988). «Кислородные соединения неметаллических элементов». Общая химия (3-е изд.). Dover Publications, Inc. с. 259. ИСБН 978-0-486-65622-9 .
- ^ I(VI) наблюдался в IO 3 , IO 4. 2− , Ч 5 ИО 6 − , Н 2 ИО 5 2− , Н 4 ИО 6 2− и HIO 5 3− ; видеть Кленинг, Ульрик К.; Сехестед, Кнуд; Вольф, Томас (1981). «Лазерный импульсный фотолиз и импульсный радиолиз йодата и периодата в водном растворе. Свойства йода (VI)». Дж. Хим. Соц., Фарадей Транс. 1 . 77 (7): 1707–18. дои : 10.1039/F19817701707 .
- ^ Соединения Xe: см. Ксенон.
- ^ Xe(0) наблюдался в тетраксенонозолоте(II) (AuXe 4 2+ ).
- ^ Сообщалось о Xe(I) в гексафторплатинате ксенона и гексафторродате ксенона (см. Полинг, Лайнус (1988). Общая химия (3-е изд.). Dover Publications, Inc. с. 250. ИСБН 978-0-486-65622-9 . ), однако позже было обнаружено, что эти соединения содержат Xe (II).
- ^ Ba(I) наблюдался в монофториде бария (BaF); видеть Коларуссо, П.; Го, Б.; Чжан, К.-Ц.; Бернат, ПФ (1995). «Спектр инфракрасного излучения монофторида бария с Фурье-преобразованием высокого разрешения» (PDF) . Журнал молекулярной спектроскопии . 170 (1): 59. Бибкод : 1996JMoSp.175..158C . дои : 10.1006/jmsp.1996.0019 . Архивировано из оригинала (PDF) 10 марта 2005 г.
- ^ Перейти обратно: а б с д La(I), Pr(I), Tb(I), Tm(I) и Yb(I) наблюдались в MB 8. − кластеры; видеть Ли, Ван-Лу; Чен, Дэн-Тэн; Чен, Вэй-Цзя; Ли, Цзюнь; Ван, Лай-Шэн (2021). «Одновалентный лантанид(I) в борозеновых комплексах» . Природные коммуникации . 12 (1): 6467. doi : 10.1038/s41467-021-26785-9 . ПМЦ 8578558 . ПМИД 34753931 .
- ^ Pr(I) наблюдался в [PrB 4 ] − ; видеть Чен, Синь; Ли, Ван-Лу; Чжао, Ли-Цзюань, Тянь; Ван, Лай-Шэн, Цзюнь (2018-). 12-13). «Лантаноиды с необычно низкими степенями окисления в PrB 3» . – и ПрБ 4 – Кластеры боридов». Неорганическая химия . 58 (1): 411–418. : 10.1021 /acs.inorgchem.8b02572 . PMID 30543295. . S2CID 56148031 doi
- ^ Pr(V) наблюдался в [PrO 2 ] + ; видеть Чжан, Циннань; Цюй, Хуэй; Ван, Гуаньцзюнь, Цзюнь-Бо, Мохуа; Чжоу, Ли, Цзюнь (06.06.2016). Соединения: образование и характеристика оксидов празеодима (V). Angewandte Chemie International Edition . 55 (24): 6896–6900. doi : 10.1002/anie.201602196 . ISSN 1521-3773 . PMID 27100273 .
- ^ Ху, Шу-Сянь; Цзянь, Дживэнь; Су, Цзин; Ву, Сюань; Ли, Цзюнь; Чжоу, Минфэй (2017). «Нитрид-оксиды пятивалентных лантаноидов: комплексы NPrO и NPrO- с тройными связями N≡Pr» . Химическая наука . 8 (5): 4035–4043. дои : 10.1039/C7SC00710H . ISSN 2041-6520 . ПМЦ 5434915 . ПМИД 28580119 .
- ^ Nd(IV) наблюдался в нестабильных твердотельных соединениях; видеть Холлеман, Арнольд Фредерик; Виберг, Эгон (2001), Виберг, Нильс (ред.), Неорганическая химия , перевод Иглсона, Мэри; Брюэр, Уильям, Сан-Диего/Берлин: Academic Press/De Gruyter, ISBN 0-12-352651-5
- ^ Перейти обратно: а б с д и Все лантаноиды (La–Lu) в степени окисления +2 наблюдались (кроме La, Gd, Lu) в разбавленных твердых растворах дигалогенидов этих элементов в щелочноземельных дигалогенидах (см. Холлеман, Арнольд Фредерик; Виберг, Эгон (2001), Виберг, Нильс (ред.), Неорганическая химия , перевод Иглсона, Мэри; Брюэр, Уильям, Сан-Диего/Берлин: Academic Press/De Gruyter, ISBN 0-12-352651-5 ) и (кроме Pm) в металлоорганических молекулярных комплексах, см. Lanthanides Topple предположения и Мейер, Г. (2014). «Все лантаноиды делают это, и даже уран имеет степень окисления +2». Angewandte Chemie, международное издание . 53 (14): 3550–51. дои : 10.1002/anie.201311325 . ПМИД 24616202 . . Кроме того, все лантаноиды (La–Lu) образуют дигидриды (LnH 2 ), дикарбиды (LnC 2 ), моносульфиды (LnS), моноселениды (LnSe) и монотеллуриды (LnTe), но для большинства элементов эти соединения имеют Ln 3+ ионы с электронами, делокализованными в зоны проводимости, например Ln 3+ (ЧАС − ) 2 (и − ).
- ^ Сообщалось о кластерном анионе SmB6, который содержит Sm в редкой степени окисления +1; видеть Пол, Дж. Робинсон; Синьсин, Чжан; Тайрел, Маккуин; Кит, Х. Боуэн; Анастасия, Н. Александрова (2017). "ЧМБ 6 – Кластерный анион: ковалентность с участием орбиталей» . J. Phys. Chem. A 2017, 121, 8, 1849–1854 . 121 (8): 1849–1854. : 10.1021 /acs.jpca.7b00247 . PMID 28182423 . doi
- ^ Dy(IV) наблюдался в нестабильных твердотельных соединениях; видеть Холлеман, Арнольд Фредерик; Виберг, Эгон (2001), Виберг, Нильс (ред.), Неорганическая химия , перевод Иглсона, Мэри; Брюэр, Уильям, Сан-Диего/Берлин: Academic Press/De Gruyter, ISBN 0-12-352651-5
- ^ Hf(I) наблюдался в монобромиде гафния (HfBr), см. Marek, G.S.; Troyanov, S.I.; Tsirel'nikov, V.I. (1979). "Кристаллическое строение и термодинамические характеристики монобромидов циркония и гафния / Crystal structure and thermodynamic characteristics of monobromides of zirconium and hafnium" . Журнал неорганической химии / Russian Journal of Inorganic Chemistry (in Russian). 24 (4): 890–893.
- ^ Re(–3) и Re(–1) встречаются в Na 3 [Re(CO) 4 ] и HRe(CO) 5 соответственно; видеть Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . п. 1046. ИСБН 978-0-08-037941-8 .
- ^ Os(-1) наблюдался в Na[Os(CO) 13 ] ; видеть Краузе, Дж.; Сиривардане, Упали; Салупо, Тереза А.; Вермер, Джозеф Р.; Кноппель, Дэвид В.; Шор, Шелдон Г. (1993). «Приготовление [Os 3 (CO) 11 ] 2− и его реакции с Os 3 (CO) 12 ; структуры [Et 4 N] [HOs 3 (CO) 11 ] и H 2 OsS 4 (CO)". Журнал металлоорганической химии . 454 (1–2): 263–271. doi : 10.1016/0022-328X(93 )83250-Y . и Картер, Уилли Дж.; Келланд, Джон В.; Окрасинский, Стэнли Дж.; Уорнер, Кейт Э.; Нортон, Джек Р. (1982). «Моноядерные гидридоалкилкарбонильные комплексы осмия и их полиядерные производные». Неорганическая химия . 21 (11): 3955–3960. дои : 10.1021/ic00141a019 .
- ^ Ir(-3) наблюдался в Ir(CO) 3 3− ; видеть Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . п. 1117. ИСБН 978-0-08-037941-8 .
- ^ Ir(–2) наблюдался в IrVO 2. – ; видеть Ле-Ши Чен; Цзяо-Цзяо Чен; Тонг-Мей Ма; Шэн-Гуй Хэ (2022). ИРВО 2 – с иридием в редкой степени окисления -II». Журнал физической химии A. 126 ( 32): 5294–5301. doi : 10.1021/acs.jpca.2c03974 .
- ^ Ir(VII) наблюдался в [(η 2 -O 2 )IrO 2 ] + ; см. C&EN: Iridium, одетый в пух и прах .
- ^ Ir(VIII) наблюдался в четырехокиси иридия (IrO 4 ); видеть Гонг, Ю; Чжоу, Минфэй; Каупп, Мартин; Ридель, Себастьян (2009). «Образование и характеристика молекулы тетраоксида иридия с иридием в степени окисления +VIII». Angewandte Chemie, международное издание . 48 (42): 7879–7883. дои : 10.1002/anie.200902733 . ПМИД 19593837 .
- ^ Ir(IX) наблюдался в ИрО + 4 ; видеть Ван, Гуаньцзюнь; Чжоу, Минфэй; Геттель, Джеймс Т.; Шробильген, Гэри Г.; Су, Цзин; Ли, Цзюнь; Шлёдер, Тобиас; Ридель, Себастьян (21 августа 2014 г.). «Идентификация иридийсодержащего соединения с формальной степенью окисления IX». Природа . 514 (7523): 475–477. Бибкод : 2014Natur.514..475W . дои : 10.1038/nature13795 . ПМИД 25341786 . S2CID 4463905 .
- ^ Pt(-1) и Pt(-2) наблюдались в платинидах бария BaPt и Ba 2 Pt соответственно: см. Карпов Андрей; Конума, Мицухару; Янсен, Мартин (2006). «Экспериментальное доказательство отрицательных степеней окисления платины: ESCA-измерения на платинидах бария». Химические коммуникации (8): 838–840. дои : 10.1039/b514631c . ПМИД 16479284 .
- ^ Pt(I) и Pt(III) наблюдались в биметаллических и полиметаллических соединениях; видеть Кауфман, Джордж Б .; Тернер, Джозеф Дж.; Затко, Дэвид А. (1967). «Гексахлорплатинат (IV) аммония». Неорганические синтезы . Том. 9. стр. 182–185. дои : 10.1002/9780470132401.ch51 . ISBN 978-0-470-13240-1 .
- ^ Наблюдалось Au(0), см. Мезай, Николя; Аварвари, Нарцис; Мегро, Николь; Рикар, Луи; Мэти, Франсуа; Ле Флох, Паскаль; Катальдо, Лоран; Берклаз, Тео; Жоффруа, Мишель (1999). «Комплексы золота (I) и золота (0) макроциклов на основе фосфинина». Angewandte Chemie, международное издание . 38 (21): 3194–3197. doi : 10.1002/(SICI)1521-3773(19991102)38:21<3194::AID-ANIE3194>3.0.CO;2-O . ПМИД 10556900 .
- ^ Hg(IV) обнаружен во фториде ртути(IV) (HgF 4 ); видеть Сюэфан Ван; Лестер Эндрюс; Себастьян Ридель; Мартин Каупп (2007). «Ртуть — переходный металл: первое экспериментальное свидетельство существования HgF 4 ». Энджью. хим. Межд. Эд . 46 (44): 8371–8375. дои : 10.1002/anie.200703710 . ПМИД 17899620 . Однако более поздние эксперименты не смогли подтвердить это; видеть Янг, Найджел (12 июля 2016 г.). «Является ли ртуть переходным металлом?» . Университет Халла. Архивировано из оригинала 12 октября 2016 г.
- ^ Tl(-5) наблюдался в Na 23 K 9 Tl 15.3 , см. Донг, З.-К.; Корбетт, доктор медицинских наук (1996). «Na 23 K 9 Tl 15.3 : необычное соединение цинтла, содержащее кажущийся Tl 5. 7− , часть 4 8− , Тл 3 7− , и Тл 5− Анионы». Неорганическая химия . 35 (11): 3107–12. doi : 10.1021/ic960014z . PMID 11666505 .
- ^ Tl(-1) наблюдался в таллиде цезия (CsTl); видеть Кинг, РБ; Шлейер, Р. (2004). «Теория и концепции кластерной химии основных групп». В Дриссе, М.; Нёт, Х. (ред.). Молекулярные кластеры элементов основной группы . Wiley-VCH, Чичестер. п. 19. ISBN 978-3-527-61437-0 .
- ^ Tl(+2) наблюдался в тетракис(гиперсилил)диталлии ([( Me 3 Si)Si] 2 Tl—Tl[Si(SiMe 3 )] 2 ), см. Соня Хенкель; Доктор Карл Вильгельм Клинкхаммер; Доктор Вольфганг Шварц (1994). «Тетракис (гиперсилил) диталлий (Tl-Tl): двухвалентное соединение таллия». Энджью. хим. Эд . 33 (6): 681–683. дои : 10.1002/anie.199406811 .
- ^ Pb(-2) наблюдался в BaPb, см. Ферро, Риккардо (2008). Николас К. Норман (ред.). Интерметаллическая химия . Эльзевир. п. 505. ИСБН 978-0-08-044099-6 . и Тодоров Илья; Севов, Слави С. (2004). «Ароматические кольца тяжелых металлов: аналоги циклопентадиенил-аниона Sn 5 6− и Pb 5 6− в фазах Цинтла Na 8 BaPb 6 , Na 8 BaSn 6 и Na 8 EuSn 6 ". Неорганическая химия . 43 (20): 6490–94. doi : 10.1021/ic000333x .
- ^ Карбонилы Pb(0) наблюдались в реакции между атомами свинца и окисью углерода ; видеть Лин, Цзян; Цян, Сюй (2005). «Наблюдение карбонилов свинца Pb n CO (n = 1–4): Реакции атомов и небольших кластеров свинца с окисью углерода в твердом аргоне» . Журнал химической физики. 122 (3): 034505 . 122 (3): 34505. Бибкод : 2005JChPh.122c4505J . дои : 10.1063/1.1834915 . ISSN 0021-9606 . ПМИД 15740207 . Также Pb(0) наблюдался в [Si II (Ксанф)Си II ]PbFe(CO) 4 ; видеть Цзянь Сюй; Судип Пан; Шэнлай Яо; Гернот Френкинг; Матиас Дрисс (2022). «Самый тяжелый металлилон, который можно разливать в бутылки: синтез одноатомного свинцового комплекса с нулевой валентностью («Плюмбилон»)» . Angewandte Chemie, международное издание . 61 (38): e202209442. дои : 10.1002/anie.202209442 . ПМЦ 9545849 . PMID 35848899 .
- ^ Pb(+1) и Pb(+3) наблюдались в свинцовоорганических соединениях , например, в гексаметилдиплюмбане Pb 2 (CH 3 ) 6 ; о Pb(I) см. Сью-Пэн Цзя; Хун-Вэй Си; Юнсинь Ли; Кок Хва Лим; Чеук-Вай Со (2013). «Стабилизированный основанием димер свинца (I) и ароматический плюмбилиденид-анион». Энджью. хим. Межд. Эд . 52 (24): 6298–6301. дои : 10.1002/anie.201301954 . ПМИД 23629949 .
- ^ Bi(-2) и Bi(-1) встречаются в фазах Цинтла, например (Ca 2+ ) 22 [Би 4 ] 4− ([Би 2 ] 4− ) 4 [С 3− ] 8 ; видеть Пону, Симеон (2006). «Германиды, двойные соли германид-вольфрамат и эффекты замещения в фазах Цинтла» . Технический университет Мюнхена. Кафедра неорганической химии с упором на новые материалы. п. 68.
- ^ Известно, что состояние Bi(0) существует в N-гетероциклическом карбеновом комплексе дивисмутена; видеть Дека, Раджеш; Ортабер, Андреас (6 мая 2022 г.). «Карбеновая химия мышьяка, сурьмы и висмута: происхождение, эволюция и перспективы» . Королевское химическое общество . 51 (22): 8540–8556. дои : 10.1039/d2dt00755j . ПМИД 35578901 . S2CID 248675805 .
- ^ Bi(I) наблюдался в монобромиде висмута (BiBr) и монойодиде висмута (BiI); видеть Годфри, С.М.; Маколифф, Калифорния; Маки, AG; Причард, Р.Г. (1998). Николас К. Норман (ред.). Химия мышьяка, сурьмы и висмута . Спрингер. стр. 67–84. ISBN 978-0-7514-0389-3 .
- ^ Bi(+2) наблюдался в дивисмутинах (R 2 Bi-BiR 2 ), см. Эш, Артур Дж. III (1990). «Термохромные дистибины и дивисмутины». Достижения металлоорганической химии . 30 : 77–97. дои : 10.1016/S0065-3055(08)60499-2 . ISBN 9780120311309 .
- ^ Bi(IV) наблюдался; видеть А.И. Александров, И.Е. Макаров (1987). «Образование Bi(II) и Bi(IV) в водно-соляных растворах Bi(III)». Вестник Академии наук СССР, Отделение химических наук . 36 (2): 217–220. дои : 10.1007/BF00959349 . S2CID 94865394 .
- ^ Po(V) наблюдался в диоксидополонии (1+) ( PoO + ); видеть Тайер, Джон С. (2010). «Релятивистские эффекты и химия более тяжелых элементов основной группы». Релятивистские методы для химиков . Проблемы и достижения в области вычислительной химии и физики. Том. 10. с. 78. дои : 10.1007/978-1-4020-9975-5_2 . ISBN 978-1-4020-9974-8 .
- ^ Rn(II) наблюдался в дифториде радона (RnF 2 ); видеть Штейн, Л. (1970). «Ионный раствор радона». Наука . 168 (3929): 362–4. Бибкод : 1970Sci...168..362S . дои : 10.1126/science.168.3929.362 . ПМИД 17809133 . S2CID 31959268 . и Кеннет С. Питцер (1975). «Фториды радона и элемента 118» . Дж. Хим. Соц., хим. Коммун. (18): 760б–761. дои : 10.1039/C3975000760b .
- ^ Rn(IV) сообщается Гринвудом и Эрншоу, но его существование не известно; видеть Сайкс, АГ (1998). «Последние достижения в химии благородных газов» . Достижения неорганической химии . Том. 46. Академическая пресса. стр. 91–93. ISBN 978-0-12-023646-6 . Проверено 22 ноября 2012 г.
- ^ Rn(VI) известен в триоксиде радона (RnO 3 ); видеть Сайкс, АГ (1998). «Последние достижения в химии благородных газов» . Достижения неорганической химии . Том. 46. Академическая пресса. стр. 91–93. ISBN 978-0-12-023646-6 . Проверено 22 ноября 2012 г.
- ^ Th(-I) и U(-I) обнаружены в газовой фазе в виде октакарбонильных анионов; видеть Чаоксиан, Пан; Луян, Мингбяо, Луо; Лили, Чжао; Гернот, Френкинг ( 2019 ) . +/− (An=Th, U) и роль f-орбиталей в связи металл-лиганд» . Химия (Weinheim an der Bergstrasse, Germany). 25 (50): 11772–11784 . 25 (50): 11772–11784. doi : 10.1002 . ISSN 0947-6539 . ПМЦ 6772027 . / хим.201902625
- ^ Th(I) известен в бромиде тория (I) (ThBr); видеть Викледер, Матиас С.; Фурест, Бландин; Дорхаут, Питер К. (2006). «Торий». В Морссе, Лестер Р.; Эдельштейн, Норман М.; Фугер, Жан (ред.). Химия актинидных и трансактинидных элементов (PDF) . Том. 3 (3-е изд.). Дордрехт, Нидерланды: Springer. стр. 52–160. дои : 10.1007/1-4020-3598-5_3 . ISBN 978-1-4020-3555-5 . Архивировано из оригинала (PDF) 7 марта 2016 г.
- ^ Th(II) и Th(III) наблюдаются в [Th II { п 5 -C 5 H 3 (SiMe 3 ) 2 } 3 ] − и [Ч III { п 5 -C 5 H 3 (SiMe 3 ) 2 } 3 ], см. Лангеслей, Райан Р.; Физер, Меган Э.; Циллер, Джозеф В.; Фурче, Филип; Эванс, Уильям Дж. (2015). «Синтез, строение и реакционная способность кристаллических молекулярных комплексов {[C 5 H 3 (SiMe 3 ) 2 ] 3 Th} 1− анион, содержащий торий в формальной степени окисления +2» . Chem. Sci . 6 (1): 517–521. : 10.1039 /C4SC03033H . PMC 5811171. . PMID 29560172 doi
- ^ Pa(II) встречается в оксиде проктактиния(II).
- ^ Th(-I) и U(-I) обнаружены в газовой фазе в виде октакарбонильных анионов; видеть Чаоксиан, Пан; Луян, Мингбяо, Луо; Лили, Чжао; Гернот, Френкинг ( 2019 ) . +/− (An=Th, U) и роль f-орбиталей в связи металл-лиганд» . Химия (Weinheim an der Bergstrasse, Germany). 25 (50): 11772–11784 . 25 (50): 11772–11784. doi : 10.1002 . ISSN 0947-6539 . ПМЦ 6772027 . / хим.201902625
- ^ U(I) наблюдался в монофториде урана (UF) и монохлориде урана (UCl), см. Сайкс, АГ (1990). «Соединения тория и урана» . Достижения неорганической химии . Том. 34. Академическая пресса. стр. 87–88. ISBN 978-0-12-023634-3 . Проверено 22 марта 2015 г. Кроме того, U(I) наблюдался в [U(η 5 -С 5 я Пр 5 ) 2 ] − , видеть Барлуцци, Лучано; Гиблин, Шон Р.; Мансиккамяки, Аксели; Лэйфилд, Ричард А. (2022). «Идентификация степени окисления +1 в молекулярном комплексе урана» . Дж. Ам. хим. Соц . 144 (40): 18229–18233. дои : 10.1021/jacs.2c06519 . ПМИД 36169550 . S2CID 252567088 . Проверено 13 июля 2023 г.
- ^ U(II) наблюдался в [K(2.2.2-Cryptand)][(C 5 H 4 SiMe 3 ) 3 U], см. Макдональд, Мэтью Р.; Физер, Меган Э.; Бейтс, Джефферсон Э.; Циллер, Джозеф В.; Фурче, Филипп; Эванс, Уильям Дж. (2013). «Идентификация степени окисления +2 урана в кристаллическом молекулярном комплексе, [K(2.2.2-криптанд)][(C 5 H 4 SiMe 3 ) 3 U]». Дж. Ам. хим. Соц . 135 (36): 13310–13313. дои : 10.1021/ja406791t . ПМИД 23984753 .
- ^ Наблюдались Np(II), (III) и (IV), см. Дуткевич, Михал С.; Апостолидис, Христос; Уолтер, Олаф; Арнольд, Полли Л. (2017). «Восстановительная химия циклопентадиенидных комплексов нептуния: от структуры к пониманию» . хим. Наука . 8 (4): 2553–2561. дои : 10.1039/C7SC00034K . ПМК 5431675 . ПМИД 28553487 .
- ^ Pu(II) наблюдался в {Pu[C 5 H 3 (SiMe 3 ) 2 ] 3 }−; видеть Виндорф, Кори Дж.; Чен, Го П; Кросс, Джастин Н; Эванс, Уильям Дж.; Фурче, Филипп; Гонт, Эндрю Дж.; Янике, Майкл Т.; Козимор, Стош А.; Скотт, Брайан Л. (2017). «Идентификация формального состояния окисления +2 плутония: синтез и характеристика ref name="curium5" {Pu II [C 5 H 3 (SiMe 3 ) 2 ] 3 }-». J. Am. Chem. Soc . 139 (11): 3970–3973. doi : 10.1021/jacs.7b00706 . PMID 28235179 .
- ^ Pu(VIII) наблюдался в ПуО 4 ; видеть Никонов, М.В.; Киселев, Ю. М.; Тананаев И.Г.; Мясоедов, Б.Ф. (март 2011 г.). «Летучесть плутония при озонировании щелочных растворов гидроксокомплексов Pu(VI)». Доклады химии . 437 (1): 69–71. дои : 10.1134/S0012500811030104 . S2CID 95951175 . Также см. Киселев, Ю. М.; Никонов, М.В.; Долженко В.Д.; Ермилов А. Ю.; Тананаев И.Г.; Мясоедов, БФ (17 января 2014 г.). «О существовании и свойствах производных плутония(VIII)». Радиохимика Акта . 102 (3): 227–237. дои : 10.1515/ract-2014-2146 . S2CID 100915090 .
- ^ Am(VII) наблюдался в АмО - 5 ; см. Америций , Периодическая таблица элементов для школ chemie-master.de (на немецком языке), дата обращения 28 ноября 2010 г. и Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . п. 1265. ИСБН 978-0-08-037941-8 .
- ^ Перейти обратно: а б с Cm(V), Bk(V) и Cf(V) наблюдались в BkO 2 + , CfO 2 + , CmO 2 (NO 3 ) 2 − , БкО 2 (НО 3 ) 2 − , и CfO 2 (NO 3 ) 2 − ; видеть Дау, Фуонг Зьем; Василиу, Моника; Петерсон, Кирк А; Диксон, Дэвид А; Гибсун, Джон К. (октябрь 2017 г.). «Удивительно высокая стабильность поздних катионов диоксида актинида: распространение химии на пятивалентный берклий и калифорний» . Химия - Европейский журнал . 23 (68): 17369–17378. дои : 10.1002/chem.201704193 . ПМИД 29024093 .
- ^ Перейти обратно: а б с Ковач, Аттила; Дау, Фуонг Д.; Марсало, Хоаким; Гибсон, Джон К. (2018). «Пятивалентный кюрий, берклий и калифорний в нитратных комплексах: расширение химии актинидов и состояний окисления». Неорг. Хим . 57 (15). Американское химическое общество: 9453–9467. doi : 10.1021/acs.inorgchem.8b01450 . ОСТИ 1631597 . ПМИД 30040397 . S2CID 51717837 .
- ^ Cm(VI) наблюдался в триоксиде кюрия (CmO 3 ) и диоксидокюрии (2+) ( CmO + 2 ); видеть Доманов, вице-президент; Лобанов, Ю. В. (октябрь 2011 г.). «Образование летучего триоксида кюрия(VI) CmO 3 ». Радиохимия . 53 (5): 453–6. дои : 10.1134/S1066362211050018 . S2CID 98052484 .
- ^ Сообщалось, что Cm (VIII) возможно встречается в тетраоксиде кюрия (CmO 4 ); видеть Доманов, В.П. (январь 2013 г.). «Возможность генерации восьмивалентного кюрия в газовой фазе в виде летучего тетраоксида CmO 4 ». Радиохимия . 55 (1): 46–51. дои : 10.1134/S1066362213010098 . S2CID 98076989 . Однако новые эксперименты, похоже, указывают на его отсутствие: Зайцевский, Андрей; Шварц, WH Eugen (апрель 2014 г.). «Структура и стабильность изомеров AnO4, An = Pu, Am и Cm: исследование релятивистского функционала плотности». Физическая химия Химическая физика . 2014 (16): 8997–9001. Бибкод : 2014PCCP...16.8997Z . дои : 10.1039/c4cp00235k . ПМИД 24695756 .
- ^ Петерсон-младший; Хобарт, Делавэр (1984). «Химия берклиума» . В Эмелеусе, Гарри Джулиус (ред.). Успехи неорганической химии и радиохимии . Том. 28. Академическая пресса. стр. 29–64 . дои : 10.1016/S0898-8838(08)60204-4 . ISBN 978-0-12-023628-2 .
- ^ Петерсон и Хобарт 1984 , с. 55.
- ^ Салливан, Джим С.; Шмидт, К.Х.; Морсс, ЛР; Пиппин, CG; Уильямс, К. (1988). «Исследование берклия (III) импульсным радиолизом: получение и идентификация берклия (II) в водных перхлоратных средах». Неорганическая химия . 27 (4): 597. doi : 10.1021/ic00277a005 .
- ^ Es(IV) известен во фториде эйнштейния(IV) (EsF 4 ); видеть Кляйншмидт, П. (1994). «Термохимия актинидов» . Журнал сплавов и соединений . 213–214: 169–172. дои : 10.1016/0925-8388(94)90898-2 .
- ^ Db(V) наблюдался в пентахлориде дубния (DbCl 5 ); видеть Х.В. Геггелер (2007). «Газовая фазовая химия сверхтяжелых элементов» (PDF) . Институт Пола Шеррера . стр. 26–28. Архивировано из оригинала (PDF) 20 февраля 2012 г.
- ^ Sg(VI) наблюдался в гидроксиде оксида сиборгия (SgO 2 (OH) 2 ); видеть Хюбенер, С.; Таут, С.; Вале, А.; Дресслер, Р.; и др. (2001). «Физико-химическая характеристика сиборгия в виде гидроксида оксида» (PDF) . Радиохим. Акта . 89 (11–12): 737–741. дои : 10.1524/ract.2001.89.11-12.737 . S2CID 98583998 . Архивировано из оригинала (PDF) 25 октября 2014 г.
- ^ Sg(0) наблюдался в гексакарбониле сиборгия (Sg(CO) 6 ); видеть Эвен, Дж.; Якушев А.; Дуллманн, CE; Хаба, Х.; и др. (2014). «Синтез и обнаружение карбонильного комплекса сиборгия». Наука . 345 (6203): 1491–3. Бибкод : 2014Sci...345.1491E . дои : 10.1126/science.1255720 . ПМИД 25237098 . S2CID 206558746 .
- ^ Bh(VII) наблюдался в оксихлориде бора (BhO 3 Cl); видеть Эйхлер Р., Дюльманн С., Геггелер Х.В., Эйхлер Б. и др. «Газохимическое исследование бория (Bh, элемент 107)» (PDF) . Годовой отчет GSI за 2000 год . Архивировано из оригинала (PDF) 28 февраля 2008 г. Проверено 29 февраля 2008 г.
- ^ Hs(VIII) наблюдался в четырехокиси гассия (HsO 4 ); видеть «Химия хассия» (PDF) . Общество исследования тяжелых ионов mbH . 2002 . Проверено 31 января 2007 г.
- ^ Cn(II) наблюдался в селениде коперниция (CnSe); видеть «Годовой отчет 2015: Лаборатория радиохимии и химии окружающей среды» (PDF) . Институт Пола Шеррера. 2015. с. 3.
- ^ Ленгмюр, Ирвинг (1919). «Расположение электронов в атомах и молекулах» . Дж. Ам. хим. Соц . 41 (6): 868–934. дои : 10.1021/ja02227a002 . Архивировано из оригинала 21 июня 2019 г. Проверено 1 июля 2019 г.
- ^ «Антуан Лоран Лавуазье. Химическая революция - ориентир - Американское химическое общество» . Американское химическое общество . Архивировано из оригинала 5 января 2021 года . Проверено 14 июля 2018 г.
- ^ «Лавуазье об элементах» . Chem125-oyc.webspace.yale.edu . Архивировано из оригинала 13 июня 2020 года . Проверено 14 июля 2018 г.
- ^ Вёлер, Ф. (1835). Основы химии: Неорганическая химия . Берлин: Дункер и Хамблот. п. 4.
- ^ Дженсен, ВБ (2007). «Происхождение концепции степени окисления». Дж. Хим. Образование . 84 (9): 1418–1419. Бибкод : 2007JChEd..84.1418J . дои : 10.1021/ed084p1418 .
- ^ Сток, А. (1919). « Einige Nomenklaturfragen der anorganischen Chemie». Энджью. Хим . 32 (98): 373–374. Бибкод : 1919АнгЧ..32..373С . дои : 10.1002/ange.19190329802 . Архивировано из оригинала 06 августа 2020 г. Проверено 1 июля 2019 г.
- ^ Перейти обратно: а б Йориссен, В.П.; Бассетт, Х.; Дэмиенс, А.; Фихтер, Ф.; Реми, Х. (1941). «Правила наименования неорганических соединений». Дж. Ам. хим. Соц . 63 : 889–897. дои : 10.1021/ja01849a001 .
- ^ Латимер, WM (1938). Состояния окисления элементов и их потенциалы в водных растворах (1-е изд.). Прентис-Холл.
- ^ Брей, туалет; Филиал ГЭК (1913). «Валентность и таутомерия» . Дж. Ам. хим. Соц . 35 (10): 1440–1447. дои : 10.1021/ja02199a003 . Архивировано из оригинала 9 февраля 2021 г. Проверено 16 сентября 2019 г.
- ^ Нойес, А.А.; Питцер, Канзас; Данн, CL (1935). «Соли серебра в растворе кислоты. I. Реакции окисления и восстановления». Дж. Ам. хим. Соц . 57 (7): 1221–1229. дои : 10.1021/ja01310a018 .
- ^ Нойес, А.А.; Питцер, Канзас; Данн, CL (1935). «Соли серебра в растворе кислоты, II. Степень окисления солей серебра». Дж. Ам. хим. Соц . 57 (7): 1229–1237. дои : 10.1021/ja01310a019 .
- ^ Фернелиус, WC (1948). «Некоторые проблемы неорганической номенклатуры». хим. англ. Новости . 26 : 161–163. doi : 10.1021/cen-v026n003.p161 .
- ^ Фернелиус, WC; Ларсен, Э.М.; Марчи, Ле; Роллинсон, CL (1948). «Номенклатура координационных соединений». хим. англ. Новости . 26 (8): 520–523. doi : 10.1021/cen-v026n008.p520 .
- ^ Полинг, Л. (1948). «Современная теория валентности» . Дж. Хим. Соц . 1948 : 1461–1467. дои : 10.1039/JR9480001461 . ПМИД 18893624 . Архивировано из оригинала 07 декабря 2021 г. Проверено 22 ноября 2021 г.
- ^ Калверт, Дж. Г. (1990). «Рекомендация ИЮПАК 1990» . Чистое приложение. Хим . 62 : 2204. дои : 10.1351/pac199062112167 .