Цианобактерии
| Цианобактерии Временный диапазон: (Возможные палеоархинские записи)
| |
|---|---|

| |
| Микроскоп изображение цилиндросперма , нитевидного рода цианобактерий | |
| Научная классификация | |
| Домен: | Бактерии |
| Clade: | Terrabacteria |
| Clade: | Cyanobacteria-Melainabacteria group |
| Phylum: | Cyanobacteria Stanier, 1973 |
| Class: | Cyanophyceae |
| Orders[3] | |
| Synonyms | |
|
List | |
Cyanobacteria ( / s aɪ ˌ æ n oʊ b æ K ˈ t ɪər i . Ə / ), также называемая цианобактериотой или цианофитой , представляют собой тип автотрофических грамотрицательных бактерий [ 4 ] Это может получить биологическую энергию с помощью кислородного фотосинтеза . Название «Cyanobacteria» (от древнегреческого κύανος ( kúanos ) «синий») относится к их голубоватому зеленому ( голубому ) цвету, [ 5 ] [ 6 ] Что составляет основу неформального общего названия Cyanobacteria , сине-зеленых водорослей , [ 7 ] [ 8 ] [ 9 ] Хотя как прокариоты они не классифицируются с научной точки зрения как водоросли . [ Примечание 1 ]
Цианобактерии, вероятно, являются самыми многочисленными таксоном , когда -либо существовавшими на Земле, и первые организмы, которые, как известно, продуцировали кислород , [ 10 ] появившись в среднем археи и, по -видимому, возник в пресной или земной среде . [ 11 ] Их фотопигменты могут поглощать частоты красного и синего спектра солнечного света (таким образом, отражая зеленоватый цвет), чтобы разделить молекулы воды на ионы водорода и кислород. Ионы водорода используются для реагирования с диоксидом углерода для получения сложных органических соединений, таких как углеводы (процесс, известный как фиксация углерода ), и кислород высвобождается в качестве побочного продукта . Считается, что, постоянно продуцируя и высвобождая кислород за миллиарды лет, цианобактерии превратили аноксическую атмосферу ранней Земли , слабо восстанавливающуюся пребиотическую атмосферу , в окислитель со свободным газовым кислородом (который ранее был бы немедленно удален различными поверхностными восстановлением )) , в результате чего великое событие окисления и « ржавчину земли » во время раннего протерозоя , [12] dramatically changing the composition of life forms on Earth.[13] Последующая адаптация ранних одноклеточных организмов к выживанию в кислороде, вероятно, привела к эндосимбиозу между анаэробными и аэробанами и, следовательно, эволюции эукариот во время палеопротерозоя .
Cyanobacteria use photosynthetic pigments such as various forms of chlorophyll, carotenoids, phycobilins to convert the photonic energy in sunlight to chemical energy. Unlike heterotrophic prokaryotes, cyanobacteria have internal membranes. These are flattened sacs called thylakoids where photosynthesis is performed.[14][15] Photoautotrophic eukaryotes such as red algae, green algae and plants perform photosynthesis in chlorophyllic organelles that are thought to have their ancestry in cyanobacteria, acquired long ago via endosymbiosis. These endosymbiont cyanobacteria in eukaryotes then evolved and differentiated into specialized organelles such as chloroplasts, chromoplasts, etioplasts, and leucoplasts, collectively known as plastids.
Sericytochromatia, the proposed name of the paraphyletic and most basal group, is the ancestor of both the non-photosynthetic group Melainabacteria and the photosynthetic cyanobacteria, also called Oxyphotobacteria.[16]
The cyanobacteria Synechocystis and Cyanothece are important model organisms with potential applications in biotechnology for bioethanol production, food colorings, as a source of human and animal food, dietary supplements and raw materials.[17] Cyanobacteria produce a range of toxins known as cyanotoxins that can cause harmful health effects in humans and animals.
Overview
[edit]
Cyanobacteria are a very large and diverse phylum of photosynthetic prokaryotes.[19] They are defined by their unique combination of pigments and their ability to perform oxygenic photosynthesis. They often live in colonial aggregates that can take on a multitude of forms.[20] Of particular interest are the filamentous species, which often dominate the upper layers of microbial mats found in extreme environments such as hot springs, hypersaline water, deserts and the polar regions,[21] but are also widely distributed in more mundane environments as well.[22] They are evolutionarily optimized for environmental conditions of low oxygen.[23] Some species are nitrogen-fixing and live in a wide variety of moist soils and water, either freely or in a symbiotic relationship with plants or lichen-forming fungi (as in the lichen genus Peltigera).[24]

Cyanobacteria are globally widespread photosynthetic prokaryotes and are major contributors to global biogeochemical cycles.[25] They are the only oxygenic photosynthetic prokaryotes, and prosper in diverse and extreme habitats.[26] They are among the oldest organisms on Earth with fossil records dating back at least 2.1 billion years.[27] Since then, cyanobacteria have been essential players in the Earth's ecosystems. Planktonic cyanobacteria are a fundamental component of marine food webs and are major contributors to global carbon and nitrogen fluxes.[28][29] Some cyanobacteria form harmful algal blooms causing the disruption of aquatic ecosystem services and intoxication of wildlife and humans by the production of powerful toxins (cyanotoxins) such as microcystins, saxitoxin, and cylindrospermopsin.[30][31] Nowadays, cyanobacterial blooms pose a serious threat to aquatic environments and public health, and are increasing in frequency and magnitude globally.[32][25]
Cyanobacteria are ubiquitous in marine environments and play important roles as primary producers. They are part of the marine phytoplankton, which currently contributes almost half of the Earth's total primary production.[33] About 25% of the global marine primary production is contributed by cyanobacteria.[34]
Within the cyanobacteria, only a few lineages colonized the open ocean: Crocosphaera and relatives, cyanobacterium UCYN-A, Trichodesmium, as well as Prochlorococcus and Synechococcus.[35][36][37][38] From these lineages, nitrogen-fixing cyanobacteria are particularly important because they exert a control on primary productivity and the export of organic carbon to the deep ocean,[35] by converting nitrogen gas into ammonium, which is later used to make amino acids and proteins. Marine picocyanobacteria (Prochlorococcus and Synechococcus) numerically dominate most phytoplankton assemblages in modern oceans, contributing importantly to primary productivity.[37][38][39] While some planktonic cyanobacteria are unicellular and free living cells (e.g., Crocosphaera, Prochlorococcus, Synechococcus); others have established symbiotic relationships with haptophyte algae, such as coccolithophores.[36] Amongst the filamentous forms, Trichodesmium are free-living and form aggregates. However, filamentous heterocyst-forming cyanobacteria (e.g., Richelia, Calothrix) are found in association with diatoms such as Hemiaulus, Rhizosolenia and Chaetoceros.[40][41][42][43]
Marine cyanobacteria include the smallest known photosynthetic organisms. The smallest of all, Prochlorococcus, is just 0.5 to 0.8 micrometres across.[44] In terms of numbers of individuals, Prochlorococcus is possibly the most plentiful genus on Earth: a single millilitre of surface seawater can contain 100,000 cells of this genus or more. Worldwide there are estimated to be several octillion (1027, a billion billion billion) individuals.[45] Prochlorococcus is ubiquitous between latitudes 40°N and 40°S, and dominates in the oligotrophic (nutrient-poor) regions of the oceans.[46] The bacterium accounts for about 20% of the oxygen in the Earth's atmosphere.[47]
Morphology
[edit]Cyanobacteria are variable in morphology, ranging from unicellular and filamentous to colonial forms. Filamentous forms exhibit functional cell differentiation such as heterocysts (for nitrogen fixation), akinetes (resting stage cells), and hormogonia (reproductive, motile filaments). These, together with the intercellular connections they possess, are considered the first signs of multicellularity.[48][49][50][25]
Many cyanobacteria form motile filaments of cells, called hormogonia, that travel away from the main biomass to bud and form new colonies elsewhere.[51][52] The cells in a hormogonium are often thinner than in the vegetative state, and the cells on either end of the motile chain may be tapered. To break away from the parent colony, a hormogonium often must tear apart a weaker cell in a filament, called a necridium.
scale bars about 10 μm

• Non-heterocytous: (c) Arthrospira maxima,
Some filamentous species can differentiate into several different cell types:
- Vegetative cells – the normal, photosynthetic cells that are formed under favorable growing conditions
- Akinetes – climate-resistant spores that may form when environmental conditions become harsh
- Thick-walled heterocysts – which contain the enzyme nitrogenase vital for nitrogen fixation[54][55][56] in an anaerobic environment due to its sensitivity to oxygen.[56]
Each individual cell (each single cyanobacterium) typically has a thick, gelatinous cell wall.[57] They lack flagella, but hormogonia of some species can move about by gliding along surfaces.[58] Many of the multicellular filamentous forms of Oscillatoria are capable of a waving motion; the filament oscillates back and forth. In water columns, some cyanobacteria float by forming gas vesicles, as in archaea.[59] These vesicles are not organelles as such. They are not bounded by lipid membranes, but by a protein sheath.
Nitrogen fixation
[edit]
Some cyanobacteria can fix atmospheric nitrogen in anaerobic conditions by means of specialized cells called heterocysts.[55][56] Heterocysts may also form under the appropriate environmental conditions (anoxic) when fixed nitrogen is scarce. Heterocyst-forming species are specialized for nitrogen fixation and are able to fix nitrogen gas into ammonia (NH3), nitrites (NO−2) or nitrates (NO−3), which can be absorbed by plants and converted to protein and nucleic acids (atmospheric nitrogen is not bioavailable to plants, except for those having endosymbiotic nitrogen-fixing bacteria, especially the family Fabaceae, among others).
Free-living cyanobacteria are present in the water of rice paddies, and cyanobacteria can be found growing as epiphytes on the surfaces of the green alga, Chara, where they may fix nitrogen.[60] Cyanobacteria such as Anabaena (a symbiont of the aquatic fern Azolla) can provide rice plantations with biofertilizer.[61]
Photosynthesis
[edit]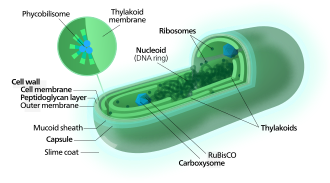

Carbon fixation
[edit]Cyanobacteria use the energy of sunlight to drive photosynthesis, a process where the energy of light is used to synthesize organic compounds from carbon dioxide. Because they are aquatic organisms, they typically employ several strategies which are collectively known as a "CO2 concentrating mechanism" to aid in the acquisition of inorganic carbon (CO2 or bicarbonate). Among the more specific strategies is the widespread prevalence of the bacterial microcompartments known as carboxysomes,[63] which co-operate with active transporters of CO2 and bicarbonate, in order to accumulate bicarbonate into the cytoplasm of the cell.[64] Carboxysomes are icosahedral structures composed of hexameric shell proteins that assemble into cage-like structures that can be several hundreds of nanometres in diameter. It is believed that these structures tether the CO2-fixing enzyme, RuBisCO, to the interior of the shell, as well as the enzyme carbonic anhydrase, using metabolic channeling to enhance the local CO2 concentrations and thus increase the efficiency of the RuBisCO enzyme.[65]
Electron transport
[edit]In contrast to purple bacteria and other bacteria performing anoxygenic photosynthesis, thylakoid membranes of cyanobacteria are not continuous with the plasma membrane but are separate compartments.[66] The photosynthetic machinery is embedded in the thylakoid membranes, with phycobilisomes acting as light-harvesting antennae attached to the membrane, giving the green pigmentation observed (with wavelengths from 450 nm to 660 nm) in most cyanobacteria.[67]
While most of the high-energy electrons derived from water are used by the cyanobacterial cells for their own needs, a fraction of these electrons may be donated to the external environment via electrogenic activity.[68]
Respiration
[edit]Respiration in cyanobacteria can occur in the thylakoid membrane alongside photosynthesis,[69] with their photosynthetic electron transport sharing the same compartment as the components of respiratory electron transport. While the goal of photosynthesis is to store energy by building carbohydrates from CO2, respiration is the reverse of this, with carbohydrates turned back into CO2 accompanying energy release.
Cyanobacteria appear to separate these two processes with their plasma membrane containing only components of the respiratory chain, while the thylakoid membrane hosts an interlinked respiratory and photosynthetic electron transport chain.[69] Cyanobacteria use electrons from succinate dehydrogenase rather than from NADPH for respiration.[69]
Cyanobacteria only respire during the night (or in the dark) because the facilities used for electron transport are used in reverse for photosynthesis while in the light.[70]
Electron transport chain
[edit]Many cyanobacteria are able to reduce nitrogen and carbon dioxide under aerobic conditions, a fact that may be responsible for their evolutionary and ecological success. The water-oxidizing photosynthesis is accomplished by coupling the activity of photosystem (PS) II and I (Z-scheme). In contrast to green sulfur bacteria which only use one photosystem, the use of water as an electron donor is energetically demanding, requiring two photosystems.[71]
Attached to the thylakoid membrane, phycobilisomes act as light-harvesting antennae for the photosystems.[72] The phycobilisome components (phycobiliproteins) are responsible for the blue-green pigmentation of most cyanobacteria.[73] The variations on this theme are due mainly to carotenoids and phycoerythrins that give the cells their red-brownish coloration. In some cyanobacteria, the color of light influences the composition of the phycobilisomes.[74][75] In green light, the cells accumulate more phycoerythrin, which absorbs green light, whereas in red light they produce more phycocyanin which absorbs red. Thus, these bacteria can change from brick-red to bright blue-green depending on whether they are exposed to green light or to red light.[76] This process of "complementary chromatic adaptation" is a way for the cells to maximize the use of available light for photosynthesis.
A few genera lack phycobilisomes and have chlorophyll b instead (Prochloron, Prochlorococcus, Prochlorothrix). These were originally grouped together as the prochlorophytes or chloroxybacteria, but appear to have developed in several different lines of cyanobacteria. For this reason, they are now considered as part of the cyanobacterial group.[77][78]
Metabolism
[edit]In general, photosynthesis in cyanobacteria uses water as an electron donor and produces oxygen as a byproduct, though some may also use hydrogen sulfide[79] a process which occurs among other photosynthetic bacteria such as the purple sulfur bacteria.
Carbon dioxide is reduced to form carbohydrates via the Calvin cycle.[80] The large amounts of oxygen in the atmosphere are considered to have been first created by the activities of ancient cyanobacteria.[81] They are often found as symbionts with a number of other groups of organisms such as fungi (lichens), corals, pteridophytes (Azolla), angiosperms (Gunnera), etc.[82] The carbon metabolism of cyanobacteria include the incomplete Krebs cycle,[83] the pentose phosphate pathway, and glycolysis.[84]
There are some groups capable of heterotrophic growth,[85] while others are parasitic, causing diseases in invertebrates or algae (e.g., the black band disease).[86][87][88]
Ecology
[edit]
Cyanobacteria can be found in almost every terrestrial and aquatic habitat – oceans, fresh water, damp soil, temporarily moistened rocks in deserts, bare rock and soil, and even Antarctic rocks. They can occur as planktonic cells or form phototrophic biofilms. They are found inside stones and shells (in endolithic ecosystems).[90] A few are endosymbionts in lichens, plants, various protists, or sponges and provide energy for the host. Some live in the fur of sloths, providing a form of camouflage.[91]
Aquatic cyanobacteria are known for their extensive and highly visible blooms that can form in both freshwater and marine environments. The blooms can have the appearance of blue-green paint or scum. These blooms can be toxic, and frequently lead to the closure of recreational waters when spotted. Marine bacteriophages are significant parasites of unicellular marine cyanobacteria.[92]
Cyanobacterial growth is favoured in ponds and lakes where waters are calm and have little turbulent mixing.[93] Their lifecycles are disrupted when the water naturally or artificially mixes from churning currents caused by the flowing water of streams or the churning water of fountains. For this reason blooms of cyanobacteria seldom occur in rivers unless the water is flowing slowly. Growth is also favoured at higher temperatures which enable Microcystis species to outcompete diatoms and green algae, and potentially allow development of toxins.[93]
Based on environmental trends, models and observations suggest cyanobacteria will likely increase their dominance in aquatic environments. This can lead to serious consequences, particularly the contamination of sources of drinking water. Researchers including Linda Lawton at Robert Gordon University, have developed techniques to study these.[94] Cyanobacteria can interfere with water treatment in various ways, primarily by plugging filters (often large beds of sand and similar media) and by producing cyanotoxins, which have the potential to cause serious illness if consumed. Consequences may also lie within fisheries and waste management practices. Anthropogenic eutrophication, rising temperatures, vertical stratification and increased atmospheric carbon dioxide are contributors to cyanobacteria increasing dominance of aquatic ecosystems.[95]

Cyanobacteria have been found to play an important role in terrestrial habitats and organism communities. It has been widely reported that cyanobacteria soil crusts help to stabilize soil to prevent erosion and retain water.[96] An example of a cyanobacterial species that does so is Microcoleus vaginatus. M. vaginatus stabilizes soil using a polysaccharide sheath that binds to sand particles and absorbs water.[97] M. vaginatus also makes a significant contribution to the cohesion of biological soil crust.[98]
Some of these organisms contribute significantly to global ecology and the oxygen cycle. The tiny marine cyanobacterium Prochlorococcus was discovered in 1986 and accounts for more than half of the photosynthesis of the open ocean.[99] Circadian rhythms were once thought to only exist in eukaryotic cells but many cyanobacteria display a bacterial circadian rhythm.
"Cyanobacteria are arguably the most successful group of microorganisms on earth. They are the most genetically diverse; they occupy a broad range of habitats across all latitudes, widespread in freshwater, marine, and terrestrial ecosystems, and they are found in the most extreme niches such as hot springs, salt works, and hypersaline bays. Photoautotrophic, oxygen-producing cyanobacteria created the conditions in the planet's early atmosphere that directed the evolution of aerobic metabolism and eukaryotic photosynthesis. Cyanobacteria fulfill vital ecological functions in the world's oceans, being important contributors to global carbon and nitrogen budgets." – Stewart and Falconer[100]
Cyanobionts
[edit]
Leaf and root colonization by cyanobacteria
(2) On the root surface, cyanobacteria exhibit two types of colonization pattern; in the root hair, filaments of Anabaena and Nostoc species form loose colonies, and in the restricted zone on the root surface, specific Nostoc species form cyanobacterial colonies.
(3) Co-inoculation with 2,4-D and Nostoc spp. increases para-nodule formation and nitrogen fixation. A large number of Nostoc spp. isolates colonize the root endosphere and form para-nodules.[101]
Some cyanobacteria, the so-called cyanobionts (cyanobacterial symbionts), have a symbiotic relationship with other organisms, both unicellular and multicellular.[102] As illustrated on the right, there are many examples of cyanobacteria interacting symbiotically with land plants.[103][104][105][106] Cyanobacteria can enter the plant through the stomata and colonize the intercellular space, forming loops and intracellular coils.[107] Anabaena spp. colonize the roots of wheat and cotton plants.[108][109][110] Calothrix sp. has also been found on the root system of wheat.[109][110] Monocots, such as wheat and rice, have been colonised by Nostoc spp.,[111][112][113][114] In 1991, Ganther and others isolated diverse heterocystous nitrogen-fixing cyanobacteria, including Nostoc, Anabaena and Cylindrospermum, from plant root and soil. Assessment of wheat seedling roots revealed two types of association patterns: loose colonization of root hair by Anabaena and tight colonization of the root surface within a restricted zone by Nostoc.[111][101]

(a) O. magnificus with numerous cyanobionts present in the upper and lower girdle lists (black arrowheads) of the cingulum termed the symbiotic chamber.
(b) O. steinii with numerous cyanobionts inhabiting the symbiotic chamber.
(c) Enlargement of the area in (b) showing two cyanobionts that are being divided by binary transverse fission (white arrows).

The relationships between cyanobionts (cyanobacterial symbionts) and protistan hosts are particularly noteworthy, as some nitrogen-fixing cyanobacteria (diazotrophs) play an important role in primary production, especially in nitrogen-limited oligotrophic oceans.[115][116][117] Cyanobacteria, mostly pico-sized Synechococcus and Prochlorococcus, are ubiquitously distributed and are the most abundant photosynthetic organisms on Earth, accounting for a quarter of all carbon fixed in marine ecosystems.[39][118][46] In contrast to free-living marine cyanobacteria, some cyanobionts are known to be responsible for nitrogen fixation rather than carbon fixation in the host.[119][120] However, the physiological functions of most cyanobionts remain unknown. Cyanobionts have been found in numerous protist groups, including dinoflagellates, tintinnids, radiolarians, amoebae, diatoms, and haptophytes.[121][122] Among these cyanobionts, little is known regarding the nature (e.g., genetic diversity, host or cyanobiont specificity, and cyanobiont seasonality) of the symbiosis involved, particularly in relation to dinoflagellate host.[102]
Collective behaviour
[edit]
Some cyanobacteria – even single-celled ones – show striking collective behaviours and form colonies (or blooms) that can float on water and have important ecological roles. For instance, billions of years ago, communities of marine Paleoproterozoic cyanobacteria could have helped create the biosphere as we know it by burying carbon compounds and allowing the initial build-up of oxygen in the atmosphere.[124] On the other hand, toxic cyanobacterial blooms are an increasing issue for society, as their toxins can be harmful to animals.[32] Extreme blooms can also deplete water of oxygen and reduce the penetration of sunlight and visibility, thereby compromising the feeding and mating behaviour of light-reliant species.[123]
As shown in the diagram on the right, bacteria can stay in suspension as individual cells, adhere collectively to surfaces to form biofilms, passively sediment, or flocculate to form suspended aggregates. Cyanobacteria are able to produce sulphated polysaccharides (yellow haze surrounding clumps of cells) that enable them to form floating aggregates. In 2021, Maeda et al. discovered that oxygen produced by cyanobacteria becomes trapped in the network of polysaccharides and cells, enabling the microorganisms to form buoyant blooms.[125] It is thought that specific protein fibres known as pili (represented as lines radiating from the cells) may act as an additional way to link cells to each other or onto surfaces. Some cyanobacteria also use sophisticated intracellular gas vesicles as floatation aids.[123]


The diagram on the left above shows a proposed model of microbial distribution, spatial organization, carbon and O2 cycling in clumps and adjacent areas. (a) Clumps contain denser cyanobacterial filaments and heterotrophic microbes. The initial differences in density depend on cyanobacterial motility and can be established over short timescales. Darker blue color outside of the clump indicates higher oxygen concentrations in areas adjacent to clumps. Oxic media increase the reversal frequencies of any filaments that begin to leave the clumps, thereby reducing the net migration away from the clump. This enables the persistence of the initial clumps over short timescales; (b) Spatial coupling between photosynthesis and respiration in clumps. Oxygen produced by cyanobacteria diffuses into the overlying medium or is used for aerobic respiration. Dissolved inorganic carbon (DIC) diffuses into the clump from the overlying medium and is also produced within the clump by respiration. In oxic solutions, high O2 concentrations reduce the efficiency of CO2 fixation and result in the excretion of glycolate. Under these conditions, clumping can be beneficial to cyanobacteria if it stimulates the retention of carbon and the assimilation of inorganic carbon by cyanobacteria within clumps. This effect appears to promote the accumulation of particulate organic carbon (cells, sheaths and heterotrophic organisms) in clumps.[126]
It has been unclear why and how cyanobacteria form communities. Aggregation must divert resources away from the core business of making more cyanobacteria, as it generally involves the production of copious quantities of extracellular material. In addition, cells in the centre of dense aggregates can also suffer from both shading and shortage of nutrients.[127][128] So, what advantage does this communal life bring for cyanobacteria?[123]

New insights into how cyanobacteria form blooms have come from a 2021 study on the cyanobacterium Synechocystis. These use a set of genes that regulate the production and export of sulphated polysaccharides, chains of sugar molecules modified with sulphate groups that can often be found in marine algae and animal tissue. Many bacteria generate extracellular polysaccharides, but sulphated ones have only been seen in cyanobacteria. In Synechocystis these sulphated polysaccharide help the cyanobacterium form buoyant aggregates by trapping oxygen bubbles in the slimy web of cells and polysaccharides.[125][123]
Previous studies on Synechocystis have shown type IV pili, which decorate the surface of cyanobacteria, also play a role in forming blooms.[130][127] These retractable and adhesive protein fibres are important for motility, adhesion to substrates and DNA uptake.[131] The formation of blooms may require both type IV pili and Synechan – for example, the pili may help to export the polysaccharide outside the cell. Indeed, the activity of these protein fibres may be connected to the production of extracellular polysaccharides in filamentous cyanobacteria.[132] A more obvious answer would be that pili help to build the aggregates by binding the cells with each other or with the extracellular polysaccharide. As with other kinds of bacteria,[133] certain components of the pili may allow cyanobacteria from the same species to recognise each other and make initial contacts, which are then stabilised by building a mass of extracellular polysaccharide.[123]
The bubble flotation mechanism identified by Maeda et al. joins a range of known strategies that enable cyanobacteria to control their buoyancy, such as using gas vesicles or accumulating carbohydrate ballasts.[134] Type IV pili on their own could also control the position of marine cyanobacteria in the water column by regulating viscous drag.[135] Extracellular polysaccharide appears to be a multipurpose asset for cyanobacteria, from floatation device to food storage, defence mechanism and mobility aid.[132][123]
Cellular death
[edit]
One of the most critical processes determining cyanobacterial eco-physiology is cellular death. Evidence supports the existence of controlled cellular demise in cyanobacteria, and various forms of cell death have been described as a response to biotic and abiotic stresses. However, cell death research in cyanobacteria is a relatively young field and understanding of the underlying mechanisms and molecular machinery underpinning this fundamental process remains largely elusive.[25] However, reports on cell death of marine and freshwater cyanobacteria indicate this process has major implications for the ecology of microbial communities/[137][138][139][140] Different forms of cell demise have been observed in cyanobacteria under several stressful conditions,[141][142] and cell death has been suggested to play a key role in developmental processes, such as akinete and heterocyst differentiation, as well as strategy for population survival.[136][143][144][48][25]
Cyanophages
[edit]Cyanophages are viruses that infect cyanobacteria. Cyanophages can be found in both freshwater and marine environments.[145] Marine and freshwater cyanophages have icosahedral heads, which contain double-stranded DNA, attached to a tail by connector proteins.[146] The size of the head and tail vary among species of cyanophages. Cyanophages, like other bacteriophages, rely on Brownian motion to collide with bacteria, and then use receptor binding proteins to recognize cell surface proteins, which leads to adherence. Viruses with contractile tails then rely on receptors found on their tails to recognize highly conserved proteins on the surface of the host cell.[147]
Cyanophages infect a wide range of cyanobacteria and are key regulators of the cyanobacterial populations in aquatic environments, and may aid in the prevention of cyanobacterial blooms in freshwater and marine ecosystems. These blooms can pose a danger to humans and other animals, particularly in eutrophic freshwater lakes. Infection by these viruses is highly prevalent in cells belonging to Synechococcus spp. in marine environments, where up to 5% of cells belonging to marine cyanobacterial cells have been reported to contain mature phage particles.[148]
The first cyanophage, LPP-1, was discovered in 1963.[149] Cyanophages are classified within the bacteriophage families Myoviridae (e.g. AS-1, N-1), Podoviridae (e.g. LPP-1) and Siphoviridae (e.g. S-1).[149]
Movement
[edit]
It has long been known that filamentous cyanobacteria perform surface motions, and that these movements result from type IV pili.[150][132][151] Additionally, Synechococcus, a marine cyanobacteria, is known to swim at a speed of 25 μm/s by a mechanism different to that of bacterial flagella.[152] Formation of waves on the cyanobacteria surface is thought to push surrounding water backwards.[153][154] Cells are known to be motile by a gliding method[155] and a novel uncharacterized, non-phototactic swimming method[156] that does not involve flagellar motion.
Many species of cyanobacteria are capable of gliding. Gliding is a form of cell movement that differs from crawling or swimming in that it does not rely on any obvious external organ or change in cell shape and it occurs only in the presence of a substrate.[157][158] Gliding in filamentous cyanobacteria appears to be powered by a "slime jet" mechanism, in which the cells extrude a gel that expands quickly as it hydrates providing a propulsion force,[159][160] although some unicellular cyanobacteria use type IV pili for gliding.[161][22]
Cyanobacteria have strict light requirements. Too little light can result in insufficient energy production, and in some species may cause the cells to resort to heterotrophic respiration.[21] Too much light can inhibit the cells, decrease photosynthesis efficiency and cause damage by bleaching. UV radiation is especially deadly for cyanobacteria, with normal solar levels being significantly detrimental for these microorganisms in some cases.[20][162][22]
Filamentous cyanobacteria that live in microbial mats often migrate vertically and horizontally within the mat in order to find an optimal niche that balances their light requirements for photosynthesis against their sensitivity to photodamage. For example, the filamentous cyanobacteria Oscillatoria sp. and Spirulina subsalsa found in the hypersaline benthic mats of Guerrero Negro, Mexico migrate downwards into the lower layers during the day in order to escape the intense sunlight and then rise to the surface at dusk.[163] In contrast, the population of Microcoleus chthonoplastes found in hypersaline mats in Camargue, France migrate to the upper layer of the mat during the day and are spread homogeneously through the mat at night.[164] An in vitro experiment using Phormidium uncinatum also demonstrated this species' tendency to migrate in order to avoid damaging radiation.[20][162] These migrations are usually the result of some sort of photomovement, although other forms of taxis can also play a role.[165][22]
Photomovement – the modulation of cell movement as a function of the incident light – is employed by the cyanobacteria as a means to find optimal light conditions in their environment. There are three types of photomovement: photokinesis, phototaxis and photophobic responses.[166][167][168][22]
Photokinetic microorganisms modulate their gliding speed according to the incident light intensity. For example, the speed with which Phormidium autumnale glides increases linearly with the incident light intensity.[169][22]
Phototactic microorganisms move according to the direction of the light within the environment, such that positively phototactic species will tend to move roughly parallel to the light and towards the light source. Species such as Phormidium uncinatum cannot steer directly towards the light, but rely on random collisions to orient themselves in the right direction, after which they tend to move more towards the light source. Others, such as Anabaena variabilis, can steer by bending the trichome.[170][22]
Finally, photophobic microorganisms respond to spatial and temporal light gradients. A step-up photophobic reaction occurs when an organism enters a brighter area field from a darker one and then reverses direction, thus avoiding the bright light. The opposite reaction, called a step-down reaction, occurs when an organism enters a dark area from a bright area and then reverses direction, thus remaining in the light.[22]
Evolution
[edit]Earth history
[edit]−4500 — – — – −4000 — – — – −3500 — – — – −3000 — – — – −2500 — – — – −2000 — – — – −1500 — – — – −1000 — – — – −500 — – — – 0 — |
| |||||||||||||||||||||||||||||||||||||||||||||
Stromatolites are layered biochemical accretionary structures formed in shallow water by the trapping, binding, and cementation of sedimentary grains by biofilms (microbial mats) of microorganisms, especially cyanobacteria.[171]
During the Precambrian, stromatolite communities of microorganisms grew in most marine and non-marine environments in the photic zone. After the Cambrian explosion of marine animals, grazing on the stromatolite mats by herbivores greatly reduced the occurrence of the stromatolites in marine environments. Since then, they are found mostly in hypersaline conditions where grazing invertebrates cannot live (e.g. Shark Bay, Western Australia). Stromatolites provide ancient records of life on Earth by fossil remains which date from 3.5 Ga ago.[172] The oldest undisputed evidence of cyanobacteria is dated to be 2.1 Ga ago, but there is some evidence for them as far back as 2.7 Ga ago.[27] Cyanobacteria might have also emerged 3.5 Ga ago.[173] Oxygen concentrations in the atmosphere remained around or below 0.001% of today's level until 2.4 Ga ago (the Great Oxygenation Event).[174] The rise in oxygen may have caused a fall in the concentration of atmospheric methane, and triggered the Huronian glaciation from around 2.4 to 2.1 Ga ago. In this way, cyanobacteria may have killed off most of the other bacteria of the time.[175]
Oncolites are sedimentary structures composed of oncoids, which are layered structures formed by cyanobacterial growth. Oncolites are similar to stromatolites, but instead of forming columns, they form approximately spherical structures that were not attached to the underlying substrate as they formed.[176] The oncoids often form around a central nucleus, such as a shell fragment,[177] and a calcium carbonate structure is deposited by encrusting microbes. Oncolites are indicators of warm waters in the photic zone, but are also known in contemporary freshwater environments.[178] These structures rarely exceed 10 cm in diameter.
One former classification scheme of cyanobacterial fossils divided them into the porostromata and the spongiostromata. These are now recognized as form taxa and considered taxonomically obsolete; however, some authors have advocated for the terms remaining informally to describe form and structure of bacterial fossils.[179]
-
Stromatolites left behind by cyanobacteria are the oldest known fossils of life on Earth. This fossil is one billion years old.
-
Oncolitic limestone formed from successive layers of calcium carbonate precipitated by cyanobacteria
-
Cyanobacterial remains of an annulated tubular microfossil Oscillatoriopsis longa [180]
Scale bar: 100 μm
Origin of photosynthesis
[edit]Oxygenic photosynthesis only evolved once (in prokaryotic cyanobacteria), and all photosynthetic eukaryotes (including all plants and algae) have acquired this ability from endosymbiosis with cyanobacteria or their endosymbiont hosts. In other words, all the oxygen that makes the atmosphere breathable for aerobic organisms originally comes from cyanobacteria or their plastid descendants.[181]
Cyanobacteria remained the principal primary producers throughout the latter half of the Archean eon and most of the Proterozoic eon, in part because the redox structure of the oceans favored photoautotrophs capable of nitrogen fixation. However, their population is argued to have varied considerably across this eon.[10][182][183] Archaeplastids such as green and red algae eventually surpassed cyanobacteria as major primary producers on continental shelves near the end of the Neoproterozoic, but only with the Mesozoic (251–65 Ma) radiations of secondary photoautotrophs such as dinoflagellates, coccolithophorids and diatoms did primary production in marine shelf waters take modern form. Cyanobacteria remain critical to marine ecosystems as primary producers in oceanic gyres, as agents of biological nitrogen fixation, and, in modified form, as the plastids of marine algae.[184]
Origin of chloroplasts
[edit]Primary chloroplasts are cell organelles found in some eukaryotic lineages, where they are specialized in performing photosynthesis. They are considered to have evolved from endosymbiotic cyanobacteria.[185][186] After some years of debate,[187] it is now generally accepted that the three major groups of primary endosymbiotic eukaryotes (i.e. green plants, red algae and glaucophytes) form one large monophyletic group called Archaeplastida, which evolved after one unique endosymbiotic event.[188][189][190][191]
The morphological similarity between chloroplasts and cyanobacteria was first reported by German botanist Andreas Franz Wilhelm Schimper in the 19th century[192] Chloroplasts are only found in plants and algae,[193] thus paving the way for Russian biologist Konstantin Mereschkowski to suggest in 1905 the symbiogenic origin of the plastid.[194] Lynn Margulis brought this hypothesis back to attention more than 60 years later[195] but the idea did not become fully accepted until supplementary data started to accumulate. The cyanobacterial origin of plastids is now supported by various pieces of phylogenetic,[196][188][191] genomic,[197] biochemical[198][199] and structural evidence.[200] The description of another independent and more recent primary endosymbiosis event between a cyanobacterium and a separate eukaryote lineage (the rhizarian Paulinella chromatophora) also gives credibility to the endosymbiotic origin of the plastids.[201]
In addition to this primary endosymbiosis, many eukaryotic lineages have been subject to secondary or even tertiary endosymbiotic events, that is the "Matryoshka-like" engulfment by a eukaryote of another plastid-bearing eukaryote.[203][185]
Chloroplasts have many similarities with cyanobacteria, including a circular chromosome, prokaryotic-type ribosomes, and similar proteins in the photosynthetic reaction center.[204][205] The endosymbiotic theory suggests that photosynthetic bacteria were acquired (by endocytosis) by early eukaryotic cells to form the first plant cells. Therefore, chloroplasts may be photosynthetic bacteria that adapted to life inside plant cells. Like mitochondria, chloroplasts still possess their own DNA, separate from the nuclear DNA of their plant host cells and the genes in this chloroplast DNA resemble those in cyanobacteria.[206] DNA in chloroplasts codes for redox proteins such as photosynthetic reaction centers. The CoRR hypothesis proposes this co-location is required for redox regulation.
Marine origins
[edit]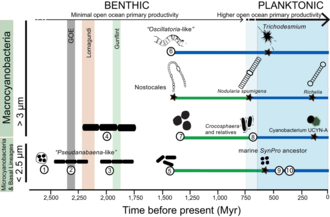
| Part of a series on |
| Plankton |
|---|
 |
Cyanobacteria have fundamentally transformed the geochemistry of the planet.[210][207] Multiple lines of geochemical evidence support the occurrence of intervals of profound global environmental change at the beginning and end of the Proterozoic (2,500–542 Mya).[211] [212][213] While it is widely accepted that the presence of molecular oxygen in the early fossil record was the result of cyanobacteria activity, little is known about how cyanobacteria evolution (e.g., habitat preference) may have contributed to changes in biogeochemical cycles through Earth history. Geochemical evidence has indicated that there was a first step-increase in the oxygenation of the Earth's surface, which is known as the Great Oxidation Event (GOE), in the early Paleoproterozoic (2,500–1,600 Mya).[210][207] A second but much steeper increase in oxygen levels, known as the Neoproterozoic Oxygenation Event (NOE),[212][81][214] occurred at around 800 to 500 Mya.[213][215] Recent chromium isotope data point to low levels of atmospheric oxygen in the Earth's surface during the mid-Proterozoic,[211] which is consistent with the late evolution of marine planktonic cyanobacteria during the Cryogenian;[216] both types of evidence help explain the late emergence and diversification of animals.[217][43]
Understanding the evolution of planktonic cyanobacteria is important because their origin fundamentally transformed the nitrogen and carbon cycles towards the end of the Pre-Cambrian.[215] It remains unclear, however, what evolutionary events led to the emergence of open-ocean planktonic forms within cyanobacteria and how these events relate to geochemical evidence during the Pre-Cambrian.[212] So far, it seems that ocean geochemistry (e.g., euxinic conditions during the early- to mid-Proterozoic)[212][214][218] and nutrient availability [219] likely contributed to the apparent delay in diversification and widespread colonization of open ocean environments by planktonic cyanobacteria during the Neoproterozoic.[215][43]
Genetics
[edit]Cyanobacteria are capable of natural genetic transformation.[220][221][222] Natural genetic transformation is the genetic alteration of a cell resulting from the direct uptake and incorporation of exogenous DNA from its surroundings. For bacterial transformation to take place, the recipient bacteria must be in a state of competence, which may occur in nature as a response to conditions such as starvation, high cell density or exposure to DNA damaging agents. In chromosomal transformation, homologous transforming DNA can be integrated into the recipient genome by homologous recombination, and this process appears to be an adaptation for repairing DNA damage.[223]
DNA repair
[edit]Cyanobacteria are challenged by environmental stresses and internally generated reactive oxygen species that cause DNA damage. Cyanobacteria possess numerous E. coli-like DNA repair genes.[224] Several DNA repair genes are highly conserved in cyanobacteria, even in small genomes, suggesting that core DNA repair processes such as recombinational repair, nucleotide excision repair and methyl-directed DNA mismatch repair are common among cyanobacteria.[224]
Classification
[edit]Phylogeny
[edit]| 16S rRNA based LTP_12_2021[225][226][227] | GTDB 08-RS214 by Genome Taxonomy Database[228][229][230] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|
Taxonomy
[edit]
Historically, bacteria were first classified as plants constituting the class Schizomycetes, which along with the Schizophyceae (blue-green algae/Cyanobacteria) formed the phylum Schizophyta,[231] then in the phylum Monera in the kingdom Protista by Haeckel in 1866, comprising Protogens, Protamaeba, Vampyrella, Protomonae, and Vibrio, but not Nostoc and other cyanobacteria, which were classified with algae,[232] later reclassified as the Prokaryotes by Chatton.[233]
The cyanobacteria were traditionally classified by morphology into five sections, referred to by the numerals I–V. The first three – Chroococcales, Pleurocapsales, and Oscillatoriales – are not supported by phylogenetic studies. The latter two – Nostocales and Stigonematales – are monophyletic as a unit, and make up the heterocystous cyanobacteria.[234][235]
The members of Chroococales are unicellular and usually aggregate in colonies. The classic taxonomic criterion has been the cell morphology and the plane of cell division. In Pleurocapsales, the cells have the ability to form internal spores (baeocytes). The rest of the sections include filamentous species. In Oscillatoriales, the cells are uniseriately arranged and do not form specialized cells (akinetes and heterocysts).[236] In Nostocales and Stigonematales, the cells have the ability to develop heterocysts in certain conditions. Stigonematales, unlike Nostocales, include species with truly branched trichomes.[234]
Most taxa included in the phylum or division Cyanobacteria have not yet been validly published under The International Code of Nomenclature of Prokaryotes (ICNP) except:
- The classes Chroobacteria, Hormogoneae, and Gloeobacteria
- The orders Chroococcales, Gloeobacterales, Nostocales, Oscillatoriales, Pleurocapsales, and Stigonematales
- The families Prochloraceae and Prochlorotrichaceae
- The genera Halospirulina, Planktothricoides, Prochlorococcus, Prochloron, and Prochlorothrix
The remainder are validly published under the International Code of Nomenclature for algae, fungi, and plants.
Formerly, some bacteria, like Beggiatoa, were thought to be colorless Cyanobacteria.[237]
The currently accepted taxonomy is based on the List of Prokaryotic names with Standing in Nomenclature (LPSN)[238] and National Center for Biotechnology Information (NCBI).[239] Class "Cyanobacteriia"
- Subclass "Gloeobacteria" Cavalier-Smith 2002
- Gloeobacterales Cavalier-Smith 2002
- Subclass "Phycobacteria" Cavalier-Smith 2002
- Acaryochloridales Miyashita et al. 2003 ex Strunecký & Mareš 2022 [incl. Thermosynechococcales]
- Aegeococcales Strunecký & Mareš 2022
- "Elainellales"
- "Eurycoccales"
- Geitlerinematales Strunecký & Mareš 2022
- Gloeoemargaritales Moreira et al. 2016
- "Leptolyngbyales" Strunecký & Mareš 2022
- Nodosilineales Strunecký & Mareš 2022
- Oculatellales Strunecký & Mareš 2022
- "Phormidesmiales"
- Prochlorococcaceae Komárek & Strunecky 2020 {"PCC-6307"}
- Pseudanabaenales Hoffmann, Komárek & Kastovsky 2005
- "Pseudophormidiales"
- Thermostichales Komárek & Strunecký 2020
- Synechococcophycidae Hoffmann, Komárek & Kastovsky 2005
- "Limnotrichales"
- Prochlorotrichales Strunecký & Mareš 2022 (PCC-9006)
- Synechococcales Hoffmann, Komárek & Kastovsky 2005
- Nostocophycidae Hoffmann, Komárek & Kastovsky 2005
- Cyanobacteriales Rippka & Cohen-Bazire 1983 (Chamaesiphonales, Chroococcales, Chroococcidiopsidales, Nostocales, Oscillatoriales, Pleurocapsales, Spirulinales, Stigonematales)
Relation to humans
[edit]Biotechnology
[edit]
The unicellular cyanobacterium Synechocystis sp. PCC6803 was the third prokaryote and first photosynthetic organism whose genome was completely sequenced.[240] It continues to be an important model organism.[241] Cyanothece ATCC 51142 is an important diazotrophic model organism. The smallest genomes have been found in Prochlorococcus spp. (1.7 Mb)[242][243] and the largest in Nostoc punctiforme (9 Mb).[144] Those of Calothrix spp. are estimated at 12–15 Mb,[244] as large as yeast.
Recent research has suggested the potential application of cyanobacteria to the generation of renewable energy by directly converting sunlight into electricity. Internal photosynthetic pathways can be coupled to chemical mediators that transfer electrons to external electrodes.[245][246] In the shorter term, efforts are underway to commercialize algae-based fuels such as diesel, gasoline, and jet fuel.[68][247][248] Cyanobacteria have been also engineered to produce ethanol[249] and experiments have shown that when one or two CBB genes are being over expressed, the yield can be even higher.[250][251]
Cyanobacteria may possess the ability to produce substances that could one day serve as anti-inflammatory agents and combat bacterial infections in humans.[252] Cyanobacteria's photosynthetic output of sugar and oxygen has been demonstrated to have therapeutic value in rats with heart attacks.[253] While cyanobacteria can naturally produce various secondary metabolites, they can serve as advantageous hosts for plant-derived metabolites production owing to biotechnological advances in systems biology and synthetic biology.[254]
Spirulina's extracted blue color is used as a natural food coloring.[255]
Researchers from several space agencies argue that cyanobacteria could be used for producing goods for human consumption in future crewed outposts on Mars, by transforming materials available on this planet.[256]
Human nutrition
[edit]
Some cyanobacteria are sold as food, notably Arthrospira platensis (Spirulina) and others (Aphanizomenon flos-aquae).[257]
Some microalgae contain substances of high biological value, such as polyunsaturated fatty acids, amino acids, proteins, pigments, antioxidants, vitamins, and minerals.[258] Edible blue-green algae reduce the production of pro-inflammatory cytokines by inhibiting NF-κB pathway in macrophages and splenocytes.[259] Sulfate polysaccharides exhibit immunomodulatory, antitumor, antithrombotic, anticoagulant, anti-mutagenic, anti-inflammatory, antimicrobial, and even antiviral activity against HIV, herpes, and hepatitis.[260]
Health risks
[edit]Some cyanobacteria can produce neurotoxins, cytotoxins, endotoxins, and hepatotoxins (e.g., the microcystin-producing bacteria genus microcystis), which are collectively known as cyanotoxins.
Specific toxins include anatoxin-a, guanitoxin, aplysiatoxin, cyanopeptolin, cylindrospermopsin, domoic acid, nodularin R (from Nodularia), neosaxitoxin, and saxitoxin. Cyanobacteria reproduce explosively under certain conditions. This results in algal blooms which can become harmful to other species and pose a danger to humans and animals if the cyanobacteria involved produce toxins. Several cases of human poisoning have been documented, but a lack of knowledge prevents an accurate assessment of the risks,[261][262][263][264] and research by Linda Lawton, FRSE at Robert Gordon University, Aberdeen and collaborators has 30 years of examining the phenomenon and methods of improving water safety.[265]
Recent studies suggest that significant exposure to high levels of cyanobacteria producing toxins such as BMAA can cause amyotrophic lateral sclerosis (ALS). People living within half a mile of cyanobacterially contaminated lakes have had a 2.3 times greater risk of developing ALS than the rest of the population; people around New Hampshire's Lake Mascoma had an up to 25 times greater risk of ALS than the expected incidence.[266] BMAA from desert crusts found throughout Qatar might have contributed to higher rates of ALS in Gulf War veterans.[262][267]
Chemical control
[edit]Several chemicals can eliminate cyanobacterial blooms from smaller water-based systems such as swimming pools. They include calcium hypochlorite, copper sulphate, Cupricide (chelated copper), and simazine.[268] The calcium hypochlorite amount needed varies depending on the cyanobacteria bloom, and treatment is needed periodically. According to the Department of Agriculture Australia, a rate of 12 g of 70% material in 1000 L of water is often effective to treat a bloom.[268] Copper sulfate is also used commonly, but no longer recommended by the Australian Department of Agriculture, as it kills livestock, crustaceans, and fish.[268] Cupricide is a chelated copper product that eliminates blooms with lower toxicity risks than copper sulfate. Dosage recommendations vary from 190 mL to 4.8 L per 1000 m2.[268] Ferric alum treatments at the rate of 50 mg/L will reduce algae blooms.[268][269] Simazine, which is also a herbicide, will continue to kill blooms for several days after an application. Simazine is marketed at different strengths (25, 50, and 90%), the recommended amount needed for one cubic meter of water per product is 25% product 8 mL; 50% product 4 mL; or 90% product 2.2 mL.[268]
Climate change
[edit]Climate change is likely to increase the frequency, intensity and duration of cyanobacterial blooms in many eutrophic lakes, reservoirs and estuaries.[270][32] Bloom-forming cyanobacteria produce a variety of neurotoxins, hepatotoxins and dermatoxins, which can be fatal to birds and mammals (including waterfowl, cattle and dogs) and threaten the use of waters for recreation, drinking water production, agricultural irrigation and fisheries.[32] Toxic cyanobacteria have caused major water quality problems, for example in Lake Taihu (China), Lake Erie (USA), Lake Okeechobee (USA), Lake Victoria (Africa) and the Baltic Sea.[32][271][272][273]
Climate change favours cyanobacterial blooms both directly and indirectly.[32] Many bloom-forming cyanobacteria can grow at relatively high temperatures.[274] Increased thermal stratification of lakes and reservoirs enables buoyant cyanobacteria to float upwards and form dense surface blooms, which gives them better access to light and hence a selective advantage over nonbuoyant phytoplankton organisms.[275][93] Protracted droughts during summer increase water residence times in reservoirs, rivers and estuaries, and these stagnant warm waters can provide ideal conditions for cyanobacterial bloom development.[276][273]
The capacity of the harmful cyanobacterial genus Microcystis to adapt to elevated CO2 levels was demonstrated in both laboratory and field experiments.[277] Microcystis spp. take up CO2 and HCO−
3 and accumulate inorganic carbon in carboxysomes, and strain competitiveness was found to depend on the concentration of inorganic carbon. As a result, climate change and increased CO2 levels are expected to affect the strain composition of cyanobacterial blooms.[277][273]
Gallery
[edit]-
Cyanobacteria activity turns Coatepeque Caldera lake a turquoise color
-
Cyanobacterial bloom near Fiji
-
Cyanobacteria in Lake Köyliö.
-
Video – Oscillatoria and Gleocapsa – with oscillatory movement as filaments of Oscillatoria orient towards light
See also
[edit]- Archean Eon
- Bacterial phyla, other major lineages of Bacteria
- Biodiesel
- Cyanobiont
- Endosymbiotic theory
- Geological history of oxygen
- Hypolith
Notes
[edit]- ^ Botanists restrict the name algae to protist eukaryotes, which does not extend to cyanobacteria, which are prokaryotes. However, the common name blue-green algae continues to be used synonymously with cyanobacteria outside of the biological sciences.
References
[edit]- ^ Silva PC, Moe RL (December 2019). "Cyanophyceae". AccessScience. McGraw Hill Education. doi:10.1036/1097-8542.175300. Retrieved 21 April 2011.
- ^ Oren A (September 2004). "A proposal for further integration of the cyanobacteria under the Bacteriological Code". International Journal of Systematic and Evolutionary Microbiology. 54 (Pt 5): 1895–1902. doi:10.1099/ijs.0.03008-0. PMID 15388760.
- ^ Komárek J, Kaštovský J, Mareš J, Johansen JR (2014). "Taxonomic classification of cyanoprokaryotes (cyanobacterial genera) 2014, using a polyphasic approach" (PDF). Preslia. 86: 295–335.
- ^ Sinha RP, Häder DP (2008). "UV-protectants in cyanobacteria". Plant Science. 174 (3): 278–289. Bibcode:2008PlnSc.174..278S. doi:10.1016/j.plantsci.2007.12.004.
- ^ Harper, Douglas. "cyan". Online Etymology Dictionary. Retrieved 21 January 2018.
- ^ κύανος. Liddell, Henry George; Scott, Robert; A Greek–English Lexicon at the Perseus Project.
- ^ "Life History and Ecology of Cyanobacteria". University of California Museum of Paleontology. Archived from the original on 19 September 2012. Retrieved 17 July 2012.
- ^ "Taxonomy Browser – Cyanobacteria". National Center for Biotechnology Information. NCBI:txid1117. Retrieved 12 April 2018.
- ^ Allaby M, ed. (1992). "Algae". The Concise Dictionary of Botany. Oxford: Oxford University Press.
- ^ Jump up to: a b Crockford PW, Bar On YM, Ward LM, Milo R, Halevy I (November 2023). "The geologic history of primary productivity". Current Biology. 33 (21): 4741–4750.e5. Bibcode:2023CBio...33E4741C. doi:10.1016/j.cub.2023.09.040. PMID 37827153. S2CID 263839383.
- ^ Stal LJ, Cretoiu MS (2016). The Marine Microbiome: An Untapped Source of Biodiversity and Biotechnological Potential. Springer Science+Business Media. ISBN 978-3319330006.
- ^ Whitton BA, ed. (2012). "The fossil record of cyanobacteria". Ecology of Cyanobacteria II: Their Diversity in Space and Time. Springer Science+Business Media. p. 17. ISBN 978-94-007-3855-3.
- ^ "Bacteria". Basic Biology. 18 March 2016.
- ^ Liberton M, Pakrasi HB (2008). "Chapter 10. Membrane Systems in Cyanobacteria". In Herrero A, Flore E (eds.). The Cyanobacteria: Molecular Biology, Genomics, and Evolution. Norwich, United Kingdom: Horizon Scientific Press. pp. 217–287. ISBN 978-1-904455-15-8.
- ^ Liberton M, Page LE, O'Dell WB, O'Neill H, Mamontov E, Urban VS, Pakrasi HB (February 2013). "Organization and flexibility of cyanobacterial thylakoid membranes examined by neutron scattering". The Journal of Biological Chemistry. 288 (5): 3632–3640. doi:10.1074/jbc.M112.416933. PMC 3561581. PMID 23255600.
- ^ Monchamp ME, Spaak P, Pomati F (27 July 2019). "Long Term Diversity and Distribution of Non-photosynthetic Cyanobacteria in Peri-Alpine Lakes". Frontiers in Microbiology. 9: 3344. doi:10.3389/fmicb.2018.03344. PMC 6340189. PMID 30692982.
- ^ Pathak J, Rajneesh, Maurya PK, Singh SP, Haeder DP, Sinha RP (2018). "Cyanobacterial Farming for Environment Friendly Sustainable Agriculture Practices: Innovations and Perspectives". Frontiers in Environmental Science. 6. doi:10.3389/fenvs.2018.00007. ISSN 2296-665X.
- ^ Morrison J (11 January 2016). "Living Bacteria Are Riding Earth's Air Currents". Smithsonian Magazine. Retrieved 10 August 2022.
- ^ Whitton BA, Potts M (2012). "Introduction to the Cyanobacteria". In Whitton BA (ed.). Ecology of Cyanobacteria II. pp. 1–13. doi:10.1007/978-94-007-3855-3_1. ISBN 978-94-007-3854-6.
- ^ Jump up to: a b c Tamulonis C, Postma M, Kaandorp J (2011). "Modeling filamentous cyanobacteria reveals the advantages of long and fast trichomes for optimizing light exposure". PLOS ONE. 6 (7): e22084. Bibcode:2011PLoSO...622084T. doi:10.1371/journal.pone.0022084. PMC 3138769. PMID 21789215.
- ^ Jump up to: a b Stay LJ (5 July 2012). "Cyanobacterial Mats and Stromatolites". In Whitton BA (ed.). Ecology of Cyanobacteria II: Their Diversity in Space and Time. Springer Science & Business Media. ISBN 9789400738553. Retrieved 15 February 2022 – via Google Books.
- ^ Jump up to: a b c d e f g h Tamulonis C, Postma M, Kaandorp J (2011). "Modeling filamentous cyanobacteria reveals the advantages of long and fast trichomes for optimizing light exposure". PLOS ONE. 6 (7): e22084. Bibcode:2011PLoSO...622084T. doi:10.1371/journal.pone.0022084. PMC 3138769. PMID 21789215.
 Material was copied from this source, which is available under a Creative Commons Attribution 4.0 International License.
Material was copied from this source, which is available under a Creative Commons Attribution 4.0 International License.
- ^ Weiss KR (30 July 2006). "A Primeval Tide of Toxins". Los Angeles Times. Archived from the original on 14 August 2006.
- ^ Dodds WK, Gudder DA, Mollenhauer D (1995). "The ecology of 'Nostoc'". Journal of Phycology. 31 (1): 2–18. Bibcode:1995JPcgy..31....2D. doi:10.1111/j.0022-3646.1995.00002.x. S2CID 85011483.
- ^ Jump up to: a b c d e f Aguilera A, Klemenčič M, Sueldo DJ, Rzymski P, Giannuzzi L, Martin MV (2021). "Cell Death in Cyanobacteria: Current Understanding and Recommendations for a Consensus on Its Nomenclature". Frontiers in Microbiology. 12: 631654. doi:10.3389/fmicb.2021.631654. PMC 7965980. PMID 33746925.
 Material was copied from this source, which is available under a Creative Commons Attribution 4.0 International License.
Material was copied from this source, which is available under a Creative Commons Attribution 4.0 International License.
- ^ Raven RA (5 July 2012). "Physiological Ecology: Carbon". In Whitton BA (ed.). Ecology of Cyanobacteria II: Their Diversity in Space and Time. Springer. p. 442. ISBN 9789400738553.
- ^ Jump up to: a b Schirrmeister BE, de Vos JM, Antonelli A, Bagheri HC (January 2013). "Evolution of multicellularity coincided with increased diversification of cyanobacteria and the Great Oxidation Event". Proceedings of the National Academy of Sciences of the United States of America. 110 (5): 1791–1796. Bibcode:2013PNAS..110.1791S. doi:10.1073/pnas.1209927110. PMC 3562814. PMID 23319632.
- ^ Bullerjahn GS, Post AF (2014). "Physiology and molecular biology of aquatic cyanobacteria". Frontiers in Microbiology. 5: 359. doi:10.3389/fmicb.2014.00359. PMC 4099938. PMID 25076944.
- ^ Tang W, Wang S, Fonseca-Batista D, Dehairs F, Gifford S, Gonzalez AG, et al. (February 2019). "Revisiting the distribution of oceanic N2 fixation and estimating diazotrophic contribution to marine production". Nature Communications. 10 (1): 831. doi:10.1038/s41467-019-08640-0. PMC 6381160. PMID 30783106.
- ^ Bláha L, Babica P, Maršálek B (June 2009). "Toxins produced in cyanobacterial water blooms - toxicity and risks". Interdisciplinary Toxicology. 2 (2): 36–41. doi:10.2478/v10102-009-0006-2. PMC 2984099. PMID 21217843.
- ^ Paerl HW, Otten TG (May 2013). "Harmful cyanobacterial blooms: causes, consequences, and controls". Microbial Ecology. 65 (4): 995–1010. Bibcode:2013MicEc..65..995P. doi:10.1007/s00248-012-0159-y. PMID 23314096. S2CID 5718333.
- ^ Jump up to: a b c d e f Huisman J, Codd GA, Paerl HW, Ibelings BW, Verspagen JM, Visser PM (August 2018). "Cyanobacterial blooms". Nature Reviews. Microbiology. 16 (8): 471–483. doi:10.1038/s41579-018-0040-1. PMID 29946124. S2CID 49427202.
- ^ Field CB, Behrenfeld MJ, Randerson JT, Falkowski P (июль 1998 г.). «Первичное производство биосферы: интеграция наземных и океанических компонентов» . Наука . 281 (5374): 237–240. Bibcode : 1998sci ... 281..237f . doi : 10.1126/science.281.5374.237 . PMID 9657713 .
- ^ Cabello-Yeves PJ, Scanlan DJ, Callieri C, Picazo A, Schallenberg L, Huber P, et al. (Октябрь 2022). «α-цианобактерии, обладающие формой, в глобальном масштабе, доминируют в водных местах обитания» . Журнал ISME . 16 (10). Springer Science and Business Media LLC: 2421–2432. Bibcode : 202222mej..16.2421c . doi : 10.1038/s41396-022-01282-z . PMC 9477826 . PMID 35851323 .
 Модифицированный текст был скопирован из этого источника, который доступен по международной лицензии Creative Commons Attribution 4.0 .
Модифицированный текст был скопирован из этого источника, который доступен по международной лицензии Creative Commons Attribution 4.0 .
- ^ Jump up to: а беременный Zehr JP (апрель 2011 г.). «Фиксация азота морскими цианобактериями». Тенденции в микробиологии . 19 (4): 162–173. doi : 10.1016/j.tim.2010.12.004 . PMID 21227699 .
- ^ Jump up to: а беременный Томпсон А.В., Фостер Р.А., Крупке А., Картер Б.Дж., Мусат Н., Ваулот Д. и др. (Сентябрь 2012 г.). «Симбиотик одноклеточного цианобактерии с одноклеточной эукариотической водорослей». Наука . 337 (6101): 1546–1550. Bibcode : 2012sci ... 337.1546t . doi : 10.1126/science.1222700 . PMID 22997339 . S2CID 7071725 .
- ^ Jump up to: а беременный Джонсон Зи, Зинсер ER, Coe A, McNulty NP, Woodward EM, Chisholm SW (март 2006 г.). «Нишевые распределения среди экотипов прохлорококка вдоль градиентов окружающей среды в масштабе океана». Наука . 311 (5768): 1737–1740. Bibcode : 2006sci ... 311.1737J . doi : 10.1126/science.1118052 . PMID 16556835 . S2CID 3549275 .
- ^ Jump up to: а беременный Scanlan DJ, Ostrowski M, Mazard S, Dufresne A, Garczarek L, Hess WR, et al. (Июнь 2009 г.). «Экологическая геномика морской пикоцианобактерии» . Микробиология и молекулярная биология обзоры . 73 (2): 249–299. doi : 10.1128/mmbr.00035-08 . PMC 2698417 . PMID 19487728 .
- ^ Jump up to: а беременный Блумбаум П., Галлегос Дж.Л., Гордилло Р.А., Ринкон Дж., Забала Л.Л., Цзяо Н. и др. (Июнь 2013 г.). «Нынешнее и будущее глобальное распределение морских Cyanbacteria prochlorococcus и Synechococcus » Труды Национальной академии наук Соединенных Штатов Америки 110 (24): 9824–9 Bibcode : 2013pnas..110.9 Doi : 10.1073/pnas.1307701110 . PMC 3683724 . PMID 23703908
- ^ Foster RA, Kuypers MM, Vagner T, Paerl RW, Musat N, Zehr JP (сентябрь 2011 г.). «Фиксация азота и перенос в диатоме-цианобактериальных симбиозах в открытом океане» . Журнал ISME . 5 (9): 1484–1493. Bibcode : 2011ismej ... 5.1484f . doi : 10.1038/ismej.2011.26 . PMC 3160684 . PMID 21451586 .
- ^ Villareal TA (1990). «Лабораторная культура и предварительная характеристика азотного фиксирующего ризозолении-ришелия симбиоза». Морская экология . 11 (2): 117–132. Bibcode : 1990marec..11..117v . doi : 10.1111/j.1439-0485.1990.tb00233.x .
- ^ Янсон С., Вутерс Дж., Бергман Б., Карпентер Э.Дж. (октябрь 1999). «Специфичность хозяина в симбиозе в Ришелеи-Диатом выявлена с помощью анализа последовательности генов HETR». Экологическая микробиология . 1 (5): 431–438. Bibcode : 1999envmi ... 1..431j . doi : 10.1046/j.1462-2920.1999.00053.x . PMID 11207763 .
- ^ Jump up to: а беременный в дюймовый и Sánchez-Baracaldo P (декабрь 2015 г.). «Происхождение морских планктонных цианобактерий» . Научные отчеты . 5 : 17418. Bibcode : 2015natsr ... 517418s . doi : 10.1038/srep17418 . PMC 4665016 . PMID 26621203 .
 Материал был скопирован из этого источника, который доступен по международной лицензии Creative Commons Attribution 4.0 .
Материал был скопирован из этого источника, который доступен по международной лицензии Creative Commons Attribution 4.0 .
- ^ Kettler GC, Martiny AC, Huang K, Zucker J, Coleman ML, Rodrigue S, et al. (Декабрь 2007 г.). «Паттерны и последствия увеличения генов и потери в эволюции прохлорококка» . PLOS Genetics . 3 (12): E231. doi : 10.1371/journal.pgen.0030231 . PMC 2151091 . PMID 18159947 .
- ^ Nemiroff R, Bonnell J, Eds. (27 сентября 2006 г.). "Земля из Сатурна" . Астрономия картина дня . НАСА .
- ^ Jump up to: а беременный Partensky F, Hess WR, Vaulot D (март 1999 г.). «Прохлорококк, морской фотосинтетический прокариот глобального значения» . Микробиология и молекулярная биология обзоры . 63 (1): 106–127. doi : 10.1128/mmbr.63.1.106-127.1999 . PMC 98958 . PMID 10066832 .
- ^ «Самый важный микроб, о котором вы никогда не слышали» . npr.org .
- ^ Jump up to: а беременный Claessen D, Rozen DE, Kuipers OP, Søgaard-Andersen L, Van Wezel GP (февраль 2014 г.). «Бактериальные решения для многоклеточности: рассказ о биопленках, филаментах и плодоносящих телах» (PDF) . Природные обзоры. Микробиология . 12 (2): 115–124. doi : 10.1038/nrmicro3178 . HDL : 11370/0DB66A9C-72EF-4E11-A75D-9D1E5827573D . PMID 24384602 . S2CID 20154495 .
- ^ Nürnberg DJ, Mariscal V, Parker J, Mastroianni G, Flores E, Mullineaux CW (март 2014 г.). «Разветвление и межклеточная связь в разделе V Cyanobacterium mastigocladus laminosus, сложный многоклеточный прокариот». Молекулярная микробиология . 91 (5): 935–949. doi : 10.1111/mmi.12506 . HDL : 10261/99110 . PMID 24383541 . S2CID 25479970 .
- ^ Herrero A, Stavans J, Flores E (ноябрь 2016 г.). «Многоклеточная природа нитевидных гетероцист цианобактерий». Обзоры микробиологии FEMS . 40 (6): 831–854. doi : 10.1093/femsre/fuw029 . HDL : 10261/140753 . PMID 28204529 .
- ^ Risser DD, Chew WG, Meeks JC (апрель 2014 г.). «Генетическая характеристика локуса HMP, хемотаксис-подобного кластера генов, которая регулирует развитие и подвижность гормогония в Punctoc Punctiforme» . Молекулярная микробиология . 92 (2): 222–233. doi : 10.1111/mmi.12552 . PMID 24533832 . S2CID 37479716 .
- ^ Khayatan B, Bains DK, Cheng MH, Cho YW, Huynh J, Kim R, et al. (Май 2017). «Предполагаемая o-связанная β- n -ацетилглюкозаминтрансфераза необходима для развития и подвижности гормогония в нитевидной цианобактерии nostoc punctiforme» . Журнал бактериологии . 199 (9): E00075–17. doi : 10.1128/jb.00075-17 . PMC 5388816 . PMID 28242721 .
- ^ Esteves-Ferreira AA, Cavalcanti JH, Vaz MG, Alvarenga LV, Nunes-Nesi A, Araújo WL (2017). «Цианобактериальные нитрогеназы: филогенетическое разнообразие, регуляция и функциональные прогнозы» . Генетика и молекулярная биология . 40 (1 Suppl 1): 261–275. doi : 10.1590/1678-4685-GMB-2016-0050 . PMC 5452144 . PMID 28323299 .
- ^ Meeks JC, Elhai J, Thiel T, Potts M, Larimer F, Lamerdin J, et al. (2001). «Обзор генома Nostoc Punctiforme, многоклеточного симбиотического цианобактериума». Фотосинтез исследования . 70 (1): 85–106. doi : 10.1023/a: 10138400255518 . PMID 16228364 . S2CID 8752382 .
- ^ Jump up to: а беременный Golden JW, Yoon HS (декабрь 1998 г.). «Формирование гетероцисты в Анабаене». Текущее мнение о микробиологии . 1 (6): 623–629. doi : 10.1016/s1369-5274 (98) 80106-9 . PMID 10066546 .
- ^ Jump up to: а беременный в Fay P (июнь 1992 г.). «Отношения кислорода азотной фиксации в цианобактериях» . Микробиологические обзоры . 56 (2): 340–373. doi : 10.1128/mmbr.56.2.340-373.1992 . PMC 372871 . PMID 1620069 .
- ^ Singh V, Pande PC, Jain Dk (Eds.). «Цианобактерии, актиномицеты, микоплазма и рикетции» . Учебная книга ботаники разнообразия микробов и криптогам . Публикации Растоги. п. 72. ISBN 978-8171338894 .
- ^ «Различия между бактериями и цианобактериями» . Микробиология Примечания . 29 октября 2015 года . Получено 21 января 2018 года .
- ^ Walsby AE (март 1994 г.). "Газовые везикулы" . Микробиологические обзоры . 58 (1): 94–144. doi : 10.1128/mmbr.58.1.94-144.1994 . PMC 372955 . PMID 8177173 .
- ^
Sims GK, Dunigan EP (1984). "Суточные и сезонные различия в активности нитрогеназы c
2 часа
2 Сокращение) рисовых корней ». Биология почвы и биохимия . 16 : 15–18. DOI : 10.1016/0038-0717 (84) 90118-4 . - ^ Bocchi S, Malgioglio A (2010). «Азолла-Анабана как биозернил для рисовых рисовых полей в долине По, территория риса в северной Италии» . Международный журнал агрономии . 2010 : 1–5. doi : 10.1155/2010/152158 . HDL : 2434/149583 .
- ^ Huokko T, Ni T, Dykes GF, Simpson DM, Brownridge P, Conradi FD, et al. (Июнь 2021 г.). «Исследование пути биогенеза и динамики тилакоидных мембран» . Природная связь . 12 (1): 3475. Bibcode : 2021natco..12.3475h . doi : 10.1038/s41467-021-23680-1 . PMC 8190092 . PMID 34108457 .
- ^ Kerfeld CA, Heinhorst S, Cannon GC (2010). «Бактериальные микрокомпментары» . Ежегодный обзор микробиологии . 64 (1): 391–408. doi : 10.1146/annurev.micro.112408.134211 . PMC 6022854 . PMID 20825353 .
- ^ Rae BD, Long BM, Badger MR, Price GD (сентябрь 2013 г.). «Функции, композиции и эволюция двух типов карбоксизомов: многогранные микрокомпарт, которые облегчают фиксацию CO2 в цианобактериях и некоторых протеобактериях» . Микробиология и молекулярная биология обзоры . 77 (3): 357–379. doi : 10.1128/mmbr.00061-12 . PMC 3811607 . PMID 24006469 .
- ^ Long BM, Badger MR, Whitney SM, Price GD (октябрь 2007 г.). «Анализ карбоксизомов из Synechococcus PCC7942 выявляет несколько комплексов Rubisco с карбоксисомными белками CCMM и CCAA» . Журнал биологической химии . 282 (40): 29323–29335. doi : 10.1074/jbc.m703896200 . PMID 17675289 .
- ^ Vothknet UC, Westhoff 2001). Полем BBA (BBA) - 1541 (1–2): 91–1 doi : s 10.1016 / PMID 11750665 .
- ^ Sobiechowska-Sasim M, Stoń-Egiert J, Kosakowska A (февраль 2014 г.). «Количественный анализ экстрагированных фикобилиновых пигментов в цианобактериях и оценке спектрофотометрических и спектрофлуорометрических методов» . Журнал прикладной фикологии . 26 (5): 2065–2074. Bibcode : 2014japco..26.2065s . doi : 10.1007/s10811-014-0244-3 . PMC 4200375 . PMID 25346572 .
- ^ Jump up to: а беременный Pisciotta JM, Zou Y, Baskakov IV (май 2010 г.). Ян Ч. (ред.). «Светозависимая электрогенная активность цианобактерий» . Plos один . 5 (5): E10821. BIBCODE : 2010PLOSO ... 510821P . doi : 10.1371/journal.pone.0010821 . PMC 2876029 . PMID 20520829 .
- ^ Jump up to: а беременный в Vermaas WF (2001). «Фотосинтез и дыхание в цианобактериях». Фотосинтез и дыхание в цианобактериях. эл . John Wiley & Sons , Ltd. doi : 10.1038/npg.els.0001670 . ISBN 978-0-470-01590-2 Полем S2CID 19016706 .
- ^ Армстронф JE (2015). Как Земля стала зеленой: короткая 3,8-миллиардная история растений . Университет Чикагской Прессы . ISBN 978-0-226-06977-7 .
- ^ Klatt JM, De Beer D, Häusler S, Polerecky L (2016). «Цианобактерии в сульфидных пружинных микробных матах могут выполнять кислородный и аноксигенный фотосинтез одновременно в течение всего суточного периода» . Границы в микробиологии . 7 : 1973. DOI : 10.3389/fmicb.2016.01973 . PMC 5156726 . PMID 28018309 .
- ^ Гроссман А.Р., Шефер М.Р., Чианг Г.Г., Коллиер Дж.Л. (сентябрь 1993 г.). «Phycobilisome, светлый комплекс, реагирующий на условия окружающей среды» . Микробиологические обзоры . 57 (3): 725–749. doi : 10.1128/mmbr.57.3.725-749.1993 . PMC 372933 . PMID 8246846 .
- ^ «Цвета из бактерий | Причины цвета» . www.webexhibits.org . Получено 22 января 2018 года .
- ^ Гарсия-Пишель F (2009). "Цианобактерии" В Schaechter M (ред.). Это третье изд.). стр. 107–24. doi : 10.1016/ b978-0 ISBN 978-0-12-373944-5 .
- ^ Kehoe DM (май 2010 г.). «Хроматическая адаптация и эволюция чувства света в цианобактериях» . Труды Национальной академии наук Соединенных Штатов Америки . 107 (20): 9029–9030. Bibcode : 2010pnas..107.9029k . doi : 10.1073/pnas.1004510107 . PMC 2889117 . PMID 20457899 .
- ^ Kehoe DM, Gutu A (2006). «Отвечая на цвет: регулирование дополнительной хроматической адаптации». Ежегодный обзор биологии растений . 57 : 127–150. doi : 10.1146/annurev.arplant.57.032905.105215 . PMID 16669758 .
- ^ Palenik B, Haselkorn R (январь 1992 г.). «Множественные эволюционные происхождения прохлорофитов, хлорофилл B-содержащие прокариоты». Природа . 355 (6357): 265–267. Bibcode : 1992natur.355..265p . doi : 10.1038/355265A0 . PMID 1731224 . S2CID 4244829 .
- ^ Урбах Е., Робертсон Д.Л., Чисхолм С.В. (январь 1992 г.). «Множественное эволюционное происхождение прохлорофитов в цианобактериальном излучении». Природа . 355 (6357): 267–270. Bibcode : 1992natur.355..267u . doi : 10.1038/355267A0 . PMID 1731225 . S2CID 2011379 .
- ^ Cohen Y, Jørgensen BB, Revsbech NP, Poplawski R (февраль 1986 г.). «Адаптация к сероводородному серо кислорода и аноксигенного фотосинтеза среди цианобактерий» . Прикладная и экологическая микробиология . 51 (2): 398–407. Bibcode : 1986apenm..51..398c . doi : 10.1128/aem.51.2.398-407.1986 . PMC 238881 . PMID 16346996 .
- ^ Blankenship Re (2014). Молекулярные механизмы фотосинтеза . Wiley-Blackwell . С. 147–73. ISBN 978-1-4051-8975-0 .
- ^ Jump up to: а беременный Och LM, Shields-rahou GA (январь 2012 г.). «Событие неопротерозойской оксигенации: возмущения окружающей среды и биогеохимический велосипед». Земля-наука обзоров . 110 (1–4): 26–57. Bibcode : 2012esrv..110 ... 26o . doi : 10.1016/j.earscirev.2011.09.004 .
- ^ Adams DG, Bergman B, Nierzwicki-Bauer SA, Duggan PS, Rai AN, Schüßler A (2013). «Симбиозы цианобактериального завода». В Розенберге Э, Делонг Эф, Лори С., Стейкбрандт Э., Томпсон Ф. (ред.). Прокариоты . Спрингер, Берлин, Гейдельберг. С. 359–400. doi : 10.1007/978-3-642-30194-0_17 . ISBN 978-3-642-30193-3 .
- ^ Чжан С., Брайант Д.А. (декабрь 2011 г.). «Цикл трикарбоновой кислоты в цианобактериях». Наука . 334 (6062): 1551–1553. Bibcode : 2011sci ... 334.1551Z . doi : 10.1126/science.1210858 . PMID 22174252 . S2CID 206536295 .
- ^ Xiong W, Lee TC, Rommelfanger S, Gjersing E, Cano M, Maness PC, et al. (Декабрь 2015). «Путь фосфокетолазы способствует метаболизму углерода в цианобактериях». Природные растения . 2 (1): 15187. DOI : 10.1038/nplants.2015.187 . PMID 27250745 . S2CID 40094360 .
- ^ Смит А (1973). «Синтез метаболических промежуточных соединений» . В Carr Ng, Whitton Ba (Eds.). Биология сине-зеленых водорослей . Калифорнийский университет. С. 30- . ISBN 978-0-520-02344-4 .
- ^ Jangoux M (1987). «Болезни Echinodermata. I. Агенты микроорганизмы и протистан» . Болезни водных организмов . 2 : 147–62. doi : 10.3354/dao002147 .
- ^ Kinne O, ed. (1980). Заболевания морских животных (PDF) . Тол. 1. Чичестер, Великобритания: Джон Вили и сыновья. ISBN 978-0-471-99584-5 .
- ^ Кристиансен А (1964). « Sarcinastrum Urosporae , бесцветный паразитный сине-зеленый водоросли» (PDF) . Phycologia . 4 (1): 19–22. Bibcode : 1964phyco ... 4 ... 19k . doi : 10.2216/i0031-8884-4-119.1 . Архивировано из оригинала (PDF) 6 января 2015 года.
- ^ Mazard S, Penesyan A, Ostrowski M, Paulsen IT, Egan S (май 2016 г.). «Крошечные микробы с большим воздействием: роль цианобактерий и их метаболитов в формировании нашего будущего» . Морские лекарства . 14 (5): 97. doi : 10.3390/md14050097 . PMC 4882571 . PMID 27196915 .
- ^ De Los Ríos A, Grube M, Sancho LG, Ascaso C (февраль 2007 г.). «Ультраструктурные и генетические характеристики эндолитических цианобактериальных биопленок, колонизирующих антарктические гранитные породы» . Микробиология FEMS Экология . 59 (2): 386–395. Bibcode : 2007femme..59..386d . doi : 10.1111/j.1574-6941.2006.00256.x . PMID 17328119 .
- ^ Воган Т. (2011). Млекопитающая . Джонс и Барлетт. п. 21. ISBN 978-0763762995 .
- ^ Schultz N (30 августа 2009 г.). «Фотосинтетические вирусы поддерживают уровень кислорода в мире» . Новый ученый .
- ^ Jump up to: а беременный в Jöhnk KD, Huisman J, Sharples J, Sommeijer B, Visser PM, Stroom JM (1 марта 2008 г.). «Летние тепловые волны способствуют цветению вредных цианобактерий» . Глобальная биология изменений . 14 (3): 495–512. Bibcode : 2008gcbio..14..495j . doi : 10.1111/j.1365-2486.2007.01510.x . S2CID 54079634 .
- ^ «Линда Лоутон - 11 -я Международная конференция по токсичным цианобактериям» . Получено 25 июня 2021 года .
- ^ Paerl HW, Пол VJ (апрель 2012 г.). «Изменение климата: связи с глобальным расширением вредных цианобактерий». Водные исследования . 46 (5): 1349–1363. Bibcode : 2012watre..46.1349p . doi : 10.1016/j.watres.2011.08.002 . PMID 21893330 .
- ^ Томас А.Д., Дугилл А.Дж. (15 марта 2007 г.). «Пространственное и временное распределение цианобактериальных почвенных коров в калахари: последствия для свойств поверхности почвы». Геоморфология . 85 (1): 17–29. Bibcode : 2007geomo..85 ... 17t . doi : 10.1016/j.geomorph.2006.03.029 .
- ^ Belnap J, Gardner JS (1993). «Микроструктура почвы в почвах плато Колорадо: роль цианобактерий -микроколея влагалища». Великий бассейн натуралист . 53 (1): 40–47. JSTOR 41712756 .
- ^ Нельсон, Кори; Гиральдо-Сильва, Ана; Варсоп Томас, Финлей; Гарсия-Пишель, Ферран (16 ноября 2022 года). «Пространственная самосегрегация пионеровских цианобактериальных видов приводит к тому, что микробиомическая организация в биокрарах» . ISME Communications . 2 (1): 114. doi : 10.1038/s43705-022-00199-0 . PMC 9723579 . PMID 37938289 .
- ^ Надис (декабрь 2003 г.). «Клетки, которые управляют морями» (PDF) . Scientific American . 289 (6): 52–53. Bibcode : 2003sciam.289f..52n . doi : 10.1038/Scientificamerican1203-52 . PMID 14631732 . Архивировано из оригинала (PDF) 19 апреля 2014 года . Получено 19 апреля 2014 года .
- ^ Стюарт I, Falconer IR (2 сентября 2011 г.). «Цианобактерии и цианобактериальные токсины» . В Walsh PJ, Smith S, Fleming L, Solo-Gabriele H, Gerwick WH (Eds.). Океаны и здоровье человека: риски и лекарства от морей . Академическая пресса . С. 271–296. ISBN 978-0-08-087782-2 .
- ^ Jump up to: а беременный в Ли С.М., Рю СМ (4 февраля 2021 г.). «Волосли как новые дети в полезном микробиоме растений» . Границы в науке о растениях . 12 Frontiers Media SA: 599742. DOI : 10.3389/fpls.2021.599742 . PMC 7889962 . PMID 33613596 .
 Материал был скопирован из этого источника, который доступен по международной лицензии Creative Commons Attribution 4.0 .
Материал был скопирован из этого источника, который доступен по международной лицензии Creative Commons Attribution 4.0 .
- ^ Jump up to: а беременный в Ким М, Чой Д.Х., Парк М.Г. (май 2021). «Цианобионтовое генетическое разнообразие и специфичность хозяина цианобионного несущего динофлагеллят орнитоцеркуса в умеренных прибрежных водах» . Научные отчеты . 11 (1): 9458. Bibcode : 2021natsr..11.9458k . doi : 10.1038/s41598-021-89072-z . PMC 8097063 . PMID 33947914 .
 Материал был скопирован из этого источника, который доступен по международной лицензии Creative Commons Attribution 4.0 .
Материал был скопирован из этого источника, который доступен по международной лицензии Creative Commons Attribution 4.0 .
- ^ Гантар М., Эльхай Дж. (1999). «Колонизация Wheatpara-Nodules с помощью N2-фиксирующего цианобактерий Nostocsp . Штамм 2S9B» . Новый фитолог . 141 (3): 373–379. doi : 10.1046/j.1469-8137.1999.00352.x .
- ^ Гантар М. (2000). «Механическое повреждение корней обеспечивает усиленную колонизацию эндорхизосфере пшеницы с помощью цианобактерии Nostoc Sp. Sp. 2s9b». Биология и плодородие почв . 32 (3): 250–255. Bibcode : 2000biofs..32..250G . doi : 10.1007/s003740000243 . S2CID 7590731 .
- ^ Treves H, Raanan H, Kedem I, Murik O, Keren N, Zer H, et al. (Июнь 2016 г.). «Механизмы, посредством которых зеленая водоросли хлорелла ohadii, изолированные из коры пустынной почвы, демонстрируют беспрепятственную сопротивление фотодобы» . Новый фитолог . 210 (4): 1229–1243. doi : 10.1111/nph.13870 . PMID 26853530 .
- ^ Чжу Х., Ли С., Ху З, Лю Г. (декабрь 2018 г.). «Молекулярная характеристика эукариотических сообществ водорослей в тропической филлосфере на основе секвенирования в реальном времени гена 18S рДНК» . BMC Биология растений . 18 (1): 365. DOI : 10.1186/S12870-018-1588-7 . PMC 6299628 . PMID 30563464 .
- ^ Krings M, Hass H, Kerp H, Taylor TN, Agerer R, Dotzler N (2009). «Эндофитные цианобактерии на земельном заводе в возрасте 400 миллионов лет: сценарий происхождения симбиоза?». Обзор палеоботании и палинологии . 153 (1–2): 62–69. Bibcode : 2009rpapa.153 ... 62k . doi : 10.1016/j.revpalbo.2008.06.006 .
- ^ Картикеян Н., Прасанна Р., Соуд А., Джайсвал П., Наяк С., Каушик Б.Д. (2009). «Физиологическая характеристика и электронное микроскопическое исследование цианобактерий, связанных с ризосферой пшеницы». Folia Microbiologica . 54 (1): 43–51. doi : 10.1007/s12223-009-0007-8 . PMID 19330544 . S2CID 23420342 .
- ^ Jump up to: а беременный Бабу С., Прасанна Р., Бидьярани Н., Сингх Р. (2015). «Анализ колонизации инокулированных цианобактерий у пшеничных растений с использованием биохимических и молекулярных инструментов». Журнал прикладной фикологии . 27 (1): 327–338. Bibcode : 2015japco..27..327b . doi : 10.1007/s10811-014-0322-6 . S2CID 17353123 .
- ^ Jump up to: а беременный Bidyarani N, Prasanna R, Chawla G, Babu S, Singh R (апрель 2015 г.). «Расшифрование факторов, связанных с колонизацией рисовых растений цианобактериями». Журнал базовой микробиологии . 55 (4): 407–419. doi : 10.1002/jobm.201400591 . PMID 25515189 . S2CID 5401526 .
- ^ Jump up to: а беременный Гантар М., Керби Н.В., Роуэлл П. (1991). «Колонизация пшеницы (Triticum vulgare L.) с помощью N2-фиксирующих цианобактерий: ii. Ультраструктурное исследование» . Новый фитолог . 118 (3): 485–492. doi : 10.1111/j.1469-8137.1991.tb00031.x .
- ^ Ахмед М., Стал Л.Дж., Хаснайн С. (2010). «Ассоциация не гетероцистовых цианобактерий с сельскохозяйственными растениями» . Растение и почва . 336 (1–2): 363–375. Bibcode : 2010plsoi.336..363a . doi : 10.1007/s11104-010-0488-x . S2CID 21309970 .
- ^ Хуссейн А., Хамаюн М., Шах -стрит (ноябрь 2013 г.). «Корневая колонизация и фитостимуляция фитогормонами, продуцирующими энтофитный nostoc sp. AH-12». Текущая микробиология . 67 (5): 624–630. doi : 10.1007/s00284-013-0408-4 . PMID 23794014 . S2CID 14704537 .
- ^ Хуссейн А., Шах Ст, Рахман Х, Иршад М., Икбал А. (2015). «Влияние IAA на рост in vitro и колонизацию Nostoc в корнях растений» . Границы в науке о растениях . 6 : 46. doi : 10.3389/fpls.2015.00046 . PMC 4318279 . PMID 25699072 .
- ^ Капоне Д.Г. (1997). «Триходесмий, глобально значимый морской цианобактериум». Наука . 276 (5316): 1221–1229. doi : 10.1126/science.276.5316.1221 .
- ^ Falkowski PG, Barber RT, Smetacek V (июль 1998 г.). «Биогеохимический контроль и обратная связь на первичном производстве океана». Наука . 281 (5374): 200–207. doi : 10.1126/science.281.5374.200 . PMID 9660741 .
- ^ Хатчинс Д.А., Фу Фкс, Чжан Ю., Уорнер М.Е., Фенг Ю., Портун К., Бернхардт П.В., Малхолланд М.Р. (2007). «Контроль CO2 фиксации Trichodesmium N2, фотосинтез, темпы роста и элементарные соотношения: последствия для прошлого, настоящего и будущей биогеохимии океана» . Лимнология и океанография . 52 (4): 1293–1304. Bibcode : 2007limoc..52.1293h . doi : 10.4319/lo.2007.52.4.1293 . S2CID 55606811 .
- ^ Huang S, Wilhelm SW, Harvey HR, Taylor K, Jiao N, Chen F (февраль 2012 г.). «Новые линии Prochlorococcus и Synechococcus в глобальных океанах» . Журнал ISME . 6 (2): 285–297. Bibcode : 2012ismej ... 6..285h . doi : 10.1038/ismej.2011.106 . PMC 3260499 . PMID 21955990 .
- ^ Шривастава А.К., Рай А.М., Нилан Б.А. (март 2013 г.). Биология стресса цианобактерий: молекулярные механизмы к клеточным реакциям . CRC Press. ISBN 9781466504783 - через Google Books .
- ^ Zehr JP, Bench SR, Carter BJ, Hewson I, Niazi F, Shi T, et al. (Ноябрь 2008 г.). «Глобально распределенные некультивированные океанические N2-фиксирующие цианобактерии не имеют кислородной фотосистемы II». Наука . 322 (5904): 1110–1112. Bibcode : 2008Sci ... 322.1110Z . doi : 10.1126/science.1165340 . PMID 19008448 . S2CID 206516012 .
- ^ Decelle J, Colin S, Foster RA (2015). «Фотосимбиоз у морских планктонных протистов». Морские протисты . С. 465–500. doi : 10.1007/978-4-431-55130-0_19 . ISBN 978-4-431-55129-4 .
- ^ Foster RA, Zehr JP (сентябрь 2019 г.). «Разнообразие, геномика и распределение одноклеточных симбиотических ассоциаций фитопланктон-цианобактерии». Ежегодный обзор микробиологии . 73 : 435–456. doi : 10.1146/annurev-micro-090817-062650 . PMID 31500535 . S2CID 202414294 .
- ^ Jump up to: а беременный в дюймовый и фон глин Mullineaux CW, Wilde A (июнь 2021 г.). «Общественная жизнь цианобактерий» . элиф . 10 doi : 10.7554/elife.70327 . PMC 8208810 . PMID 34132636 .
 Материал был скопирован из этого источника, который доступен по международной лицензии Creative Commons Attribution 4.0 .
Материал был скопирован из этого источника, который доступен по международной лицензии Creative Commons Attribution 4.0 .
- ^ Kamennaya NA, Zemla M, Mahoney L, Chen L, Holman E, Holman HY, et al. (Май 2018). «Высокий PCO 2 -индуцированный экзополисахаридные балластные заполнители планктонных цианобактерий могут объяснить палеопротерозойское углеродное захоронение» . Природная связь . 9 (1): 2116. Bibcode : 2018natco ... 9.2116K . doi : 10.1038/s41467-018-04588-9 . PMC 5974010 . PMID 29844378 .
- ^ Jump up to: а беременный Maeda K, Okuda Y, Enomoto G, Watanabe S, Ikeuchi M (июнь 2021 г.). «Биосинтез сульфатированного экзополисахарида, синхана и образования цветения в модели Cyanobacterium synechocystis sp. Штамм PCC 6803» . элиф . 10 doi : 10.7554/elife.66538 . PMC 8205485 . PMID 34127188 .
- ^ Jump up to: а беременный SIM MS, Liang B, Petroff AP, Evans A, Klepac-Ceraj V, Flannery DT, et al. (2012). «Кислоронозависимый морфогенез современных компоненных фотосинтетических матов и последствия для архейского строматолита» . Геоссауки . 2 (4): 235–259. Bibcode : 2012geosc ... 2..235s . doi : 10.3390/Geosciences2040235 . HDL : 1721,1/85544 .
 Материал был скопирован из этого источника, который доступен по международной лицензии Creative Commons Attribution 3.0 .
Материал был скопирован из этого источника, который доступен по международной лицензии Creative Commons Attribution 3.0 .
- ^ Jump up to: а беременный Conradi FD, Zhou RQ, Easer S, Schuergers N, Wilde A, Mullineaux CW (октябрь 2019). «Факторы, контролирующие образование и структуру FROC в Cyanobacterium synechocystis sp. Штамм PCC 6803» . Журнал бактериологии . 201 (19). doi : 10.1128/jb.00344-19 . PMC 6755745 . PMID 31262837 .
- ^ Enomoto G, Ikeuchi M (март 2020 г.). «Cyanobacteriochromes, чувствительные к сине-зеленым свету, являются клеточными датчиками в красных светах, переполненных нишами» . ISCAING . 23 (3): 100936. Bibcode : 202020sci ... 23J0936E . doi : 10.1016/j.isci.2020.100936 . PMC 7063230 . PMID 32146329 .
- ^ Galluzzi L, Bravo-San Pedro JM, Vitale I, Aaronson SA, Abrams JM, Adam D, et al. (Январь 2015). «Основные и аксессуальные аспекты гибели клеток: рекомендации NCCD 2015» . Гибель клеток и дифференциация . 22 (1): 58–73. doi : 10.1038/cdd.2014.137 . PMC 4262782 . PMID 25236395 .
- ^ Аллен Р., Риттманн Б.Е., Кертисс Р. (апрель 2019 г.). «Образование и агрегация аксенической биопленки с помощью Synechocystis sp. Штамм PCC 6803 индуцируется изменениями концентрации питательных веществ и требует структур клеточной поверхности» . Прикладная и экологическая микробиология . 85 (7). Bibcode : 2019apenm..85e2192a . doi : 10.1128/aem.02192-18 . PMC 6585507 . PMID 30709828 .
- ^ Schuergers N, Wilde A (март 2015 г.). «Придатки цианобактериальной клетки» . Жизнь . 5 (1): 700–715. Bibcode : 2015life .... 5..700S . doi : 10.3390/life5010700 . PMC 4390875 . PMID 25749611 .
- ^ Jump up to: а беременный в Khayatan B, Meeks JC, Risser DD (декабрь 2015 г.). «Свидетельство о том, что модифицированная пилусная система типа IV способствует скользящей подвижности и секреции полисахаридов в нитевидных цианобактериях» . Молекулярная микробиология . 98 (6): 1021–1036. doi : 10.1111/mmi.13205 . PMID 26331359 . S2CID 8749419 .
- ^ Адамс Д.В., Штутцманн С., Студманн С., Блокш М. (сентябрь 2019). «ДНК-поглощение пили вибрао-холеры необходимо для колонизации хитина и способна распознавать родные с помощью последовательности, специфичного для самостоятельного взаимодействия» . Природная микробиология . 4 (9): 1545–1557. doi : 10.1038/s41564-019-0479-5 . PMC 6708440 . PMID 31182799 .
- ^ Kromkamp J, Walsby AE (1990). «Компьютерная модель плавучести и вертикальной миграции в цианобактериях». Журнал Plankton Research . 12 : 161–183. doi : 10.1093/plankt/12.1.161 .
- ^ Aguilo-Ferretjans MD, Bosch R, Puxty RJ, Latva M, Zadjelovic V, Chhun A, et al. (Март 2021 г.). «Пили позволяют доминирующим морским цианобактериям избегать тонущего и уклоняться от хищничества» . Природная связь . 12 (1): 1857. Bibcode : 2021natco..12.1857a . doi : 10.1038/s41467-021-22152-w . PMC 7994388 . PMID 33767153 .
- ^ Jump up to: а беременный Hu C, Rzymski P (декабрь 2019 г.). «Запрограммированное, похожее на гибель клеток и сопровождающее высвобождение микроцистина в пресноводном цветущем цвете цианобактерий Microcystis : от идентификации до экологической значимости» . Токсины . 11 (12): 706. doi : 10.3390/toxins11120706 . PMC 6950475 . PMID 31817272 .
- ^ Agustí S (июнь 2004 г.). «Жизнеспособность и ниша сегрегация клеток прохлорококка и синехококка через центральный Атлантический океан» . Водная микробная экология . 36 (1): 53–59. doi : 10.3354/ame036053 . HDL : 10261/86957 .
- ^ Агусти С., Алу Э.В., Хойер М.В., Фрейзер Т.К. , Кэнфилд Д.Е. (2006). «Клеточная гибель в общинах озера Фитопланктон». Пресноводная биология . 51 (8): 1496–1506. Bibcode : 2006frbio..51.1496a . doi : 10.1111/j.1365-2427.2006.01584.x .
- ^ Франклин DJ, Brussaard CP, Berges JA (2006). «Какова роль и природа запрограммированной гибели клеток в экологии фитопланктона?» Полем Европейский журнал Phycology . 41 (1): 1–14. Bibcode : 2006ejphy..41 .... 1f . doi : 10.1080/09670260500505433 . S2CID 53599616 .
- ^ Sigee DC, Selwyn A, Gallois P, Dean AP (2007). «Модели гибели клеток в пресноводных колониальных цианобактериях в конце лета». Phycologia . 46 (3): 284–292. Bibcode : 2007phyco..46..284S . doi : 10.2216/06-69.1 . S2CID 86268392 .
- ^ Берман-Франк I, Бидл К.Д., Харамати Л., Фалковски П.Г. (2004). «Снижение морской цианобактерии, Trichodesmium spp., Через автокатализированный путь гибели клеток» . Лимнология и океанография . 49 (4): 997–1005. Bibcode : 2004limoc..49..997b . doi : 10.4319/lo.2004.49.4.0997 .
- ^ Hu C, Rzymski P (декабрь 2019 г.). «Запрограммированное, похожее на гибель клеток и сопровождающее высвобождение микроцистина в пресноводном цветущем цвете цианобактерий Microcystis : от идентификации до экологической значимости» . Токсины . 11 (12): 706. doi : 10.3390/toxins11120706 . PMC 6950475 . PMID 31817272 .
- ^ Рзимски П., Климаскик П., Юркзак Т., Пониедзиалек Б. (2020). «Окислительный стресс, запрограммированная гибель клеток и высвобождение микроцистина в Microcystis aeruginosa в ответ на Daphnia Grazers» . Границы в микробиологии . 11 : 1201. DOI : 10.3389/fmicb.2020.01201 . PMC 7311652 . PMID 32625177 .
- ^ Jump up to: а беременный Meeks JC, Elhai J, Thiel T, Potts M, Larimer F, Lamerdin J, et al. (2001). «Обзор генома Nostoc Punctiforme, многоклеточного симбиотического цианобактериума». Фотосинтез исследования . 70 (1): 85–106. doi : 10.1023/a: 10138400255518 . PMID 16228364 . S2CID 8752382 .
- ^ Suttle CA (1 января 2000 г.). «Цианофаги и их роль в экологии цианобактерий». В Whitton Ba, Potts M (Eds.). Экология цианобактерий . Спрингер Нидерланды. С. 563–589. doi : 10.1007/0-306-46855-7_20 . ISBN 9780792347354 .
- ^ Саттл С.А., Чан А.М. (1993). «Морские цианофаги, заражающие океанические и прибрежные штаммы Synechococcus: изобилие, морфология, межинфекционная и характеристики роста» . Серия прогресса в морской экологии . 92 : 99–109. Bibcode : 1993meps ... 92 ... 99S . doi : 10.3354/meps092099 .
- ^ Фокин А., Россманн М.Г. (январь 2014 г.). «Молекулярная архитектура хвостовых двухцепочечных ДНК-фагов» . Бактериофаг . 4 (1): E28281. doi : 10.4161/bact.28281 . PMC 3940491 . PMID 24616838 .
- ^ Proctor LM, Fuhrman JA (1990). «Вирусная смертность морских бактерий и цианобактерий». Природа . 343 (6253): 60–62. Bibcode : 1990natur.343 ... 60p . doi : 10.1038/343060A0 . S2CID 4336344 .
- ^ Jump up to: а беременный Сарма Та. «Цианофаги» в Справочнике цианобактерий ( CRC Press ; 2012) ( ISBN 1466559411 )
- ^ Duggan PS, Gottardello P, Adams DG (июнь 2007 г.). «Молекулярный анализ генов в точковом точке, участвующем в биогенезе пилуса и инфекции растений» . Журнал бактериологии . 189 (12): 4547–4551. doi : 10.1128/jb.01927-06 . PMC 1913353 . PMID 17416648 .
- ^ Уайльд А., Маллино CW (декабрь 2015 г.). «Моторичность в цианобактериях: полисахаридные треки и моторы Pilus IV типа» . Молекулярная микробиология . 98 (6): 998–1001. doi : 10.1111/mmi.13242 . PMID 26447922 . S2CID 22585994 .
- ^ Уотербери Дж.Б., Уилли Дж. М., Фрэнкс Д.Г., Валуа Ф.В., Уотсон С.В. (октябрь 1985 г.). «Цианобактерий, способный плавать подвижностью». Наука . 230 (4721): 74–76. Bibcode : 1985Sci ... 230 ... 74W . doi : 10.1126/science.230.4721.74 . PMID 17817167 . S2CID 29180516 .
- ^ Элерс К., Остер Г. (2012). «О таинственном движении Synechococcus» . Plos один . 7 (5): E36081. BIBCODE : 2012PLOSO ... 736081E . doi : 10.1371/journal.pone.0036081 . PMC 3342319 . PMID 22567124 .
- ^ Miyata M, Robinson RC, Uyeda TQ, Fukumori Y, Fukushima SI, Haruta S, et al. (Январь 2020 г.). «Дерево подвижности - предлагаемая история систем подвижности в дереве жизни» . Гены к клеткам . 25 (1): 6–21. doi : 10.1111/gtc.12737 . PMC 7004002 . PMID 31957229 .
 Материал был скопирован из этого источника, который доступен по международной лицензии Creative Commons Attribution 4.0 .
Материал был скопирован из этого источника, который доступен по международной лицензии Creative Commons Attribution 4.0 .
- ^ Castenholz RW (1982). «Подвижность и налоги». В Carr Ng, Whitton Ba (Eds.). Биология цианобактерий . Университет Калифорнийской прессы, Беркли и Лос -Анджелес. С. 413–439. ISBN 978-0-520-04717-4 .
- ^ Уотербери Дж.Б., Уилли Дж. М., Фрэнкс Д.Г., Валуа Ф.В., Уотсон С.В. (октябрь 1985 г.). «Цианобактерий, способный плавать подвижностью». Наука . 230 (4721): 74–76. Bibcode : 1985Sci ... 230 ... 74W . doi : 10.1126/science.230.4721.74 . PMID 17817167 . S2CID 29180516 .
- ^ McBride MJ (2001). «Бактериальная скользящая подвижность: множественные механизмы для движения клеток над поверхностями». Ежегодный обзор микробиологии . 55 : 49–75. doi : 10.1146/annurev.micro.55.1.49 . PMID 11544349 .
- ^ Рейхенбах Х. (1981). «Таксономия скользящих бактерий». Ежегодный обзор микробиологии . 35 : 339–364. doi : 10.1146/annurev.mi.35.100181.002011 . PMID 6794424 .
- ^ Hoiczyk E, Baumeister W (октябрь 1998 г.). «Комплекс соединения пор, прокариотическая секреция, является молекулярной моторной моторией, лежащей в основе скользящей подвижности в цианобактериях» . Текущая биология . 8 (21): 1161–1168. Bibcode : 1998cbio .... 8.1161h . doi : 10.1016/s0960-9822 (07) 00487-3 . PMID 9799733 . S2CID 14384308 .
- ^ Hoiczyk E (2000). «Скоростная подвижность в цианобактериальном: наблюдения и возможные объяснения». Архив микробиологии . 174 (1–2): 11–17. Bibcode : 2000.Armic.174 ... 11h . doi : 10.1007/s002030000187 . PMID 10985737 . S2CID 9927312 .
- ^ Bhaya D, Watanabe N, Ogawa T, Grossman AR (март 1999 г.). «Роль альтернативного сигма -фактора в подвижности и формировании пиласа в Cyanobacterium synechocystis sp. Штамм PCC6803» . Труды Национальной академии наук Соединенных Штатов Америки . 96 (6): 3188–3193. Bibcode : 1999pnas ... 96.3188b . doi : 10.1073/pnas.96.6.3188 . PMC 15917 . PMID 10077659 .
- ^ Jump up to: а беременный Donkor VA, Amewoor DH, Häder DP (1993). «Влияние тропического солнечного излучения на подвижность фламеномических цианобактерий » Микробиология FEMS Экология 12 (2): 143–1 Bibcode : 1993femme..12..143d Doi : 10.1111/ j.1574-6941.1993.tb00026.x
- ^ Garcia-Pichel F, Mechling M, Castenholz RW (май 1994). «Миграции Diel микроорганизмов в бентическом сообществе гиперсолиновых матов» . Прикладная и экологическая микробиология . 60 (5): 1500–1511. Bibcode : 1994apenm..60.1500g . doi : 10.1128/aem.60.5.1500-1511.1994 . PMC 201509 . PMID 16349251 .
- ^ Fourçans A, Solé A, Diestra E, Ranchou-Peyruse A, Esteve I, Caumette P, Duran R (сентябрь 2006 г.). «Вертикальная миграция фототрофических бактериальных популяций в гиперзалиновом микробном мате от Salins-de-Giraud (Camargue, France)» . Микробиология FEMS Экология . 57 (3): 367–377. Bibcode : 2006femme..57..367f . doi : 10.1111/j.1574-6941.2006.00124.x . PMID 16907751 .
- ^ Ричардсон Л.Л., Кастенхольц Р.В. (сентябрь 1987 г.). «Diel вертикальные движения цианобактерии осциллярии Terebriformis в микробном мате горячих источников, богатого сульфидом» . Прикладная и экологическая микробиология . 53 (9): 2142–2150. Bibcode : 1987apenm..53.2142r . doi : 10.1128/aem.53.9.2142-2150.1987 . PMC 204072 . PMID 16347435 .
- ^ Häder DP (1987). «Влияние облучения ультрафиолетового излучения на фотомофинку у десмида, космария огумиса». Фотохимия и фотобиология . 46 : 121–126. doi : 10.1111/j.1751-1097.1987.tb04745.x . S2CID 97100233 .
- ^ Nultsch W, Häder DP (июнь 1988 г.). «Фотомообразование в подвижных микроорганизмах-II» . Фотохимия и фотобиология . 47 (6): 837–869. doi : 10.1111/j.1751-1097.1988.tb01668.x . PMID 3064112 . S2CID 26445775 .
- ^ Ceccucci, G., Sgarbossa, A. and Lenci, F. (2004) «Стоколы микроорганизмов: введение». Справочник по органической фотохимии и фотобиологии CRC , 2 -е изд., CRC Press.
- ^ Nultsch, Вильгельм (1962) «Влияние света на движение цианофииза: III. Коммуникация: фотофоботаксис Phormidium uncinatum». Планта , 58 (6): 647–63.
- ^ Nultsch W, Schuchart H, Höhl M (1979). «Исследования фототаксической ориентации Anabaena variabilis». Архив микробиологии . 122 (1): 85–91. Bibcode : 1979mic.122 ... 85n . doi : 10.1007/bf00408050 . S2CID 12242837 .
- ^ Riding R (2007). «Термин строматолит: к существенному определению». Летая . 32 (4): 321–30. doi : 10.1111/j.1502-3931.1999.tb00550.x .
- ^ Baumgartner RJ, Van Kranendonk MJ, Wacey D, Fiorentini ML, Saunders M, Caruso S, et al. (2019). «Нано-пористого пирита и органического вещества у строматолитов в 3,5 млрд. Строматолитов регистрируют изначальную жизнь» (PDF) . Геология . 47 (11): 1039–43. Bibcode : 2019geo .... 47.1039b . doi : 10.1130/g46365.1 . S2CID 2042585544 .
- ^ Schopf JW, Packer BM (июль 1987 г.). «Ранние археи (от 3,3 до 3,5 млрд. Митофоссий из группы Warrawoona, Австралия». Наука . 237 (4810): 70–73. Bibcode : 1987Sci ... 237 ... 70S . doi : 10.1126/science.11539686 . PMID 11539686 .
- ^ Farquhar J, Bao H, Thiemens M (август 2000 г.). «Атмосферное влияние самого раннего серного цикла Земли». Наука . 289 (5480): 756–759. Bibcode : 2000sci ... 289..756f . doi : 10.1126/science.289.5480.756 . PMID 10926533 .
- ^ Лейн N (6 февраля 2010 г.). «Первое дыхание: миллиардная борьба Земли за кислород» . Новый ученый . С. 36–39. Смотрите также сопровождающий график.
- ^ Корсетти Ф.А., Авамик С.М., Пирс Д. (апрель 2003 г.). «Сложная микробиота из снежных времен Земли: микрофоссили из неопротерозойского пика Кингстон, долины Смерти, США» . Труды Национальной академии наук Соединенных Штатов Америки . 100 (8): 4399–4404. Bibcode : 2003pnas..100.4399c . doi : 10.1073/pnas.0730560100 . PMC 153566 . PMID 12682298 .
- ^ Gutschick RC, Perry TG (1 ноября 1959 г.). «Sappington (Kinderhookian) губки и их окружающая среда [Монтана]» . Журнал палеонтологии . 33 (6): 977–85 . Получено 28 июня 2007 года .
- ^ Riding R (1991). Кальциальные водоросли и строматолиты . Springer-Verlag Press. п. 32
- ^ Монти К.Л. (1981). «Спонгиостромат против Porostromate строматолитов и онколитов» . В Монти Кл (ред.). Фанерозойские строматолиты . Берлин, Гейдельберг: Спрингер. С. 1–4. doi : 10.1007/978-3-642-67913-1_1 . ISBN 978-3-642-67913-1 .
- ^ Кастелано С., Маас А., Эриксон М.Е., Хуаг Дж.Т., Хугт С., Вальзек Д. (2018). В кембрийском Орстенском депозитах. Паалонтология 61 (6): 855–880. Bibcode : 2018palgy.61.855c . doi : 10.1111/боль . S2CID 134049042 .
- ^ «Как растения делают кислород? Спросите цианобактерии» . Phys.org . Science X. 30 марта 2017 года . Получено 26 октября 2017 года .
- ^ Crockford PW, Kunzmann M, Bekker A, Hayles J, Bao H, Halverson GP, et al. (20 мая 2019). «Клэйпул продолжил: расширение изотопной записи осадочного сульфата» . Химическая геология . 513 : 200–225. BIBCODE : 2019CHGEO.513..200C . doi : 10.1016/j.chemgeo.2019.02.030 . ISSN 0009-2541 . S2CID 134406359 .
- ^ Hodgskiss MS, Crockford PW, Peng Y, Wing BA, Horner TJ (август 2019). «Производительность разрушается, чтобы положить конец великолепному окислению Земли» . Труды Национальной академии наук Соединенных Штатов Америки . 116 (35): 17207–17212. Bibcode : 2019pnas..11617207H . doi : 10.1073/pnas.1900325116 . PMC 6717284 . PMID 31405980 .
- ^ Эрреро А (2008). Flores E (ред.). Цианобактерии: молекулярная биология, геномика и эволюция (1 -е изд.). Caister Academic Press. ISBN 978-1-904455-15-8 .
- ^ Jump up to: а беременный Килинг PJ (2013). «Количество, скорость и влияние пластидных эндосимбиозов в эукариотической эволюции». Ежегодный обзор биологии растений . 64 : 583–607. doi : 10.1146/annurev-arplant-050312-120144 . PMID 23451781 . S2CID 207679266 .
- ^ Мур К.Р., Магнабоско С., Момпер Л., Голд Д.А., Босак Т., Фурнье Г.П. (2019). «Расширенная рибосомная филогения цианобактерий поддерживает глубокое размещение пластид» . Границы в микробиологии . 10 : 1612. DOI : 10.3389/fmicb.2019.01612 . PMC 6640209 . PMID 31354692 .
- ^ Howe CJ, Bardrook AC, Nisbet RE, Lockhart PJ, Larkum AW (август 2008 г.). «Происхождение пластидов» . Философские транзакции Королевского общества Лондона. Серия B, биологические науки . 363 (1504): 2675–2685. doi : 10.1098/rstb.2008.0050 . PMC 2606771 . PMID 18468982 .
- ^ Jump up to: а беременный Rodríguez-Ezpeleta N, Brinkmann H, Burey SC, Roure B, Burger G, Löffelhardt W, et al. (Июль 2005 г.). «Монофилия первичных фотосинтетических эукариот: зеленые растения, красные водоросли и глаукофиты» . Текущая биология . 15 (14): 1325–1330. Bibcode : 2005cbio ... 15.1325r . doi : 10.1016/j.cub.2005.06.040 . PMID 16051178 .
- ^ ADL SM, Simpson AG, Lane CE, Lukeus J, Bass D, Bowser SS, et al. (Сентябрь 2012 г.). «Пересмотренная классификация эукариот» . Журнал эукариотической микробиологии . 59 (5): 429–493. doi : 10.1111/j.1550-7408.2012.00644.x . PMC 3483872 . PMID 23020233 .
- ^ Прайс DC, Chan CX, Yoon HS, Yang EC, Qiu H, Weber AP, et al. (Февраль 2012 г.). «Cyanophora paradoxa геном выясняет происхождение фотосинтеза у водорослей и растений». Наука . 335 (6070): 843–847. Bibcode : 2012sci ... 335..843p . doi : 10.1126/science.1213561 . PMID 22344442 . S2CID 17190180 .
- ^ Jump up to: а беременный Ребрар 2017). Ориентатор Текущая биология 27 (3): 386–3 Bibcode : 2017cbiio ... 27..386p . DOI : 10.1016/J . PMC 5650054 . PMID 28132810 .
- ^ Шимпер AF (1883). «О развитии хлорофилла зерна и цветного тела» [о развитии зерна и пятен хлорофилла]. Бот . 41 : 105–14, 121–31, 137–46, 153–62. Архивировано с оригинала 19 октября 2013 года.
- ^ Альбертс Б (2002). «Хлоропласты и фотосинтез». Молекулярная биология клетки (4. изд.). Нью -Йорк [UA]: Гарленда. ISBN 978-0-8153-4072-0 .
- ^ Мересчковский С. (1905). «О природе и происхождении хроматофоров в растительном королевстве» [о природе и происхождении хроматофоров в растительном королевстве]. Biol Centralbl (на немецком языке). 25 : 593–604.
- ^ Саган Л (март 1967 г.). «О происхождении клеток митозирования». Журнал теоретической биологии . 14 (3): 255–274. Bibcode : 1967jthbi..14..225s . doi : 10.1016/0022-5193 (67) 90079-3 . PMID 11541392 .
- ^ Шварц Р.М., Дейхофф Мо (январь 1978 г.). «Происхождение прокариот, эукариот, митохондрии и хлоропласты». Наука . 199 (4327): 395–403. Bibcode : 1978sci ... 199..395s . doi : 10.1126/science.202030 . PMID 202030 .
- ^ Арчибальд Дж. М. (август 2015 г.). «Геномные перспективы на рождение и распространение пластид» . Труды Национальной академии наук Соединенных Штатов Америки . 112 (33): 10147–10153. Bibcode : 2015pnas..11210147a . doi : 10.1073/pnas.1421374112 . PMC 4547232 . PMID 25902528 .
- ^ Blankenship Re (октябрь 2010 г.). «Ранняя эволюция фотосинтеза» . Физиология растений . 154 (2): 434–438. doi : 10.1104/pp.110.161687 . PMC 2949000 . PMID 20921158 .
- ^ Rockwell NC, Lagarias JC, Bhattacharya D (2014). «Первичный эндосимбиоз и эволюция света и зондирования кислорода у фотосинтетических эукариот» . Границы в экологии и эволюции . 2 (66). doi : 10.3389/fevo.2014.00066 . PMC 4343542 . PMID 25729749 .
- ^ Суммировано в Cavalier-Smith T (апрель 2000 г.). «Мембранная наследственность и ранняя эволюция хлоропластов». Тенденции в науке о растениях . 5 (4): 174–182. doi : 10.1016/s1360-1385 (00) 01598-3 . PMID 10740299 .
- ^ Nowack ec, melkonian m, glöckner g (март 2008 г.). «Хроматофорный геном последовательность Paulinella проливает свет на приобретение фотосинтеза эукариотами» . Текущая биология . 18 (6): 410–418. Bibcode : 2008cbio ... 18..410n . doi : 10.1016/j.cub.2008.02.051 . PMID 18356055 .
- ^ Килинг PJ (октябрь 2004 г.). «Разнообразие и эволюционная история пластидов и их хозяев» . Американский журнал ботаники . 91 (10): 1481–1493. doi : 10.3732/ajb.91.10.1481 . PMID 21652304 .
- ^ Арчибальд Дж. М. (январь 2009 г.). «Загадка эволюции пластидов» . Текущая биология . 19 (2): R81 - R88. Bibcode : 2009cbio ... 19..r81a . doi : 10.1016/j.cub.2008.11.067 . PMID 19174147 .
- ^ Дуглас Се (декабрь 1998 г.). «Пластидная эволюция: происхождение, разнообразие, тенденции». Текущее мнение в области генетики и развития . 8 (6): 655–661. doi : 10.1016/s0959-437x (98) 80033-6 . PMID 9914199 .
- ^ Reyes-Prieto A, Weber AP, Bhattacharya D (2007). «Происхождение и установление пластида в водорослях и растениях». Ежегодный обзор генетики . 41 : 147–168. doi : 10.1146/annurev.genet.41.110306.130134 . PMID 17600460 .
- ^ Raven JA, Allen JF (2003). «Геномика и эволюция хлоропластов: что делали цианобактерии для растений?» Полем Биология генома . 4 (3): 209. DOI : 10.1186/GB-2003-4-3-209 . PMC 153454 . PMID 12620099 .
- ^ Jump up to: а беременный в Bekker A, Holland HD, Wang PL, Rumble D, Stein HJ, Hannah JL, et al. (Январь 2004 г.). «Знакомство с ростом атмосферного кислорода». Природа . 427 (6970): 117–120. Bibcode : 2004natur.427..117b . doi : 10.1038/nature02260 . PMID 14712267 . S2CID 4329872 .
- ^ Kump LR, Junium C, Arthur MA, Brasier A, Fallick A, Melezhik V, et al. (Декабрь 2011 г.). «Изотопные доказательства массивного окисления органического вещества после большого события окисления» . Наука . 334 (6063): 1694–1696. Bibcode : 2011sci ... 334.1694K . doi : 10.1126/science.1213999 . PMID 22144465 . S2CID 27680273 .
- ^ Fralick P, Davis DW, Kissin SA (2002). «Возраст формирования Gunflint, Онтарио, Канада: Определения возраста в одном цирконе U - PB из переработанного вулканического пепла». Канадский журнал наук о Земле . 39 (7): 1085–1091. Bibcode : 2002cajes..39.1085f . doi : 10.1139/e02-028 .
- ^ Jump up to: а беременный Holland HD (июнь 2006 г.). «Оксигенация атмосферы и океанов» . Философские транзакции Королевского общества Лондона. Серия B, биологические науки . 361 (1470): 903–915. doi : 10.1098/rstb.2006.1838 . PMC 1578726 . PMID 16754606 .
- ^ Jump up to: а беременный в дюймовый Lyons TW, Reinhard CT, Planavsky NJ (февраль 2014 г.). «Рост кислорода в раннем океане и атмосфере Земли». Природа . 506 (7488): 307–315. Bibcode : 2014natur.506..307L . doi : 10.1038/nature13068 . PMID 24553238 . S2CID 4443958 .
- ^ Jump up to: а беременный Sahoo SK, Planavsky NJ, Kendall B, Wang X, Shi X, Scott C, et al. (Сентябрь 2012 г.). «Океанская оксигенация после оледенения Мариноан». Природа . 489 (7417): 546–549. Bibcode : 2012natur.489..546s . doi : 10.1038/nature11445 . PMID 23018964 . S2CID 4391882 .
- ^ Jump up to: а беременный Канфилд Д.Е., Поултон С.В., Нарбонн Г.М. (январь 2007 г.). «Поздний неопротерозой глубокоокеанский оксигенация и рост животной жизни» . Наука . 315 (5808): 92–95. Bibcode : 2007sci ... 315 ... 92c . doi : 10.1126/science.1135013 . PMID 17158290 . S2CID 24761414 .
- ^ Jump up to: а беременный в Fike DA, Grotzinger JP, Pratt LM, Summons Re (декабрь 2006 г.). «Окисление океана Эдиакара» . Природа . 444 (7120): 744–747. Bibcode : 2006natur.444..744f . doi : 10.1038/nature05345 . PMID 17151665 . S2CID 4337003 .
- ^ Sánchez-Baracaldo P, Ridgwell A, Raven Ja (март 2014 г.). «Неопротерозойский переход в морском азотном цикле» . Текущая биология . 24 (6): 652–657. Bibcode : 2014cbio ... 24..652s . doi : 10.1016/j.cub.2014.01.041 . PMID 24583016 . S2CID 16756351 .
- ^ Эрвин Д.Х., Лафламм М., Твидт С.М., Сперлинг Е.А., Пизани Д., Петерсон К.Дж. (ноябрь 2011 г.). «Камбрийская загадка: ранняя дивергенция и более поздний экологический успех в ранней истории животных». Наука . 334 (6059): 1091–1097. Bibcode : 2011sci ... 334.1091e . doi : 10.1126/science.1206375 . PMID 22116879 . S2CID 7737847 .
- ^ Poulton SW, Canfield DE (2011). «Жеровизные условия: доминирующая особенность океана через историю Земли». Элементы . 7 (2): 107–112. Bibcode : 2011eleme ... 7..107p . doi : 10.2113/gselents.7.2.107 . S2CID 131561186 .
- ^ Anbar ad, Knoll AH (август 2002 г.). «Протерозойская химия и эволюция океана: бионорганический мост?». Наука . 297 (5584): 1137–1142. Bibcode : 2002sci ... 297.1137a . doi : 10.1126/science.1069651 . PMID 12183619 . S2CID 5578019 .
- ^ Orkwiszewski KG, Kaney AR (июнь 1974 г.). «Генетическая трансформация сине-зеленой бактерии, anacystis nidulans». Archiv für Mikrobiologie . 98 (1): 31–37. Bibcode : 1974mic..98 ... 31o . doi : 10.1007/bf00425265 . PMID 4209657 . S2CID 5635245 .
- ^ Стивенс С.Е., Портер Р.Д. (октябрь 1980 г.). «Трансформация в agnellum Quadruplicatum» . Труды Национальной академии наук Соединенных Штатов Америки . 77 (10): 6052–6056. Bibcode : 1980pnas ... 77.6052s . doi : 10.1073/pnas.77.10.6052 . PMC 350211 . PMID 16592896 .
- ^ Григореев Г., Шестаков С. (1982). «Трансформация в Cyanobacterium synechocystis sp. 6803» . Письма микробиологии FEMS . 13 (4): 367–70. doi : 10.1111/j.1574-6968.1982.tb08289.x .
- ^ Бернштейн Х, Бернштейн С., Мичод Р.Е. (январь 2018 г.). «Секс в микробных патогенах» . Инфекция, генетика и эволюция . 57 : 8–25. Bibcode : 2018infge..57 .... 8b . doi : 10.1016/j.meegid.2017.10.024 . PMID 29111273 .
- ^ Jump up to: а беременный Cassier-Chauvat C, Veaudor T, Chauvat F (2016). «Сравнительная геномика рекомбинации и восстановления ДНК в цианобактериях: биотехнологические последствия» . Границы в микробиологии . 7 : 1809. DOI : 10.3389/fmicb.2016.01809 . PMC 5101192 . PMID 27881980 .
- ^ "LTP" . Получено 23 февраля 2021 года .
- ^ «Дерево LTP_ALL в формате Newick» . Получено 23 февраля 2021 года .
- ^ «LTP_12_2021 Notes» (PDF) . Получено 23 февраля 2021 года .
- ^ "GTDB Release 08-RS214" . База данных таксономии генома . Получено 10 мая 2023 года .
- ^ "BAC120_R214.sp_label" . База данных таксономии генома . Получено 10 мая 2023 года .
- ^ «История таксонов» . База данных таксономии генома . Получено 10 мая 2023 года .
- ^ Найгели С (1857). Каспари Р (ред.). «Отчет о переговорах о 33 -м собрании немецких натуралистов и врачей, проведенных в Бонне с 18 по 24 сентября 1857 года» [Отчет о разбирательстве 33 -й собрания немецких ученых и врачей, состоявшегося в Бонне, со счетом 18 по 24 сентября 1857]. Ботаническая газета . 15 : 749–776.
- ^ Haeckel E (1867). Общая морфология организмов . Реймер, Берлин.
- ^ Чаттон Э (1925). « Panporella perplexa : амебиянка с защищенными спорами паразита с дафниями отражений о биологии и филогении простейших» [ Pansporella perplexa : амебиян с защищенными споры паразит дафнии отражений на биологии и филогении протзоа]. Энн. Наука НАТ Zool . 10 (по -французски). VII : 1–84.
- ^ Jump up to: а беременный Gugger MF, Hoffmann L (март 2004 г.). «Полифили истинные ветвящиеся цианобактерии (stigonematales)» . Международный журнал систематической и эволюционной микробиологии . 54 (Pt 2): 349–357. doi : 10.1099/ijs.0.02744-0 . PMID 15023942 .
- ^ Говард-Аззе М., Шамсейр Л., Шеллхорн Х. Х., Гупта Р.С. (ноябрь 2014 г.). «Филогенетический анализ и молекулярные признаки, определяющие монофилетическую кладу гетероцистических цианобактерий и идентифицирующие его ближайшие родственники». Фотосинтез исследования . 122 (2): 171–185. Bibcode : 2014phore.122..171H . doi : 10.1007/s11120-014-0020-x . PMID 24917519 . S2CID 17745718 .
- ^ Комарек Дж., Каштовский Дж., Мареш Дж., Йохансен младший (2014). "Таксономическая классификация цианопрокариот (цианобактериальные роды) 2014, с использованием и полифазическим подходом (PDF) . Преслия . 86 : 295–335.
- ^ Прингсейм, например (1963). Бесцветные водоросли: вклад в эволюционные исследования [ бесцветные водоросли: вклад в эволюционные исследования ] (на немецком языке). Густав Фишер Верлаг.
- ^ Euzéby JP. « Цианобактерии » . Список прокариотических имен с стоянием в номенклатуре (LPSN) . Получено 22 января 2022 года .
- ^ «Цианобактерии» . Национальный центр биотехнологической информации (NCBI) База данных таксономии . Получено 20 марта 2021 года .
- ^ Kaneko T, Sato S, Kotani H, Tanaka A, Asamizu E, Nakamura Y, et al. (Июнь 1996 г.). «Анализ последовательности генома одноклеточного Cyanobacterium synechocystis sp. Штамм PCC6803. II. Определение последовательности всего генома и присвоение потенциальных областей кодирования белка» . ДНК -исследования . 3 (3): 109–136. doi : 10.1093/dnares/3.3.109 . PMID 8905231 .
- ^ Табей Y, Окада К, Цузуки М (апрель 2007 г.). «SLL1330 контролирует экспрессию гликолитических генов в Synechocystis sp. PCC 6803». Биохимическая и биофизическая исследовательская коммуникация . 355 (4): 1045–1050. doi : 10.1016/j.bbrc.2007.02.065 . PMID 17331473 .
- ^ Rocap G, Larimer FW, Lamerdin J, Malfatti S, Chain P, Ahlgren NA, et al. (Август 2003 г.). «Дивергенция генома в двух экотипах Prochlorococcus отражает дифференцировку океанической ниши» . Природа . 424 (6952): 1042–1047. Bibcode : 2003natur.424.1042R . doi : 10.1038/nature01947 . PMID 12917642 . S2CID 4344597 .
- ^ Dufresne A, Salanoubat M, Partensky F, Artiguenave F, Axmann IM, Barbe V, et al. (Август 2003 г.). «Последовательность генома Cyanobacterium prochlorococcus marinus ss120, почти минимальный оксифотрофный геном» . Труды Национальной академии наук Соединенных Штатов Америки . 100 (17): 10020–10025. Bibcode : 2003pnas..10010020D . doi : 10.1073/pnas.1733211100 . PMC 187748 . PMID 12917486 .
- ^ Herdman M, Janvier M, Rippka R, Stanier Ry (1979). «Размер генома цианобактерий» . Журнал общей микробиологии . 111 : 73–85. doi : 10.1099/00221287-111-1-73 .
- ^ Quintana N, Van der Kooy F, Van de Rhee MD, Voshol GP, Verpoorte R (август 2011 г.). «Возобновляемая энергия от цианобактерий: оптимизация производства энергии с помощью метаболического пути инженерии» . Прикладная микробиология и биотехнология . 91 (3): 471–490. doi : 10.1007/s00253-011-3394-0 . PMC 3136707 . PMID 21691792 .
- ^ Chen X, Lawrence JM, Wey LT, Schertel L, Jing Q, Vignolini S, et al. (Июль 2022 г.). «Электроды матрицы иерархических колонн с 3D-печатью для высокопроизводительного полуамератфиссионного фотосинтеза» . Природные материалы . 21 (7): 811–818. Bibcode : 2022natma..21..811c . doi : 10.1038/s41563-022-01205-5 . PMID 35256790 . S2CID 247255146 .
- ^ «Голубые зеленые бактерии могут помочь генерировать« зеленый »электричество» , индус , 21 июня 2010 г.
- ^ «Joule выигрывает ключевой патент на ГМО Cyanobacteria, которые создают топливо от солнечного света, CO2 и воды: биотопливо дайджест» . 14 сентября 2010 года . Получено 10 августа 2022 года .
- ^ Денг М.Д., Коулман -младший (февраль 1999 г.). «Синтез этанола генной инженерией в цианобактериях» . Прикладная и экологическая микробиология . 65 (2): 523–528. Bibcode : 1999apenm..65..523d . doi : 10.1128/aem.65.2.523-528.1999 . PMC 91056 . PMID 9925577 .
- ^ Liang F, Lindberg P, Lindblad P (20 ноября 2018 г.). «Инженерная фотоавтотрофная фиксация углерода для повышения роста и продуктивности» . Устойчивая энергия и топливо . 2 (12): 2583–2600. doi : 10.1039/c8se00281a .
- ^ Roussou S, Albergati A, Liang F, Lindblad P (июнь 2021 г.). «Инженерные цианобактерии с дополнительной сверхэкспрессией выбранных ферментов Кальвина-Бенсона-Бассума демонстрируют дальнейшее увеличение производства этанола» . Метаболическая инженерная коммуникация . 12 : E00161. doi : 10.1016/j.mec.2021.e00161 . PMC 7820548 . PMID 33520653 . S2CID 231727024 .
- ^ Choi H, Mascuch SJ, Villa FA, Byrum T, Teasdale ME, Smith JE, et al. (Май 2012 г.). «Honaucins AC, мощные ингибиторы воспаления и зондирования бактериального кворума: синтетические производные и взаимосвязь структурной активности» . Химия и биология . 19 (5): 589–598. doi : 10.1016/j.chembiol.2012.03.014 . PMC 3361693 . PMID 22633410 .
- ^ Фришкорн К (19 июня 2017 г.). «Нужно исправить сердечный приступ? Попробуйте фотосинтез» . Смитсоновский институт . Получено 20 мая 2021 года .
- ^ Jeong Y, Cho Sh, Lee H, Choi HK, Kim DM, Lee CG, et al. (Ноябрь 2020 г.). «Текущий статус и будущие стратегии для увеличения производства вторичного метаболита из цианобактерий» . Микроорганизмы . 8 (12): 1849. doi : 10.3390/microorganisms8121849 . PMC 7761380 . PMID 33255283 .
- ^ Newsome AG, Culver CA, Van Breemen RB (июль 2014 г.). «Природная палитра: поиск натуральных синих цветов». Журнал сельскохозяйственной и пищевой химии . 62 (28): 6498–6511. doi : 10.1021/jf501419q . PMID 24930897 .
- ^ Verseux C, Baqué M, Lehto K, De Vera JP, Rothschild LJ , Billi D (2016). «Устойчивая жизненная поддержка на Марсе - потенциальная роль цианобактерий» . Международный журнал астробиологии . 15 (1): 65–92. Bibcode : 2016ijasb..15 ... 65V . doi : 10.1017/s147355041500021x .
- ^ Spolaore P, Joannis-Cassan C, Duran E, Isambert A (февраль 2006 г.). «Коммерческое применение микроводорослей». Журнал биологии и биоинженерии . 101 (2): 87–96. doi : 10.1263/jbb.101.87 . PMID 16569602 . S2CID 16896655 .
- ^ Christaki E, Florou-Paneri P, Bonos E (декабрь 2011 г.). «Микроводоросли: новый ингредиент в питании». Международный журнал пищевых наук и питания . 62 (8): 794–799. doi : 10.3109/09637486.2011.582460 . PMID 21574818 . S2CID 45956239 .
- ^ Ku CS, Pham TX, Park Y, Kim B, Shin MS, Kang I, Lee J (апрель 2013 г.). «Съедобные сине-зеленые водоросли уменьшают выработку провоспалительных цитокинов, ингибируя путь NF-κB в макрофагах и спленоцитах» . Biochimica et Biophysica Acta (BBA) - Общие субъекты . 1830 (4): 2981–2988. doi : 10.1016/j.bbagen.2013.01.018 . PMC 35944481 . PMID 23357040 .
- ^ Мишеркова Л., Шкранкова С., Самки Д., Амброжова Дж., Махал (2012). «Преимущества для здоровья полисахаридов водорослей в питании человека». Достижения в области исследований пищи и питания . 66 : 75–145. Doi : 10.1016/b978-0-12-394597-6.00003-3 . ISBN 978-0-12-394597-6 Полем PMID 22909979 .
- ^ Thebault L, Lesne J, Boutin JP (1995). «[Цианобактерии, их токсины и риски для здоровья]». Тропическая медицина . 55 (4): 375–380. PMID 8830224 .
- ^ Jump up to: а беременный «Сине -зеленые водоросли (цианобактерии) и их токсины - питьевая вода» . 30 мая 2008 г. Архивировано из оригинала 30 мая 2008 года . Получено 10 августа 2022 года .
- ^ «Вредный цветение в озере Атитла, Гватемала» . EarthObservatory.nasa.gov . 3 декабря 2009 г. Получено 10 августа 2022 года . из обсерватории НАСА Земля ,
- ^ Вейрих Калифорния, Миллер Т.Р. (январь 2014 г.). «Пресноводные вредные цветы водорослей: токсины и здоровье детей». Текущие проблемы в детском и подростковом здравоохранении . 44 (1): 2–24. doi : 10.1016/j.cppeds.2013.10.007 . PMID 24439026 .
- ^ «Профессор Линда Лоутон» . rgu-repository.worktribe.com . Получено 25 июня 2021 года .
- ^ Вызывающий абонент Т.А., Дулин Дж.В., Хейни Дж.Ф., Мерби А.Дж., Уэст К.Г., Фаррар Х. и др. (2009). «Кластер амиотрофического бокового склероза в Нью -Гемпшире: возможная роль для цветов токсичных цианобактерий». Амиотрофический боковой склероз . 10 (Suppl 2): 101–108. doi : 10.3109/17482960903278485 . PMID 19929741 . S2CID 35250897 .
- ^ Кокс П.А., Ришер Р., Меткалф Дж.С., Банак С.А., Кодд Г.А., Брэдли В.Г. (2009). «Цианобактерии и воздействие BMAA от пыли в пустыне: возможная связь с спорадической ALS среди ветеранов войны в Персидском заливе». Амиотрофический боковой склероз . 10 (Suppl 2): 109–117. doi : 10.3109/17482960903286066 . PMID 19929742 . S2CID 1748627 .
- ^ Jump up to: а беременный в дюймовый и фон Главный DC (2006). «Цветения токсичных водорослей» (PDF) . Ветеринарный патолог, Южный Перт . Agric.wa.gov.au. Архивировано из оригинала (PDF) 1 декабря 2014 года . Получено 18 ноября 2014 года .
- ^ May V, Baker H (1978). «Снижение токсичных водорослей в фермерских плотинах выпускниками железа». Технический Бык 19 : 1–16.
- ^ Paerl HW, Huisman J (апрель 2008 г.). «Климат. Цветет, как горячо». Наука . 320 (5872): 57–58. doi : 10.1126/science.1155398 . PMID 18388279 . S2CID 142881074 .
- ^ Sitoki L, Kurmayer R, Rott E (июль 2012 г.). «Пространственное изменение композиции Phytoplankton, Biovolume и полученных концентраций микроцистина в заливе Ньянза (озеро Виктория, Кения)» . Гидробиология . 691 (1): 109–122. doi : 10.1007/s10750-012-1062-8 . PMC 3968937 . PMID 24683268 .
- ^ Metcalf JS, Banack SA, Powell JT, Tymm FJ, Murch SJ, Brand LE, Cox PA (2018). «Ответы общественного здравоохранения на токсичные цианобактериальные цветы: перспективы со события во Флориде 2016 года» . Водная политика . 20 (5): 919–932. doi : 10.2166/wp.2018.012 . S2CID 88502303 .
- ^ Jump up to: а беременный в Cavicchioli R, Ripple WJ, Timmis KN, Azam F, Bakken LR, Baylis M, et al. (Сентябрь 2019). «Предупреждение ученых о человечестве: микроорганизмы и изменение климата» . Природные обзоры. Микробиология . 17 (9): 569–586. doi : 10.1038/s41579-019-0222-5 . PMC 7136171 . PMID 31213707 .
 Материал был скопирован из этого источника, который доступен по международной лицензии Creative Commons Attribution 4.0 .
Материал был скопирован из этого источника, который доступен по международной лицензии Creative Commons Attribution 4.0 .
- ^ Visser PM, Verspagen JM, Sandrini G, Stal LJ, Matthijs HC, Davis TW, et al. (Апрель 2016 г.). «Как повышение CO 2 и глобальное потепление могут стимулировать вредные цианобактериальные цветения» . Вредные водоросли . 54 : 145–159. doi : 10.1016/j.hal.2015.12.006 . PMID 28073473 .
- ^ Walsby AE, Hayes PK, Boje R, Stal LJ (июль 1997 г.). «Селективное преимущество плавучести, обеспечиваемого газовыми пузырьками для планктонных цианобактерий в Балтийском море». Новый фитолог . 136 (3): 407–417. doi : 10.1046/j.1469-8137.1997.00754.x . PMID 33863010 .
- ^ Lehman PW, Kurobe T, Lesmeister S, Baxa D, Tung A, Teh SJ (март 2017 г.). «Влияние сильной засухи 2014 года на Bloom Microcystis в устье Сан -Франциско» . Вредные водоросли . 63 : 94–108. Bibcode : 2017halga..63 ... 94L . doi : 10.1016/j.hal.2017.01.011 . PMID 28366405 .
- ^ Jump up to: а беременный Sandrini G, Ji X, Verspagen JM, Tann RP, Slot PC, Luimstra VM, et al. (Август 2016 г.). «Быстрая адаптация вредных цианобактерий к росту CO2» . Труды Национальной академии наук Соединенных Штатов Америки . 113 (33): 9315–9320. Bibcode : 2016pnas..113.9315s . doi : 10.1073/pnas.1602435113 . PMC 4995953 . PMID 27482094 .
Атрибуция
![]() Эта статья включает в себя текст , доступный в соответствии с лицензией CC на 2,5 .
Эта статья включает в себя текст , доступный в соответствии с лицензией CC на 2,5 .
Дальнейшее чтение
[ редактировать ]- Джиллиан С. (1997). Superfood Nature: сине-зеленая революция водорослей (первое изд.). NewLeaf. ISBN 978-0-7522-0569-4 .
- Savage M (1994). Тысячелетний проект: колонизация галактики в восемь простых шагов . Little Brown & Co. ISBN 978-0-316-77163-4 .
- Fogg GE, Stewart WD, Fay P, Walsby AE (1973). Сине-зеленые водоросли . Лондон и Нью -Йорк: академическая пресса . ISBN 978-0-12-261650-1 .
- «Архитекторы атмосферы Земли, Введение в цианобактерии» . Калифорнийский университет, Беркли . 3 февраля 2006 г.
- Уиттон Б.А. (2002). «Phylum cyanophyta (cyanobacteria)». Пресноводная водоросли флора Британских островов . Кембридж: издательство Кембриджского университета . ISBN 978-0-521-77051-4 .
- Пятидесятница А., Франке У (2010). «Фотосинтез и кальцификация строматолитической пресной воды цианобактерии Rivularia » . Европейский журнал Phycology . 45 (4): 345–53. Bibcode : 2010ejphy..45..345p . doi : 10.1080/09670262.2010.492914 .
- Уиттон Б.А., Поттс М, ред. (2000). Экология цианобактерий: их разнообразие во времени и пространстве . Спрингер. ISBN 978-0-7923-4735-4 .
- «От микроалги до голубого масла» . Paristech Review . Декабрь 2011 года. Архивировано с оригинала 17 апреля 2016 года . Получено 2 марта 2012 года .
Внешние ссылки
[ редактировать ]- Что такое цианобактерии и каковы его типы?
- WebServer для исследования Cyanobacteria (архивировано 16 сентября 2019 года)
- Дайвинг антарктической капсулы времени, наполненной изначальной жизнью







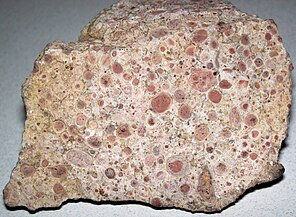

![Cyanobacterial remains of an annulated tubular microfossil Oscillatoriopsis longa [180] Scale bar: 100 μm](http://upload.wikimedia.org/wikipedia/commons/thumb/3/38/Oscillatoriopsis_longa_fossil.jpg/217px-Oscillatoriopsis_longa_fossil.jpg)






