Тетрахлорид селена
| |

| |
| Имена | |
|---|---|
| Название ИЮПАК
Тетрахлорид селена
| |
| Другие имена
Хлорид селена(IV), тетрахлор-λ 4 - Селен
| |
| Идентификаторы | |
3D model ( JSmol )
|
|
| ХимическийПаук | |
| Информационная карта ECHA | 100.030.036 |
| Номер ЕС |
|
ПабХим CID
|
|
| номер РТЭКС |
|
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA )
|
|
| Характеристики | |
| SeCl 4 | |
| Молярная масса | 220.771 g/mol |
| Появление | кристаллы от белого до желтого цвета |
| Плотность | 2,6 г/см 3 , твердый |
| Температура плавления | сублимируется при 191,4 °C [ 1 ] |
| разлагается в воде | |
| Структура | |
| Моноклиника , мС80 | |
| С12/с1, № 15 | |
| Качели (газовая фаза) [ нужна ссылка ] | |
| Опасности [ 2 ] | |
| СГС Маркировка : | |
  
| |
| Опасность | |
| Х301 , Х331 , Х373 , Х410 | |
| P260 , P261 , P264 , P270 , P271 , P273 , P301+P310 , P304+P340 , P311 , P314 , P321 , P330 , P391 , P403+P233 , P405 , P501 | |
| NFPA 704 (огненный алмаз) | |
| точка возгорания | негорючий |
| Родственные соединения | |
Другие анионы
|
Тетрафторид селена Тетрабромид селена диоксид селена |
Другие катионы
|
Оксид дихлора Тетрахлорид серы Тетрахлорид теллура |
Родственные соединения
|
Дихлорид селена |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |
селена представляет собой неорганическое соединение формулы 4 SeCl Тетрахлорид . Это соединение существует в виде летучего твердого вещества от желтого до белого цвета. Это один из двух широко доступных хлоридов селена , другим примером является монохлорид селена Se 2 Cl 2 . SeCl 4 используется в синтезе других соединений селена .
Синтез и структура
[ редактировать ]
Соединение получают селена хлором . обработкой [ 3 ] При нагревании реагирующего селена продукт сублимируется из реакционной колбы. Летучесть тетрахлорида селена можно использовать для очистки селена.
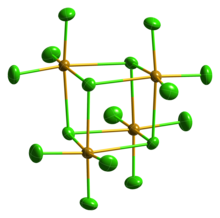
Твердый SeCl 4 на самом деле представляет собой тетрамерный кластер кубанового типа , для которого атом Se октаэдра SeCl 6 расположен в четырех углах куба, а мостиковые атомы Cl - в остальных четырех углах. Мостиковые расстояния Se-Cl длиннее, чем концевые расстояния Se-Cl, но все углы Cl-Se-Cl составляют примерно 90°. [ 4 ]
SeCl 4 часто использовался в качестве примера для обучения VSEPR правилам для гипервалентных молекул . Таким образом, можно было бы предсказать четыре связи, но пять электронных групп, что приводит к геометрии качелей . это явно не так В кристаллической структуре . Другие предположили, что кристаллическую структуру можно представить как SeCl 3 + и Cl − . Эта формулировка предсказывает пирамидальную геометрию SeCl 3 + катион с валентным углом Cl-Se-Cl примерно 109°. Однако эта молекула является прекрасным примером ситуации, когда максимального связывания невозможно достичь с помощью простейшей молекулярной формулы. Образование тетрамера (SeCl 4 ) 4 , [ 5 ] с делокализованной сигма-связью мостикового хлорида явно предпочтительнее «гипервалентной» небольшой молекулы. Газообразный SeCl 4 содержит SeCl 2 и хлор, которые рекомбинируют при конденсации.
Реакции
[ редактировать ]Тетрахлорид селена можно восстановить in situ до дихлорида с помощью трифенилстибина :
- SeCl 4 + SbPh 3 → SeCl 2 + Cl 2 SbPh 3
Тетрахлорид селена реагирует с водой с образованием селенистой и соляной кислот : [ 6 ] [ нужна страница ]
- SeCl 4 + 3 H 2 O → H 2 SeO 3 + 4 HCl
При обработке диоксидом селена образуется оксихлорид селена : [ 6 ] [ нужна страница ]
- SeCl 4 + SeO 2 → 2SeOCl 2
Ссылки
[ редактировать ]- ^ Лиде, Дэвид Р. (1998). Справочник по химии и физике (87 изд.). Бока-Ратон, Флорида: CRC Press. п. 487. ИСБН 0-8493-0594-2 . Проверено 2 июля 2008 г.
- ^ «323527 Селена тетрахлорид» . Сигма-Олдрич . Проверено 2 июля 2008 г.
- ^ Новак, Х.Г.; Саттл, Дж. Ф.; Паркер, МЫ; Кляйнберг, Дж. (1957). «Селен (IV) хлорид». Неорганические синтезы . Том. 5. с. 125. дои : 10.1002/9780470132364.ch33 . ISBN 9780470132364 .
- ^ Кристаллическая структура стабильной модификации SeCl4, Journal of Natural Research, 36b, 1660, 1981.
- ^ Уэллс, Структурная неорганическая химия , пятое изд., Оксфорд, с. 709, ISBN 0-19-855370-6
- ^ Jump up to: а б Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . ISBN 978-0-08-037941-8 .
