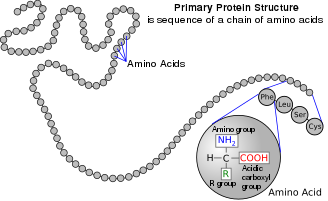
Аминокислота

Аминокислоты — это органические соединения , которые содержат как амино , так и карбоновой кислоты функциональные группы . [1] Хотя в природе существует более 500 аминокислот, наиболее важными являются 22 α-аминокислоты, включенные в белки . [2] Только эти 22 присутствуют в генетическом коде жизни. [3] [4]
Аминокислоты можно классифицировать по расположению основных структурных функциональных групп ( альфа- (α-) , бета- (β-) , гамма- (γ-) аминокислоты и т. д.); другие категории относятся к полярности , ионизации и типу группы боковой цепи ( алифатическая , ациклическая , ароматическая , полярная и т. д.). В виде белков аминокислотные остатки составляют второй по величине компонент ( вода самый крупный — ) мышц и других тканей человека . [5] Помимо своей роли остатков в белках, аминокислоты участвуют в ряде процессов, таких как транспорт нейромедиаторов и биосинтез . Считается, что они сыграли ключевую роль в создании жизни на Земле и ее возникновении . [6]
Аминокислоты официально названы IUPAC - IUBMB Объединенной комиссией по биохимической номенклатуре в соответствии с вымышленной «нейтральной» структурой, показанной на иллюстрации. Например, систематическое название аланина — 2-аминопропановая кислота, исходя из формулы СН 3 -СН(NH 2 )-СООН . Комиссия обосновала этот подход следующим образом: [7]
Приведенные систематические названия и формулы относятся к гипотетическим формам, в которых аминогруппы непротонированы, а карбоксильные группы недиссоциированы. Это соглашение полезно для того, чтобы избежать различных номенклатурных проблем, но его не следует понимать как подразумевающее, что эти структуры представляют собой значительную часть молекул аминокислот.
История
[ редактировать ]Первые несколько аминокислот были обнаружены в начале 1800-х годов. [8] [9] В 1806 году французские химики Луи-Николя Воклен и Пьер Жан Робике соединение выделили из спаржи , которое впоследствии было названо аспарагином — первой открытой аминокислотой. [10] [11] Цистин был открыт в 1810 г. [12] хотя его мономер, цистеин , оставался неоткрытым до 1884 года. [13] [11] [а] Глицин и лейцин были открыты в 1820 году. [14] Последней из 20 распространенных аминокислот был открыт треонин в 1935 году Уильям Камминг Роуз , который также определил незаменимые аминокислоты и установил минимальные суточные потребности во всех аминокислотах для оптимального роста. [15] [16]
Единство химической категории было признано Вюрцем в 1865 г., но он не дал ей особого названия. [17] Первое использование термина «аминокислота» в английском языке датируется 1898 годом. [18] тогда как немецкий термин Aminosäure использовался ранее. [19] Было обнаружено, что белки образуют аминокислоты после ферментативного расщепления или кислотного гидролиза . В 1902 году Эмиль Фишер и Франц Хофмайстер независимо друг от друга предположили, что белки образуются из многих аминокислот, при этом между аминогруппой одной аминокислоты и карбоксильной группой другой образуются связи, в результате чего образуется линейная структура, которую Фишер назвал « пептидом ». [20]
Общая структура
[ редактировать ]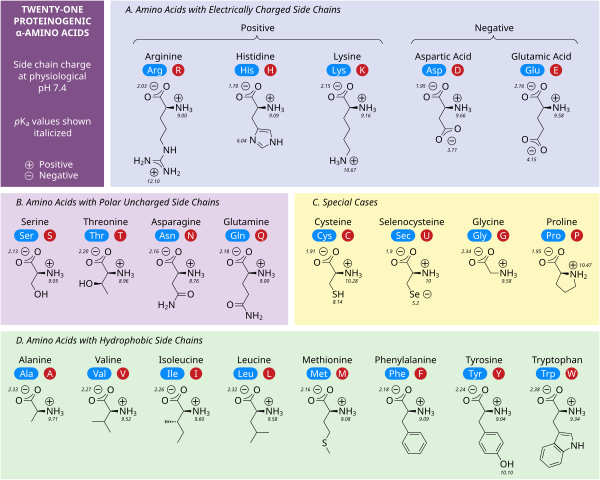
2- , альфа- или α-аминокислоты [21] есть общая формула H 2 NCHRCOOH в большинстве случаев [б] где R представляет собой органический заместитель, известный как « боковая цепь ». [22]
Из многих сотен описанных аминокислот 22 являются протеиногенными («белкостроительными»). [23] [24] [25] Именно эти 22 соединения в совокупности образуют огромное количество пептидов и белков, собираемых рибосомами . [26] Непротеиногенные или модифицированные аминокислоты могут возникать в результате посттрансляционной модификации или во время нерибосомального пептидного синтеза.
Хиральность
[ редактировать ]Атом углерода , расположенный рядом с карбоксильной группой, называется α-углеродом . В протеиногенных аминокислотах он несет амин и группу R или боковую цепь, специфичную для каждой аминокислоты. Имея четыре различных заместителя, α-углерод является стереогенным во всех α-аминокислотах, кроме глицина. Все хиральные протеогенные аминокислоты имеют L- конфигурацию. Это «левые» энантиомеры , которые относятся к стереоизомерам альфа-углерода.
Некоторые D -аминокислоты («правосторонние») обнаружены в природе, например, в бактериальных оболочках , как нейромодулятор ( D - серин ) и в некоторых антибиотиках . [27] [28] Редко остатки D -аминокислоты встречаются в белках и преобразуются из L -аминокислоты в результате посттрансляционной модификации . [29] [с]
Боковые цепи
[ редактировать ]Полярные заряженные боковые цепи
[ редактировать ]Пять аминокислот обладают зарядом при нейтральном pH. Часто эти боковые цепи появляются на поверхности белков, что обеспечивает их растворимость в воде, а боковые цепи с противоположными зарядами образуют важные электростатические контакты, называемые солевыми мостиками , которые поддерживают структуры внутри одного белка или между взаимодействующими белками. [32] Многие белки специфически связывают металл в свои структуры, и эти взаимодействия обычно опосредуются заряженными боковыми цепями, такими как аспартат , глутамат и гистидин . При определенных условиях каждая ионообразующая группа может заряжаться, образуя двойные соли. [33]
Две отрицательно заряженные аминокислоты при нейтральном pH — это аспартат (Asp, D) и глутамат (Glu, E). Анионные карбоксилатные группы ведут себя как основания Бренстеда . в большинстве случаев [32] Ферменты в средах с очень низким pH, такие как аспарагиновая протеаза пепсин в желудках млекопитающих, могут иметь каталитические остатки аспартата или глутамата, которые действуют как кислоты Бренстеда.

Есть три аминокислоты с боковыми цепями, которые при нейтральном pH являются катионами: аргинин (Arg, R), лизин (Lys, K) и гистидин (His, H). Аргинин имеет заряженную гуанидиновую группу, а лизин - заряженную алкиламиногруппу и полностью протонирован при pH 7. Имидазольная группа гистидина имеет pK a 6,0 и протонирована только около 10% при нейтральном pH. Поскольку гистидин легко обнаруживается в основной и сопряженной кислотной формах, он часто участвует в каталитическом переносе протонов в ферментативных реакциях. [32]
Полярные незаряженные боковые цепи
[ редактировать ]Полярные незаряженные аминокислоты серин (Ser, S), треонин (Thr, T), аспарагин (Asn, N) и глютамин (Gln, Q) легко образуют водородные связи с водой и другими аминокислотами. [32] Они не ионизируются в нормальных условиях, за исключением каталитического серина в сериновых протеазах . Это пример сильного возмущения, не характерного для остатков серина в целом. Треонин имеет два хиральных центра: не только хиральный центр L (2S ) при α-углероде, общий для всех аминокислот, кроме ахирального глицина, но также (3R ) при β-углероде. Полная стереохимическая характеристика: ( 2S , 3R ) -L - треонин .
Гидрофобные боковые цепи
[ редактировать ]Неполярные аминокислотные взаимодействия являются основной движущей силой процессов, которые сворачивают белки в их функциональные трехмерные структуры. [32] Ни одна из боковых цепей этих аминокислот не ионизируется легко и, следовательно, не имеет pK a s, за исключением тирозина (Tyr, Y). Гидроксил тирозина может депротонироваться при высоком pH, образуя отрицательно заряженный фенолят. По этой причине тирозин можно было бы отнести к категории полярных незаряженных аминокислот, но его очень низкая растворимость в воде хорошо соответствует характеристикам гидрофобных аминокислот.
Боковые цепи для особых случаев
[ редактировать ]Некоторые боковые цепи плохо описываются заряженными, полярными и гидрофобными категориями. Глицин (Gly, G) можно считать полярной аминокислотой, поскольку его небольшой размер означает, что его растворимость в значительной степени определяется амино- и карбоксилатными группами. Однако отсутствие какой-либо боковой цепи придает глицину уникальную гибкость среди аминокислот с большими разветвлениями при сворачивании белка. [32] Цистеин (Cys, C) также может легко образовывать водородные связи, что относит его к категории полярных аминокислот, хотя его часто можно обнаружить в белковых структурах, образующих ковалентные связи, называемые дисульфидными связями , с другими цистеинами. Эти связи влияют на сворачивание и стабильность белков и необходимы для образования антител . Пролин (Pro, P) имеет алкильную боковую цепь и может считаться гидрофобным, но поскольку боковая цепь снова присоединяется к альфа-аминогруппе, она становится особенно негибкой при включении в белки. Подобно глицину, он влияет на структуру белка уникальным образом среди аминокислот. Селеноцистеин (Sec, U) — редкая аминокислота, не кодируемая напрямую ДНК, но включающаяся в белки через рибосому. Селеноцистеин имеет более низкий окислительно-восстановительный потенциал по сравнению с аналогичным цистеином и участвует в нескольких уникальных ферментативных реакциях. [34] Пирролизин (Pyl, O) — еще одна аминокислота, не кодируемая в ДНК, но синтезируемая в белок рибосомами. [35] Он обнаружен у видов архей, где участвует в каталитической активности нескольких метилтрансфераз.
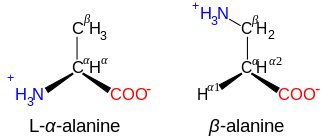
β- и γ-аминокислоты
[ редактировать ]Аминокислоты со структурой NH + 3 -CXY-CXY-CO - 2 , такие как β-аланин , компонент карнозина и некоторые другие пептиды, представляют собой β-аминокислоты. Те, у кого есть структура NH + 3 -CXY-CXY-CXY-CO - 2 – γ-аминокислоты и т. д., где X и Y – два заместителя (один из которых обычно H). [7]
Цвиттерионы
[ редактировать ]
Распространенные природные формы аминокислот имеют цвиттер-ионную структуру. −NH + 3 ( −NH + 2 − в случае пролина) и -CO - 2 функциональные группы прикреплены к одному и тому же атому C и, таким образом, представляют собой α-аминокислоты и являются единственными, которые обнаруживаются в белках во время трансляции в рибосоме.В водном растворе при pH, близком к нейтральному, аминокислоты существуют в виде цвиттер-ионов , т.е. в виде диполярных ионов с обоими НХ + 3 и CO − 2 в заряженном состоянии, поэтому общая структура имеет вид NH + 3 -CHR-CO - 2 . При физиологическом pH возникают так называемые «нейтральные формы». -NH 2 -CHR-CO 2 H не присутствуют в какой-либо измеримой степени. [36] Хотя два заряда в структуре цвиттер-иона в сумме равны нулю, ошибочно называть вид с нулевым чистым зарядом «незаряженным».
В сильнокислых условиях (рН ниже 3) карбоксилатная группа протонируется и структура становится аммонийно-карбоновой кислотой. NH + 3 -CHR-CO 2 Ч . Это актуально для таких ферментов, как пепсин, которые активны в кислой среде, например, в желудке и лизосомах млекопитающих , но не применимо в значительной степени к внутриклеточным ферментам. В сильноосновных условиях (рН более 10, что обычно не наблюдается в физиологических условиях) аммониевая группа депротонируется с образованием NH 2 -CHR-CO - 2 .
Хотя в химии используются различные определения кислот и оснований, единственное, что полезно для химии в водных растворах, — это определение Брёнстеда : [37] [38] кислота — это вид, который может отдать протон другому виду, а основание — это тот, который может принять протон. Этот критерий используется для обозначения групп на рисунке выше. Карбоксилатные боковые цепи остатков аспартата и глутамата являются основными бренстедовскими основаниями в белках. Аналогично, лизин, тирозин и цистеин обычно действуют как кислота Бренстеда. Гистидин в этих условиях может действовать как кислота Бренстеда, так и основание.
Изоэлектрическая точка
[ редактировать ]
Для аминокислот с незаряженными боковыми цепями цвиттер-ион преобладает при значениях pH между двумя значениями p K a , но сосуществует в равновесии с небольшими количествами чистых отрицательных и чистых положительных ионов. В средней точке между двумя значениями p K a следовые количества чистых отрицательных и следовые количества чистых отрицательных ионов уравновешиваются, так что средний чистый заряд всех присутствующих форм равен нулю. [39] Этот pH известен как изоэлектрическая точка p I , поэтому p I = 1/2 + ( p K a1 p K a2 ).
Для аминокислот с заряженными боковыми цепями участвует p K a боковой цепи. Таким образом, для аспартата или глутамата с отрицательными боковыми цепями концевая аминогруппа практически полностью находится в заряженной форме. −NH + 3 , но этот положительный заряд должен быть уравновешен состоянием, в котором только одна С-концевая карбоксилатная группа заряжена отрицательно. Это происходит на полпути между двумя значениями карбоксилата p K a : p I = 1/2 + a ( (p K a1 p K R) ), где p K a(R) — боковая цепь p K a . [38]
Аналогичные соображения применимы и к другим аминокислотам с ионизируемыми боковыми цепями, включая не только глутамат (похожий на аспартат), но также цистеин, гистидин, лизин, тирозин и аргинин с положительными боковыми цепями.
Аминокислоты имеют нулевую подвижность при электрофорезе в своей изоэлектрической точке, хотя это поведение чаще используется для пептидов и белков, чем для отдельных аминокислот. Цвиттер-ионы имеют минимальную растворимость в своей изоэлектрической точке, а некоторые аминокислоты (в частности, с неполярными боковыми цепями) можно выделить осаждением из воды, доведя pH до необходимой изоэлектрической точки.
Физико-химические свойства
[ редактировать ]20 канонических аминокислот можно классифицировать по их свойствам. Важными факторами являются заряд, гидрофильность или гидрофобность , размер и функциональные группы. [28] Эти свойства влияют на структуру белка и белок-белковые взаимодействия . Водорастворимые белки имеют тенденцию иметь гидрофобные остатки ( Leu , Ile , Val , Phe и Trp ), захороненные в середине белка, тогда как гидрофильные боковые цепи подвергаются воздействию водного растворителя. (В биохимии остаток» относится к определенному мономеру в полимерной термин « цепи полисахарида , белка или нуклеиновой кислоты .) Интегральные мембранные белки имеют тенденцию иметь внешние кольца из открытых гидрофобных аминокислот, которые закрепляют их в липидном бислое . Некоторые периферические мембранные белки имеют на поверхности участок гидрофобных аминокислот, который прилипает к мембране. Подобным образом белки, которые должны связываться с положительно заряженными молекулами, имеют поверхности, богатые отрицательно заряженными аминокислотами, такими как глутамат и аспартат , тогда как белки, связывающиеся с отрицательно заряженными молекулами, имеют поверхности, богатые положительно заряженными аминокислотами, такими как лизин и аргинин . Например, лизин и аргинин присутствуют в больших количествах в области низкой сложности белков, связывающих нуклеиновые кислоты. [40] Существуют различные шкалы гидрофобности аминокислотных остатков. [41]
Некоторые аминокислоты обладают особыми свойствами. Цистеин может образовывать ковалентные дисульфидные связи с другими остатками цистеина. Пролин образует цикл с основной цепью полипептида, а глицин более гибок, чем другие аминокислоты.
Глицин и пролин широко присутствуют в областях низкой сложности как эукариотических, так и прокариотических белков, тогда как обратное имеет место с цистеином, фенилаланином, триптофаном, метионином, валином, лейцином, изолейцином, которые являются высокореактивными, комплексными или гидрофобными. [40] [42] [43]
Многие белки подвергаются ряду посттрансляционных модификаций , в результате которых к боковым цепям аминокислотных остатков присоединяются дополнительные химические группы, иногда с образованием липопротеинов (которые являются гидрофобными). [44] или гликопротеины (гидрофильные) [45] позволяя белку временно прикрепиться к мембране. Например, сигнальный белок может прикрепляться к клеточной мембране, а затем отделяться от нее, поскольку он содержит остатки цистеина, к которым может быть добавлена жирная кислота пальмитиновая кислота , а затем удалена. [46]
Таблица стандартных сокращений и свойств аминокислот
[ редактировать ]Хотя в таблицу включены однобуквенные символы, IUPAC–IUBMB рекомендует [7] что «использование однобуквенных символов должно быть ограничено сравнением длинных последовательностей».
Однобуквенное обозначение было выбрано IUPAC-IUB на основе следующих правил: [47]
- Там, где нет двусмысленности, используются начальные буквы: C цистеин, H гистидин, I изолейцин, М метионин, S серин, V валин, [47]
- Там, где необходимо произвольное назначение, приоритет отдается структурно более простым аминокислотам: A аланин, G глицин, L лейцин, P пролин, T треонин, [47]
- F PH энилаланин и R a R гинин назначаются фонетически наводящими на размышления, [47]
- Триптофан W присвоен на основании двойного кольца, визуально напоминающего громоздкую букву W. [47]
- K-лизин и Y-тирозин обозначены как ближайшие к своим инициалам L и T в алфавитном порядке (обратите внимание, что U избегали из-за его сходства с V, а X был зарезервирован для неопределенных или атипичных аминокислот); для тирозина также было предложено мнемоническое обозначение t Y розин, [48]
- D-аспартат был назначен произвольно, с предложенным мнемоническим обозначением аспаровая диковая кислота; [49] Глутамат Е был присвоен в алфавитной последовательности, крупнее всего на одну метиленовую группу –CH2–, [48]
- N аспарагин был назначен произвольно, с предложенной мнемоникой аспарагин N e; [49] Q-глутамин был назначен в алфавитной последовательности из тех, что все еще доступны (обратите внимание еще раз, что O избегали из-за сходства с D), с предложенной мнемоникой Q- лютамин. [49]
| Аминокислота | 3- и 1-буквенные символы | Боковая цепь | Гидропатия индекс [50] | Молярная поглощающая способность [51] | Молекулярная масса | Изобилие в белки (%) [52] | Стандартное генетическое кодирование, Обозначение ИЮПАК | ||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 3 | 1 | Сорт | Химическая полярность [53] | Чистая стоимость при pH 7,4 [53] | Длина волны, λ макс (нм) | Коэффициент ε (мМ −1 ·см −1 ) | |||||
| Аланин | Земля | А | Алифатический | Неполярный | Нейтральный | 1.8 | 89.094 | 8.76 | GCN | ||
| Аргинин | Арг | Р | Фиксированный катион | Базовая полярная | Позитивный | −4.5 | 174.203 | 5.78 | MGR, CGY [54] | ||
| Аспарагин | Асн | Н | Амид | Полярный | Нейтральный | −3.5 | 132.119 | 3.93 | ДА | ||
| Аспартат | Асп | Д | Анион | База Бренстеда | Отрицательный | −3.5 | 133.104 | 5.49 | ГЕЙ | ||
| Цистеин | Цис | С | Тиол | Бренстедовская кислота | Нейтральный | 2.5 | 250 | 0.3 | 121.154 | 1.38 | БИЗНЕС |
| Глютамин | Глн | вопрос | Амид | Полярный | Нейтральный | −3.5 | 146.146 | 3.9 | МАШИНА | ||
| Глутамат | Глу | И | Анион | База Бренстеда | Отрицательный | −3.5 | 147.131 | 6.32 | ДАЖЕ | ||
| Глицин | Глай | Г | Алифатический | Неполярный | Нейтральный | −0.4 | 75.067 | 7.03 | ГГН | ||
| Гистидин | Его | ЧАС | катионный | Кислота и основание Бренстеда | Позитивные, 10% Нейтральный, 90% | −3.2 | 211 | 5.9 | 155.156 | 2.26 | ПРЯНЫЙ |
| изолейцин | С | я | Алифатический | Неполярный | Нейтральный | 4.5 | 131.175 | 5.49 | АУХ | ||
| Лейцин | Лео | л | Алифатический | Неполярный | Нейтральный | 3.8 | 131.175 | 9.68 | YUR, CUY [55] | ||
| Лизин | Свет | К | Катион | Бренстедовская кислота | Позитивный | −3.9 | 146.189 | 5.19 | ГОД | ||
| Метионин | Из | М | Тиоэфир | Неполярный | Нейтральный | 1.9 | 149.208 | 2.32 | АВГ | ||
| Фенилаланин | Пхе | Ф | Ароматный | Неполярный | Нейтральный | 2.8 | 257, 206, 188 | 0.2, 9.3, 60.0 | 165.192 | 3.87 | УУЙ |
| Пролин | Про | П | Циклический | Неполярный | Нейтральный | −1.6 | 115.132 | 5.02 | CCN | ||
| Серин | Быть | С | Гидроксильный | Полярный | Нейтральный | −0.8 | 105.093 | 7.14 | УХН, МОЗГ | ||
| Треонин | чр | Т | Гидроксильный | Полярный | Нейтральный | −0.7 | 119.119 | 5.53 | АКС | ||
| Триптофан | Трп | В | Ароматный | Неполярный | Нейтральный | −0.9 | 280, 219 | 5.6, 47.0 | 204.228 | 1.25 | Угги |
| Тирозин | Тир | И | Ароматный | Бренстедовская кислота | Нейтральный | −1.3 | 274, 222, 193 | 1.4, 8.0, 48.0 | 181.191 | 2.91 | УАЙ |
| Валин | Вал | V | Алифатический | Неполярный | Нейтральный | 4.2 | 117.148 | 6.73 | ПИСТОЛЕТ | ||
Две дополнительные аминокислоты у некоторых видов кодируются кодонами , которые обычно интерпретируются как стоп-кодоны :
| 21-я и 22-я аминокислоты | 3-буквенный | 1 буква | Молекулярная масса |
|---|---|---|---|
| Селеноцистеин | сек. | В | 168.064 |
| Пирролизин | Pyl | ТО | 255.313 |
Помимо конкретных кодов аминокислот, заполнители используются в тех случаях, когда химический или кристаллографический анализ пептида или белка не может окончательно определить идентичность остатка. Они также используются для обобщения консервативных белковых последовательностей мотивов . Использование одиночных букв для обозначения наборов подобных остатков аналогично использованию кодов сокращений для вырожденных оснований . [56] [57]
| Неоднозначные аминокислоты | 3-буквенный | 1 буква | Аминокислоты в составе | Кодоны включены |
|---|---|---|---|---|
| Любой/неизвестный | Да | Х | Все | ННН |
| Аспарагин или аспартат | Аскс | Б | Д, Н | РЭЙ |
| Глютамин или глутамат | Глкс | С | Э, Кью | САР |
| Лейцин или изолейцин | Хле | Дж | я, л | YTR, ATH, CTY [58] |
| гидрофобный | Ф | В, И, Л, Ж, Ж, Й, М | НТН, ТАЙ, ТГГ | |
| Ароматный | Ой | Ф, Ш, Ю, Ч | YWY, TTY, TGG [59] | |
| Алифатические (неароматические) | P.S. | V, I, L, M | ВТН, ТТР [60] | |
| Маленький | п | П, Г, А, С | БКН, РГИ, ГГР | |
| гидрофильный | г | С, Т, Ч, Н, Q, Е, D, К, Р | ФУРГОН, WCN, CGN, МОЗГ [61] | |
| Положительно заряженный | + | К, Р, Ч | ARR, CRY, CGR | |
| Отрицательно заряженный | − | Д, Э | ОДНАКО |
Unk иногда используется вместо Xaa , но это менее стандартно.
Ter или * (от терминации) используются в обозначениях мутаций в белках, когда возникает стоп-кодон. Он вообще не соответствует никакой аминокислоте. [62]
Кроме того, многие нестандартные аминокислоты имеют определенный код. Например, некоторые пептидные препараты, такие как бортезомиб и MG132 , синтезированы искусственно и сохраняют свои защитные группы , имеющие специфические коды. Бортезомиб представляет собой Pyz -Phe-boroLeu, а MG132 представляет собой Z -Leu-Leu-Leu-al. Для анализа структуры белка фотореактивные аналоги аминокислот доступны . К ним относятся фотолейцин ( pLeu ) и фотометионин ( pMet ). [63]
Возникновение и функции в биохимии
[ редактировать ]Протеиногенные аминокислоты
[ редактировать ]Аминокислоты являются предшественниками белков. [26] Они соединяются в результате реакций конденсации с образованием коротких полимерных цепей, называемых пептидами, или более длинных цепей, называемых полипептидами или белками. Эти цепи линейные и неразветвленные, причем каждый аминокислотный остаток внутри цепи присоединен к двум соседним аминокислотам. В природе процесс создания белков, кодируемых генетическим материалом РНК, называется трансляцией и включает поэтапное добавление аминокислот к растущей белковой цепи с помощью рибозима , называемого рибосомой . [64] Порядок добавления аминокислот считывается через генетический код с матрицы мРНК , которая представляет собой РНК, организма полученную из одного из генов .
Двадцать две аминокислоты естественным образом включены в полипептиды и называются протеиногенными или природными аминокислотами. [28] Из них 20 кодируются универсальным генетическим кодом. Остальные два, селеноцистеин и пирролизин , включаются в белки с помощью уникальных синтетических механизмов. Селеноцистеин включается, когда транслируемая мРНК включает элемент SECIS , который заставляет кодон UGA кодировать селеноцистеин вместо стоп-кодона. [65] Пирролизин используется некоторыми метаногенными архей в ферментах, которые они используют для производства метана . Он кодируется кодоном UAG, который обычно является стоп-кодоном у других организмов. [66]
Несколько независимых эволюционных исследований показали, что Gly, Ala, Asp, Val, Ser, Pro, Glu, Leu, Thr могут принадлежать к группе аминокислот, составлявших ранний генетический код, тогда как Cys, Met, Tyr, Trp, His, Phe может принадлежать к группе аминокислот, которые позднее стали дополнениями к генетическому коду. [67] [68] [69]
Стандартные и нестандартные аминокислоты
[ редактировать ]20 аминокислот, которые кодируются непосредственно кодонами универсального генетического кода, называются стандартными или каноническими аминокислотами. Модифицированная форма метионина ( N -формилметионин ) часто включается вместо метионина в качестве исходной аминокислоты белков бактерий, митохондрий и пластид (включая хлоропласты). Остальные аминокислоты называются нестандартными или неканоническими . Большинство нестандартных аминокислот также непротеиногенны (т.е. не могут быть включены в белки во время трансляции), но две из них являются протеиногенными, поскольку могут быть включены в белки трансляционно, используя информацию, не закодированную в универсальном генетическом коде.
Двумя нестандартными протеиногенными аминокислотами являются селеноцистеин (присутствует у многих неэукариот, а также у большинства эукариот, но не кодируется непосредственно ДНК) и пирролизин (обнаружен только у некоторых архей и по крайней мере у одной бактерии ). Включение этих нестандартных аминокислот встречается редко. Например, 25 белков человека включают в свою первичную структуру селеноцистеин. [70] а структурно охарактеризованные ферменты (селеноферменты) используют селеноцистеин в качестве каталитического фрагмента в своих активных центрах. [71] Пирролизин и селеноцистеин кодируются вариантными кодонами. Например, селеноцистеин кодируется стоп-кодоном и элементом SECIS . [72] [73] [74]
N -формилметионин (который часто является исходной аминокислотой белков бактерий, митохондрий и хлоропластов ) обычно рассматривается как форма метионина , а не как отдельная протеиногенная аминокислота. Не встречающиеся в природе комбинации кодон- тРНК также могут быть использованы для «расширения» генетического кода и образования новых белков, известных как аллопротеины, включающих непротеиногенные аминокислоты . [75] [76] [77]
Непротеиногенные аминокислоты
[ редактировать ]Помимо 22 протеиногенных аминокислот , известны многие непротеиногенные аминокислоты. Они либо не содержатся в белках (например, карнитин , ГАМК , левотироксин ), либо не производятся напрямую и изолированно стандартными клеточными механизмами. Например, гидроксипролин синтезируется из пролина . Другой пример — селенометионин ).
Непротеиногенные аминокислоты, содержащиеся в белках, образуются путем посттрансляционной модификации . Такие модификации могут также определять локализацию белка, например, добавление длинных гидрофобных групп может привести к связыванию белка с фосфолипидной мембраной. [78] Примеры:
- карбоксилирование , глутамата кальция позволяет лучше катионы связывать [79]
- Гидроксипролин , образующийся в результате гидроксилирования пролина , является основным компонентом соединительной ткани коллагена . [80]
- Гипузин в факторе инициации трансляции EIF5A содержит модификацию лизина. [81]
Некоторые непротеиногенные аминокислоты не встречаются в белках. Примеры включают 2-аминоизомасляную кислоту и нейротрансмиттер гамма-аминомасляную кислоту . Непротеиногенные аминокислоты часто встречаются в качестве промежуточных продуктов в метаболических путях стандартных аминокислот – например, орнитин и цитруллин встречаются в цикле мочевины аминокислот , являющемся частью катаболизма (см. ниже). [82] Редким исключением из доминирования α-аминокислот в биологии является β-аминокислота бета-аланин (3-аминопропановая кислота), которая используется растениями и микроорганизмами при синтезе пантотеновой кислоты (витамина В 5 ), компонента коэнзим А. [83]
В питании млекопитающих
[ редактировать ]
Аминокислоты не являются типичным компонентом пищи: животные питаются белками. В процессе пищеварения белок расщепляется на аминокислоты. Затем они используются для синтеза новых белков и других биомолекул или окисляются до мочевины и углекислого газа в качестве источника энергии. [84] Путь окисления начинается с удаления аминогруппы трансаминазой ; аминогруппа затем подается в цикл мочевины . Другим продуктом трансамидирования является кетокислота , вступающая в цикл лимонной кислоты . [85] Глюкогенные аминокислоты также могут превращаться в глюкозу посредством глюконеогенеза . [86]
Из 20 стандартных аминокислот девять ( His , Ile , Leu , Lys , Met , Phe , Thr , Trp и Val ) называются незаменимыми аминокислотами, поскольку организм человека не может синтезировать их из других соединений на уровне, необходимом для нормального роста. поэтому их необходимо получать из пищи. [87] [88] [89]
Полунезаменимые и условно незаменимые аминокислоты и потребности подростков
[ редактировать ]Кроме того, цистеин, тирозин и аргинин считаются полунезаменимыми аминокислотами, а таурин — полунезаменимой аминосульфоновой кислотой у детей. Некоторые аминокислоты условно незаменимы для определенного возраста или состояния здоровья. Незаменимые аминокислоты также могут варьироваться от вида к виду. [д] Метаболические пути, синтезирующие эти мономеры, еще не полностью развиты. [90] [91]
Небелковые функции
[ редактировать ]Многие протеиногенные и непротеиногенные аминокислоты выполняют биологические функции, помимо того, что они являются предшественниками белков и пептидов. У человека аминокислоты также играют важную роль в различных путях биосинтеза. Для защиты растений от травоядных животных иногда используются аминокислоты. [95] Примеры:
Стандартные аминокислоты
[ редактировать ]- Триптофан является предшественником нейромедиатора серотонина . [96]
- Тирозин (и его предшественник фенилаланин) являются предшественниками катехоламиновых нейротрансмиттеров дофамина , адреналина и норадреналина , а также различных следовых аминов .
- Фенилаланин является предшественником фенэтиламина и тирозина в организме человека. В растениях он является предшественником различных фенилпропаноидов , которые играют важную роль в метаболизме растений.
- Глицин является предшественником порфиринов, таких как гем . [97]
- Аргинин является предшественником оксида азота . [98]
- Орнитин и S -аденозилметионин являются предшественниками полиаминов . [99]
- Аспартат , глицин и глутамин являются предшественниками нуклеотидов . [100] Однако не все функции других распространенных нестандартных аминокислот известны.
Роль нестандартных аминокислот
[ редактировать ]- Карнитин используется в транспорте липидов .
- гамма-аминомасляная кислота является нейромедиатором. [101]
- 5-HTP (5-гидрокситриптофан) используется для экспериментального лечения депрессии. [102]
- L -ДОФА ( L -дигидроксифенилаланин) для лечения болезни Паркинсона , [103]
- Эфлорнитин ингибирует орнитиндекарбоксилазу и используется при лечении сонной болезни . [104]
- Канаванин , аналог аргинина, обнаруженный во многих бобовых, является антифидантом , защищающим растение от хищников. [105]
- Мимозин, содержащийся в некоторых бобовых, является еще одним возможным антифидантом . [106] Это соединение является аналогом тирозина и может отравить животных, пасущихся на этих растениях.
Использование в промышленности
[ редактировать ]Корма для животных
[ редактировать ]Аминокислоты иногда добавляют в корм для животных , поскольку некоторые компоненты этих кормов, такие как соевые бобы , содержат низкие уровни некоторых незаменимых аминокислот , особенно лизина, метионина, треонина и триптофана. [107] Аналогичным образом аминокислоты используются для хелатирования катионов металлов с целью улучшения усвоения минералов из кормовых добавок. [108]
Еда
[ редактировать ]Пищевая промышленность является крупным потребителем аминокислот, особенно глутаминовой кислоты , которая используется в качестве усилителя вкуса . [109] и аспартам (1-метиловый эфир аспартилфенилаланина), который используется в качестве искусственного подсластителя . [110] Аминокислоты иногда добавляются в пищу производителями для облегчения симптомов дефицита минералов, таких как анемия, за счет улучшения усвоения минералов и уменьшения негативных побочных эффектов от приема неорганических минеральных добавок. [111]
Химические строительные блоки
[ редактировать ]Аминокислоты представляют собой недорогое сырье, используемое в синтезе хиральных пулов в качестве энантиомерно чистых строительных блоков. [112] [113]
Аминокислоты используются при синтезе некоторых косметических средств . [107]
Желаемое использование
[ редактировать ]Удобрения
[ редактировать ]Хелатирующая . способность аминокислот иногда используется в удобрениях для облегчения доставки минералов к растениям с целью устранения дефицита минералов, такого как хлороз железа Эти удобрения также используются для предотвращения возникновения недостатков и для улучшения общего состояния растений. [114]
Биоразлагаемые пластики
[ редактировать ]Аминокислоты рассматривались как компоненты биоразлагаемых полимеров, которые находят применение в качестве экологически чистой упаковки, а также в медицине для доставки лекарств и изготовления протезных имплантатов . [115] Интересным примером таких материалов является полиаспартат , водорастворимый биоразлагаемый полимер, который может найти применение в одноразовых подгузниках и сельском хозяйстве. [116] Благодаря своей растворимости и способности хелатировать ионы металлов полиаспартат также используется в качестве биоразлагаемого средства против накипи и ингибитора коррозии . [117] [118]
Синтез
[ редактировать ]
Химический синтез
[ редактировать ]Коммерческое производство аминокислот обычно основано на мутантных бактериях, которые перепроизводят отдельные аминокислоты, используя глюкозу в качестве источника углерода. Некоторые аминокислоты производятся путем ферментативного превращения синтетических промежуточных продуктов. 2-аминотиазолин-4-карбоновая кислота является промежуточным продуктом в одном промышленном синтезе L -цистеина Например, . Аспарагиновую кислоту получают добавлением аммиака к фумарату с помощью лиазы. [111]
Биосинтез
[ редактировать ]В растениях азот сначала усваивается в органические соединения в виде глутамата , образующегося из альфа-кетоглутарата и аммиака в митохондриях. Что касается других аминокислот, растения используют трансаминазы для перемещения аминогруппы от глутамата к другой альфа-кетокислоте. Например, аспартатаминотрансфераза превращает глутамат и оксалоацетат в альфа-кетоглутарат и аспартат. [119] Другие организмы также используют трансаминазы для синтеза аминокислот.
Нестандартные аминокислоты обычно образуются путем модификации стандартных аминокислот. Например, гомоцистеин образуется путем транссульфурации или деметилирования метионина через промежуточный метаболит S -аденозилметионин . [120] в то время как производится посттрансляционной модификацией пролина гидроксипролин . [121]
Микроорганизмы и растения синтезируют множество редких аминокислот. Например, некоторые микробы производят 2-аминоизомасляную кислоту и лантионин , который представляет собой производное аланина с сульфидными мостиками. Обе эти аминокислоты содержатся в пептидных лантибиотиках, таких как аламетицин . [122] Однако в растениях 1-аминоциклопропан-1-карбоновая кислота представляет собой небольшую дизамещенную циклическую аминокислоту, которая является промежуточным продуктом в производстве растительного гормона этилена . [123]
Первичный синтез
[ редактировать ]Предполагается, что образование аминокислот и пептидов предшествует и, возможно, вызывает появление жизни на Земле . Аминокислоты могут образовываться из простых предшественников в различных условиях. [124] Поверхностный химический метаболизм аминокислот и очень небольших соединений мог привести к накоплению аминокислот, коферментов и небольших молекул углерода на основе фосфатов. [125] [ необходимы дополнительные ссылки ] Аминокислоты и подобные строительные блоки могли бы быть преобразованы в протопептиды , причем пептиды считаются ключевыми игроками в зарождении жизни. [126]
В знаменитом эксперименте Юри-Миллера при прохождении электрической дуги через смесь метана, водорода и аммиака образуется большое количество аминокислот. С тех пор ученые открыли ряд способов и компонентов, с помощью которых могло происходить потенциально пребиотическое образование и химическая эволюция пептидов, таких как конденсирующие агенты, конструкция самореплицирующихся пептидов и ряд неферментативных механизмов, с помощью которых аминокислоты кислоты могли возникнуть и превратиться в пептиды. [126] Несколько гипотез ссылаются на синтез Стрекера, посредством которого цианистый водород, простые альдегиды, аммиак и вода производят аминокислоты. [124]
Согласно обзору, аминокислоты и даже пептиды «довольно регулярно обнаруживаются в различных экспериментальных бульонах , которые разрешено готовить из простых химикатов. Это потому, что нуклеотиды гораздо труднее синтезировать химическим путем, чем аминокислоты». В хронологическом порядке это предполагает, что должен был существовать «белковый мир» или, по крайней мере, «полипептидный мир», за которым, возможно, позже последовали « мир РНК » и « мир ДНК ». [127] Картирование кодонов и аминокислот может быть биологической информационной системой, лежащей в основе первобытного зарождения жизни на Земле. [128] Хотя аминокислоты и, следовательно, простые пептиды должны были образоваться при различных экспериментально исследованных геохимических сценариях, переход от абиотического мира к первым формам жизни в значительной степени все еще не решен. [129]
Реакции
[ редактировать ]Аминокислоты подвергаются реакциям, ожидаемым от составляющих их функциональных групп. [130] [131]
Образование пептидной связи
[ редактировать ]
Поскольку как аминная, так и карбоксильная группы аминокислот могут вступать в реакцию с образованием амидных связей, одна молекула аминокислоты может вступать в реакцию с другой и соединяться посредством амидной связи. Эта полимеризация аминокислот и создает белки. Эта реакция конденсации дает вновь образованную пептидную связь и молекулу воды. В клетках эта реакция не происходит напрямую; вместо этого аминокислота сначала активируется путем присоединения к молекуле транспортной РНК через сложноэфирную связь. Эта аминоацил-тРНК образуется в результате АТФ -зависимой реакции, осуществляемой аминоацил-тРНК-синтетазой . [132] Эта аминоацил-тРНК затем является субстратом для рибосомы, которая катализирует атаку аминогруппы удлиняющейся белковой цепи на сложноэфирную связь. [133] В результате этого механизма все белки, образуемые рибосомами, синтезируются, начиная с их N -конца и продвигаясь к их С -концу.
Однако не все пептидные связи образуются таким образом. В некоторых случаях пептиды синтезируются специфическими ферментами. Например, трипептид глутатион является важной частью защиты клеток от окислительного стресса. Этот пептид синтезируется в два этапа из свободных аминокислот. [134] На первом этапе гамма-глутамилцистеинсинтетаза конденсирует цистеин и глутамат посредством пептидной связи, образующейся между карбоксилом боковой цепи глутамата (гамма-углерод этой боковой цепи) и аминогруппой цистеина. Этот дипептид затем конденсируется с глицином под действием глутатионсинтетазы с образованием глутатиона. [135]
В химии пептиды синтезируют с помощью множества реакций. Один из наиболее часто используемых в твердофазном синтезе пептидов использует ароматические оксимные производные аминокислот в качестве активированных единиц. Они последовательно добавляются к растущей пептидной цепи, которая прикреплена к твердой смоляной подложке. [136] Библиотеки пептидов используются при поиске лекарств посредством высокопроизводительного скрининга . [137]
Сочетание функциональных групп позволяет аминокислотам быть эффективными полидентатными лигандами для хелатов металлов с аминокислотами. [138] Множественные боковые цепи аминокислот также могут подвергаться химическим реакциям.
Катаболизм
[ редактировать ]
* Глюкогенные , продукты, способные образовывать глюкозу путем глюконеогенеза.
* Кетогенные – продукты, не обладающие способностью образовывать глюкозу. Эти продукты все еще могут использоваться для кетогенеза или синтеза липидов .
* Аминокислоты катаболизируются как в глюкогенные, так и в кетогенные продукты.
Деградация аминокислоты часто включает дезаминирование путем перемещения ее аминогруппы в α-кетоглутарат с образованием глутамата . В этом процессе участвуют трансаминазы, часто те же, что и те, которые используются при аминировании во время синтеза. У многих позвоночных аминогруппа затем удаляется в ходе цикла мочевины и выводится из организма в виде мочевины . Однако вместо этого в результате деградации аминокислот может образовываться мочевая кислота или аммиак. Например, сериндегидратаза превращает серин в пируват и аммиак. [100] После удаления одной или нескольких аминогрупп оставшуюся часть молекулы иногда можно использовать для синтеза новых аминокислот или использовать для получения энергии путем участия в гликолизе или цикле лимонной кислоты , как подробно показано на изображении справа.
Комплексообразование
[ редактировать ]Аминокислоты являются бидентатными лигандами, образующими аминокислотные комплексы переходных металлов . [140]
Химический анализ
[ редактировать ]Общий азот органического вещества в основном формируется за счет аминогрупп белков. Общий азот по Кьельдалю ( TKN ) — это показатель азота, широко используемый при анализе (сточных) вод, почвы, пищевых продуктов, кормов и органических веществ в целом. Как следует из названия, метод Кьельдаля применяется . Существуют более чувствительные методы. [141] [142]
См. также
[ редактировать ]Примечания
[ редактировать ]- ^ Позднее открытие объясняется тем, что цистеин окисляется до цистина на воздухе.
- ^ Пролин и другие циклические аминокислоты являются исключением из этой общей формулы. Циклизация α-аминокислоты приводит к образованию соответствующего вторичного амина. Их иногда называют иминокислотами .
- ^ Соглашение L и D для конфигурации аминокислот относится не к оптической активности самой аминокислоты, а скорее к оптической активности изомера глицеральдегида, из которого эта аминокислота теоретически может быть синтезирована ( D -глицеральдегид является правовращающим). - глицеральдегид L является левовращающим).Альтернативное соглашение заключается в использовании обозначений ( S ) и ( R ) для указания абсолютной конфигурации . [30] Почти все аминокислоты в белках имеют ( S ) у α-углерода, при этом цистеин является ( R ), а глицин нехиральным . [31] Цистеин имеет боковую цепь в том же геометрическом положении, что и другие аминокислоты, но терминология R / S поменяна местами, поскольку сера имеет более высокий атомный номер по сравнению с карбоксильным кислородом, что дает боковой цепи более высокий приоритет по методу Кана-Ингольда-Прелога. правила последовательности .
- ^ Например, жвачные животные, такие как коровы, получают ряд аминокислот через микробы в первых двух камерах желудка .
Ссылки
[ редактировать ]- ^ Нельсон Д.Л., Кокс М.М. (2005). Принципы биохимии (4-е изд.). Нью-Йорк: WH Freeman. ISBN 0-7167-4339-6 .
- ^ Флисси, Арески; Рикар, Эмма; Кампар, Клементина; Шевалье, Микаэль; Дюфрен, Йоанн; Михалик, Юрай; Жак, Филипп; Флао, Кристоф; Лисачек, Фредерик; Леклер, Валери; Пупин, Мод (2020). «Норин: обновление ресурса нерибосомальных пептидов» . Исследования нуклеиновых кислот . 48 (Д1): Д465–Д469. дои : 10.1093/nar/gkz1000 . ПМЦ 7145658 . ПМИД 31691799 .
- ^ Ричард Каммак, изд. (2009). «Вестник 2009» . Комитет по биохимической номенклатуре ИЮПАК и NC-IUBMB. Пирролизин. Архивировано из оригинала 12 сентября 2017 года . Проверено 16 апреля 2012 г.
- ^ Ротер, Майкл; Кшицкий, Джозеф А. (1 января 2010 г.). «Селеноцистеин, пирролизин и уникальный энергетический метаболизм метаногенных архей» . Архея . 2010 : 1–14. дои : 10.1155/2010/453642 . ISSN 1472-3646 . ПМЦ 2933860 . ПМИД 20847933 .
- ^ Лэтэм MC (1997). «Глава 8. Состав тела, функции питания, обмена веществ и энергетики» . Питание человека в развивающихся странах . Серия «Продовольствие и питание» – № 29. Рим: Продовольственная и сельскохозяйственная организация Объединенных Наций. Архивировано из оригинала 8 октября 2012 года . Проверено 9 сентября 2012 года .
- ^ Луизи, Пьер Луиджи (13 июля 2006 г.). Возникновение жизни: от химического происхождения к синтетической биологии . Издательство Кембриджского университета. п. 13. ISBN 9781139455640 . Проверено 5 августа 2024 г.
Конечно, если бы на Земле существовали только дикетопиперазины, а не аминокислоты; или если бы сахара не имели того размера, который они имеют; или если бы липиды были в три раза короче, то у нас не было бы жизни.
- ^ Перейти обратно: а б с «Номенклатура и символика аминокислот и пептидов» . Совместная комиссия IUPAC-IUB по биохимической номенклатуре. 1983. Архивировано из оригинала 9 октября 2008 года . Проверено 17 ноября 2008 г.
- ^ Викери Х.Б., Шмидт К.Л. (1931). «История открытия аминокислот». хим. Преподобный . 9 (2): 169–318. дои : 10.1021/cr60033a001 .
- ^ Хансен С. (май 2015 г.). «Открытие протеиногенных аминокислот с 1805 года в Париже по 1935 год в Иллинойсе» (PDF) (на немецком языке). Берлин. Архивировано из оригинала (PDF) 1 декабря 2017 года.
- ^ Воклен Л.Н., Робике П.Ж. (1806). «Открытие нового растительного принципа у Asparagus sativus». Анналы де Шими . 57 : 88–93.
- ^ Перейти обратно: а б Анфинсен CB, Эдсолл Дж. Т., Ричардс Ф. М. (1972). Достижения в области химии белков . Нью-Йорк: Академическая пресса. стр. 99, 103 . ISBN 978-0-12-034226-6 .
- ^ Волластон WH (1810 г.). «О кистозной окиси, новом виде мочевых камней». Философские труды Королевского общества . 100 : 223–230. дои : 10.1098/rstl.1810.0015 . S2CID 110151163 .
- ^ Бауман Э (1884). «Уберцистин и цистеин» . Z Физиол Хим . 8 (4): 299–305. Архивировано из оригинала 14 марта 2011 года . Проверено 28 марта 2011 г.
- ^ Браконнот HM (1820 г.). «О превращении животных веществ в новые вещества с помощью серной кислоты». Анналы химии и физики . 2-я серия. 13 :113–125.
- ^ Симони Р.Д., Хилл Р.Л., Воган М. (сентябрь 2002 г.). «Открытие аминокислоты треонина: работа Уильяма К. Роуза [классическая статья]» . Журнал биологической химии . 277 (37): Е25. дои : 10.1016/S0021-9258(20)74369-3 . ПМИД 12218068 . Архивировано из оригинала 10 июня 2019 года . Проверено 4 июля 2015 г.
- ^ Маккой Р.Х., Мейер CE, Роуз WC (1935). «Опыты по кормлению смесями высокоочищенных аминокислот. VIII. Выделение и идентификация новой незаменимой аминокислоты» . Журнал биологической химии . 112 : 283–302. дои : 10.1016/S0021-9258(18)74986-7 .
- ^ Ментен, П. Химический словарь: этимологический и исторический подход . Де Бек, Брюссель. ссылка Архивировано 28 декабря 2019 года в Wayback Machine .
- ^ Харпер Д. «Амино-» . Интернет-словарь этимологии . Архивировано из оригинала 2 декабря 2017 года . Проверено 19 июля 2010 г.
- ^ Паал С (1894). «О влиянии фенил-и-цианата на органические аминокислоты» . Отчеты Немецкого химического общества . 27 :974-979. дои : 10.1002/cber.189402701205 . Архивировано из оригинала 25 июля 2020 года.
- ^ Фрутон Дж.С. (1990). «Глава 5 — Эмиль Фишер и Франц Хофмайстер» . Контрасты в научном стиле: исследовательские группы в области химических и биохимических наук . Том. 191. Американское философское общество. стр. 163–165. ISBN 978-0-87169-191-0 .
- ^ «Альфа-аминокислота» . Мерриам-Вебстер Медикал . Архивировано из оригинала 3 января 2015 года . Проверено 3 января 2015 г. .
- ^ Кларк, Джим (август 2007 г.). «Знакомство с аминокислотами» . химгид . Архивировано из оригинала 30 апреля 2015 года . Проверено 4 июля 2015 г.
- ^ Якубке Х.Д., Севальд Н. (2008). «Аминокислоты» . Пептиды от А до Я: Краткая энциклопедия . Германия: Wiley-VCH. п. 20. ISBN 9783527621170 . Архивировано из оригинала 17 мая 2016 года . Проверено 5 января 2016 г. - через Google Книги.
- ^ Поллегиони Л., Серви С., ред. (2012). Неприродные аминокислоты: методы и протоколы . Методы молекулярной биологии. Том. 794. Хумана Пресс. п. v. doi : 10.1007/978-1-61779-331-8 . ISBN 978-1-61779-331-8 . OCLC 756512314 . S2CID 3705304 .
- ^ Хертвек С. (октябрь 2011 г.). «Биосинтез и зарядка пирролизина, 22-й генетически кодируемой аминокислоты». Angewandte Chemie, международное издание . 50 (41): 9540–9541. дои : 10.1002/anie.201103769 . ПМИД 21796749 . S2CID 5359077 .

- ^ Перейти обратно: а б «Глава 1: Белки — рабочие молекулы организма» . Структуры жизни . Национальный институт общих медицинских наук. 27 октября 2011 года. Архивировано из оригинала 7 июня 2014 года . Проверено 20 мая 2008 г.
- ^ Михал Г., Шомбург Д., ред. (2012). Биохимические пути: Атлас биохимии и молекулярной биологии (2-е изд.). Оксфорд: Уайли-Блэквелл. п. 5. ISBN 978-0-470-14684-2 .
- ^ Перейти обратно: а б с Крейтон, штат Техас (1993). «Глава 1» . Белки: структура и молекулярные свойства . Сан-Франциско: WH Freeman. ISBN 978-0-7167-7030-5 .
- ^ Генчи, Джузеппе (1 сентября 2017 г.). «Обзор d-аминокислот» . Аминокислоты . 49 (9): 1521–1533. дои : 10.1007/s00726-017-2459-5 . ISSN 1438-2199 . ПМИД 28681245 . S2CID 254088816 .
- ^ Кан, RS ; Ингольд, СК ; Прелог, В. (1966). «Спецификация молекулярной хиральности». Angewandte Chemie, международное издание . 5 (4): 385–415. дои : 10.1002/anie.196603851 .
- ^ Хатем СМ (2006). «Газохроматографическое определение энантиомеров аминокислот в табаке и бутылочных винах» . Университет Гиссена. Архивировано из оригинала 22 января 2009 года . Проверено 17 ноября 2008 г.
- ^ Перейти обратно: а б с д и ж Гарретт, Реджинальд Х.; Гришэм, Чарльз М. (2010). Биохимия (4-е изд.). Бельмонт, Калифорния: Брукс/Коул, Cengage Learning. стр. 74, 134–176, 430–442. ISBN 978-0-495-10935-8 . OCLC 297392560 .
- ^ Новиков Антон П.; Сафонов Алексей Владимирович; Герман Константин Евгеньевич; Григорьев Михаил С. (1 декабря 2023 г.). «Какие взаимодействия мы можем получить при переходе от цвиттер-ионов к «дриттерным» ионам: анион-анионные взаимодействия C–O⋯Re(O4) и Re–O⋯Re(O4) составляют структурное различие между перренатом и пертехнетатом L-гистидиния» . CrystEngComm . 26 : 61–69. дои : 10.1039/D3CE01164J . ISSN 1466-8033 . S2CID 265572280 .
- ^ Папп, Лаура Ванда; Лу, Джун; Холмгрен, Арне; Ханна, Кум Кум (1 июля 2007 г.). «От селена к селенопротеинам: синтез, идентичность и их роль в здоровье человека» . Антиоксиданты и окислительно-восстановительная сигнализация . 9 (7): 775–806. дои : 10.1089/ars.2007.1528 . ISSN 1523-0864 . ПМИД 17508906 .
- ^ Хао, Бинг; Гонг, Вэйминь; Фергюсон, Цунео К.; Джеймс, Кэри М.; Кшицкий, Джозеф А.; Чан, Майкл К. (24 мая 2002 г.). «Новый UAG-кодируемый остаток в структуре метаногенметилтрансферазы» . Наука . 296 (5572): 1462–1466. Бибкод : 2002Sci...296.1462H . дои : 10.1126/science.1069556 . ISSN 0036-8075 . ПМИД 12029132 . S2CID 35519996 .
- ^ Стейнхардт, Дж.; Рейнольдс, Дж. А. (1969). Множественные равновесия в белках . Нью-Йорк: Академическая пресса. стр. 176–21. ISBN 978-0126654509 .
- ^ Брёнстед, Дж.Н. (1923). «Некоторые замечания о понятии кислот и оснований». Recueil des Travaux Chimiques des Pays-Bas . 42 (8): 718–728. дои : 10.1002/recl.19230420815 .
- ^ Перейти обратно: а б Воллхардт, К. Питер К. (2007). Органическая химия: строение и функции . Нил Эрик Шор (5-е изд.). Нью-Йорк: WH Freeman. стр. 58–66. ISBN 978-0-7167-9949-8 . OCLC 61448218 .
- ^ Феннема ОР (19 июня 1996 г.). Пищевая химия 3-е изд . ЦРК Пресс. стр. 327–328. ISBN 978-0-8247-9691-4 .
- ^ Перейти обратно: а б Нтунтуми С., Властаридис П., Моссиалос Д., Статопулос С., Илиопулос И., Промпонас В. и др. (ноябрь 2019 г.). «Области низкой сложности в белках прокариот выполняют важные функциональные роли и высоко консервативны» . Исследования нуклеиновых кислот . 47 (19): 9998–10009. дои : 10.1093/nar/gkz730 . ПМК 6821194 . ПМИД 31504783 .
- ^ Урри Д.В. (2004). «Изменение свободной энергии Гиббса для гидрофобной ассоциации: вывод и оценка с помощью обратных температурных переходов». Письма по химической физике . 399 (1–3): 177–183. Бибкод : 2004CPL...399..177U . дои : 10.1016/S0009-2614(04)01565-9 .
- ^ Маркотт Э.М., Пеллегрини М., Йейтс Т.О., Айзенберг Д. (октябрь 1999 г.). «Перепись белковых повторов». Журнал молекулярной биологии . 293 (1): 151–60. дои : 10.1006/jmbi.1999.3136 . ПМИД 10512723 .
- ^ Хаэрти В., Голдинг ГБ (октябрь 2010 г.). Бонен Л. (ред.). «Последовательности низкой сложности и повторы отдельных аминокислот: а не просто «мусорные» пептидные последовательности». Геном . 53 (10): 753–62. дои : 10.1139/G10-063 . ПМИД 20962881 .
- ^ Маги Т., Seabra MC (апрель 2005 г.). «Жировое ацилирование и пренилирование белков: что интересного в жирах». Современное мнение в области клеточной биологии . 17 (2): 190–196. дои : 10.1016/j.ceb.2005.02.003 . ПМИД 15780596 .
- ^ Пилобелло К.Т., Махал Л.К. (июнь 2007 г.). «Расшифровка гликокода: сложность и аналитическая задача гликомики». Современное мнение в области химической биологии . 11 (3): 300–305. дои : 10.1016/j.cbpa.2007.05.002 . ПМИД 17500024 .
- ^ Смотрис Дж. Е., Линдер М. Е. (2004). «Пальмитоилирование внутриклеточных сигнальных белков: регуляция и функция». Ежегодный обзор биохимии . 73 (1): 559–587. doi : 10.1146/annurev.biochem.73.011303.073954 . ПМИД 15189153 .
- ^ Перейти обратно: а б с д и «Комиссия IUPAC-IUB по биохимической номенклатуре. Однобуквенное обозначение аминокислотных последовательностей» . Журнал биологической химии . 243 (13): 3557–3559. 10 июля 1968 г. doi : 10.1016/S0021-9258(19)34176-6 .
- ^ Перейти обратно: а б Шафран, М. (апрель 1998 г.). «Названия аминокислот и комнатные игры: от тривиальных названий до однобуквенного кода, названия аминокислот напрягают память студентов. Возможна ли более рациональная номенклатура?» . Биохимическое образование . 26 (2): 116–118. дои : 10.1016/S0307-4412(97)00167-2 .
- ^ Перейти обратно: а б с Адога, Годвин I; Николсон, Б.Х. (январь 1988 г.). «Письма в редакцию» . Биохимическое образование . 16 (1): 49. дои : 10.1016/0307-4412(88)90026-X .
- ^ Кайт Дж., Дулитл РФ (май 1982 г.). «Простой метод отображения гидропатического характера белка». Журнал молекулярной биологии . 157 (1): 105–132. CiteSeerX 10.1.1.458.454 . дои : 10.1016/0022-2836(82)90515-0 . ПМИД 7108955 .
- ^ Фрайфельдер Д. (1983). Физическая биохимия (2-е изд.). WH Фриман и компания. ISBN 978-0-7167-1315-9 . [ нужна страница ]
- ^ Козловский Л.П. (январь 2017 г.). «Протеом-p I : база данных изоэлектрических точек протеома» . Исследования нуклеиновых кислот . 45 (Д1): Д1112–Д1116. дои : 10.1093/nar/gkw978 . ПМК 5210655 . ПМИД 27789699 .
- ^ Перейти обратно: а б Хаусман Р.Э., Купер Г.М. (2004). Клетка: молекулярный подход . Вашингтон, округ Колумбия: ASM Press. п. 51. ИСБН 978-0-87893-214-6 .
- ^ Кодоны также могут выражаться: CGN, AGR.
- ^ кодоны также могут выражаться с помощью: CUN, UUR.
- ^ Осланд Р., Абрамс К., Ампе К., Болл Л.Дж., Бедфорд М.Т., Чезарени Дж., Джимона М., Херли Дж.Х., Джарчау Т., Лехто В.П., Леммон М.А., Линдинг Р., Майер Б.Дж., Нагаи М., Судол М., Уолтер Ю., Уиндер С.Дж. (февраль 2002 г.). «Нормализация номенклатуры пептидных мотивов как лигандов модульных белковых доменов». Письма ФЭБС . 513 (1): 141–144. дои : 10.1111/j.1432-1033.1968.tb00350.x . ПМИД 11911894 .
- ^ Комиссия IUPAC – IUB по биохимической номенклатуре (1972). «Однобуквенное обозначение аминокислотных последовательностей» . Чистая и прикладная химия . 31 (4): 641–645. дои : 10.1351/pac197231040639 . ПМИД 5080161 .
- ^ Кодоны также могут выражаться с помощью: CTN, ATH, TTR; MTY, YTR, АТА; МТИ, ХТА, YTG
- ^ Кодоны также могут выражаться с помощью: TWY, CAY, TGG.
- ^ Кодоны также могут выражаться с помощью: NTR, VTY.
- ^ Кодоны также могут выражаться с помощью: VAN, WCN, MGY, CGP.
- ^ «HGVS: Номенклатура вариантов последовательностей, рекомендации по белкам» . Архивировано из оригинала 24 сентября 2021 года . Проверено 23 сентября 2021 г.
- ^ Суханек М., Радзиковска А., Тиле С. (апрель 2005 г.). «Фотолейцин и фотометионин позволяют идентифицировать белок-белковые взаимодействия в живых клетках» . Природные методы . 2 (4): 261–267. дои : 10.1038/nmeth752 . ПМИД 15782218 .
- ^ Роднина М.В., Берингер М., Винтермейер В. (январь 2007 г.). «Как рибосомы образуют пептидные связи». Тенденции биохимических наук . 32 (1): 20–26. дои : 10.1016/j.tibs.2006.11.007 . ПМИД 17157507 .
- ^ Дрисколл Д.М., Коупленд PR (2003). «Механизм и регуляция синтеза селенопротеинов». Ежегодный обзор питания . 23 (1): 17–40. дои : 10.1146/annurev.nutr.23.011702.073318 . ПМИД 12524431 .
- ^ Кшицкий Я.А. (декабрь 2005 г.). «Прямое генетическое кодирование пирролизина». Современное мнение в микробиологии . 8 (6): 706–712. дои : 10.1016/j.mib.2005.10.009 . ПМИД 16256420 .
- ^ Вонг, JT-F. (1975). «Теория коэволюции генетического кода» . Труды Национальной академии наук . 72 (5): 1909–1912. Бибкод : 1975PNAS...72.1909T . дои : 10.1073/pnas.72.5.1909 . ПМК 432657 . ПМИД 1057181 .
- ^ Трифонов Е.Н. (декабрь 2000 г.). «Консенсусный временной порядок аминокислот и эволюция триплетного кода». Джин . 261 (1): 139–151. дои : 10.1016/S0378-1119(00)00476-5 . ПМИД 11164045 .
- ^ Хиггс П.Г., Пудриц Р.Э. (июнь 2009 г.). «Термодинамические основы синтеза пребиотических аминокислот и природа первого генетического кода». Астробиология . 9 (5): 483–90. arXiv : 0904.0402 . Бибкод : 2009AsBio...9..483H . дои : 10.1089/ast.2008.0280 . ПМИД 19566427 . S2CID 9039622 .
- ^ Крюков Г.В., Кастеллано С., Новоселов С.В., Лобанов А.В., Зехтаб О., Гиго Р., Гладышев В.Н. (май 2003 г.). «Характеристика селенопротеомов млекопитающих» . Наука . 300 (5624): 1439–1443. Бибкод : 2003Sci...300.1439K . дои : 10.1126/science.1083516 . ПМИД 12775843 . S2CID 10363908 . Архивировано из оригинала 23 июля 2018 года . Проверено 12 июня 2019 г.
- ^ Громер С., Уриг С., Беккер К. (январь 2004 г.). «Тиоредоксиновая система - от науки к клинике». Обзоры медицинских исследований . 24 (1): 40–89. дои : 10.1002/мед.10051 . ПМИД 14595672 . S2CID 1944741 .
- ^ Чонг Х (2008). Моделирование электростатического вклада в сворачивание и связывание белков (кандидатская диссертация). Государственный университет Флориды. п. 1 сноска. Архивировано из оригинала 28 января 2020 года . Проверено 28 января 2020 г.
- ^ Стюарт Л., Бургин AB (2005). «Цельный синтез генов: гено-матическое будущее» . Границы в разработке и открытии лекарств . 1 . Издательство Bentham Science : 299. doi : 10.2174/1574088054583318 . ISBN 978-1-60805-199-1 . ISSN 1574-0889 . Архивировано из оригинала 14 апреля 2021 года . Проверено 5 января 2016 г.
- ^ Эльжановский А., Остелл Дж. (7 апреля 2008 г.). «Генетические коды» . Национальный центр биотехнологической информации (NCBI). Архивировано из оригинала 20 августа 2016 года . Проверено 10 марта 2010 г.
- ^ Се Дж., Шульц П.Г. (декабрь 2005 г.). «Добавление аминокислот в генетический репертуар». Современное мнение в области химической биологии . 9 (6): 548–554. дои : 10.1016/j.cbpa.2005.10.011 . ПМИД 16260173 .
- ^ Ван Ц, Пэрриш А.Р., Ван Л. (март 2009 г.). «Расширение генетического кода для биологических исследований» . Химия и биология . 16 (3): 323–336. doi : 10.1016/j.chembiol.2009.03.001 . ПМК 2696486 . ПМИД 19318213 .
- ^ Саймон М. (2005). Новые вычисления: акцент на биоинформатике . Нью-Йорк: AIP Press/Springer Science+Business Media. стр. 105–106 . ISBN 978-0-387-22046-8 .
- ^ Бленис Дж., Реш, доктор медицинских наук (декабрь 1993 г.). «Субклеточная локализация, определяемая ацилированием и фосфорилированием белков». Современное мнение в области клеточной биологии . 5 (6): 984–989. дои : 10.1016/0955-0674(93)90081-Z . ПМИД 8129952 .
- ^ Вермеер С. (март 1990 г.). «Гамма-карбоксиглутаматсодержащие белки и витамин К-зависимая карбоксилаза» . Биохимический журнал . 266 (3): 625–636. дои : 10.1042/bj2660625 . ПМЦ 1131186 . ПМИД 2183788 .
- ^ Бхаттачарджи А., Бансал М. (март 2005 г.). «Структура коллагена: тройная спираль Мадраса и текущий сценарий». ИУБМБ Жизнь . 57 (3): 161–172. дои : 10.1080/15216540500090710 . ПМИД 16036578 . S2CID 7211864 .
- ^ Парк М.Х. (февраль 2006 г.). «Посттрансляционный синтез аминокислоты, полученной из полиамина, гипузина, в эукариотическом факторе инициации трансляции 5А (eIF5A)» . Журнал биохимии . 139 (2): 161–169. дои : 10.1093/jb/mvj034 . ПМК 2494880 . ПМИД 16452303 .
- ^ Курис Э., Николис И., Муанард С., Осовска С., Зеррук Н., Бенасет С., Кинобер Л. (ноябрь 2005 г.). «Почти все о цитруллине у млекопитающих». Аминокислоты . 29 (3): 177–205. дои : 10.1007/s00726-005-0235-4 . ПМИД 16082501 . S2CID 23877884 .
- ^ Коксон К.М., Чакауя Э., Оттенхоф Х.Х., Уитни Х.М., Бланделл Т.Л., Абелл С., Смит А.Г. (август 2005 г.). «Биосинтез пантотената у высших растений». Труды Биохимического общества . 33 (Часть 4): 743–746. дои : 10.1042/BST0330743 . ПМИД 16042590 .
- ^ Саками В., Харрингтон Х (1963). «Обмен аминокислот». Ежегодный обзор биохимии . 32 (1): 355–398. дои : 10.1146/annurev.bi.32.070163.002035 . ПМИД 14144484 .
- ^ Броснан Дж. Т. (апрель 2000 г.). «Глутамат на стыке обмена аминокислот и углеводов» . Журнал питания . 130 (дополнение 4S): 988S–990S. дои : 10.1093/jn/130.4.988S . ПМИД 10736367 .
- ^ Янг В.Р., Аджами А.М. (сентябрь 2001 г.). «Глютамин: император или его одежда?» . Журнал питания . 131 (9 доп.): 2449S–2459S, 2486S–2487S. дои : 10.1093/jn/131.9.2449S . ПМИД 11533293 .
- ^ Молодой VR (август 1994 г.). «Потребности взрослых в аминокислотах: необходимость серьезного пересмотра текущих рекомендаций» . Журнал питания . 124 (8 дополнений): 1517S–1523S. дои : 10.1093/jn/124.suppl_8.1517S . ПМИД 8064412 .
- ^ Фюрст П., Штеле П. (июнь 2004 г.). «Какие основные элементы необходимы для определения потребности человека в аминокислотах?» . Журнал питания . 134 (6 Доп.): 1558S–1565S. дои : 10.1093/jn/134.6.1558S . ПМИД 15173430 .
- ^ Ридс П.Дж. (июль 2000 г.). «Незаменимые и незаменимые аминокислоты для человека» . Журнал питания . 130 (7): 1835–1840 гг. дои : 10.1093/jn/130.7.1835S . ПМИД 10867060 .
- ^ Имура К., Окада А. (январь 1998 г.). «Обмен аминокислот у пациентов детского возраста». Питание . 14 (1): 143–148. дои : 10.1016/S0899-9007(97)00230-X . ПМИД 9437700 .
- ^ Лоренцо Р., Камило М.Е. (2002). «Таурин: условно незаменимая аминокислота для человека? Обзор здоровья и болезней». Больничное питание . 17 (6): 262–270. ПМИД 12514918 .
- ^ Бродли К.Дж. (март 2010 г.). «Сосудистые эффекты следовых аминов и амфетаминов». Фармакология и терапия . 125 (3): 363–375. doi : 10.1016/j.pharmthera.2009.11.005 . ПМИД 19948186 .
- ^ Линдеманн Л., Хонер MC (май 2005 г.). «Ренессанс следовых аминов, вдохновленный новым семейством GPCR». Тенденции в фармакологических науках . 26 (5): 274–281. дои : 10.1016/j.tips.2005.03.007 . ПМИД 15860375 .
- ^ Ван X, Ли Дж, Донг Дж, Юэ Дж (февраль 2014 г.). «Эндогенные субстраты CYP2D мозга». Европейский журнал фармакологии . 724 : 211–218. дои : 10.1016/j.ejphar.2013.12.025 . ПМИД 24374199 .
- ^ Хилин Дж. В. (1969). «Токсичные пептиды и аминокислоты в пищевых продуктах и кормах». Журнал сельскохозяйственной и пищевой химии . 17 (3): 492–496. дои : 10.1021/jf60163a003 .
- ^ Савельева К.В., Чжао С., Погорелов В.М., Раджан И., Ян Кью, Куллинан Э., Ланторн Т.Х. (2008). Бартоломуччи А. (ред.). «Генетическое нарушение обоих генов триптофангидроксилазы резко снижает уровень серотонина и влияет на поведение моделей, чувствительных к антидепрессантам» . ПЛОС ОДИН . 3 (10): е3301. Бибкод : 2008PLoSO...3.3301S . дои : 10.1371/journal.pone.0003301 . ПМК 2565062 . ПМИД 18923670 .
- ^ Шемин Д., Риттенберг Д. (декабрь 1946 г.). «Биологическое использование глицина для синтеза протопорфирина гемоглобина» . Журнал биологической химии . 166 (2): 621–625. дои : 10.1016/S0021-9258(17)35200-6 . ПМИД 20276176 . Архивировано из оригинала 7 мая 2022 года . Проверено 3 ноября 2008 г.
- ^ Техеро Дж., Бисвас А., Ван ЗК, Пейдж Р.К., Хак М.М., Хеманн С., Цвайер Дж.Л., Мисра С., Штуер DJ (ноябрь 2008 г.). «Стабилизация и характеристика промежуточного продукта гем-оксиреакции в индуцибельной синтазе оксида азота» . Журнал биологической химии . 283 (48): 33498–33507. дои : 10.1074/jbc.M806122200 . ПМК 2586280 . ПМИД 18815130 .
- ^ Родригес-Касо С., Монтаньес Р., Касканте М., Санчес-Хименес Ф., Медина М.А. (август 2006 г.). «Математическое моделирование обмена полиаминов у млекопитающих» . Журнал биологической химии . 281 (31): 21799–21812. дои : 10.1074/jbc.M602756200 . ПМИД 16709566 .
- ^ Перейти обратно: а б Страйер Л., Берг Дж.М., Тимочко Дж.Л. (2002). Биохимия (5-е изд.). Нью-Йорк: WH Freeman. стр. 693–698 . ISBN 978-0-7167-4684-3 .
- ^ Петров О.А. (декабрь 2002 г.). «ГАМК и глутамат в мозге человека». Нейробиолог . 8 (6): 562–573. дои : 10.1177/1073858402238515 . ПМИД 12467378 . S2CID 84891972 .
- ^ Тернер Э.Х., Лофтис Дж.М., Блэквелл А.Д. (март 2006 г.). «Серотонин по меню: добавка предшественника серотонина 5-гидрокситриптофана» . Фармакология и терапия . 109 (3): 325–338. doi : 10.1016/j.pharmthera.2005.06.004 . ПМИД 16023217 . S2CID 2563606 . Архивировано из оригинала 13 апреля 2020 года . Проверено 12 июня 2019 г.
- ^ Костшева Р.М., Новак П., Костшева Дж.П., Костшева Р.А., Брус Р. (март 2005 г.). «Особенности лечения болезни Паркинсона L-ДОФА». Аминокислоты . 28 (2): 157–164. дои : 10.1007/s00726-005-0162-4 . ПМИД 15750845 . S2CID 33603501 .
- ^ Хеби О., Перссон Л., Рентала М. (август 2007 г.). «Нацеливание на ферменты биосинтеза полиаминов: многообещающий подход к терапии африканской сонной болезни, болезни Шагаса и лейшманиоза». Аминокислоты . 33 (2): 359–366. дои : 10.1007/s00726-007-0537-9 . ПМИД 17610127 . S2CID 26273053 .
- ^ Розенталь Г.А. (2001). «L-Канаванин: инсектицидный аллелохимический препарат высших растений». Аминокислоты . 21 (3): 319–330. дои : 10.1007/s007260170017 . ПМИД 11764412 . S2CID 3144019 .
- ^ Хаммонд, Эндрю К. (1 мая 1995 г.). «Лейценовый токсикоз и борьба с ним у жвачных животных» . Журнал зоотехники . 73 (5): 1487–1492. дои : 10.2527/1995.7351487x . ПМИД 7665380 . Архивировано из оригинала 7 мая 2022 года . Проверено 7 мая 2022 г.
- ^ Перейти обратно: а б Лейхтенбергер В., Хутмахер К., Драуз К. (ноябрь 2005 г.). «Биотехнологическое производство аминокислот и их производных: современное состояние и перспективы». Прикладная микробиология и биотехнология . 69 (1): 1–8. дои : 10.1007/s00253-005-0155-y . ПМИД 16195792 . S2CID 24161808 .
- ^ Эшмид HD (1993). Роль хелатов аминокислот в питании животных . Вествуд: Публикации Нойеса.
- ^ Гараттини С. (апрель 2000 г.). «Глутаминовая кислота, двадцать лет спустя» . Журнал питания . 130 (дополнение 4S): 901S–909S. дои : 10.1093/jn/130.4.901S . ПМИД 10736350 .
- ^ Стегинк Л.Д. (июль 1987 г.). «История аспартама: модель клинических испытаний пищевой добавки». Американский журнал клинического питания . 46 (1 приложение): 204–215. дои : 10.1093/ajcn/46.1.204 . ПМИД 3300262 .
- ^ Перейти обратно: а б Драуз К., Грейсон И., Климанн А., Криммер Х.П., Лейхтенбергер В., Векбекер С. (2007). «Аминокислоты». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a02_057.pub2 . ISBN 978-3527306732 .
- ^ Ханессян С. (1993). «Размышления о полном синтезе натуральных продуктов: искусство, ремесло, логика и подход Хирона» . Чистая и прикладная химия . 65 (6): 1189–1204. дои : 10.1351/pac199365061189 . S2CID 43992655 .
- ^ Блазер Х.У. (1992). «Хиральный пул как источник энантиоселективных катализаторов и вспомогательных веществ». Химические обзоры . 92 (5): 935–952. дои : 10.1021/cr00013a009 .
- ^ Эшмид HD (1986). Внекорневая подкормка растений хелатами аминокислот . Парк-Ридж: Публикации Нойеса.
- ^ Санда Ф., Эндо Т. (1999). «Синтез и функции полимеров на основе аминокислот» . Макромолекулярная химия и физика . 200 (12): 2651–2661. doi : 10.1002/(SICI)1521-3935(19991201)200:12<2651::AID-MACP2651>3.0.CO;2-P .
- ^ Гросс Р.А., Калра Б. (август 2002 г.). «Биоразлагаемые полимеры для окружающей среды» . Наука . 297 (5582): 803–807. Бибкод : 2002Sci...297..803G . дои : 10.1126/science.297.5582.803 . ПМИД 12161646 . Архивировано из оригинала 25 июля 2020 года . Проверено 12 июня 2019 г.
- ^ Лоу К.С., Уиллер А.П., Коскан Л.П. (1996). Коммерческая полиаспарагиновая кислота и ее использование . Достижения в серии «Химия». Том. 248. Вашингтон, округ Колумбия: Американское химическое общество .
- ^ Томбре С.М., Сарваде Б.Д. (2005). «Синтез и биоразлагаемость полиаспарагиновой кислоты: критический обзор». Журнал макромолекулярной науки, часть A. 42 (9): 1299–1315. дои : 10.1080/10601320500189604 . S2CID 94818855 .
- ^ Джонс Р.К., Бьюкенен Б.Б., Груиссем В. (2000). Биохимия и молекулярная биология растений . Роквилл, Мэриленд: Американское общество физиологов растений. стр. 371–372 . ISBN 978-0-943088-39-6 .
- ^ Броснан Дж. Т., Броснан М. Е. (июнь 2006 г.). «Серосодержащие аминокислоты: обзор» . Журнал питания . 136 (6 Доп.): 1636–1640С. дои : 10.1093/jn/136.6.1636S . ПМИД 16702333 .
- ^ Кивирикко К.И., Пихлажаниеми Т (1998). «Коллагенгидроксилазы и субъединица протеиндисульфидизомеразы пролил-4-гидроксилаз». Достижения энзимологии и смежных областей молекулярной биологии . Достижения в энзимологии и смежных областях молекулярной биологии. Том. 72. С. 325–398. дои : 10.1002/9780470123188.ch9 . ISBN 9780470123188 . ПМИД 9559057 .
- ^ Уитмор Л., Уоллес Б.А. (май 2004 г.). «Анализ состава последовательностей пептайбола: значение для синтеза in vivo и формирования каналов». Европейский биофизический журнал . 33 (3): 233–237. дои : 10.1007/s00249-003-0348-1 . ПМИД 14534753 . S2CID 24638475 .
- ^ Александр Л., Грирсон Д. (октябрь 2002 г.). «Биосинтез и действие этилена в томатах: модель климактерического созревания плодов» . Журнал экспериментальной ботаники . 53 (377): 2039–2055. дои : 10.1093/jxb/erf072 . ПМИД 12324528 .
- ^ Перейти обратно: а б Китадай, Норио; Маруяма, Сигенори (2018). «Происхождение строительных блоков жизни: обзор » Геонаучные границы . 9 (4): 1117–1153. Бибкод : 2018GeoFr... 9.1117K дои : 10.1016/j.gsf.2017.07.007 . S2CID 102659869 .
- ^ Данчин, Антуан (12 июня 2017 г.). «От химического метаболизма к жизни: происхождение процесса генетического кодирования» . Журнал органической химии Бейльштейна . 13 (1): 1119–1135. дои : 10.3762/bjoc.13.111 . ISSN 1860-5397 . ПМК 5480338 . ПМИД 28684991 .
- ^ Перейти обратно: а б Френкель-Пинтер, Моран; Саманта, Моусуми; Ашкенаси, Гонен; Леман, Люк Дж. (10 июня 2020 г.). «Пребиотические пептиды: молекулярные центры происхождения жизни» . Химические обзоры . 120 (11): 4707–4765. doi : 10.1021/acs.chemrev.9b00664 . ISSN 0009-2665 . ПМИД 32101414 . S2CID 211536416 .
- ^ Милнер-Уайт, Э. Джеймс (6 декабря 2019 г.). «Белковые трехмерные структуры в зарождении жизни» . Фокус на интерфейсе . 9 (6): 20190057. doi : 10.1098/rsfs.2019.0057 . ПМК 6802138 . ПМИД 31641431 .
- ^ Чаттерджи, Санкар; Ядав, Сурья (июнь 2022 г.). «Коэволюция биомолекул и пребиотических информационных систем в происхождении жизни: модель визуализации для сборки первого гена» . Жизнь . 12 (6): 834. Бибкод : 2022Life...12..834C . дои : 10.3390/life12060834 . ISSN 2075-1729 . ПМЦ 9225589 . ПМИД 35743865 .
- ^ Киршнинг, Андреас (26 мая 2021 г.). «Пара кофермент/белок и молекулярная эволюция жизни» . Отчеты о натуральных продуктах . 38 (5): 993–1010. дои : 10.1039/D0NP00037J . ISSN 1460-4752 . ПМИД 33206101 . S2CID 227037164 .
- ^ Элмор Д.Т., Барретт Г.К. (1998). Аминокислоты и пептиды . Кембридж, Великобритания: Издательство Кембриджского университета. стр. 48–60 . ISBN 978-0-521-46827-5 .
- ^ Гаттеридж А., Торнтон Дж. М. (ноябрь 2005 г.). «Понимание каталитического инструментария природы». Тенденции биохимических наук . 30 (11): 622–629. дои : 10.1016/j.tibs.2005.09.006 . ПМИД 16214343 .
- ^ Ибба М., Сёлль Д. (май 2001 г.). «Ренессанс синтеза аминоацил-тРНК» . Отчеты ЭМБО . 2 (5): 382–387. doi : 10.1093/embo-reports/kve095 . ПМЦ 1083889 . ПМИД 11375928 .
- ^ Лендьел П., Сёлль Д. (июнь 1969 г.). «Механизм биосинтеза белка» . Бактериологические обзоры . 33 (2): 264–301. дои : 10.1128/MMBR.33.2.264-301.1969 . ПМК 378322 . ПМИД 4896351 .
- ^ Ву Дж., Фанг Ю.З., Ян С., Луптон-младший, Тернер Н.Д. (март 2004 г.). «Метаболизм глутатиона и его значение для здоровья» . Журнал питания . 134 (3): 489–492. дои : 10.1093/jn/134.3.489 . ПМИД 14988435 .
- ^ Мейстер А. (ноябрь 1988 г.). «Метаболизм глутатиона и его селективная модификация» . Журнал биологической химии . 263 (33): 17205–17208. дои : 10.1016/S0021-9258(19)77815-6 . ПМИД 3053703 .
- ^ Карпино Л.А. (1992). «1-Гидрокси-7-азабензотриазол. Эффективная добавка для связывания пептидов». Журнал Американского химического общества . 115 (10): 4397–4398. дои : 10.1021/ja00063a082 .
- ^ Мараско Д., Перретта Г., Сабателла М., Руво М. (октябрь 2008 г.). «Прошлые и будущие перспективы библиотек синтетических пептидов». Современная наука о белках и пептидах . 9 (5): 447–467. дои : 10.2174/138920308785915209 . ПМИД 18855697 .
- ^ Конара С., Ганьона К., Клирфилд А., Томпсон С., Хартл Дж., Эриксон С., Нельсон С. (2010). «Определение структуры и характеристика бисглицинатов меди и цинка методами рентгеновской кристаллографии и масс-спектрометрии». Журнал координационной химии . 63 (19): 3335–3347. дои : 10.1080/00958972.2010.514336 . S2CID 94822047 .
- ^ Стипанюк М.Х. (2006). Биохимические, физиологические и молекулярные аспекты питания человека (2-е изд.). Сондерс Эльзевир.
- ^ Дгайм Р.Д., Дхаван Р., Арндцен Б.А. (сентябрь 2001 г.). «Использование монооксида углерода и иминов в качестве синтонов, производных пептидов: простой катализируемый палладием синтез имидазолинов, полученных из α-аминокислот». Ангеванде Хеми . 40 (17): 3228–3230. doi : 10.1002/(SICI)1521-3773(19980703)37:12<1634::AID-ANIE1634>3.0.CO;2-C . ПМИД 29712039 .
- ^ Муньос-Уэрта Р.Ф., Гевара-Гонсалес Р.Г., Контрерас-Медина Л.М., Торрес-Пачеко И., Прадо-Оливарес Х., Окампо-Веласкес Р.В. (август 2013 г.). «Обзор методов определения азотного статуса растений: преимущества, недостатки и последние достижения» . Датчики . 13 (8). Базель, Швейцария: 10823–43. Бибкод : 2013Senso..1310823M . дои : 10.3390/s130810823 . ПМК 3812630 . ПМИД 23959242 .
- ^ Мартин П.Д., Мэлли Д.Ф., Мэннинг Дж., Фуллер Л. (2002). «Определение органического углерода и азота в почве на полевом уровне методом ближней инфракрасной спектроскопии». Канадский журнал почвоведения . 82 (4): 413–422. дои : 10.4141/S01-054 .
Дальнейшее чтение
[ редактировать ]- Тимочко Ю.Л. (2012). «Белковый состав и структура» . Биохимия . Нью-Йорк: WH Freeman и компания. стр. 28–31. ISBN 9781429229364 .
- Дулитл РФ (1989). «Избыточность в белковых последовательностях». В Фасман Г.Д. (ред.). Предсказания структуры белка и принципы конформации белка . Нью-Йорк: Пленум Пресс . стр. 599–623. ISBN 978-0-306-43131-9 . LCCN 89008555 .
- Нельсон Д.Л., Кокс М.М. (2000). Ленингерские принципы биохимии (3-е изд.). Стоит издательства . ISBN 978-1-57259-153-0 . LCCN 99049137 .
- Мейеренрих У (2008). Аминокислоты и асимметрия жизни (PDF) . Берлин: Springer Verlag . ISBN 978-3-540-76885-2 . LCCN 2008930865 . Архивировано из оригинала (PDF) 12 января 2012 года.
Внешние ссылки
[ редактировать ] СМИ, связанные с аминокислотами, на Викискладе?
СМИ, связанные с аминокислотами, на Викискладе?