Водород
 Фиолетовое свечение в плазменном состоянии | ||||||||||||||||||||||||||
| Водород | ||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Появление | Бесцветный газ | |||||||||||||||||||||||||
| Стандартный атомный вес А р °(Н) | ||||||||||||||||||||||||||
| ||||||||||||||||||||||||||
| Hydrogen in the periodic table | ||||||||||||||||||||||||||
| ||||||||||||||||||||||||||
| Atomic number (Z) | 1 | |||||||||||||||||||||||||
| Group | group 1: hydrogen and alkali metals | |||||||||||||||||||||||||
| Period | period 1 | |||||||||||||||||||||||||
| Block | s-block | |||||||||||||||||||||||||
| Electron configuration | 1s1 | |||||||||||||||||||||||||
| Electrons per shell | 1 | |||||||||||||||||||||||||
| Physical properties | ||||||||||||||||||||||||||
| Phase at STP | gas | |||||||||||||||||||||||||
| Melting point | (H2) 13.99 K (−259.16 °C, −434.49 °F) | |||||||||||||||||||||||||
| Boiling point | (H2) 20.271 K (−252.879 °C, −423.182 °F) | |||||||||||||||||||||||||
| Density (at STP) | 0.08988 g/L | |||||||||||||||||||||||||
| when liquid (at m.p.) | 0.07 g/cm3 (solid: 0.0763 g/cm3)[3] | |||||||||||||||||||||||||
| when liquid (at b.p.) | 0.07099 g/cm3 | |||||||||||||||||||||||||
| Triple point | 13.8033 K, 7.041 kPa | |||||||||||||||||||||||||
| Critical point | 32.938 K, 1.2858 MPa | |||||||||||||||||||||||||
| Heat of fusion | (H2) 0.117 kJ/mol | |||||||||||||||||||||||||
| Heat of vaporization | (H2) 0.904 kJ/mol | |||||||||||||||||||||||||
| Molar heat capacity | (H2) 28.836 J/(mol·K) | |||||||||||||||||||||||||
Vapor pressure
| ||||||||||||||||||||||||||
| Atomic properties | ||||||||||||||||||||||||||
| Oxidation states | −1, 0, +1 (an amphoteric oxide) | |||||||||||||||||||||||||
| Electronegativity | Pauling scale: 2.20 | |||||||||||||||||||||||||
| Ionization energies |
| |||||||||||||||||||||||||
| Covalent radius | 31±5 pm | |||||||||||||||||||||||||
| Van der Waals radius | 120 pm | |||||||||||||||||||||||||
| Other properties | ||||||||||||||||||||||||||
| Natural occurrence | primordial | |||||||||||||||||||||||||
| Crystal structure | hexagonal (hP4) | |||||||||||||||||||||||||
| Lattice constants | a = 378.97 pm c = 618.31 pm (at triple point)[4] | |||||||||||||||||||||||||
| Thermal conductivity | 0.1805 W/(m⋅K) | |||||||||||||||||||||||||
| Magnetic ordering | diamagnetic[5] | |||||||||||||||||||||||||
| Molar magnetic susceptibility | −3.98×10−6 cm3/mol (298 K)[6] | |||||||||||||||||||||||||
| Speed of sound | 1310 m/s (gas, 27 °C) | |||||||||||||||||||||||||
| CAS Number | 12385-13-6 1333-74-0 (H2) | |||||||||||||||||||||||||
| History | ||||||||||||||||||||||||||
| Discovery | Henry Cavendish[7][8] (1766) | |||||||||||||||||||||||||
| Named by | Louis-Bernard Guyton de Morveau Antoine Lavoisier[9][10] (1787) | |||||||||||||||||||||||||
| Isotopes of hydrogen | ||||||||||||||||||||||||||
| ||||||||||||||||||||||||||
Водород — химический элемент ; он имеет символ H и атомный номер 1. Это самый легкий элемент и при стандартных условиях представляет собой газ двухатомных молекул с формулой H 2 , иногда называемый диводородом , [11] но чаще его называют газообразным водородом , молекулярным водородом или просто водородом. Он бесцветен, не имеет запаха, вкуса, [12] нетоксичный и очень горючий . Составляя примерно 75% всей нормальной материи , водород является самым распространенным химическим веществом во Вселенной . [13] [примечание 1] Звезды , включая Солнце , в основном состоят из водорода в состоянии плазмы , тогда как на Земле водород встречается в воде , органических соединениях , в виде диводорода и в других молекулярных формах . Самый распространенный изотоп водорода (обозначение 1 H) состоит из одного протона , одного электрона и не содержит нейтронов .
In the early universe, the formation of hydrogen's protons occurred during the first second following the Big Bang, with neutral hydrogen atoms only forming approximately 370,000 years later during the recombination epoch as the universe cooled and plasma had cooled enough for electrons to remain bound to protons.[14] Hydrogen, typically nonmetallic except under extreme pressures, readily forms covalent bonds with most nonmetals, contributing to the formation of compounds like water and various organic substances. Its role is crucial in acid-base reactions, which predominantly involve proton exchange among soluble molecules. In ionic compounds, hydrogen can take the form of either a negatively charged anion, where it is known as hydride, or as a positively charged cation denoted by the symbol H+. The cation, simply a proton (symbol p), exhibits specific behavior in aqueous solutions and in ionic compounds involves screening of its electric charge by surrounding polar molecules or anions. Hydrogen's unique position as the only neutral atom for which the Schrödinger equation can be directly solved has significantly contributed to the foundational principles of quantum mechanics through the exploration of its energetics and chemical bonding.[15]
Historically, hydrogen gas was first produced artificially in the early 16th century through the reaction of acids with metals. Henry Cavendish, between 1766 and 1781, identified hydrogen gas as a distinct substance[16] and discovered its property of producing water when burned—hence its name derived from the Greek "water-former".
The majority of hydrogen production occurs through steam reforming of natural gas, with a smaller portion derived from energy-intensive methods such as the electrolysis of water.[17][18] Its primary industrial uses include fossil fuel processing, such as hydrocracking, and ammonia production, with emerging applications in fuel cells for electricity generation and as a heat source.[19] When used in fuel cells, hydrogen's only emission at the point of use is water vapor,[19] though combustion can produce nitrogen oxides.[19] Hydrogen's interaction with metals may cause embrittlement.[20]
Properties
Combustion

Hydrogen gas is highly flammable:
- 2 H2(g) + O2(g) → 2 H2O(l) (572 kJ/2 mol = 286 kJ/mol = 141.865 MJ/kg)[note 2]
The enthalpy of combustion is −286 kJ/mol.[21]
Hydrogen gas forms explosive mixtures with air in concentrations from 4–74%[22] and with chlorine at 5–95%. The hydrogen autoignition temperature, the temperature of spontaneous ignition in air, is 500 °C (932 °F).[23]
Flame
Pure hydrogen-oxygen flames emit ultraviolet light and with high oxygen mix are nearly invisible to the naked eye, as illustrated by the faint plume of the Space Shuttle Main Engine, compared to the highly visible plume of a Space Shuttle Solid Rocket Booster, which uses an ammonium perchlorate composite. The detection of a burning hydrogen leak may require a flame detector; such leaks can be very dangerous. Hydrogen flames in other conditions are blue, resembling blue natural gas flames.[24] The destruction of the Hindenburg airship was a notorious example of hydrogen combustion and the cause is still debated. The visible flames in the photographs were the result of carbon compounds in the airship skin burning.[25]
Reactants
H2 is unreactive compared to diatomic elements such as halogens or oxygen. The thermodynamic basis of this low reactivity is the very strong H–H bond, with a bond dissociation energy of 435.7 kJ/mol.[26] The kinetic basis of the low reactivity is the nonpolar nature of H2 and its weak polarizability. It spontaneously reacts with chlorine and fluorine to form hydrogen chloride and hydrogen fluoride, respectively.[27] The reactivity of H2 is strongly affected by the presence of metal catalysts. Thus, while mixtures of H2 with O2 or air combust readily when heated to at least 500 °C by a spark or flame, they do not react at room temperature in the absence of a catalyst.
Electron energy levels

The ground state energy level of the electron in a hydrogen atom is −13.6 eV,[28] which is equivalent to an ultraviolet photon of roughly 91 nm wavelength.[29]
The energy levels of hydrogen can be calculated fairly accurately using the Bohr model of the atom, which conceptualizes the electron as "orbiting" the proton in analogy to the Earth's orbit of the Sun. However, the atomic electron and proton are held together by electromagnetic force, while planets and celestial objects are held by gravity. Because of the discretization of angular momentum postulated in early quantum mechanics by Bohr, the electron in the Bohr model can only occupy certain allowed distances from the proton, and therefore only certain allowed energies.[30]
A more accurate description of the hydrogen atom comes from a quantum mechanical analysis that uses the Schrödinger equation, Dirac equation or Feynman path integral formulation to calculate the probability density of the electron around the proton.[31] The most complex formulas include the small effects of special relativity and vacuum polarization. In the quantum mechanical treatment, the electron in a ground state hydrogen atom has no angular momentum—illustrating how the "planetary orbit" differs from electron motion.
Spin isomers
Molecular H2 exists as two spin isomers, i.e. compounds that differ only in the spin states of their nuclei.[32] In the orthohydrogen form, the spins of the two nuclei are parallel, forming a spin triplet state having a total molecular spin ; in the parahydrogen form the spins are antiparallel and form a spin singlet state having spin . The equilibrium ratio of ortho- to para-hydrogen depends on temperature. At room temperature or warmer, equilibrium hydrogen gas contains about 25% of the para form and 75% of the ortho form.[33] The ortho form is an excited state, having higher energy than the para form by 1.455 kJ/mol,[34] and it converts to the para form over the course of several minutes when cooled to low temperature.[35] The thermal properties of the forms differ because they differ in their allowed rotational quantum states, resulting in different thermal properties such as the heat capacity.[36]
The ortho-to-para ratio in H2 is an important consideration in the liquefaction and storage of liquid hydrogen: the conversion from ortho to para is exothermic and produces enough heat to evaporate most of the liquid if not converted first to parahydrogen during the cooling process.[37] Catalysts for the ortho-para interconversion, such as ferric oxide and activated carbon compounds, are used during hydrogen cooling to avoid this loss of liquid.[38]
Phases


- Gaseous hydrogen
- Liquid hydrogen
- Solid hydrogen
- Metallic hydrogen
- Plasma hydrogen
Compounds
Covalent and organic compounds
While H2 is not very reactive under standard conditions, it does form compounds with most elements. Hydrogen can form compounds with elements that are more electronegative, such as halogens (F, Cl, Br, I), or oxygen; in these compounds hydrogen takes on a partial positive charge.[39] When bonded to a more electronegative element, particularly fluorine, oxygen, or nitrogen, hydrogen can participate in a form of medium-strength noncovalent bonding with another electronegative element with a lone pair, a phenomenon called hydrogen bonding that is critical to the stability of many biological molecules.[40][41] Hydrogen also forms compounds with less electronegative elements, such as metals and metalloids, where it takes on a partial negative charge. These compounds are often known as hydrides.[42]
Hydrogen forms many compounds with carbon called the hydrocarbons, and an even more with heteroatoms that, because of their association with living things, are called organic compounds.[43] The study of their properties is known as organic chemistry[44] and their study in the context of living organisms is called biochemistry.[45] By some definitions, "organic" compounds are only required to contain carbon. However, most of them also contain hydrogen, and because it is the carbon-hydrogen bond that gives this class of compounds most of its particular chemical characteristics, carbon-hydrogen bonds are required in some definitions of the word "organic" in chemistry.[43] Millions of hydrocarbons are known, and they are usually formed by complicated pathways that seldom involve elemental hydrogen.
Hydrogen is highly soluble in many rare earth and transition metals[46] and is soluble in both nanocrystalline and amorphous metals.[47] Hydrogen solubility in metals is influenced by local distortions or impurities in the crystal lattice.[48] These properties may be useful when hydrogen is purified by passage through hot palladium disks, but the gas's high solubility is a metallurgical problem, contributing to the embrittlement of many metals,[20] complicating the design of pipelines and storage tanks.[49]
Hydrides

Compounds of hydrogen are often called hydrides, a term that is used fairly loosely. The term "hydride" suggests that the H atom has acquired a negative or anionic character, denoted H−, and is used when hydrogen forms a compound with a more electropositive element. The existence of the hydride anion, suggested by Gilbert N. Lewis in 1916 for group 1 and 2 salt-like hydrides, was demonstrated by Moers in 1920 by the electrolysis of molten lithium hydride (LiH), producing a stoichiometric quantity of hydrogen at the anode.[50] For hydrides other than group 1 and 2 metals, the term is quite misleading, considering the low electronegativity of hydrogen. An exception in group 2 hydrides is BeH2, which is polymeric. In lithium aluminium hydride, the [AlH4]− anion carries hydridic centers firmly attached to the Al(III).
Although hydrides can be formed with almost all main-group elements, the number and combination of possible compounds varies widely; for example, more than 100 binary borane hydrides are known, but only one binary aluminium hydride.[51] Binary indium hydride has not yet been identified, although larger complexes exist.[52]
In inorganic chemistry, hydrides can also serve as bridging ligands that link two metal centers in a coordination complex. This function is particularly common in group 13 elements, especially in boranes (boron hydrides) and aluminium complexes, as well as in clustered carboranes.[53]
Protons and acids
Oxidation of hydrogen removes its electron and gives H+, which contains no electrons and a nucleus which is usually composed of one proton. That is why H+ is often called a proton. This species is central to discussion of acids. Under the Brønsted–Lowry acid–base theory, acids are proton donors, while bases are proton acceptors.
A bare proton, H+, cannot exist in solution or in ionic crystals because of its strong attraction to other atoms or molecules with electrons. Except at the high temperatures associated with plasmas, such protons cannot be removed from the electron clouds of atoms and molecules, and will remain attached to them. However, the term 'proton' is sometimes used loosely and metaphorically to refer to positively charged or cationic hydrogen attached to other species in this fashion, and as such is denoted "H+" without any implication that any single protons exist freely as a species.
To avoid the implication of the naked "solvated proton" in solution, acidic aqueous solutions are sometimes considered to contain a less unlikely fictitious species, termed the "hydronium ion" ([H3O]+). However, even in this case, such solvated hydrogen cations are more realistically conceived as being organized into clusters that form species closer to [H9O4]+.[54] Other oxonium ions are found when water is in acidic solution with other solvents.[55]
Although exotic on Earth, one of the most common ions in the universe is the H+3 ion, known as protonated molecular hydrogen or the trihydrogen cation.[56]
Isotopes



Hydrogen has three naturally occurring isotopes, denoted 1
H, 2
H and 3
H. Other, highly unstable nuclei (4
H to 7
H) have been synthesized in the laboratory but not observed in nature.[57][58]
- 1
H is the most common hydrogen isotope, with an abundance of more than 99.98%. Because the nucleus of this isotope consists of only a single proton, it is given the descriptive but rarely used formal name protium.[59] It is unique among all stable isotopes in having no neutrons; see diproton for a discussion of why others do not exist. - 2
H, the other stable hydrogen isotope, is known as deuterium and contains one proton and one neutron in the nucleus. Nearly all deuterium in the universe is thought to have been produced at the time of the Big Bang, and has endured since that time. Deuterium is not radioactive, and does not represent a significant toxicity hazard. Water enriched in molecules that include deuterium instead of normal hydrogen is called heavy water. Deuterium and its compounds are used as a non-radioactive label in chemical experiments and in solvents for 1
H-NMR spectroscopy.[60] Heavy water is used as a neutron moderator and coolant for nuclear reactors. Deuterium is also a potential fuel for commercial nuclear fusion.[61] - 3
H is known as tritium and contains one proton and two neutrons in its nucleus. It is radioactive, decaying into helium-3 through beta decay with a half-life of 12.32 years.[53] It is radioactive enough to be used in luminous paint to enhance the visibility of data displays, such as for painting the hands and dial-markers of watches. The watch glass prevents the small amount of radiation from escaping the case.[62] Small amounts of tritium are produced naturally by cosmic rays striking atmospheric gases; tritium has also been released during nuclear weapons tests.[63] It is used in nuclear fusion reactions,[64] as a tracer in isotope geochemistry,[65] and in specialized self-powered lighting devices.[66] Tritium has also been used in chemical and biological labeling experiments as a radiolabel.[67]
Unique among the elements, distinct names are assigned to its isotopes in common use. During the early study of radioactivity, heavy radioactive isotopes were given their own names, but they are no longer used, except for deuterium and tritium. The symbols D and T (instead of 2
H and 3
H) are sometimes used for deuterium and tritium, but the symbol P was already used for phosphorus and thus was not available for protium.[68] In its nomenclatural guidelines, the International Union of Pure and Applied Chemistry (IUPAC) allows any of D, T, 2
H, and 3
H to be used, although 2
H and 3
H are preferred.[69]
The exotic atom muonium (symbol Mu), composed of an antimuon and an electron, can also be considered a light radioisotope of hydrogen.[70] Because muons decay with lifetime 2.2 µs, muonium is too unstable for observable chemistry.[71] Nevertheless, muonium compounds are important test cases for quantum simulation, due to the mass difference between the antimuon and the proton,[72] and IUPAC nomenclature incorporates such hypothetical compounds as muonium chloride (MuCl) and sodium muonide (NaMu), analogous to hydrogen chloride and sodium hydride respectively.[73]
Thermal and physical properties
Table of thermal and physical properties of hydrogen (H2) at atmospheric pressure:[74][75]
| Temperature (K) | Density (kg/m^3) | Specific heat (kJ/kg K) | Dynamic viscosity (kg/m s) | Kinematic viscosity (m^2/s) | Thermal conductivity (W/m K) | Thermal diffusivity (m^2/s) | Prandtl Number |
History
Discovery and use
Robert Boyle

In 1671, the Irish scientist Robert Boyle discovered and described the reaction between iron filings and dilute acids, which results in the production of hydrogen gas.[76][77]
Having provided a saline spirit [hydrochloric acid], which by an uncommon way of preparation was made exceeding sharp and piercing, we put into a vial, capable of containing three or four ounces of water, a convenient quantity of filings of steel, which were not such as are commonly sold in shops to Chymists and Apothecaries, (those being usually not free enough from rust) but such as I had a while before caus'd to be purposely fil'd off from a piece of good steel. This metalline powder being moistn'd in the viol with a little of the menstruum, was afterwards drench'd with more; whereupon the mixture grew very hot, and belch'd up copious and stinking fumes; which whether they consisted altogether of the volatile sulfur of the Mars [iron], or of metalline steams participating of a sulfureous nature, and join'd with the saline exhalations of the menstruum, is not necessary to be here discuss'd. But whencesoever this stinking smoak proceeded, so inflammable it was, that upon the approach of a lighted candle to it, it would readily enough take fire, and burn with a blewish and somewhat greenish flame at the mouth of the viol for a good while together; and that, though with little light, yet with more strength than one would easily suspect.
— Robert Boyle, Tracts written by the Honourable Robert Boyle containing new experiments, touching the relation betwixt flame and air...
The word "sulfureous" may be somewhat confusing, especially since Boyle did a similar experiment with iron and sulfuric acid.[78] However, in all likelihood, "sulfureous" should here be understood to mean combustible.[79]
Henry Cavendish
In 1766, Henry Cavendish was the first to recognize hydrogen gas as a discrete substance, by naming the gas from a metal-acid reaction "inflammable air". He speculated that "inflammable air" was in fact identical to the hypothetical substance called "phlogiston"[80][81] and further finding in 1781 that the gas produces water when burned. He is usually given credit for the discovery of hydrogen as an element.[7][8]
Antoine Lavoisier

In 1783, Antoine Lavoisier identified the element that came to be known as hydrogen[82] when he and Laplace reproduced Cavendish's finding that water is produced when hydrogen is burned.[8] Lavoisier produced hydrogen for his experiments on mass conservation by reacting a flux of steam with metallic iron through an incandescent iron tube heated in a fire. Anaerobic oxidation of iron by the protons of water at high temperature can be schematically represented by the set of following reactions:
- 1) Fe + H2O → FeO + H2
- 2) Fe + 3 H2O → Fe2O3 + 3 H2
- 3) Fe + 4 H2O → Fe3O4 + 4 H2
Many metals such as zirconium undergo a similar reaction with water leading to the production of hydrogen.
19th century
François Isaac de Rivaz built the first de Rivaz engine, an internal combustion engine powered by a mixture of hydrogen and oxygen in 1806. Edward Daniel Clarke invented the hydrogen gas blowpipe in 1819. The Döbereiner's lamp and limelight were invented in 1823.[8]
Hydrogen was liquefied for the first time by James Dewar in 1898 by using regenerative cooling and his invention, the vacuum flask.[8] He produced solid hydrogen the next year.[8]
Hydrogen-lifted airship

The first hydrogen-filled balloon was invented by Jacques Charles in 1783.[8] Hydrogen provided the lift for the first reliable form of air-travel following the 1852 invention of the first hydrogen-lifted airship by Henri Giffard.[8] German count Ferdinand von Zeppelin promoted the idea of rigid airships lifted by hydrogen that later were called Zeppelins; the first of which had its maiden flight in 1900.[8] Regularly scheduled flights started in 1910 and by the outbreak of World War I in August 1914, they had carried 35,000 passengers without a serious incident. Hydrogen-lifted airships were used as observation platforms and bombers during the war.
The first non-stop transatlantic crossing was made by the British airship R34 in 1919. Regular passenger service resumed in the 1920s and the discovery of helium reserves in the United States promised increased safety, but the U.S. government refused to sell the gas for this purpose. Therefore, H2 was used in the Hindenburg airship, which was destroyed in a midair fire over New Jersey on 6 May 1937.[8] The incident was broadcast live on radio and filmed. Ignition of leaking hydrogen is widely assumed to be the cause, but later investigations pointed to the ignition of the aluminized fabric coating by static electricity. But the damage to hydrogen's reputation as a lifting gas was already done and commercial hydrogen airship travel ceased. Hydrogen is still used, in preference to non-flammable but more expensive helium, as a lifting gas for weather balloons.
Deuterium and tritium
Deuterium was discovered in December 1931 by Harold Urey, and tritium was prepared in 1934 by Ernest Rutherford, Mark Oliphant, and Paul Harteck.[7] Heavy water, which consists of deuterium in the place of regular hydrogen, was discovered by Urey's group in 1932.[8]
Hydrogen-cooled turbogenerator
The first hydrogen-cooled turbogenerator went into service using gaseous hydrogen as a coolant in the rotor and the stator in 1937 at Dayton, Ohio, owned by the Dayton Power & Light Co.[83] This was justified by the high thermal conductivity and very low viscosity of hydrogen gas, thus lower drag than air. This is the most common coolant used for generators 60 MW and larger; smaller generators are usually air-cooled.
Nickel–hydrogen battery
The nickel–hydrogen battery was used for the first time in 1977 aboard the U.S. Navy's Navigation technology satellite-2 (NTS-2).[84] The International Space Station,[85] Mars Odyssey[86] and the Mars Global Surveyor[87] are equipped with nickel-hydrogen batteries. In the dark part of its orbit, the Hubble Space Telescope is also powered by nickel-hydrogen batteries, which were finally replaced in May 2009,[88] more than 19 years after launch and 13 years beyond their design life.[89]
Role in quantum theory

Because of its simple atomic structure, consisting only of a proton and an electron, the hydrogen atom, together with the spectrum of light produced from it or absorbed by it, has been central to the development of the theory of atomic structure.[90] Furthermore, study of the corresponding simplicity of the hydrogen molecule and the corresponding cation H+2 brought understanding of the nature of the chemical bond, which followed shortly after the quantum mechanical treatment of the hydrogen atom had been developed in the mid-1920s.
One of the first quantum effects to be explicitly noticed (but not understood at the time) was a Maxwell observation involving hydrogen, half a century before full quantum mechanical theory arrived. Maxwell observed that the specific heat capacity of H2 unaccountably departs from that of a diatomic gas below room temperature and begins to increasingly resemble that of a monatomic gas at cryogenic temperatures. According to quantum theory, this behavior arises from the spacing of the (quantized) rotational energy levels, which are particularly wide-spaced in H2 because of its low mass. These widely spaced levels inhibit equal partition of heat energy into rotational motion in hydrogen at low temperatures. Diatomic gases composed of heavier atoms do not have such widely spaced levels and do not exhibit the same effect.[91]
Antihydrogen (
H
) is the antimatter counterpart to hydrogen. It consists of an antiproton with a positron. Antihydrogen is the only type of antimatter atom to have been produced as of 2015[update].[92][93]
Cosmic prevalence and distribution

Hydrogen, as atomic H, is the most abundant chemical element in the universe, making up 75 percent of normal matter by mass and more than 90 percent by number of atoms. (Most of the mass of the universe, however, is not in the form of chemical-element type matter, but rather is postulated to occur as yet-undetected forms of mass such as dark matter and dark energy.[94])
Hydrogen is found in great abundance in stars and gas giant planets. Molecular clouds of H2 are associated with star formation. Hydrogen plays a vital role in powering stars through the proton-proton reaction in case of stars with very low to approximately 1 mass of the Sun and the CNO cycle of nuclear fusion in case of stars more massive than the Sun.[95]
States
Throughout the universe, hydrogen is mostly found in the atomic and plasma states, with properties quite distinct from those of molecular hydrogen. As a plasma, hydrogen's electron and proton are not bound together, resulting in very high electrical conductivity and high emissivity (producing the light from the Sun and other stars). The charged particles are highly influenced by magnetic and electric fields. For example, in the solar wind they interact with the Earth's magnetosphere giving rise to Birkeland currents and the aurora.
Hydrogen is found in the neutral atomic state in the interstellar medium because the atoms seldom collide and combine. They are the source of the 21-cm hydrogen line at 1420 MHz that is detected in order to probe primordial hydrogen.[96] The large amount of neutral hydrogen found in the damped Lyman-alpha systems is thought to dominate the cosmological baryonic density of the universe up to a redshift of z = 4.[97]
Under ordinary conditions on Earth, elemental hydrogen exists as the diatomic gas, H2. Hydrogen gas is very rare in the Earth's atmosphere (around 0.53 ppm on a molar basis[98]) because of its light weight, which enables it to escape from the atmosphere more rapidly than heavier gases. However, hydrogen is the third most abundant element on the Earth's surface,[99] mostly in the form of chemical compounds such as hydrocarbons and water.[53]
A molecular form called protonated molecular hydrogen (H+3) is found in the interstellar medium, where it is generated by ionization of molecular hydrogen from cosmic rays. This ion has also been observed in the upper atmosphere of the planet Jupiter. The ion is relatively stable in the environment of outer space due to the low temperature and density. H+3 is one of the most abundant ions in the universe, and it plays a notable role in the chemistry of the interstellar medium.[100] Neutral triatomic hydrogen H3 can exist only in an excited form and is unstable.[101] By contrast, the positive hydrogen molecular ion (H+2) is a rare molecule in the universe.
Production
Many methods exist for producing H2, but three dominate commercially: steam reforming often coupled to water-gas shift, partial oxidation of hydrocarbons, and water electrolysis.[102]
Steam reforming
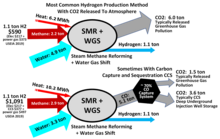
Hydrogen is mainly produced by steam methane reforming (SMR), the reaction of water and methane.[103][104] [105] Thus, at high temperatures (1000–1400 K, 700–1100 °C or 1300–2000 °F), steam (water vapor) reacts with methane to yield carbon monoxide and H2.
- CH4 + H2O → CO + 3 H2
Steam reforming is also used for the industrial preparation of ammonia.
This reaction is favored at low pressures, Nonetheless, conducted at high pressures (2.0 MPa, 20 atm or 600 inHg) because high-pressure H2 is the most marketable product, and pressure swing adsorption (PSA) purification systems work better at higher pressures. The product mixture is known as "synthesis gas" because it is often used directly for the production of methanol and many other compounds. Hydrocarbons other than methane can be used to produce synthesis gas with varying product ratios. One of the many complications to this highly optimized technology is the formation of coke or carbon:
- CH4 → C + 2 H2
Consequently, steam reforming typically employs an excess of H2O. Additional hydrogen can be recovered from the steam by use of carbon monoxide through the water gas shift reaction (WGS). This process requires an iron oxide catalyst:[105]
- CO + H2O → CO2 + H2
Hydrogen is sometimes produced and consumed in the same industrial process, without being separated. In the Haber process for the production of ammonia, hydrogen is generated from natural gas.[106]
Partial oxidation of hydrocarbons
Other methods for CO and H2 production include partial oxidation of hydrocarbons:[107]
- 2 CH4 + O2 → 2 CO + 4 H2
Although less important commercially, coal can serve as a prelude to the shift reaction above:[105]
- C + H2O → CO + H2
Olefin production units may produce substantial quantities of byproduct hydrogen particularly from cracking light feedstocks like ethane or propane.[108]
Water electrolysis

The electrolysis of water is a conceptually simple method of producing hydrogen.
- 2 H2O(l) → 2 H2(g) + O2(g)
Commercial electrolyzers use nickel-based catalysts in strongly alkaline solution. Platinum is a superior catalyst but is expensive.[109]
Electrolysis of brine to yield chlorine also produces hydrogen as a co-product.[110]
Methane pyrolysis
Водород можно получить пиролизом природного газа (метана).
Этот маршрут имеет меньший углеродный след, чем коммерческие процессы производства водорода. [111] [112] [113] [114] Разработка коммерческого процесса пиролиза метана может ускорить расширение использования водорода в промышленности и транспорте. Пиролиз метана осуществляется путем пропускания метана через расплавленный металлический катализатор, содержащий растворенный никель . Метан преобразуется в газообразный водород и твердый углерод . [115] [116]
- CH 4 (г) → C(т) + 2 H 2 (г) (ΔH° = 74 кДж/моль)
Углерод может быть продан в качестве производственного сырья или топлива или выброшен на свалку.
Дальнейшие исследования продолжаются в нескольких лабораториях, в том числе в Лаборатории жидких металлов Карлсруэ. [117] и в Калифорнийском университете в Санта-Барбаре. [118] BASF построил пилотную установку пиролиза метана. [119]
Термохимический
можно использовать более 200 термохимических циклов Для расщепления воды . Многие из этих циклов, такие как цикл оксида железа , цикл оксида церия (IV)-оксида церия (III) , цикл цинк-цинк-оксид , цикл сера-йод , цикл медь-хлор и гибридный цикл серы , были оценены на предмет их коммерческого потенциала. производить водород и кислород из воды и тепла без использования электричества. [120] Ряд лабораторий (в том числе во Франции , Германии , Греции , Японии и США ) разрабатывают термохимические методы получения водорода из солнечной энергии и воды. [121]
Лабораторные методы
H 2 производится в лабораториях часто как побочный продукт других реакций. Многие металлы реагируют с водой с образованием H 2 , но скорость выделения водорода зависит от металла, pH и присутствия легирующих добавок. Чаще всего выделение водорода вызывают кислоты. Щелочные и щелочноземельные металлы, алюминий, цинк, марганец и железо легко реагируют с водными кислотами. Эта реакция лежит в основе аппарата Киппа , который когда-то использовался в качестве лабораторного источника газа:
- Цинк + 2 Н + → Цинк 2+ + Ч 2
В отсутствие кислоты происходит выделение H 2 медленнее. Поскольку железо является широко используемым конструкционным материалом, его анаэробная коррозия имеет технологическое значение:
- Fe + 2 H 2 O → Fe(OH) 2 + H 2
Многие металлы, такие как алюминий , медленно реагируют с водой, поскольку образуют пассивированные оксидные покрытия. Однако сплав алюминия и галлия реагирует с водой. [122] При высоком pH алюминий может производить Ч2 :
- 2 Аl + 6 Н 2 О + 2 ОН − → 2 [Ал(ОН) 4 ] − + 3 Ч 2
Некоторые металлосодержащие соединения реагируют с кислотами с выделением Н 2 . В анаэробных условиях гидроксид железа ( Fe(OH)
2 ) может окисляться протонами воды с образованием магнетита и Н 2 . Этот процесс описывается реакцией Шикорра :
- 3 Fe(OH) 2 → Fe 3 O 4 + 2 H 2 O + H 2
Этот процесс происходит при анаэробной коррозии железа и стали в бескислородных грунтовых водах и при восстановлении почв ниже уровня грунтовых вод .
Биоводород
H 2 вырабатывается ферментами гидрогеназами при некоторых ферментациях . [123]
Уэллс
Есть скважина в Мали и месторождения в ряде других стран, например, во Франции. [124]
Приложения

Нефтехимическая промышленность
Большое количество H 2 используются при «модернизации» ископаемого топлива . Ключевые потребители H 2 включают гидродесульфурацию и гидрокрекинг . Многие из этих реакций можно отнести к гидрогенолизу , т. е. разрыву связей водородом. Показательным является отделение серы из жидкого ископаемого топлива: [102]
- Р 2 С + 2 Ч 2 → Ч 2 С + 2 Правая
гидрирование
Гидрирование , добавление H 2 на различные подложки проводится в больших масштабах. Гидрирование N 2 для производства аммиака по процессу Габера-Боша потребляет несколько процентов энергетического бюджета всей отрасли. Полученный аммиак используется для обеспечения большей части белка, потребляемого человеком. [126] Гидрирование используется для преобразования ненасыщенных жиров и масел в насыщенные (транс) жиры и масла. Основное применение — производство маргарина . Метанол получают гидрированием углекислого газа. Это также источник водорода при производстве соляной кислоты . H 2 также используется в качестве восстановителя при превращении некоторых руд в металлы. [127]
охлаждающая жидкость
Водород обычно используется на электростанциях в качестве теплоносителя в генераторах благодаря ряду полезных свойств, которые являются прямым результатом его легких двухатомных молекул. К ним относятся низкая плотность , низкая вязкость и самая высокая удельная теплоемкость и теплопроводность среди всех газов.
Энергоноситель
Элементарный водород широко обсуждается в контексте энергетики как энергоноситель, способный способствовать декарбонизации экономики и снижению выбросов парниковых газов. [128] [129] Поэтому для этого необходимо производить чистый водород в количествах, которые будут поставляться в сектора и приложения, где более дешевые и более энергоэффективные альтернативы смягчения последствий ограничены. К ним относятся тяжелая промышленность и перевозки на дальние расстояния. [128] Водород является «носителем» энергии, а не энергетическим ресурсом, поскольку не существует природного источника водорода в полезных количествах. [130]
Водород можно использовать в качестве источника энергии в топливных элементах для производства электроэнергии или путем сжигания для выработки тепла. [19] Когда водород потребляется в топливных элементах, единственным выбросом в месте использования является водяной пар. [19] Сгорание водорода может привести к термическому образованию вредных оксидов азота . [19] Общие выбросы водорода в течение жизненного цикла зависят от того, как он производится. Почти весь нынешний мировой запас водорода создается из ископаемого топлива. [131] [132] Основным методом является паровая конверсия метана , при которой водород получается в результате химической реакции между паром и метаном , основным компонентом природного газа. При производстве одной тонны водорода с помощью этого процесса выделяется 6,6–9,3 тонны углекислого газа. [133] Хотя улавливание и хранение углерода (CCS) могло бы устранить значительную часть этих выбросов, общий углеродный след водорода из природного газа по состоянию на 2021 год оценить сложно. [update], отчасти из-за выбросов (включая выбрасываемый и неорганизованный метан ), образующихся при производстве самого природного газа. [134]
Электричество можно использовать для расщепления молекул воды и получения устойчивого водорода при условии, что электричество вырабатывается экологически устойчивым способом. Однако этот процесс электролиза в настоящее время дороже, чем получение водорода из метана без CCS, а эффективность преобразования энергии по своей сути низка. [129] Водород можно производить, когда имеется избыток возобновляемой электроэнергии , а затем хранить и использовать для выработки тепла или для регенерации электроэнергии. [135] Водород, полученный посредством электролиза с использованием возобновляемых источников энергии, обычно называют « зеленым водородом ». [136] В дальнейшем его можно перерабатывать в синтетическое топливо, такое как аммиак и метанол . [137]
Инновации в области электролизеров водорода могут сделать крупномасштабное производство водорода из электроэнергии более конкурентоспособным. [138] Водород, производимый таким способом, может сыграть значительную роль в декарбонизации энергетических систем, где существуют проблемы и ограничения для замены ископаемого топлива прямым использованием электроэнергии. [128]
Водородное топливо может производить интенсивное тепло, необходимое для промышленного производства стали, цемента, стекла и химикатов, тем самым способствуя декарбонизации промышленности наряду с другими технологиями, такими как электродуговые печи для производства стали. [139] Однако он, вероятно, будет играть более важную роль в обеспечении промышленного сырья для более чистого производства аммиака и органических химикатов. [128] Например, в сталелитейном производстве водород может выступать в качестве экологически чистого энергоносителя, а также в качестве низкоуглеродного катализатора, заменяющего кокс, получаемый из угля . [140] Водород, используемый для декарбонизации транспорта, вероятно, найдет наибольшее применение в судоходстве, авиации и, в меньшей степени, в грузовых автомобилях за счет использования синтетического топлива, полученного из водорода, такого как аммиак и метанол , а также технологии топливных элементов. [128] Для транспортных средств малой грузоподъемности, включая легковые автомобили, водород значительно отстает от других транспортных средств на альтернативном топливе , особенно по сравнению с темпами внедрения аккумуляторных электромобилей , и может не играть существенной роли в будущем. [141]
К недостаткам водорода как энергоносителя относятся высокие затраты на хранение и распространение из-за взрывоопасности водорода, его большого объема по сравнению с другими видами топлива и склонности к хрупкости труб. [134]
Полупроводниковая промышленность
Водород используется для насыщения разорванных («оборванных») связей аморфного кремния и аморфного углерода , что помогает стабилизировать свойства материала. [142] Он также является потенциальным донором электронов в различных оксидных материалах, включая ZnO . [143] [144] SnO 2 , CdO , MgO , [145] ЗрО 2 , HfO 2 , Ла2О3 O3, Y 2 О 3 , ТиО 2 , СрТиО 3 , ЛаАлО3 , SiO 2 , Ал2О3 O3, ZrSiO 4 , HfSiO 4 и SrZrO3 . [146]
Ниша и развивающееся использование
- Защитный газ: Водород используется в качестве защитного газа в таких методах сварки , как сварка атомарным водородом . [147] [148]
- Криогенные исследования: Жидкость H 2 используется в криогенных исследованиях, в том числе в исследованиях сверхпроводимости . [149]
- Плавучий подъем: потому что H 2 легче воздуха, имея лишь 7% плотности воздуха, когда-то он широко использовался в качестве подъемного газа в воздушных шарах и дирижаблях . [150]
- Обнаружение утечек: Водород в чистом виде или в смеси с азотом (иногда называемым формовочным газом ) является индикаторным газом для обнаружения мельчайших утечек. Приложения можно найти в автомобильной, химической, энергетической, аэрокосмической и телекоммуникационной отраслях. [151] Водород является разрешенной пищевой добавкой (Е 949), которая позволяет проверять герметичность упаковки пищевых продуктов, а также обладает антиоксидантными свойствами. [152]
- Замедление нейтронов: Дейтерий (водород-2) используется в приложениях ядерного деления в качестве замедлителя для замедления нейтронов .
- Топливо для ядерного синтеза: Дейтерий используется в ядерного синтеза . реакциях [8]
- Изотопная маркировка. Соединения дейтерия находят применение в химии и биологии при изучении влияния изотопов на скорость реакций. [153]
- Ракетное топливо: жидкий водород и жидкий кислород вместе служат криогенным топливом в жидкостных ракетах , например, в главных двигателях космических шаттлов . НАСА исследовало использование ракетного топлива, изготовленного из атомарного водорода, бора или углерода, замороженного в твердые молекулярные частицы водорода, суспендированные в жидком гелии. При нагревании смесь испаряется, позволяя атомным частицам рекомбинироваться, нагревая смесь до высокой температуры. [154]
- Использование трития: Тритий (водород-3), производимый в ядерных реакторах , используется при производстве водородных бомб , [155] как изотопная метка в биологических науках, [67] и в качестве источника бета-излучения в радиолюминесцентной краске для циферблатов приборов и аварийных указателей. [62]
Биологические реакции
H 2 является продуктом некоторых типов анаэробного метаболизма и вырабатывается несколькими микроорганизмами , обычно в результате реакций катализируемых ферментами железо- или никельсодержащими , называемыми , гидрогеназами . Эти ферменты катализируют обратимую окислительно-восстановительную реакцию между H 2 и его составляющая два протона и два электрона. Образование газообразного водорода происходит при переносе восстанавливающих эквивалентов, образующихся при пируватном брожении , в воду. [156] Естественный цикл производства и потребления водорода организмами называется водородным циклом . [157] Бактерии, такие как Mycobacterium smegmatis, могут использовать небольшое количество водорода в атмосфере в качестве источника энергии, когда другие источники отсутствуют, используя гидрогеназу с небольшими каналами, которые исключают кислород и, таким образом, позволяют реакции происходить, даже если концентрация водорода очень низкая. а концентрация кислорода такая же, как в обычном воздухе. [98] [158]
Водород является наиболее распространенным элементом в человеческом организме по количеству атомов элемента, но третьим по распространенности элементом по массе. Н 2 появляется в дыхании человека вследствие метаболической активности гидрогеназосодержащих микроорганизмов в толстом кишечнике и является естественным компонентом газов . Концентрация в дыхании голодающих людей в состоянии покоя обычно составляет менее 5 частей на миллион (ppm), но может достигать 50 ppm, когда люди с кишечными расстройствами потребляют молекулы, которые они не могут усвоить во время диагностических водородных дыхательных тестов . [159]
Расщепление воды , при котором вода разлагается на составляющие ее протоны, электроны и кислород, происходит в световых реакциях у всех фотосинтезирующих организмов. Некоторые такие организмы, в том числе водоросли Chlamydomonas Reinhardtii и цианобактерии , развили вторую стадию темновых реакций , в которых протоны и электроны восстанавливаются с образованием Газ H 2 под действием специализированных гидрогеназ в хлоропластах . [160] Были предприняты усилия по генетической модификации цианобактериальных гидрогеназ для эффективного синтеза. Газ H 2 даже в присутствии кислорода. [161] Были также предприняты усилия по использованию генетически модифицированных водорослей в биореакторе . [162]
Безопасность и меры предосторожности
| Опасности | |
|---|---|
| СГС Маркировка : | |
 | |
| Опасность | |
| Н220 | |
| П202 , П210 , П271 , П377 , П381 , П403 [163] | |
| NFPA 704 (огненный алмаз) | |
Водород представляет ряд опасностей для безопасности человека: от возможных детонаций и пожаров при смешивании с воздухом до удушливого действия в чистой, бескислородной форме. [164] Кроме того, жидкий водород является криогеном и представляет опасность (например, обморожение ), связанную с очень холодными жидкостями. [165] Водород растворяется во многих металлах и помимо утечки может оказывать на них вредное воздействие, например, водородное охрупчивание . [166] что приводит к трещинам и взрывам. [167] Водород, попадающий в наружный воздух, может самовозгораться. Более того, водородный огонь, хотя и очень горячий, практически невидим и поэтому может привести к случайным ожогам. [168]
Даже интерпретация данных по водороду (включая данные по безопасности) затруднена рядом явлений. Многие физические и химические свойства водорода зависят от соотношения параводород/ортоводород (при данной температуре часто требуются дни или недели для достижения равновесного соотношения, для которого обычно приводятся данные). Параметры детонации водорода, такие как критическое давление и температура детонации, сильно зависят от геометрии контейнера. [164]
См. также
- Водородная электростанция комбинированного цикла
- Водородная экономика . Использование водорода для декарбонизации секторов, которые трудно электрифицировать.
- Производство водорода – Промышленное производство молекулярного водорода
- Безопасность водорода . Процедуры безопасного производства, обращения и использования водорода.
- Водородные технологии - Технологии, связанные с производством и использованием водорода.
- Водородный транспорт
- Жидкий водород - жидкое состояние элемента водорода.
- Пиролиз метана – Термическое разложение материалов. (для водорода).
- Природный водород - Молекулярный водород, встречающийся на Земле в природе.
- Пиролиз - Термическое разложение материалов.
Примечания
- ^ Однако большая часть массы Вселенной находится не в форме барионов или химических элементов. См. темную материю и темную энергию .
- ^ 286 кДж/моль: энергия на моль горючего материала (молекулярного водорода).
Ссылки
- ^ «Стандартные атомные массы: водород» . ЦИАВ . 2009.
- ^ Прохаска, Томас; Ирргехер, Йоханна; Бенефилд, Жаклин; Бёлке, Джон К.; Чессон, Лесли А.; Коплен, Тайлер Б.; Дин, Типинг; Данн, Филип Дж. Х.; Грёнинг, Манфред; Холден, Норман Э.; Мейер, Харро Эй Джей (4 мая 2022 г.). «Стандартные атомные веса элементов 2021 (Технический отчет ИЮПАК)» . Чистая и прикладная химия . дои : 10.1515/pac-2019-0603 . ISSN 1365-3075 .
- ^ Виберг, Эгон; Виберг, Нильс; Холлеман, Арнольд Фредерик (2001). Неорганическая химия . Академическая пресса. стр. 240. ISBN 978-0123526519 .
- ^ Арбластер, Джон В. (2018). Некоторые значения кристаллографических свойств элементов . Парк материалов, Огайо: ASM International. ISBN 978-1-62708-155-9 .
- ^ Лиде, Д.Р., изд. (2005). «Магнитная восприимчивость элементов и неорганических соединений». Справочник CRC по химии и физике (PDF) (86-е изд.). Бока-Ратон (Флорида): CRC Press. ISBN 978-0-8493-0486-6 .
- ^ Уэст, Роберт (1984). CRC, Справочник по химии и физике . Бока-Ратон, Флорида: Издательство компании Chemical Rubber Company. стр. E110. ISBN 978-0-8493-0464-4 .
- ^ Jump up to: Перейти обратно: а б с «Водород». Химическая энциклопедия Ван Ностранда . Уайли-Интерсайенс. 2005. стр. 797–799. ISBN 978-0-471-61525-5 .
- ^ Jump up to: Перейти обратно: а б с д и ж г час я дж к л Эмсли, Джон (2001). Строительные блоки природы . Оксфорд: Издательство Оксфордского университета. стр. 183–191. ISBN 978-0-19-850341-5 .
- ^ Мишковец, Павел (апрель 2023 г.). «Игра в имена: История наименований химических элементов — часть 1 — от древности до конца XVIII века» . Основы химии . 25 (1): 29–51. дои : 10.1007/s10698-022-09448-5 .
- ^ Ствертка, Альберт (1996). Руководство по элементам . Издательство Оксфордского университета. стр. 16–21. ISBN 978-0-19-508083-4 .
- ^ «Дигидроген» . O=CHem Каталог . Университет Южного Мэна . Архивировано из оригинала 13 февраля 2009 года . Проверено 6 апреля 2009 г.
- ^ «Водород» . Британская энциклопедия . Архивировано из оригинала 24 декабря 2021 года . Проверено 25 декабря 2021 г.
- ^ Бойд, Пади (19 июля 2014 г.). «Каков химический состав звезд?» . НАСА . Архивировано из оригинала 15 января 2015 года . Проверено 5 февраля 2008 г.
- ^ Танабаши, М.; и др. (2018). «Космология большого взрыва» (PDF) . Физический обзор D . 98 (3): 358. doi : 10.1103/PhysRevD.98.030001 . Архивировано (PDF) из оригинала 29 июня 2021 года - через группу данных о частицах Беркли Национальной лаборатории Лоуренса в .
Глава 21.4.1 - Это произошло, когда возраст Вселенной составлял около 370 000 лет.
(Пересмотрено в сентябре 2017 г.) Кейт А. Олив и Джон А. Пикок . - ^ Лаурсен, С.; Чанг, Дж.; Медлин, В.; Гюрмен, Н.; Фоглер, HS (27 июля 2004 г.). «Чрезвычайно краткое введение в вычислительную квантовую химию» . Молекулярное моделирование в химической технологии . Мичиганский университет. Архивировано из оригинала 20 мая 2015 года . Проверено 4 мая 2015 г.
- ^ Докладчик: профессор Джим Аль-Халили (21 января 2010 г.). «Открытие стихий» . Химия: изменчивая история . 25:40 минута. BBC . BBC Четыре . Архивировано из оригинала 25 января 2010 года . Проверено 9 февраля 2010 г.
- ^ Динсер, Ибрагим; Акар, Канан (14 сентября 2015 г.). «Обзор и оценка методов производства водорода для повышения устойчивости» . Международный журнал водородной энергетики . 40 (34): 11094–11111. Бибкод : 2015IJHE...4011094D . doi : 10.1016/j.ijhydene.2014.12.035 . ISSN 0360-3199 . Архивировано из оригинала 15 февраля 2022 года . Проверено 4 февраля 2022 г.
- ^ «Основы водорода – Производство» . Центр солнечной энергии Флориды . 2007. Архивировано из оригинала 18 февраля 2008 года . Проверено 5 февраля 2008 г.
- ^ Jump up to: Перейти обратно: а б с д и ж Льюис, Аластер К. (10 июня 2021 г.). «Оптимизация сопутствующих выгод от качества воздуха в водородной экономике: аргументы в пользу конкретных водородных стандартов выбросов NO x» . Наука об окружающей среде: Атмосфера . 1 (5): 201–207. дои : 10.1039/D1EA00037C . S2CID 236732702 .
 В эту статью включен текст из этого источника, доступного по лицензии CC BY 3.0 .
В эту статью включен текст из этого источника, доступного по лицензии CC BY 3.0 . - ^ Jump up to: Перейти обратно: а б Роджерс, ХК (1999). «Водородное охрупчивание металлов». Наука . 159 (3819): 1057–1064. Бибкод : 1968Sci...159.1057R . дои : 10.1126/science.159.3819.1057 . ПМИД 17775040 . S2CID 19429952 .
- ^ Комитет по альтернативам и стратегиям будущего производства и использования водорода (2004 г.). Водородная экономика: возможности, затраты, барьеры и потребности в исследованиях и разработках . Пресса национальных академий . п. 240. ИСБН 978-0-309-09163-3 . Архивировано из оригинала 29 января 2021 года . Проверено 3 сентября 2020 г.
- ^ Каркасси, Миннесота; Финески, Ф. (2005). «Дефлаграция бедных смесей H 2 –воздух и CH 4 –воздух в вентилируемой многокамерной среде». Энергия . 30 (8): 1439–1451. Бибкод : 2005Ene....30.1439C . дои : 10.1016/j.energy.2004.02.012 .
- ^ Патнаик, П. (2007). Комплексное руководство по опасным свойствам химических веществ . Уайли-Интерсайенс. п. 402. ИСБН 978-0-471-71458-3 . Архивировано из оригинала 26 января 2021 года . Проверено 3 сентября 2020 г.
- ^ Шефер, EW; Кулатилака, В.Д.; Паттерсон, Б.Д.; Сеттерстен, ТБ (июнь 2009 г.). «Видимое излучение водородного пламени» . Горение и пламя . 156 (6): 1234–1241. Бибкод : 2009CoFl..156.1234S . дои : 10.1016/j.combustflame.2009.01.011 . Архивировано из оригинала 29 января 2021 года . Проверено 30 июня 2019 г.
- ^ «Мифы о катастрофе Гинденбурга» . Дирижабли.нет . Архивировано из оригинала 20 апреля 2021 года . Проверено 29 марта 2021 г.
- ^ Лиде, Дэвид Р., изд. (2006). Справочник CRC по химии и физике (87-е изд.). Бока-Ратон, Флорида: CRC Press . ISBN 0-8493-0487-3 .
- ^ Клейтон, Д.Д. (2003). Справочник по изотопам в космосе: от водорода до галлия . Издательство Кембриджского университета . ISBN 978-0-521-82381-4 .
- ^ Лаборатории НААП (2009). «Уровни энергии» . Университет Небраски, Линкольн. Архивировано из оригинала 11 мая 2015 года . Проверено 20 мая 2015 г.
- ^ «длина волны фотона 13,6 эВ» . Вольфрам Альфа . 20 мая 2015 года. Архивировано из оригинала 12 мая 2016 года . Проверено 20 мая 2015 г.
- ^ Стерн, ДП (16 мая 2005 г.). «Атомное ядро и ранняя модель атома Бора» . Центр космических полетов имени Годдарда НАСА (зеркало). Архивировано из оригинала 17 октября 2008 года . Проверено 20 декабря 2007 г.
- ^ Стерн, Д.П. (13 февраля 2005 г.). «Волновая механика» . Центр космических полетов имени Годдарда НАСА. Архивировано из оригинала 13 мая 2008 года . Проверено 16 апреля 2008 г.
- ^ Персонал (2003). «Свойства, использование и применение водорода (H 2 ): газообразный водород и жидкий водород» . Universal Industrial Gases, Inc. Архивировано из оригинала 19 февраля 2008 года . Проверено 5 февраля 2008 г.
- ^ Грин, Ричард А.; и др. (2012). «Теория и практика гиперполяризации в магнитном резонансе с использованием параводорода » . Прог. Нукл. Магн. Резон. Спектроск . 67 : 1–48. Бибкод : 2012PNMRS..67....1G . дои : 10.1016/j.pnmrs.2012.03.001 . ПМИД 23101588 . Архивировано из оригинала 28 августа 2021 года . Проверено 28 августа 2021 г.
- ^ «Открытие параводорода» . Институт биофизической химии Макса Планка (на немецком языке). Архивировано из оригинала 16 ноября 2020 года . Проверено 9 ноября 2020 г.
- ^ Миленко, Ю. Я.; Сибилева Р.М.; Стржемечный, М.А. (1997). «Степень естественной орто-пара-конверсии в жидком и газообразном водороде». Журнал физики низких температур . 107 (1–2): 77–92. Бибкод : 1997JLTP..107...77M . дои : 10.1007/BF02396837 . S2CID 120832814 .
- ^ Хритц, Дж. (март 2006 г.). «Гл. 6 – Водород» (PDF) . Руководство по безопасности Гленна НАСА, Исследовательский центр Гленна, документ GRC-MQSA.001 . НАСА. Архивировано из оригинала (PDF) 16 февраля 2008 года . Проверено 5 февраля 2008 г.
- ^ Амос, Уэйд А. (1 ноября 1998 г.). «Затраты на хранение и транспортировку водорода» (PDF) . Национальная лаборатория возобновляемых источников энергии. стр. 6–9. Архивировано (PDF) из оригинала 26 декабря 2014 года . Проверено 19 мая 2015 г.
- ^ Свадленак, Р.Э.; Скотт, AB (1957). «Превращение орто- в параводород на катализаторах оксида железа и оксида цинка». Журнал Американского химического общества . 79 (20): 5385–5388. дои : 10.1021/ja01577a013 .
- ^ Кларк, Дж. (2002). «Кислотность галогеноводородов» . Химгид . Архивировано из оригинала 20 февраля 2008 года . Проверено 9 марта 2008 г.
- ^ Кимбалл, JW (7 августа 2003 г.). «Водород» . Страницы биологии Кимбалла . Архивировано из оригинала 4 марта 2008 года . Проверено 4 марта 2008 г.
- ^ Сборник химической терминологии IUPAC, электронная версия, Водородная связь. Архивировано 19 марта 2008 г. в Wayback Machine.
- ^ Сандрок, Г. (2 мая 2002 г.). «Системы Металл-Водород» . Сандианские национальные лаборатории. Архивировано из оригинала 24 февраля 2008 года . Проверено 23 марта 2008 г.
- ^ Jump up to: Перейти обратно: а б «Структура и номенклатура углеводородов» . Университет Пердью. Архивировано из оригинала 11 июня 2012 года . Проверено 23 марта 2008 г.
- ^ «Органическая химия» . Словарь.com . Издательская группа Лексико. 2008. Архивировано из оригинала 18 апреля 2008 года . Проверено 23 марта 2008 г.
- ^ «Биохимия» . Словарь.com . Издательская группа Лексико. 2008. Архивировано из оригинала 29 марта 2008 года . Проверено 23 марта 2008 г.
- ^ Такешита, Т.; Уоллес, МЫ; Крейг, Р.С. (1974). «Растворимость водорода в соединениях иттрия или тория и никеля или кобальта 1:5». Неорганическая химия . 13 (9): 2282–2283. дои : 10.1021/ic50139a050 .
- ^ Кирххайм, Р.; Мучеле, Т.; Кинингер, В.; Глейтер, Х.; Бирринджер, Р.; Кобле, Т. (1988). «Водород в аморфных и нанокристаллических металлах». Материаловедение и инженерия . 99 (1–2): 457–462. дои : 10.1016/0025-5416(88)90377-1 .
- ^ Кирххайм, Р. (1988). «Растворимость и диффузия водорода в дефектных и аморфных металлах». Прогресс в материаловедении . 32 (4): 262–325. дои : 10.1016/0079-6425(88)90010-2 .
- ^ Кристенсен, Швейцария; Норсков, Дж. К.; Йоханнессен, Т. (9 июля 2005 г.). «Сделать общество независимым от ископаемого топлива – датские исследователи раскрывают новую технологию» . Технический университет Дании . Архивировано из оригинала 21 мая 2015 года . Проверено 19 мая 2015 г.
- ^ Моерс, К. (1920). «Исследования солевого характера гидрида лития» . Журнал неорганической и общей химии . 113 (191): 179–228. дои : 10.1002/zaac.19201130116 . Архивировано (PDF) из оригинала 24 августа 2019 г. Проверено 24 августа 2019 г.
- ^ Даунс, Эй Джей; Пулхэм, ЧР (1994). «Гидриды алюминия, галлия, индия и таллия: переоценка». Обзоры химического общества . 23 (3): 175–184. дои : 10.1039/CS9942300175 .
- ^ Хиббс, Делавэр; Джонс, К.; Смитис, Северная Каролина (1999). «Чрезвычайно стабильный комплекс тригидрида индия: синтез и характеристика [InH 3 P(C 6 H 11 ) 3 ]». Химические коммуникации (2): 185–186. дои : 10.1039/a809279f .
- ^ Jump up to: Перейти обратно: а б с Мисслер, Г.Л.; Тарр, Д.А. (2003). Неорганическая химия (3-е изд.). Прентис Холл. ISBN 978-0-13-035471-6 .
- ^ Окумура, AM; Да, ЛИ; Майерс, доктор медицинских наук; Ли, Ю.Т. (1990). «Инфракрасные спектры сольватированного иона гидроксония: колебательная предиссоциационная спектроскопия массово-селектированного H 3 O+•(H 2 O )n •(H 2 ) m ». Журнал физической химии . 94 (9): 3416–3427. дои : 10.1021/j100372a014 .
- ^ Пердонсин, Г.; Скоррано, Г. (1977). «Равновесия протонирования в воде при нескольких температурах спиртов, простых эфиров, ацетона, диметилсульфида и диметилсульфоксида». Журнал Американского химического общества . 99 (21): 6983–6986. дои : 10.1021/ja00463a035 .
- ^ Кэррингтон, А.; Макнаб, ИК (1989). «Инфракрасный спектр предиссоциации трехатомного катиона водорода (H 3 + )». Отчеты о химических исследованиях . 22 (6): 218–222. doi : 10.1021/ar00162a004 .
- ^ Gurov, Y. B.; Aleshkin, D. V.; Behr, M. N.; Lapushkin, S. V.; Morokhov, P. V.; Pechkurov, V. A.; Poroshin, N. O.; Sandukovsky, V. G.; Tel'kushev, M. V.; Chernyshev, B. A.; Tschurenkova, T. D. (2004). "Spectroscopy of superheavy hydrogen isotopes in stopped-pion absorption by nuclei". Physics of Atomic Nuclei . 68 (3): 491–97. Bibcode : 2005PAN....68..491G . doi : 10.1134/1.1891200 . S2CID 122902571 .
- ^ Коршенинников А.; Никольский Е.; Кузьмин Е.; Одзава, А.; Моримото, К.; Токанай, Ф.; Канунго, Р.; Танихата, И.; и др. (2003). «Экспериментальные доказательства существования 7 H и для конкретной структуры 8 He». Physical Review Letters . 90 (8): 082501. Bibcode : 2003PhRvL..90h2501K . doi : 10.1103/PhysRevLett.90.082501 . PMID 12633420 .
- ^ Юри, ХК; Брикведде, ФГ; Мерфи, генеральный директор (1933). «Названия изотопов водорода». Наука . 78 (2035): 602–603. Бибкод : 1933Sci....78..602U . дои : 10.1126/science.78.2035.602 . ПМИД 17797765 .
- ^ Ода, Ю.; Накамура, Х.; Ямадзаки, Т.; Нагаяма, К.; Ёсида, М.; Канайя, С.; Икехара, М. (1992). «Исследование 1H-ЯМР дейтерированной рибонуклеазы HI, избирательно меченной протонированными аминокислотами». Журнал биомолекулярного ЯМР . 2 (2): 137–47. дои : 10.1007/BF01875525 . ПМИД 1330130 . S2CID 28027551 .
- ^ Броуд, WJ (11 ноября 1991 г.). «Прорыв в области ядерного синтеза дает надежду на будущее» . Нью-Йорк Таймс . Архивировано из оригинала 29 января 2021 года . Проверено 12 февраля 2008 г.
- ^ Jump up to: Перейти обратно: а б Трауб, Р.Дж.; Дженсен, Дж. А. (июнь 1995 г.). «Тритиевые радиолюминесцентные устройства. Руководство по охране труда и технике безопасности» (PDF) . Международное агентство по атомной энергии. п. 2.4. Архивировано (PDF) из оригинала 6 сентября 2015 года . Проверено 20 мая 2015 г.
- ^ Персонал (15 ноября 2007 г.). «Тритий» . Агентство по охране окружающей среды США. Архивировано из оригинала 2 января 2008 года . Проверено 12 февраля 2008 г.
- ^ Нейв, Чехия (2006). «Дейтерий-тритиевый синтез» . Гиперфизика . Государственный университет Джорджии. Архивировано из оригинала 16 марта 2008 года . Проверено 8 марта 2008 г.
- ^ Кендалл, К.; Колдуэлл, Э. (1998). К. Кендалл; Джей Джей МакДоннелл (ред.). «Глава 2: Основы изотопной геохимии» . Изотопные индикаторы в гидрологии водосборных бассейнов . Геологическая служба США: 51–86. дои : 10.1016/B978-0-444-81546-0.50009-4 . Архивировано из оригинала 14 марта 2008 года . Проверено 8 марта 2008 г.
- ^ «Тритиевая лаборатория» . Университет Майами. 2008. Архивировано из оригинала 28 февраля 2008 года . Проверено 8 марта 2008 г.
- ^ Jump up to: Перейти обратно: а б Холте, А.Е.; Хоук, Массачусетс; Колли, Нидерланды (2004). «Потенциальная роль паразитизма в эволюции мутуализма у астигматидных клещей». Экспериментальная и прикладная акарология . 25 (2): 97–107. дои : 10.1023/A:1010655610575 . ПМИД 11513367 . S2CID 13159020 .
- ^ ван дер Крогт, П. (5 мая 2005 г.). «Водород» . Элементимология и элементы Multidict. Архивировано из оригинала 23 января 2010 года . Проверено 20 декабря 2010 г.
- ^ § IR-3.3.2, Предварительные рекомендации. Архивировано 9 февраля 2016 г. в Wayback Machine , Отдел номенклатуры неорганической химии, химической номенклатуры и представления структуры, ИЮПАК. Доступ онлайн 3 октября 2007 г.
- ^ ИЮПАК (1997). «Муоний» . В AD Макнот, А. Уилкинсон (ред.). Сборник химической терминологии (2-е изд.). Научные публикации Блэквелла . дои : 10.1351/goldbook.M04069 . ISBN 978-0-86542-684-9 . Архивировано из оригинала 13 марта 2008 года . Проверено 15 ноября 2016 г.
- ^ Фольксваген Хьюз; и др. (1960). «Образование мюония и наблюдение его ларморовской прецессии». Письма о физических отзывах . 5 (2): 63–65. Бибкод : 1960PhRvL...5...63H . дои : 10.1103/PhysRevLett.5.63 .
- ^ Бонди, Дания; Коннор, JNL; Манц, Дж.; Ремельт, Дж. (20 октября 1983 г.). «Точное квантовое и колебательно-адиабатическое квантовое, полуклассическое и квазиклассическое исследование коллинеарных реакций Cl + MuCl, Cl + HCl, Cl + DCl». Молекулярная физика . 50 (3): 467–488. Бибкод : 1983MolPh..50..467B . дои : 10.1080/00268978300102491 . ISSN 0026-8976 .
- ^ WH Коппенол; ИЮПАК (2001). «Названия атомов мюония и водорода и их ионов» (PDF) . Чистая и прикладная химия . 73 (2): 377–380. дои : 10.1351/pac200173020377 . S2CID 97138983 . Архивировано (PDF) из оригинала 14 мая 2011 года . Проверено 15 ноября 2016 г.
- ^ Холман, Джек П. (2002). Теплопередача (9-е изд.). Нью-Йорк, штат Нью-Йорк: МакГроу-Хилл. стр. 600–606. ISBN 0-07-240655-0 . OCLC 46959719 .
- ^ Инкропера, Фрэнк П .; Девитт, Дэвид П.; Бергман, Теодор Л.; Лавин, Адриенн С. (2007). Основы тепломассообмена (6-е изд.). Хобокен, Нью-Джерси: John Wiley and Sons, Inc., стр. 941–950. ISBN 978-0-471-45728-2 . OCLC 62532755 .
- ^ Бойль, Р. (1672). Трактаты, написанные достопочтенным Робертом Бойлем, содержащие новые эксперименты, затрагивающие связь между пламенем и воздухом, а также взрывы, гидростатический дискурс, вызванный некоторыми возражениями доктора Генри Мора против некоторых объяснений новых экспериментов, сделанных автором этих трактатов. : К которому прилагается гидростатическое письмо, поясняющее эксперимент о способе взвешивания воды в воде, новые эксперименты о положительной или относительной легкости тел под водой, о воздействии воздуха на тела под водой, о различии давление тяжелых твердых тел и жидкостей . Напечатано для Ричарда Дэвиса. стр. 64–65.
- ^ Зима, М. (2007). «Водород: исторические сведения» . WebElements Ltd. Архивировано из оригинала 10 апреля 2008 года . Проверено 5 февраля 2008 г.
- ^ Шидло, ЗА (2020). «Водород – некоторые исторические моменты» . Химия-Дидактика-Экология-Метрология . 25 (1–2): 5–34. doi : 10.2478/cdem-2020-0001 . S2CID 231776282 .
- ^ Рамзи, В. (1896). Газы атмосферы: История их открытия . Макмиллан. п. 19.
- ^ Масгрейв, А. (1976). «Почему кислород вытеснил флогистон? Исследовательские программы химической революции» . В Хаусоне, К. (ред.). Метод и оценка в физических науках . Критический фон современной науки, 1800–1905 гг. Издательство Кембриджского университета. дои : 10.1017/CBO9780511760013 . ISBN 978-0-521-21110-9 . Проверено 22 октября 2011 г.
- ^ Кавендиш, Генри (12 мая 1766 г.). «Три статьи, содержащие эксперименты с искусственным воздухом, достопочтенного Генри Кавендиша, FRS», «Философские труды » . 56 : 141–184. Бибкод : 1766RSPT...56..141C . дои : 10.1098/rstl.1766.0019 . JSTOR 105491 .
- ^ Ствертка, Альберт (1996). Руководство по элементам . Издательство Оксфордского университета. стр. 16–21 . ISBN 978-0-19-508083-4 .
- ^ Национальная ассоциация производителей электротехники (1946 г.). Хронологическая история развития электротехники с 600 г. до н.э. Нью-Йорк, штат Нью-Йорк, Национальная ассоциация производителей электрооборудования. п. 102. Архивировано из оригинала 4 марта 2016 года . Проверено 9 февраля 2016 г.
- ^ Стокель, Дж. Ф.; Джей Джей Данлоп; Бетц, Ф (1980). «Руководство никель-водородной батареи НТС-2 31». Журнал космических кораблей и ракет . 17 : 31–34. Бибкод : 1980JSpRo..17...31S . дои : 10.2514/3.57704 .
- ^ Джанетт, АГ; Хойницкий, Дж. С.; МакКиссок, Д.Б.; Финканнон, Дж.; Керслейк, ТВ; Родригес, CD (июль 2002 г.). Проверка модели электрических характеристик международной космической станции с помощью орбитальной телеметрии (PDF) . МЭКЕС '02. 2002 г. 37-я Межобщественная конференция по вопросам преобразования энергии, 2002 г. стр. 45–50. doi : 10.1109/IECEC.2002.1391972 . hdl : 2060/20020070612 . ISBN 0-7803-7296-4 . Архивировано (PDF) из оригинала 14 мая 2010 года . Проверено 11 ноября 2011 г.
- ^ Андерсон, премьер-министр; Койн, JW (2002). «Легкая, высоконадежная система питания с одной батареей для межпланетных космических кораблей». Материалы аэрокосмической конференции IEEE . Том. 5. С. 5–2433. дои : 10.1109/AERO.2002.1035418 . ISBN 978-0-7803-7231-3 . S2CID 108678345 .
- ^ «Глобальный исследователь Марса» . Astronautix.com. Архивировано из оригинала 10 августа 2009 года . Проверено 6 апреля 2009 г.
- ^ Лори Тяхла, изд. (7 мая 2009 г.). «Основы обслуживания миссии Хаббл 4» . НАСА. Архивировано из оригинала 13 марта 2015 года . Проверено 19 мая 2015 г.
- ^ Хендрикс, Сьюзен (25 ноября 2008 г.). Лори Тяхла (ред.). «Продление срока службы Хаббла с помощью новых батарей» . НАСА. Архивировано из оригинала 5 марта 2016 года . Проверено 19 мая 2015 г.
- ^ Крепо, Р. (1 января 2006 г.). Нильс Бор: Модель атома . Великие научные умы. ISBN 978-1-4298-0723-4 .
- ^ Берман, Р.; Кук, АХ; Хилл, RW (1956). «Криогеника». Ежегодный обзор физической химии . 7 :1–20. Бибкод : 1956ARPC....7....1B . дои : 10.1146/annurev.pc.07.100156.000245 .
- ^ Чарльтон, Майк; Ван дер Верф, Дирк Питер (1 марта 2015 г.). «Достижения физики антиводорода» . Научный прогресс . 98 (1): 34–62. дои : 10.3184/003685015X14234978376369 . ПМЦ 10365473 . ПМИД 25942774 . S2CID 23581065 .
- ^ Келлербауэр, Альбан (29 января 2015 г.). «Почему антивещество имеет значение». Европейский обзор . 23 (1): 45–56. дои : 10.1017/S1062798714000532 . S2CID 58906869 .
- ^ Ганьон, С. «Водород» . Джефферсонская лаборатория. Архивировано из оригинала 10 апреля 2008 года . Проверено 5 февраля 2008 г.
- ^ Хаубольд, Х.; Матай, AM (15 ноября 2007 г.). «Генерация солнечной термоядерной энергии» . Колумбийский университет . Архивировано из оригинала 11 декабря 2011 года . Проверено 12 февраля 2008 г.
- ^ «Водород» . mysite.du.edu . Архивировано из оригинала 18 апреля 2009 года . Проверено 20 апреля 2008 г.
- ^ Сторри-Ломбарди, LJ; Вульф, AM (2000). «Обзоры для z > 3 затухающих абсорбционных систем Лайман-альфа: эволюция нейтрального газа». Астрофизический журнал . 543 (2): 552–576. arXiv : astro-ph/0006044 . Бибкод : 2000ApJ...543..552S . дои : 10.1086/317138 . S2CID 120150880 .
- ^ Jump up to: Перейти обратно: а б Рис Гринтер; Кропп, А.; Венугопал; и др. (2023). «Структурные основы бактериального извлечения энергии из атмосферного водорода» . Природа . 615 (7952): 541–547. Бибкод : 2023Natur.615..541G . дои : 10.1038/s41586-023-05781-7 . ПМЦ 10017518 . ПМИД 36890228 .
- ^ Дрессельхаус, М. ; и др. (15 мая 2003 г.). «Потребности в фундаментальных исследованиях водородной экономики» (PDF) . Тезисы мартовского заседания APS . 2004 . Аргоннская национальная лаборатория, Министерство энергетики США, Научная лаборатория Управления: m1.001. Бибкод : 2004APS..MAR.m1001D . Архивировано из оригинала (PDF) 13 февраля 2008 года . Проверено 5 февраля 2008 г.
- ^ МакКолл Групп; Группа «Ока» (22 апреля 2005 г.). «Ресурсный центр H3+» . Университеты Иллинойса и Чикаго. Архивировано из оригинала 11 октября 2007 года . Проверено 5 февраля 2008 г.
- ^ Хельм, Х.; и др. (2003), «Связь связанных состояний с состояниями континуума в нейтральном трехатомном водороде», Диссоциативная рекомбинация молекулярных ионов с электронами , факультет молекулярной и оптической физики, Фрайбургский университет, Германия, стр. 275–288, doi : 10.1007/978 -1-4615-0083-4_27 , ISBN 978-1-4613-4915-0
- ^ Jump up to: Перейти обратно: а б Бааде, Уильям Ф.; Парех, Удай Н.; Раман, Венкат С. (2001). «Водород». Энциклопедия химической технологии Кирка-Отмера . дои : 10.1002/0471238961.0825041803262116.a01.pub2 . ISBN 9780471484943 .
- ^ Фрейермут, Джордж Х. «Патент 1934 г.: «Производство водорода из метановых углеводородов действием пара при повышенной температуре » . Патентные полнотекстовые базы данных . Ведомство США по патентам и товарным знакам. Архивировано из оригинала 1 октября 2021 года . Проверено 30 октября 2020 г. .
- ^ Пресс, Роман Дж.; Сантанам, КСВ; Мири, Массуд Дж.; Бейли, Алла В.; Такач, Джеральд А. (2008). Введение в водородную технологию . Джон Уайли и сыновья. п. 249. ИСБН 978-0-471-77985-8 .
- ^ Jump up to: Перейти обратно: а б с Окстоби, Д.В. (2002). Принципы современной химии (5-е изд.). Томсон Брукс/Коул. ISBN 978-0-03-035373-4 .
- ^ Фундербург, Э. (2008). «Почему цены на азот такие высокие?» . Благородный фонд Сэмюэля Робертса. Архивировано из оригинала 9 мая 2001 года . Проверено 11 марта 2008 г.
- ^ «Свойства, использование, применение водорода» . Universal Industrial Gases, Inc. 2007. Архивировано из оригинала 27 марта 2008 года . Проверено 11 марта 2008 г.
- ^ Ханнула, Илкка (2015). «Совместное производство синтетического топлива и централизованного теплоснабжения из остатков биомассы, углекислого газа и электроэнергии: анализ эффективности и затрат» . Биомасса и биоэнергетика . 74 : 26–46. Бибкод : 2015BmBe...74...26H . дои : 10.1016/j.biombioe.2015.01.006 . ISSN 0961-9534 .
- ^ Гонг, Мин, Ву; Цай, Чжоу, Цзиган; Гуань, Минг-Чан; Ван, Ди-Янь; Хван, Бинг-Джо; Дай, Хунцзе (2014). никеля/никеля для электрокатализа выделения активного водорода» Бибкод « Наноразмерные оксида гетероструктуры : 2014NatCo ...5.4695G . . . ; . PMID 25146255
- ^ Лиз, А. (2007). «Химические препараты из соли» . Би-би-си. Архивировано из оригинала 26 октября 2007 года . Проверено 11 марта 2008 г.
- ^ Фон Вальд, Грегори А. (2020). «Оптимизационный технико-экономический анализ пиролиза метана в расплавленных средах для снижения выбросов CO2 в промышленности» . Устойчивая энергетика и топливо . 4 (9). Королевское химическое общество: 4598–4613. дои : 10.1039/D0SE00427H . S2CID 225676190 . Архивировано из оригинала 8 ноября 2020 года . Проверено 31 октября 2020 г.
- ^ Шнайдер, Стефан (2020). «Современное состояние производства водорода путем пиролиза природного газа» . ХимБиоИнж Обзоры . 7 (5). Интернет-библиотека Wiley: 150–158. дои : 10.1002/cben.202000014 .
- ^ Картрайт, Джон. «Реакция, которая навсегда даст нам чистое ископаемое топливо» . Новый учёный . Архивировано из оригинала 26 октября 2020 года . Проверено 30 октября 2020 г. .
- ^ Технологический институт Карлсруэ. «Водород из метана без выбросов CO2» . Физ.орг . Архивировано из оригинала 21 октября 2020 года . Проверено 30 октября 2020 г. .
- ^ Апэм, Д. Честер (2017). «Каталитические расплавленные металлы для прямой конверсии метана в водород и отделяемый углерод» . Наука . 358 (6365). Американская ассоциация развития науки: 917–921. Бибкод : 2017Sci...358..917U . дои : 10.1126/science.aao5023 . ПМИД 29146810 . S2CID 206663568 .
- ^ Кларк, Палмер (2020). «Сухой риформинг метана, катализируемый расплавленными металлическими сплавами» . Природный катализ . 3 : 83–89. дои : 10.1038/s41929-019-0416-2 . S2CID 210862772 . Архивировано из оригинала 29 января 2021 года . Проверено 31 октября 2020 г.
- ^ Гусев, Александр. «KITT/IASS – Производство водорода без CO2 из природного газа для использования в энергии» . Европейские энергетические инновации . Институт перспективных исследований в области устойчивого развития. Архивировано из оригинала 29 января 2021 года . Проверено 30 октября 2020 г. .
- ^ Фернандес, Соня. «Исследователи разрабатывают потенциально недорогую технологию с низким уровнем выбросов, которая может конвертировать метан без образования CO2» . Физ-орг . Американский институт физики. Архивировано из оригинала 19 октября 2020 года . Проверено 19 октября 2020 г.
- ^ БАСФ. «Исследователи BASF работают над принципиально новым, низкоуглеродистым процессом производства — пиролизом метана» . Устойчивое развитие США . БАСФ. Архивировано из оригинала 19 октября 2020 года . Проверено 19 октября 2020 г.
- ^ Веймер, Эл (25 мая 2005 г.). «Развитие термохимического производства водорода из воды на солнечной энергии» (PDF) . Проект солнечной термохимической генерации водорода. Архивировано (PDF) из оригинала 17 апреля 2007 г. Проверено 21 декабря 2008 г.
- ^ Перре, Р. «Развитие термохимического производства водорода из воды с помощью солнечной энергии, Водородная программа Министерства энергетики, 2007» (PDF) . Архивировано из оригинала (PDF) 27 мая 2010 года . Проверено 17 мая 2008 г.
- ^ Пармузина А.В.; Кравченко О.В. (2008). «Активация металлического алюминия для выделения водорода из воды». Международный журнал водородной энергетики . 33 (12): 3073–3076. Бибкод : 2008IJHE...33.3073P . doi : 10.1016/j.ijhydene.2008.02.025 .
- ^ Любиц, Вольфганг; Рейерсе, Эдуард; Ван Гастель, Морис (2007). «[NiFe] и [FeFe] гидрогеназы, изученные с помощью передовых методов магнитного резонанса». Химические обзоры . 107 (10): 4331–4365. дои : 10.1021/cr050186q . ПМИД 17845059 .
- ^ «Природный водород: потенциальный источник чистой энергии под нашими ногами» . Йель E360 . Проверено 27 января 2024 г.
- ^ Барнард, Майкл (22 октября 2023 г.). «Что нового на ступенях водородной лестницы Либрайха?» . ЧистаяТехника . Проверено 10 марта 2024 г.
- ^ Смиль, Вацлав (2004). Обогащение Земли: Фриц Хабер, Карл Бош и трансформация мирового производства продуктов питания (1-е изд.). Кембридж, Массачусетс: Массачусетский технологический институт. ISBN 978-0-262-69313-4 .
- ^ Химические операции (15 декабря 2003 г.). «Водород» . Лос-Аламосская национальная лаборатория. Архивировано из оригинала 4 марта 2011 года . Проверено 5 февраля 2008 г.
- ^ Jump up to: Перейти обратно: а б с д и МГЭИК (2022 г.). Шукла, PR; Ски, Дж.; Слэйд, Р.; Аль Хурдаджи, А.; и др. (ред.). Изменение климата 2022: Смягчение последствий изменения климата (PDF) . Вклад Рабочей группы III в шестой оценочный доклад Межправительственной группы экспертов по изменению климата. Кембридж, Великобритания, и Нью-Йорк, штат Нью-Йорк, США: Издательство Кембриджского университета (в печати). стр. 91–92. дои : 10.1017/9781009157926 . ISBN 9781009157926 .
- ^ Jump up to: Перейти обратно: а б Эванс, Саймон; Габбатисс, Джош (30 ноября 2020 г.). «Углубленные вопросы и ответы: нужен ли миру водород для решения проблемы изменения климата?» . Карбоновое резюме . Архивировано из оригинала 1 декабря 2020 года . Проверено 1 декабря 2020 г.
- ^ Маккарти, Дж. (31 декабря 1995 г.). «Водород» . Стэнфордский университет . Архивировано из оригинала 14 марта 2008 года . Проверено 14 марта 2008 г.
- ^ Рид, Стэнли; Юинг, Джек (13 июля 2021 г.). «Водород — один из ответов на изменение климата. Получить его — трудная часть» . Нью-Йорк Таймс . ISSN 0362-4331 . Архивировано из оригинала 14 июля 2021 года . Проверено 14 июля 2021 г.
- ^ ИРЕНА (2019). Водород: перспективы возобновляемой энергетики (PDF) . п. 9. ISBN 978-92-9260-151-5 . Архивировано (PDF) из оригинала 29 сентября 2021 года . Проверено 17 октября 2021 г. .
- ^ Бонёр, Майк; Вандевалле, Лориен А.; Марин, Гай Б.; Ван Гим, Кевин М. (март 2021 г.). «Мечта или реальность? Электрификация химических производств» . Журнал КЭП . Американский институт инженеров-химиков . Архивировано из оригинала 17 июля 2021 года . Проверено 6 июля 2021 г.
- ^ Jump up to: Перейти обратно: а б Гриффитс, Стив; Совакул, Бенджамин К.; Ким, Джинсу; Базилиан, Морган; и др. (2021). «Промышленная декарбонизация с помощью водорода: критический и систематический обзор событий, социотехнических систем и вариантов политики» . Энергетические исследования и социальные науки . 80 : 39. Бибкод : 2021ERSS...8002208G . дои : 10.1016/j.erss.2021.102208 . ISSN 2214-6296 . Архивировано из оригинала 16 октября 2021 года . Проверено 11 сентября 2021 г.
- ^ Палис, Мэтью Дж.; Даутидис, Продромос (2020). «Использование водорода и аммиака для хранения возобновляемой энергии: географически комплексное технико-экономическое исследование» . Компьютеры и химическая инженерия . 136 : 106785. doi : 10.1016/j.compchemeng.2020.106785 . ISSN 0098-1354 .
- ^ «Водородная промышленность должна очиститься, прежде чем расширяться в новые…» . Канарские СМИ . 31 августа 2021 г. Проверено 5 апреля 2023 г.
- ^ ИРЕНА (2021). Перспективы мирового энергетического перехода: путь к повышению температуры на 1,5°C (PDF) . стр. 12, 22. ISBN. 978-92-9260-334-2 . Архивировано (PDF) из оригинала 11 июня 2021 года.
- ^ МЭА (2021 г.). Net Zero к 2050 году: дорожная карта для глобального энергетического сектора (PDF) . стр. 15, 75–76. Архивировано (PDF) из оригинала 23 мая 2021 года.
- ^ Чельберг-Моттон, Брендан (7 февраля 2022 г.). «Декарбонизация стали набирает обороты | Argus Media» . www.argusmedia.com . Проверено 7 сентября 2023 г.
- ^ Бланк, Томас; Молли, Патрик (январь 2020 г.). «Влияние декарбонизации водорода на промышленность» (PDF) . Институт Роки Маунтин . стр. 2, 7, 8. Архивировано (PDF) из оригинала 22 сентября 2020 года.
- ^ Плётц, Патрик (31 января 2022 г.). «Водородная технология вряд ли сыграет важную роль в устойчивом автомобильном транспорте» . Природная электроника . 5 (1): 8–10. дои : 10.1038/s41928-021-00706-6 . ISSN 2520-1131 . S2CID 246465284 .
- ^ Ле Комбер, разыгрывающий; Джонс, Д.И.; Копье, МЫ (1977). «Эффект Холла и примесная проводимость в аморфном кремнии, легированном замещением». Философский журнал . 35 (5): 1173–1187. Бибкод : 1977PMag...35.1173C . дои : 10.1080/14786437708232943 .
- ^ Ван де Валле, CG (2000). «Водород как причина легирования оксида цинка» (PDF) . Письма о физических отзывах . 85 (5): 1012–1015. Бибкод : 2000PhRvL..85.1012V . doi : 10.1103/PhysRevLett.85.1012 . hdl : 11858/00-001M-0000-0026-D0E6-E . ПМИД 10991462 . Архивировано (PDF) из оригинала 15 августа 2017 года . Проверено 1 августа 2018 г.
- ^ Джанотти, А.; Ван Де Валле, CG (2007). «Водородные многоцентровые связи». Природные материалы . 6 (1): 44–47. Бибкод : 2007NatMa...6...44J . дои : 10.1038/nmat1795 . ПМИД 17143265 .
- ^ Килич, К.; Зунгер, Алекс (2002). «Допирование оксидов n-типа водородом». Письма по прикладной физике . 81 (1): 73–75. Бибкод : 2002АпФЛ..81...73К . дои : 10.1063/1.1482783 . S2CID 96415065 .
- ^ Павлин, PW; Робертсон, Дж. (2003). «Поведение водорода в оксидных изоляторах с высокой диэлектрической проницаемостью». Письма по прикладной физике . 83 (10): 2025–2027. Бибкод : 2003АпФЛ..83.2025П . дои : 10.1063/1.1609245 .
- ^ Дургутлу, А. (2003). «Экспериментальное исследование влияния водорода в аргоне как защитного газа на сварку TIG аустенитной нержавеющей стали». Материалы и дизайн . 25 (1): 19–23. дои : 10.1016/j.matdes.2003.07.004 .
- ^ «Атомноводородная сварка» . Специальные сварные швы. 2007. Архивировано из оригинала 16 июля 2011 года.
- ^ Харди, WN (2003). «От H2 к криогенным H-мазерам и сверхпроводникам HiTc: маловероятный, но полезный путь». Физика C: Сверхпроводимость . 388–389: 1–6. Бибкод : 2003PhyC..388....1H . дои : 10.1016/S0921-4534(02)02591-1 .
- ^ Альмквист, Эббе (2003). История промышленных газов . Нью-Йорк, штат Нью-Йорк: Издательство Kluwer Academic/Plenum. стр. 47–56. ISBN 978-0-306-47277-0 . Проверено 20 мая 2015 г.
- ^ Блок, М. (3 сентября 2004 г.). Водород как индикаторный газ для обнаружения утечек . 16-я ВКНДТ 2004 г. Монреаль, Канада: Sensistor Technologies. Архивировано из оригинала 8 января 2009 года . Проверено 25 марта 2008 г.
- ^ «Отчет Комиссии по потреблению пищевых добавок» (PDF) . Евросоюз . Архивировано (PDF) из оригинала 16 февраля 2008 г. Проверено 5 февраля 2008 г.
- ^ Рейнш, Дж.; Кац, А.; Уин, Дж.; Апраамян, Г.; МакФарланд, Дж. Т. (1980). «Влияние изотопа дейтерия на реакцию жирной ацил-КоА-дегидрогеназы и бутирил-КоА» . Ж. Биол. Хим . 255 (19): 9093–97. дои : 10.1016/S0021-9258(19)70531-6 . ПМИД 7410413 .
- ^ «NASA/TM—2002-211915: Эксперименты с твердым водородом для атомного топлива» (PDF) . Архивировано (PDF) из оригинала 9 июля 2021 года . Проверено 2 июля 2021 г.
- ^ Бержерон, К.Д. (2004). «Смерть отсутствия двойного использования» . Бюллетень ученых-атомщиков . 60 (1): 15–17. Бибкод : 2004БуАтС..60а..15Б . дои : 10.2968/060001004 . Архивировано из оригинала 19 апреля 2008 года . Проверено 13 апреля 2008 г.
- ^ Каммак, Р.; Робсон, Р.Л. (2001). Водород как топливо: чему учиться у природы . Taylor & Francisco Ltd., стр. 202–203. ISBN 978-0-415-24242-4 . Архивировано из оригинала 29 января 2021 года . Проверено 3 сентября 2020 г.
- ^ Ри, ТС; Бреннинкмейер, CAM; Рёкманн, Т. (19 мая 2006 г.). «Подавляющая роль почв в глобальном цикле водорода в атмосфере» (PDF) . Химия и физика атмосферы . 6 (6): 1611–1625. Бибкод : 2006ACP.....6.1611R . дои : 10.5194/acp-6-1611-2006 . Архивировано (PDF) из оригинала 24 августа 2019 г. Проверено 24 августа 2019 г.
- ^ Алекс Уилкинс (8 марта 2023 г.). «Фермент почвенных бактерий вырабатывает электричество из водорода в воздухе» . Новый учёный . 257 (3430): 13. Бибкод : 2023NewSc.257...13W . дои : 10.1016/S0262-4079(23)00459-1 . S2CID 257625443 .
- ^ Эйзенманн, Александр; Аманн, Антон; Саид, Майкл; Датта, Беттина; Ледоховский, Максимилиан (2008). «Проведение и интерпретация водородных дыхательных тестов» (PDF) . Журнал исследований дыхания . 2 (4): 046002. Бибкод : 2008JBR.....2d6002E . дои : 10.1088/1752-7155/2/4/046002 . ПМИД 21386189 . S2CID 31706721 . Архивировано из оригинала (PDF) 29 января 2021 года . Проверено 26 декабря 2020 г.
- ^ Крузе, О.; Рупрехт, Дж.; Бадер, К.; Томас-Холл, С.; Шенк, ПМ; Финацци, Г.; Ханкамер, Б. (2005). «Улучшение фотобиологического производства H 2 в сконструированных клетках зеленых водорослей» (PDF) . Журнал биологической химии . 280 (40): 34170–7. дои : 10.1074/jbc.M503840200 . ПМИД 16100118 . S2CID 5373909 . Архивировано (PDF) из оригинала 29 января 2021 года . Проверено 24 августа 2019 г.
- ^ Смит, Гамильтон О.; Сюй, Цин (2005). «IV.E.6 Водород из воды в новой рекомбинантной кислородтолерантной системе цианобактерий» (PDF) . Отчет о проделанной работе за 2005 финансовый год . Министерство энергетики США. Архивировано (PDF) из оригинала 29 декабря 2016 года . Проверено 6 августа 2016 г.
- ^ Уильямс, К. (24 февраля 2006 г.). «Жизнь в пруду: будущее энергетики» . Наука . Регистр. Архивировано из оригинала 9 мая 2011 года . Проверено 24 марта 2008 г.
- ^ «MyChem: Химия» (PDF) . Архивировано из оригинала (PDF) 1 октября 2018 года . Проверено 1 октября 2018 г.
- ^ Jump up to: Перейти обратно: а б Браун, WJ; и др. (1997). «Стандарт безопасности для водорода и водородных систем» (PDF) . НАСА . НСС 1740.16. Архивировано (PDF) из оригинала 1 мая 2017 года . Проверено 12 июля 2017 г. .
- ^ «Паспорт безопасности жидкого водорода» (PDF) . Praxair, Inc., сентябрь 2004 г. Архивировано из оригинала (PDF) 27 мая 2008 г. . Проверено 16 апреля 2008 г.
- ^ « Ошибки» и водородное охрупчивание». Новости науки . 128 (3): 41. 20 июля 1985 г. doi : 10.2307/3970088 . JSTOR 3970088 .
- ^ Хейс, Б. «Башня абсорбера аминов Union Oil» . ТВИ. Архивировано из оригинала 20 ноября 2008 года . Проверено 29 января 2010 г.
- ^ Уокер, Джеймс Л.; Уолтрип, Джон С.; Занкер, Адам (1988). «Отношения спроса и предложения молочной кислоты и магния» . У Джона Дж. МакКетты; Уильям Аарон Каннингем (ред.). Энциклопедия химической обработки и дизайна . Том. 28. Нью-Йорк: Деккер. п. 186. ИСБН 978-0-8247-2478-8 . Проверено 20 мая 2015 г.
Дальнейшее чтение
- Сверхтонкое расщепление водорода - Фейнмановские лекции по физике
- Таблица нуклидов (17-е изд.). Лаборатория атомной энергии Ноллса. 2010. ISBN 978-0-9843653-0-2 .
- Ньютон, Дэвид Э. (1994). Химические элементы . Нью-Йорк: Франклин Уоттс. ISBN 978-0-531-12501-4 .
- Ригден, Джон С. (2002). Водород: необходимый элемент . Кембридж, Массачусетс: Издательство Гарвардского университета. ISBN 978-0-531-12501-4 .
- Ромм, Джозеф Дж. (2004). Шумиха вокруг водорода: факты и вымыслы в гонке за спасение климата . Остров Пресс. ISBN 978-1-55963-703-9 .
- Шерри, Эрик (2007). Периодическая система, ее история и значение . Нью-Йорк: Издательство Оксфордского университета. ISBN 978-0-19-530573-9 .




