Клиническое испытание

Клинические испытания представляют собой проспективные биомедицинские или поведенческие исследования участников, предназначенных для ответа на конкретные вопросы о биомедицинских или поведенческих вмешательствах, включая новые методы лечения (такие как новые вакцины , лекарства , диетический выбор , пищевые добавки и медицинские приборы ) и известные вмешательства, которые требуют дальнейших. изучение и сравнение. Клинические испытания генерируют данные о дозировке, безопасности и эффективности. [ 1 ] [ 2 ] Они проводятся только после того, как они получили одобрение комитета по здравоохранению/этике в стране, где требуется одобрение терапии. Эти власти несут ответственность за проверку коэффициента риска/выгоды для испытания - их одобрение не означает, что терапия «безопасна» или эффективна, только в том, что исследование может быть проведено.
В зависимости от типа продукта и стадии разработки, исследователи первоначально регистрируют добровольцев или пациентов в небольшие пилотные исследования и впоследствии проводят постепенно более масштабные сравнительные исследования. Клинические испытания могут варьироваться по размеру и стоимости, и они могут включать в себя один исследовательский центр или несколько центров , в одной стране или в нескольких странах. Конструкция клинических исследований направлена на то, чтобы обеспечить научную обоснованность и воспроизводимость результатов.
Costs for clinical trials can range into the billions of dollars per approved drug,[3] and the complete trial process to approval may require 7–15 years.[4][5] The sponsor may be a governmental organization or a pharmaceutical, biotechnology or medical-device company. Certain functions necessary to the trial, such as monitoring and lab work, may be managed by an outsourced partner, such as a contract research organization or a central laboratory. Only 10 percent of all drugs started in human clinical trials become approved drugs.[6]
Overview
[edit]Trials of drugs
[edit]Some clinical trials involve healthy subjects with no pre-existing medical conditions. Other clinical trials pertain to people with specific health conditions who are willing to try an experimental treatment. Pilot experiments are conducted to gain insights for design of the clinical trial to follow.[citation needed]
There are two goals to testing medical treatments: to learn whether they work well enough, called "efficacy", or "effectiveness"; and to learn whether they are safe enough, called "safety".[1] Neither is an absolute criterion; both safety and efficacy are evaluated relative to how the treatment is intended to be used, what other treatments are available, and the severity of the disease or condition. The benefits must outweigh the risks.[7][8]: 8 For example, many drugs to treat cancer have severe side effects that would not be acceptable for an over-the-counter pain medication, yet the cancer drugs have been approved since they are used under a physician's care and are used for a life-threatening condition.[9]
In the US the elderly constitute 14% of the population, while they consume over one-third of drugs.[10] People over 55 (or a similar cutoff age) are often excluded from trials because their greater health issues and drug use complicate data interpretation, and because they have different physiological capacity than younger people. Children and people with unrelated medical conditions are also frequently excluded.[11] Pregnant women are often excluded due to potential risks to the fetus.
The sponsor designs the trial in coordination with a panel of expert clinical investigators, including what alternative or existing treatments to compare to the new drug and what type(s) of patients might benefit. If the sponsor cannot obtain enough test subjects at one location investigators at other locations are recruited to join the study.[citation needed]
During the trial, investigators recruit subjects with the predetermined characteristics, administer the treatment(s) and collect data on the subjects' health for a defined time period. Data include measurements such as vital signs, concentration of the study drug in the blood or tissues, changes to symptoms, and whether improvement or worsening of the condition targeted by the study drug occurs. The researchers send the data to the trial sponsor, who then analyzes the pooled data using statistical tests.[citation needed]
Examples of clinical trial goals include assessing the safety and relative effectiveness of a medication or device:[citation needed]
- On a specific kind of patient
- At varying dosages
- For a new indication
- Evaluation for improved efficacy in treating a condition as compared to the standard therapy for that condition
- Evaluation of the study drug or device relative to two or more already approved/common interventions for that condition
While most clinical trials test one alternative to the novel intervention, some expand to three or four and may include a placebo.[citation needed]
Except for small, single-location trials, the design and objectives are specified in a document called a clinical trial protocol. The protocol is the trial's "operating manual" and ensures all researchers perform the trial in the same way on similar subjects and that the data is comparable across all subjects.[citation needed]
As a trial is designed to test hypotheses and rigorously monitor and assess outcomes, it can be seen as an application of the scientific method, specifically the experimental step.[citation needed]
The most common clinical trials evaluate new pharmaceutical products, medical devices, biologics, diagnostic assays, psychological therapies, or other interventions.[12] Clinical trials may be required before a national regulatory authority[13] approves marketing of the innovation.
Trials of devices
[edit]Similarly to drugs, manufacturers of medical devices in the United States are required to conduct clinical trials for premarket approval.[14] Device trials may compare a new device to an established therapy, or may compare similar devices to each other. An example of the former in the field of vascular surgery is the Open versus Endovascular Repair (OVER trial) for the treatment of abdominal aortic aneurysm, which compared the older open aortic repair technique to the newer endovascular aneurysm repair device.[15] An example of the latter are clinical trials on mechanical devices used in the management of adult female urinary incontinence.[16]
Trials of procedures
[edit]Similarly to drugs, medical or surgical procedures may be subjected to clinical trials,[17] such as comparing different surgical approaches in treatment of fibroids for subfertility.[18] However, when clinical trials are unethical or logistically impossible in the surgical setting, case-controlled studies will be replaced.[19]
Patient and public involvement
[edit]Besides being participants in a clinical trial, members of the public can be actively collaborate with researchers in designing and conducting clinical research. This is known as patient and public involvement (PPI). Public involvement involves a working partnership between patients, caregivers, people with lived experience, and researchers to shape and influence what is researcher and how.[20] PPI can improve the quality of research and make it more relevant and accessible. People with current or past experience of illness can provide a different perspective than professionals and compliment their knowledge. Through their personal knowledge they can identify research topics that are relevant and important to those living with an illness or using a service. They can also help to make the research more grounded in the needs of the specific communities they are part of. Public contributors can also ensure that the research is presented in plain language that is clear to the wider society and the specific groups it is most relevant for.[21]
History
[edit]Development
[edit]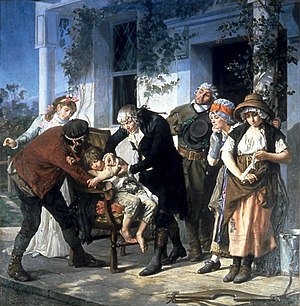
Although early medical experimentation was performed often, the use of a control group to provide an accurate comparison for the demonstration of the intervention's efficacy was generally lacking. For instance, Lady Mary Wortley Montagu, who campaigned for the introduction of inoculation (then called variolation) to prevent smallpox, arranged for seven prisoners who had been sentenced to death to undergo variolation in exchange for their life. Although they survived and did not contract smallpox, there was no control group to assess whether this result was due to the inoculation or some other factor. Similar experiments performed by Edward Jenner over his smallpox vaccine were equally conceptually flawed.[22]
The first proper clinical trial was conducted by the Scottish physician James Lind.[23] The disease scurvy, now known to be caused by a Vitamin C deficiency, would often have terrible effects on the welfare of the crew of long-distance ocean voyages. In 1740, the catastrophic result of Anson's circumnavigation attracted much attention in Europe; out of 1900 men, 1400 had died, most of them allegedly from having contracted scurvy.[24] John Woodall, an English military surgeon of the British East India Company, had recommended the consumption of citrus fruit (it has an antiscorbutic effect) from the 17th century, but their use did not become widespread.[25]
Lind conducted the first systematic clinical trial in 1747.[26] He included a dietary supplement of an acidic quality in the experiment after two months at sea, when the ship was already afflicted with scurvy. He divided twelve scorbutic sailors into six groups of two. They all received the same diet but, in addition, group one was given a quart of cider daily, group two twenty-five drops of elixir of vitriol (sulfuric acid), group three six spoonfuls of vinegar, group four half a pint of seawater, group five received two oranges and one lemon, and the last group a spicy paste plus a drink of barley water. The treatment of group five stopped after six days when they ran out of fruit, but by then one sailor was fit for duty while the other had almost recovered. Apart from that, only group one also showed some effect of its treatment.[27] Each year, May 20 is celebrated as Clinical Trials Day in honor of Lind's research.[28]
After 1750 the discipline began to take its modern shape.[29][30] The English doctor John Haygarth demonstrated the importance of a control group for the correct identification of the placebo effect in his celebrated study of the ineffective remedy called Perkin's tractors. Further work in that direction was carried out by the eminent physician Sir William Gull, 1st Baronet in the 1860s.[22]
Frederick Akbar Mahomed (d. 1884), who worked at Guy's Hospital in London, made substantial contributions to the process of clinical trials, where "he separated chronic nephritis with secondary hypertension from what we now term essential hypertension. He also founded the Collective Investigation Record for the British Medical Association; this organization collected data from physicians practicing outside the hospital setting and was the precursor of modern collaborative clinical trials."[31]
Modern trials
[edit]
Ideas of Sir Ronald A. Fisher still play a role in clinical trials. While working for the Rothamsted experimental station in the field of agriculture, Fisher developed his Principles of experimental design in the 1920s as an accurate methodology for the proper design of experiments. Among his major ideas include the importance of randomization—the random assignment of individuals to different groups for the experiment;[32] replication—to reduce uncertainty, measurements should be repeated and experiments replicated to identify sources of variation;[33] blocking—to arrange experimental units into groups of units that are similar to each other, and thus reducing irrelevant sources of variation; use of factorial experiments—efficient at evaluating the effects and possible interactions of several independent factors.[22] Of these, blocking and factorial design are seldom applied in clinical trials, because the experimental units are human subjects and there is typically only one independent intervention: the treatment.[citation needed]
The British Medical Research Council officially recognized the importance of clinical trials from the 1930s. The council established the Therapeutic Trials Committee to advise and assist in the arrangement of properly controlled clinical trials on new products that seem likely on experimental grounds to have value in the treatment of disease.[22]
The first randomised curative trial was carried out at the MRC Tuberculosis Research Unit by Sir Geoffrey Marshall (1887–1982). The trial, carried out between 1946 and 1947, aimed to test the efficacy of the chemical streptomycin for curing pulmonary tuberculosis. The trial was both double-blind and placebo-controlled.[34]
The methodology of clinical trials was further developed by Sir Austin Bradford Hill, who had been involved in the streptomycin trials. From the 1920s, Hill applied statistics to medicine, attending the lectures of renowned mathematician Karl Pearson, among others. He became famous for a landmark study carried out in collaboration with Richard Doll on the correlation between smoking and lung cancer. They carried out a case-control study in 1950, which compared lung cancer patients with matched control and also began a sustained long-term prospective study into the broader issue of smoking and health, which involved studying the smoking habits and health of more than 30,000 doctors over a period of several years. His certificate for election to the Royal Society called him "... the leader in the development in medicine of the precise experimental methods now used nationally and internationally in the evaluation of new therapeutic and prophylactic agents."
International clinical trials day is celebrated on 20 May.[35]
The acronyms used in the titling of clinical trials are often contrived, and have been the subject of derision.[36]
Types
[edit]Clinical trials are classified by the research objective created by the investigators.[12]
- In an observational study, the investigators observe the subjects and measure their outcomes. The researchers do not actively manage the study.[37]
- In an interventional study, the investigators give the research subjects an experimental drug, surgical procedure, use of a medical device, diagnostic or other intervention to compare the treated subjects with those receiving no treatment or the standard treatment. Then the researchers assess how the subjects' health changes.[37]
Trials are classified by their purpose. After approval for human research is granted to the trial sponsor, the U.S. Food and Drug Administration (FDA) organizes and monitors the results of trials according to type:[12]
- Prevention trials look for ways to prevent disease in people who have never had the disease or to prevent a disease from returning. These approaches may include drugs, vitamins or other micronutrients, vaccines, or lifestyle changes.
- Screening trials test for ways to identify certain diseases or health conditions.
- Diagnostic trials are conducted to find better tests or procedures for diagnosing a particular disease or condition.
- Treatment trials test experimental drugs, new combinations of drugs, or new approaches to surgery or radiation therapy.
- Quality of life trials (supportive care trials) evaluate how to improve comfort and quality of care for people with a chronic illness.
- Genetic trials are conducted to assess the prediction accuracy of genetic disorders making a person more or less likely to develop a disease.
- Epidemiological trials have the goal of identifying the general causes, patterns or control of diseases in large numbers of people.
- Compassionate use trials or expanded access trials provide partially tested, unapproved therapeutics to a small number of patients who have no other realistic options. Usually, this involves a disease for which no effective therapy has been approved, or a patient who has already failed all standard treatments and whose health is too compromised to qualify for participation in randomized clinical trials.[38] Usually, case-by-case approval must be granted by both the FDA and the pharmaceutical company for such exceptions.
- Fixed trials consider existing data only during the trial's design, do not modify the trial after it begins, and do not assess the results until the study is completed.
- Adaptive clinical trials use existing data to design the trial, and then use interim results to modify the trial as it proceeds. Modifications include dosage, sample size, drug undergoing trial, patient selection criteria and "cocktail" mix.[39] Adaptive trials often employ a Bayesian experimental design to assess the trial's progress. In some cases, trials have become an ongoing process that regularly adds and drops therapies and patient groups as more information is gained.[40] The aim is to more quickly identify drugs that have a therapeutic effect and to zero in on patient populations for whom the drug is appropriate.[41][42]
Clinical trials are conducted typically in four phases, with each phase using different numbers of subjects and having a different purpose to construct focus on identifying a specific effect.[12]
Phases
[edit]Clinical trials involving new drugs are commonly classified into five phases. Each phase of the drug approval process is treated as a separate clinical trial. The drug development process will normally proceed through phases I–IV over many years, frequently involving a decade or longer. If the drug successfully passes through phases I, II, and III, it will usually be approved by the national regulatory authority for use in the general population.[12] Phase IV trials are performed after the newly approved drug, diagnostic or device is marketed, providing assessment about risks, benefits, or best uses.[12]
Phase Aim Notes Phase 0 Pharmacodynamics and pharmacokinetics in humans Phase 0 trials are optional first-in-human trials. Single subtherapeutic doses of the study drug or treatment are given to a small number of subjects (typically 10 to 15) to gather preliminary data on the agent's pharmacodynamics (what the drug does to the body) and pharmacokinetics (what the body does to the drugs).[43] For a test drug, the trial documents the absorption, distribution, metabolization, and clearance (excretion) of the drug, and the drug's interactions within the body, to confirm that these appear to be as expected. Phase I Screening for safety Often are first-in-person trials. Testing within a small group of people (typically 20–80) to evaluate safety, determine safe dosage ranges, and identify side effects.[12] Phase II Establishing the preliminary efficacy of the drug in a "treatment group", usually against a placebo control group Phase II-a is specifically designed to assess dosing requirements (how much drug should be given),[12][44] while a Phase II-b trial is designed to determine efficacy (100–300 people),[1] assessing how well the drug works at the prescribed dose(s) to establish a therapeutic dose range and monitor for possible side effects.[44] Phase III Final confirmation of safety and efficacy Testing with large groups of people (typically 1,000–3,000) to confirm drug efficacy, evaluate its effectiveness, monitor side effects, compare it to commonly used treatments, and collect information that will allow it to be used safely.[12] Phase IV Safety studies during sales Postmarketing studies delineate risks, benefits, and optimal use. As such, they are ongoing during the drug's lifetime of active medical use.[12]
Trial design
[edit]A fundamental distinction in evidence-based practice is between observational studies and randomized controlled trials.[45] Types of observational studies in epidemiology, such as the cohort study and the case-control study, provide less compelling evidence than the randomized controlled trial.[45] In observational studies, the investigators retrospectively assess associations between the treatments given to participants and their health status, with potential for considerable errors in design and interpretation.[46]
A randomized controlled trial can provide compelling evidence that the study treatment causes an effect on human health.[45]
Some Phase II and most Phase III drug trials are designed as randomized, double-blind, and placebo-controlled.[citation needed]
- Randomized: Each study subject is randomly assigned to receive either the study treatment or a placebo.
- Blind: The subjects involved in the study do not know which study treatment they receive. If the study is double-blind, the researchers also do not know which treatment a subject receives. This intent is to prevent researchers from treating the two groups differently. A form of double-blind study called a "double-dummy" design allows additional insurance against bias. In this kind of study, all patients are given both placebo and active doses in alternating periods.
- Placebo-controlled: The use of a placebo (fake treatment) allows the researchers to isolate the effect of the study treatment from the placebo effect.
Clinical studies having small numbers of subjects may be "sponsored" by single researchers or a small group of researchers, and are designed to test simple questions or feasibility to expand the research for a more comprehensive randomized controlled trial.[47]
Clinical studies can be "sponsored" (financed and organized) by academic institutions, pharmaceutical companies, government entities and even private groups. Trials are conducted for new drugs, biotechnology, diagnostic assays or medical devices to determine their safety and efficacy prior to being submitted for regulatory review that would determine market approval.[citation needed]
Active control studies
[edit]In cases where giving a placebo to a person suffering from a disease may be unethical, "active comparator" (also known as "active control") trials may be conducted instead.[48] In trials with an active control group, subjects are given either the experimental treatment or a previously approved treatment with known effectiveness. In other cases, sponsors may conduct an active comparator trial to establish an efficacy claim relative to the active comparator instead of the placebo in labeling.[citation needed]
Master protocol
[edit]A master protocol includes multiple substudies, which may have different objectives and involve coordinated efforts to evaluate one or more medical products in one or more diseases or conditions within the overall study structure. Trials that could develop a master protocol include the umbrella trial (multiple medical products for a single disease), platform trial (multiple products for a single disease entering and leaving the platform), and basket trial (one medical product for multiple diseases or disease subtypes).[49]
Genetic testing enables researchers to group patients according to their genetic profile, deliver drugs based on that profile to that group and compare the results. Multiple companies can participate, each bringing a different drug. The first such approach targets squamous cell cancer, which includes varying genetic disruptions from patient to patient. Amgen, AstraZeneca and Pfizer are involved, the first time they have worked together in a late-stage trial. Patients whose genomic profiles do not match any of the trial drugs receive a drug designed to stimulate the immune system to attack cancer.[50]
Clinical trial protocol
[edit]A clinical trial protocol is a document used to define and manage the trial. It is prepared by a panel of experts. All study investigators are expected to strictly observe the protocol.[citation needed]
The protocol describes the scientific rationale, objective(s), design, methodology, statistical considerations and organization of the planned trial. Details of the trial are provided in documents referenced in the protocol, such as an investigator's brochure.[citation needed]
The protocol contains a precise study plan to assure safety and health of the trial subjects and to provide an exact template for trial conduct by investigators. This allows data to be combined across all investigators/sites. The protocol also informs the study administrators (often a contract research organization).[citation needed]
The format and content of clinical trial protocols sponsored by pharmaceutical, biotechnology or medical device companies in the United States, European Union, or Japan have been standardized to follow Good Clinical Practice guidance[51] issued by the International Conference on Harmonisation (ICH).[52] Regulatory authorities in Canada, China, South Korea, and the UK also follow ICH guidelines. Journals such as Trials, encourage investigators to publish their protocols.
Design features
[edit]Informed consent
[edit]
Clinical trials recruit study subjects to sign a document representing their "informed consent".[53] The document includes details such as its purpose, duration, required procedures, risks, potential benefits, key contacts and institutional requirements.[54] The participant then decides whether to sign the document. The document is not a contract, as the participant can withdraw at any time without penalty.[citation needed]
Informed consent is a legal process in which a recruit is instructed about key facts before deciding whether to participate.[53] Researchers explain the details of the study in terms the subject can understand. The information is presented in the subject's native language. Generally, children cannot autonomously provide informed consent, but depending on their age and other factors, may be required to provide informed assent.[citation needed]
Statistical power
[edit]In any clinical trial, the number of subjects, also called the sample size, has a large impact on the ability to reliably detect and measure the effects of the intervention. This ability is described as its "power", which must be calculated before initiating a study to figure out if the study is worth its costs.[55] In general, a larger sample size increases the statistical power, also the cost.
The statistical power estimates the ability of a trial to detect a difference of a particular size (or larger) between the treatment and control groups. For example, a trial of a lipid-lowering drug versus placebo with 100 patients in each group might have a power of 0.90 to detect a difference between placebo and trial groups receiving dosage of 10 mg/dL or more, but only 0.70 to detect a difference of 6 mg/dL.[citation needed]
Placebo groups
[edit]Merely giving a treatment can have nonspecific effects. These are controlled for by the inclusion of patients who receive only a placebo. Subjects are assigned randomly without informing them to which group they belonged. Many trials are doubled-blinded so that researchers do not know to which group a subject is assigned.
Assigning a subject to a placebo group can pose an ethical problem if it violates his or her right to receive the best available treatment. The Declaration of Helsinki provides guidelines on this issue.
Duration
[edit]
Clinical trials are only a small part of the research that goes into developing a new treatment. Potential drugs, for example, first have to be discovered, purified, characterized, and tested in labs (in cell and animal studies) before ever undergoing clinical trials. In all, about 1,000 potential drugs are tested before just one reaches the point of being tested in a clinical trial.[56] For example, a new cancer drug has, on average, six years of research behind it before it even makes it to clinical trials. But the major holdup in making new cancer drugs available is the time it takes to complete clinical trials themselves. On average, about eight years pass from the time a cancer drug enters clinical trials until it receives approval from regulatory agencies for sale to the public.[57] Drugs for other diseases have similar timelines.
Some reasons a clinical trial might last several years:
- For chronic conditions such as cancer, it takes months, if not years, to see if a cancer treatment has an effect on a patient.
- For drugs that are not expected to have a strong effect (meaning a large number of patients must be recruited to observe 'any' effect), recruiting enough patients to test the drug's effectiveness (i.e., getting statistical power) can take several years.
- Only certain people who have the target disease condition are eligible to take part in each clinical trial. Researchers who treat these particular patients must participate in the trial. Then they must identify the desirable patients and obtain consent from them or their families to take part in the trial.
A clinical trial might also include an extended post-study follow-up period from months to years for people who have participated in the trial, a so-called "extension phase", which aims to identify long-term impact of the treatment.[58]
The biggest barrier to completing studies is the shortage of people who take part. All drug and many device trials target a subset of the population, meaning not everyone can participate. Some drug trials require patients to have unusual combinations of disease characteristics. It is a challenge to find the appropriate patients and obtain their consent, especially when they may receive no direct benefit (because they are not paid, the study drug is not yet proven to work, or the patient may receive a placebo). In the case of cancer patients, fewer than 5% of adults with cancer will participate in drug trials. According to the Pharmaceutical Research and Manufacturers of America (PhRMA), about 400 cancer medicines were being tested in clinical trials in 2005. Not all of these will prove to be useful, but those that are may be delayed in getting approved because the number of participants is so low.[59]
For clinical trials involving potential for seasonal influences (such as airborne allergies, seasonal affective disorder, influenza, and skin diseases), the study may be done during a limited part of the year (such as spring for pollen allergies), when the drug can be tested.[60][61]
Clinical trials that do not involve a new drug usually have a much shorter duration. (Exceptions are epidemiological studies, such as the Nurses' Health Study).
Administration
[edit]Clinical trials designed by a local investigator, and (in the US) federally funded clinical trials, are almost always administered by the researcher who designed the study and applied for the grant. Small-scale device studies may be administered by the sponsoring company. Clinical trials of new drugs are usually administered by a contract research organization (CRO) hired by the sponsoring company. The sponsor provides the drug and medical oversight. A CRO is contracted to perform all the administrative work on a clinical trial. For Phases II–IV the CRO recruits participating researchers, trains them, provides them with supplies, coordinates study administration and data collection, sets up meetings, monitors the sites for compliance with the clinical protocol, and ensures the sponsor receives data from every site. Specialist site management organizations can also be hired to coordinate with the CRO to ensure rapid IRB/IEC approval and faster site initiation and patient recruitment. Phase I clinical trials of new medicines are often conducted in a specialist clinical trial clinic, with dedicated pharmacologists, where the subjects can be observed by full-time staff. These clinics are often run by a CRO which specialises in these studies.
At a participating site, one or more research assistants (often nurses) do most of the work in conducting the clinical trial. The research assistant's job can include some or all of the following: providing the local institutional review board (IRB) with the documentation necessary to obtain its permission to conduct the study, assisting with study start-up, identifying eligible patients, obtaining consent from them or their families, administering study treatment(s), collecting and statistically analyzing data, maintaining and updating data files during followup, and communicating with the IRB, as well as the sponsor and CRO.
Quality
[edit]In the context of a clinical trial, quality typically refers to the absence of errors which can impact decision making, both during the conduct of the trial and in use of the trial results.[62]
Marketing
[edit]An Interactional Justice Model may be used to test the effects of willingness to talk with a doctor about clinical trial enrollment.[63] Results found that potential clinical trial candidates were less likely to enroll in clinical trials if the patient is more willing to talk with their doctor. The reasoning behind this discovery may be patients are happy with their current care. Another reason for the negative relationship between perceived fairness and clinical trial enrollment is the lack of independence from the care provider. Results found that there is a positive relationship between a lack of willingness to talk with their doctor and clinical trial enrollment. Lack of willingness to talk about clinical trials with current care providers may be due to patients' independence from the doctor. Patients who are less likely to talk about clinical trials are more willing to use other sources of information to gain a better insight of alternative treatments. Clinical trial enrollment should be motivated to utilize websites and television advertising to inform the public about clinical trial enrollment.
Information technology
[edit]The last decade has seen a proliferation of information technology use in the planning and conduct of clinical trials. Clinical trial management systems are often used by research sponsors or CROs to help plan and manage the operational aspects of a clinical trial, particularly with respect to investigational sites. Advanced analytics for identifying researchers and research sites with expertise in a given area utilize public and private information about ongoing research.[64] Web-based electronic data capture (EDC) and clinical data management systems are used in a majority of clinical trials[65] to collect case report data from sites, manage its quality and prepare it for analysis. Interactive voice response systems are used by sites to register the enrollment of patients using a phone and to allocate patients to a particular treatment arm (although phones are being increasingly replaced with web-based (IWRS) tools which are sometimes part of the EDC system). While patient-reported outcome were often paper based in the past, measurements are increasingly being collected using web portals or hand-held ePRO (or eDiary) devices, sometimes wireless.[66] Statistical software is used to analyze the collected data and prepare them for regulatory submission. Access to many of these applications are increasingly aggregated in web-based clinical trial portals. In 2011, the FDA approved a Phase I trial that used telemonitoring, also known as remote patient monitoring, to collect biometric data in patients' homes and transmit it electronically to the trial database. This technology provides many more data points and is far more convenient for patients, because they have fewer visits to trial sites. As noted below, decentralized clinical trials are those that do not require patients' physical presence at a site, and instead rely largely on digital health data collection, digital informed consent processes, and so on.
Analysis
[edit]A clinical trial produces data that could reveal quantitative differences between two or more interventions; statistical analyses are used to determine whether such differences are true, result from chance, or are the same as no treatment (placebo).[67][68] Data from a clinical trial accumulate gradually over the trial duration, extending from months to years.[53] Accordingly, results for participants recruited early in the study become available for analysis while subjects are still being assigned to treatment groups in the trial. Early analysis may allow the emerging evidence to assist decisions about whether to stop the study, or to reassign participants to the more successful segment of the trial.[67] Investigators may also want to stop a trial when data analysis shows no treatment effect.[68]
Ethical aspects
[edit]Clinical trials are closely supervised by appropriate regulatory authorities. All studies involving a medical or therapeutic intervention on patients must be approved by a supervising ethics committee before permission is granted to run the trial. The local ethics committee has discretion on how it will supervise noninterventional studies (observational studies or those using already collected data). In the US, this body is called the Institutional Review Board (IRB); in the EU, they are called Ethics committees. Most IRBs are located at the local investigator's hospital or institution, but some sponsors allow the use of a central (independent/for profit) IRB for investigators who work at smaller institutions.
Чтобы быть этическим, исследователи должны получить полное и информированное согласие участвующих людей. (Одна из основных функций IRB - обеспечить, чтобы потенциальные пациенты были адекватно информированы о клиническом испытании.) Если пациент не может дать согласие на себя, исследователи могут обратиться за согласием от юридически уполномоченного представителя пациента. Кроме того, участники клинического испытания должны быть осведомлены о том, что они могут выйти из клинического испытания в любое время без каких -либо неблагоприятных действий против них. [69] В Калифорнии штат расставил приоритеты лиц, которые могут служить юридически уполномоченным представителем. [ 70 ]
В некоторых местах в США местный IRB должен сертифицировать исследователей и их сотрудников, прежде чем они смогут провести клинические испытания. Они должны понимать закон о конфиденциальности пациентов ( HIPAA ) и хорошую клиническую практику. Международная конференция по гармонизации для хорошей клинической практики представляет собой набор стандартов, используемых на международном уровне для проведения клинических испытаний. Руководящие принципы направлены на то, чтобы обеспечить защиту «права, безопасность и благополучие предметов».
Понятие информированного согласия участвующих людей существует во многих странах, но его точное определение все еще может различаться.
Информированное согласие, очевидно, является «необходимым» условием этического поведения, но не «обеспечивает« этическое поведение ». В испытаниях сострадательного использования последнее становится особенно сложной проблемой. Окончательная цель состоит в том, чтобы обслуживать сообщество пациентов или будущих пациентов наиболее эффективным и наиболее ответственным образом. Смотрите также расширенный доступ . Однако может быть трудно превратить эту цель в четко определенную, количественную, объективную функцию. Однако в некоторых случаях это можно сделать, например, для вопросов о том, когда остановить последовательные методы лечения (см. Алгоритм шансов ), а затем количественные методы могут играть важную роль.
Дополнительные этические проблемы присутствуют при проведении клинических испытаний по детям ( педиатрии ) и в чрезвычайных или эпидемических ситуациях. [ 71 ] [ 72 ]
Этическое уравновешивание прав многочисленных заинтересованных сторон может быть трудным. Например, когда испытания на наркотики терпят неудачу, спонсоры могут немедленно сообщить нынешним и потенциальным инвесторам, что означает, что как исследовательский персонал, так и зарегистрированные участники могут сначала услышать о окончании судебного разбирательства через общественные деловые новости . [ 73 ]
Конфликты интересов и неблагоприятных исследований
[ редактировать ]В ответ на конкретные случаи, в которых не были опубликованы неблагоприятные данные, спонсируемые фармацевтическими исследованиями, фармацевтические исследования и производители Америки опубликовали новые руководящие принципы, которые призывали компании сообщать все выводы и ограничить финансовое участие в фармацевтических компаниях исследователями. [ 74 ] Конгресс США подписал законопроект, который требует, чтобы клинические испытания II и фаза III были зарегистрированы спонсором на веб -сайте Clinicaltrials.gov, составленном Национальными институтами здравоохранения . [ 75 ]
Исследователи от наркотиков, не работающие непосредственно в фармацевтических компаниях, часто ищут гранты от производителей, и производители часто обращаются к академическим исследователям для проведения исследований в сетях университетов и их больниц, например, для исследований по трансляционному раку. Аналогичным образом, конкуренция на штатные академические должности, государственные гранты и престиж создают конфликт интересов среди ученых -академиков. [ 76 ] Согласно одному исследованию, приблизительно 75% статей, отобранных по причинам, связанным с неправомерными действиями, не имели заявленной финансовой поддержки отрасли. [ 77 ] Посевные испытания особенно противоречивы. [ 78 ]
В Соединенных Штатах все клинические испытания, представленные в FDA в рамках процесса одобрения лекарственного средства, независимо оцениваются клиническими экспертами в Управлении по контролю за продуктами и лекарствами, [ 79 ] включая проверки сбора первичных данных на выбранных сайтах клинических испытаний. [ 80 ]
В 2001 году редакторы 12 основных журналов опубликовали совместную редакционную статью, опубликованную в каждом журнале, о контроле над клиническими испытаниями, осуществляемыми спонсорами, в частности, нацеливаясь на использование контрактов, которые позволяют спонсорам пересматривать исследования до публикации и удерживать публикацию. Они укрепили редакционные ограничения, чтобы противостоять эффекту. В редакционной статье отметилась, что к 2000 году организации по контракту получили 60% грантов от фармацевтических компаний в США. Исследователи могут быть ограничены от участия в проекте испытания, доступа к необработанным данным и интерпретации результатов. [ 81 ]
Несмотря на явные рекомендации заинтересованных сторон в области мер по улучшению стандартов спонсируемых отрасли медицинских исследований, [ 82 ] В 2013 году Тоен предупредил о настойчивости разрыва в достоверности выводов, возникающих в результате финансируемых промышленными клиническими испытаниями, и призвал обеспечить строгую соблюдение этических стандартов в промышленном сотрудничестве с научными кругами, чтобы избежать дальнейшей эрозии доверия общественности. [ 83 ] Проблемы, обращенные к вниманию в этом отношении, включают потенциальное смещение наблюдения, продолжительность времени наблюдения для технических исследований, выбор популяций пациентов, факторы, которые влияют на реакцию плацебо и источники финансирования. [ 84 ] [ 85 ] [ 86 ]
Во время кризиса общественного здравоохранения
[ редактировать ]Проведение клинических испытаний вакцин во время эпидемий и пандемиков подвержена этическим проблемам. При заболеваниях с высоким уровнем смертности, такими как Эбола, назначение людей на плацебо или контрольную группу можно рассматривать как смертный приговор. В ответ на этические проблемы, связанные с клиническими исследованиями во время эпидемий, Национальная медицина национальной медицинской академии написала отчет, в котором выявлены семь этических и научных соображений. Эти соображения: [ 87 ]
- Научная ценность
- Социальная ценность
- Уважение к людям
- Вовлечение сообщества
- Забота о благосостоянии участников и интересах
- Баланс к выгоде по сравнению с рисками
- Доступ после испытаний к проверенной терапии, которая была удержана во время испытания
Беременные женщины и дети
[ редактировать ]Беременные женщины и дети, как правило, исключаются из клинических испытаний в качестве уязвимых групп населения, хотя данные, подтверждающие их, не являются надежными. Исключая их из клинических испытаний, часто отсутствует информация о безопасности и эффективности методов лечения для этих популяций. Во время ранней истории эпидемии ВИЧ/СПИДа ученый отметил, что, исключая эти группы из потенциально спасительного лечения, они «защищены до смерти». Такие проекты, как этика исследования для вакцин, эпидемии и новые технологии (предотвращение), выступали за этическую включение беременных женщин в испытаниях вакцины. Включение детей в клинические испытания имеет дополнительные моральные соображения, поскольку у детей не хватает автономии, принимающих решения. Испытания в прошлом подвергались критике за использование госпитализированных детей или сирот; Эти этические проблемы эффективно остановили будущие исследования. В усилиях по поддержанию эффективной педиатрической помощи в нескольких европейских странах и США есть политика, чтобы соблазнить или заставлять фармацевтические компании провести педиатрические испытания. Международное руководство рекомендует этические педиатрические испытания, ограничивая вред, учитывая различные риски и учитывая сложности педиатрической помощи. [ 87 ]
Безопасность
[ редактировать ]Ответственность за безопасность субъектов в клиническом испытании распределяется между спонсором, местными исследователями сайта (если отличается от спонсора), различные IRB, которые контролируют исследование, и (в некоторых случаях, если исследование включает в себя рыночный препарат или устройство), регулирующее агентство для страны, где будет продаваться препарат или устройство.
Систематическое параллельное обзор безопасности часто используется для обеспечения безопасности участников исследования. Поведение и постоянный обзор предназначены для того, чтобы быть пропорциональными риску испытания. Как правило, эта роль заполняется комитетом по данным и безопасности , внешне назначенным монитором медицинской безопасности, [ 88 ] Независимый сотрудник по безопасности , или для малых или низких исследований, основной исследователь. [ 89 ]
По соображениям безопасности многие клинические испытания лекарств [ 90 ] предназначены для исключения женщин детородного возраста, беременных женщин или женщин, которые забеременеют во время исследования. В некоторых случаях партнеры из этих женщин также исключаются или требуются для принятия мер по борьбе с рождаемостью.
Спонсор
[ редактировать ]На протяжении всего клинического испытания спонсор отвечает за точную информирование местных исследователей о истинном историческом отчете о безопасности препарата, устройства или других медицинских методов лечения, которые должны быть проверены, и любого потенциального взаимодействия исследуемого лечения с уже одобренным лечение. Это позволяет местным следователям выносить осознанное суждение о том, следует ли участвовать в исследовании или нет. Спонсор также отвечает за мониторинг результатов исследования, поскольку они поступают с различных сайтов по мере поступления испытания. В более крупных клинических испытаниях спонсор будет использовать услуги комитета по мониторингу данных (DMC, известный в США как Совет по мониторингу безопасности данных). Эта независимая группа клиницистов и статистиков периодически встречается, чтобы пересмотреть неослабежные данные, которые спонсор получил до сих пор. DMC имеет право рекомендовать прекращение исследования на основе их обзора, например, если исследование лечение вызывает больше смертей, чем стандартное лечение, или, по-видимому, вызывает неожиданные и связанные с исследованиями. неблагоприятные события . Спонсор отвечает за сбор отчетов о побочных событиях от всех следователей сайта в исследовании, а также за информирование всех исследователей о решении спонсора о том, были ли эти неблагоприятные события связаны или не связаны с лечением исследования.
Спонсор и следователи местных сайтов несут совместно ответственность за написание информированного согласия , специфичного для конкретного сайта , которое точно информирует о потенциальных предметах истинных рисков и потенциальных преимуществ участия в исследовании, в то же время представляя материал как можно кратко и и кратко на обычном языке. В правилах FDA говорится, что участие в клинических испытаниях является добровольным, причем субъект имеет право не участвовать или прекратить участие в любое время. [ 91 ]
Местные следователи сайта
[ редактировать ]Этическое принцип Primum non-nocere («во-первых, не причиняет вреда») направляет исследование, и если исследователь считает, что лечение исследования может нанести ущерб субъектам в исследовании, исследователь может прекратить участие в любое время. С другой стороны, следователи часто заинтересованы в наборе предметов и могут действовать неэтично, чтобы получить и поддерживать свое участие.
Местные следователи несут ответственность за проведение исследования в соответствии с протоколом исследования и надзор за персоналом исследования на протяжении всего исследования. Местный исследователь или его/ее исследовательский персонал также несут ответственность за обеспечение потенциальных предметов в исследовании понимать риски и потенциальные преимущества участия в исследовании. Другими словами, они (или их юридически уполномоченные представители) должны дать действительно информированное согласие.
Местные следователи несут ответственность за рассмотрение всех отчетов о побочных событиях, отправленных спонсором. Эти отчеты о неблагоприятных событиях содержат мнения как следователя (на месте, где произошло неблагоприятное событие), так и спонсора, касающиеся взаимосвязи неблагоприятных событий с лечением исследования. Местные следователи также несут ответственность за вынесение независимого суждения об этих отчетах и оперативно информировать местный IRB о всех серьезных и учебных побочных событиях, связанных с лечением.
Когда местный следователь является спонсором, не может быть официальных отчетов о неблагоприятных событиях, но персонал исследования во всех местах несет ответственность за информирование координационного следователя о чем -то неожиданном. Местный следователь несет ответственность за то, чтобы быть правдивым для местного IRB во всех сообщениях, связанных с исследованием.
Институциональные обзоры (IRBS)
[ редактировать ]Одобрение институциональным контрольным советом (IRB) или Независимого комитета по этике (МЭК) необходимо, прежде чем все, кроме самых неформальных исследований. В коммерческих клинических испытаниях протокол исследования не одобрен IRB до того, как спонсор набирает участки для проведения испытания. Тем не менее, протокол исследования и процедуры были адаптированы для соответствия общим требованиям представления IRB. В этом случае, и там, где нет независимого спонсора, каждый исследователь местного сайта представляет протокол исследования, согласие (ов), формы сбора данных и подтверждающая документацию для локального IRB. Университеты и большинство больниц имеют собственные IRBS. Другие исследователи (например, в клиниках, использующих независимые IRB.
IRB изучает исследование как для медицинской безопасности, так и для защиты пациентов, участвующих в исследовании, до того, как он позволит исследователю начать исследование. Это может потребовать изменения в процедурах исследования или в объяснениях, данных пациенту. Необходимый ежегодный отчет «Продолжающегося рассмотрения» от исследователя обновляет IRB о ходе исследования и любой новой информации о безопасности, связанной с исследованием.
Регулирующие органы
[ редактировать ]В США FDA может проверять файлы файлов местных следователей сайта после того, как они закончили участие в исследовании, чтобы увидеть, правильно ли они следовали процедурам обучения. Этот аудит может быть случайным или по причине (потому что исследователь подозревается в мошеннических данных). Избегать аудита является стимулом для исследователей следовать процедурам обучения. «Покрытое клиническое исследование» относится к испытанию, представленному в FDA как часть маркетинговой заявки (например, как часть NDA или 510 (k) ), о котором FDA может потребовать раскрытия финансового интереса клинического следователя в результате исследования. Например, заявитель должен раскрыть, владеет ли следователь в спонсоре или владеет собственным интересом к исследуемому продукту. FDA определяет покрытое исследование как «... любое исследование препарата, биологического продукта или устройства у людей, представленных в маркетинговой заявке или петиции реклассификации, на которое полагается заявитель или FDA, чтобы установить, что продукт эффективен (включая исследования, которые показывают Эквивалентность эффективному продукту) или любое исследование, в котором один исследователь вносит значительный вклад в демонстрацию безопасности ». [ 92 ]
В качестве альтернативы, многие американские фармацевтические компании перенесли некоторые клинические испытания за рубежом. Преимущества проведения испытаний за рубежом включают более низкие затраты (в некоторых странах) и способность проводить более крупные испытания в более короткие сроки, тогда как потенциальное недостаток существует при управлении испытаниями более низкого качества. [ 93 ] Различные страны имеют разные нормативные требования и правоприменение. По оценкам, 40% всех клинических испытаний в настоящее время проходят в Азии, Восточной Европе, в Центральной и Южной Америке. «В этих странах нет обязательной системы регистрации для клинических испытаний, и многие не следуют европейским директивам в своих операциях»,-говорит Джейкоб Сиджтсма из Нидерландов Wemos, организации здравоохранения, отслеживая клинические испытания в развивающихся странах. [ 94 ]
Начиная с 1980 -х годов, гармонизация протоколов клинических испытаний была показана как выполнимое в странах Европейского Союза. В то же время координация между Европой, Японией и Соединенными Штатами привела к совместной нормативно-промышленной инициативе по международной гармонизации, названной в честь 1990 года как Международная конференция по гармонизации технических требований для регистрации фармацевтических препаратов для использования человека (ICH) [ 95 ] В настоящее время большинство программ клинических испытаний следуют руководящим принципам ICH, направленным на «обеспечение того, чтобы хорошее качество, безопасные и эффективные лекарства разрабатывались и зарегистрированы наиболее эффективным и экономически эффективным способом. Эти действия преследуются в интересах потребителя и общественного здравоохранения, Чтобы предотвратить ненужное дублирование клинических испытаний у людей и минимизировать использование испытаний на животных без ущерба для регулирующих обязательств по безопасности и эффективности ». [ 96 ]
Агрегация данных безопасности во время клинической разработки
[ редактировать ]Агрегирование данных безопасности в клинических испытаниях во время разработки лекарств важно, потому что испытания обычно предназначены для того, чтобы сосредоточиться на определении того, насколько хорошо работает лекарство. Данные безопасности, собранные и агрегируемые по нескольким исследованиям по мере разработки лекарственного средства, позволяют спонсорам, исследователям и регулирующим органам контролировать профиль совокупного безопасности экспериментальных лекарств по мере их разработки. Значение оценки совокупных данных о безопасности: a) решения, основанные на совокупной оценке безопасности во время разработки медицины, могут быть приняты на протяжении всей разработки медицины, и б) он устанавливает спонсоров и регуляторы для оценки безопасности лекарства после одобрения препарата Полем [ 97 ] [ 98 ] [ 99 ] [ 100 ] [ 101 ]
Экономика
[ редактировать ]Затраты на клинические испытания варьируются в зависимости от этапа испытания, типа испытаний и изученных заболеваний. Исследование клинических испытаний, проведенных в Соединенных Штатах с 2004 по 2012 год, показало, что средняя стоимость исследований I фазы составляет от 1,4 до 6,6 млн. Долл. США, в зависимости от типа заболевания. Испытания фазы II варьировались от 7 до 20 миллионов долларов, а испытания III фазы - от 11 до 53 миллионов долларов. [ 102 ]
Спонсор
[ редактировать ]Стоимость исследования зависит от многих факторов, особенно от количества участков, проводящих исследование, количество вовлеченных пациентов, и является ли исследовательское лечение уже одобрено для медицинского использования.
Расходы, понесенные фармацевтической компанией, при управлении клиническим испытанием III или IV, среди прочего, могут включать в себя клиническое исследование фазы III или IV:
- Производство оцениваемого препарата или устройства (-ов)
- Заработная плата персонала для дизайнеров и администраторов судебного разбирательства
- Платежи в организацию по контракту, организация по управлению сайтами (если используется) и любые внешние консультанты
- Платежи местным исследователям и их сотрудникам за их время и усилия по набору предметов и сбору данных для спонсора
- стоимость учебных материалов и платы, понесенные для их отправки
- Коммуникация с местными исследователями, включая мониторинг на месте CRO до и (в некоторых случаях) несколько раз во время исследования
- ОДИН или несколько встреч для обучения следователей
- Расходы, понесенные местными исследователями, такими как плата за аптеки, плата за IRB и почтовые расходы
- Любые платежи по субъектам, зарегистрированным в суде
- Расходы на лечение испытуемого, у которого развивается состояние здоровья, вызванное препаратом для исследования
Эти расходы понесены в течение нескольких лет.
В США спонсоры могут получить 50 -процентный налоговый кредит на клинические испытания, проведенные на лекарства, разрабатываемые для лечения заболеваний сирот . [ 103 ] Национальные медицинские агентства, такие как Национальные институты здравоохранения США , предлагают гранты следователям, которые разрабатывают клинические испытания, которые пытаются ответить на исследования, представляющие интерес для агентства. В этих случаях исследователь, который пишет грант и управляет исследованием в качестве спонсора, и координирует сбор данных с любых других сайтов. Эти другие сайты могут или не могут быть оплачены за участие в исследовании, в зависимости от суммы гранта и суммы, ожидаемых от них усилий. Использование интернет -ресурсов может, в некоторых случаях, сократить экономическое бремя. [ 104 ]
Следователи
[ редактировать ]Следователи часто получают компенсацию за свою работу в клинических испытаниях. Эти суммы могут быть небольшими, просто охватывая частичную заработную плату для научных сотрудников и стоимость любых поставки (обычно в случае с исследованиями национальных агентств здравоохранения), или быть существенными и включать «накладные расходы», которые позволяют исследователю платить исследовательскому персоналу во время между клиническими испытаниями. [ Цитация необходима ]
Субъекты
[ редактировать ]Участники в испытаниях по наркотикам I фазы не получают прямой пользы для здоровья от участия. Как правило, им платят за свое время, с регулируемыми платежами и не связаны с каким -либо связанным с риском. Мотивации здоровых добровольцев не ограничиваются финансовым вознаграждением и могут включать другие мотивы, такие как участие в науке и других. [ 105 ] В последующих этапах испытаний субъекты не могут быть выплачены, чтобы обеспечить их мотивацию для участия с потенциалом для медицинской выгоды или способствуя медицинским знаниям. Небольшие платежи могут быть произведены за расходы, связанные с исследованиями, такие как поездки или компенсация за их время, предоставление последующей информации о их здоровье после завершения пробного лечения.
Набор и участие участников
[ редактировать ]
Фаза 0 и фаза I Испытания на наркотики ищут здоровых добровольцев. Большинство других клинических испытаний ищут пациентов с конкретным заболеванием или заболеванием. Разнообразие, наблюдаемое в обществе, должно быть отражено в клинических испытаниях посредством соответствующего включения населения этнических меньшинств . [ 106 ] Набор персонала или набор участников играет важную роль в деятельности и обязанностях участков, проводящих клинические испытания. [ 107 ]
Все добровольцы, рассматриваемые для судебного разбирательства, должны пройти медицинский скрининго. Требования различаются в соответствии с требованиями испытаний, но обычно добровольцы будут проверены в медицинской лаборатории на: [ 108 ]
- Измерение электрической активности сердца (ЭКГ)
- Измерение артериального давления, частоты сердечных сокращений и температуры тела
- Чемкопотребление крови
- Отбор проб мочи
- Измерение веса и высоты
- Испытание на злоупотребление наркотиками
- Тестирование беременности
Было отмечено, что участники клинических испытаний непропорционально белые. [ 109 ] [ 110 ] Часто меньшинства не информируются о клинических испытаниях. [ 111 ] Один недавний систематический обзор литературы обнаружил, что раса/этническая принадлежность, а также пол были не хорошо представлены, а иногда даже отслеживались как участники большого числа клинических испытаний по утрате слуха у взрослых. [ 112 ] Это может снизить обоснованность результатов в отношении небелых пациентов [ 113 ] не соответствующим образом представляя большую популяцию .
Расположение испытаний
[ редактировать ]В зависимости от того, что требуется участники, спонсоры клинических испытаний или исследовательских организаций, работающих от их имени, пытаются найти сайты с квалифицированным персоналом, а также доступ к пациентам, которые могут участвовать в исследовании. Работая с этими сайтами, они могут использовать различные стратегии найма, в том числе базы данных пациентов, газетные и радиопередачи, листовки, плакаты в местах, которые могут пойти пациенты (например, офисы врача) и личный набор пациентов с исследователями.
Добровольцы с конкретными условиями или заболеваниями имеют дополнительные онлайн -ресурсы, чтобы помочь им найти клинические испытания. Например, искатель испытания FOX связывает испытания болезни Паркинсона по всему миру с волонтерами, которые имеют определенное набор критериев, таких как местоположение, возраст и симптомы. [ 114 ] Другие специфичные для болезни услуги существуют для добровольцев, чтобы найти испытания, связанные с их состоянием. [ 115 ] Добровольцы могут непосредственно искать на клинических обращениях. Gov для поиска испытаний, используя реестр, управляемый Национальным институтом здравоохранения и национальной медицинской библиотеки США . Также существует программное обеспечение, которое позволяет врачам найти варианты испытаний для отдельного пациента на основе таких данных, как геномные данные. [ 116 ]
Исследовать
[ редактировать ]
Модель в поисках и обработке информации о рисках (RISP) анализирует социальные последствия, которые влияют на отношение и принятие решений, относящиеся к клиническим испытаниям. [ 117 ] Люди, которые имеют более высокую долю или интерес к лечению, представленному в клиническом испытании, показали большую вероятность поиска информации о клинических испытаниях. Пациенты с раком сообщили, что более оптимистичное отношение к клиническим испытаниям, чем население в целом. Наличие более оптимистичного взгляда на клинические испытания также приводит к большей вероятности регистрации. [ 117 ]
Соответствующий
[ редактировать ]Сопоставление включает в себя систематическое сравнение клинической и демографической информации пациента с критериями приемлемости различных испытаний. Методы включают:
- Руководство: поставщики медицинских услуг или координаторы клинических испытаний вручную просмотрите записи пациентов и доступные критерии испытаний для выявления потенциальных совпадений. [ 118 ] Это также может включать в себя поиск вручную в базах данных клинических испытаний. [ 119 ]
- Электронные медицинские записи (EHR). Некоторые системы интегрируются с EHR, чтобы автоматически помечать пациентов, которые могут иметь право на исследования на основе их медицинских данных. Эти системы могут использовать методы машинного обучения , искусственного интеллекта или точной медицины, чтобы более эффективно соответствовать пациентам с исследованиями. [ 120 ] Эти методы сталкиваются с проблемой преодоления ограничений записей EHR, таких как упущения и ошибки ведения журнала.
- Услуги прямого к пациенту: ресурсы специализируются на поддержке пациентов в поиске клинических испытаний через онлайн-платформы, горячие линии и персонализированную поддержку. [ 118 ] [ 119 ] [ 121 ]
Децентрализованные испытания
[ редактировать ]Хотя испытания обычно проводятся в крупных медицинских центрах, некоторые участники исключаются из -за расстояния и расходов, необходимых для поездок, что приводит к трудностям, недостаткам и несправедливости для участников, особенно в сельских и недостаточно обслуживаемых общинах. Следовательно, концепция «децентрализованного клинического испытания», которая минимизирует или устраняет необходимость перемещения пациентов на сайты [ 122 ] теперь более широко распространен, способность улучшается с помощью телездравоохранения и носимых технологий . [ 123 ]
Смотрите также
[ редактировать ]Ссылки
[ редактировать ]- ^ Подпрыгнуть до: а беременный в «NIH клинические исследования и вас: основы» . Национальные институты здравоохранения США. 3 октября 2022 года. Архивировано с оригинала 22 апреля 2020 года . Получено 7 ноября 2022 года .
- ^ «Клинические испытания» (PDF) . Билл и Мелинда Гейтс Фонд. Архивировано (PDF) из оригинала 12 января 2017 года . Получено 1 января 2014 года .
- ^ Димаси, Джозеф А; Grabowski, Генри Г; Хансен, Рональд В. (2016). «Инновации в фармацевтической промышленности: новые оценки расходов на НИОКР». Журнал экономики здравоохранения . 47 : 20–33. doi : 10.1016/j.jhealeco.2016.01.012 . HDL : 10161/12742 . PMID 26928437 .
- ^ «Процесс разработки лекарственного средства. Шаг 3: клинические исследования» . Управление по контролю за продуктами и лекарствами США. 4 января 2018 года . Получено 9 марта 2024 года .
- ^ «Сколько времени требуется новое препарат, чтобы пройти клинические испытания» . Рак исследований Великобритания. 1 февраля 2022 года . Получено 9 марта 2024 года .
- ^ Emanuel EJ (9 сентября 2015 г.). «Решение цен на лекарства» . New York Times . Архивировано из оригинала 5 декабря 2022 года . Получено 26 февраля 2017 года .
Из лекарств, начатых в клинических испытаниях на людях, только 10 процентов обеспечивают одобрение FDA. ...
- ^ 25 апреля . 2014 года Страница FDA в последний раз обновляется
- ^ Phrma. Февраль 2007 г. Обнаружение и развитие наркотиков Архивировало 10 апреля 2023 года в The Wayback Machine
- ^ Merck Manual. Последний полный обзор/пересмотр октября 2013 г. Даниэль А. Гусар, докторская степень, докторская докторская без рецепта связь о препаратах, заархивированных 4 февраля 2015 года на машине Wayback
- ^ Averorn J. (2004). Мощные лекарства , с. 129–33. Альфред А. Кнопф.
- ^ Van Spall HG, Toren A, Kiss A, Fowler RA (март 2007 г.). «Критерии приемлемости рандомизированных контролируемых испытаний, опубликованных в общих медицинских журналах с высоким воздействием: систематический обзор выборки». Джама . 297 (11): 1233–40. doi : 10.1001/Jama.297.11.1233 . PMID 17374817 .
- ^ Подпрыгнуть до: а беременный в дюймовый и фон глин час я Дж "Каковы различные виды клинических исследований?" Полем Управление по контролю за продуктами и лекарствами США. 2019. Архивировано с оригинала 12 июня 2019 года . Получено 24 мая 2019 года .
- ^ Регулирующий орган в США - Управление по контролю за продуктами и лекарствами ; в Канаде, здравоохранение Канада ; В Европейском Союзе Европейское агентство по лекарственным средствам ; и в Японии, Министерство здравоохранения, труда и благосостояния
- ^ «Медицинские устройства, Прамаркетские клинические исследования для освобождения от исследования» . Управление по контролю за продуктами и лекарствами США. 17 марта 2017 года. Архивировано с оригинала 1 ноября 2017 года . Получено 2 октября 2017 года .
- ^ Ледерле Ф.А., Фрейшлаг Дж.А., Кириакидес Т.К., Падберг Ф.Т., Мацумура Дж.С., Колер Т.Р., Лин П.Х., Жан-Клод Дж. М., Сикрит Д.Ф., Свансон К.М., Педуцзи Пн (октябрь 2009 г.). «Результаты после эндоваскулярного и открытого восстановления аневризмы аорты брюшной полости: рандомизированное исследование» . Джама . 302 (14): 1535–42. doi : 10.1001/Jama.2009.1426 . PMID 19826022 .
- ^ Липп А., Шоу С., Главинд К (декабрь 2014 г.). «Механические устройства для недержания мочи у женщин» . Кокрановская база данных систематических обзоров . 2014 (12): CD001756. doi : 10.1002/14651858.cd001756.pub6 . PMC 7061494 . PMID 25517397 .
- ^ Farrokhyar F, Karanicolas PJ, Thoma A, Simunovic M, Bhandari M, Devereaux PJ, Anvari M, Adili A, Guyatt G (март 2010 г.). «Рандомизированные контролируемые исследования хирургических вмешательств». Анналы хирургии . 251 (3): 409–16. doi : 10.1097/sla.0b013e3181cf863d . PMID 20142732 . S2CID 17084906 .
- ^ Метвалли, Мостафа; Рейбулд, Грейс; Cheong, Ying C; Хорн, Эндрю В. (29 января 2020 года). Кокрановская гинекология и группа фертильности (ред.). «Хирургическое лечение миомы для под поверхности» . Кокрановская база данных систематических обзоров . 2020 (1): CD003857. doi : 10.1002/14651858.cd003857.pub4 . PMC 6989141 . PMID 31995657 .
- ^ Cao Am, Cox MR, Eslick GD (март 2016 г.). «Дизайн исследования в хирургии на основе фактических данных: какова роль исследований в отношении случайного контроля?» Полем Мировой журнал методологии . 6 (1): 101–4. doi : 10.5662/wjm.v6.i1.101 . PMC 4804244 . PMID 27019801 .
- ^ «Пакет общественной информации (PIP): как принять участие в NHS, исследованиях общественного здравоохранения и социального обеспечения» . Национальный институт исследований здравоохранения и ухода . Получено 3 января 2024 года .
- ^ «Брифинг примечания для исследователей - общественное участие в NHS, исследованиях в области здравоохранения и социального обеспечения» . Национальный институт исследований здравоохранения и ухода . Получено 3 января 2024 года .
- ^ Подпрыгнуть до: а беременный в дюймовый Meinert CL, Tonascia S (1986). Клинические испытания: проектирование, поведение и анализ . Издательство Оксфордского университета, США. п. 3. ISBN 978-0-19-503568-1 Полем Архивировано из оригинала 15 апреля 2023 года . Получено 5 июня 2020 года .
- ^ Саймон, Харви Б. (2002). Гарвардская медицинская школа по здоровью мужчин . Нью -Йорк: Свободная пресса . п. 31 ISBN 978-0-684-87181-3 .
- ^ Браун, Стивен Р. (2003). Скюрви: как хирург, моряк и джентльмен решил величайшую медицинскую загадку эпохи паруса . Нью -Йорк, Нью -Йорк: пресса Святого Мартина. ISBN 0-312-31391-8
- ^ Роджерс, Эверетт М. (1995). Распространение инноваций . Нью -Йорк, Нью -Йорк: Свободная пресса. ISBN 0-7432-2209-1 . п. 7
- ^ Карлайл, Родни (2004). Scientific American Изобретения и открытия , John Wiley & Songs, Inc., Нью -Джерси. п. 393. ISBN 0-471-24410-4 .
- ^ «Джеймс Линд: трактат цинги (1754)» . 2001. Архивировано с оригинала 1 октября 2018 года . Получено 9 сентября 2007 года .
- ^ «О клинических испытаниях» . День клинических испытаний . Архивировано из оригинала 5 февраля 2023 года . Получено 7 апреля 2023 года .
- ^ Грин С., Кроули Дж., Бенедетти Дж., Смит А (30 июля 2002 г.). Клинические испытания в онкологии, второе издание . CRC Press. С. 1-. ISBN 978-1-4200-3530-8 .
- ^ GAD SC (17 июня 2009 г.). Справочник по клиническим испытаниям . Джон Уайли и сыновья. с. 118–. ISBN 978-0-470-46635-3 .
- ^ О'Рурк М.Ф. (февраль 1992 г.). «Фредерик Акбар Маромед» . Гипертония . 19 (2): 212–7. doi : 10.1161/01.hyp.19.2.212 . PMID 1737655 .
- ^ Creswell, JW (2008). Образовательные исследования: планирование, проведение и оценка количественных и качественных исследований (3 -е). Верхняя седл -река, Нью -Джерси: Прентис Холл. 2008, с. 300. ISBN 0-13-613550-1
- ^ Хани (2009). «Исследование репликации» . Архивировано с оригинала 2 июня 2012 года . Получено 27 октября 2011 года .
- ^ Metcalfe NH (февраль 2011 г.). «Сэр Джеффри Маршалл (1887-1982): врач-респиратор, катализатор развития анестезии, доктор как премьер-министра, так и короля, и командир Баржа Первой мировой войны». Журнал медицинской биографии . 19 (1): 10–4. doi : 10.1258/jmb.2010.010019 . PMID 21350072 . S2CID 39878743 .
- ^ Pharmabiz.com, 19 мая 2014 года, Руководство по выпускам Mumbai ISCR для участников клинических испытаний на Международном дне клинических испытаний машине 7 апреля 2023 года на Wayback (по состоянию на 20 мая 2014 года)
- ^ Pottegård, Anton; Haastrup, Maija Bruun; Стадия, разорение Bjerregaard; Хансен, Мортен Рикс; и др. (16 декабря 2014 г.). «Поиск юмористических и экстравагантных аббревиатур и совершенно неадекватных названий для важных клинических испытаний (научные): качественное и количественное систематическое исследование» . BMJ . 349 : G7092. doi : 10.1136/bmj.g7092 . PMC 4267482 . PMID 25516539 .
- ^ Подпрыгнуть до: а беременный "Что такое клиническое исследование?" Полем Национальная библиотека медицины, Национальные институты здравоохранения США. 1 марта 2019 года. Архивировано с оригинала 19 мая 2019 года . Получено 24 мая 2019 года .
- ^ Хелен С. (2010). «ЕС сострадательные программы использования (Cups): нормативно -правовая база и указывают на то, что нужно рассмотреть перед реализацией CUP» . Pharm Med . 24 (4): 223–229. doi : 10.1007/bf03256820 . S2CID 31439802 .
- ^ Бреннан Z (5 июня 2013 г.). «Крос медленно переходит к адаптивным конструкциям клинических испытаний» . Аутсорсинг-pharma.com. Архивировано из оригинала 27 августа 2017 года . Получено 5 января 2014 года .
- ^ «Адаптивные клинические испытания для преодоления исследований» . News-medical.net. 17 сентября 2013 года. Архивировано с оригинала 11 августа 2020 года . Получено 4 января 2014 года .
- ^ Ван, Ширли С. (30 декабря 2013 г.). «Здоровье: ученые стремятся улучшить стоимость и время испытаний на лекарства - wsj.com» . Online.wsj.com. Архивировано с оригинала 14 марта 2016 года . Получено 4 января 2014 года .
- ^ Huber PW (12 ноября 2013 г.). Лечение в кодексе: как закон 20 -го века подрывает медицину 21 -го века . Основные книги. ISBN 978-0-465-06981-1 .
- ^ Lancet (июль 2009 г.). «Испытания фазы 0: платформа для разработки лекарств?» Полем Лансет . 374 (9685): 176. DOI : 10.1016/S0140-6736 (09) 61309-X . PMID 19616703 . S2CID 30939770 .
- ^ Подпрыгнуть до: а беременный «Фаза IIA и фаза IIB Клиническое испытание» . www.musculardystrophyuk.org . Архивировано из оригинала 9 августа 2020 года . Получено 10 августа 2020 года .
- ^ Подпрыгнуть до: а беременный в Ханнан Эль (июнь 2008 г.). «Рандомизированные клинические испытания и обсервационные исследования: руководящие принципы для оценки соответствующих сильных сторон и ограничений» . Jacc. Сердечно -сосудистые вмешательства . 1 (3): 211–7. doi : 10.1016/j.jcin.2008.01.008 . PMID 19463302 .
- ^ Sessler DI, Imrey PB (октябрь 2015). «Методология клинических исследований 2: наблюдательные клинические исследования» . Анестезия и анальгезия . 121 (4): 1043–51. doi : 10.1213/ane.0000000000000861 . PMID 26378704 . S2CID 19333613 .
- ^ Элдридж С.М., Ланкастер Г.А., Кэмпбелл М.Дж., Табан Л., Хоупвелл С., Коулман К.Л., Бонд К.М. (2016). «Определение осуществимости и пилотных исследований в подготовке к рандомизированным контролируемым исследованиям: разработка концептуальной структуры» . Plos один . 11 (3): E0150205. Bibcode : 2016ploso..1150205E . doi : 10.1371/journal.pone.0150205 . PMC 4792418 . PMID 26978655 .
- ^ «Активный контроль / активный компаратор» . 3 марта 2017 года. Архивировано с оригинала 8 апреля 2023 года . Получено 31 октября 2017 года .
- ^ «Основные протоколы для разработки лекарственного и биологического продукта» . www.fda.gov . Министерство здравоохранения и социальных служб США Центр Управления по контролю за пищевыми продуктами и лекарствами по оценке и исследованиям лекарств. 21 декабря 2023 г. с. 1 Получено 25 июля 2024 года .
 Эта статья включает текст из этого источника, который находится в общественном доступе .
Эта статья включает текст из этого источника, который находится в общественном доступе .
- ^ Молодая, Сьюзен. «Фонд медицина присоединяется к коалиции, направленной на то, чтобы встряхнуть испытания лекарств от рака | Обзор технологий MIT» . TechnologyReview.com. Архивировано с оригинала 13 ноября 2013 года . Получено 14 ноября 2013 года .
- ^ «Официальный веб -сайт ICH» (PDF) . www.ich.org . Архивировано из оригинала (PDF) 21 сентября 2008 года.
- ^ «Официальный веб -сайт ICH: ICH» . ich.org . Архивировано из оригинала 25 мая 2011 года . Получено 5 октября 2008 года .
- ^ Подпрыгнуть до: а беременный в «Узнайте о клинических исследованиях» . Clinicaltrials.gov . Архивировано из оригинала 10 апреля 2012 года.
- ^ Малони, Деннис М. (1984). Защита субъектов по исследованиям человека: практическое руководство по федеральным законам и правилам . Бостон, Массачусетс: Springer US. п. 151. ISBN 9781461327035 .
- ^ Дори, Фредерик (2011). «Статистика вкратце: статистическая сила: что это и когда ее следует использовать?» Полем Клиническая ортопедия и связанные с ними исследования . 469 (2): 619–620. doi : 10.1007/s11999-010-1435-0 . PMC 3018227 . PMID 20585913 .
- ^ Norwitz ER, Greenberg JA (2011). «Одобрение FDA на использование лекарств во время беременности: тяжелая битва» . Отзывы в области акушерства и гинекологии . 4 (2): 39–41. PMC 3218552 . PMID 22102925 .
- ^ «Часто задаваемые вопросы | Онкологический центр Университета Аризоны» . Azcc.arizona.edu. Архивировано с оригинала 2 декабря 2013 года . Получено 14 ноября 2013 года .
- ^ Мисета, изд (17 декабря 2019 г.). «Янссен использует геозон для мониторинга пациентов с клиническими испытаниями» . Клинический лидер . Пенсильвания, Соединенные Штаты: Вертмарки. Архивировано из оригинала 27 января 2020 года . Получено 26 января 2020 года .
- ^ Unger, JM; Кук, E; Тай, E; Блейер, А (2016). «Роль участия в клинических исследованиях в исследованиях рака: барьеры, доказательства и стратегии» . Американское общество клинической онкологической образовательной книги. Американское общество клинической онкологии. Ежегодное собрание . 35 (36). Американское общество клинической онкологии: 185–198. doi : 10.1200/edbk_156686 . PMC 5495113 . PMID 27249699 .
- ^ Weiss SC, Rowell R, Krochmal L (2008). «Влияние сезонности на проведение клинических исследований в дерматологии». Клиники в дерматологии . 26 (5): 565–9. doi : 10.1016/j.clindermatol.2008.01.016 . PMID 18755376 .
- ^ Хан Й. Тилли С. , Pharm-Olam International. Архивировано из оригинала (PDF) 15 июля 2011 года . Получено 26 апреля 2010 года .
- ^ Маршалл, Меган (19 декабря 2019 г.). «Реализация QBD в вашем клиническом испытании? 4 вопроса, чтобы ответить первым» . Клинический лидер . Пенсильвания: вертмаркеты. Архивировано из оригинала 27 января 2020 года . Получено 26 января 2020 года .
- ^ Yang, ZJ, et al. (2010). «Мотивация для поиска и обработки информации о медицинской информации о регистрации клинических испытаний». Связь здравоохранения 25 (5): 423–436.
- ^ «Биография для использования VIS Analytics для оптимизации педиатрических клинических исследований - wsj.com» . Online.wsj.com. 7 мая 2013 года. Архивировано с оригинала 4 февраля 2014 года . Получено 14 ноября 2013 года .
- ^ Группа стратегии наук о жизни, «Использование технологий клинических испытаний, предпочтения закупок и перспективы роста», май 2009 г., май 2009 г.
- ^ «Электронный пациент сообщил о результатах (EPRO) - изменение лица клинических испытаний» . Med-quest.org . Архивировано из оригинала 21 мая 2015 года . Получено 20 мая 2015 года .
- ^ Подпрыгнуть до: а беременный Эванс, Скотт Р. (2010). «Общие статистические проблемы в клинических испытаниях» . Журнал экспериментального инсульта и трансляционной медицины . 3 (1): 1–7. doi : 10.6030/1939-067x-3,1,1 (неактивный 17 марта 2024 г.). ISSN 1939-067X . PMC 3059317 . PMID 21423790 .
{{cite journal}}: CS1 Maint: doi неактивен с марта 2024 года ( ссылка ) - ^ Подпрыгнуть до: а беременный Эванс -младший, Ch; Ildstad, St, Eds. (2001). «Статистические подходы к анализу небольших клинических испытаний». Небольшие клинические испытания и проблемы и проблемы; В кн.: Статистические подходы к анализу небольших клинических испытаний . Национальная академическая пресса (США). Архивировано из оригинала 15 апреля 2023 года . Получено 7 ноября 2022 года .
- ^ Гордон, EJ; Prohaska, TR (2006). «Этика вывода от участия в исследовании» . Подотчетность в исследованиях . 13 (4): 285–309. doi : 10.1080/08989620600848645 . PMC 9527709 . PMID 17849641 .
- ^ «Законопроект № 2328 Ассамблеи» (PDF) . Архивировано из оригинала (PDF) 2 декабря 2007 года . Получено 19 ноября 2007 года .
- ^ Хайден Е.К. (ноябрь 2014 г.). «Этическая дилемма для испытаний на наркотики Эбола» . Природа . 515 (7526): 177–8. Bibcode : 2014natur.515..177c . doi : 10.1038/515177a . PMID 25391940 .
- ^ Паттинсон, Шон Д. (2012). «Аварийные исследования и интересы участников» (PDF) . Медицинское право интернациональное . 12 (2): 121–141. doi : 10.1177/0968533212465615 . S2CID 71853867 . Архивировано (PDF) из оригинала 9 апреля 2023 года . Получено 13 июля 2019 года .
- ^ SPAN, Паула (3 марта 2020 г.). «Когда исследование наркотиков внезапно заканчивается, добровольцам остается справляться» . New York Times . ISSN 0362-4331 . Архивировано из оригинала 7 апреля 2023 года . Получено 23 апреля 2020 года .
- ^ Мойнихан Р. (2003). «Кто платит за пиццу? Переопределение отношений между врачами и фармацевтическими компаниями. 2: распущенность» . Британский медицинский журнал . 326 (7400): 1193–1196. doi : 10.1136/bmj.326.7400.1193 . PMC 1126054 . PMID 12775622 .
- ^ «Обновление Hogan & Hartson по регистрации фармацевтических испытаний» (PDF) . 3 марта 2008 года. Архивировано из оригинала (PDF) 25 июня 2008 года . Получено 2 июня 2008 года .
- ^ «Восстание в научных журналах, которые вызывает призывы к реформе» . New York Times . 16 апреля 2012 года. Архивировано с оригинала 18 июня 2018 года . Получено 22 мая 2018 года .
- ^ Вулли К.Л., Лью Р.А., Стреттон С., Эли Дж.А., Брамич Н.Дж., Кейс Дж.Р., Монк Дж.А., Вулли М.Дж. (июнь 2011 г.). «Отсутствие участия медицинских писателей и фармацевтической промышленности в публикациях отозвано для проступка: систематическое контролируемое, ретроспективное исследование». Текущие медицинские исследования и мнение . 27 (6): 1175–82. doi : 10.1185/03007995.2011.573546 . PMID 21473670 . S2CID 2583905 .
- ^ Sox HC, Rennie D (август 2008 г.). «Испытания по посевам: просто скажите" нет " . Анналы внутренней медицины . 149 (4): 279–80. doi : 10.7326/0003-4819-149-4-200808190-00012 . PMID 18711161 .
- ^ «Процесс разработки и одобрения (лекарства)» . Управление по контролю за продуктами и лекарствами США. Архивировано с оригинала 10 июня 2018 года . Получено 22 мая 2018 года .
- ^ «Руководство по информационным листам для IRB, клинических исследователей и спонсоров: проверки FDA клинических исследователей» (PDF) . Управление по контролю за продуктами и лекарствами . Июнь 2010. Архивировал (PDF) из оригинала 11 июня 2014 года . Получено 16 октября 2014 года .
- ^ Davidoff F, Deangelis CD, Drazen JM, Nicholls MG, Hoey J, Højgaard L, Horton R, Kotzin S, Nylenna M, Overbeke AJ, Sox HC, Van Der Weyden MB, Wilkes MS (сентябрь 2001 г.). «Спонсорство, авторство и ответственность» . CMAJ . 165 (6): 786–8. PMC 81460 . PMID 11584570 . Архивировано из оригинала 15 апреля 2023 года . Получено 27 февраля 2011 года .
- ^ Манси, Бернадетт А.; Кларк, Юли; Дэвид, Фрэнк С.; Gesell, Thomas M.; Глассер, Сьюзен; Гонсалес, Джон; Халлер, Даниэль Г.; Лейн, Кристина; Миллер, Чарльз Л.; Муни, Лаверн А.; Zecevic, Maja (май 2012 г.). «Десять рекомендаций по сокращению разрыва в доверительстве в спонсируемых отраслью клинических исследований: совместный журнал и перспектива фармацевтической промышленности» . Майо -клиника . 87 (5): 424–429. doi : 10.1016/j.mayocp.2012.02.009 . ISSN 1942-5546 . PMC 3538468 . PMID 22560521 .
- ^ Тохен, Маурисио (сентябрь 2013 г.). «Доверие к клиническим испытаниям, финансируемым в отрасли» . Международный журнал нейропсихофармакологии . 16 (8): 1879–1884. doi : 10.1017/s1461145713000461 . ISSN 1469-5111 . PMID 23672957 .
- ^ Тохен, Маурисио (1 февраля 2017 г.). К " Полем 20 (2): 95–97. doi : 10.1093/ijnp/pyx . ISSN 1469-5111 . PMC 5356994 . PMID 28927197 .
- ^ Tohen, Mauricio (2018). «Тяжесть симптомов в маниаклинических руководящих принципах и последствий проектирования исследования» . Биполярные расстройства . 20 (2): 171–172. doi : 10.1111/bdi.12598 . ISSN 1399-5618 . PMID 29327798 . Архивировано из оригинала 8 апреля 2023 года . Получено 27 мая 2021 года .
- ^ Tohen, Mauricio (2013). «Доверие к клиническим испытаниям, финансируемым в отрасли» . Международный журнал нейропсихофармакологии . 16 (8): 1879–1884. doi : 10.1017/s1461145713000461 . ISSN 1469-5111 . PMID 23672957 .
- ^ Подпрыгнуть до: а беременный Эдвардс, Кэтрин М.; Коххар, Сонали (2020). «Этика проведения клинических исследований в условиях вспышки» . Ежегодный обзор вирусологии . 7 (1): 475–494. doi : 10.1146/annurev-virology-013120-013123 . PMID 32212920 .
- ^ «Руководящие принципы Ninds по мониторингу в клинических испытаниях | Национальный институт неврологических расстройств и инсульта» . ninds.nih.gov . Архивировано из оригинала 9 января 2020 года . Получено 25 ноября 2019 года .
- ^ «Руководство по обучению совета по мониторингу данных и безопасности для исследований, инициированных исследователями-Tufts CTSI» . tuftsctsi.wpengine.com . 15 мая 2018 года. Архивировано с оригинала 7 апреля 2023 года . Получено 25 ноября 2019 года .
- ^ Проектирование и проведение клинических испытаний - обзор . Международный журнал статистики и медицинской информатики. 2019. ISBN 9781096489085 .
- ^ «Для пациентов: информированное согласие на клинические испытания» . Управление по контролю за продуктами и лекарствами США. 25 февраля 2016 года. Архивировано с оригинала 22 июля 2017 года . Получено 9 августа 2017 года .
- ^ Руководство по промышленности: раскрытие финансовой информации клиническими следователями , Управление по контролю за продуктами и лекарствами , 20 марта 2001 года, архивировано из оригинала 11 мая 2009 года , извлеченные 16 декабря 2019 года.
- ^ Ланг Т., Сирибаддана С. (2012). «Клинические испытания прошли глобальный: это хорошо?» Полем PLOS Medicine . 9 (6): E1001228. doi : 10.1371/journal.pmed.1001228 . PMC 3373653 . PMID 22719228 .
- ^ «Индия: основное место для неэтичных клинических испытаний» . Общие сны . Архивировано из оригинала 15 декабря 2007 года . Получено 16 декабря 2007 года .
- ^ фармацевтическое медицинское устройство Общая организация» PDF . «PMDA.GO.JP Независимое ) (
- ^ «Официальный веб -сайт ICH: ICH» . www.ich.org . Архивировано из оригинала 30 июня 2007 года.
- ^ «Управление информацией о безопасности из клинических испытаний: отчет о рабочей группе CIOMS VI» . Публикации CIOMS . 2005. Архивировано из оригинала 15 августа 2019 года . Получено 11 ноября 2017 года .
- ^ «Применение нового препарата (IND) - Окончательное правило: Новые требования к отчетности по безопасности лекарств для расследования для лекарств и биологических продуктов для человека и требований к отчетности о безопасности для биодоступности и биоэквивалентности у людей» . fda.gov . Центр оценки лекарств и исследований. 29 сентября 2010 года. Архивировано с оригинала 23 апреля 2019 года . Получено 11 ноября 2017 года .
- ^ «Руководство для требований отчетности по безопасности промышленности и следователей для Inds и BA/BE BE BE . Управление по контролю за продуктами и лекарствами =. Декабрь 2012 года. Архивировал (PDF) из оригинала 16 января 2019 года . Получено 11 ноября 2017 года .
- ^ «Оценка безопасности для Руководства по отчетности по безопасности IND для промышленности» (PDF) . Управление по контролю за продуктами и лекарствами. Декабрь 2015 года. Архивировал (PDF) из оригинала 4 мая 2017 года . Получено 11 ноября 2017 года .
- ^ «Синтез доказательств и метаанализ: отчет о рабочей группе CIOM X» . Публикации CIOMS. 2016. Архивировано с оригинала 15 августа 2019 года . Получено 11 ноября 2017 года .
- ^ Серткая, Айлин; Вонг, Хуи-Хсинг; Джессап, Эмбер; Белече, Тринидад (2016). «Ключевые драйверы фармацевтических клинических испытаний в Соединенных Штатах» . Клинические испытания . 13 (2): 117–126. doi : 10.1177/1740774515625964 . PMID 26908540 . S2CID 24308679 .
- ^ «Налоговый кредит на тестирование расходов на лекарства при редких заболеваниях или условиях» . Управление по контролю за продуктами и лекарствами . 17 апреля 2001 года. Архивировано из оригинала 6 апреля 2007 года . Получено 27 марта 2007 года .
- ^ Пол Дж, Сейб Р., Прескотт Т (март 2005 г.). «Интернет и клинические испытания: предыстория, онлайн -ресурсы, примеры и проблемы» . Журнал медицинского интернета . 7 (1): E5. doi : 10.2196/jmir.7.1.e5 . PMC 1550630 . PMID 15829477 .
- ^ Станкель, Линн; Грэди, Кристина (май 2011 г.). «Больше, чем деньги: обзор литературы, исследующей мотивы здоровых добровольцев» . Современные клинические испытания . 32 (3): 342–352. doi : 10.1016/j.cct.2010.12.003 . PMC 4943215 . PMID 21146635 .
- ^ Лю Дж.Дж., Дэвидсон Э., шейх А. (2011). «Достижение этнического разнообразия при наборе судебного разбирательства» . Pharm Med . 25 (4): 215–222. doi : 10.1007/bf03256863 . S2CID 19557355 . Архивировано из оригинала 14 ноября 2011 года.
- ^ Макдональд А.М., Найт Р.К., Кэмпбелл М.К., Энтвистл В.А., Грант А.М., Кук Дж., Элборн Д.Р., Фрэнсис Д., Гарсия Дж., Робертс I, Сноудон С (апрель 2006 г.). «Какое влияние влияет на найд на рандомизированные контролируемые испытания? Обзор испытаний, финансируемых двумя британскими финансирующими агентствами» . Испытания . 7 : 9. doi : 10.1186/1745-6215-7-9 . PMC 1475627 . PMID 16603070 .
- ^ «Волонтерство для клинического испытания» . Бостон, Массачусетс: Центр. 2016. Архивировано с оригинала 25 ноября 2016 года . Получено 26 ноября 2016 года .
- ^ «Разнообразие и включение в клинические испытания» . Nimhd . Архивировано с оригинала 18 марта 2023 года . Получено 9 декабря 2022 года .
- ^ Конкель, Линдси (2015). «Расовые и этнические различия в научных исследованиях: задача создания более разнообразных когорт» . Перспективы здоровья окружающей среды . 123 (12): A297 - A302. doi : 10.1289/ehp.123-A297 . ISSN 0091-6765 . PMC 4670264 . PMID 26625444 .
- ^ «Почти половина чернокожих пациентов с метастатическим раком молочной железы не сообщается о клинических испытаниях» . 6 августа 2022 года. Архивировано с оригинала 7 апреля 2023 года . Получено 7 апреля 2023 года .
- ^ Питтман, Коринн А.; Рура, Рауль; Прайс, Кэрри; Лин, Фрэнк Р.; Маррон, Николь; Ниман, Кэрри Л. (1 июля 2021 г.). «Расовые/этнические и половые представления в клинических испытаниях по утрате слуха у взрослых в США: систематический обзор» . Jama Otolaryngology - Head & Head Hurgery . 147 (7): 656–662. doi : 10.1001/jamaoto.2021.0550 . ISSN 2168-6181 . PMID 33885733 . S2CID 233351877 .
- ^ «Как остановить отсутствие разнообразия, подрывающего данные клинических испытаний» . Финансовые времена . 18 января 2019 года. Архивировано с оригинала 10 декабря 2022 года . Получено 26 февраля 2019 года .
- ^ «Клинические испытания болезни Паркинсона» . Fox Trial Finder . Получено 14 ноября 2013 года .
- ^ «Медицинская информация в Интернете» . Mlanet.org. Архивировано из оригинала 3 октября 2013 года . Получено 14 ноября 2013 года .
- ^ Кляйн, Гарри; Мазор, Тали; Зигель, Итан; Труханов, Павел; Оваль, Андреа; Веккио Фитц, Кэтрин Дель; Цвислер, Захари; Кумари, Прити; Ван дер Вин, Бернд; Марриотт, Эрик; Гансель, Джейсон; Ю, Джойс; Албайрак, Адем; Барри, Сьюзен; Келлер, Рэйчел Б.; MacConaill, Laura E.; Линдеман, Нил; Джонсон, Брюс Э.; Роллинс, Барретт Дж.; До, Хан Т.; Бердсли, Брайан; Шапиро, Джеффри; Гектор-Барри, Сюзанна; Метот, Джон; Шолл, Линетт; Линдсей, Джеймс; Хассетт, Майкл Дж.; Керами, Итан (6 октября 2022 г.). «Matchminer: платформа с открытым исходным кодом для прецизионной медицины рака» . NPJ точная онкология . 6 (1): 69. doi : 10.1038/s41698-022-00312-5 . ISSN 2397-768X . PMC 9537311 . PMID 36202909 .
- ^ Подпрыгнуть до: а беременный Ян З.Дж., МакМас К.А., Гей Г.К., Леонард Дж.П., Данненберг А.Дж., Диллон Х (2012). «Сравнение принятия решений между больными раком и населением в целом: мысли, эмоции или социальное влияние?». Журнал здравоохранения . 17 (4): 477–94. doi : 10.1080/10810730.2011.635774 . PMID 22376222 . S2CID 1344880 .
- ^ Подпрыгнуть до: а беременный «Что знать о программах соответствия клинических испытаний по раку» . Cancer.net . 14 марта 2023 года. Архивировано с оригинала 28 сентября 2023 года . Получено 26 декабря 2023 года .
- ^ Подпрыгнуть до: а беременный «Как искать клинические исследования» . Clinicaltrials.gov, Национальная библиотека медицины США. 2023. Архивировано с оригинала 26 декабря 2023 года . Получено 26 декабря 2023 года .
- ^ Fountzilas E, Tsimberidou AM, Vo HH, Kurzrock R (август 2022). «Конструкция клинических испытаний в эпоху точной медицины» . Медицина генома . 14 (1): 101. doi : 10.1186/s13073-022-01102-1 . PMC 9428375 . PMID 36045401 .
- ^ Fleury Me (2023). «Консенсусные рекомендации по улучшению рака клинических испытаний, соответствующих окружающей среде» . Рак . 130 (1): 11–15. doi : 10.1002/cncr.35034 . PMID 37851508 .
- ^ Петрини, Карло (15 декабря 2022 года). «Децентрализованные клинические испытания (DCT): несколько этических соображений» . Передний. Общественное здравоохранение . 10 doi : 10.3389/fpubh.2022.1081150 . PMC 9797802 . PMID 36590004 .
- ^ Ван Норман, Джорджия (27 апреля 2021 г.). «Децентрализованные клинические испытания» . JACC: Основная к трансляционной науке . 6 (4): 384–387. doi : 10.1016/j.jacbts.2021.01.011 . PMC 8093545 . PMID 33997523 .
Внешние ссылки
[ редактировать ]- Международная конференция по гармонизации технических требований для регистрации фармацевтических препаратов для использования человека , руководство по регулированию клинических испытаний
- Clinicaltrials.gov, всемирная база данных зарегистрированных клинических испытаний ; Национальная библиотека медицины США
- Кокрановский центральный реестр контролируемых испытаний (центральный) ; Концентрированный источник библиографических отчетов о рандомизированных контролируемых исследованиях
- Clinicaltrials.EU, Европейская информационная сеть клинических испытаний ; Клинические испытания легко понялись.