Клиническое испытание

Клинические испытания представляют собой проспективные биомедицинские или поведенческие исследования участников, предназначенных для ответа на конкретные вопросы о биомедицинских или поведенческих вмешательствах, включая новые методы лечения (такие как новые вакцины , лекарства , диетический выбор , пищевые добавки и медицинские приборы ) и известные вмешательства, которые требуют дальнейших. изучение и сравнение. Клинические испытания генерируют данные о дозировке, безопасности и эффективности. [ 1 ] [ 2 ] Они проводятся только после того, как они получили одобрение комитета по здравоохранению/этике в стране, где требуется одобрение терапии. Эти власти несут ответственность за проверку коэффициента риска/выгоды для испытания - их одобрение не означает, что терапия «безопасна» или эффективна, только в том, что исследование может быть проведено.
В зависимости от типа продукта и стадии разработки, исследователи первоначально регистрируют добровольцев или пациентов в небольшие пилотные исследования и впоследствии проводят постепенно более масштабные сравнительные исследования. Клинические испытания могут варьироваться по размеру и стоимости, и они могут включать в себя один исследовательский центр или несколько центров , в одной стране или в нескольких странах. Конструкция клинических исследований направлена на то, чтобы обеспечить научную обоснованность и воспроизводимость результатов.
Расходы на клинические испытания могут варьироваться до миллиардов долларов на одобренное лекарство, [ 3 ] и полный процесс судебного разбирательства для утверждения может потребоваться 7–15 лет. [ 4 ] [ 5 ] Спонсор может быть государственной организацией или фармацевтической , биотехнологической или медицинской компанией. Некоторые функции, необходимые для испытания, такие как мониторинг и лабораторная работа, могут выполняться аутсорсинговым партнером, таким как организация по исследованию контрактов или центральная лаборатория. Только 10 процентов всех лекарств, начатых в клинических испытаниях человека, становятся одобренными препаратами . [ 6 ]
Обзор
[ редактировать ]Испытания наркотиков
[ редактировать ]В некоторых клинических испытаниях участвуют здоровые субъекты без ранее существовавших заболеваний . Другие клинические испытания относятся к людям с определенными состояниями здоровья, которые готовы попробовать экспериментальное лечение. Пилотные эксперименты проводятся, чтобы получить представление о разработке клинического испытания, чтобы следовать. [ Цитация необходима ]
Есть две цели в тестировании медицинских методов лечения: узнать, работают ли они достаточно хорошо, называемые «эффективностью» или «эффективностью»; и узнать, достаточно ли они в безопасности, называемые «безопасностью». [ 1 ] Также не является абсолютным критерием; Как безопасность, так и эффективность оцениваются по сравнению с тем, как предназначено для использования лечения, какие другие методы лечения доступны, и тяжесть заболевания или состояния. Преимущества должны перевесить риски. [ 7 ] [ 8 ] : 8 Например, многие препараты для лечения рака имеют тяжелые побочные эффекты, которые не были бы приемлемы для безрецептурных обезболивающих препаратов, однако лекарства от рака были одобрены, поскольку они используются под уходом врача и используются для опасного для жизни состояние. [ 9 ]
В США пожилые люди составляют 14% населения, в то время как они потребляют более трети наркотиков. [ 10 ] Люди старше 55 лет (или аналогичный возраст) часто исключаются из испытаний, потому что их большие проблемы со здоровьем и употребление наркотиков усложняют интерпретацию данных, а также потому, что они обладают иной физиологической способностью, чем молодые люди. Дети и люди с не связанными заболеваниями также часто исключаются. [ 11 ] Беременные женщины часто исключаются из -за потенциального риска для плода .
Спонсор разрабатывает исследование по координации с группой экспертных клинических исследователей, в том числе то, что альтернативное или существующее лечение для сравнения с новым препаратом и каким типом (-ами) пациентов может принести пользу. Если спонсор не может получить достаточно испытуемых в одном месте, исследователи в других местах набираются для присоединения к исследованию. [ Цитация необходима ]
В ходе исследования исследователи набирают субъектов с предопределенными характеристиками, вводятся в лечение (ы) и собирают данные о здоровье субъектов в течение определенного периода времени. Данные включают измерения, такие как жизненно важные признаки , концентрацию исследуемого препарата в крови или тканях, изменения в симптомах и возникают ли улучшение или ухудшение состояния, нацеленного на исследовательское препарат. Исследователи отправляют данные в испытательный спонсор, который затем анализирует объединенные данные, используя статистические тесты . [ Цитация необходима ]
Примеры целей клинического испытания включают оценку безопасности и относительной эффективности лекарства или устройства: [ Цитация необходима ]
- На конкретном типе пациента
- В различных дозировках
- Для нового указания
- Оценка повышения эффективности при лечении состояния по сравнению со стандартной терапией для этого состояния
- Оценка исследуемого препарата или устройства относительно двух или более уже утвержденных/общих вмешательств для этого условия
В то время как большинство клинических испытаний проверяют одну альтернативу новому вмешательству, некоторые расширяются до трех или четырех и могут включать плацебо . [ Цитация необходима ]
За исключением небольших испытаний в однокладе, конструкция и цели указаны в документе, который называется протокол клинических испытаний . Протокол является «Руководством по эксплуатации» испытания и гарантирует, что все исследователи выполняют испытание одинаково по аналогичным субъектам и что данные сравнимы по всем субъектам. [ Цитация необходима ]
Поскольку исследование предназначено для проверки гипотез и строгого контроля и оценки результатов, оно может рассматриваться как применение научного метода , в частности, экспериментальный этап. [ Цитация необходима ]
Наиболее распространенные клинические испытания оценивают новые фармацевтические продукты, медицинские устройства, биологические данные , диагностические анализы , психологическую терапию или другие вмешательства. [ 12 ] Клинические испытания могут потребоваться перед национальным регулирующим органом [ 13 ] утверждает маркетинг инноваций.
Испытания устройств
[ редактировать ]Подобно лекарствам, производители медицинских устройств в Соединенных Штатах должны провести клинические испытания для одобрения премаркета . [ 14 ] Устройства могут сравнить новое устройство с установленной терапией или могут сравнить аналогичные устройства друг с другом. Примером первого в области сосудистой хирургии является восстановление открытых и эндоваскулярных (над испытанием) для лечения аневризмы брюшной аорты , которая сравнивала более старую технику восстановления аорты с новым устройством восстановления эндоваскулярной аневризмы . [ 15 ] Примером последних являются клинические испытания на механических устройствах, используемых при лечении недержания мочи взрослых . [ 16 ]
Испытания процедур
[ редактировать ]Подобно лекарствам, медицинские или хирургические процедуры могут быть подвергнуты клиническим испытаниям, [ 17 ] такие как сравнение различных хирургических подходов в лечении миомы для под поверхности . [ 18 ] Однако, когда клинические испытания неэтичные или логистически невозможны в хирургических условиях, исследования, контролируемые случаями . будут заменены [ 19 ]
Участие пациента и общественности
[ редактировать ]Помимо участников клинического испытания, представители общественности могут активно сотрудничать с исследователями в разработке и проведении клинических исследований . Это известно как участие пациента и общественности (PPI). Общественное участие включает в себя рабочее партнерство между пациентами, лицами, обеспечивающими уход, люди с живым опытом и исследователями, чтобы формировать и влиять на то, что является исследователем и как. [ 20 ] PPI может улучшить качество исследований и сделать его более актуальным и доступным. Люди с нынешним или прошлым опытом болезни могут обеспечить другую перспективу, чем профессионалы, и дополнять свои знания. Благодаря своим личным знаниям они могут определить темы исследований, которые являются актуальными и важными для тех, кто живет с болезнью или использованием услуги. Они также могут помочь сделать исследование более основанным на потребностях конкретных сообществ, в которых они участвуют. Государственные участники могут также обеспечить, чтобы исследование было представлено на простом языке , которое ясно для широкого общества и конкретных групп, для которых оно наиболее важно. [ 21 ]
История
[ редактировать ]Разработка
[ редактировать ]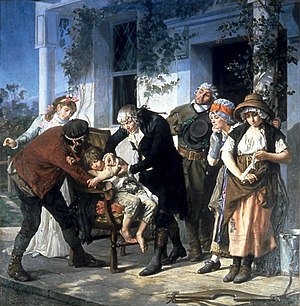
Хотя ранние медицинские эксперименты часто проводились, использование контрольной группы для обеспечения точного сравнения для демонстрации эффективности вмешательства, как правило, отсутствовало. Например, леди Мэри Уортли Монтегю , которая проводила кампанию за введение прививки (тогда называемой вариолиацией) для предотвращения оспы , организовала семи заключенных, которые были приговорены к смертной казни, чтобы подвергнуть вариолиации в обмен на их жизнь. Хотя они выжили и не сокращали оспу, не было контрольной группы, чтобы оценить, был ли этот результат из -за прививки или какого -либо другого фактора. Аналогичные эксперименты, проводимые Эдвардом Дженнером по его вакцине против оспы, были одинаково концептуально ошибочными. [ 22 ]
Первое правильное клиническое испытание было проведено шотландским врачом Джеймсом Линдом . [ 23 ] заболевания Скюшн , в настоящее время известный как вызванный дефицитом витамина С , часто оказывал ужасное влияние на благосостояние экипажа океанских путешествий на длинные дистанции. В 1740 году катастрофический результат привлек округа Ансона ; много внимания в Европе Из 1900 человек, 1400, умерли, большинство из них якобы от контракта с цингой. [ 24 ] Джон Вудолл , английский военный хирург Британской Ост -Индской компании , рекомендовал потребление цитрусовых (он обладает антискорбутическим эффектом) с 17 -го века, но их использование не стало широко распространенным. [ 25 ]
Линд провела первое систематическое клиническое испытание в 1747 году. [ 26 ] Он включил пищевую добавку кислого качества в эксперименте через два месяца в море, когда корабль уже был поражен цингой. Он разделил двенадцать Scorbutic Sailors на шесть групп из двух. Все они получали одну и ту же диету, но, кроме того, первая группа ежедневно получала литр цидра , группу второй двадцать пять капель эликсира витриола ( серная кислота ), группа три шесть ложки уксуса , четыре половина пинты морской воды Пятая группа получила два апельсина и один лимон , а последнюю группу - пряную пасту, а также напиток с ячменной водой . Обработка пятой группы прекратилась через шесть дней, когда у них кончился фрукты, но к тому времени один моряк подходил для службы, в то время как другой почти выздоровел. Кроме того, только первая группа также показала некоторое влияние на его лечение. [ 27 ] Каждый год 20 мая отмечается как День клинических испытаний в честь исследований Линда. [ 28 ]
После 1750 года дисциплина начала принимать свою современную форму. [ 29 ] [ 30 ] Английский доктор Джон Хейгарт продемонстрировал важность контрольной группы для правильной идентификации эффекта плацебо в своем знаменитом исследовании неэффективного лекарства, называемого тракторами Перкина . Дальнейшая работа в этом направлении была проведена выдающимся врачом сэром Уильямом Гуллом, 1 -м баронетом в 1860 -х годах. [ 22 ]
Фредерик Акбар Магомед (ум. 1884), который работал в больнице Гай в Лондоне , внес существенный вклад в процесс клинических испытаний, где «он отделял хронический нефрит с вторичной гипертонией от того, что мы сейчас наклоняем . Запись для Британской медицинской ассоциации ; [ 31 ]
Современные испытания
[ редактировать ]
Идеи сэра Рональда А. Фишера все еще играют роль в клинических испытаниях. Работая на экспериментальной станции Rothamsted в области сельского хозяйства, Фишер разработал свои принципы экспериментального дизайна в 1920 -х годах в качестве точной методологии надлежащего дизайна экспериментов. Среди его основных идей включают важность рандомизации - случайное назначение отдельных лиц различным группам для эксперимента; [ 32 ] Репликация - Чтобы уменьшить неопределенность , измерения должны быть повторены, а эксперименты реплицируются для идентификации источников вариации; [ 33 ] Блокировка - чтобы организовать экспериментальные единицы в группы единиц, которые похожи друг на друга, и, таким образом, уменьшая не относящиеся к делу источники вариации; Использование факторных экспериментов - эффективно оценивать эффекты и возможные взаимодействия нескольких независимых факторов. [ 22 ] Из них блокировка и факторный дизайн редко применяются в клинических испытаниях, потому что экспериментальные единицы являются человеческими субъектами, и обычно существует только одно независимое вмешательство: лечение. [ Цитация необходима ]
Британский совет по медицинским исследованиям официально признал важность клинических испытаний 1930 -х годов. Совет установил Комитет по терапевтическим испытаниям, чтобы консультировать и оказать помощь в организации надлежащих контролируемых клинических испытаний по новым продуктам, которые, вероятно, на экспериментальных соображениях имеют ценность при лечении заболевания. [ 22 ]
Первое рандомизированное лечебное исследование было проведено в исследовательском отделении MRC Tuberculosis сэром Джеффри Маршаллом (1887–1982). Исследование, проведенное между 1946 и 1947 годами, направлено на проверку эффективности химического стрептомицина для лечения туберкулеза легких . Испытание было как двойным, так и плацебо-контролировано . [ 34 ]
Методология клинических испытаний была дополнительно разработана сэром Остином Брэдфордом Хиллом , который участвовал в испытаниях стрептомицина. С 1920 -х годов Хилл применял статистику к медицине, посещая лекции известного математика Карла Пирсона , среди прочего. Он прославился знаковым исследованием, проведенным в сотрудничестве с Ричардом Доллом в отношении корреляции между курением и раком легких . Они провели исследование в отношении случайного контроля в 1950 году, в котором сравнивались пациенты с раком легких с соответствующим контролем, а также начали устойчивое долгосрочное проспективное исследование более широкой проблемы курения и здоровья, которое включало изучение привычек курения и здоровья более 30 000 Врачи в течение нескольких лет. Его сертификат о выборах Королевскому обществу назвал его «... лидер в области развития медицины точных экспериментальных методов, которые в настоящее время используются на национальном и международном уровне при оценке новых терапевтических и профилактических агентов ».
Международный день клинических испытаний отмечается 20 мая. [ 35 ]
Сокращения, используемые при названии клинических испытаний , часто придуманы и были предметом насмешки. [ 36 ]
Типы
[ редактировать ]Клинические испытания классифицируются по цели исследования, созданной исследователями. [ 12 ]
- В обсервационном исследовании исследователи наблюдают за субъектами и измеряют свои результаты. Исследователи не активно управляют исследованием. [ 37 ]
- В интервенционном исследовании исследователи предоставляют субъектам исследование экспериментальное препарат, хирургическую процедуру, использование медицинского устройства, диагностику или другое вмешательство для сравнения лечащихся субъектов, которые не получают лечения или стандартное лечение. Затем исследователи оценивают, как меняется здоровье субъектов. [ 37 ]
Испытания классифицируются по их цели. После того, как утверждение на человеческую исследование было предоставлено спонсору испытания, Управление по контролю за продуктами и лекарствами США (FDA) организует и контролирует результаты испытаний в соответствии с типом: [ 12 ]
- Профилактические испытания ищут способы предотвращения заболеваний у людей, у которых никогда не было заболевания или предотвратить возвращение заболевания. Эти подходы могут включать лекарства , витамины или другие микроэлементы , вакцины или изменения образа жизни .
- Скрининг испытаний тест на то, чтобы выявить определенные заболевания или состояния здоровья.
- Диагностические испытания проводятся, чтобы найти лучшие тесты или процедуры для диагностики конкретного заболевания или состояния.
- Испытания на лечение проверяют экспериментальные препараты, новые комбинации лекарств или новые подходы к хирургии или лучевой терапии .
- Качество жизненных испытаний (испытания поддержки) оценивают, как улучшить комфорт и качество ухода за людьми с хроническим заболеванием .
- Генетические испытания проводятся для оценки точности прогнозирования генетических нарушений, что делает человека более или менее вероятной развития заболевания.
- Эпидемиологические испытания имеют целью определить общие причины, модели или контроль заболеваний у большого числа людей.
- сострадательного использования Испытания или расширенные исследования доступа предоставляют частично протестированные, неутвержденные терапевтические средства для небольшого числа пациентов, у которых нет других реалистичных вариантов. Обычно это включает в себя заболевание, для которой не было одобрено эффективной терапии, или пациент, который уже провалил все стандартные методы лечения и чье здоровье слишком поставлено под угрозу, чтобы претендовать на участие в рандомизированных клинических испытаниях. [ 38 ] Обычно FDA и фармацевтической компании должно быть предоставлено как о утверждении, так и фармацевтической компании.
- Фиксированные испытания рассматривают существующие данные только во время проектирования испытания, не изменяют испытание после того, как они начинаются, и не оценивают результаты до тех пор, пока исследование не будет завершено.
- Адаптивные клинические испытания используют существующие данные для разработки испытания, а затем используют промежуточные результаты для изменения исследования по мере его прохождения. Модификации включают в себя дозировку, размер выборки, испытание препарата, критерии отбора пациентов и «коктейль». [ 39 ] Адаптивные испытания часто используют байесовский экспериментальный дизайн для оценки прогресса испытания. В некоторых случаях испытания стали постоянным процессом, который регулярно добавляет и снижает терапию и группы пациентов по мере получения дополнительной информации. [ 40 ] Цель состоит в том, чтобы быстрее идентифицировать препараты, которые имеют терапевтический эффект и нулевой на популяциях пациентов, для которых препарат подходит. [ 41 ] [ 42 ]
Клинические испытания проводятся обычно в четырех этапах, причем каждая фаза использует различное количество субъектов и имеет различную цель для создания фокуса на определение специфического эффекта. [ 12 ]
Фазы
[ редактировать ]Клинические испытания с участием новых лекарств обычно классифицируются на пять этапов. Каждая этап процесса одобрения лекарственного средства рассматривается как отдельное клиническое исследование. Процесс разработки лекарств обычно проходит через фазы I -IV в течение многих лет, часто участвуя в десятилетии или дольше. Если препарат успешно проходит через фазы I, II и III, он обычно одобрен Национальным органом регулирования для использования в общем населении. [ 12 ] Испытания фазы IV выполняются после того, как вновь утвержденный лекарство, диагностику или устройство продаются, что обеспечивает оценку рисков, выгод или наилучшего использования. [ 12 ]
Фаза Цель Примечания Фаза 0 Фармакодинамика и фармакокинетика у людей Испытания фазы 0 являются необязательными испытаниями первого человека. Единые субтерапевтические дозы исследуемого препарата или лечения предоставляются небольшому числу субъектов (обычно от 10 до 15) для сбора предварительных данных о фармакодинамике агента (что препарат делает с организмом) и фармакокинетике (что является телом с наркотиками. ) [ 43 ] Для испытательного препарата в исследовании документируется поглощение, распределение, метаболизация и клиренс (экскреция) препарата, а также взаимодействие препарата в организме, чтобы подтвердить, что они, по -видимому, являются такими же ожидаемыми. Фаза i Скрининг на безопасность Часто испытаны первым человеком. Тестирование в небольшой группе людей (обычно 20–80) для оценки безопасности, определения безопасных диапазонов дозировки и определения побочных эффектов . [ 12 ] Фаза II Установление предварительной эффективности препарата в «группе лечения» , как правило, против плацебо контрольной группы Фаза II-A специально предназначена для оценки требований к дозированию (сколько лекарств должно быть дано), [ 12 ] [ 44 ] В то время как исследование фазы II-B предназначено для определения эффективности (100–300 человек), [ 1 ] Оценка того, насколько хорошо работает препарат в предписанной дозе (ы), чтобы установить диапазон терапевтической дозы и контролировать возможные побочные эффекты. [ 44 ] Фаза III Окончательное подтверждение безопасности и эффективности Тестирование с большими группами людей (обычно 1000–3000) для подтверждения эффективности лекарств, оценить ее эффективность, контролировать побочные эффекты, сравнить его с обычно используемыми методами лечения и собирать информацию, которая позволит ее безопасно использовать. [ 12 ] Фаза IV Исследования безопасности во время продаж Исследования по почте маркетинга определяют риски, преимущества и оптимальное использование. Таким образом, они продолжаются во время жизни препарата активного медицинского использования. [ 12 ]
Пробный дизайн
[ редактировать ]Основное различие в практике, основанной на фактических данных, находится между обсервационными исследованиями и рандомизированными контролируемыми исследованиями . [ 45 ] Типы обсервационных исследований в эпидемиологии , таких как когортное исследование и исследование «случай-контроль» , предоставляют менее убедительные доказательства, чем рандомизированное контролируемое исследование. [ 45 ] В обсервационных исследованиях исследователи ретроспективно оценивают ассоциации между лечением, предоставленными участникам, и их состоянием здоровья, с потенциалом для значительных ошибок в проектировании и интерпретации. [ 46 ]
Рандомизированное контролируемое исследование может предоставить убедительные доказательства того, что исследовательское лечение оказывает влияние на здоровье человека. [ 45 ]
Некоторые фазы II и большинство исследований лекарств III фазы разработаны как рандомизированные, двойные слепые и плацебо -контролируемые. [ Цитация необходима ]
- Рандомизированный: каждый субъект исследования случайным образом назначается для получения либо лечения исследования, либо плацебо.
- Слепые: субъекты, участвующие в исследовании, не знают, какое исследование они получают. Если исследование двойное слепо, исследователи также не знают, какое лечение получает субъект. Это намерение состоит в том, чтобы не дать исследователям по -разному относиться к двум группам. Форма двойного слепого исследования под названием «двойной дьякь» позволяет дополнительную страховку от предвзятости. В таком исследовании всем пациентам дают как плацебо, так и активные дозы в переменные периоды.
- Плацебо-контролируется: использование плацебо (поддельное лечение) позволяет исследователям изолировать влияние лечения исследования от эффекта плацебо .
Клинические исследования, имеющие небольшое количество субъектов, могут быть «спонсируются» отдельными исследователями или небольшой группой исследователей, и предназначены для проверки простых вопросов или осуществимости для расширения исследования для более полного рандомизированного контролируемого исследования. [ 47 ]
Клинические исследования могут быть «спонсируются» (финансируются и организованы) академическими учреждениями, фармацевтическими компаниями, государственными организациями и даже частными группами. Испытания проводятся для новых лекарств, биотехнологий, диагностических анализов или медицинских устройств, чтобы определить их безопасность и эффективность до того, как они будут представлены для регулирующего рассмотрения, который определит одобрение рынка. [ Цитация необходима ]
Активные контрольные исследования
[ редактировать ]В тех случаях, когда предоставление плацебо человеку, страдающему от заболевания, может быть неэтичным, вместо этого могут проводиться испытания «активный компаратор» (также известный как «активный контроль»). [ 48 ] В испытаниях с активной контрольной группой субъектам получают либо экспериментальное лечение, либо ранее одобренное лечение с известной эффективностью. В других случаях спонсоры могут провести активное исследование компаратора для установления требования эффективности относительно активного компаратора вместо плацебо при маркировке . [ Цитация необходима ]
Мастер -протокол
[ редактировать ]Основной протокол включает в себя несколько веществ, которые могут иметь разные цели и включать скоординированные усилия по оценке одного или нескольких медицинских продуктов при одном или нескольких заболеваниях или условиях в рамках общей структуры исследования. Испытания, которые могут разработать основной протокол, включают исследование Umbrella (множество медицинских продуктов для одного заболевания), исследование платформы (несколько продуктов для одного заболевания, входящего и покинуть платформу) и исследование корзины (один медицинский продукт для множества заболеваний или подтипов заболеваний ) [ 49 ]
Генетическое тестирование позволяет исследователям группировать пациентов в соответствии с их генетическим профилем, доставлять лекарства на основе этого профиля с этой группой и сравнивать результаты. Многочисленные компании могут принять участие, каждая из которых приносит другой препарат. Первый такой подход нацелен на плоскоклеточный рак , который включает в себя различные генетические нарушения от пациента к пациенту. Amgen, Astrazeneca и Pfizer участвуют, в первый раз, когда они работали вместе в испытании поздней стадии. Пациенты, чьи геномные профили не совпадают с ни одного из испытательных препаратов, получают препарат, предназначенный для стимуляции иммунной системы для атаки рака. [ 50 ]
Протокол клинических испытаний
[ редактировать ]Протокол клинических испытаний - это документ, используемый для определения и управления испытанием. Это подготовлено панелью экспертов. Ожидается, что все исследователи будут строго соблюдать протокол. [ Цитация необходима ]
Протокол описывает научное обоснование, объективные (ы), дизайн, методология, статистические соображения и организацию запланированного испытания. Подробная информация о испытании приведена в документах, упомянутых в протоколе, таких как брошюра следователя . [ Цитация необходима ]
Протокол содержит точный план обучения, обеспечивающий безопасность и здоровье субъектов и предоставление точного шаблона для проведения испытаний следователями. Это позволяет комбинировать данные для всех исследователей/сайтов. Протокол также информирует администраторов исследования (часто организация по исследованию контрактов ). [ Цитация необходима ]
Формат и содержание протоколов клинических испытаний, спонсируемых фармацевтическими, биотехнологическими или медицинскими компаниями в Соединенных Штатах, Европейском Союзе или Японии, были стандартизированы для следования хорошей клинической практике [ 51 ] выпущена Международной конференцией по гармонизации (ICH). [ 52 ] Регулирующие органы в Канаде , Китае , Южной Корее и Великобритании также следуют руководящим принципам ICH. Журналы, такие как испытания , поощряют следователей публиковать свои протоколы.
Дизайн функции
[ редактировать ]Информированное согласие
[ редактировать ]
Клинические испытания набирают изучение субъектов, чтобы подписать документ, представляющий их « информированное согласие ». [ 53 ] Документ включает в себя такие детали, как его цель, продолжительность, необходимые процедуры, риски, потенциальные выгоды, ключевые контакты и институциональные требования. [ 54 ] Затем участник решает, подписать ли документ. Документ не является контрактом, так как участник может в любое время выйти без штрафа. [ Цитация необходима ]
Информированное согласие - это юридический процесс, в котором рекрутируется рекрутом о ключевых фактах, прежде чем решить, следует ли участвовать. [ 53 ] Исследователи объясняют детали исследования в терминах, которые может понять предмет. Информация представлена на родном языке субъекта. Как правило, дети не могут автономно предоставить информированное согласие, но в зависимости от их возраста и других факторов могут потребоваться информированное согласие. [ Цитация необходима ]
Статистическая сила
[ редактировать ]В любом клиническом испытании число субъектов, также называемых размером выборки, оказывает большое влияние на способность надежно обнаруживать и измерять влияние вмешательства. Эта способность описывается как « власть », которая должна быть рассчитана перед началом исследования, чтобы выяснить, стоит ли исследование его затрат. [ 55 ] В целом, больший размер выборки увеличивает статистическую мощность, а также стоимость.
Статистическая мощность оценивает способность испытания обнаруживать разницу определенного размера (или большего) между группами лечения и контрольной. Например, исследование липидного лекарственного средства по сравнению с плацебо с 100 пациентами в каждой группе может иметь мощность 0,90 для обнаружения разницы между плацебо и испытательными группами, получающими дозировку 10 мг/дл или более, но только 0,70 для обнаружения Разница 6 мг/дл. [ Цитация необходима ]
Группы плацебо
[ редактировать ]Простое проведение лечения может иметь неспецифические эффекты. Они контролируются включением пациентов, которые получают только плацебо. Субъектам назначается случайным образом, не информируя их, которой они принадлежали. Многие испытания удвоены слепы, так что исследователи не знают, какой субъект группы A назначается.
Назначение субъекта группе плацебо может создать этическую проблему, если она нарушает его или ее право на получение наилучшего доступного лечения. Декларация Хельсинки предоставляет руководящие принципы по этому вопросу.
Продолжительность
[ редактировать ]
Клинические испытания являются лишь небольшой частью исследования, которое идет по разработке нового лечения. Потенциальные лекарства, например, сначала должны быть обнаружены, очищены, охарактеризованы и протестированы в лабораториях (в исследованиях клеток и на животных) в начале прохождения клинических испытаний. В целом, около 1000 потенциальных препаратов протестируются, прежде чем только один достигнет точки проверки в клиническом испытании. [ 56 ] Например, в среднем новое лекарство от рака в среднем за шесть лет исследований, прежде чем он даже попадет в клинические испытания. Но основным привлечением новых лекарств от рака является время, необходимое для самостоятельного завершения клинических испытаний. В среднем около восьми лет проходит с того момента, как раковое препарат попадает в клинические испытания, пока он не получит одобрение от регулирующих органов для продажи общественности. [ 57 ] Препараты для других заболеваний имеют сходные сроки.
Некоторые причины, по которым клиническое исследование может продлиться несколько лет:
- Для хронических состояний, таких как рак, требуются месяцы, если не годы, чтобы увидеть, влияет ли лечение рака на пациента.
- Для лекарств, которые не ожидают, окажут сильный эффект (то есть большое количество пациентов должно быть набирается, чтобы наблюдать «любое» эффект), привлечение достаточно пациентов, чтобы проверить эффективность препарата (то есть получение статистической власти), может занять несколько лет.
- Только некоторые люди, которые имеют целевое заболевание, имеют право участвовать в каждом клиническом исследовании. Исследователи, которые лечат этих конкретных пациентов, должны участвовать в исследовании. Затем они должны идентифицировать желательных пациентов и получить согласие от них или их семей, чтобы принять участие в исследовании.
Клиническое испытание также может включать в себя продленный период наблюдения после учебы от месяцев до многих лет для людей, которые участвовали в исследовании, так называемое «фаза расширения», которая направлена на выявление долгосрочного воздействия лечения. [ 58 ]
Самым большим барьером для завершения исследований является нехватка людей, которые принимают участие. Все наркотики и многие исследования устройства нацелены на подмножество населения, что означает, что не каждый может участвовать. Некоторые исследования лекарств требуют, чтобы у пациентов были необычные комбинации характеристик заболевания. Основлено найти подходящих пациентов и получить их согласие, особенно когда они не могут получить прямую выгоду (поскольку они не оплачиваются, препарат для исследования еще не доказывается, или пациент может получить плацебо). В случае больных раком, менее 5% взрослых с раком будут участвовать в исследованиях лекарств. Согласно фармацевтическим исследованиям и производителям Америки (PHRMA), в 2005 году в клинических испытаниях было испытано около 400 раковых лекарств. Участники так низки. [ 59 ]
Для клинических испытаний, связанных с потенциалом сезонных влияний (таких как аллергия на воздушную дорогу , сезонное аффективное расстройство , грипп и кожные заболевания ), исследование может быть проведено в течение ограниченной части года (например, весна для аллергии на пыльцу), когда препарат может быть проверенным. [ 60 ] [ 61 ]
Клинические испытания, которые не связаны с новым препаратом, обычно имеют гораздо более короткую продолжительность. (Исключениями являются эпидемиологические исследования, такие как исследование здоровья медсестер ).
Администрация
[ редактировать ]Клинические испытания, разработанные местным исследователем, и (в США), финансируемые федерально, практически всегда управляются исследователем, который разработал исследование и подал заявку на грант. Спонсорская компания может управлять мелкомасштабными исследованиями. Клинические испытания новых лекарств обычно проводится в организации по контракту (CRO), нанятой спонсором. Спонсор обеспечивает надзор за наркотиками и медицинским обслуживанием. CRO заключен контракт на выполнение всей административной работы над клиническим испытанием. Для этапов II - IV рекрутов CRO, участвующих исследователей, обучает их, предоставляет им поставки, координирует администрацию исследования и сбор данных , устанавливает встречи, контролирует сайты для соответствия клиническому протоколу и обеспечивает получение спонсора с каждого сайта. Специализированные организации по управлению сайтами также могут быть наняты для координации с CRO, чтобы обеспечить быстрое одобрение IRB/IEC и более быстрое посвящение и набор пациентов. Фаза I Клинические испытания новых лекарств часто проводятся в специализированной клинической клинике клинических испытаний с специальными фармакологами, где субъекты могут наблюдаться штатным персоналом. Этими клиниками часто управляется CRO, который специализируется на этих исследованиях.
На участвующем сайте один или несколько научных сотрудников (часто медсестры) выполняют большую часть работы по проведению клинического испытания. Работа ассистента-исследователь может включать некоторые или все из следующих: предоставление местной институциональной контрольной комиссии (IRB) с документацией, необходимой для получения разрешения на проведение исследования, помощь в запуске исследования, выявление подходящих пациентов, получение согласия от них или их семьи, управляя учебным лечением, сбором и статистическим анализом данных, поддержания и обновления файлов данных во время наблюдения и общения с IRB, а также спонсора и CRO.
Качество
[ редактировать ]В контексте клинического испытания качество обычно относится к отсутствию ошибок, которые могут влиять на принятие решений, как во время проведения испытания, так и при использовании результатов испытания. [ 62 ]
Маркетинг
[ редактировать ]Модель взаимодействия справедливости может быть использована для проверки последствий готовности поговорить с врачом о зачислении в клинические испытания. [ 63 ] Результаты показали, что потенциальные кандидаты в клинические испытания с меньшей вероятностью будут зачисляться в клинические испытания, если пациент более готов поговорить со своим врачом. Причиной этого открытия может быть пациенты довольны своей текущей заботой. Другая причина негативной связи между воспринимаемой справедливостью и зачислением в клинические испытания - отсутствие независимости от поставщика медицинской помощи. Результаты обнаружили, что существует положительная связь между отсутствием готовности поговорить со своим врачом и клиническим испытанием. Отсутствие готовности говорить о клинических испытаниях с текущими поставщиками медицинской помощи может быть связана с независимостью пациентов от врача. Пациенты, которые с меньшей вероятностью будут говорить о клинических испытаниях, более склонны использовать другие источники информации, чтобы получить лучшее представление об альтернативных методах лечения. Зачисление в клинические испытания должна быть мотивирована использовать веб -сайты и телевизионную рекламу, чтобы информировать общественность о зачислении в клинические испытания.
Информационные технологии
[ редактировать ]В последнем десятилетии было распространено распространение информационных технологий при планировании и проведении клинических испытаний. Системы управления клиническими испытаниями часто используются спонсорами исследований или CRO, чтобы помочь планировать и управлять эксплуатационными аспектами клинического испытания, особенно в отношении мест исследований. Расширенная аналитика для выявления исследователей и исследовательских площадок с опытом в данной области использует государственную и частную информацию о текущих исследованиях. [ 64 ] Веб- электронные сбора данных (EDC) и системы управления клиническими данными используются в большинстве клинических испытаний [ 65 ] Чтобы собрать данные отчета о случаях с сайтов, управлять его качеством и подготовить их к анализу. Интерактивные системы голосового ответа используются сайтами для регистрации зачисления пациентов, использующих телефон, и для распределения пациентов с конкретным подразделением лечения (хотя телефоны все чаще заменяются инструментами на основе веб-сайтов (IWRS), которые иногда являются частью системы EDC) Полем В то время как результат, о котором сообщают пациенту, часто основывались на бумаге в прошлом, измерения все чаще собираются с использованием веб-порталов или ручных устройств EPRO (или Ediary), иногда беспроводных. [ 66 ] Статистическое программное обеспечение используется для анализа собранных данных и подготовки их к регулирующему представлению. Доступ ко многим из этих приложений все чаще агрегируется в веб- порталах клинических испытаний . В 2011 году FDA одобрило исследование I фазы, в котором использовалось телесоноторинг, также известный как удаленный мониторинг пациентов, для сбора биометрических данных в домах пациентов и передачи его в электронном виде в испытательную базу данных. Эта технология предоставляет гораздо больше точек данных и гораздо более удобна для пациентов, потому что у них меньше посещений участков испытаний. Как отмечалось ниже, децентрализованные клинические испытания - это те, которые не требуют физического присутствия пациентов на сайте, и вместо этого в основном полагаются на сборы цифровых данных здоровья, цифровые информированные процессы согласия и так далее.
Анализ
[ редактировать ]Клиническое исследование дает данные, которые могут выявить количественные различия между двумя или более вмешательств; Статистический анализ используется для определения того, являются ли такие различия истинными, результатами случайно или являются такими же, как нет обработки (плацебо). [ 67 ] [ 68 ] Данные клинических испытаний постепенно накапливаются в течение продолжительности испытаний, простирающиеся от месяцев до лет. [ 53 ] Соответственно, результаты для участников, набираемых в начале исследования, стали доступны для анализа, в то время как субъекты все еще назначаются для групп лечения в испытании. Ранний анализ может позволить новым данным оказать решения о том, остановить ли исследование или переназначить участников в более успешный сегмент испытания. [ 67 ] Исследователи также могут захотеть остановить испытание, когда анализ данных не показывает эффект лечения. [ 68 ]
Этические аспекты
[ редактировать ]Клинические испытания тесно контролируются соответствующими регулирующими органами. Все исследования, включающие медицинское или терапевтическое вмешательство на пациентов, должны быть одобрены Комитетом по надзору за этикой, прежде чем разрешение будет предоставлено на проведение судебного разбирательства. Местный комитет по этике имеет усмотрение в отношении того, как он будет контролировать невмешательные исследования (обсервационные исследования или те, которые используют уже собранные данные). В США этот орган называется Институциональным контрольным советом (IRB); В ЕС их называют комитетами по этике . Большинство IRB расположены в больнице или учреждении местного следователя, но некоторые спонсоры позволяют использовать центральный (независимый/для получения прибыли) для следователей, которые работают в небольших учреждениях.
Чтобы быть этическим, исследователи должны получить полное и информированное согласие участвующих людей. (Одна из основных функций IRB - обеспечить, чтобы потенциальные пациенты были адекватно информированы о клиническом испытании.) Если пациент не может дать согласие на себя, исследователи могут обратиться за согласием от юридически уполномоченного представителя пациента. Кроме того, участники клинического испытания должны быть осведомлены о том, что они могут выйти из клинического испытания в любое время без каких -либо неблагоприятных действий против них. [ 69 ] В Калифорнии штат расставил приоритеты лиц, которые могут служить юридически уполномоченным представителем. [ 70 ]
В некоторых местах в США местный IRB должен сертифицировать исследователей и их сотрудников, прежде чем они смогут провести клинические испытания. Они должны понимать закон о конфиденциальности пациентов ( HIPAA ) и хорошую клиническую практику. Международная конференция по гармонизации для хорошей клинической практики представляет собой набор стандартов, используемых на международном уровне для проведения клинических испытаний. Руководящие принципы направлены на то, чтобы обеспечить защиту «права, безопасность и благополучие предметов».
Понятие информированного согласия участвующих людей существует во многих странах, но его точное определение все еще может различаться.
Информированное согласие, очевидно, является «необходимым» условием этического поведения, но не «обеспечивает« этическое поведение ». В испытаниях сострадательного использования последнее становится особенно сложной проблемой. Окончательная цель состоит в том, чтобы обслуживать сообщество пациентов или будущих пациентов наиболее эффективным и наиболее ответственным образом. Смотрите также расширенный доступ . Однако может быть трудно превратить эту цель в четко определенную, количественную, объективную функцию. Однако в некоторых случаях это можно сделать, например, для вопросов о том, когда остановить последовательные методы лечения (см. Алгоритм шансов ), а затем количественные методы могут играть важную роль.
Дополнительные этические проблемы присутствуют при проведении клинических испытаний по детям ( педиатрии ) и в чрезвычайных или эпидемических ситуациях. [ 71 ] [ 72 ]
Этическое уравновешивание прав многочисленных заинтересованных сторон может быть трудным. Например, когда испытания на наркотики терпят неудачу, спонсоры могут немедленно сообщить нынешним и потенциальным инвесторам, что означает, что как исследовательский персонал, так и зарегистрированные участники могут сначала услышать о окончании судебного разбирательства через общественные деловые новости . [ 73 ]
Конфликты интересов и неблагоприятных исследований
[ редактировать ]В ответ на конкретные случаи, в которых не были опубликованы неблагоприятные данные, спонсируемые фармацевтическими исследованиями, фармацевтические исследования и производители Америки опубликовали новые руководящие принципы, которые призывали компании сообщать все выводы и ограничить финансовое участие в фармацевтических компаниях исследователями. [ 74 ] Конгресс США подписал законопроект, который требует, чтобы клинические испытания II и фаза III были зарегистрированы спонсором на веб -сайте Clinicaltrials.gov, составленном Национальными институтами здравоохранения . [ 75 ]
Исследователи от наркотиков, не работающие непосредственно в фармацевтических компаниях, часто ищут гранты от производителей, и производители часто обращаются к академическим исследователям для проведения исследований в сетях университетов и их больниц, например, для исследований по трансляционному раку. Аналогичным образом, конкуренция на штатные академические должности, государственные гранты и престиж создают конфликт интересов среди ученых -академиков. [ 76 ] Согласно одному исследованию, приблизительно 75% статей, отобранных по причинам, связанным с неправомерными действиями, не имели заявленной финансовой поддержки отрасли. [ 77 ] Посевные испытания особенно противоречивы. [ 78 ]
В Соединенных Штатах все клинические испытания, представленные в FDA в рамках процесса одобрения лекарственного средства, независимо оцениваются клиническими экспертами в Управлении по контролю за продуктами и лекарствами, [ 79 ] включая проверки сбора первичных данных на выбранных сайтах клинических испытаний. [ 80 ]
В 2001 году редакторы 12 основных журналов опубликовали совместную редакционную статью, опубликованную в каждом журнале, о контроле над клиническими испытаниями, осуществляемыми спонсорами, в частности, нацеливаясь на использование контрактов, которые позволяют спонсорам пересматривать исследования до публикации и удерживать публикацию. Они укрепили редакционные ограничения, чтобы противостоять эффекту. В редакционной статье отметилась, что к 2000 году организации по контракту получили 60% грантов от фармацевтических компаний в США. Исследователи могут быть ограничены от участия в проекте испытания, доступа к необработанным данным и интерпретации результатов. [ 81 ]
Несмотря на явные рекомендации заинтересованных сторон в области мер по улучшению стандартов спонсируемых отрасли медицинских исследований, [ 82 ] В 2013 году Тоен предупредил о настойчивости разрыва в достоверности выводов, возникающих в результате финансируемых промышленными клиническими испытаниями, и призвал обеспечить строгую соблюдение этических стандартов в промышленном сотрудничестве с научными кругами, чтобы избежать дальнейшей эрозии доверия общественности. [ 83 ] Проблемы, обращенные к вниманию в этом отношении, включают потенциальное смещение наблюдения, продолжительность времени наблюдения для технических исследований, выбор популяций пациентов, факторы, которые влияют на реакцию плацебо и источники финансирования. [ 84 ] [ 85 ] [ 86 ]
Во время кризиса общественного здравоохранения
[ редактировать ]Проведение клинических испытаний вакцин во время эпидемий и пандемиков подвержена этическим проблемам. При заболеваниях с высоким уровнем смертности, такими как Эбола, назначение людей на плацебо или контрольную группу можно рассматривать как смертный приговор. В ответ на этические проблемы, связанные с клиническими исследованиями во время эпидемий, Национальная медицина национальной медицинской академии написала отчет, в котором выявлены семь этических и научных соображений. Эти соображения: [ 87 ]
- Научная ценность
- Социальная ценность
- Уважение к людям
- Вовлечение сообщества
- Забота о благосостоянии участников и интересах
- Баланс к выгоде по сравнению с рисками
- Доступ после испытаний к проверенной терапии, которая была удержана во время испытания
Беременные женщины и дети
[ редактировать ]Беременные женщины и дети, как правило, исключаются из клинических испытаний в качестве уязвимых групп населения, хотя данные, подтверждающие их, не являются надежными. Исключая их из клинических испытаний, часто отсутствует информация о безопасности и эффективности методов лечения для этих популяций. Во время ранней истории эпидемии ВИЧ/СПИДа ученый отметил, что, исключая эти группы из потенциально спасительного лечения, они «защищены до смерти». Такие проекты, как этика исследования для вакцин, эпидемии и новые технологии (предотвращение), выступали за этическую включение беременных женщин в испытаниях вакцины. Включение детей в клинические испытания имеет дополнительные моральные соображения, поскольку у детей не хватает автономии, принимающих решения. Испытания в прошлом подвергались критике за использование госпитализированных детей или сирот; Эти этические проблемы эффективно остановили будущие исследования. В усилиях по поддержанию эффективной педиатрической помощи в нескольких европейских странах и США есть политика, чтобы соблазнить или заставлять фармацевтические компании провести педиатрические испытания. Международное руководство рекомендует этические педиатрические испытания, ограничивая вред, учитывая различные риски и учитывая сложности педиатрической помощи. [ 87 ]
Безопасность
[ редактировать ]Ответственность за безопасность субъектов в клиническом испытании распределяется между спонсором, местными исследователями сайта (если отличается от спонсора), различные IRB, которые контролируют исследование, и (в некоторых случаях, если исследование включает в себя рыночный препарат или устройство), регулирующее агентство для страны, где будет продаваться препарат или устройство.
Систематическое параллельное обзор безопасности часто используется для обеспечения безопасности участников исследования. Поведение и постоянный обзор предназначены для того, чтобы быть пропорциональными риску испытания. Как правило, эта роль заполняется комитетом по данным и безопасности , внешне назначенным монитором медицинской безопасности, [ 88 ] Независимый сотрудник по безопасности , или для малых или низких исследований, основной исследователь. [ 89 ]
По соображениям безопасности многие клинические испытания лекарств [ 90 ] предназначены для исключения женщин детородного возраста, беременных женщин или женщин, которые забеременеют во время исследования. В некоторых случаях партнеры из этих женщин также исключаются или требуются для принятия мер по борьбе с рождаемостью.
Спонсор
[ редактировать ]На протяжении всего клинического испытания спонсор отвечает за точную информирование местных исследователей о истинном историческом отчете о безопасности препарата, устройства или других медицинских методов лечения, которые должны быть проверены, и любого потенциального взаимодействия исследуемого лечения с уже одобренным лечение. Это позволяет местным следователям выносить осознанное суждение о том, следует ли участвовать в исследовании или нет. Спонсор также отвечает за мониторинг результатов исследования, поскольку они поступают с различных сайтов по мере поступления испытания. В более крупных клинических испытаниях спонсор будет использовать услуги комитета по мониторингу данных (DMC, известный в США как Совет по мониторингу безопасности данных). Эта независимая группа клиницистов и статистиков периодически встречается, чтобы пересмотреть неослабежные данные, которые спонсор получил до сих пор. DMC имеет право рекомендовать прекращение исследования на основе их обзора, например, если исследование лечение вызывает больше смертей, чем стандартное лечение, или, по-видимому, вызывает неожиданные и связанные с исследованиями. неблагоприятные события . Спонсор отвечает за сбор отчетов о побочных событиях от всех следователей сайта в исследовании, а также за информирование всех исследователей о решении спонсора о том, были ли эти неблагоприятные события связаны или не связаны с лечением исследования.
Спонсор и следователи местных сайтов несут совместно ответственность за написание информированного согласия , специфичного для конкретного сайта , которое точно информирует о потенциальных предметах истинных рисков и потенциальных преимуществ участия в исследовании, в то же время представляя материал как можно кратко и и кратко на обычном языке. В правилах FDA говорится, что участие в клинических испытаниях является добровольным, причем субъект имеет право не участвовать или прекратить участие в любое время. [ 91 ]
Местные следователи сайта
[ редактировать ]Этическое принцип Primum non-nocere («во-первых, не причиняет вреда») направляет исследование, и если исследователь считает, что лечение исследования может нанести ущерб субъектам в исследовании, исследователь может прекратить участие в любое время. С другой стороны, следователи часто заинтересованы в наборе предметов и могут действовать неэтично, чтобы получить и поддерживать свое участие.
Местные следователи несут ответственность за проведение исследования в соответствии с протоколом исследования и надзор за персоналом исследования на протяжении всего исследования. Местный исследователь или его/ее исследовательский персонал также несут ответственность за обеспечение потенциальных предметов в исследовании понимать риски и потенциальные преимущества участия в исследовании. Другими словами, они (или их юридически уполномоченные представители) должны дать действительно информированное согласие.
Местные следователи несут ответственность за рассмотрение всех отчетов о побочных событиях, отправленных спонсором. Эти отчеты о неблагоприятных событиях содержат мнения как следователя (на месте, где произошло неблагоприятное событие), так и спонсора, касающиеся взаимосвязи неблагоприятных событий с лечением исследования. Местные следователи также несут ответственность за вынесение независимого суждения об этих отчетах и оперативно информировать местный IRB о всех серьезных и учебных побочных событиях, связанных с лечением.
Когда местный следователь является спонсором, не может быть официальных отчетов о неблагоприятных событиях, но персонал исследования во всех местах несет ответственность за информирование координационного следователя о чем -то неожиданном. Местный следователь несет ответственность за то, чтобы быть правдивым для местного IRB во всех сообщениях, связанных с исследованием.
Институциональные обзоры (IRBS)
[ редактировать ]Одобрение институциональным контрольным советом (IRB) или Независимого комитета по этике (МЭК) необходимо, прежде чем все, кроме самых неформальных исследований. В коммерческих клинических испытаниях протокол исследования не одобрен IRB до того, как спонсор набирает участки для проведения испытания. Тем не менее, протокол исследования и процедуры были адаптированы для соответствия общим требованиям представления IRB. В этом случае, и там, где нет независимого спонсора, каждый исследователь местного сайта представляет протокол исследования, согласие (ов), формы сбора данных и подтверждающая документацию для локального IRB. Университеты и большинство больниц имеют собственные IRBS. Другие исследователи (например, в клиниках, использующих независимые IRB.
IRB изучает исследование как для медицинской безопасности, так и для защиты пациентов, участвующих в исследовании, до того, как он позволит исследователю начать исследование. Это может потребовать изменения в процедурах исследования или в объяснениях, данных пациенту. Необходимый ежегодный отчет «Продолжающегося рассмотрения» от исследователя обновляет IRB о ходе исследования и любой новой информации о безопасности, связанной с исследованием.
Регулирующие органы
[ редактировать ]В США FDA может проверять файлы файлов местных следователей сайта после того, как они закончили участие в исследовании, чтобы увидеть, правильно ли они следовали процедурам обучения. Этот аудит может быть случайным или по причине (потому что исследователь подозревается в мошеннических данных). Избегать аудита является стимулом для исследователей следовать процедурам обучения. «Покрытое клиническое исследование» относится к испытанию, представленному в FDA как часть маркетинговой заявки (например, как часть NDA или 510 (k) ), о котором FDA может потребовать раскрытия финансового интереса клинического следователя в результате исследования. Например, заявитель должен раскрыть, владеет ли следователь в спонсоре или владеет собственным интересом к исследуемому продукту. FDA определяет покрытое исследование как «... любое исследование препарата, биологического продукта или устройства у людей, представленных в маркетинговой заявке или петиции реклассификации, на которое полагается заявитель или FDA, чтобы установить, что продукт эффективен (включая исследования, которые показывают Эквивалентность эффективному продукту) или любое исследование, в котором один исследователь вносит значительный вклад в демонстрацию безопасности ». [ 92 ]
В качестве альтернативы, многие американские фармацевтические компании перенесли некоторые клинические испытания за рубежом. Преимущества проведения испытаний за рубежом включают более низкие затраты (в некоторых странах) и способность проводить более крупные испытания в более короткие сроки, тогда как потенциальное недостаток существует при управлении испытаниями более низкого качества. [ 93 ] Различные страны имеют разные нормативные требования и правоприменение. По оценкам, 40% всех клинических испытаний в настоящее время проходят в Азии, Восточной Европе, в Центральной и Южной Америке. «В этих странах нет обязательной системы регистрации для клинических испытаний, и многие не следуют европейским директивам в своих операциях»,-говорит Джейкоб Сиджтсма из Нидерландов Wemos, организации здравоохранения, отслеживая клинические испытания в развивающихся странах. [ 94 ]
Начиная с 1980 -х годов, гармонизация протоколов клинических испытаний была показана как выполнимое в странах Европейского Союза. В то же время координация между Европой, Японией и Соединенными Штатами привела к совместной нормативно-промышленной инициативе по международной гармонизации, названной в честь 1990 года как Международная конференция по гармонизации технических требований для регистрации фармацевтических препаратов для использования человека (ICH) [ 95 ] В настоящее время большинство программ клинических испытаний следуют руководящим принципам ICH, направленным на «обеспечение того, чтобы хорошее качество, безопасные и эффективные лекарства разрабатывались и зарегистрированы наиболее эффективным и экономически эффективным способом. Эти действия преследуются в интересах потребителя и общественного здравоохранения, Чтобы предотвратить ненужное дублирование клинических испытаний у людей и минимизировать использование испытаний на животных без ущерба для регулирующих обязательств по безопасности и эффективности ». [ 96 ]
Агрегация данных безопасности во время клинической разработки
[ редактировать ]Агрегирование данных безопасности в клинических испытаниях во время разработки лекарств важно, потому что испытания обычно предназначены для того, чтобы сосредоточиться на определении того, насколько хорошо работает лекарство. Данные безопасности, собранные и агрегируемые по нескольким исследованиям по мере разработки лекарственного средства, позволяют спонсорам, исследователям и регулирующим органам контролировать профиль совокупного безопасности экспериментальных лекарств по мере их разработки. Значение оценки совокупных данных о безопасности: a) решения, основанные на совокупной оценке безопасности во время разработки медицины, могут быть приняты на протяжении всей разработки медицины, и б) он устанавливает спонсоров и регуляторы для оценки безопасности лекарства после одобрения препарата Полем [ 97 ] [ 98 ] [ 99 ] [ 100 ] [ 101 ]
Экономика
[ редактировать ]Затраты на клинические испытания варьируются в зависимости от этапа испытания, типа испытаний и изученных заболеваний. Исследование клинических испытаний, проведенных в Соединенных Штатах с 2004 по 2012 год, показало, что средняя стоимость исследований I фазы составляет от 1,4 до 6,6 млн. Долл. США, в зависимости от типа заболевания. Испытания фазы II варьировались от 7 до 20 миллионов долларов, а испытания III фазы - от 11 до 53 миллионов долларов. [ 102 ]
Спонсор
[ редактировать ]Стоимость исследования зависит от многих факторов, особенно от количества участков, проводящих исследование, количество вовлеченных пациентов, и является ли исследовательское лечение уже одобрено для медицинского использования.
Расходы, понесенные фармацевтической компанией, при управлении клиническим испытанием III или IV, среди прочего, могут включать в себя клиническое исследование фазы III или IV:
- Производство оцениваемого препарата или устройства (-ов)
- Заработная плата персонала для дизайнеров и администраторов судебного разбирательства
- Платежи в организацию по контракту, организация по управлению сайтами (если используется) и любые внешние консультанты
- Платежи местным исследователям и их сотрудникам за их время и усилия по набору предметов и сбору данных для спонсора
- стоимость учебных материалов и платы, понесенные для их отправки
- Коммуникация с местными исследователями, включая мониторинг на месте CRO до и (в некоторых случаях) несколько раз во время исследования
- ОДИН или несколько встреч для обучения следователей
- Расходы, понесенные местными исследователями, такими как плата за аптеки, плата за IRB и почтовые расходы
- Любые платежи по субъектам, зарегистрированным в суде
- Расходы на лечение испытуемого, у которого развивается состояние здоровья, вызванное препаратом для исследования
Эти расходы понесены в течение нескольких лет.
В США спонсоры могут получить 50 -процентный налоговый кредит на клинические испытания, проведенные на лекарства, разрабатываемые для лечения заболеваний сирот . [ 103 ] Национальные медицинские агентства, такие как Национальные институты здравоохранения США , предлагают гранты следователям, которые разрабатывают клинические испытания, которые пытаются ответить на исследования, представляющие интерес для агентства. В этих случаях исследователь, который пишет грант и управляет исследованием в качестве спонсора, и координирует сбор данных с любых других сайтов. Эти другие сайты могут или не могут быть оплачены за участие в исследовании, в зависимости от суммы гранта и суммы, ожидаемых от них усилий. Использование интернет -ресурсов может, в некоторых случаях, сократить экономическое бремя. [ 104 ]
Следователи
[ редактировать ]Следователи часто получают компенсацию за свою работу в клинических испытаниях. Эти суммы могут быть небольшими, просто охватывая частичную заработную плату для научных сотрудников и стоимость любых поставки (обычно в случае с исследованиями национальных агентств здравоохранения), или быть существенными и включать «накладные расходы», которые позволяют исследователю платить исследовательскому персоналу во время между клиническими испытаниями. [ Цитация необходима ]
Субъекты
[ редактировать ]Участники в испытаниях по наркотикам I фазы не получают прямой пользы для здоровья от участия. Как правило, им платят за свое время, с регулируемыми платежами и не связаны с каким -либо связанным с риском. Мотивации здоровых добровольцев не ограничиваются финансовым вознаграждением и могут включать другие мотивы, такие как участие в науке и других. [ 105 ] В последующих этапах испытаний субъекты не могут быть выплачены, чтобы обеспечить их мотивацию для участия с потенциалом для медицинской выгоды или способствуя медицинским знаниям. Небольшие платежи могут быть произведены за расходы, связанные с исследованиями, такие как поездки или компенсация за их время, предоставление последующей информации о их здоровье после завершения пробного лечения.
Набор и участие участников
[ редактировать ]
Фаза 0 и фаза I Испытания на наркотики ищут здоровых добровольцев. Большинство других клинических испытаний ищут пациентов с конкретным заболеванием или заболеванием. Разнообразие, наблюдаемое в обществе, должно быть отражено в клинических испытаниях посредством соответствующего включения населения этнических меньшинств . [ 106 ] Набор персонала или набор участников играет важную роль в деятельности и обязанностях участков, проводящих клинические испытания. [ 107 ]
Все добровольцы, рассматриваемые для судебного разбирательства, должны пройти медицинский скрининго. Требования различаются в соответствии с требованиями испытаний, но обычно добровольцы будут проверены в медицинской лаборатории на: [ 108 ]
- Измерение электрической активности сердца (ЭКГ)
- Измерение артериального давления, частоты сердечных сокращений и температуры тела
- Чемкопотребление крови
- Отбор проб мочи
- Измерение веса и высоты
- Испытание на злоупотребление наркотиками
- Тестирование беременности
Было отмечено, что участники клинических испытаний непропорционально белые. [ 109 ] [ 110 ] Часто меньшинства не информируются о клинических испытаниях. [ 111 ] Один недавний систематический обзор литературы обнаружил, что раса/этническая принадлежность, а также пол были не хорошо представлены, а иногда даже отслеживались как участники большого числа клинических испытаний по утрате слуха у взрослых. [ 112 ] Это может снизить обоснованность результатов в отношении небелых пациентов [ 113 ] не соответствующим образом представляя большую популяцию .
Расположение испытаний
[ редактировать ]В зависимости от того, что требуется участники, спонсоры клинических испытаний или исследовательских организаций, работающих от их имени, пытаются найти сайты с квалифицированным персоналом, а также доступ к пациентам, которые могут участвовать в исследовании. Работая с этими сайтами, они могут использовать различные стратегии найма, в том числе базы данных пациентов, газетные и радиопередачи, листовки, плакаты в местах, которые могут пойти пациенты (например, офисы врача) и личный набор пациентов с исследователями.
Добровольцы с конкретными условиями или заболеваниями имеют дополнительные онлайн -ресурсы, чтобы помочь им найти клинические испытания. Например, искатель испытания FOX связывает испытания болезни Паркинсона по всему миру с волонтерами, которые имеют определенное набор критериев, таких как местоположение, возраст и симптомы. [ 114 ] Другие специфичные для болезни услуги существуют для добровольцев, чтобы найти испытания, связанные с их состоянием. [ 115 ] Добровольцы могут непосредственно искать на клинических обращениях. Gov для поиска испытаний, используя реестр, управляемый Национальным институтом здравоохранения и национальной медицины США . Также существует программное обеспечение, которое позволяет врачам найти варианты испытаний для отдельного пациента на основе таких данных, как геномные данные. [ 116 ]
Исследовать
[ редактировать ]
Модель в поисках и обработке информации о рисках (RISP) анализирует социальные последствия, которые влияют на отношение и принятие решений, относящиеся к клиническим испытаниям. [ 117 ] Люди, которые имеют более высокую долю или интерес к лечению, представленному в клиническом испытании, показали большую вероятность поиска информации о клинических испытаниях. Пациенты с раком сообщили, что более оптимистичное отношение к клиническим испытаниям, чем население в целом. Наличие более оптимистичного взгляда на клинические испытания также приводит к большей вероятности регистрации. [ 117 ]
Соответствующий
[ редактировать ]Сопоставление включает в себя систематическое сравнение клинической и демографической информации пациента с критериями приемлемости различных испытаний. Методы включают:
- Руководство: поставщики медицинских услуг или координаторы клинических испытаний вручную просмотрите записи пациентов и доступные критерии испытаний для выявления потенциальных совпадений. [ 118 ] Это также может включать в себя поиск вручную в базах данных клинических испытаний. [ 119 ]
- Электронные медицинские записи (EHR). Некоторые системы интегрируются с EHR, чтобы автоматически помечать пациентов, которые могут иметь право на исследования на основе их медицинских данных. Эти системы могут использовать методы машинного обучения , искусственного интеллекта или точной медицины, чтобы более эффективно соответствовать пациентам с исследованиями. [ 120 ] Эти методы сталкиваются с проблемой преодоления ограничений записей EHR, таких как упущения и ошибки ведения журнала.
- Услуги прямого к пациенту: ресурсы специализируются на поддержке пациентов в поиске клинических испытаний через онлайн-платформы, горячие линии и персонализированную поддержку. [ 118 ] [ 119 ] [ 121 ]
Децентрализованные испытания
[ редактировать ]Хотя испытания обычно проводятся в крупных медицинских центрах, некоторые участники исключаются из -за расстояния и расходов, необходимых для поездок, что приводит к трудностям, недостаткам и несправедливости для участников, особенно в сельских и недостаточно обслуживаемых общинах. Следовательно, концепция «децентрализованного клинического испытания», которая минимизирует или устраняет необходимость перемещения пациентов на участки, [ 122 ] в настоящее время более широко распространен, способность улучшается с помощью телездравоохранения и носимых технологий . [ 123 ]
Смотрите также
[ редактировать ]Ссылки
[ редактировать ]- ^ Подпрыгнуть до: а беременный в «NIH клинические исследования и вас: основы» . Национальные институты здравоохранения США. 3 октября 2022 года. Архивировано с оригинала 22 апреля 2020 года . Получено 7 ноября 2022 года .
- ^ «Клинические испытания» (PDF) . Билл и Мелинда Гейтс Фонд. Архивировано (PDF) из оригинала 12 января 2017 года . Получено 1 января 2014 года .
- ^ Димаси, Джозеф А; Grabowski, Генри Г; Хансен, Рональд В. (2016). «Инновации в фармацевтической промышленности: новые оценки расходов на НИОКР». Журнал экономики здравоохранения . 47 : 20–33. doi : 10.1016/j.jhealeco.2016.01.012 . HDL : 10161/12742 . PMID 26928437 .
- ^ «Процесс разработки лекарственного средства. Шаг 3: клинические исследования» . Управление по контролю за продуктами и лекарствами США. 4 января 2018 года . Получено 9 марта 2024 года .
- ^ «Сколько времени требуется новое препарат, чтобы пройти клинические испытания» . Рак исследований Великобритания. 1 февраля 2022 года . Получено 9 марта 2024 года .
- ^ Emanuel EJ (9 сентября 2015 г.). «Решение цен на лекарства» . New York Times . Архивировано из оригинала 5 декабря 2022 года . Получено 26 февраля 2017 года .
Из лекарств, начатых в клинических испытаниях на людях, только 10 процентов обеспечивают одобрение FDA. ...
- ^ 25 апреля . 2014 года Страница FDA в последний раз обновляется
- ^ Phrma. Февраль 2007 г. Обнаружение и развитие наркотиков Архивировало 10 апреля 2023 года в The Wayback Machine
- ^ Merck Manual. Последний полный обзор/пересмотр октября 2013 г. Даниэль А. Гусар, докторская степень, докторская докторская без рецепта связь о препаратах, заархивированных 4 февраля 2015 года на машине Wayback
- ^ Averorn J. (2004). Мощные лекарства , с. 129–33. Альфред А. Кнопф.
- ^ Van Spall HG, Toren A, Kiss A, Fowler RA (март 2007 г.). «Критерии приемлемости рандомизированных контролируемых испытаний, опубликованных в общих медицинских журналах с высоким воздействием: систематический обзор выборки». Джама . 297 (11): 1233–40. doi : 10.1001/Jama.297.11.1233 . PMID 17374817 .
- ^ Подпрыгнуть до: а беременный в дюймовый и фон глин час я Дж "Каковы различные виды клинических исследований?" Полем Управление по контролю за продуктами и лекарствами США. 2019. Архивировано с оригинала 12 июня 2019 года . Получено 24 мая 2019 года .
- ^ Регулирующий орган в США - Управление по контролю за продуктами и лекарствами ; в Канаде, здравоохранение Канада ; В Европейском Союзе Европейское агентство по лекарственным средствам ; и в Японии, Министерство здравоохранения, труда и благосостояния
- ^ «Медицинские устройства, Прамаркетские клинические исследования для освобождения от исследования» . Управление по контролю за продуктами и лекарствами США. 17 марта 2017 года. Архивировано с оригинала 1 ноября 2017 года . Получено 2 октября 2017 года .
- ^ Ледерле Ф.А., Фрейшлаг Дж.А., Кириакидес Т.К., Падберг Ф.Т., Мацумура Дж.С., Колер Т.Р., Лин П.Х., Жан-Клод Дж. М., Сикрит Д.Ф., Свансон К.М., Педуцзи Пн (октябрь 2009 г.). «Результаты после эндоваскулярного и открытого восстановления аневризмы аорты брюшной полости: рандомизированное исследование» . Джама . 302 (14): 1535–42. doi : 10.1001/Jama.2009.1426 . PMID 19826022 .
- ^ Липп А., Шоу С., Главинд К (декабрь 2014 г.). «Механические устройства для недержания мочи у женщин» . Кокрановская база данных систематических обзоров . 2014 (12): CD001756. doi : 10.1002/14651858.cd001756.pub6 . PMC 7061494 . PMID 25517397 .
- ^ Farrokhyar F, Karanicolas PJ, Thoma A, Simunovic M, Bhandari M, Devereaux PJ, Anvari M, Adili A, Guyatt G (март 2010 г.). «Рандомизированные контролируемые исследования хирургических вмешательств». Анналы хирургии . 251 (3): 409–16. doi : 10.1097/sla.0b013e3181cf863d . PMID 20142732 . S2CID 17084906 .
- ^ Метвалли, Мостафа; Рейбулд, Грейс; Cheong, Ying C; Хорн, Эндрю В. (29 января 2020 года). Кокрановская гинекология и группа фертильности (ред.). «Хирургическое лечение миомы для под поверхности» . Кокрановская база данных систематических обзоров . 2020 (1): CD003857. doi : 10.1002/14651858.cd003857.pub4 . PMC 6989141 . PMID 31995657 .
- ^ Cao Am, Cox MR, Eslick GD (март 2016 г.). «Дизайн исследования в хирургии на основе фактических данных: какова роль исследований в отношении случайного контроля?» Полем Мировой журнал методологии . 6 (1): 101–4. doi : 10.5662/wjm.v6.i1.101 . PMC 4804244 . PMID 27019801 .
- ^ «Пакет общественной информации (PIP): как принять участие в NHS, исследованиях общественного здравоохранения и социального обеспечения» . Национальный институт исследований здравоохранения и ухода . Получено 3 января 2024 года .
- ^ «Брифинг примечания для исследователей - общественное участие в NHS, исследованиях в области здравоохранения и социального обеспечения» . Национальный институт исследований здравоохранения и ухода . Получено 3 января 2024 года .
- ^ Подпрыгнуть до: а беременный в дюймовый Meinert CL, Tonascia S (1986). Клинические испытания: проектирование, поведение и анализ . Издательство Оксфордского университета, США. п. 3. ISBN 978-0-19-503568-1 Полем Архивировано из оригинала 15 апреля 2023 года . Получено 5 июня 2020 года .
- ^ Саймон, Харви Б. (2002). Гарвардская медицинская школа по здоровью мужчин . Нью -Йорк: Свободная пресса . п. 31 ISBN 978-0-684-87181-3 .
- ^ Браун, Стивен Р. (2003). Скюрви: как хирург, моряк и джентльмен решил величайшую медицинскую загадку эпохи паруса . Нью -Йорк, Нью -Йорк: пресса Святого Мартина. ISBN 0-312-31391-8
- ^ Роджерс, Эверетт М. (1995). Распространение инноваций . Нью -Йорк, Нью -Йорк: Свободная пресса. ISBN 0-7432-2209-1 . п. 7
- ^ Карлайл, Родни (2004). Scientific American Изобретения и открытия , John Wiley & Songs, Inc., Нью -Джерси. п. 393. ISBN 0-471-24410-4 .
- ^ «Джеймс Линд: трактат цинги (1754)» . 2001. Архивировано с оригинала 1 октября 2018 года . Получено 9 сентября 2007 года .
- ^ «О клинических испытаниях» . День клинических испытаний . Архивировано из оригинала 5 февраля 2023 года . Получено 7 апреля 2023 года .
- ^ Грин С., Кроули Дж., Бенедетти Дж., Смит А (30 июля 2002 г.). Клинические испытания в онкологии, второе издание . CRC Press. С. 1-. ISBN 978-1-4200-3530-8 .
- ^ GAD SC (17 июня 2009 г.). Справочник по клиническим испытаниям . Джон Уайли и сыновья. с. 118–. ISBN 978-0-470-46635-3 .
- ^ О'Рурк М.Ф. (февраль 1992 г.). «Фредерик Акбар Маромед» . Гипертония . 19 (2): 212–7. doi : 10.1161/01.hyp.19.2.212 . PMID 1737655 .
- ^ Creswell, JW (2008). Образовательные исследования: планирование, проведение и оценка количественных и качественных исследований (3 -е). Верхняя седл -река, Нью -Джерси: Прентис Холл. 2008, с. 300. ISBN 0-13-613550-1
- ^ Хани (2009). «Исследование репликации» . Архивировано с оригинала 2 июня 2012 года . Получено 27 октября 2011 года .
- ^ Metcalfe NH (февраль 2011 г.). «Сэр Джеффри Маршалл (1887-1982): врач-респиратор, катализатор развития анестезии, доктор как премьер-министра, так и короля, и командир Баржа Первой мировой войны». Журнал медицинской биографии . 19 (1): 10–4. doi : 10.1258/jmb.2010.010019 . PMID 21350072 . S2CID 39878743 .
- ^ Pharmabiz.com, 19 мая 2014 года, Руководство по выпускам Mumbai ISCR для участников клинических испытаний на Международном дне клинических испытаний машине 7 апреля 2023 года на Wayback (по состоянию на 20 мая 2014 года)
- ^ Pottegård, Anton; Haastrup, Maija Bruun; Стадия, разорение Bjerregaard; Хансен, Мортен Рикс; и др. (16 декабря 2014 г.). «Поиск юмористических и экстравагантных аббревиатур и совершенно неадекватных названий для важных клинических испытаний (научные): качественное и количественное систематическое исследование» . BMJ . 349 : G7092. doi : 10.1136/bmj.g7092 . PMC 4267482 . PMID 25516539 .
- ^ Подпрыгнуть до: а беременный "Что такое клиническое исследование?" Полем Национальная библиотека медицины, Национальные институты здравоохранения США. 1 марта 2019 года. Архивировано с оригинала 19 мая 2019 года . Получено 24 мая 2019 года .
- ^ Хелен С. (2010). «ЕС сострадательные программы использования (Cups): нормативно -правовая база и указывают на то, что нужно рассмотреть перед реализацией CUP» . Pharm Med . 24 (4): 223–229. doi : 10.1007/bf03256820 . S2CID 31439802 .
- ^ Бреннан Z (5 июня 2013 г.). «Крос медленно переходит к адаптивным конструкциям клинических испытаний» . Аутсорсинг-pharma.com. Архивировано из оригинала 27 августа 2017 года . Получено 5 января 2014 года .
- ^ «Адаптивные клинические испытания для преодоления исследований» . News-medical.net. 17 сентября 2013 года. Архивировано с оригинала 11 августа 2020 года . Получено 4 января 2014 года .
- ^ Ван, Ширли С. (30 декабря 2013 г.). «Здоровье: ученые стремятся улучшить стоимость и время испытаний на лекарства - wsj.com» . Online.wsj.com. Архивировано с оригинала 14 марта 2016 года . Получено 4 января 2014 года .
- ^ Huber PW (12 ноября 2013 г.). Лечение в кодексе: как закон 20 -го века подрывает медицину 21 -го века . Основные книги. ISBN 978-0-465-06981-1 .
- ^ Lancet (июль 2009 г.). «Испытания фазы 0: платформа для разработки лекарств?» Полем Лансет . 374 (9685): 176. DOI : 10.1016/S0140-6736 (09) 61309-X . PMID 19616703 . S2CID 30939770 .
- ^ Подпрыгнуть до: а беременный «Фаза IIA и фаза IIB Клиническое испытание» . www.musculardystrophyuk.org . Архивировано из оригинала 9 августа 2020 года . Получено 10 августа 2020 года .
- ^ Подпрыгнуть до: а беременный в Ханнан Эль (июнь 2008 г.). «Рандомизированные клинические испытания и обсервационные исследования: руководящие принципы для оценки соответствующих сильных сторон и ограничений» . Jacc. Сердечно -сосудистые вмешательства . 1 (3): 211–7. doi : 10.1016/j.jcin.2008.01.008 . PMID 19463302 .
- ^ Sessler DI, Imrey PB (октябрь 2015). «Методология клинических исследований 2: наблюдательные клинические исследования» . Анестезия и анальгезия . 121 (4): 1043–51. doi : 10.1213/ane.0000000000000861 . PMID 26378704 . S2CID 19333613 .
- ^ Элдридж С.М., Ланкастер Г.А., Кэмпбелл М.Дж., Табан Л., Хоупвелл С., Коулман К.Л., Бонд К.М. (2016). «Определение осуществимости и пилотных исследований в подготовке к рандомизированным контролируемым исследованиям: разработка концептуальной структуры» . Plos один . 11 (3): E0150205. Bibcode : 2016ploso..1150205E . doi : 10.1371/journal.pone.0150205 . PMC 4792418 . PMID 26978655 .
- ^ «Активный контроль / активный компаратор» . 3 марта 2017 года. Архивировано с оригинала 8 апреля 2023 года . Получено 31 октября 2017 года .
- ^ «Основные протоколы для разработки лекарственного и биологического продукта» . www.fda.gov . Министерство здравоохранения и социальных служб США Центр Управления по контролю за пищевыми продуктами и лекарствами по оценке и исследованиям лекарств. 21 декабря 2023 г. с. 1 Получено 25 июля 2024 года .
 Эта статья включает текст из этого источника, который находится в общественном доступе .
Эта статья включает текст из этого источника, который находится в общественном доступе .
- ^ Молодая, Сьюзен. «Фонд медицина присоединяется к коалиции, направленной на то, чтобы встряхнуть испытания лекарств от рака | Обзор технологий MIT» . TechnologyReview.com. Архивировано с оригинала 13 ноября 2013 года . Получено 14 ноября 2013 года .
- ^ «Официальный веб -сайт ICH» (PDF) . www.ich.org . Архивировано из оригинала (PDF) 21 сентября 2008 года.
- ^ «Официальный веб -сайт ICH: ICH» . ich.org . Архивировано из оригинала 25 мая 2011 года . Получено 5 октября 2008 года .
- ^ Подпрыгнуть до: а беременный в «Узнайте о клинических исследованиях» . Clinicaltrials.gov . Архивировано из оригинала 10 апреля 2012 года.
- ^ Малони, Деннис М. (1984). Защита субъектов по исследованиям человека: практическое руководство по федеральным законам и правилам . Бостон, Массачусетс: Springer US. п. 151. ISBN 9781461327035 .
- ^ Дори, Фредерик (2011). «Статистика вкратце: статистическая сила: что это и когда ее следует использовать?» Полем Клиническая ортопедия и связанные с ними исследования . 469 (2): 619–620. doi : 10.1007/s11999-010-1435-0 . PMC 3018227 . PMID 20585913 .
- ^ Norwitz ER, Greenberg JA (2011). «Одобрение FDA на использование лекарств во время беременности: тяжелая битва» . Отзывы в области акушерства и гинекологии . 4 (2): 39–41. PMC 3218552 . PMID 22102925 .
- ^ «Часто задаваемые вопросы | Онкологический центр Университета Аризоны» . Azcc.arizona.edu. Архивировано с оригинала 2 декабря 2013 года . Получено 14 ноября 2013 года .
- ^ Мисета, изд (17 декабря 2019 г.). «Янссен использует геозон для мониторинга пациентов с клиническими испытаниями» . Клинический лидер . Пенсильвания, Соединенные Штаты: Вертмарки. Архивировано из оригинала 27 января 2020 года . Получено 26 января 2020 года .
- ^ Unger, JM; Кук, E; Тай, E; Блейер, А (2016). «Роль участия в клинических исследованиях в исследованиях рака: барьеры, доказательства и стратегии» . Американское общество клинической онкологической образовательной книги. Американское общество клинической онкологии. Ежегодное собрание . 35 (36). Американское общество клинической онкологии: 185–198. doi : 10.1200/edbk_156686 . PMC 5495113 . PMID 27249699 .
- ^ Weiss SC, Rowell R, Krochmal L (2008). «Влияние сезонности на проведение клинических исследований в дерматологии». Клиники в дерматологии . 26 (5): 565–9. doi : 10.1016/j.clindermatol.2008.01.016 . PMID 18755376 .
- ^ Хан Й. Тилли С. , Pharm-Olam International. Архивировано из оригинала (PDF) 15 июля 2011 года . Получено 26 апреля 2010 года .
- ^ Маршалл, Меган (19 декабря 2019 г.). «Реализация QBD в вашем клиническом испытании? 4 вопроса, чтобы ответить первым» . Клинический лидер . Пенсильвания: вертмаркеты. Архивировано из оригинала 27 января 2020 года . Получено 26 января 2020 года .
- ^ Yang, ZJ, et al. (2010). «Мотивация для поиска и обработки информации о медицинской информации о регистрации клинических испытаний». Связь здравоохранения 25 (5): 423–436.
- ^ «Биография для использования VIS Analytics для оптимизации педиатрических клинических исследований - wsj.com» . Online.wsj.com. 7 мая 2013 года. Архивировано с оригинала 4 февраля 2014 года . Получено 14 ноября 2013 года .
- ^ Группа стратегии наук о жизни, «Использование технологий клинических испытаний, предпочтения закупок и перспективы роста», май 2009 г., май 2009 г.
- ^ «Электронный пациент сообщил о результатах (EPRO) - изменение лица клинических испытаний» . Med-quest.org . Архивировано из оригинала 21 мая 2015 года . Получено 20 мая 2015 года .
- ^ Подпрыгнуть до: а беременный Эванс, Скотт Р. (2010). «Общие статистические проблемы в клинических испытаниях» . Журнал экспериментального инсульта и трансляционной медицины . 3 (1): 1–7. doi : 10.6030/1939-067x-3,1,1 (неактивный 17 марта 2024 г.). ISSN 1939-067X . PMC 3059317 . PMID 21423790 .
{{cite journal}}: CS1 Maint: doi неактивен с марта 2024 года ( ссылка ) - ^ Подпрыгнуть до: а беременный Эванс -младший, Ch; Ildstad, St, Eds. (2001). «Статистические подходы к анализу небольших клинических испытаний». Небольшие клинические испытания и проблемы и проблемы; В кн.: Статистические подходы к анализу небольших клинических испытаний . Национальная академическая пресса (США). Архивировано из оригинала 15 апреля 2023 года . Получено 7 ноября 2022 года .
- ^ Гордон, EJ; Prohaska, TR (2006). «Этика вывода от участия в исследовании» . Подотчетность в исследованиях . 13 (4): 285–309. doi : 10.1080/08989620600848645 . PMC 9527709 . PMID 17849641 .
- ^ «Законопроект № 2328 Ассамблеи» (PDF) . Архивировано из оригинала (PDF) 2 декабря 2007 года . Получено 19 ноября 2007 года .
- ^ Хайден Е.К. (ноябрь 2014 г.). «Этическая дилемма для испытаний на наркотики Эбола» . Природа . 515 (7526): 177–8. Bibcode : 2014natur.515..177c . doi : 10.1038/515177a . PMID 25391940 .
- ^ Паттинсон, Шон Д. (2012). «Аварийные исследования и интересы участников» (PDF) . Медицинское право интернациональное . 12 (2): 121–141. doi : 10.1177/0968533212465615 . S2CID 71853867 . Архивировано (PDF) из оригинала 9 апреля 2023 года . Получено 13 июля 2019 года .
- ^ SPAN, Паула (3 марта 2020 г.). «Когда исследование наркотиков внезапно заканчивается, добровольцам остается справляться» . New York Times . ISSN 0362-4331 . Архивировано из оригинала 7 апреля 2023 года . Получено 23 апреля 2020 года .
- ^ Мойнихан Р. (2003). «Кто платит за пиццу? Переопределение отношений между врачами и фармацевтическими компаниями. 2: распущенность» . Британский медицинский журнал . 326 (7400): 1193–1196. doi : 10.1136/bmj.326.7400.1193 . PMC 1126054 . PMID 12775622 .
- ^ «Обновление Hogan & Hartson по регистрации фармацевтических испытаний» (PDF) . 3 марта 2008 года. Архивировано из оригинала (PDF) 25 июня 2008 года . Получено 2 июня 2008 года .
- ^ «Восстание в научных журналах, которые вызывает призывы к реформе» . New York Times . 16 апреля 2012 года. Архивировано с оригинала 18 июня 2018 года . Получено 22 мая 2018 года .
- ^ Вулли К.Л., Лью Р.А., Стреттон С., Эли Дж.А., Брамич Н.Дж., Кейс Дж.Р., Монк Дж.А., Вулли М.Дж. (июнь 2011 г.). «Отсутствие участия медицинских писателей и фармацевтической промышленности в публикациях отозвано для проступка: систематическое контролируемое, ретроспективное исследование». Текущие медицинские исследования и мнение . 27 (6): 1175–82. doi : 10.1185/03007995.2011.573546 . PMID 21473670 . S2CID 2583905 .
- ^ Sox HC, Rennie D (август 2008 г.). «Испытания по посевам: просто скажите" нет " . Анналы внутренней медицины . 149 (4): 279–80. doi : 10.7326/0003-4819-149-4-200808190-00012 . PMID 18711161 .
- ^ «Процесс разработки и одобрения (лекарства)» . Управление по контролю за продуктами и лекарствами США. Архивировано с оригинала 10 июня 2018 года . Получено 22 мая 2018 года .
- ^ «Руководство по информационным листам для IRB, клинических исследователей и спонсоров: проверки FDA клинических исследователей» (PDF) . Управление по контролю за продуктами и лекарствами . Июнь 2010. Архивировал (PDF) из оригинала 11 июня 2014 года . Получено 16 октября 2014 года .
- ^ Davidoff F, Deangelis CD, Drazen JM, Nicholls MG, Hoey J, Højgaard L, Horton R, Kotzin S, Nylenna M, Overbeke AJ, Sox HC, Van Der Weyden MB, Wilkes MS (сентябрь 2001 г.). «Спонсорство, авторство и ответственность» . CMAJ . 165 (6): 786–8. PMC 81460 . PMID 11584570 . Архивировано из оригинала 15 апреля 2023 года . Получено 27 февраля 2011 года .
- ^ Манси, Бернадетт А.; Кларк, Юли; Дэвид, Фрэнк С.; Gesell, Thomas M.; Глассер, Сьюзен; Гонсалес, Джон; Халлер, Даниэль Г.; Лейн, Кристина; Миллер, Чарльз Л.; Муни, Лаверн А.; Zecevic, Maja (май 2012 г.). «Десять рекомендаций по сокращению разрыва в доверительстве в спонсируемых отраслью клинических исследований: совместный журнал и перспектива фармацевтической промышленности» . Майо -клиника . 87 (5): 424–429. doi : 10.1016/j.mayocp.2012.02.009 . ISSN 1942-5546 . PMC 3538468 . PMID 22560521 .
- ^ Тохен, Маурисио (сентябрь 2013 г.). «Доверие к клиническим испытаниям, финансируемым в отрасли» . Международный журнал нейропсихофармакологии . 16 (8): 1879–1884. doi : 10.1017/s1461145713000461 . ISSN 1469-5111 . PMID 23672957 .
- ^ Тохен, Маурисио (1 февраля 2017 г.). К " Полем 20 (2): 95–97. doi : 10.1093/ijnp/pyx . ISSN 1469-5111 . PMC 5356994 . PMID 28927197 .
- ^ Tohen, Mauricio (2018). «Тяжесть симптомов в маниаклинических руководящих принципах и последствий проектирования исследования» . Биполярные расстройства . 20 (2): 171–172. doi : 10.1111/bdi.12598 . ISSN 1399-5618 . PMID 29327798 . Архивировано из оригинала 8 апреля 2023 года . Получено 27 мая 2021 года .
- ^ Tohen, Mauricio (2013). «Доверие к клиническим испытаниям, финансируемым в отрасли» . Международный журнал нейропсихофармакологии . 16 (8): 1879–1884. doi : 10.1017/s1461145713000461 . ISSN 1469-5111 . PMID 23672957 .
- ^ Подпрыгнуть до: а беременный Эдвардс, Кэтрин М.; Коххар, Сонали (2020). «Этика проведения клинических исследований в условиях вспышки» . Ежегодный обзор вирусологии . 7 (1): 475–494. doi : 10.1146/annurev-virology-013120-013123 . PMID 32212920 .
- ^ «Руководящие принципы Ninds по мониторингу в клинических испытаниях | Национальный институт неврологических расстройств и инсульта» . ninds.nih.gov . Архивировано из оригинала 9 января 2020 года . Получено 25 ноября 2019 года .
- ^ «Руководство по обучению совета по мониторингу данных и безопасности для исследований, инициированных исследователями-Tufts CTSI» . tuftsctsi.wpengine.com . 15 мая 2018 года. Архивировано с оригинала 7 апреля 2023 года . Получено 25 ноября 2019 года .
- ^ Проектирование и проведение клинических испытаний - обзор . Международный журнал статистики и медицинской информатики. 2019. ISBN 9781096489085 .
- ^ «Для пациентов: информированное согласие на клинические испытания» . Управление по контролю за продуктами и лекарствами США. 25 февраля 2016 года. Архивировано с оригинала 22 июля 2017 года . Получено 9 августа 2017 года .
- ^ Руководство по промышленности: раскрытие финансовой информации клиническими следователями , Управление по контролю за продуктами и лекарствами , 20 марта 2001 года, архивировано из оригинала 11 мая 2009 года , извлеченные 16 декабря 2019 года.
- ^ Ланг Т., Сирибаддана С. (2012). «Клинические испытания прошли глобальный: это хорошо?» Полем PLOS Medicine . 9 (6): E1001228. doi : 10.1371/journal.pmed.1001228 . PMC 3373653 . PMID 22719228 .
- ^ «Индия: основное место для неэтичных клинических испытаний» . Общие сны . Архивировано из оригинала 15 декабря 2007 года . Получено 16 декабря 2007 года .
- ^ фармацевтическое медицинское устройство Общая организация» PDF . «PMDA.GO.JP Независимое ) (
- ^ «Официальный веб -сайт ICH: ICH» . www.ich.org . Архивировано из оригинала 30 июня 2007 года.
- ^ «Управление информацией о безопасности из клинических испытаний: отчет о рабочей группе CIOMS VI» . Публикации CIOMS . 2005. Архивировано из оригинала 15 августа 2019 года . Получено 11 ноября 2017 года .
- ^ «Применение нового препарата (IND) - Окончательное правило: Новые требования к отчетности по безопасности лекарств для расследования для лекарств и биологических продуктов для человека и требований к отчетности о безопасности для биодоступности и биоэквивалентности у людей» . fda.gov . Центр оценки лекарств и исследований. 29 сентября 2010 года. Архивировано с оригинала 23 апреля 2019 года . Получено 11 ноября 2017 года .
- ^ «Руководство для требований отчетности по безопасности промышленности и следователей для Inds и BA/BE BE BE . Управление по контролю за продуктами и лекарствами =. Декабрь 2012 года. Архивировал (PDF) из оригинала 16 января 2019 года . Получено 11 ноября 2017 года .
- ^ «Оценка безопасности для Руководства по отчетности по безопасности IND для промышленности» (PDF) . Управление по контролю за продуктами и лекарствами. Декабрь 2015 года. Архивировал (PDF) из оригинала 4 мая 2017 года . Получено 11 ноября 2017 года .
- ^ «Синтез доказательств и метаанализ: отчет о рабочей группе CIOM X» . Публикации CIOMS. 2016. Архивировано с оригинала 15 августа 2019 года . Получено 11 ноября 2017 года .
- ^ Серткая, Айлин; Вонг, Хуи-Хсинг; Джессап, Эмбер; Белече, Тринидад (2016). «Ключевые драйверы фармацевтических клинических испытаний в Соединенных Штатах» . Клинические испытания . 13 (2): 117–126. doi : 10.1177/1740774515625964 . PMID 26908540 . S2CID 24308679 .
- ^ «Налоговый кредит на тестирование расходов на лекарства при редких заболеваниях или условиях» . Управление по контролю за продуктами и лекарствами . 17 апреля 2001 года. Архивировано из оригинала 6 апреля 2007 года . Получено 27 марта 2007 года .
- ^ Пол Дж, Сейб Р., Прескотт Т (март 2005 г.). «Интернет и клинические испытания: предыстория, онлайн -ресурсы, примеры и проблемы» . Журнал медицинского интернета . 7 (1): E5. doi : 10.2196/jmir.7.1.e5 . PMC 1550630 . PMID 15829477 .
- ^ Станкель, Линн; Грэди, Кристина (май 2011 г.). «Больше, чем деньги: обзор литературы, исследующей мотивы здоровых добровольцев» . Современные клинические испытания . 32 (3): 342–352. doi : 10.1016/j.cct.2010.12.003 . PMC 4943215 . PMID 21146635 .
- ^ Лю Дж.Дж., Дэвидсон Э., шейх А. (2011). «Достижение этнического разнообразия при наборе судебного разбирательства» . Pharm Med . 25 (4): 215–222. doi : 10.1007/bf03256863 . S2CID 19557355 . Архивировано из оригинала 14 ноября 2011 года.
- ^ Макдональд А.М., Найт Р.К., Кэмпбелл М.К., Энтвистл В.А., Грант А.М., Кук Дж., Элборн Д.Р., Фрэнсис Д., Гарсия Дж., Робертс I, Сноудон С (апрель 2006 г.). «Какое влияние влияет на найд на рандомизированные контролируемые испытания? Обзор испытаний, финансируемых двумя британскими финансирующими агентствами» . Испытания . 7 : 9. doi : 10.1186/1745-6215-7-9 . PMC 1475627 . PMID 16603070 .
- ^ «Волонтерство для клинического испытания» . Бостон, Массачусетс: Центр. 2016. Архивировано с оригинала 25 ноября 2016 года . Получено 26 ноября 2016 года .
- ^ «Разнообразие и включение в клинические испытания» . Nimhd . Архивировано с оригинала 18 марта 2023 года . Получено 9 декабря 2022 года .
- ^ Конкель, Линдси (2015). «Расовые и этнические различия в научных исследованиях: задача создания более разнообразных когорт» . Перспективы здоровья окружающей среды . 123 (12): A297 - A302. doi : 10.1289/ehp.123-A297 . ISSN 0091-6765 . PMC 4670264 . PMID 26625444 .
- ^ «Почти половина чернокожих пациентов с метастатическим раком молочной железы не сообщается о клинических испытаниях» . 6 августа 2022 года. Архивировано с оригинала 7 апреля 2023 года . Получено 7 апреля 2023 года .
- ^ Питтман, Коринн А.; Рура, Рауль; Прайс, Кэрри; Лин, Фрэнк Р.; Маррон, Николь; Ниман, Кэрри Л. (1 июля 2021 г.). «Расовые/этнические и половые представления в клинических испытаниях по утрате слуха у взрослых в США: систематический обзор» . Jama Otolaryngology - Head & Head Hurgery . 147 (7): 656–662. doi : 10.1001/jamaoto.2021.0550 . ISSN 2168-6181 . PMID 33885733 . S2CID 233351877 .
- ^ «Как остановить отсутствие разнообразия, подрывающего данные клинических испытаний» . Финансовые времена . 18 января 2019 года. Архивировано с оригинала 10 декабря 2022 года . Получено 26 февраля 2019 года .
- ^ «Клинические испытания болезни Паркинсона» . Fox Trial Finder . Получено 14 ноября 2013 года .
- ^ «Медицинская информация в Интернете» . Mlanet.org. Архивировано из оригинала 3 октября 2013 года . Получено 14 ноября 2013 года .
- ^ Кляйн, Гарри; Мазор, Тали; Зигель, Итан; Труханов, Павел; Оваль, Андреа; Веккио Фитц, Кэтрин Дель; Цвислер, Захари; Кумари, Прити; Ван дер Вин, Бернд; Марриотт, Эрик; Гансель, Джейсон; Ю, Джойс; Албайрак, Адем; Барри, Сьюзен; Келлер, Рэйчел Б.; MacConaill, Laura E.; Линдеман, Нил; Джонсон, Брюс Э.; Роллинс, Барретт Дж.; До, Хан Т.; Бердсли, Брайан; Шапиро, Джеффри; Гектор-Барри, Сюзанна; Метот, Джон; Шолл, Линетт; Линдсей, Джеймс; Хассетт, Майкл Дж.; Керами, Итан (6 октября 2022 г.). «Matchminer: платформа с открытым исходным кодом для прецизионной медицины рака» . NPJ точная онкология . 6 (1): 69. doi : 10.1038/s41698-022-00312-5 . ISSN 2397-768X . PMC 9537311 . PMID 36202909 .
- ^ Подпрыгнуть до: а беременный Ян З.Дж., МакМас К.А., Гей Г.К., Леонард Дж.П., Данненберг А.Дж., Диллон Х (2012). «Сравнение принятия решений между больными раком и населением в целом: мысли, эмоции или социальное влияние?». Журнал здравоохранения . 17 (4): 477–94. doi : 10.1080/10810730.2011.635774 . PMID 22376222 . S2CID 1344880 .
- ^ Подпрыгнуть до: а беременный «Что знать о программах соответствия клинических испытаний по раку» . Cancer.net . 14 марта 2023 года. Архивировано с оригинала 28 сентября 2023 года . Получено 26 декабря 2023 года .
- ^ Подпрыгнуть до: а беременный «Как искать клинические исследования» . Clinicaltrials.gov, Национальная библиотека медицины США. 2023. Архивировано с оригинала 26 декабря 2023 года . Получено 26 декабря 2023 года .
- ^ Fountzilas E, Tsimberidou AM, Vo HH, Kurzrock R (август 2022). «Конструкция клинических испытаний в эпоху точной медицины» . Медицина генома . 14 (1): 101. doi : 10.1186/s13073-022-01102-1 . PMC 9428375 . PMID 36045401 .
- ^ Fleury Me (2023). «Консенсусные рекомендации по улучшению рака клинических испытаний, соответствующих окружающей среде» . Рак . 130 (1): 11–15. doi : 10.1002/cncr.35034 . PMID 37851508 .
- ^ Петрини, Карло (15 декабря 2022 года). «Децентрализованные клинические испытания (DCT): несколько этических соображений» . Передний. Общественное здравоохранение . 10 doi : 10.3389/fpubh.2022.1081150 . PMC 9797802 . PMID 36590004 .
- ^ Ван Норман, Джорджия (27 апреля 2021 г.). «Децентрализованные клинические испытания» . JACC: Основная к трансляционной науке . 6 (4): 384–387. doi : 10.1016/j.jacbts.2021.01.011 . PMC 8093545 . PMID 33997523 .
Внешние ссылки
[ редактировать ]- Международная конференция по гармонизации технических требований для регистрации фармацевтических препаратов для использования человека , руководство по регулированию клинических испытаний
- Clinicaltrials.gov, всемирная база данных зарегистрированных клинических испытаний ; Национальная библиотека медицины США
- Кокрановский центральный реестр контролируемых испытаний (центральный) ; Концентрированный источник библиографических отчетов о рандомизированных контролируемых исследованиях
- Clinicaltrials.EU, Европейская информационная сеть клинических испытаний ; Клинические испытания легко понялись.