Основной прионный белок
| ПрНП | |||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | PRNP , ASCR, AltPrP, CD230, CJD, GSS, KURU, PRIP, PrP, PrP27-30, PrP33-35C, PrPc, p27-30, прионный белок | ||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | ОМИМ : 176640 ; МГИ : 97769 ; Гомологен : 7904 ; GeneCards : PRNP ; ОМА : PRNP — ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
Основной прионный белок ( PrP ) в организме человека кодируется PRNP, геном также известным как CD230 ( кластер дифференцировки 230). [5] [6] [7] [8] Экспрессия белка наиболее преобладает в нервной системе , но происходит и во многих других тканях организма. [9] [10] [11]
Белок может существовать в нескольких изоформах : нормальный PrP С форму, а устойчивую к протеазе форму, обозначенную PrP. Рез такие как вызывающий заболевание PrP наук (скрэпи) и изоформа, расположенная в митохондриях . Неправильно сложенная версия PrP наук связан с различными когнитивными расстройствами и нейродегенеративными заболеваниями, такими как у животных: овец скрепи , губчатая энцефалопатия крупного рогатого скота (ГЭКРС, коровье бешенство), губчатая энцефалопатия кошек , трансмиссивная энцефалопатия норок (ТМЕ), экзотическая энцефалопатия копытных , хроническая истощающая болезнь (ХИБ). ), который поражает оленей ; и у людей: болезнь Крейтцфельдта-Якоба (БКЯ), фатальная семейная бессонница (ФФИ), синдром Герстмана-Штраусслера-Шейнкера (ГСС), куру и вариант болезни Крейтцфельдта-Якоба (вБКЯ). Существует сходство между куру, которое, как полагают, возникает в результате употребления человеком в пищу больных людей, и vCJD, которое, как считается, возникает в результате употребления человеком продуктов крупного рогатого скота, зараженных ГЭКРС.
Ген
[ редактировать ]
человека Ген PRNP расположен на коротком (p) плече хромосомы 20 между концом (концом) плеча и позицией 13, от пары оснований 4 615 068 до пары оснований 4 630 233.
Структура
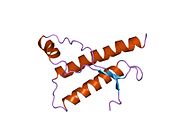
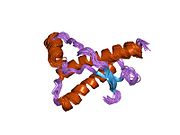
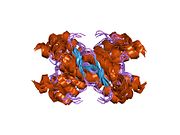
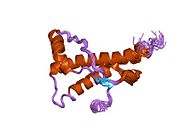
[ редактировать ]PrP высоко консервативен у млекопитающих, что подтверждает выводы, полученные на подопытных животных, таких как мыши. [12] Сравнение между приматами особенно похоже: сходство аминокислотных последовательностей варьируется от 92,9 до 99,6% . Структура белка человека состоит из глобулярного домена с тремя α-спиралями и двухцепочечным антипараллельным β-листом , NH2 - концевого хвоста и короткого COOH -концевого хвоста. [13] Мембранный гликофосфатидилинозитол ( GPI ) закрепляется на COOH-конце, привязывая PrP к клеточным мембранам , и это оказывается неотъемлемой частью передачи конформационных изменений; секретируемый PrP, лишенный якорного компонента, не подвержен влиянию инфекционной изоформы. [14]
Первичная последовательность PrP состоит из 253 аминокислот задолго до посттрансляционной модификации . Сигнальные последовательности на амино- и карбокси -концах удаляются посттрансляционно, в результате чего зрелая длина составляет 208 аминокислот. человека и золотистого хомячка Для PrP на спиралях 2 и 3 существуют два гликозилированных сайта: Asn 181 и Asn197. Мышиный PrP имеет сайты гликозилирования Asn180 и Asn196. Дисульфидная человека связь существует между Cys 179 второй спирали и Cys214 третьей спирали (PrP С нумерация).
PrP Информационная РНК содержит структуру псевдоузла ( прионный псевдоузел ), который, как полагают, участвует в регуляции трансляции белка PrP . [15]
Лиганд-связывание
[ редактировать ]Предполагается, что механизмом конформационного преобразования в изоформу скрепи является неуловимый белок- лиганд , но до сих пор такое соединение не было идентифицировано. Тем не менее, было проведено большое количество исследований кандидатов и их взаимодействия с PrP. С . [16]
Медь , цинк , марганец и никель являются подтвержденными лигандами PrP, которые связываются с его октарепатовой областью. [17] Связывание лиганда вызывает конформационные изменения с неизвестным эффектом. Связывание тяжелых металлов с помощью PrP связано с устойчивостью к окислительному стрессу, возникающему в результате токсичности тяжелых металлов . [17] [18]
ПрП С (нормальная клеточная) изоформа
[ редактировать ]Точная функция PrP пока неизвестна. Он может играть роль в транспортировке ионной меди в клетки из окружающей среды. Исследователи также предположили роль PrP в передаче сигналов клетками или в формировании синапсов . [19] ПрП С прикрепляется к внешней поверхности клеточной мембраны с помощью гликозилфосфатидилинозитолового якоря на С-концевом Ser 231.
Прионный белок содержит пять октапептидных повторов с последовательностью PHGGGWGQ (хотя первый повтор имеет слегка модифицированную последовательность с дефицитом гистидина PQGGGGWGQ). Считается, что это приводит к образованию медь- связывающего домена за счет атомов азота в гистидинимидазола боковых цепях и депротонированных амидных атомов азота из 2-го и 3-го глицинов в повторе. Таким образом, способность связывать медь зависит от pH . ЯМР показывает, что связывание меди приводит к конформационным изменениям на N-конце .
ПрП наук (скрэпи) изоформа
[ редактировать ]ПрП наук представляет собой конформационную изоформу PrP С , но эта ориентация имеет тенденцию накапливаться в компактных, устойчивых к протеазам агрегатах внутри нервной ткани. [20] Аномальный ПрП наук отличную изоформа имеет вторичную и третичную структуру, от PrP. С , но идентичная первичная последовательность. Тогда как ПрП С имеет в основном альфа-спиральные и неупорядоченные домены, [21] ПрП наук не имеет альфа-спирали и имеет ядро амилоидных фибрилл, состоящее из стопки молекул PrP, склеенных параллельными межмолекулярными бета-листами в рядах. [22] [23] [24] Эта рефолдинг превращает PrP наук изоформа чрезвычайно устойчива к протеолизу .
Распространение ПрП наук представляет большой интерес, так как его накопление является патологической причиной нейродегенерации . Основываясь на прогрессирующем характере губчатых энцефалопатий, преобладающая гипотеза утверждает, что изменение ПрП по сравнению с нормальным С вызвано присутствием и взаимодействием с PrP наук . [25] Сильное подтверждение этому получено в исследованиях, в которых мыши с нокаутом PRNP устойчивы к введению PrP. наук . [26] Несмотря на широкое признание гипотезы конформации конформации, некоторые исследования опровергают утверждения о прямой связи между PrP наук и цитотоксичность . [27]
Полиморфизмы в сайтах 136, 154 и 171 связаны с различной восприимчивостью к скрепи овец . (Эти сайты овцы соответствуют человеческим сайтам 133, 151 и 168.) Полиморфизмы формы PrP-VRQ и формы PrP-ARQ связаны с повышенной восприимчивостью, тогда как PrP-ARR связан с устойчивостью. Национальный план Великобритании по скрепи направлен на выведение этих полиморфизмов скрепи за счет увеличения частоты устойчивых аллелей. [28] Однако полиморфизмы PrP-ARR восприимчивы к атипичному скрепи, поэтому это может оказаться бесплодным.
Функция
[ редактировать ]Нервная система
[ редактировать ]Тесная связь с нейродегенеративными заболеваниями поднимает множество вопросов о функции PrP в мозге. Распространенный подход заключается в использовании PrP-нокаутных и трансгенных мышей для исследования недостатков и различий. [29] Первоначальные попытки привели к появлению двух линий мышей с нулевым уровнем PrP, которые не показали никаких физиологических различий или различий в развитии при проведении ряда тестов. Однако более поздние штаммы показали значительные когнитивные нарушения. [16]
По мере старения нулевых мышей заметная потеря клеток Пуркинье в мозжечке приводит к снижению координации движений. Однако этот эффект не является прямым результатом отсутствия PrP, а скорее возникает из-за повышенной экспрессии гена Doppel . [30] Другие наблюдаемые различия включают снижение реакции на стресс и более активное исследование новой среды. [31] [32]
Циркадный ритм изменен у нулевых мышей. [11] Считается, что фатальная семейная бессонница является результатом точечной мутации кодона 178 PRNP , что подтверждает участие PrP в циклах сна-бодрствования. [33] Кроме того, циркадная регуляция была продемонстрирована в мРНК PrP, которая регулярно циклически сменяет день и ночь. [34]
Память
[ редактировать ]Хотя нулевые мыши демонстрируют нормальную способность к обучению и кратковременную память , долговременной памяти был продемонстрирован дефицит консолидации . Как и в случае с атаксией , это связано с экспрессией гена Доппель. Однако пространственное обучение , преимущественно функция гиппокампа, снижается у нулевых мышей и может быть восстановлено с восстановлением PrP в нейронах; это указывает на то, что причиной является потеря функции PrP. [35] [36] Взаимодействие PrP гиппокампа с ламинином (LN) имеет решающее значение для обработки памяти и, вероятно, модулируется киназами PKA и ERK1/2. [37] [38]
Дальнейшее подтверждение роли PrP в формировании памяти получено в нескольких популяционных исследованиях. Тест на здоровых молодых людях показал увеличение способности долговременной памяти, связанной с генотипом MM или MV, по сравнению с VV. [39] Пациенты с синдромом Дауна с единственной заменой валина были связаны с более ранним снижением когнитивных функций. [40] Некоторые полиморфизмы PRNP . связаны с когнитивными нарушениями у пожилых людей, а также с более ранним снижением когнитивных функций [41] [42] [43] Во всех этих исследованиях изучались различия в кодоне 129, что указывает на его важность в общей функциональности PrP, в частности в отношении памяти.
Нейроны и синапсы
[ редактировать ]PrP присутствует как в пре-, так и в постсинаптическом отделе, с наибольшей концентрацией в пресинаптической части. [44] Учитывая это, а также набор поведенческих влияний PrP, функции и взаимодействия нервных клеток представляют особый интерес. Одна предложенная функция, основанная на медном лиганде, представляет PrP как медный буфер для синаптической щели . В этой роли белок может служить либо механизмом гомеостаза меди , модулятором кальция, либо сенсором меди или окислительного стресса. [45] Потеря функции PrP связана с долговременной потенциацией (LTP). Этот эффект может быть положительным или отрицательным и обусловлен изменением возбудимости нейронов и синаптической передачи в гиппокампе . [46] [47]
Некоторые исследования указывают на участие PrP в развитии, дифференцировке и росте нейритов нейронов . Путь передачи сигнала, активируемый PrP, связан с разрастанием аксонов и дендритов с помощью ряда киназ. [27] [48]
Иммунная система
[ редактировать ]Хотя наибольшее внимание уделяется присутствию PrP в нервной системе, его также много в тканях иммунной системы. Иммунные клетки PrP включают гемопоэтические стволовые клетки, зрелые лимфоидные и миелоидные компартменты и некоторые лимфоциты ; кроме того, он был обнаружен в естественных клетках-киллерах , тромбоцитах и моноцитах . Активация Т-клеток сопровождается сильным усилением PrP, хотя это и не является обязательным. Отсутствие иммунного ответа на трансмиссивные губчатые энцефалопатии (TSE), нейродегенеративные заболевания, вызываемые прионами, может быть связано с толерантностью к PrP. наук . [49]
Мышцы, печень и гипофиз
[ редактировать ]Мыши с нулевым уровнем PrP дают ключ к пониманию роли в мышечной физиологии, когда их подвергают тесту на принудительное плавание, который показал снижение двигательной активности. У стареющих мышей со сверхэкспрессией PRNP наблюдалась значительная деградация мышечной ткани.
Несмотря на его присутствие, в печени присутствуют очень низкие уровни PrP, что может быть связано с фиброзом печени. Было показано, что присутствие PrP в гипофизе влияет на нейроэндокринную функцию у амфибий, но о гипофизе млекопитающих мало что известно. [16]
Сотовая связь
[ редактировать ]Изменение экспрессии PrP в клеточном цикле привело к предположениям об его участии в развитии. Был проведен широкий спектр исследований по изучению роли в пролиферации, дифференцировке, гибели и выживании клеток. [16] Участие PrP связано с активацией передачи сигнала .
Модуляция путей передачи сигнала была продемонстрирована при перекрестном связывании с антителами и связывании лиганда (hop/STI1 или медь). [16] Учитывая разнообразие взаимодействий, эффектов и распределения, PrP был предложен как динамический поверхностный белок, функционирующий в сигнальных путях. Определенные участки белка связывают другие белки, биомолекулы и металлы. Эти интерфейсы позволяют определенным наборам клеток взаимодействовать в зависимости от уровня экспрессии и окружающей микросреды. Закрепление на рафте GPI в липидном бислое подтверждает утверждения о функции внеклеточного каркаса . [16]
Заболевания, вызванные неправильным сворачиванием PrP
[ редактировать ]более 20 мутаций гена PRNP выявлено У людей с наследственными прионными заболеваниями , к которым относятся следующие: [50] [51]
- Болезнь Крейцфельдта-Якоба - глутаминовая кислота -200 заменена лизином , а валин присутствует в аминокислоте 129.
- Синдром Герстмана-Штраусслера-Шейнкера - обычно изменение кодона 102 с пролина на лейцин. [52]
- фатальная семейная бессонница - аспарагиновая кислота -178 заменена аспарагином , а метионин присутствует в аминокислоте 129. [53]
Конверсия ПрП С к ПрП наук Конформация является механизмом передачи фатальных нейродегенеративных трансмиссивных губчатых энцефалопатий (TSE). Это может возникнуть из-за генетических факторов, инфекции из внешнего источника или спонтанно по неизвестным причинам. Накопление ПрП наук соответствует прогрессированию нейродегенерации и является предполагаемой причиной. Некоторые мутации PRNP приводят к изменению отдельных аминокислот (строительных блоков белков) в прионном белке. Другие вставляют в белок дополнительные аминокислоты или вызывают образование аномально короткого белка. Эти мутации заставляют клетку вырабатывать прионные белки с аномальной структурой. Аномальный белок PrP наук накапливается в мозге и разрушает нервные клетки, что приводит к психическим и поведенческим особенностям прионных заболеваний.
Некоторые другие изменения в гене PRNP (называемые полиморфизмами) не вызывают прионных заболеваний, но могут повлиять на риск развития этих заболеваний у человека или изменить течение заболеваний. Аллель , кодирующая вариант PRNP, G127V, обеспечивает устойчивость к куру . [54]
Кроме того, некоторые прионные заболевания могут передаваться от внешних источников PrP. наук . [55]
- Скрепи - смертельное нейродегенеративное заболевание овец, не передающееся человеку.
- Губчатая энцефалопатия крупного рогатого скота (коровье бешенство) – смертельное нейродегенеративное заболевание коров, которое может передаваться человеку при проглатывании тканей головного, спинного мозга или пищеварительного тракта инфицированной коровы.
- Куру – ТГЭ у человека, передающийся через погребальный каннибализм. Как правило, пострадавшим членам семьи по традиции давали части центральной нервной системы в соответствии с ритуалом при употреблении в пищу умерших членов семьи.
болезнь Альцгеймера
[ редактировать ]ПрП С Белок является одним из нескольких клеточных рецепторов растворимых олигомеров бета-амилоида (Aβ), которые канонически участвуют в возникновении болезни Альцгеймера . [56] Эти олигомеры состоят из более мелких бляшек Aβ и наиболее повреждают целостность нейрона . [56] Точный механизм того, что растворимые олигомеры Aβ непосредственно вызывают нейротоксичность , неизвестен, а экспериментальное удаление PRNP у животных дало несколько противоречивых результатов. Когда олигомеры Aβ вводили в желудочки головного мозга мышиной модели болезни Альцгеймера, делеция PRNP не обеспечивала защиты, а обеспечивала только защиту от PrP. С антитела предотвращали дефицит долговременной памяти и пространственного обучения . [57] [58] Это предполагает либо неравную связь между PRNP и нейродегенерацией , опосредованной олигомером Aβ , либо сайт-специфическую реляционную значимость. В случае прямого введения олигомеров Aβ в гиппокамп мыши , нокаутные по PRNP, оказались неотличимы от контроля как по уровню гибели нейронов, так и по измерениям синаптической пластичности . [56] [58] Далее было обнаружено, что Aβ-олигомеры связываются с PrP. С на постсинаптической плотности , косвенно гиперактивируя рецептор NMDA через фермент Fyn , что приводит к эксайтотоксичности . [57] Растворимые олигомеры Aβ также связываются с PrP. С в дендритных шипиках , образуя комплекс с Fyn и чрезмерно активируя тау , еще один белок, участвующий в развитии болезни Альцгеймера. [57] Поскольку ген FYN кодирует фермент Fyn, у мышей с нокаутом по FYN не наблюдаются ни эксайтотоксические явления, ни сморщивание дендритных шипов при инъекции олигомеров Aβ. [57] У млекопитающих полное функциональное значение PRNP остается неясным, поскольку удаление PRNP было профилактически реализовано в животноводстве без видимого вреда. [56] У мышей эта же делеция фенотипически варьируется между линиями мышей с болезнью Альцгеймера, поскольку мыши hAPPJ20 и мыши TgCRND8 демонстрируют небольшое увеличение эпилептической активности, что способствует противоречивым результатам при изучении выживаемости при болезни Альцгеймера. [56] Следует отметить, что удаление PRNP как в APPswe, так и в SEN1dE9, двух других трансгенных моделях болезни Альцгеймера, ослабило фенотип смерти, вызванный эпилепсией, наблюдаемый у части этих животных. [56] В совокупности недавние данные свидетельствуют о том, что PRNP может иметь важное значение для обеспечения нейротоксических эффектов растворимых Aβ-олигомеров и развития развивающейся болезни Альцгеймера. [56] [57] [58]
У людей метионин / валин полиморфизм в кодоне 129 PRNP (rs1799990) наиболее тесно связан с болезнью Альцгеймера. [59] варианта V Носители аллеля (VV и MV) демонстрируют снижение риска развития болезни Альцгеймера на 13% по сравнению с гомозиготой по метионину (MM). Однако защитные эффекты носителей варианта V были обнаружены исключительно у европеоидов . Снижение риска у носителей аллеля V ограничивается только болезнью Альцгеймера с поздним началом (≥ 65 лет). [59] PRNP также может функционально взаимодействовать с полиморфизмами двух других генов, участвующих в развитии болезни Альцгеймера, PSEN1 и APOE , что усугубляет риск как болезни Альцгеймера, так и спорадической болезни Крейцфельдта-Якоба . [56] Точечная мутация кодона 102 PRNP, по крайней мере частично, способствовала развитию атипичной лобно-височной деменции у трех отдельных пациентов в одной семье, что указывает на новый фенотип синдрома Герстмана-Штраусслера-Шейнкера . [56] [60] В том же исследовании было предложено секвенирование PRNP в случаях неоднозначно диагностированной деменции, поскольку различные формы деменции могут оказаться сложными для дифференциальной диагностики . [60]
Исследовать
[ редактировать ]В 2006 году производство крупного рогатого скота без ПрП С Сообщалось о форме белка основного прионного белка (PrP), которая была устойчива к размножению прионов без видимых аномалий развития. Помимо изучения продуктов крупного рогатого скота, не содержащих прионных белков, можно было бы использовать и другие фармацевтические препараты для человека, используя их кровь без опасности заражения этих продуктов инфекционным агентом, вызывающим коровье бешенство. [61] [62]
Взаимодействия
[ редактировать ]существует сильное взаимодействие . Между PrP и кошапероном Hop ( организующим белком Hsp70 / Hsp90 ; также называемым STI1 (стресс-индуцированный белок 1)) [63] [64]
Ссылки
[ редактировать ]- ^ Jump up to: а б с GRCh38: Версия Ensembl 89: ENSG00000171867 – Ensembl , май 2017 г.
- ^ Jump up to: а б с GRCm38: выпуск Ensembl 89: ENSMUSG00000079037 – Ensembl , май 2017 г.
- ^ «Ссылка на Human PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Ссылка на Mouse PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ Кречмар Х.А., Стоуринг Л.Е., Вестэуэй Д., Стабблбайн В.Х., Прусинер С.Б., Дирмонд С.Дж. (август 1986 г.). «Молекулярное клонирование кДНК прионного белка человека». ДНК . 5 (4): 315–324. дои : 10.1089/dna.1986.5.315 . ПМИД 3755672 .
- ^ Спаркс Р.С., Саймон М., Кон В.Х., Фурнье Р.Э., Лем Дж., Клисак И. и др. (октябрь 1986 г.). «Отнесение генов прионного белка человека и мыши к гомологичным хромосомам» . Труды Национальной академии наук Соединенных Штатов Америки . 83 (19): 7358–7362. Бибкод : 1986PNAS...83.7358S . дои : 10.1073/pnas.83.19.7358 . ПМЦ 386716 . ПМИД 3094007 .
- ^ Ляо Ю.К., Лебо Р.В., Клоусон Г.А., Смаклер Э.А. (июль 1986 г.). «КДНК прионного белка человека: молекулярное клонирование, хромосомное картирование и биологические последствия». Наука . 233 (4761): 364–367. Бибкод : 1986Sci...233..364L . дои : 10.1126/science.3014653 . ПМИД 3014653 .
- ^ Робакис Н.К., Девайн-Гейдж Э.А., Дженкинс Э.К., Касчак Р.Дж., Браун В.Т., Кравчун М.С., Сильверман В.П. (октябрь 1986 г.). «Локализация человеческого гена, гомологичного гену PrP, на плече хромосомы 20 и обнаружение антигенов, связанных с PrP, в нормальном человеческом мозге». Связь с биохимическими и биофизическими исследованиями . 140 (2): 758–765. дои : 10.1016/0006-291X(86)90796-5 . ПМИД 2877664 .
- ^ Прусинер С.Б. (май 2001 г.). «Лекция Шаттука - нейродегенеративные заболевания и прионы» . Медицинский журнал Новой Англии . 344 (20): 1516–1526. дои : 10.1056/NEJM200105173442006 . ПМИД 11357156 .
- ^ Вайсманн С. (ноябрь 2004 г.). «Состояние приона». Обзоры природы. Микробиология . 2 (11): 861–871. дои : 10.1038/nrmicro1025 . ПМИД 15494743 . S2CID 20992257 .
- ^ Jump up to: а б Зомоса-Синьоре В., Арно Ж.Д., Фонтес П., Альварес-Мартинес М.Т., Лиотар Ж.П. (2008). «Физиологическая роль клеточного белка-приона» . Ветеринарное исследование . 39 (4): 9. doi : 10.1051/vetres:2007048 . ПМИД 18073096 .
- ^ Дамбергер Ф.Ф., Кристен Б., Перес Д.Р., Хорнеманн С., Вютрих К. (октябрь 2011 г.). «Конформация и функция клеточного прионного белка» . Труды Национальной академии наук Соединенных Штатов Америки . 108 (42): 17308–17313. Бибкод : 2011PNAS..10817308D . дои : 10.1073/pnas.1106325108 . ПМК 3198368 . ПМИД 21987789 .
- ^ Шецль Х.М., Да Коста М., Тейлор Л., Коэн Ф.Е., Прусинер С.Б. (январь 1995 г.). «Вариации гена прионного белка у приматов». Журнал молекулярной биологии . 245 (4): 362–374. дои : 10.1006/jmbi.1994.0030 . ПМИД 7837269 .
- ^ Чесебро Б., Трифило М., Рэйс Р., Мид-Уайт К., Тенг С., Лакасс Р. и др. (июнь 2005 г.). «Безанкорный прионный белок приводит к инфекционному амилоидному заболеванию без клинического скрепи». Наука . 308 (5727): 1435–1439. Бибкод : 2005Sci...308.1435C . CiteSeerX 10.1.1.401.781 . дои : 10.1126/science.1110837 . ПМИД 15933194 . S2CID 10064966 .
- ^ Барретт I, Пуассон Дж., Гендрон П., Майор Ф. (февраль 2001 г.). «Псевдоузлы в мРНК прионного белка, подтвержденные сравнительным анализом последовательностей и поиском закономерностей» . Исследования нуклеиновых кислот . 29 (3): 753–758. дои : 10.1093/нар/29.3.753 . ПМК 30388 . ПМИД 11160898 .
- ^ Jump up to: а б с д и ж Линден Р., Мартинс В.Р., Прадо М.А., Каммарота М., Искьердо И., Брентани Р.Р. (апрель 2008 г.). «Физиология прионного белка». Физиологические обзоры . 88 (2): 673–728. doi : 10.1152/physrev.00007.2007 . ПМИД 18391177 .
- ^ Jump up to: а б Прчина М, Концекова Е, Новак М (июнь 2015 г.). «Прионный белок предотвращает перегрузку клеток тяжелыми металлами и, таким образом, защищает их от их токсичности» . Акта вирусологика . 59 (2): 179–184. дои : 10.4149/av_2015_02_179 . ПМИД 26104335 .
- ^ Браун Д.Р., Клайв С., Хасуэлл С.Дж. (январь 2001 г.). «Антиоксидантная активность, связанная со связыванием меди нативным прионным белком» . Журнал нейрохимии . 76 (1): 69–76. дои : 10.1046/j.1471-4159.2001.00009.x . ПМИД 11145979 . S2CID 45647133 .
- ^ Канаани Дж., Прусинер С.Б., Дьяково Дж., Беккесков С., Легнаме Дж. (декабрь 2005 г.). «Рекомбинантный прионный белок индуцирует быструю поляризацию и развитие синапсов в нейронах эмбрионального гиппокампа крысы in vitro» . Журнал нейрохимии . 95 (5): 1373–1386. дои : 10.1111/j.1471-4159.2005.03469.x . ПМИД 16313516 . S2CID 24329326 .
- ^ Росс Калифорния, Пуарье Массачусетс (июль 2004 г.). «Агрегация белков и нейродегенеративные заболевания». Природная медицина . 10 (7 доп.): С10–С17. дои : 10.1038/нм1066 . ПМИД 15272267 . S2CID 205383483 .
- ^ Риек Р., Хорнеманн С., Видер Г., Глокшубер Р., Вютрих К. (август 1997 г.). «ЯМР-характеристика полноразмерного рекомбинантного мышиного прионного белка, mPrP (23-231)» (PDF) . Письма ФЭБС . 413 (2): 282–288. Бибкод : 1997FEBSL.413..282R . дои : 10.1016/S0014-5793(97)00920-4 . ПМИД 9280298 . S2CID 39791520 .
- ^ Краус А., Хойт Ф., Шварц К.Л., Хансен Б., Артикис Е., Хьюсон А.Г. и др. (ноябрь 2021 г.). «Структура высокого разрешения и сравнение штаммов инфекционных прионов млекопитающих». Молекулярная клетка . 81 (21): 4540–4551.e6. doi : 10.1016/j.molcel.2021.08.011 . ПМИД 34433091 .
- ^ Манка С.В., Чжан В., Венборн А., Беттс Дж., Джойнер С., Сайбил Х.Р. и др. (июль 2022 г.). «Крио-ЭМ структура 2,7 Å прионных фибрилл ex vivo RML» . Природные коммуникации . 13 (1): 4004. Бибкод : 2022NatCo..13.4004M . дои : 10.1038/s41467-022-30457-7 . ПМЦ 9279362 . ПМИД 35831275 .
- ^ Хойт Ф., Стендке Х.Г., Артикис Е., Шварц К.Л., Хансен Б., Ли К. и др. (июль 2022 г.). «Крио-ЭМ-структура приона RML без якоря обнаруживает различия в общих мотивах между отдельными штаммами» . Природные коммуникации . 13 (1): 4005. Бибкод : 2022NatCo..13.4005H . дои : 10.1038/s41467-022-30458-6 . ПМЦ 9279418 . ПМИД 35831291 .
- ^ Сандберг М.К., Аль-Дуджайли Х., Шарпс Б., Кларк А.Р., Коллиндж Дж. (февраль 2011 г.). «Распространение прионов и токсичность in vivo происходят в две отдельные механистические фазы». Природа . 470 (7335): 540–542. Бибкод : 2011Natur.470..540S . дои : 10.1038/nature09768 . ПМИД 21350487 . S2CID 4399936 .
- ^ Бюлер Х., Агуцци А., Зайлер А., Грейнер Р.А., Аутенрид П., Аге М., Вайсманн С. (июль 1993 г.). «Мыши, лишенные PrP, устойчивы к скрепи» . Клетка . 73 (7): 1339–1347. дои : 10.1016/0092-8674(93)90360-3 . ПМИД 8100741 .
- ^ Jump up to: а б Агуцци А., Бауманн Ф., Бремер Дж. (2008). «Неуловимая причина существования приона». Ежегодный обзор неврологии . 31 : 439–477. дои : 10.1146/annurev.neuro.31.060407.125620 . ПМИД 18558863 .
- ^ Аткинсон М. (октябрь 2001 г.). «Национальный план скрепи». Ветеринарный журнал . 149 (15): 462. PMID 11688751 .
- ^ Вайсманн С., Флехсиг Э. (2003). «Нокаут PrP и трансгенные мыши PrP в исследованиях прионов» . Британский медицинский бюллетень . 66 : 43–60. дои : 10.1093/bmb/66.1.43 . ПМИД 14522848 .
- ^ Катамин С., Нисида Н., Сугимото Т., Нода Т., Сакагути С., Сигемацу К. и др. (декабрь 1998 г.). «Нарушение координации движений у мышей, лишенных прионного белка». Клеточная и молекулярная нейробиология . 18 (6): 731–742. дои : 10.1023/А:1020234321879 . ПМИД 9876879 . S2CID 23409873 .
- ^ Нико П.Б., де-Пари Ф., Винадэ Э.Р., Амарал О.Б., Рокенбах И., Соарес Б.Л. и др. (июль 2005 г.). «Измененная поведенческая реакция на острый стресс у мышей, у которых отсутствует клеточный прионный белок». Поведенческие исследования мозга . 162 (2): 173–181. дои : 10.1016/j.bbr.2005.02.003 . ПМИД 15970215 . S2CID 37511702 .
- ^ Рослер Р., Уолц Р., Кеведо Дж., де-Пари Ф., Заната С.М., Гранер Э. и др. (август 1999 г.). «Нормальное обучение избеганию торможения и тревога, но повышенная двигательная активность у мышей, лишенных PrP (C)». Исследования мозга. Молекулярные исследования мозга . 71 (2): 349–353. дои : 10.1016/S0169-328X(99)00193-X . ПМИД 10521590 .
- ^ Медори Р., Тричлер Х.Дж., ЛеБлан А., Вилларе Ф., Манетто В., Чен Х.И. и др. (февраль 1992 г.). «Фатальная семейная бессонница, прионное заболевание с мутацией в кодоне 178 гена прионного белка» . Медицинский журнал Новой Англии . 326 (7): 444–449. дои : 10.1056/NEJM199202133260704 . ПМК 6151859 . ПМИД 1346338 .
- ^ Кагампанг Ф.Р., Уотли С.А., Митчелл А.Л., Пауэлл Дж.Ф., Кэмпбелл И.С., Коэн К.В. (1999). «Циркадная регуляция информационной РНК прионного белка в переднем мозге крыс: широко распространенный и синхронный ритм». Нейронаука . 91 (4): 1201–1204. дои : 10.1016/S0306-4522(99)00092-5 . ПМИД 10391428 . S2CID 42892475 .
- ^ Криадо Дж.Р., Санчес-Алавес М., Конти Б., Джаккино Дж.Л., Уиллс Д.Н., Хенриксен С.Дж. и др. (2005). «Мыши, лишенные прионного белка, имеют когнитивные нарушения, которые устраняются восстановлением PrP в нейронах». Нейробиология болезней . 19 (1–2): 255–265. дои : 10.1016/j.nbd.2005.01.001 . ПМИД 15837581 . S2CID 2618712 .
- ^ Бальдуччи С., Бег М., Стравалачи М., Бастон А., Склип А., Биазини Е. и др. (февраль 2010 г.). «Синтетические олигомеры бета-амилоида ухудшают долговременную память независимо от клеточного прионного белка» . Труды Национальной академии наук Соединенных Штатов Америки . 107 (5): 2295–2300. Бибкод : 2010PNAS..107.2295B . дои : 10.1073/pnas.0911829107 . ПМК 2836680 . ПМИД 20133875 .
- ^ Коитиньо А.С., Фрейтас А.Р., Лопес М.Х., Хадж Г.Н., Рослер Р., Уолц Р. и др. (декабрь 2006 г.). «Взаимодействие между прионным белком и ламинином модулирует консолидацию памяти». Европейский журнал неврологии . 24 (11): 3255–3264. дои : 10.1111/j.1460-9568.2006.05156.x . ПМИД 17156386 . S2CID 17164351 .
- ^ Шортер Дж., Линдквист С. (июнь 2005 г.). «Прионы как адаптивные проводники памяти и наследования». Обзоры природы. Генетика . 6 (6): 435–450. дои : 10.1038/nrg1616 . ПМИД 15931169 . S2CID 5575951 .
- ^ Папасситиропулос А., Воллмер М.А., Агуцци А., Хок С., Нитш Р.М., де Кервен DJ (август 2005 г.). «Ген приона связан с долговременной памятью человека» . Молекулярная генетика человека . 14 (15): 2241–2246. дои : 10.1093/hmg/ddi228 . ПМИД 15987701 .
- ^ Дель Бо Р., Коми ГП, Джорда Р., Крими М., Локателли Ф., Мартинелли-Бонески Ф. и др. (июнь 2003 г.). «Полиморфизм 129 кодонов гена прионного белка влияет на более ранние когнитивные способности у субъектов с синдромом Дауна». Журнал неврологии . 250 (6): 688–692. дои : 10.1007/s00415-003-1057-5 . ПМИД 12796830 . S2CID 21049364 .
- ^ Берр С., Ришар Ф., Дюфуй С., Амант С., Альперович А., Амуэль П. (сентябрь 1998 г.). «Полиморфизм прионного белка связан с когнитивными нарушениями у пожилых людей: исследование EVA». Неврология . 51 (3): 734–737. дои : 10.1212/wnl.51.3.734 . ПМИД 9748018 . S2CID 11352163 .
- ^ Кроес Э.А., Дермаут Б., Хаувинг-Дуистермаат Дж.Дж., Ван ден Брук М., Крутс М., Бретелер М.М. и др. (август 2003 г.). «Раннее снижение когнитивных функций связано с полиморфизмом кодона 129 прионного белка». Анналы неврологии . 54 (2): 275–276. дои : 10.1002/ана.10658 . ПМИД 12891686 . S2CID 31538672 .
- ^ Качивала С.Дж., Харрис С.Э., Райт А.Ф., Хейворд С., Старр Дж.М., Уолли Л.Дж., Дири И.Дж. (сентябрь 2005 г.). «Генетические влияния на окислительный стресс и их связь с нормальным когнитивным старением». Письма по неврологии . 386 (2): 116–120. дои : 10.1016/j.neulet.2005.05.067 . ПМИД 16023289 . S2CID 23642220 .
- ^ Хермс Дж., Тингс Т., Галл С., Мадлунг А., Гизе А., Зиберт Х. и др. (октябрь 1999 г.). «Доказательства пресинаптического расположения и функции прионного белка» . Журнал неврологии . 19 (20): 8866–8875. doi : 10.1523/JNEUROSCI.19-20-08866.1999 . ПМК 6782778 . ПМИД 10516306 .
- ^ Кардос Дж., Ковач И., Хайош Ф., Кальман М., Симони М. (август 1989 г.). «Нервные окончания ткани головного мозга крысы выделяют медь при деполяризации. Возможная роль в регуляции возбудимости нейронов». Письма по неврологии . 103 (2): 139–144. дои : 10.1016/0304-3940(89)90565-X . ПМИД 2549468 . S2CID 24917999 .
- ^ Бэйли Ч., Кандел Э.Р., Си К. (сентябрь 2004 г.). «Постоянство долговременной памяти: молекулярный подход к самоподдерживающимся изменениям в синаптическом росте, вызванном обучением» . Нейрон . 44 (1): 49–57. дои : 10.1016/j.neuron.2004.09.017 . ПМИД 15450159 . S2CID 2637074 .
- ^ Барко А., Бэйли Ч., Кандел Э.Р. (июнь 2006 г.). «Общие молекулярные механизмы в явной и неявной памяти» . Журнал нейрохимии . 97 (6): 1520–1533. дои : 10.1111/j.1471-4159.2006.03870.x . ПМИД 16805766 . S2CID 26307975 .
- ^ Лорен Дж., Гимбель Д.А., Найгаард Х.Б., Гилберт Дж.В., Стриттматтер С.М. (февраль 2009 г.). «Клеточный прионный белок опосредует нарушение синаптической пластичности олигомерами бета-амилоида» . Природа . 457 (7233): 1128–1132. Бибкод : 2009Natur.457.1128L . дои : 10.1038/nature07761 . ПМЦ 2748841 . ПМИД 19242475 .
- ^ Айзекс Дж.Д., Джексон Г.С., Альтманн Д.М. (октябрь 2006 г.). «Роль клеточного прионного белка в иммунной системе» . Клиническая и экспериментальная иммунология . 146 (1): 1–8. дои : 10.1111/j.1365-2249.2006.03194.x . ПМЦ 1809729 . ПМИД 16968391 .
- ^ Кастилья Дж., Хетц С., Сото С. (июнь 2004 г.). «Молекулярные механизмы нейротоксичности патологического прионного белка». Современная молекулярная медицина . 4 (4): 397–403. дои : 10.2174/1566524043360654 . ПМИД 15354870 .
- ^ Ковач Г.Г., Трабаттони Г., Хайнфеллнер Дж.А., Айронсайд Дж.В., Найт Р.С., Будка Х. (ноябрь 2002 г.). «Мутации фенотипического спектра гена прионного белка». Журнал неврологии . 249 (11): 1567–1582. дои : 10.1007/s00415-002-0896-9 . ПМИД 12420099 . S2CID 22688729 .
- ^ Коллинз С., Маклин Калифорния, Мастерс CL (сентябрь 2001 г.). «Синдром Герстмана-Штраусслера-Шейнкера, фатальная семейная бессонница и куру: обзор этих менее распространенных трансмиссивных губчатых энцефалопатий человека». Журнал клинической неврологии . 8 (5): 387–397. дои : 10.1054/jocn.2001.0919 . ПМИД 11535002 . S2CID 31976428 .
- ^ Монтанья П., Гамбетти П., Кортелли П., Лугарези Э. (март 2003 г.). «Семейная и спорадическая фатальная бессонница». «Ланцет». Неврология . 2 (3): 167–176. дои : 10.1016/S1474-4422(03)00323-5 . ПМИД 12849238 . S2CID 20822956 .
- ^ Мид С., Уитфилд Дж., Поултер М., Шах П., Апхилл Дж., Кэмпбелл Т. и др. (ноябрь 2009 г.). «Новый вариант защитного прионного белка, который колокализуется при воздействии куру» . Медицинский журнал Новой Англии . 361 (21): 2056–2065. дои : 10.1056/NEJMoa0809716 . ПМИД 19923577 .
- «Ген устойчивости к заболеваниям головного мозга развивается в сообществе Папуа-Новой Гвинеи; это может дать представление о БКЯ» . ScienceDaily (пресс-релиз). 21 ноября 2009 г.
- ^ Хван Д., Ли И.Ю., Ю Х., Геленборг Н., Чо Дж.Х., Петритис Б. и др. (2009). «Системный подход к прионным заболеваниям» . Молекулярная системная биология . 5 (1): 252. doi : 10.1038/msb.2009.10 . ПМК 2671916 . ПМИД 19308092 .
- ^ Jump up to: а б с д и ж г час я Лорен Дж (2014). «Клеточный прионный белок как терапевтическая мишень при болезни Альцгеймера». Журнал болезни Альцгеймера . 38 (2): 227–244. дои : 10.3233/JAD-130950 . ПМИД 23948943 .
- ^ Jump up to: а б с д и Чжоу Дж, Лю Б (май 2013 г.). «Болезнь Альцгеймера и прионный белок» . Исследование трудноизлечимых и редких заболеваний . 2 (2): 35–44. дои : 10.5582/irdr.2013.v2.2.35 . ПМК 4204584 . ПМИД 25343100 .
- ^ Jump up to: а б с Лорен Дж., Гимбель Д.А., Найгаард Х.Б., Гилберт Дж.В., Стриттматтер С.М. (февраль 2009 г.). «Клеточный прионный белок опосредует нарушение синаптической пластичности олигомерами бета-амилоида» . Природа . 457 (7233): 1128–1132. Бибкод : 2009Natur.457.1128L . дои : 10.1038/nature07761 . ПМЦ 2748841 . ПМИД 19242475 .
- ^ Jump up to: а б Хэ Дж, Ли Х, Ян Дж, Хуан Дж, Фу Х, Чжан Ю, Фань Х (март 2013 г.). «Связь между полиморфизмом метионин/валин (M/V) (rs1799990) в гене PRNP и риском болезни Альцгеймера: обновленная информация метаанализа». Журнал неврологических наук . 326 (1–2): 89–95. дои : 10.1016/j.jns.2013.01.020 . ПМИД 23399523 . S2CID 31070331 .
- ^ Jump up to: а б Джованьоли А.Р., Ди Феде Г., Арези А., Реати Ф., Росси Г., Тальявини Ф. (декабрь 2008 г.). «Атипичная лобно-височная деменция как новый клинический фенотип болезни Герстмана-Штраусслера-Шейнкера с мутацией PrP-P102L. Описание ранее не зарегистрированной итальянской семьи». Неврологические науки . 29 (6): 405–410. дои : 10.1007/s10072-008-1025-z . ПМИД 19030774 . S2CID 20553167 .
- ^ Вайс Р. (1 января 2007 г.). «Ученые объявляют о прорыве в области коровьего бешенства» . Вашингтон Пост . Проверено 1 января 2007 г.
- ^ Рихт Дж.А., Касинатан П., Хамир А.Н., Кастилья Дж., Сатиясилан Т., Варгас Ф. и др. (январь 2007 г.). «Производство крупного рогатого скота, лишенного прионного белка» . Природная биотехнология . 25 (1): 132–138. дои : 10.1038/nbt1271 . ПМК 2813193 . ПМИД 17195841 .
- ^ Америко Т.А., Кьярини Л.Б., Линден Р. (июнь 2007 г.). «Передача сигналов, индуцированная прыжком / STI-1, зависит от эндоцитоза». Связь с биохимическими и биофизическими исследованиями . 358 (2): 620–625. дои : 10.1016/j.bbrc.2007.04.202 . ПМИД 17498662 .
- ^ Заната С.М., Лопес М.Х., Меркаданте А.Ф., Хадж Г.Н., Кьярини Л.Б., Номизо Р. и др. (июль 2002 г.). «Стресс-индуцируемый белок 1 является лигандом клеточной поверхности для клеточного приона, который запускает нейропротекцию» . Журнал ЭМБО . 21 (13): 3307–3316. дои : 10.1093/emboj/cdf325 . ПМЦ 125391 . ПМИД 12093732 .
Внешние ссылки
[ редактировать ]- Ген PRNP (PrP) на GeneCard
- PRNP+белок+человек Национальной медицинской библиотеки США по медицинским предметным рубрикам (MeSH)
- Семинар Сьюзен Линдквист: «Удивительный мир прионной биологии»