Биохимия
| Часть серии на |
| Биохимия |
|---|
 |
Биохимия или биологическая химия - это изучение химических процессов внутри и связанных с живыми организмами . [ 1 ] Субдисциплина как химии, так и биологии , биохимия может быть разделена на три поля: структурная биология , фермерство и метаболизм . За последние десятилетия 20 -го века биохимия стала успешной в объяснении процессов жизни с помощью этих трех дисциплин. Почти все области наук о жизни раскрываются и развиваются с помощью биохимической методологии и исследований. [ 2 ] Биохимия фокусируется на понимании химической основы, которая позволяет биологическим молекулам вызывать процессы, которые происходят в живых клетках и между клетками, [ 3 ] в свою очередь, в значительной степени связанной с пониманием тканей и органов , а также структурой и функции организма. [ 4 ] Биохимия тесно связана с молекулярной биологией , изучением молекулярных механизмов биологических явлений. [ 5 ]
Большая часть биохимии имеет дело со структурами, функциями и взаимодействиями биологических макромолекул, таких как белки , нуклеиновые кислоты , углеводы и липиды . Они обеспечивают структуру ячеек и выполняют многие функции, связанные с жизнью. [ 6 ] Химия клетки также зависит от реакций малых молекул и ионов . Они могут быть неорганическими (например, ионами воды и металлов ) или органическими (например, аминокислоты , которые используются для синтеза белков ). [ 7 ] Механизмы, используемые клетками для использования энергии из окружающей среды через химические реакции , известны как метаболизм . Результаты биохимии применяются в основном в медицине , питании и сельском хозяйстве . В медицине биохимики исследуют причины лечение болезней и . [ 8 ] Питание изучает, как поддерживать здоровье и благополучие, а также влияние дефицита питания . [ 9 ] В сельском хозяйстве биохимики исследуют почву и удобрения с целью улучшения выращивания сельскохозяйственных культур, хранения урожая и борьбы с вредителями . В последние десятилетия биохимические принципы и методы были объединены с подходами к решению проблем от инженерии до манипулирования живыми системами для создания полезных инструментов для исследований, промышленных процессов, а также диагностики и контроля заболевания-дисциплины биотехнологии .
История
[ редактировать ]
В наиболее полном определении биохимия можно рассматривать как изучение компонентов и состава живых существ и того, как они объединяются, чтобы стать жизнью. Поэтому в этом смысле история биохимии может вернуться до древних греков . [ 10 ] Тем не менее, биохимия как конкретная научная дисциплина началась где -то в 19 веке или чуть раньше, в зависимости от того, на каком аспекте биохимии сосредоточен. Некоторые утверждали, что начало биохимии, возможно, было открытием первого фермента , диастаза (теперь называемой амилазой ), в 1833 году Ансельма Пейеном , [ 11 ] В то время как другие считали первую демонстрацию Эдуарда Бухнера сложного биохимического процесса, алкогольной ферментации в бесклеточных экстрактах в 1897 году, стала рождением биохимии. [ 12 ] [ 13 ] Некоторые могут также указывать на ее начало влиятельной работы 1842 года Юстуса фон Либига , химии животных или органической химии в ее применении к физиологии и патологии , которая представляла химическую теорию метаболизма, [ 10 ] или даже ранее до исследований 18 -го века по ферментации и дыханию Антуан Лавуазье . [ 14 ] [ 15 ] Многие другие пионеры в этой области, которые помогли раскрыть слои сложности биохимии, были провозглашены основателями современной биохимии. Эмиль Фишер , который изучал химию белков , [ 16 ] и Ф. Гоуленд Хопкинс , который изучал ферменты и динамический характер биохимии, представляют два примера ранних биохимиков. [ 17 ]
Термин «биохимия» был впервые использован, когда Винзенц Клетцинский (1826–1882) был напечатан в «Компендиуме дер -биохимии» в Вене в 1858 году; Он получен из комбинации биологии и химии . В 1877 году Феликс Хоппе-Сейлер использовал термин ( биохимия на немецком языке) в качестве синоним физиологической химии в предисловии в первом выпуске Zeitschrift für Physiologische Chemie (Журнал физиологической химии), где он спорил для создания институтов, посвященных Эта область обучения. [ 18 ] [ 19 ] Немецкий химик Карл Нойберг , однако, часто упоминается, чтобы придумать слово в 1903 году, [ 20 ] [ 21 ] [ 22 ] в то время как некоторые приписывали это Францу Хофмайстеру . [ 23 ]
Когда-то было в целом считалось, что жизнь и ее материалы имели какое-то важное свойство или вещество (часто называемое « жизненно важным принципом »), отличным от любого, обнаруженного в неживом веществе, и считалось, что только живые существа могут создавать молекулы жизнь. [ 25 ] В 1828 году Фридрих Вёлер опубликовал статью о своем счастливом мочевины синтезе из цианового и сульфата калия и сульфата аммония ; Некоторые считали, что как прямое свержение витализма и установление органической химии . [ 26 ] [ 27 ] Тем не менее, синтез Вёлера вызвал противоречие, поскольку некоторые отвергают смерть витализма в его руках. [ 28 ] С тех пор биохимия продвинулась, особенно с середины 20-го века, с разработкой новых методов, таких как хроматография , рентгеновская дифракция , двойная поляризационная интерферометрия , ЯМР-спектроскопия , радиоизотопическая маркировка , электронная микроскопия и моделирование молекулярной динамики . Эти методы позволили открыть и подробный анализ многих молекул и метаболических путей клетки , таких как гликолиз и цикл Кребса (цикл лимонной кислоты), и привели к пониманию биохимии на молекулярном уровне. [ Цитация необходима ]
Другим значительным историческим событием в биохимии является открытие гена и его роль в передаче информации в клетке. В 1950 -х годах Джеймс Д. Уотсон , Фрэнсис Крик , Розалинда Франклин и Морис Уилкинс сыграли важную роль в решении структуры ДНК и предполагали ее взаимосвязь с генетической передачей информации. [ 29 ] В 1958 году Джордж Бидл и Эдвард Татум получили Нобелевскую премию за работу в грибах, показывая, что один ген производит один фермент . [ 30 ] В 1988 году Колин Питчфорк был первым человеком, осужденным за убийство с помощью ДНК -доказательств, что привело к росту судебно -медицинской экспертизы . [ 31 ] Совсем недавно Эндрю З. Файр и Крейг С. Мелло получили Нобелевскую премию 2006 года за обнаружение роли интерференции РНК (RNAi) в молчании экспрессии генов . [ 32 ]
Стартовые материалы: химические элементы жизни
[ редактировать ]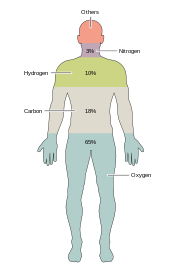
Около двух десятков химических элементов необходимы для различных видов биологической жизни . Наиболее редкие элементы на Земле не нужны для жизни (исключения являются селена и йодом ), [ 33 ] в то время как несколько распространенных ( алюминий и титан ) не используются. Большинство организмов разделяют потребности элементов, но есть несколько различий между растениями и животными . Например, океанские водоросли используют брома , но наземные растения и животные, кажется, не нужны. Все животные требуют натрия , но не являются важным элементом для растений. Растениям нужен бор и кремний , но животным не могут (или могут потребоваться сверхумные количества). [ Цитация необходима ]
Всего шесть элементов - углерод , водород , азот , кислород , кальций и фосфор - составляют почти 99% массы живых клеток, в том числе в человеческом организме (см. Состав человеческого тела для полного списка). В дополнение к шести основным элементам, которые составляют большую часть человеческого тела, людям требуется меньшее количество, возможно, еще 18. [ 34 ]
Биомолекулы
[ редактировать ]4 основных класса молекул в биохимии (часто называемые биомолекулами ) являются углеводы , липиды , белки и нуклеиновые кислоты . [ 35 ] Многие биологические молекулы являются полимерами : в этой терминологии мономеры являются относительно небольшими макромолекулами, которые связаны вместе для создания больших макромолекул, известных как полимеры. Когда мономеры связаны вместе, чтобы синтезировать биологический полимер , они проходят процесс, называемый синтезом дегидратации . Различные макромолекулы могут собираться в более крупных комплексах, часто необходимых для биологической активности .
Углеводы
[ редактировать ]Двумя основными функциями углеводов являются хранение энергии и обеспечение структуры. Одним из распространенных сахаров , известных как глюкоза , является углевод, но не все углеводы являются сахарами. На Земле больше углеводов, чем любой другой известный тип биомолекулы; Они используются для хранения энергии и генетической информации , а также для игры в важную роль в клеточных взаимодействиях и коммуникациях . [ Цитация необходима ]
Самый простой тип углеводов - это моносахарид , который среди других свойств содержит углерод , водород и кислород , в основном в соотношении 1: 2: 1 (генерализованная формула C N H 2 N O N , где n составляет не менее 3). Глюкоза (C 6 H 12 O 6 ) является одним из наиболее важных углеводов; Другие включают фруктозу (C 6 H 12 O 6 ), сахар, обычно связанный со вкусом фруктов сладким , [ 36 ] [ А ] и дезоксирибоза (C 5 H 10 O 4 ), компонент ДНК . Моносахарид может переключаться между ациклической (открытой цепью) формой и циклической формой. Форма с открытой цепью можно превратить в кольцо атомов углерода, соединенного атомом кислорода , созданного из карбонильной группы одного конца и гидроксильной группы другого. Циклическая молекула имеет гемиацетальную или гемикетальную группу, в зависимости от того, была ли линейная форма альдозой или кетозой . [ 38 ]
В этих циклических формах кольцо обычно имеет 5 или 6 атомов. Эти формы называются фуранозами и пиранозами , соответственно-по аналогии с фураном и пираном , самые простые соединения с одним и тем же углеродно-кислотным кольцом (хотя им не хватает углеродных двойных связей этих двух молекул). Например, глюкоза альдогексозы может образовывать гемиацетальную связь между гидроксилом на углероде 1 и кислородом на углероде 4, давая молекулу с 5-членным кольцом, называемой глюкофуранозой . Та же самая реакция может происходить между углеродами 1 и 5 с образованием молекулы с 6-членным кольцом, называемой глюкопиранозой . Циклические формы с кольцом 7-атома, называемого гепптозами, редки. [ Цитация необходима ]
Два моносахарида могут соединяться гликозидной или сложной связью в дисахарид посредством реакции дегидратации, во время которой высвобождается молекула воды. Обратная реакция, в которой гликозидная связь дисахарида разбивается на два моносахарида, называется гидролизом . Самым известным дисахаридом является сахароза или обычный сахар , который состоит из молекулы глюкозы и соединенной молекулы фруктозы . Другим важным дисахаридом является лактоза , обнаруженная в молоке, состоящая из молекулы глюкозы и молекулы галактозы . Лактоза может быть гидролизирована лактазой , а дефицит в этом ферменте приводит к непереносимости лактозы .
Когда соединяются несколько (около трех-шести) моносахаридов, это называется олигосахаридом ( олиго - означает «мало»). Эти молекулы, как правило, используются в качестве маркеров и сигналов , а также имеют некоторые другие применения. [ 39 ] Многие моносахариды соединены образуют полисахарид . Они могут быть соединены в одной длинной линейной цепи, или они могут быть разветвлены . Двумя наиболее распространенными полисахаридами являются целлюлоза и гликоген , оба состоящие из повторяющихся глюкозных мономеров . Целлюлоза растения является важным структурным компонентом клеточных стен , а гликоген используется в качестве формы хранения энергии у животных.
Сахар можно охарактеризовать, имея уменьшающиеся или не измельчивающие концы. Рядовой конец углевода-это атом углерода, который может быть в равновесии с открытой цепью альдегидом ( альдозой ) или кетовой формой ( кетоза ). Если соединение мономеров происходит при таком атоме углерода, группа свободной гидрокси пиранозы ацетал или фуранозной формы обменивается с помощью цепь OH на стороне другого сахара, что дает полный . Это предотвращает открытие цепи в форме альдегида или кето и делает модифицированный остаток, не отброшенный. Лактоза содержит уменьшающийся конец в его глюкозной части, тогда как галактозный фрагмент образует полный ацеталь с группой глюкозы C4-OH. Сахароза не имеет уменьшающегося конца из -за полного ацетального образования между альдегидным углеродом глюкозы (С1) и углеродом кето фруктозы (С2).
Липиды
[ редактировать ]
Липиды включают в себя разнообразные молекулы , а в некоторой степени является ловушка для относительно нерастворимых или неполярных соединений биологического происхождения, включая воски , жирные кислоты жирные акислотные фосфолипиды , сфинголипиды , гликолипиды и терпеноиды (EG ретиноиды , , ) Некоторые липиды являются линейными алифатическими молекулами с открытой цепью, в то время как другие имеют кольцевые структуры. Некоторые из них являются ароматными (с циклической [кольцевой] и плоской [плоской] структурой), а другие - нет. Некоторые из них гибки, в то время как другие жесткие. [ 42 ]
Липиды обычно производятся из одной молекулы глицерина в сочетании с другими молекулами. В триглицеридах , основной группе объемных липидов, есть одна молекула глицерина и три жирных кислот . Жирные кислоты считаются мономером в этом случае и, возможно, насыщенные (без двойных связей в углеродной цепи) или ненасыщенных (одна или несколько двойных связей в углеродной цепи). [ Цитация необходима ]
Большинство липидов имеют некоторый полярный характер и в значительной степени неполярные. В целом, основная часть их структуры является неполярной или гидрофобной («водоснабжение»), что означает, что она плохо взаимодействует с полярными растворителями, такими как вода . Другая часть их структуры-полярная или гидрофильная («любящая вода») и будет иметь тенденцию ассоциироваться с полярными растворителями, такими как вода. Это делает их амфифильными молекулами (имеющими как гидрофобные, так и гидрофильные участки). В случае холестерина полярная группа представляет собой просто –OH (гидроксил или спирт). [ Цитация необходима ]
В случае фосфолипидов полярные группы значительно больше и полярнее, как описано ниже.
Липиды являются неотъемлемой частью нашей ежедневной диеты. Большинство масел и молочных продуктов , которые мы используем для приготовления и еды, как масло , сыр , топленое масло и т. Д., Составляют жиры . Растительные масла богаты различными полиненасыщенными жирными кислотами (PUFA). Липидсодержащие продукты подвергаются пищеварению в организме и разбиваются на жирные кислоты и глицерин, конечные продукты разложения жиров и липидов. Липиды, особенно фосфолипиды , также используются в различных фармацевтических продуктах , либо в качестве со-формирователей (например, в парентеральных инфузиях), либо в качестве компонентов лекарственного средства (например, в липосоме или трансфессионале ).
Белки
[ редактировать ]
Белки -это очень большие молекулы-макро-биополимеры-изготовленные из мономеров, называемых аминокислотами . Аминокислота состоит из альфа -атома углерода, прикрепленного к аминогруппе , –NH 2 , группе карбоновой кислоты , –coOH (хотя они существуют как -nh 3 + и –coo − в физиологических условиях), простой атом водорода и боковой цепь, обычно обозначаемой как «r». Боковая цепь «r» отличается для каждой аминокислоты, из которой есть 20 стандартных . Именно эта группа «R» делает каждую аминокислоту отличаться, и свойства боковых цепей сильно влияют на общую трехмерную конформацию белка. Некоторые аминокислоты имеют функции сами по себе или в модифицированной форме; Например, глутамат функционирует как важный нейротрансмиттер . Аминокислоты можно соединить через пептидную связь . В этом обезвоживания синтезе молекула воды удаляется , а пептидная связь соединяет азот аминогрузки одной аминокислоты с углеродом карбоновой кислоты группы другой. Полученная молекула называется дипептидом , а короткие участки аминокислот (обычно менее тридцати) называются пептидами или полипептидами . Более длинные растяжения заслуживают титульных белков . Например, важный в белок белка крови содержит 585 аминокислотных остатков . [ 43 ]


Белки могут иметь структурные и/или функциональные роли. Например, движения белков актина и миозина в конечном итоге ответственны за сокращение скелетных мышц. Одно свойство, которое имеют многие белки, состоит в том, что они специально связываются с определенной молекулой или классом молекул - они могут быть чрезвычайно селективными в том, что они связывают. Антитела являются примером белков, которые прикрепляются к одному специфическому типу молекулы. Антитела состоят из тяжелых и легких цепей. Две тяжелые цепочки будут связаны с двумя легкими цепочками посредством дисульфидных связей между их аминокислотами. Антитела специфичны посредством изменений на основе различий в N-концевой домене. [ 44 ]
( Иммуноферментный анализ, связанный с ферментом ELISA), который использует антитела, является одним из наиболее чувствительных испытаний, которые современная медицина использует для обнаружения различных биомолекул. Вероятно, наиболее важными белками являются ферменты . Практически каждая реакция в живой клетке требует фермента для снижения энергии активации реакции. Эти молекулы распознают специфические молекулы реагента, называемые субстратами ; Затем они катализируют реакцию между ними. Понизив энергию активации , фермент ускоряет эту реакцию на скорость 10 11 или больше; Реакция, которая обычно занимает более 3000 лет, чтобы завершить самопроизвольно, может занять менее секунды с ферментом. Сам фермент не используется в процессе и может катализировать ту же реакцию с новым набором субстратов. Используя различные модификаторы, активность фермента может регулироваться, что позволяет контролировать биохимию клетки в целом.
Структура белков традиционно описывается в иерархии четырех уровней. Первичная структура белка состоит из его линейной последовательности аминокислот; Например, «аланин-глицин-трипптофан-серино-глутамат-аспаригин-глицин-лизин -...». Вторичная структура связана с локальной морфологией (морфология является изучением структуры). Некоторые комбинации аминокислот будут склонны свернуться в катушке, называемой α-спиралью , или в лист, называемый β-лист ; Некоторые α-спирали можно увидеть в схеме гемоглобина выше. Третичная структура -это вся трехмерная форма белка. Эта форма определяется последовательности аминокислот. На самом деле, единственное изменение может изменить всю структуру. Альфа -цепь гемоглобина содержит 146 аминокислотных остатков; Замена остатка глутамата в положении 6 с остатком валина настолько изменяет поведение гемоглобина, что приводит к болезням серповидноклета . Наконец, четвертичная структура связана с структурой белка с множественными пептидными субъединицами, такими как гемоглобин с его четырьмя субъединицами. Не все белки имеют более одной субъединицы. [ 45 ]


Принимаемые белки обычно разбиваются на отдельные аминокислоты или дипептиды в тонкой кишке , а затем поглощаются. Затем они могут быть объединены, чтобы сформировать новые белки. Промежуточные продукты гликолиза, цикла лимонной кислоты и пути пентозофосфата могут использоваться для образования всех двадцати аминокислот, и большинство бактерий и растений обладают всеми необходимыми ферментами для их синтеза. Люди и другие млекопитающие, однако, могут синтезировать только половину из них. Они не могут синтезировать изолейцин , лейцин , лизин , метионин , фенилаланин , треонин , триптофан и валин . Поскольку они должны быть проглатываться, это незаменимые аминокислоты . Млекопитающие обладают ферментами для синтеза аланина , аспарагина , аспартата , цистеина , глутамата , глутамина , глицина , пролина , серина и тирозина , несущественных аминокислот. Хотя они могут синтезировать аргинин и гистидин , они не могут производить его в достаточных количествах для молодых, растущих животных, и поэтому их часто считаются незаменимыми аминокислотами.
Если аминогруппа удаляется из аминокислоты, она оставляет карбоновый скелет, называемый α- кето кислотой . Ферменты, называемые трансаминазами, могут легко перенести аминогрузку из одной аминокислоты (делая ее α-кето кислотой) в другую α-кето-кислоту (делая ее аминокислотой). Это важно в биосинтезе аминокислот, поскольку для многих путей промежуточные соединения из других биохимических путей превращаются в скелет α-кето кислоты, а затем добавляется аминогрузка, часто путем трансаминации . Затем аминокислоты могут быть связаны вместе с образованием белка.
Аналогичный процесс используется для разрушения белков. Сначала он гидролизуется в свои компонентные аминокислоты. Свободный аммиак (NH3), существующий как ион аммония (NH4+) в крови, является токсичным для форм жизни. Поэтому подходящий метод для вывода должен существовать. Различная тактика развивалась у разных животных, в зависимости от потребностей животных. Одноклеточные организмы выделяют аммиак в окружающую среду. Аналогично, костная рыба может высвобождать аммиак в воду, где он быстро разбавляется. В целом млекопитающие преобразуют аммиак в мочевину через цикл мочевины .
Чтобы определить, связаны ли два белка или, другими словами, решить, являются ли они гомологичными или нет, ученые используют методы последовательности. Такие методы, как выравнивание последовательностей и структурные выравнивания, являются мощными инструментами, которые помогают ученым выявлять гомологию между родственными молекулами. Актуальность поиска гомологий среди белков выходит за рамки образования эволюционного паттерна белков . Обнаружив, насколько похожи две белковые последовательности, мы приобретаем знания об их структуре и, следовательно, их функции.
Нуклеиновые кислоты
[ редактировать ]
Нуклеиновые кислоты , так называемые из-за их распространенности в клеточных ядрах , является общим названием семейства биополимеров . Это сложные, высокомолекулярные биохимические макромолекулы, которые могут передавать генетическую информацию во всех живых клетках и вирусах. [ 2 ] Мономеры называются нуклеотидами , и каждый из них состоит из трех компонентов: азотистого гетероциклического основания (либо пурина , либо пиримидина ), пентозного сахара и фосфатной группы. [ 46 ]

Наиболее распространенными нуклеиновыми кислотами являются дезоксирибонуклеиновая кислота (ДНК) и рибонуклеиновая кислота (РНК). Группа фосфата и сахар каждой нуклеотидной связи друг с другом, образуя основную цепь нуклеиновой кислоты, в то время как последовательность азотных оснований хранит информацию. Наиболее распространенными азотистыми основаниями являются аденин , цитозин , гуанин , тимин и урацил . Азотистые основания каждой цепи нуклеиновой кислоты будут образовывать водородные связи с некоторыми другими азотистыми основаниями в комплементарной цепи нуклеиновой кислоты. Аденин связывается с тимином, а урацил, тимин связывается только с аденином, а цитозин и гуанин могут связываться только друг с другом. Аденин, тимин и урацил содержат две водородные связи, в то время как водородные связи, образованные между цитозином и гуанином, составляют три.
Помимо генетического материала клетки, нуклеиновые кислоты часто играют роль вторых посланников , а также образуют базовую молекулу для аденозинтрифосфата (АТФ), первичной молекулы энергетики, обнаруженной во всех живых организмах. Кроме того, азотные основы, возможные в двух ядлеиновых кислотах, различны: аденин, цитозин и гуанин встречаются как в РНК, так и в ДНК, в то время как тимин встречается только в ДНК и урациле в РНК.
Метаболизм
[ редактировать ]Углеводы как источник энергии
[ редактировать ]Глюкоза является источником энергии в большинстве форм жизни. Например, полисахариды разбиваются на свои мономеры ферментами ( гликогенфосфорилаза удаляет остатки глюкозы из гликогена, полисахарида). Дисахариды, такие как лактоза или сахароза, расщепляются в два компонентных моносахарида. [ 47 ]
Гликолиз (анаэробный)
[ редактировать ]Глюкоза в основном метаболизируется очень важным десятиэтапным путем, называемым гликолизом , чистый результат которого состоит в том, чтобы разбить одну молекулу глюкозы на две молекулы пирувата . Это также производит чистые две молекулы АТФ , энергетическую валюту ячеек, а также два снижения эквивалента конвертации NAD + (Никотинамид аденин динуклеотид: окисленная форма) до NADH (никотинамид аденин -динуклеотид: уменьшенная форма). Это не требует кислорода; Если кислород не доступен (или клетка не может использовать кислород), NAD восстанавливается путем превращения пирувата в лактат (молочная кислота) (например, у людей) или в этанол плюс углекислый газ (например, у дрожжей ). Другие моносахариды, такие как галактоза и фруктоза, могут быть преобразованы в промежуточные соединения гликолитического пути. [ 48 ]
Аэробный
[ редактировать ]В аэробных клетках с достаточным количеством кислорода , как и в большинстве клеток человека, пируват дополнительно метаболизируется. Он необратимо преобразуется в ацетил-КоА отходов , выделяя один атом углерода в качестве углекислого газа , генерируя еще один эквивалент, эквивалентный как NADH . Затем две молекулы ацетил-КоА (из одной молекулы глюкозы) попадают в цикл лимонной кислоты , продуцируя две молекулы АТФ, еще шесть молекул NADH и два пониженных (UBI) хинонов (через FADH 2 в качестве кофактора, связанного с ферментом), и выпуски оставшиеся атомы углерода в виде углекислого газа. Затем продуцированные молекулы NADH и хинола питаются в ферментативные комплексы дыхательной цепи, система транспорта электронов, переносив электроны в конечном итоге в кислород и сохраняет высвобожденную энергию в форме градиента протона над мембраной ( внутренняя митохондриальная мембрана у эукариотов). Таким образом, кислород сводится к воде, а оригинальные акцепторы электронов NAD + и хинон регенерированы. Вот почему люди дышат кислородом и дышат углекислым газом. Энергия, высвобождаемая от передачи электронов из высоких энергий в NADH и хиноле, сохраняется в первую очередь в качестве градиента протона и превращается в АТФ через АТФ-синтазу. Это генерирует дополнительные 28 молекул АТФ (24 из 8 NADH + 4 из 2 хинолов), на общую сумму до 32 молекул АТФ, консервативных на разлагаемую глюкозу (два из гликолиза + два из цитратного цикла). [ 49 ] Ясно, что использование кислорода для полного окисления глюкозы обеспечивает организм с гораздо большей энергией, чем любая зависимая от кислорода метаболическая особенность, и, как считается, это была причиной, по которой сложная жизнь появилась только после того, как атмосфера Земли накапливала большое количество кислорода.
Глюконеогенез
[ редактировать ]У позвоночных энергично сокращающиеся скелетные мышцы (например, во время тяжелой атлетики или спринта) не получают достаточно кислорода для удовлетворения потребности в энергии, и поэтому они переходят к анаэробному метаболизму , превращая глюкозу в лактат. Комбинация глюкозы из некарбогидратов происхождения, таких как жир и белки. Это происходит только тогда, когда гликоген поставляется в печени. Путь является решающим изменением гликолиза от пирувата в глюкозу и может использовать многие источники, такие как аминокислоты, цикл глицерина и Кребса . Крупномасштабный белок и жирный катаболизм обычно возникает, когда те, кто страдает от голода или определенных эндокринных расстройств. [ 50 ] Печень называемый восстанавливает глюкозу, используя процесс, глюконеогенез . Этот процесс не совсем противоположна гликолизу и фактически требует в три раза больше энергии, полученной от гликолиза (используются шесть молекул АТФ по сравнению с двумя полученными при гликолизе). Аналогично вышеупомянутым реакциям, образуемая глюкоза может затем подвергаться гликолизу в тканях, которые нуждаются в энергии, храниться в виде гликогена (или крахмала у растений) или быть преобразованными в другие моносахариды или соединены в ди- или олигосахариды. Комбинированные пути гликолиза во время упражнений, пересечение лактата через кровоток к печени, последующий глюконеогенез и высвобождение глюкозы в кровоток называется циклом CORI . [ 51 ]
Взаимосвязь с другими «молекулярными» биологическими науками
[ редактировать ]В этом разделе есть несколько проблем. Пожалуйста, помогите улучшить его или обсудить эти вопросы на странице разговоров . ( Узнайте, как и когда удалить эти сообщения )
|

Исследователи в биохимии используют конкретные методы, родные для биохимии, но все чаще объединяют их с методами и идеями, разработанными в областях генетики , молекулярной биологии и биофизики . Между этими дисциплинами нет определенной строки. Биохимические исследования. Химия, необходимая для биологической активности молекул, молекулярная биология изучает их биологическую активность, генетика изучает их наследственность, которая, как оказалось, переносится их геномом . Это показано в следующей схеме, которая изображает один возможный взгляд на отношения между полями:
- Биохимия - это изучение химических веществ и жизненно важных процессов, происходящих в живых организмах . Биохимики в значительной степени сосредоточены на роли, функциях и структуре биомолекул . Изучение химии, стоящих за биологическими процессами, и синтеза биологически активных молекул являются применением биохимии. Биохимия изучает жизнь на атомном и молекулярном уровне.
- Генетика - это изучение влияния генетических различий в организмах. Это часто можно вывести из -за отсутствия нормального компонента (например, один ген ). Изучение « мутантов »-организмов, в которых отсутствует один или несколько функциональных компонентов по отношению к так называемому « дикому типу » или нормальному фенотипу . Генетические взаимодействия ( эпистаз ) часто могут смешать простые интерпретации таких « нокаутных » исследований.
- Молекулярная биология - это изучение молекулярных основ биологических явлений, сосредоточенное на молекулярном синтезе, модификации, механизмах и взаимодействиях. Центральная догма молекулярной биологии , где генетический материал транскрибируется в РНК, а затем переводится в белок , несмотря на то, что он упрощена, все еще обеспечивает хорошую отправную точку для понимания поля. Эта концепция была пересмотрена в свете новых новых ролей РНК .
- Химическая биология направлена на разработку новых инструментов на основе небольших молекул , которые позволяют минимально нарушать биологические системы, одновременно предоставляя подробную информацию об их функции. Кроме того, химическая биология использует биологические системы для создания не натуральных гибридов между биомолекулами и синтетическими устройствами (например, опустошенные вирусные капсиды , которые могут доставлять генную терапию или молекулы лекарственного средства ).
Смотрите также
[ редактировать ]Списки
[ редактировать ]Смотрите также
[ редактировать ]- Астробиология
- Биохимия (журнал)
- Биологическая химия (журнал)
- Биофизика
- Химическая экология
- Вычислительная биомоделирование
- Выделенные биосмысленные химические вещества
- ЕС номер
- Гипотетические виды биохимии
- Международный союз биохимии и молекулярной биологии
- Метаболом
- Метаболомика
- Молекулярная биология
- Молекулярная медицина
- Биохимия растения
- Протеолиз
- Маленькая молекула
- Структурная биология
- Цикл TCA
Примечания
[ редактировать ]- ^ Фруктоза - не единственный сахар, найденный в фруктах. Глюкоза и сахароза также обнаруживаются в различных количествах в различных фруктах, а иногда превышают присутствие фруктозы. Например, 32% съедобной части даты представляют собой глюкозу по сравнению с 24% фруктозой и 8% сахарозы. Однако персики содержат больше сахарозы (6,66%), чем они делают фруктозу (0,93%) или глюкозу (1,47%). [ 37 ]
Ссылки
[ редактировать ]- ^ «Биологическая/биохимия» . acs.org . Архивировано из оригинала 2019-08-21 . Получено 2016-01-04 .
- ^ Jump up to: а беременный Голос (2005), с. 3
- ^ Карп (2009), с. 2
- ^ Миллер (2012). п. 62
- ^ ASTBURY (1961), p. 1124.
- ^ Eldra (2007), p. 45
- ^ Маркс (2012), глава 14.
- ^ Finkel (2009), с. 1–4.
- ^ Unicef (2010), с. 61, 75.
- ^ Jump up to: а беременный Helvoort (2000), p. 81.
- ^ Хантер (2000), с. 75
- ^ Hamblin (2005), p. 26
- ^ Hunter (2000), с. 96–98.
- ^ Берг (1980), с. 1–2.
- ^ Холмс (1987), с. XV.
- ^ Фельдман (2001), с. 206
- ^ Rayner-Canham (2005), p. 136
- ^ Ziesak (1999), p. 169
- ^ Kleinkauf (1988), p. 116
- ^ Bethanhem (2009), p. 2982.
- ^ Amsler (1986), p. 55
- ^ Хортон (2013), с. 36
- ^ Kleinkauf (1988), p. 43
- ^ Эдвардс (1992), с. 1161–1173.
- ^ Рыбалка (1890), стр.
- ^ Wöhler, F. (1828). "Ueber künstliche Bildung des Harnstoffs" . Annalen der Physik und Chemie . 88 (2): 253–256. Bibcode : 1828AnP....88..253W . doi : 10.1002/andp.18280880206 . ISSN 0003-3804 . Archived from the original on 2023-10-28 . Получено 2021-05-04 .
- ^ Kauffman (2001), с. 121–133.
- ^ Липман, Тимоти О. (август 1964 г.). «Подготовка Воулера мочевины и судьбы витализма» . Журнал химического образования . 41 (8): 452. Bibcode : 1964jched..41..452L . doi : 10.1021/ed041p452 . ISSN 0021-9584 . Архивировано из оригинала 2023-10-28 . Получено 2021-05-04 .
- ^ Отряд (2012), стр.
- ^ Кребс (2012), с. 32
- ^ Батлер (2009), с. 5
- ^ Чандан (2007), с. 193–194.
- ^ Кокс, Нельсон, Лехнингер (2008). Лехнингер Принципы биохимии . Макмиллан.
{{cite book}}: Cs1 maint: несколько имен: список авторов ( ссылка ) - ^ Нильсен (1999), с. 283–303.
- ^ Slabaugh (2007), с. 3–6.
- ^ Whiting (1970), с. 1–31.
- ^ Whiting , GC (1970), p. 5
- ^ Голос (2005), стр. 358–359.
- ^ Varki (1999), p. 17.
- ^ Stryer (2007), p. 328.
- ^ Voet (2005), гл. 12 липидов и мембран.
- ^ Ахмед, Саба; Шах, Парини; Ахмед, Оваис (2023), «Биохимия, липиды» , Statpearls , Остров сокровищ (FL): Statpearls Publishing, PMID 30247827 , получен 2023-11-30
- ^ Метцлер (2001), с. 58
- ^ Фейдж, Матиас Дж.; Хендершот, Линда М.; Бухнер, Йоханнес (2010). «Как складываются антитела» . Тенденции в биохимических науках . 35 (4): 189–198. doi : 10.1016/j.tibs.2009.11.005 . PMC 4716677 . PMID 20022755 .
- ^ Fromm and Hargrove (2012), с. 35–51.
- ^ Saenger (1984), p.
- ^ "Дисахарид" . Энциклопедия Британская . Архивировано из оригинала 19 октября 2023 года . Получено 14 октября 2023 года .
- ^ Fromm and Hargrove (2012), с. 163–180.
- ^ Voet (2005), гл. 17 гликолиз.
- ^ Словарь биологии . Издательство Оксфордского университета. 17 сентября 2015 года. ISBN 9780198714378 Полем Архивировано из оригинала 10 июля 2020 года . Получено 29 апреля 2020 года .
- ^ Fromm and Hargrove (2012), с. 183–194.
Цитируемая литература
[ редактировать ]- Амслер, Марк (1986). Языки творчества: модели, решение проблем, дискурс . Университет Делавэр Пресс. ISBN 978-0-87413-280-9 Полем Архивировано из оригинала 2023-10-28 . Получено 2015-07-27 .
- Astbury, WT (1961). "Молекулярная биология или ультраструктурная биология?" Полем Природа . 190 (4781): 1124. Bibcode : 1961natur.190.1124a . doi : 10.1038/1901124a0 . PMID 13684868 . S2CID 4172248 .
- Бен-Менахем, Ари (2009). Историческая энциклопедия естественных и математических наук . Спрингер. п. 2982. Bibcode : 2009henm.book ..... b . ISBN 978-3-540-68831-0 .
- Бертон, Фельдман (2001). Нобелевская премия: история гения, споров и престижа . Arcade Publishing. ISBN 978-1-55970-592-9 .
- Батлер, Джон М. (2009). Основы криминалистического типирования ДНК . Академическая пресса. ISBN 978-0-08-096176-7 .
- Сен, Чандан К.; Рой, Сашвати (2007). «Мирна: лицензирован на убийство посланника». ДНК и клеточная биология . 26 (4): 193–194. doi : 10.1089/dna.2006.0567 . PMID 17465885 . S2CID 10665411 .
- Кларенс, Питер Берг (1980). Университет Айовы и биохимия от их начала . Университет Айовы. ISBN 978-0-87414-014-9 Полем Архивировано из оригинала 2023-10-28 . Получено 2015-07-27 .
- Эдвардс, Карен Дж.; Браун, Дэвид Г.; Спинк, Нил; Скелли, Джейн v.; Нейдл, Стивен (1992). «Молекулярная структура додекамера B-ДНК D (CGCAAATTTGCG) 2 Исследование поворота пропеллера и структуры воды с незначительностью при 2 · 2 ÅResolution». Журнал молекулярной биологии . 226 (4): 1161–1173. doi : 10.1016/0022-2836 (92) 91059-x . PMID 1518049 .
- Эльдра П. Соломон; Линда Р. Берг; Диана В. Мартин (2007). Биология, 8 -е издание, международное студенческое издание . Томсон Брукс/Коул. ISBN 978-0-495-31714-2 Полем Архивировано с оригинала 2016-03-04.
- Fariselli, P.; Росси, я.; Capriotti, E.; Casadio, R. (2006). «WWWH от отдаленного обнаружения гомолога: состояние искусства» . Брифинги в биоинформатике . 8 (2): 78–87. doi : 10.1093/bib/bbl032 . PMID 17003074 .
- Фиске, Джон (1890). Схема космической философии, основанная на доктринах эволюции, с критикой позитивной философии, том 1 . Бостон и Нью -Йорк: Хоутон, Миффлин. Архивировано из оригинала 28 октября 2023 года . Получено 16 февраля 2015 года .
- Финкель, Ричард; Кубидду, Луиджи; Кларк, Мишель (2009). Иллюстрированные обзоры Липпинкотта: Фармакология (4 -е изд.). Липпинкотт Уильямс и Уилкинс. ISBN 978-0-7817-7155-9 Полем Архивировано из оригинала 2023-10-28 . Получено 2020-06-05 .
- Кребс, Джоселин Э.; Гольдштейн, Эллиотт С.; Левин, Бенджамин; Килпатрик, Стивен Т. (2012). Основные гены . Jones & Bartlett Publishers. ISBN 978-1-4496-1265-8 .
- Фромм, Герберт Дж.; Hargrove, Mark (2012). Основы биохимии . Спрингер. ISBN 978-3-642-19623-2 Полем Архивировано из оригинала 2023-10-28 . Получено 2020-06-05 .
- Хэмблин, Джейкоб Дарвин (2005). Наука в начале двадцатого века: энциклопедия . ABC-Clio. ISBN 978-1-85109-665-7 Полем Архивировано из оригинала 2023-10-28 . Получено 2015-07-27 .
- Helvoort, Ton Van (2000). Arne Hessenbruch (ред.). Руководство читателя по истории науки . Фицрой Дирборн издательство. ISBN 978-1-884964-29-9 Полем Архивировано из оригинала 2023-10-28 . Получено 2015-07-27 .
- Холмс, Фредерик Лоуренс (1987). Lavoisier и химия жизни: исследование научного творчества . Университет Висконсин Пресс. ISBN 978-0-299-09984-8 Полем Архивировано из оригинала 2023-10-28 . Получено 2015-07-27 .
- Хортон, Дерек, изд. (2013). Достижения в области химии углеводов и биохимии, том 70 . Академическая пресса. ISBN 978-0-12-408112-3 Полем Архивировано из оригинала 2023-10-28 . Получено 2015-07-27 .
- Хантер, Грэм К. (2000). Жизненно важные силы: открытие молекулярной основы жизни . Академическая пресса. ISBN 978-0-12-361811-5 Полем Архивировано из оригинала 2023-10-28 . Получено 2020-06-05 .
- Карп, Джеральд (2009). Клеточная и молекулярная биология: концепции и эксперименты . Джон Уайли и сыновья. ISBN 978-0-470-48337-4 .
- Кауфман, Джордж Б.; Chooljian, Steven H. (2001). «Фридрих Вёлер (1800–1882), на двухсотлетие его рождения». Химический педагог . 6 (2): 121–133. doi : 10.1007/s00897010444a . S2CID 93425404 .
- Небольшая покупка, Хорст; Дёрен, Ганс фон; Jaenicke Lothar (1988). Корни современной биохимии: Squiggle Fritz Lippmann и его достоинства . Walter de Gruyter & Co. p. 116. ISBN 978-3-11-085245-5 Полем Архивировано из оригинала 2023-10-28 . Получено 2015-07-27 .
- Ноулз, младший (1980). «Катализируемые ферментом реакции переноса фосфорила». Ежегодный обзор биохимии . 49 : 877–919. doi : 10.1146/annurev.bi.49.070180.004305 . PMID 6250450 . S2CID 7452392 .
- Метцлер, Дэвид Эверетт; Метцлер, Кэрол М. (2001). Биохимия: химические реакции живых клеток . Тол. 1. Академическая пресса. ISBN 978-0-12-492540-3 .
- Миллер G; Spoolman Скотт (2012). Наука по окружающей среде - Биоразнообразие является важной частью естественного капитала Земли . Cengage Learning . ISBN 978-1-133-70787-5 Полем Архивировано из оригинала 2023-04-13 . Получено 2016-01-04 .
- Нильсен, Форрест Х. (1999). «Ультратрасные минералы». В Морисе Э. Шилс; и др. (ред.). Современное питание в здоровье и болезнях . Балтимор: Уильямс и Уилкинс. С. 283–303. HDL : 10113/46493 .
- Пит, Алиса (2012). Маркс, Аллан; Либерман Майкл А. (ред.). Основная медицинская биохимия Marks (Lieberman, основная медицинская биохимия Маркса) (4 -е изд.). Липпинкотт Уильямс и Уилкинс. ISBN 978-1-60831-572-7 Полем Архивировано из оригинала 2023-10-28 . Получено 2020-06-05 .
- Rayner-Canham, Marelene F.; Рейнер-Канхэм, Марелен; Рейнер-Канхэм, Джеффри (2005). Женщины в химии: их меняющиеся роли с алхимических времен до середины двадцатого века . Фонд химического наследия. ISBN 978-0-941901-27-7 .
- Рохас-Руиз, Фернандо А.; Варгас-Мендес, Леонор Y.; Kouznetsov, Vladimir V. (2011). «Проблемы и перспективы химической биологии, успешная междисциплинарная область естественных наук» . Молекулы . 16 (3): 2672–2687. doi : 10.3390/molecules16032672 . PMC 6259834 . PMID 21441869 .
- Saenger, Wolfram (1984). Принципы структуры нуклеиновой кислоты . Нью-Йорк: Springer-Verlag. ISBN 978-0-387-90762-8 Полем Архивировано из оригинала 2023-10-28 . Получено 2020-06-05 .
- Slabaugh, Michael R.; Сигер, Спенсер Л. (2013). Органическая и биохимия на сегодня (6 -е изд.). Тихоокеанская роща: Брукс Коул. ISBN 978-1-133-60514-0 Полем Архивировано из оригинала 2023-10-28 . Получено 2020-06-05 .
- Шервуд, Лаурели; Кландорф, Хиллар; Янси, Пол Х. (2012). Физиология животных: от генов до организмов . Cengage Learning. ISBN 978-0-8400-6865-1 .
- Stryer L, Berg JM, JL Tymical (2007). Биохимики (6 -е изд.). Сан -Франциско: WH Freeman. Я 978-0-7167-8724-2 .
- Tropp, Burton E. (2012). Молекулярная биология (4 -е изд.). Jones & Bartlett Learning. ISBN 978-1-4496-0091-4 Полем Архивировано из оригинала 2023-10-28 . Получено 2020-06-05 .
- ЮНИСЕФ (2010). Факты на всю жизнь (PDF) (4 -е изд.). Нью -Йорк: Детский фонд Организации Объединенных Наций. ISBN 978-92-806-4466-1 Полем Архивировано (PDF) из оригинала на 2022-10-09.
- Ульвелирование, Дэмиен; Францистел, Клэр; Hubé, Florent (2011). «Когда кто -то лучше двух: РНК с двойными функциями» (PDF) . Биохими . 93 (4): 633–644. doi : 10.1016/j.biochi.2010.11.004 . PMID 21111023 . S2CID 22165949 . Архивировано (PDF) из оригинала на 2022-10-09.
- Варки А., Каммингс Р., Эско Дж., Джессика Ф., Харт Г., Март Дж. (1999). Основы гликобиологии . Cold Spring Harbor Laboratory Press. ISBN 978-0-87969-560-6 Полем Архивировано из оригинала 2023-10-28 . Получено 2020-06-05 .
- Голосовать, D; Голос, JG (2005). Биохимия (3 -е и.). Хобокен, Нью -Джерси: John Wiley & Sounds Inc. ISBN 978-0-471-19350-0 Полем Архивировано из оригинала 11 сентября 2007 года.
- Уайтинг, GC (1970). «Сахар» . В AC Hulme (ред.). Биохимия фруктов и их продуктов . Тол. 1. Лондон и Нью -Йорк: Академическая пресса. ISBN 978-0-12-361201-4 .
- Zeies, Анн-Катрин; Черт Ханс-Роберт (1999). Walter The Grury Publisters, 1749-1999 . Walter The Grucyter & Co. ISBN 978-3-11-016741-2 Полем Архивировано из оригинала 2023-10-28 . Получено 2015-07-27 .
- Эшкрофт, Стив. «Профессор сэр Филипп Рэндл; исследователь метаболизма: [1 -е издание]». Независимый . ProQuest 311080685 .
Дальнейшее чтение
[ редактировать ]- Фрутон, Джозеф С. Белки, ферменты, гены: взаимодействие химии и биологии . Издательство Йельского университета: Нью -Хейвен, 1999. ISBN 0-300-07608-8
- Кит Робертс, Мартин Рафф, Брюс Альбертс, Питер Уолтер, Джулиан Льюис и Александр Джонсон, Молекулярная биология клетки
- 4 -е издание, Routledge, март 2002 г., твердый переплет, 1616 стр. ISBN 0-8153-3218-1
- 3 -е издание, Garland, 1994, ISBN 0-8153-1620-8
- 2 -е издание, Garland, 1989, ISBN 0-8240-3695-6
- Колер, Роберт. От медицинской химии до биохимии: создание биомедицинской дисциплины . Издательство Кембриджского университета, 1982.
- Маджио, Лорен А.; Уиллинский, Джон М.; Стейнберг, Райан М.; Митхен, Даниэль; Wass, Joseph L.; Донг, Тинг (2017). «Arc.Ask3.Ru как шлюз к биомедицинским исследованиям: относительное распределение и использование цитат в английской Википедии» . Plos один . 12 (12): E0190046. BIBCODE : 2017PLOSO..1290046M . doi : 10.1371/journal.pone.0190046 . PMC 5739466 . PMID 29267345 .
Внешние ссылки
[ редактировать ]- «Биохимическое общество» .
- Виртуальная библиотека биохимии, молекулярной биологии и клеточной биологии
- Биохимия, 5 -е изд. Полный текст Берга, Тимоцко и Страйера, любезно предоставленной NCBI .
- SystemSx.CH - Швейцарская инициатива в системной биологии
- Полный текст биохимии Кевина и Индиры, вводного учебника по биохимии.




