Нитрат
 | |
| Имена | |
|---|---|
| Систематическое название ИЮПАК Нитрат | |
| Идентификаторы | |
3D model ( JSmol ) | |
| КЭБ | |
| ХимическийПаук | |
ПабХим CID | |
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| НЕТ − 3 | |
| Молярная масса | 62.004 g·mol −1 |
| Конъюгатная кислота | Азотная кислота |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
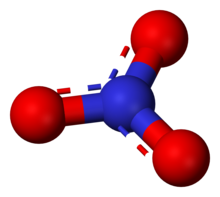
Нитрат представляет собой многоатомный ион с химической формулой NO. −
3 . Соли, содержащие этот ион, называются нитратами . Нитраты являются распространенными компонентами удобрений и взрывчатых веществ. [1] Почти все неорганические нитраты растворимы в воде . Примером нерастворимого нитрата является оксинитрат висмута .
Химическая структура
[ редактировать ]
Нитрат- анион представляет собой сопряженное основание , азотной кислоты состоящее из одного центрального азота, атома окруженного тремя одинаково связанными атомами кислорода в тригональном плоском расположении. Нитрат-ион несет формальный заряд -1. [ нужна ссылка ] Этот заряд возникает в результате комбинации формального заряда, в котором каждый из трех атомов кислорода несет — 2 ⁄ заряда , [ нужна ссылка ] тогда как азот несет заряд +1, и все это в сумме дает формальный заряд многоатомного нитрат-иона. [ нужна ссылка ] Такое расположение обычно используется в качестве примера резонанса . Как и изоэлектронный карбонат -ион, нитрат-ион может быть представлен тремя резонансными структурами:
Химические и биохимические свойства
[ редактировать ]В NO − 3 Анион , степень окисления центрального атома азота V (+5). Это соответствует максимально возможной степени окисления азота. Нитрат является потенциально мощным окислителем , о чем свидетельствует его взрывное поведение при высокой температуре, когда он детонирует в нитрате аммония ( NH 4 NO 3 ), или черный порох , воспламеняющийся от ударной волны первичного взрывчатого вещества . Однако в отличие от красной дымящей азотной кислоты ( HNO 3 /N 2 O 4 ), или концентрированная азотная кислота ( HNO 3 ), нитрат, растворенный в водном растворе при нейтральном или высоком pH, является лишь слабым окислителем и стабилен в стерильных, или асептических , условиях, в отсутствие микроорганизмов . Для повышения его окислительной способности необходимы кислые условия и высокие концентрации, при которых нитрат превращается в азотную кислоту. Такое поведение согласуется с общей теорией восстановления-окисления (окислительно-восстановительного процесса) в электрохимии : окислительная способность усиливается в кислых условиях, тогда как сила восстановителей усиливается в основных условиях. Это можно проиллюстрировать с помощью диаграммы Пурбе (диаграмма E h –pH), построенной с использованием уравнения Нернста и соответствующих окислительно-восстановительных реакций. При восстановлении окислителей степень окисления снижается и ионы оксида ( ТО 2− ) в избытке, выделяющиеся в воде в результате реакции, легче протонируются в кислых условиях ( ТО 2− + 2 ч. + → H 2 O ), который направляет реакцию восстановления вправо по принципу Ле Шателье . При окислении восстановителей происходит обратный процесс: по мере увеличения степени окисления оксидные анионы необходимы для нейтрализации избытка положительных зарядов, переносимых центральным атомом. Поскольку основные условия благоприятствуют образованию оксидных анионов ( 2 ОН − → 2− + H 2 O ), это смещает химическое равновесие реакции окисления вправо.
Между тем, нитрат используется в качестве мощного терминального акцептора электронов денитрифицирующими бактериями , чтобы доставлять им энергию, необходимую для процветания. В анаэробных условиях нитрат является сильнейшим акцептором электронов, используемым прокариотными микроорганизмами ( бактериями и археями ) для дыхания. пара Редокс - НЕТ − 3 / N 2 находится на вершине окислительно-восстановительной шкалы для анаэробного дыхания , чуть ниже пары кислорода ( O 2 / H 2 O ), но выше пар Mn(IV)/Mn(II), Fe(III)/Fe(II), SO2−4 4/ HS − , СО 2 / Ч 4 . В природных водах, неизбежно загрязненных микроорганизмами, нитраты являются весьма нестабильными и лабильными растворенными химическими соединениями, поскольку метаболизируются денитрифицирующими бактериями. Пробы воды для анализа нитратов/нитритов необходимо хранить при температуре 4 °C в охлаждаемом помещении и анализировать как можно быстрее, чтобы ограничить потерю нитратов.
На первом этапе процесса денитрификации растворяется нитрат ( NO - 3 ) каталитически восстанавливается до нитрита ( NO - 2 ) за счет ферментативной активности бактерий. В водном растворе растворенный нитрит N(III) является более мощным окислителем, чем нитрат N(V), поскольку ему приходится принимать меньше электронов , а его восстановление менее кинетически затруднено, чем восстановление нитрата.
В процессе биологической денитрификации дальнейшее восстановление нитритов также приводит к образованию другого мощного окислителя: оксида азота (NO). NO может фиксироваться на миоглобине, подчеркивая его красную окраску. NO является важной биологической сигнальной молекулой и вмешивается в процесс расширения сосудов , но он также может производить свободные радикалы в биологических тканях , ускоряя их деградацию и процесс старения. Активные формы кислорода (АФК), генерируемые NO, способствуют окислительному стрессу — состоянию, связанному с сосудистой дисфункцией и атерогенезом . [2]
Обнаружение при химическом анализе
[ редактировать ]Нитрат- анион обычно анализируется в воде с помощью ионной хроматографии (ИК) вместе с другими анионами, также присутствующими в растворе. Основным преимуществом IC является простота и одновременный анализ всех анионов, присутствующих в водной пробе. Другие методы специфического обнаружения нитратов основаны на его преобразовании в нитрит с последующим проведением тестов, специфичных для нитритов. Восстановление нитрата до нитрита осуществляется медно - кадмиевым материалом. Проба вводится в анализатор с проточным впрыском , а полученные в результате нитритсодержащие стоки затем объединяются с реагентом для колориметрического или электрохимического обнаружения. Самым популярным из этих анализов является тест Грисса , при котором нитрит преобразуется в глубоко окрашенный азокраситель , подходящий для УФ-спектроскопического анализа. В этом методе используется реакционная способность азотистой кислоты, получаемой в результате подкисления нитрита. Азотистая кислота избирательно реагирует с ароматическими аминами с образованием солей диазония, которые, в свою очередь, соединяются со вторым реагентом с образованием азокрасителя. предел обнаружения составляет от 0,02 до 2 мкм. [3] Такие методы хорошо адаптированы к биологическим образцам. [4]
Возникновение и производство
[ редактировать ]Нитратные соли встречаются в природе на Земле в засушливых условиях в виде крупных месторождений, особенно нитратина , основного источника нитрата натрия .
Нитраты производятся рядом видов нитрифицирующих бактерий в природной среде с использованием аммиака или мочевины в качестве источника азота и источника свободной энергии. Нитратные соединения для пороха исторически производились в отсутствие минеральных источников нитратов посредством различных процессов ферментации с использованием мочи и навоза.
Удары молний в земной атмосфере, богатой азотом и кислородом, образуют смесь оксидов азота, которые образуют ионы азота и ионы нитрата, которые вымываются из атмосферы дождями или скрытыми отложениями .
Нитраты производятся в промышленности из азотной кислоты . [1]
Использование
[ редактировать ]Сельское хозяйство
[ редактировать ]Нитрат — это химическое соединение , которое служит основной формой азота для многих растений. Это важное питательное вещество используется растениями для синтеза белков, нуклеиновых кислот и других жизненно важных органических молекул. [5] Превращению атмосферного азота в нитрат способствуют определенные бактерии и молнии в азотном цикле, что иллюстрирует способность природы превращать относительно инертную молекулу в форму, имеющую решающее значение для биологической продуктивности. [6]
Нитраты используются в качестве удобрений в сельском хозяйстве из-за их высокой растворимости и биоразлагаемости. Основными нитратными удобрениями являются аммония , натрия , калия , кальция и магния соли . Для этой цели ежегодно производится несколько миллиардов килограммов. [1] Значение нитрата выходит за рамки его роли питательного вещества, поскольку он действует в растениях как сигнальная молекула, регулируя такие процессы, как рост корней, цветение и развитие листьев. [7]
Хотя нитраты полезны для сельского хозяйства, поскольку они повышают плодородие почвы и урожайность сельскохозяйственных культур, их чрезмерное использование может привести к стоку питательных веществ, загрязнению воды и увеличению количества водных мертвых зон. [8] Поэтому необходимы устойчивые методы ведения сельского хозяйства, которые сочетают производительность с охраной окружающей среды. Важность нитратов в экосистемах очевидна, поскольку они поддерживают рост и развитие растений, способствуя биоразнообразию и экологическому балансу. [9]
Огнестрельное оружие
[ редактировать ]Нитраты используются в качестве окислителей, особенно во взрывчатых веществах, где при быстром окислении соединений углерода выделяются большие объемы газов (см., порох например, ).
Промышленный
[ редактировать ]Нитрат натрия используется для удаления пузырьков воздуха из расплавленного стекла и некоторых видов керамики. Смеси расплавленной соли используются для упрочнения некоторых металлов. [1]
Фотопленка
[ редактировать ]Нитрат также использовался в качестве пленочного материала через нитроцеллюлозу . Из-за ее высокой горючести в 1950 году киностудии перешли на из ацетата целлюлозы защитную пленку .
Лекарственное и фармацевтическое применение
[ редактировать ]В медицинской сфере органические эфиры нитратов , такие как тринитрат глицерина , динитрат изосорбида и мононитрат изосорбида , используются для профилактики и лечения острого коронарного синдрома , инфаркта миокарда , острого отека легких . [10] Этот класс препаратов, к которому относится и амилнитрит , известен как нитровазодилататоры .
Токсичность и безопасность
[ редактировать ]Двумя областями, вызывающими обеспокоенность по поводу токсичности нитратов, являются следующие:
- нитрат, восстанавливаемый микробной активностью нитратредуцирующих бактерий, является предшественником нитрита в воде и нижних отделах желудочно-кишечного тракта . Нитрит является предшественником канцерогенных нитрозаминов и;
- Через образование нитрита нитрат участвует в метгемоглобинемии , нарушении гемоглобина в красных кровяных тельцах , которое особенно поражает младенцев и детей ясельного возраста. [11] [12]
Метгемоглобинемия
[ редактировать ]Одна из наиболее частых причин метгемоглобинемии у младенцев связана с попаданием нитратов и нитритов в организм через колодезную воду или пищу.
На самом деле нитраты ( NO - 3 ), часто присутствующие в слишком высоких концентрациях в питьевой воде, являются лишь химическими предшественниками нитритов ( NO - 2 ), настоящие виновники метгемоглобинемии. Нитриты, образующиеся в результате микробного восстановления нитратов (непосредственно в питьевой воде или после приема ребенком в его пищеварительной системе), являются более мощными окислителями, чем нитраты, и являются химическими агентами, действительно ответственными за окисление железа. 2+ в Fe 3+ в тетрапирроловом геме гемоглобина . Действительно, нитрат-анионы являются слишком слабыми окислителями в водном растворе, чтобы иметь возможность напрямую или, по крайней мере, достаточно быстро окислять Fe. 2+ в Fe 3+ , из-за кинетических ограничений.
Младенцы младше 4 месяцев подвергаются большему риску, поскольку они пьют больше воды на массу тела, у них более низкая активность НАДН - цитохром b5-редуктазы и более высокий уровень фетального гемоглобина, который легче превращается в метгемоглобин . Кроме того, младенцы подвергаются повышенному риску после эпизода гастроэнтерита -за выработки нитритов бактериями из . [13]
Однако другие причины, помимо нитратов, также могут влиять на младенцев и беременных женщин. [14] [15] Действительно, синдром голубого ребенка также может быть вызван рядом других факторов, таких как цианотическая болезнь сердца , врожденный порок сердца , приводящий к низкому уровню кислорода в крови, [16] или расстройством желудка, например, диарейной инфекцией, непереносимостью белка, токсичностью тяжелых металлов и т. д. [17]
Стандарты питьевой воды
[ редактировать ]В соответствии с Законом о безопасной питьевой воде Агентство по охране окружающей среды США установило максимальный уровень загрязнения 10 мг/л или 10 частей на миллион нитратов в питьевой воде. [18]
Допустимая суточная доза (ADI) нитрат-ионов была установлена в диапазоне 0–3,7 мг (кг массы тела). −1 день −1 Объединенным комитетом экспертов ФАО/ВОЗ по пищевым добавкам (JEFCA). [19]
Водная токсичность
[ редактировать ]
В пресноводных или устьевых системах, расположенных вблизи суши, нитраты могут достигать смертельных для рыб концентраций. Нитрат гораздо менее токсичен, чем аммиак. [20] уровни нитратов более 30 ppm могут подавлять рост, ослаблять иммунную систему и вызывать стресс у некоторых водных видов. [21] Токсичность нитратов остается предметом дискуссий. [22]
В большинстве случаев избыточных концентраций нитратов в водных системах основными источниками являются сбросы сточных вод, а также поверхностные стоки с сельскохозяйственных или ландшафтных территорий, получивших избыточное количество нитратных удобрений. В результате эвтрофикация и цветение водорослей приводят к аноксии и мертвым зонам . Как следствие, поскольку нитраты являются компонентом общего количества растворенных твердых веществ , они широко используются в качестве индикатора качества воды .
Воздействие человека на экосистемы через отложение нитратов
[ редактировать ]
Выпадение нитратов в экосистемы заметно увеличилось из-за антропогенной деятельности, в частности, из-за широкого применения богатых азотом удобрений в сельском хозяйстве и выбросов в результате сжигания ископаемого топлива. [23] Ежегодно в мире используется около 195 миллионов тонн синтетических азотных удобрений, значительную часть из которых составляют нитраты. [24] В регионах с интенсивным сельским хозяйством, например в некоторых частях США, Китая и Индии, использование азотных удобрений может превышать 200 килограммов на гектар. [24]
Воздействие увеличения отложения нитратов выходит за рамки растительных сообществ и влияет на популяции почвенных микробов. [25] Изменение химического состава почвы и динамики питательных веществ может нарушить естественные процессы фиксации азота, нитрификации и денитрификации, что приведет к изменению структуры и функций микробного сообщества. Это нарушение может еще больше повлиять на круговорот питательных веществ и общее состояние экосистемы. [26]
Пищевая нитрат
[ редактировать ]Источником нитратов в рационе человека является потребление листовых зеленых продуктов, таких как шпинат и руккола . НЕТ −
3 может присутствовать в свекольном соке. Питьевая вода также является основным источником поступления нитратов. [27]
Прием нитратов быстро увеличивает концентрацию нитратов в плазме в 2–3 раза, и эта повышенная концентрация нитратов может сохраняться более 2 недель. Увеличение содержания нитратов в плазме увеличивает выработку оксида азота NO. Оксид азота представляет собой физиологическую сигнальную молекулу, которая, помимо прочего, участвует в регуляции мышечного кровотока и митохондриального дыхания. [28]
Соленое мясо
[ редактировать ]Нитрит ( NO - 2 ) потребление в первую очередь определяется количеством съеденного обработанного мяса и концентрацией нитратов ( НЕТ – 3 ) добавляют к этому мясу ( бекону , колбасам …) для его засолки. Хотя нитриты являются видами азота, которые в основном используются при консервировании мяса , нитраты также используются и могут превращаться в нитрит микроорганизмами или в процессе пищеварения, начиная с их растворения в слюне и их контакта с микробиотой рта. Нитриты приводят к образованию канцерогенных нитрозаминов . [29] Выработку нитрозаминов можно ингибировать за счет использования антиоксидантов витамина С и альфа-токофероловой формы витамина Е во время лечения. [30]
Многие мясоперерабатывающие предприятия заявляют, что их мясо (например, бекон) «необработанное» – это маркетинговое утверждение, не имеющее фактической основы: не существует такого понятия, как «необработанный» бекон (поскольку это, по сути, сырая нарезанная свиная грудинка). [31] [ нужен лучший источник ] «Необработанное» мясо на самом деле коптится с помощью нитритов практически без каких-либо различий в процессе – единственная разница заключается в требованиях маркировки Министерства сельского хозяйства США между нитритом растительного происхождения (например, из сельдерея) и «синтетическим» нитритом натрия. Можно провести аналогию с очищенной « морской солью » и хлоридом натрия – оба являются одним и тем же химическим веществом, с единственной существенной разницей в происхождении.
Антигипертензивные диеты, такие как диета DASH , обычно содержат высокие уровни нитратов, которые сначала восстанавливаются до нитритов в слюне , как это обнаружено при тестировании слюны , прежде чем образовывать оксид азота (NO). [27]
Корма для домашних животных
[ редактировать ]Симптомы отравления нитратами у домашних животных включают учащенное сердцебиение и дыхание; в запущенных случаях кровь и ткани могут стать синими или коричневыми. Корм можно проверить на нитраты; обработка заключается в дополнении или замене существующих запасов материалом с низким содержанием нитратов. Безопасные уровни нитратов для различных видов скота следующие: [32]
| Категория | %НО 3 | %NO 3 -N | % КНО3 | Эффекты |
|---|---|---|---|---|
| 1 | < 0,5 | < 0,12 | < 0,81 | В целом безопасен для мясного скота и овец. |
| 2 | 0.5–1.0 | 0.12–0.23 | 0.81–1.63 | Внимание: некоторые субклинические симптомы могут появиться у беременных лошадей, овец и мясного скота. |
| 3 | 1.0 | 0.23 | 1.63 | Проблемы с высоким содержанием нитратов: смертность и аборты могут возникать у мясного скота и овец |
| 4 | < 1,23 | < 0,28 | < 2,00 | Максимально безопасный уровень для лошадей. Не скармливайте беременным кобылам корма с высоким содержанием нитратов. |
Приведенные выше значения указаны для сухого (без влаги) материала.
Соли и ковалентные производные
[ редактировать ]Образование нитратов с элементами таблицы Менделеева:
См. также
[ редактировать ]- Аммоний
- Эвтрофикация
- f-система
- Диаграмма заморозков
- Нитрификация
- Нитратин
- Нитрит , анион NO −
2 - Оксид азота
- Триоксид азота , нейтральный радикал NO
3 - Пероксинитрат , OONO –
2 - Нитрат натрия
Ссылки
[ редактировать ]- ^ Перейти обратно: а б с д Лауэ В., Тиманн М., Шайблер Э., Виганд К.В. (2006). «Нитраты и нитриты». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a17_265 . ISBN 978-3527306732 .
- ^ Любош Э., Хэнди Д.Э., Лоскальцо Дж. (май 2008 г.). «Роль окислительного стресса и оксида азота в атеротромбозе» . Границы бионауки . 13 (13). ИМР Пресс: 5323–5344. дои : 10.2741/3084 . ПМЦ 2617738 . ПМИД 18508590 .
- ^ Муркрофт М.Дж., Дэвис Дж., Комптон Р.Г. (июнь 2001 г.). «Обнаружение и определение нитратов и нитритов: обзор». Таланта . 54 (5): 785–803. дои : 10.1016/S0039-9140(01)00323-X . ПМИД 18968301 .
- ^ Эллис Г., Адатия И., Язданпана М., Макела С.К. (июнь 1998 г.). «Анализ нитритов и нитратов: взгляд на клиническую биохимию». Клиническая биохимия . 31 (4): 195–220. дои : 10.1016/S0009-9120(98)00015-0 . ПМИД 9646943 .
- ^ Чжан ГБ, Мэн С., Гонг Дж.М. (ноябрь 2018 г.). «Ожидаемая и неожиданная роль переносчиков нитратов в устойчивости растений к абиотическому стрессу и их регуляция» . Международный журнал молекулярных наук . 19 (11): 3535. doi : 10.3390/ijms19113535 . ПМК 6274899 . ПМИД 30423982 .
- ^ Чуанг Х.П. (26 ноября 2018 г.). «Понимание путей трансформации видов азота и экспрессии функциональных генов целевыми игроками, участвующими в азотном цикле». Влияние . 2018 (8): 58–59. дои : 10.21820/23987073.2018.8.58 . ISSN 2398-7073 .
- ^ Лю Б, Ву Дж, Ян С, Шифельбейн Дж, Ган Ю (июль 2020 г.). Сюй Г (ред.). «Нитратная регуляция развития боковых корней и корневых волосков у растений» . Журнал экспериментальной ботаники . 71 (15): 4405–4414. дои : 10.1093/jxb/erz536 . ПМЦ 7382377 . ПМИД 31796961 .
- ^ Башир У, Лоне Ф.А., Бхат Р.А., Мир С.А., Дар З.А., Дар С.А. (2020). «Опасения и угрозы загрязнения водных экосистем». В Хаким К.Р., Бхат Р.А., Кадри Х. (ред.). Биоремедиация и биотехнология . Чам: Международное издательство Springer. стр. 1–26. дои : 10.1007/978-3-030-35691-0_1 . ISBN 978-3-030-35690-3 .
- ^ Кирхманн Х., Джонстон А.Э., Бергстрем Л.Ф. (август 2002 г.). «Возможности снижения выщелачивания нитратов из сельскохозяйственных земель». Амбио . 31 (5): 404–408. Бибкод : 2002Амбио..31..404К . дои : 10.1579/0044-7447-31.5.404 . ПМИД 12374048 .
- ^ Соман Б., Виджаярагаван Дж. (апрель 2017 г.). «Роль органических нитратов в оптимальном лечении стенокардии» . Электронный журнал кардиологической практики (2) . Проверено 30 октября 2023 г.
- ^ Паулсон Д.С., Аддискотт Т.М., Бенджамин Н., Кассман К.Г., де Кок Т.М., ван Гринсвен Х. и др. (2008). «Когда нитраты становятся опасными для человека?» . Журнал качества окружающей среды . 37 (2): 291–295. Бибкод : 2008JEnvQ..37..291P . дои : 10.2134/jeq2007.0177 . ПМИД 18268290 . S2CID 14097832 .
- ^ «Отравление нитратами и нитритами: Введение» . Ветеринарное руководство компании Merck . Проверено 27 декабря 2008 г.
- ^ Смит-Уитли К., Квятковски Дж.Л. (2000). «Глава 489: Гемоглобинопатии». В Клигман Р.М. (ред.). Учебник педиатрии Нельсона (21-е изд.). Elsevier Inc., стр. 2540–2558. ISBN 978-0-323-52950-1 .
- ^ Аддискотт Т.М., Бенджамин Н. (2006). «Нитраты и здоровье человека». Использование и управление почвами . 20 (2): 98–104. дои : 10.1111/j.1475-2743.2004.tb00344.x . S2CID 96297102 .
- ^ Эйвери А.А. (июль 1999 г.). «Детская метгемоглобинемия: пересмотр роли нитратов питьевой воды» . Перспективы гигиены окружающей среды . 107 (7): 583–6. дои : 10.1289/ehp.99107583 . ПМК 1566680 . ПМИД 10379005 .
- ^ Энциклопедия MedlinePlus : Цианотическая болезнь сердца.
- ^ Манассарам Д.М., Бэкер Л.К., Мессинг Р., Флеминг Л.Е., Люк Б., Монтейл К.П. (октябрь 2010 г.). «Нитраты в питьевой воде и уровень метгемоглобина во время беременности: продольное исследование» . Экологическое здоровье . 9 (1): 60. Бибкод : 2010EnvHe...9...60M . дои : 10.1186/1476-069x-9-60 . ПМЦ 2967503 . ПМИД 20946657 .
- ^ «4. Каковы правила EPA по содержанию нитратов в питьевой воде?» . Грунтовые и питьевые воды . Проверено 13 ноября 2018 г.
- ^ Багери Х., Хаджян А., Резаи М., Ширзадмехр А. (февраль 2017 г.). «Композит из наночастиц металла меди-многостенных углеродных нанотрубок-восстановленного оксида графена как новая и высокоэффективная платформа электрохимического сенсора для одновременного определения нитрита и нитрата». Журнал опасных материалов . 324 (Часть Б): 762–772. Бибкод : 2017JHzM..324..762B . дои : 10.1016/j.jhazmat.2016.11.055 . ПМИД 27894754 .
- ^ Романо Н., Цзэн С. (сентябрь 2007 г.). «Острая токсичность нитрата натрия, нитрата калия и хлорида калия и их влияние на состав гемолимфы и структуру жабр ранней молоди синих крабов-пловцов (Portunus pelagicus Linnaeus, 1758) (Decapoda, Brachyura, Portunidae)». Экологическая токсикология и химия . 26 (9): 1955–1962. дои : 10.1897/07-144р.1 . ПМИД 17705664 . S2CID 19854591 .
- ^ Шарп, Ширли. «Нитраты в аквариуме» . О сайте.com . Архивировано из оригинала 24 июля 2011 года . Проверено 30 октября 2013 г.
- ^ Романо Н., Цзэн С. (декабрь 2007 г.). «Влияние калия на нитрат-опосредованные изменения осморегуляции у морских крабов». Водная токсикология . 85 (3): 202–208. Бибкод : 2007AqTox..85..202R . дои : 10.1016/j.aquatox.2007.09.004 . ПМИД 17942166 .
- ^ Канакиду М., Мириокефалитакис С., Даскалакис Н., Фанургакис Г., Ненес А., Бейкер А.Р. и др. (май 2016 г.). «Прошлое, настоящее и будущее атмосферных осаждений азота» . Журнал атмосферных наук . 73 (5): 2039–2047. Бибкод : 2016JAtS...73.2039K . doi : 10.1175/JAS-D-15-0278.1 . ПМЦ 7398418 . ПМИД 32747838 .
- ^ Перейти обратно: а б «Глобальное потребление удобрений по питательным веществам, 1965-2021 гг.» . Статистика . Проверено 20 апреля 2024 г.
- ^ Ли Ю, Цзоу Н, Лян Х, Чжоу Х, Го С, Ван Ю и др. (10 января 2023 г.). «Влияние поступления азота на структуру почвенного бактериального сообщества и круговорот азота в ризосферной почве Lycium barbarum L» . Границы микробиологии . 13 : 1070817. doi : 10.3389/fmicb.2022.1070817 . ПМЦ 9871820 . ПМИД 36704567 .
- ^ Мелилло Дж. М. (апрель 2021 г.). «Нарушение глобального цикла азота: грандиозный вызов XXI века: эта статья входит в сборник, посвященный 50-летию Амбио. Тема: эвтрофикация» . Амбио . 50 (4): 759–763. дои : 10.1007/s13280-020-01429-2 . ПМЦ 7982378 . ПМИД 33534057 .
- ^ Перейти обратно: а б Хорд Н.Г., Тан Ю., Брайан Н.С. (июль 2009 г.). «Пищевые источники нитратов и нитритов: физиологический контекст потенциальной пользы для здоровья» . Американский журнал клинического питания . 90 (1): 1–10. дои : 10.3945/ajcn.2008.27131 . ПМИД 19439460 .
- ^ Моэн Р.Дж. (2013). Еда, питание и спортивные результаты III . Нью-Йорк: Тейлор и Фрэнсис. п. 63. ИСБН 978-0-415-62792-4 .
- ^ Бингхэм С.А., Хьюз Р., Кросс А.Дж. (ноябрь 2002 г.). «Влияние белого и красного мяса на эндогенное N-нитрозирование в толстой кишке человека и дополнительные доказательства реакции на дозу» . Журнал питания . 132 (11 Доп.): 3522S–3525S. дои : 10.1093/jn/132.11.3522S . ПМИД 12421881 .
- ^ Партасарати Д.К., Брайан Н.С. (ноябрь 2012 г.). «Нитрит натрия: «лекарство» от недостаточности оксида азота». Мясная наука . 92 (3): 274–279. doi : 10.1016/j.meatsci.2012.03.001 . ПМИД 22464105 .
- ^ «Есть ли разница между вяленым и невяленым беконом?» . 9 декабря 2022 г.
- ^ «Нитратный риск в кормовых культурах – часто задаваемые вопросы» . Сельское хозяйство и развитие сельских районов . Правительство Альберты . Проверено 30 октября 2013 г.
