Серебро
 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Серебро | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Появление | блестящий белый металл | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Стандартный атомный вес А р °(В) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Серебро в таблице Менделеева | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Атомный номер ( Z ) | 47 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Группа | группа 11 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Период | период 5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Блокировать | d-блок | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Электронная конфигурация | [ Кр ] 4д 10 5 с 1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Электроны на оболочку | 2, 8, 18, 18, 1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Физические свойства | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Фаза в СТП | твердый | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Температура плавления | 1234,93 К (961,78 °С, 1763,2 °F) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Точка кипения | 2435 К (2162 °С, 3924 °F) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Плотность (при 20°С) | 10,503 г/см 3 [ 3 ] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| в жидком состоянии (при температуре плавления ) | 9,320 г/см 3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Теплота плавления | 11,28 кДж/моль | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Теплота испарения | 254 кДж/моль | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Молярная теплоемкость | 25350 Дж/(моль К) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Давление пара
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Атомные свойства | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Стадии окисления | −2, −1, 0, [ 4 ] +1 , +2, +3 ( амфотерный оксид) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Электроотрицательность | Шкала Полинга: 1,93. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Энергии ионизации |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Атомный радиус | эмпирический: 144 вечера | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ковалентный радиус | 145±17:00 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Радиус Ван-дер-Ваальса | 172 вечера | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Другие объекты недвижимости | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Естественное явление | первобытный | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Кристаллическая структура | гранецентрированная кубическая (ГЦК) ( cF4 ) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Постоянная решетки | а = 408,60 вечера (при 20 ° C) [ 3 ] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Тепловое расширение | 18.92 × 10 −6 /К (при 20 °С) [ 3 ] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Теплопроводность | 429 Вт/(м⋅К) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Температуропроводность | 174 мм 2 /с (при 300 К) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Электрическое сопротивление | 15,87 нОм⋅м (при 20 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Магнитный заказ | диамагнитный [ 5 ] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Молярная магнитная восприимчивость | −19.5 × 10 −6 см 3 /mol (296 K) [ 6 ] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Модуль Юнга | 83 ГПа | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Модуль сдвига | 30 ГПа | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Объемный модуль | 100 ГПа | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Скорость звука тонкого стержня | 2680 м/с (при комнатной температуре ) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| коэффициент Пуассона | 0.37 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Твердость по шкале Мооса | 2.5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Твердость по Виккерсу | 251 МПа | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Твердость по Бринеллю | 206–250 МПа | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Номер CAS | 7440-22-4 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| История | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Открытие | до 5000 г. до н.э. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Символ | «Ag»: от латинского argentum. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Изотопы серебра | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Серебро — химический элемент ; он имеет символ Ag (от латинского argentum «серебро», происходящего от протоиндоевропейского *h₂erϵ « блестящий, белый » ) и атомный номер 47. Мягкий, белый, блестящий переходный металл , он демонстрирует высочайшую электропроводность и теплопроводность. и отражательная способность любого металла . [ 8 ] Серебро встречается в земной коре в чистой, свободной элементарной форме (« самородное серебро»), в виде сплава с золотом и другими металлами, а также в таких минералах, как аргентит и хлораргирит . Большая часть серебра производится как побочный продукт меди , золота, свинца и цинка переработки .
Серебро издавна ценилось как драгоценный металл . Металлическое серебро используется во многих инвестиционных монетах , иногда вместе с золотом : [ 9 ] хотя его больше, чем золота, его гораздо меньше, чем самородного металла . [ 10 ] Его чистота обычно измеряется на промилле ; сплав с чистотой 94% описывается как «тонкий 0,940». Серебро , как один из семи металлов древности , играло непреходящую роль в большинстве человеческих культур.
Помимо валюты и инвестиционного средства ( монеты и слитки ), серебро используется в солнечных батареях , фильтрации воды , ювелирных изделиях , украшениях, дорогой посуде и утварях (отсюда и термин « серебряные изделия »), в электрических контактах и проводниках . в специализированных зеркалах, покрытиях для окон, в катализе химических реакций, в качестве красителя в витражах и в специализированных кондитерских изделиях. Его соединения используются в фото- и рентгеновской пленке. Разбавленные растворы нитрата серебра и других соединений серебра применяют как дезинфицирующие и микробиоциды ( олигодинамический эффект ), добавляют в повязки , раневые повязки, катетеры и др. медицинский инструментарий .
Характеристики

Серебро по своим физическим и химическим свойствам похоже на двух своих соседей по вертикали в 11-й группе таблицы Менделеева : медь и золото . Его 47 электронов расположены в конфигурации [Kr]4d 10 5 с 1 , аналогично меди ([Ar]3d 10 4 с 1 ) и золото ([Xe]4f 14 5д 10 6 с 1 ); группа 11 — одна из немногих групп d-блока , имеющая полностью согласованный набор электронных конфигураций. [ 12 ] Эта характерная электронная конфигурация с единственным электроном в самой высокой занятой подоболочке s над заполненной подоболочкой d, объясняет многие необычные свойства металлического серебра. [ 13 ]
Серебро — относительно мягкий, чрезвычайно пластичный и податливый переходный металл , хотя оно немного менее податливо, чем золото. Серебро кристаллизуется в гранецентрированной кубической решетке с объемным координационным числом 12, в которой делокализован только один 5s-электрон, подобно меди и золоту. [ 14 ] В отличие от металлов с неполной d-оболочкой металлические связи в серебре не имеют ковалентного характера и относительно слабы. Это наблюдение объясняет низкую твердость и высокую пластичность монокристаллов серебра. [ 15 ]
Серебро имеет блестящий белый металлический блеск, который можно полировать до блеска . [ 16 ] и который настолько характерен, что само название металла превратилось в название цвета . [ 13 ] Защищенное серебро имеет большую оптическую отражательную способность , чем алюминий, на всех длинах волн длиннее ~ 450 нм. [ 17 ] На длинах волн короче 450 нм отражательная способность серебра уступает отражательной способности алюминия и падает до нуля вблизи 310 нм. [ 18 ]
Элементам группы 11 свойственна очень высокая электро- и теплопроводность, поскольку их единственный s-электрон свободен и не взаимодействует с заполненной d-подоболочкой, поскольку такие взаимодействия (которые происходят в предыдущих переходных металлах) снижают подвижность электронов. [ 19 ] Теплопроводность сверхтекучего гелия серебра одна из самых высоких из всех материалов, хотя теплопроводность углерода (в алмаза аллотропе ) и -4 выше. [ 12 ] Электропроводность . серебра самая высокая из всех металлов, даже выше, чем у меди Серебро также имеет самое низкое контактное сопротивление среди всех металлов. [ 12 ] Серебро редко используется из-за его электропроводности из-за его высокой стоимости, хотя исключение составляет радиочастотная техника , особенно на УКВ и более высоких частотах, где серебряное покрытие улучшает электропроводность, поскольку эти токи имеют тенденцию течь по поверхности проводников, а не по поверхности. через интерьер. Во время Второй мировой войны в США было использовано 13540 тонн серебра для изготовления электромагнитов в калютронах для обогащения урана , главным образом из-за дефицита меди во время войны. [ 20 ] [ 21 ] [ 22 ]
Серебро легко образует сплавы с медью, золотом и цинком . Сплавы цинка с серебром с низкой концентрацией цинка можно рассматривать как гранецентрированные кубические твердые растворы цинка в серебре, поскольку структура серебра практически не меняется, а концентрация электронов возрастает по мере добавления цинка. Дальнейшее увеличение концентрации электронов приводит к образованию объемноцентрированной кубической (концентрация электронов 1,5), сложной кубической (1,615) и гексагональной плотноупакованных фаз (1,75). [ 14 ]
изотопы
Встречающееся в природе серебро состоит из двух стабильных изотопов : 107 АГ и 109 Аг, с 107 Ag немного более распространен (51,839% естественной распространенности ). Такое почти равное содержание редко встречается в периодической таблице. Атомный вес 107,8682(2) u ; [ 23 ] [ 24 ] это значение очень важно из-за важности соединений серебра, особенно галогенидов, в гравиметрическом анализе . [ 23 ] Оба изотопа серебра производятся в звездах посредством s-процесса (медленный захват нейтронов), а также в сверхновых посредством r-процесса (быстрый захват нейтронов). [ 25 ]
двадцать восемь радиоизотопов , наиболее стабильным из которых является Охарактеризовано 105 Ag с периодом полураспада 41,29 дней, 111 Ag с периодом полураспада 7,45 дней и 112 Ag с периодом полураспада 3,13 часа. Серебро имеет множество ядерных изомеров , наиболее стабильным из которых является 108 м Ag ( t 1/2 = 418 лет), 110 м Ag ( t 1/2 = 249,79 дней) и 106 м Ag (t1/2 = 8.28 days). All of the remaining radioactive isotopes have half-lives of less than an hour, and the majority of these have half-lives of less than three minutes.[26]
Isotopes of silver range in relative atomic mass from 92.950 u (93Ag) to 129.950 u (130Ag);[27] the primary decay mode before the most abundant stable isotope, 107Ag, is electron capture and the primary mode after is beta decay. The primary decay products before 107Ag are palladium (element 46) isotopes, and the primary products after are cadmium (element 48) isotopes.[26]
The palladium isotope 107Pd decays by beta emission to 107Ag with a half-life of 6.5 million years. Iron meteorites are the only objects with a high-enough palladium-to-silver ratio to yield measurable variations in 107Ag abundance. Radiogenic 107Ag was first discovered in the Santa Clara meteorite in 1978.[28] 107Pd–107Ag correlations observed in bodies that have clearly been melted since the accretion of the Solar System must reflect the presence of unstable nuclides in the early Solar System.[29]
Chemistry
| Oxidation state |
Coordination number |
Stereochemistry | Representative compound |
|---|---|---|---|
| 0 (d10s1) | 3 | Planar | Ag(CO)3 |
| 1 (d10) | 2 | Linear | [Ag(CN)2]− |
| 3 | Trigonal planar | AgI(PEt2Ar)2 | |
| 4 | Tetrahedral | [Ag(diars)2]+ | |
| 6 | Octahedral | AgF, AgCl, AgBr | |
| 2 (d9) | 4 | Square planar | [Ag(py)4]2+ |
| 3 (d8) | 4 | Square planar | [AgF4]− |
| 6 | Octahedral | [AgF6]3− |
Silver is a rather unreactive metal. This is because its filled 4d shell is not very effective in shielding the electrostatic forces of attraction from the nucleus to the outermost 5s electron, and hence silver is near the bottom of the electrochemical series (E0(Ag+/Ag) = +0.799 V).[13] In group 11, silver has the lowest first ionization energy (showing the instability of the 5s orbital), but has higher second and third ionization energies than copper and gold (showing the stability of the 4d orbitals), so that the chemistry of silver is predominantly that of the +1 oxidation state, reflecting the increasingly limited range of oxidation states along the transition series as the d-orbitals fill and stabilize.[31] Unlike copper, for which the larger hydration energy of Cu2+ as compared to Cu+ is the reason why the former is the more stable in aqueous solution and solids despite lacking the stable filled d-subshell of the latter, with silver this effect is swamped by its larger second ionisation energy. Hence, Ag+ is the stable species in aqueous solution and solids, with Ag2+ being much less stable as it oxidizes water.[31]
Most silver compounds have significant covalent character due to the small size and high first ionization energy (730.8 kJ/mol) of silver.[13] Furthermore, silver's Pauling electronegativity of 1.93 is higher than that of lead (1.87), and its electron affinity of 125.6 kJ/mol is much higher than that of hydrogen (72.8 kJ/mol) and not much less than that of oxygen (141.0 kJ/mol).[32] Due to its full d-subshell, silver in its main +1 oxidation state exhibits relatively few properties of the transition metals proper from groups 4 to 10, forming rather unstable organometallic compounds, forming linear complexes showing very low coordination numbers like 2, and forming an amphoteric oxide[33] as well as Zintl phases like the post-transition metals.[34] Unlike the preceding transition metals, the +1 oxidation state of silver is stable even in the absence of π-acceptor ligands.[31]
Silver does not react with air, even at red heat, and thus was considered by alchemists as a noble metal, along with gold. Its reactivity is intermediate between that of copper (which forms copper(I) oxide when heated in air to red heat) and gold. Like copper, silver reacts with sulfur and its compounds; in their presence, silver tarnishes in air to form the black silver sulfide (copper forms the green sulfate instead, while gold does not react). While silver is not attacked by non-oxidizing acids, the metal dissolves readily in hot concentrated sulfuric acid, as well as dilute or concentrated nitric acid. In the presence of air, and especially in the presence of hydrogen peroxide, silver dissolves readily in aqueous solutions of cyanide.[30]
The three main forms of deterioration in historical silver artifacts are tarnishing, formation of silver chloride due to long-term immersion in salt water, as well as reaction with nitrate ions or oxygen. Fresh silver chloride is pale yellow, becoming purplish on exposure to light; it projects slightly from the surface of the artifact or coin. The precipitation of copper in ancient silver can be used to date artifacts, as copper is nearly always a constituent of silver alloys.[35]
Silver metal is attacked by strong oxidizers such as potassium permanganate (KMnO
4) and potassium dichromate (K
2Cr
2O
7), and in the presence of potassium bromide (KBr). These compounds are used in photography to bleach silver images, converting them to silver bromide that can either be fixed with thiosulfate or redeveloped to intensify the original image. Silver forms cyanide complexes (silver cyanide) that are soluble in water in the presence of an excess of cyanide ions. Silver cyanide solutions are used in electroplating of silver.[36]
The common oxidation states of silver are (in order of commonness): +1 (the most stable state; for example, silver nitrate, AgNO3); +2 (highly oxidising; for example, silver(II) fluoride, AgF2); and even very rarely +3 (extreme oxidising; for example, potassium tetrafluoroargentate(III), KAgF4).[37] The +3 state requires very strong oxidising agents to attain, such as fluorine or peroxodisulfate, and some silver(III) compounds react with atmospheric moisture and attack glass.[38] Indeed, silver(III) fluoride is usually obtained by reacting silver or silver monofluoride with the strongest known oxidizing agent, krypton difluoride.[39]
Compounds
Oxides and chalcogenides

Silver and gold have rather low chemical affinities for oxygen, lower than copper, and it is therefore expected that silver oxides are thermally quite unstable. Soluble silver(I) salts precipitate dark-brown silver(I) oxide, Ag2O, upon the addition of alkali. (The hydroxide AgOH exists only in solution; otherwise it spontaneously decomposes to the oxide.) Silver(I) oxide is very easily reduced to metallic silver, and decomposes to silver and oxygen above 160 °C.[40] This and other silver(I) compounds may be oxidized by the strong oxidizing agent peroxodisulfate to black AgO, a mixed silver(I,III) oxide of formula AgIAgIIIO2. Some other mixed oxides with silver in non-integral oxidation states, namely Ag2O3 and Ag3O4, are also known, as is Ag3O which behaves as a metallic conductor.[40]
Silver(I) sulfide, Ag2S, is very readily formed from its constituent elements and is the cause of the black tarnish on some old silver objects. It may also be formed from the reaction of hydrogen sulfide with silver metal or aqueous Ag+ ions. Many non-stoichiometric selenides and tellurides are known; in particular, AgTe~3 is a low-temperature superconductor.[40]
Halides

The only known dihalide of silver is the difluoride, AgF2, which can be obtained from the elements under heat. A strong yet thermally stable and therefore safe fluorinating agent, silver(II) fluoride is often used to synthesize hydrofluorocarbons.[41]
In stark contrast to this, all four silver(I) halides are known. The fluoride, chloride, and bromide have the sodium chloride structure, but the iodide has three known stable forms at different temperatures; that at room temperature is the cubic zinc blende structure. They can all be obtained by the direct reaction of their respective elements.[41] As the halogen group is descended, the silver halide gains more and more covalent character, solubility decreases, and the colour changes from the white chloride to the yellow iodide as the energy required for ligand-metal charge transfer (X−Ag+ → XAg) decreases.[41] The fluoride is anomalous, as the fluoride ion is so small that it has a considerable solvation energy and hence is highly water-soluble and forms di- and tetrahydrates.[41] The other three silver halides are highly insoluble in aqueous solutions and are very commonly used in gravimetric analytical methods.[23] All four are photosensitive (though the monofluoride is so only to ultraviolet light), especially the bromide and iodide which photodecompose to silver metal, and thus were used in traditional photography.[41] The reaction involved is:[42]
- X− + hν → X + e− (excitation of the halide ion, which gives up its extra electron into the conduction band)
- Ag+ + e− → Ag (liberation of a silver ion, which gains an electron to become a silver atom)
The process is not reversible because the silver atom liberated is typically found at a crystal defect or an impurity site, so that the electron's energy is lowered enough that it is "trapped".[42]
Other inorganic compounds

White silver nitrate, AgNO3, is a versatile precursor to many other silver compounds, especially the halides, and is much less sensitive to light. It was once called lunar caustic because silver was called luna by the ancient alchemists, who believed that silver was associated with the Moon.[43][44] It is often used for gravimetric analysis, exploiting the insolubility of the heavier silver halides which it is a common precursor to.[23] Silver nitrate is used in many ways in organic synthesis, e.g. for deprotection and oxidations. Ag+ binds alkenes reversibly, and silver nitrate has been used to separate mixtures of alkenes by selective absorption. The resulting adduct can be decomposed with ammonia to release the free alkene.[45]
Yellow silver carbonate, Ag2CO3 can be easily prepared by reacting aqueous solutions of sodium carbonate with a deficiency of silver nitrate.[46] Its principal use is for the production of silver powder for use in microelectronics. It is reduced with formaldehyde, producing silver free of alkali metals:[47]
- Ag2CO3 + CH2O → 2 Ag + 2 CO2 + H2
Silver carbonate is also used as a reagent in organic synthesis such as the Koenigs–Knorr reaction. In the Fétizon oxidation, silver carbonate on celite acts as an oxidising agent to form lactones from diols. It is also employed to convert alkyl bromides into alcohols.[46]
Silver fulminate, AgCNO, a powerful, touch-sensitive explosive used in percussion caps, is made by reaction of silver metal with nitric acid in the presence of ethanol. Other dangerously explosive silver compounds are silver azide, AgN3, formed by reaction of silver nitrate with sodium azide,[48] and silver acetylide, Ag2C2, formed when silver reacts with acetylene gas in ammonia solution.[31] In its most characteristic reaction, silver azide decomposes explosively, releasing nitrogen gas: given the photosensitivity of silver salts, this behaviour may be induced by shining a light on its crystals.[31]
- 2 AgN
3 (s) → 3 N
2 (g) + 2 Ag (s)
Coordination compounds

Silver complexes tend to be similar to those of its lighter homologue copper. Silver(III) complexes tend to be rare and very easily reduced to the more stable lower oxidation states, though they are slightly more stable than those of copper(III). For instance, the square planar periodate [Ag(IO5OH)2]5− and tellurate [Ag{TeO4(OH)2}2]5− complexes may be prepared by oxidising silver(I) with alkaline peroxodisulfate. The yellow diamagnetic [AgF4]− is much less stable, fuming in moist air and reacting with glass.[38]
Silver(II) complexes are more common. Like the valence isoelectronic copper(II) complexes, they are usually square planar and paramagnetic, which is increased by the greater field splitting for 4d electrons than for 3d electrons. Aqueous Ag2+, produced by oxidation of Ag+ by ozone, is a very strong oxidising agent, even in acidic solutions: it is stabilized in phosphoric acid due to complex formation. Peroxodisulfate oxidation is generally necessary to give the more stable complexes with heterocyclic amines, such as [Ag(py)4]2+ and [Ag(bipy)2]2+: these are stable provided the counterion cannot reduce the silver back to the +1 oxidation state. [AgF4]2− is also known in its violet barium salt, as are some silver(II) complexes with N- or O-donor ligands such as pyridine carboxylates.[49]
By far the most important oxidation state for silver in complexes is +1. The Ag+ cation is diamagnetic, like its homologues Cu+ and Au+, as all three have closed-shell electron configurations with no unpaired electrons: its complexes are colourless provided the ligands are not too easily polarized such as I−. Ag+ forms salts with most anions, but it is reluctant to coordinate to oxygen and thus most of these salts are insoluble in water: the exceptions are the nitrate, perchlorate, and fluoride. The tetracoordinate tetrahedral aqueous ion [Ag(H2O)4]+ is known, but the characteristic geometry for the Ag+ cation is 2-coordinate linear. For example, silver chloride dissolves readily in excess aqueous ammonia to form [Ag(NH3)2]+; silver salts are dissolved in photography due to the formation of the thiosulfate complex [Ag(S2O3)2]3−; and cyanide extraction for silver (and gold) works by the formation of the complex [Ag(CN)2]−. Silver cyanide forms the linear polymer {Ag–C≡N→Ag–C≡N→}; silver thiocyanate has a similar structure, but forms a zigzag instead because of the sp3-hybridized sulfur atom. Chelating ligands are unable to form linear complexes and thus silver(I) complexes with them tend to form polymers; a few exceptions exist, such as the near-tetrahedral diphosphine and diarsine complexes [Ag(L–L)2]+.[50]
Organometallic
Under standard conditions, silver does not form simple carbonyls, due to the weakness of the Ag–C bond. A few are known at very low temperatures around 6–15 K, such as the green, planar paramagnetic Ag(CO)3, which dimerizes at 25–30 K, probably by forming Ag–Ag bonds. Additionally, the silver carbonyl [Ag(CO)] [B(OTeF5)4] is known. Polymeric AgLX complexes with alkenes and alkynes are known, but their bonds are thermodynamically weaker than even those of the platinum complexes (though they are formed more readily than those of the analogous gold complexes): they are also quite unsymmetrical, showing the weak π bonding in group 11. Ag–C σ bonds may also be formed by silver(I), like copper(I) and gold(I), but the simple alkyls and aryls of silver(I) are even less stable than those of copper(I) (which tend to explode under ambient conditions). For example, poor thermal stability is reflected in the relative decomposition temperatures of AgMe (−50 °C) and CuMe (−15 °C) as well as those of PhAg (74 °C) and PhCu (100 °C).[51]
The C–Ag bond is stabilized by perfluoroalkyl ligands, for example in AgCF(CF3)2.[52] Alkenylsilver compounds are also more stable than their alkylsilver counterparts.[53] Silver-NHC complexes are easily prepared, and are commonly used to prepare other NHC complexes by displacing labile ligands. For example, the reaction of the bis(NHC)silver(I) complex with bis(acetonitrile)palladium dichloride or chlorido(dimethyl sulfide)gold(I):[54]
Intermetallic

Silver forms alloys with most other elements on the periodic table. The elements from groups 1–3, except for hydrogen, lithium, and beryllium, are very miscible with silver in the condensed phase and form intermetallic compounds; those from groups 4–9 are only poorly miscible; the elements in groups 10–14 (except boron and carbon) have very complex Ag–M phase diagrams and form the most commercially important alloys; and the remaining elements on the periodic table have no consistency in their Ag–M phase diagrams. By far the most important such alloys are those with copper: most silver used for coinage and jewellery is in reality a silver–copper alloy, and the eutectic mixture is used in vacuum brazing. The two metals are completely miscible as liquids but not as solids; their importance in industry comes from the fact that their properties tend to be suitable over a wide range of variation in silver and copper concentration, although most useful alloys tend to be richer in silver than the eutectic mixture (71.9% silver and 28.1% copper by weight, and 60.1% silver and 28.1% copper by atom).[55]
Most other binary alloys are of little use: for example, silver–gold alloys are too soft and silver–cadmium alloys too toxic. Ternary alloys have much greater importance: dental amalgams are usually silver–tin–mercury alloys, silver–copper–gold alloys are very important in jewellery (usually on the gold-rich side) and have a vast range of hardnesses and colours, silver–copper–zinc alloys are useful as low-melting brazing alloys, and silver–cadmium–indium (involving three adjacent elements on the periodic table) is useful in nuclear reactors because of its high thermal neutron capture cross-section, good conduction of heat, mechanical stability, and resistance to corrosion in hot water.[55]
Etymology
The word silver appears in Old English in various spellings, such as seolfor and siolfor. It is cognate with Old High German silabar; Gothic silubr; or Old Norse silfr, all ultimately deriving from Proto-Germanic *silubra. The Balto-Slavic words for silver are rather similar to the Germanic ones (e.g. Russian серебро [serebró], Polish srebro, Lithuanian sidãbras), as is the Celtiberian form silabur. They may have a common Indo-European origin, although their morphology rather suggest a non-Indo-European Wanderwort.[56][57] Some scholars have thus proposed a Paleo-Hispanic origin, pointing to the Basque form zilharr as an evidence.[58]
The chemical symbol Ag is from the Latin word for silver, argentum (compare Ancient Greek ἄργυρος, árgyros), from the Proto-Indo-European root *h₂erǵ- (formerly reconstructed as *arǵ-), meaning 'white' or 'shining'. This was the usual Proto-Indo-European word for the metal, whose reflexes are missing in Germanic and Balto-Slavic.[57]
History


Silver was known in prehistoric times:[59] the three metals of group 11, copper, silver, and gold, occur in the elemental form in nature and were probably used as the first primitive forms of money as opposed to simple bartering.[60] However, unlike copper, silver did not lead to the growth of metallurgy on account of its low structural strength, and was more often used ornamentally or as money.[61] Since silver is more reactive than gold, supplies of native silver were much more limited than those of gold.[60] For example, silver was more expensive than gold in Egypt until around the fifteenth century BC:[62] the Egyptians are thought to have separated gold from silver by heating the metals with salt, and then reducing the silver chloride produced to the metal.[63]
The situation changed with the discovery of cupellation, a technique that allowed silver metal to be extracted from its ores. While slag heaps found in Asia Minor and on the islands of the Aegean Sea indicate that silver was being separated from lead as early as the 4th millennium BC,[12] and one of the earliest silver extraction centres in Europe was Sardinia in the early Chalcolithic period,[64] these techniques did not spread widely until later, when it spread throughout the region and beyond.[62] The origins of silver production in India, China, and Japan were almost certainly equally ancient, but are not well-documented due to their great age.[63]

When the Phoenicians first came to what is now Spain, they obtained so much silver that they could not fit it all on their ships, and as a result used silver to weight their anchors instead of lead.[62] By the time of the Greek and Roman civilizations, silver coins were a staple of the economy:[60] the Greeks were already extracting silver from galena by the 7th century BC,[62] and the rise of Athens was partly made possible by the nearby silver mines at Laurium, from which they extracted about 30 tonnes a year from 600 to 300 BC.[65] The stability of the Roman currency relied to a high degree on the supply of silver bullion, mostly from Spain, which Roman miners produced on a scale unparalleled before the discovery of the New World. Reaching a peak production of 200 tonnes per year, an estimated silver stock of 10,000 tonnes circulated in the Roman economy in the middle of the second century AD, five to ten times larger than the combined amount of silver available to medieval Europe and the Abbasid Caliphate around AD 800.[66][67] The Romans also recorded the extraction of silver in central and northern Europe in the same time period. This production came to a nearly complete halt with the fall of the Roman Empire, not to resume until the time of Charlemagne: by then, tens of thousands of tonnes of silver had already been extracted.[63]
Central Europe became the centre of silver production during the Middle Ages, as the Mediterranean deposits exploited by the ancient civilisations had been exhausted. Silver mines were opened in Bohemia, Saxony, Alsace, the Lahn region, Siegerland, Silesia, Hungary, Norway, Steiermark, Schwaz, and the southern Black Forest. Most of these ores were quite rich in silver and could simply be separated by hand from the remaining rock and then smelted; some deposits of native silver were also encountered. Many of these mines were soon exhausted, but a few of them remained active until the Industrial Revolution, before which the world production of silver was around a meagre 50 tonnes per year.[63] In the Americas, high temperature silver-lead cupellation technology was developed by pre-Inca civilizations as early as AD 60–120; silver deposits in India, China, Japan, and pre-Columbian America continued to be mined during this time.[63][68]
With the discovery of America and the plundering of silver by the Spanish conquistadors, Central and South America became the dominant producers of silver until around the beginning of the 18th century, particularly Peru, Bolivia, Chile, and Argentina:[63] the last of these countries later took its name from that of the metal that composed so much of its mineral wealth.[65] The silver trade gave way to a global network of exchange. As one historian put it, silver "went round the world and made the world go round."[69] Much of this silver ended up in the hands of the Chinese. A Portuguese merchant in 1621 noted that silver "wanders throughout all the world... before flocking to China, where it remains as if at its natural center."[70] Still, much of it went to Spain, allowing Spanish rulers to pursue military and political ambitions in both Europe and the Americas. "New World mines", concluded several historians, "supported the Spanish empire."[71]
In the 19th century, primary production of silver moved to North America, particularly Canada, Mexico, and Nevada in the United States: some secondary production from lead and zinc ores also took place in Europe, and deposits in Siberia and the Russian Far East as well as in Australia were mined.[63] Poland emerged as an important producer during the 1970s after the discovery of copper deposits that were rich in silver, before the centre of production returned to the Americas the following decade. Today, Peru and Mexico are still among the primary silver producers, but the distribution of silver production around the world is quite balanced and about one-fifth of the silver supply comes from recycling instead of new production.[63]
-
Протоэламский бык, стоящий на коленях и держащий сосуд с фонтаном; 3100–2900 гг. до н. э.; 16,3×6,3×10,8 см; Метрополитен-музей (Нью-Йорк)
-
Древнеегипетская фигурка Гора в образе бога-сокола с египетской короной; в. 500 г. до н.э .; серебро и электрум ; высота: 26,9 см; Государственная коллекция египетского искусства ( Мюнхен , Германия)
-
Древнегреческая тетрадрахма ; 315–308 гг. до н. э.; диаметр: 2,7 см; Метрополитен-музей
-
Древнегреческая позолоченная чаша; 2–1 век до н. э.; высота: 7,6 см, диаметр: 14,8 см; Метрополитен-музей
-
римская тарелка; I – II века нашей эры; высота: 0,1 см, диаметр: 12,7 см; Метрополитен-музей
-
Римский бюст Сераписа ; 2 ст.; 15,6×9,5 см; Метрополитен-музей
-
Аурикулярный таз со сценами из истории Дианы и Актеона; 1613; длина: 50 см, высота: 6 см, ширина: 40 см; Рейксмузеум ( Амстердам , Нидерланды )
-
супница во французском стиле рококо ; 1749 г.; высота: 26,3 см, ширина: 39 см, глубина: 24 см; Метрополитен-музей
-
кофейник французского рококо; 1757 г.; высота: 29,5 см; Метрополитен-музей
-
Французский неоклассический кувшин; 1784–1785; высота: 32,9 см; Метрополитен-музей
-
в стиле неорококо кофейник ; 1845 г.; общий размер: 32×23,8×15,4 см; Кливлендский художественный музей ( Кливленд , Огайо , США)
-
французского модерна десертные ложки ; около 1890 г.; Купер Хьюитт, Смитсоновский музей дизайна (Нью-Йорк)
-
жардиньерка в стиле модерн; около 1905–1910 гг.; высота: 22 см, ширина: 47 см, глубина: 22,5 см; Купер Хьюитт, Смитсоновский музей дизайна
Символическая роль

Серебро играет определенную роль в мифологии и нашло различное использование в качестве метафоры и в фольклоре. Греческий поэт Гесиод в «Трудах и днях » (строки 109–201) перечисляет разные возрасты человека, названные в честь таких металлов, как золото, серебро, бронза и железо, чтобы объяснить последовательные эпохи человечества. [ 72 ] содержат » Овидия «Метаморфозы еще один пересказ истории, содержащий иллюстрацию метафорического использования серебра для обозначения второго лучшего в ряду, лучшего, чем бронза, но хуже, чем золото:
Но когда добрый Сатурн изгнан сверху,
Был загнан в ад, мир находился под властью Юпитера .
Наступают последующие времена, вот серебряный век,
Превосходная латунь, но еще более превосходящая золото.- Овидий, Метаморфозы , Книга I, пер. Джон Драйден
В фольклоре обычно считалось, что серебро обладает мистическими способностями: например, пуля, отлитая из серебра, часто считается в таком фольклоре единственным оружием, эффективным против оборотня , ведьмы или других монстров . [ 73 ] [ 74 ] [ 75 ] Отсюда идиома « серебряная пуля» превратилась в образное обозначение любого простого решения с очень высокой эффективностью или почти чудесными результатами, как в широко обсуждаемой статье по разработке программного обеспечения « Нет серебряной пули ». [ 76 ] Другие способности, приписываемые серебру, включают обнаружение яда и облегчение перехода в мифическое царство фей . [ 75 ]
Производство серебра также вдохновило образный язык. Явные упоминания о купелировании встречаются во всем Ветхом Завете Библии . , например, в упреке Иеремии Иуде: «Мехи сгорают, свинец сгорает в огне, плавит напрасно, ибо нечестивые не исторгаются» ... Нечестивым серебром назовут их люди, потому что Господь отверг их». (Иеремия 6:19–20) Иеремия также знал о листовом серебре, которое служило примером ковкости и пластичности металла: «Серебро, разложенное на пластины, привозится из Фарсиса, а золото из Уфаза, дело рук и рук основателя: синяя и пурпурная одежда их: все они — дело хитрых людей». (Иеремия 10:9) [ 62 ]
Серебро также имеет более негативное культурное значение: идиома «тридцать сребреников» , относящаяся к награде за предательство, отсылает к взятке, которую, Иуда Искариот как сказано в Новом Завете, взял у еврейских лидеров в Иерусалиме, чтобы передать Иисуса из Назарета солдатам первосвященник Каиафа. [ 77 ] С этической точки зрения серебро также символизирует жадность и деградацию сознания; это отрицательный аспект, извращение его ценности. [ 78 ]
Возникновение и производство

Содержание серебра в земной коре составляет 0,08 частей на миллион , что почти точно такое же, как у ртути . Чаще всего он встречается в сульфидных рудах, особенно в акантите и аргентите , Ag 2 S. Месторождения аргентита иногда содержат и самородное серебро, когда они встречаются в восстановительных средах, а при контакте с соленой водой превращаются в хлораргирит (в том числе роговое серебро ), AgCl, который распространен в Чили и Новом Южном Уэльсе . [ 79 ] Большинство других минералов серебра представляют собой пниктиды или халькогениды серебра ; Обычно это блестящие полупроводники. Большинство настоящих месторождений серебра, в отличие от серебристых месторождений других металлов, произошло в результате вулканизма третичного периода . [ 80 ]
Основными источниками серебра являются руды меди, медно-никелевые, свинцовые и свинцово-цинковые руды, добываемые в Перу , Боливии , Мексике , Китае , Австралии , Чили , Польше и Сербии . [ 12 ] Перу, Боливия и Мексика добывают серебро с 1546 года и до сих пор являются крупнейшими мировыми производителями. Крупнейшие рудники по добыче серебра — Каннингтон (Австралия), Фреснильо (Мексика), Сан-Кристобаль (Боливия), Антамина (Перу), Рудна (Польша) и Пенаскито (Мексика). [ 81 ] Крупнейшими проектами разработки месторождений на ближайшую перспективу до 2015 года являются Паскуа Лама (Чили), Навидад (Аргентина), Хаунисипио (Мексика), Малку Хота (Боливия), [ 82 ] и река Хакетт (Канада). [ 81 ] Известно, что в Центральной Азии Таджикистан обладает одними из крупнейших месторождений серебра в мире. [ 83 ]
Серебро обычно встречается в природе в сочетании с другими металлами или в минералах, содержащих соединения серебра, обычно в форме сульфидов , таких как галенит (сульфид свинца) или церуссит (карбонат свинца). Таким образом, первичное производство серебра требует плавки, а затем купелирования серебристосодержащих свинцовых руд, что является исторически важным процессом. [ 84 ] Свинец плавится при 327 °С, оксид свинца — при 888 °С, серебро — при 960 °С. Для отделения серебра сплав снова плавят при высокой температуре от 960°С до 1000°С в окислительной среде. Свинец окисляется до монооксида свинца , известного тогда как глет , который захватывает кислород из других присутствующих металлов. Жидкий оксид свинца удаляется или впитывается под действием капиллярных сил в футеровку пода. [ 85 ] [ 86 ] [ 87 ]
- Ag (s) + 2 Pb (s) + O
2 (г) → 2 PbO (поглощенный) + Ag(л)
Сегодня металлическое серебро в основном производится как вторичный побочный продукт электролитического рафинирования меди, свинца и цинка, а также путем применения процесса Паркса к слиткам свинца из руды, которая также содержит серебро. [ 88 ] В таких процессах серебро следует за рассматриваемым цветным металлом через его концентрацию и плавку, а затем очищается. Например, при производстве меди очищенная медь электролитически осаждается на катоде, в то время как менее реакционноспособные драгоценные металлы, такие как серебро и золото, собираются под анодом в виде так называемого «анодного шлама». Затем его отделяют и очищают от неблагородных металлов путем обработки горячей аэрированной разбавленной серной кислотой и нагревания с известью или кремнеземным флюсом, после чего серебро очищается до чистоты более 99,9% посредством электролиза в нитратном растворе. [ 79 ]
Чистота технического серебра составляет не менее 99,9%, но доступно серебро с чистотой более 99,999%. В 2022 году Мексика была крупнейшим производителем серебра (6300 тонн или 24,2% от мирового объема в 26 000 тонн), за ней следовали Китай (3600 тонн) и Перу (3100 тонн). [ 88 ]
В морской среде
низкая Концентрация серебра в морской воде (пмоль/л). Уровни варьируются в зависимости от глубины и между водоемами. Концентрация растворенного серебра колеблется от 0,3 пмоль/л в прибрежных поверхностных водах до 22,8 пмоль/л в пелагических глубоких водах. [ 89 ] Анализ присутствия и динамики серебра в морской среде затруднен из-за особенно низких концентраций и сложных взаимодействий в окружающей среде. [ 90 ] Несмотря на то, что металл является редким микроэлементом, на его концентрацию сильно влияют речные, эоловые, атмосферные и апвеллинговые поступления, а также антропогенные поступления в виде сбросов, удаления отходов и выбросов промышленных компаний. [ 91 ] [ 92 ] Другие внутренние процессы, такие как разложение органического вещества, могут быть источником растворенного серебра в более глубоких водах, которое попадает в некоторые поверхностные воды посредством апвеллинга и вертикального перемешивания. [ 92 ]
В Атлантическом и Тихом океанах концентрации серебра минимальны на поверхности, но возрастают в более глубоких водах. [ 93 ] Серебро поглощается планктоном в фотической зоне, ремобилизуется с глубиной и обогащается в глубоких водах. Серебро транспортируется из Атлантики в другие океанические водные массы. [ 91 ] В водах северной части Тихого океана серебро ремобилизуется медленнее и все больше обогащается по сравнению с глубокими водами Атлантического океана. Концентрация серебра увеличивается, следуя по главному океаническому конвейеру, который перемещает воду и питательные вещества из Северной Атлантики в Южную Атлантику и в северную часть Тихого океана. [ 94 ]
Не существует большого количества данных о том, как серебро влияет на морскую жизнь, несмотря на вероятные вредные последствия, которые оно может оказать на организмы посредством биоаккумуляции , связи с твердыми частицами и сорбции . [ 89 ] Лишь примерно в 1984 году ученые начали понимать химические характеристики серебра и его потенциальную токсичность. Фактически, ртуть — единственный микроэлемент, который превосходит по токсичному воздействию серебро; однако полная степень токсичности серебра не ожидается в условиях океана из-за его способности переходить в нереакционноспособные биологические соединения. [ 95 ]
В одном исследовании присутствие избытка ионного серебра и наночастиц серебра вызывало эффект биоаккумуляции в органах рыбок данио и изменяло химические пути в их жабрах. [ 96 ] Кроме того, очень ранние экспериментальные исследования показали, как токсическое воздействие серебра колеблется в зависимости от солености и других параметров, а также от стадии жизни и различных видов, таких как рыбы, моллюски и ракообразные. [ 97 ] Другое исследование обнаружило повышенную концентрацию серебра в мышцах и печени дельфинов и китов, что указывает на загрязнение этого металла в последние десятилетия. Серебро — металл, который нелегко вывести из организма, и повышенные концентрации могут привести к смерти. [ 98 ]
Денежное использование

царстве Самые ранние известные монеты были отчеканены в Лидийском в Малой Азии около 600 г. до н. э. [ 99 ] Монеты Лидии были изготовлены из электрума — природного сплава золота и серебра, доступного на территории Лидии. [ 99 ] С этого времени серебряные стандарты , в которых стандартной экономической единицей расчета является фиксированный вес серебра, получили широкое распространение во всем мире вплоть до 20 века. Известные серебряные монеты на протяжении веков включают греческую драхму , [ 100 ] римский денарий , [ 101 ] исламский дирхам , [ 102 ] каршапана Империи Великих из древней Индии и рупия времен Моголов (сгруппированная с медными и золотыми монетами для создания триметаллического стандарта), [ 103 ] и испанский доллар . [ 104 ]
Соотношение количества серебра, используемого для чеканки монет, и количества серебра, используемого для других целей, со временем сильно менялось; например, в военное время больше серебра, как правило, использовалось для чеканки монет для финансирования войны. [ 105 ]
Сегодня серебряные слитки имеют код валюты XAG по стандарту ISO 4217 , один из четырех драгоценных металлов, имеющих такой код (остальные — палладий , платина и золото). [ 106 ] Серебряные монеты производятся из литых стержней или слитков, прокатываются до нужной толщины, подвергаются термообработке, а затем используются для вырезания заготовок . Эти заготовки затем фрезеруются и чеканятся в чеканном прессе; современные чеканные станки могут производить 8000 серебряных монет в час. [ 105 ]
Цена
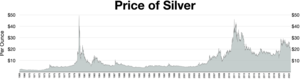
Цены на серебро обычно указываются в тройских унциях . Одна тройская унция равна 31,1034768 грамма. Лондонский фиксинг серебра публикуется каждый рабочий день в полдень по лондонскому времени. [ 107 ] Эта цена определяется несколькими крупными международными банками и используется участниками лондонского рынка драгоценных металлов для торгов в этот день. Цены чаще всего указываются в долларах США (USD), фунтах стерлингов (GBP) и евро (EUR).
Приложения
Ювелирные изделия и серебро


На протяжении большей части истории серебро, помимо чеканки монет, главным образом использовалось в производстве ювелирных изделий и других предметов общего пользования, и это продолжает оставаться основным применением и сегодня. Примеры включают столовое серебро для столовых приборов, для которого серебро очень подходит из-за его антибактериальных свойств. Западные концертные флейты или изготавливаются из него обычно покрываются серебром ; [ 109 ] на самом деле, большая часть столового серебра всего лишь посеребрена, а не сделана из чистого серебра; серебро обычно наносится гальванопокрытием . Посеребренное стекло (в отличие от металлического) используется для изготовления зеркал, термосов и елочных украшений. [ 110 ]
Поскольку чистое серебро очень мягкое, большая часть серебра, используемого для этих целей, легирована медью, причем обычно используются пробы 925/1000, 835/1000 и 800/1000. Одним из недостатков является легкое потускнение серебра в присутствии сероводорода и его производных. Включение драгоценных металлов, таких как палладий, платина и золото, обеспечивает устойчивость к потускнению, но обходится довольно дорого; базовые металлы, такие как цинк , кадмий , кремний и германий, не полностью предотвращают коррозию и имеют тенденцию влиять на блеск и цвет сплава. Электролитически очищенное покрытие серебром эффективно повышает устойчивость к потускнению. Обычными решениями для восстановления блеска потускневшего серебра являются окунающие ванны, восстанавливающие поверхность сульфида серебра до металлического серебра, и очистка слоя потускнения пастой; Последний подход также имеет приятный побочный эффект, заключающийся в одновременной полировке серебра. [ 109 ]
Лекарство
В медицине серебро добавляют в раневые повязки и используют в качестве антибиотического покрытия в медицинских устройствах. Раневые повязки, содержащие сульфадиазин серебра или наноматериалы серебра, используются для лечения внешних инфекций. Серебро также используется в некоторых медицинских целях, таких как мочевые катетеры (где предварительные данные указывают на то, что оно снижает риск возникновения катетер-ассоциированных инфекций мочевыводящих путей ) и в эндотрахеальных дыхательных трубках , связанной с аппаратом искусственной вентиляции легких (где данные свидетельствуют о том, что оно снижает риск возникновения пневмонии ). [ 111 ] [ 112 ] серебра Ион биоактивен концентрации и в достаточной легко убивает бактерии in vitro . Ионы серебра мешают ферментам бактерий, которые транспортируют питательные вещества, формируют структуры и синтезируют клеточные стенки; эти ионы также связываются с генетическим материалом бактерий. Серебро и наночастицы серебра используются в качестве противомикробного средства в различных отраслях промышленности, здравоохранения и быта: например, наполнение одежды частицами наносеребра позволяет ей дольше оставаться без запаха. [ 113 ] [ 114 ] Однако бактерии могут развить устойчивость к противомикробному действию серебра. [ 115 ] Соединения серебра усваиваются организмом так же, как соединения ртути , но лишены токсичности последних. Серебро и его сплавы применяют в черепной хирургии для замещения кости, амальгамы серебра, олова и ртути — в стоматологии. [ 110 ] Фторид диаммина серебра , фторидная соль координационного комплекса с формулой [Ag(NH 3 ) 2 ]F, представляет собой лекарственное средство (лекарство) местного действия, используемое для лечения и профилактики зубов и снятия гиперчувствительности дентина. кариеса (кариеса) [ 116 ]
Электроника
Серебро очень важно в электронике для изготовления проводников и электродов из-за его высокой электропроводности, даже если оно потускнело. Объемное серебро и серебряная фольга использовались для изготовления электронных ламп и продолжают использоваться сегодня в производстве полупроводниковых приборов, схем и их компонентов. Например, серебро используется в высококачественных разъемах для ВЧ , УКВ и более высоких частот, особенно в настроенных схемах, таких как резонаторные фильтры , где проводники не могут масштабироваться более чем на 6%. Печатные схемы и RFID- антенны выполнены серебристыми красками. [ 12 ] [ 117 ] Порошковое серебро и его сплавы используются при приготовлении паст для проводящих слоев и электродов, керамических конденсаторов и других керамических компонентов. [ 118 ]
Припои
Серебросодержащие припои используются для пайки металлических материалов, в основном сплавов на основе кобальта , никеля и меди, инструментальных сталей и драгоценных металлов. Основными компонентами являются серебро и медь, а другие элементы выбираются в соответствии с конкретным желаемым применением: например, цинк, олово, кадмий, палладий, марганец и фосфор . Серебро обеспечивает повышенную обрабатываемость и устойчивость к коррозии во время использования. [ 119 ]
Химическое оборудование
Серебро полезно при производстве химического оборудования из-за его низкой химической активности, высокой теплопроводности и легкости обработки. Для проведения щелочной плавки применяют серебряные тигли (легированные 0,15% никеля во избежание рекристаллизации металла при красном калении). Медь и серебро также используются при проведении химии с фтором . Оборудование, предназначенное для работы при высоких температурах, часто бывает посеребренным. Серебро и его сплавы с золотом применяют в качестве проволочных или кольцевых уплотнений кислородных компрессоров и вакуумного оборудования. [ 120 ]
Катализ
Металлическое серебро является хорошим катализатором реакций окисления ; на самом деле оно слишком хорошо для большинства целей, поскольку мелкодисперсное серебро имеет тенденцию приводить к полному окислению органических веществ до углекислого газа и воды, и, следовательно, вместо него обычно используется более крупнозернистое серебро. Например, 15%-ное серебро, нанесенное на α-Al 2 O 3 или силикаты, является катализатором окисления этилена в оксид этилена при 230–270 °С. Дегидрирование метанола в формальдегид проводится при 600–720 ° C на серебряной сетке или кристаллах в качестве катализатора, как и дегидрирование изопропанола в ацетон . В газовой фазе гликоль дает глиоксаль , а этанол дает ацетальдегид , а органические амины дегидратируются до нитрилов . [ 120 ]
Фотография
До появления цифровой фотографии , которая сейчас доминирует, светочувствительность галогенидов серебра использовалась для использования в традиционной пленочной фотографии. используемая Светочувствительная эмульсия, в черно-белой фотографии, представляет собой суспензию кристаллов галогенида серебра в желатине , возможно, смешанную с некоторыми соединениями благородных металлов для улучшения светочувствительности, проявления и настройки. [ объяснить ] .
Цветная фотография требует добавления специальных красящих компонентов и сенсибилизаторов, так что исходное черно-белое серебряное изображение сочетается с другим красящим компонентом. Оригинальные серебряные изображения отбеливаются, а затем серебро восстанавливается и перерабатывается. Нитрат серебра во всех случаях является исходным материалом. [ 121 ]
Рынок нитрата серебра и галогенидов серебра для фотографии быстро сократился с появлением цифровых камер. С пикового мирового спроса на фотосеребро в 1999 году (267 000 000 тройских унций или 8 304,6 тонны ) к 2013 году рынок сократился почти на 70%. [ 122 ]
Наночастицы
Частицы наносеребра размером от 10 до 100 нанометров используются во многих приложениях. Они используются в проводящих чернилах для печатной электроники и имеют гораздо более низкую температуру плавления, чем более крупные частицы серебра микрометрового размера. [ 123 ] Они также используются в медицинских целях в антибактериальных и противогрибковых средствах почти так же, как и более крупные частицы серебра. [ 114 ] Кроме того, по данным Обсерватории наноматериалов Европейского Союза (EUON), наночастицы серебра используются как в пигментах, так и в косметике. [ 124 ] [ 125 ]
Разнообразный

Чистый металл серебра используется в качестве пищевого красителя. Он имеет обозначение E174 и одобрен в Европейском Союзе . [ 126 ] Традиционные индийские и пакистанские блюда иногда включают декоративную серебряную фольгу, известную как варк . [ 127 ] а в других культурах серебряное драже используется для украшения тортов, печенья и других десертов. [ 128 ]
Фотохромные линзы содержат галогениды серебра, поэтому ультрафиолетовый свет при естественном дневном свете высвобождает металлическое серебро, затемняя линзы. Галогениды серебра реформируются при более низкой интенсивности света. Бесцветные пленки хлорида серебра используются в детекторах радиации . Цеолитовые сита с содержанием Ag + ионы используются для опреснения морской воды во время спасательных операций, используя ионы серебра для осаждения хлорида в виде хлорида серебра. Серебро также используется из-за его антибактериальных свойств для дезинфекции воды, но его применение ограничено ограничениями на потребление серебра. Коллоидное серебро также используется для дезинфекции закрытых бассейнов; хотя оно имеет то преимущество, что не выделяет запаха, как обработка гипохлоритом , коллоидное серебро недостаточно эффективно для более загрязненных открытых бассейнов. Маленькие кристаллы йодида серебра используются при засеве облаков, вызывающих дождь. [ 114 ]
Законодательное собрание Техаса объявило серебро официальным драгоценным металлом Техаса в 2007 году. [ 129 ]
Меры предосторожности
| Опасности | |
|---|---|
| СГС Маркировка : | |

| |
| Предупреждение | |
| H410 | |
| П273 , П391 , П501 [ 130 ] | |
| NFPA 704 (огненный алмаз) | |
Соединения серебра обладают низкой токсичностью по сравнению с соединениями большинства других тяжелых металлов , поскольку они плохо усваиваются организмом человека при попадании в организм, а то, что усваивается, быстро превращается в нерастворимые соединения серебра или образует комплекс с металлотионеином . Однако фторид серебра и нитрат серебра являются едкими и могут вызвать повреждение тканей, что приводит к гастроэнтериту , диарее , падению артериального давления , судорогам, параличу и остановке дыхания . У животных, которым неоднократно вводили соли серебра, наблюдалась анемия , замедление роста, некроз печени и жировая дегенерация печени и почек; у крыс, которым имплантировали серебряную фольгу или которым вводили коллоидное серебро , наблюдалось развитие локализованных опухолей. При парентеральном введении коллоидное серебро вызывает острое отравление серебром. [ 131 ] Некоторые водные виды особенно чувствительны к солям серебра и других драгоценных металлов; однако в большинстве ситуаций серебро не представляет серьезной опасности для окружающей среды. [ 131 ]
В больших дозах серебро и содержащие его соединения могут всасываться в систему кровообращения и откладываться в различных тканях организма, что приводит к аргирии , приводящей к сине-сероватой пигментации кожи, глаз и слизистых оболочек . Аргирия встречается редко и, насколько известно, не причиняет иного вреда здоровью человека, хотя уродует и обычно необратима. Легкие формы аргирии иногда ошибочно принимают за цианоз — синий оттенок кожи, вызванный недостатком кислорода. [ 131 ] [ 12 ]
Металлическое серебро, как и медь, является антибактериальным агентом, который был известен древним людям и впервые научно исследован , названным олигодинамическим эффектом Карлом Нэгели . Ионы серебра повреждают метаболизм бактерий даже в таких низких концентрациях, как 0,01–0,1 миллиграмма на литр; металлическое серебро оказывает аналогичный эффект из-за образования оксида серебра. Этот эффект теряется в присутствии серы из-за крайней нерастворимости сульфида серебра. [ 131 ]
Некоторые соединения серебра очень взрывоопасны, например, соединения азота азид серебра, амид серебра и гремучее серебро, а также ацетилид серебра , оксалат серебра и оксид серебра (II). Они могут взрываться при нагревании, силе, высыхании, освещении, а иногда и самопроизвольно. Чтобы избежать образования таких соединений, аммиак и ацетилен следует хранить подальше от серебряного оборудования. Соли серебра с сильно окисляющими кислотами, такими как хлорат серебра и нитрат серебра, могут взрываться при контакте с легко окисляющимися материалами, такими как органические соединения, сера и сажа. [ 131 ]
См. также
- Серебряная монета
- Серебряная медаль
- Бесплатное серебро
- Список стран по производству серебра
- Список соединений серебра
- Серебро как инвестиция
- Сильверпойнт Рисунок
Ссылки
- ^ «Стандартный атомный вес: серебро» . ЦИАВ . 1985.
- ^ Прохаска, Томас; Ирргехер, Йоханна; Бенефилд, Жаклин; Бёлке, Джон К.; Чессон, Лесли А.; Коплен, Тайлер Б.; Дин, Типинг; Данн, Филип Дж. Х.; Грёнинг, Манфред; Холден, Норман Э.; Мейер, Харро Эй Джей (4 мая 2022 г.). «Стандартные атомные веса элементов 2021 (Технический отчет ИЮПАК)» . Чистая и прикладная химия . дои : 10.1515/pac-2019-0603 . ISSN 1365-3075 .
- ^ Перейти обратно: а б с Арбластер, Джон В. (2018). Некоторые значения кристаллографических свойств элементов . Парк материалов, Огайо: ASM International. ISBN 978-1-62708-155-9 .
- ^ Ag(0) наблюдался в карбонильных комплексах в низкотемпературных матрицах: см. Макинтош, Д.; Озин, Г.А. (1976). «Синтез с использованием паров металлов. Карбонилы серебра. Матричные инфракрасные, ультрафиолето-видимые и электронные спектры спинового резонанса, структуры и связывание трикарбонила серебра, дикарбонила серебра, монокарбонила серебра и гексакарбонила дисеребра». Дж. Ам. хим. Соц . 98 (11): 3167–75. дои : 10.1021/ja00427a018 .
- ^ Лиде, Д.Р., изд. (2005). «Магнитная восприимчивость элементов и неорганических соединений». Справочник CRC по химии и физике (PDF) (86-е изд.). Бока-Ратон (Флорида): CRC Press. ISBN 0-8493-0486-5 .
- ^ Уэст, Роберт (1984). CRC, Справочник по химии и физике . Бока-Ратон, Флорида: Издательство компании Chemical Rubber Company. стр. E110. ISBN 0-8493-0464-4 .
- ^ Кондев, ФГ; Ван, М.; Хуанг, WJ; Наими, С.; Ауди, Г. (2021). «Оценка ядерных свойств NUBASE2020» (PDF) . Китайская физика C . 45 (3): 030001. doi : 10.1088/1674-1137/abddae .
- ^ Пул, Чарльз П. младший (11 марта 2004 г.). Энциклопедический словарь по физике конденсированного состояния . Академическая пресса. ISBN 978-0-08-054523-3 .
- ^ «Слитки и нумизматические монеты: разница между слитками и нумизматическими монетами» . Providentmetals.com . Проверено 17 декабря 2017 г.
- ^ « В мире в 5 раз больше золота, чем серебра» | Последние новости и обновления в Daily News & Analysis» . ДНК . 3 марта 2009 года . Проверено 17 декабря 2017 г.
- ^ Масуда, Хидеки (2016). «Комбинированная просвечивающая электронная микроскопия - наблюдение процесса формирования in situ и измерение физических свойств металлических проводов одиночного атомного размера». В Янечеке, Милош; Крал, Роберт (ред.). Современная электронная микроскопия в физических и биологических науках . ИнТех. дои : 10.5772/62288 . ISBN 978-953-51-2252-4 . S2CID 58893669 .
- ^ Перейти обратно: а б с д и ж г Хаммонд, ЧР (2004). Элементы в Справочнике по химии и физике (81-е изд.). ЦРК Пресс. ISBN 978-0-8493-0485-9 .
- ^ Перейти обратно: а б с д Гринвуд и Эрншоу, с. 1177
- ^ Перейти обратно: а б Гринвуд и Эрншоу, с. 1178
- ^ Джордж Л. Тригг; Эдмунд Х. Иммергут (1992). Энциклопедия прикладной физики . Том. 4: Горение до диамагнетизма. Издательство ВЧ. стр. 267–72. ISBN 978-3-527-28126-8 . Проверено 2 мая 2011 г.
- ^ Остин, Алекс (2007). Ремесло серебряного дела: методы, проекты, вдохновение . Стерлинг Паблишинг Компани, Инк. 43. ИСБН 978-1-60059-131-0 .
- ^ Эдвардс, HW; Петерсен, Р.П. (1936). «Отражательная способность пленок напыленного серебра». Физический обзор . 50 (9): 871. Бибкод : 1936PhRv...50..871E . дои : 10.1103/PhysRev.50.871 .
- ^ «Серебро против алюминия» . Обсерватория Джемини . Проверено 1 августа 2014 г.
- ^ Рассел, Алан М.; Ли, Кок Лунг (2005). Соотношения структура-свойство в цветных металлах . Нью-Йорк: Джон Уайли и сыновья. п. 302. дои : 10.1002/0471708542 . ISBN 9780471649526 .
- ^ Николс, Кеннет Д. (1987). Дорога к Троице . Морроу, Нью-Йорк: Морроу. п. 42. ИСБН 978-0-688-06910-0 .
- ^ Янг, Ховард (11 сентября 2002 г.). «Истман в Ок-Ридже во время Второй мировой войны» . Архивировано из оригинала 8 февраля 2012 года.
- ^ Оман, Х. (1992). «Не здесь изобретено? Проверьте свою историю». Журнал аэрокосмических и электронных систем . 7 (1): 51–53. дои : 10.1109/62.127132 . S2CID 22674885 .
- ^ Перейти обратно: а б с д «Атомные массы элементов 2007 (ИЮПАК)» . Архивировано из оригинала 6 сентября 2017 года . Проверено 11 ноября 2009 г.
- ^ «Атомный вес и изотопный состав всех элементов (NIST)» . Проверено 11 ноября 2009 г.
- ^ Кэмерон, AGW (1973). «Изобилие элементов в Солнечной системе» (PDF) . Обзоры космической науки . 15 (1): 121–46. Бибкод : 1973ССРв...15..121С . дои : 10.1007/BF00172440 . S2CID 120201972 .
- ^ Перейти обратно: а б Ауди, Жорж; Берсильон, Оливье; Блашо, Жан; Вапстра, Аалдерт Хендрик (2003), « Оценка NUBASE свойств ядра и распада» , Nuclear Physics A , 729 : 3–128, Бибкод : 2003NuPhA.729....3A , doi : 10.1016/j.nuclphysa.2003.11 .001
- ^ «Атомный вес и изотопный состав серебра (NIST)» . Проверено 11 ноября 2009 г.
- ^ Келли, Уильям Р.; Вассербург, Дж.Дж. (1978). «Доказательства существования 107 Pd в ранней солнечной системе » (PDF) . Geophysical Research Letters . 5 (12): 1079–82. Bibcode : 1978GeoRL...5.1079K . doi : 10.1029/GL005i012p01079 .
- ^ Рассел, Сара С .; Гунель, Матье; Хатчисон, Роберт (2001). «Происхождение короткоживущих радионуклидов». Философские труды Королевского общества А. 359 (1787): 1991–2004. Бибкод : 2001RSPTA.359.1991R . дои : 10.1098/rsta.2001.0893 . JSTOR 3066270 . S2CID 120355895 .
- ^ Перейти обратно: а б Гринвуд и Эрншоу, с. 1179
- ^ Перейти обратно: а б с д и Гринвуд и Эрншоу, с. 1180
- ^ Гринвуд и Эрншоу, с. 1176
- ^ Лидин Р.А. 1996, Справочник по неорганическим веществам , Begell House, Нью-Йорк, ISBN 1-56700-065-7 . п. 5
- ^ Гудвин Ф., Гурусвами С., Кайнер К.У., Каммер С., Кнабл В., Кете А., Лейхтфрид Г., Шламп Г., Стиклер Р. и Варлимонт Х. 2005, «Благородные металлы и сплавы благородных металлов», в Springer Handbook of Condensed Matter and Materials Data. , В. Мартиенссен и Х. Варлимонт (редакторы), Springer, Берлин, стр. 329–406, ISBN 3-540-44376-2 . п. 341
- ^ «Серебряные артефакты» в книге «Коррозия – Артефакты» . Ресурсный центр NACE
- ^ Бьелхаген, Ганс И. (1995). Галогенсеребряные записывающие материалы: для голографии и их обработки . Спрингер. стр. 156–66 . ISBN 978-3-540-58619-7 .
- ^ Ридель, Себастьян; Каупп, Мартин (2009). «Высшие степени окисления элементов переходных металлов». Обзоры координационной химии . 253 (5–6): 606–24. дои : 10.1016/j.ccr.2008.07.014 .
- ^ Перейти обратно: а б Гринвуд и Эрншоу, с. 1188
- ^ Гринвуд и Эрншоу, с. 903
- ^ Перейти обратно: а б с Гринвуд и Эрншоу, стр. 1181–82.
- ^ Перейти обратно: а б с д и Гринвуд и Эрншоу, стр. 1183–85.
- ^ Перейти обратно: а б Гринвуд и Эрншоу, стр. 1185–87.
- ^ Аббри, Фердинандо (2019). «Золото и серебро: совершенство металлов в средневековой и ранней современной алхимии» . Сущность : 39–44. doi : 10.13128/Субстанция-603 . Проверено 8 апреля 2022 г.
- ^ «Определение лунной каустики» . словарь.die.net . Архивировано из оригинала 31 января 2012 года.
- ^ Коуп, AC; Бах, Р.Д. (1973). «транс-циклооктен» . Органические синтезы ; Сборник томов , т. 5, с. 315 .
- ^ Перейти обратно: а б Макклоски CM; Коулман, GH (1955). «β-d-Глюкоза-2,3,4,6-Тетраацетат» . Органические синтезы ; Сборник томов , т. 3, с. 434 .
- ^ Брамби и др.
- ^ Мейер, Рудольф; Кёлер, Йозеф и Хомбург, Аксель (2007). Взрывчатые вещества . Уайли – ВЧ. стр. 284 . ISBN 978-3-527-31656-4 .
- ^ Гринвуд и Эрншоу, с. 1189
- ^ Гринвуд и Эрншоу, стр. 1195–96.
- ^ Гринвуд и Эрншоу, стр. 1199–200.
- ^ Миллер, WT; Бернард, Р.Дж. (1968). «Перфторалкилсеребряные соединения». Дж. Ам. хим. Соц. 90 (26): 7367–68. дои : 10.1021/ja01028a047 .
- ^ Холлидей, А.; Пендлбери, RE (1967). «Соединения винилсвинца I. Отщепление винильных групп тетравинилсвинца». Дж. Органомет. хим. 7 (2): 281–84. дои : 10.1016/S0022-328X(00)91078-7 .
- ^ Ван, Харрисон MJ; Лин, Иван Дж.Б. (1998). «Простой синтез комплексов серебра (I)-карбена. Полезные агенты переноса карбена». Металлоорганические соединения . 17 (5): 972–75. дои : 10.1021/om9709704 .
- ^ Перейти обратно: а б Брамби и др., стр. 54–61.
- ^ Кроонен, Гус (2013). Этимологический словарь прагерманского языка . Брилл. п. 436. ИСБН 978-90-04-18340-7 .
- ^ Перейти обратно: а б Мэллори, Джеймс П .; Адамс, Дуглас К. (2006). Оксфордское введение в протоиндоевропейский и протоиндоевропейский мир . Издательство Оксфордского университета. стр. 241–242. ISBN 978-0-19-928791-8 .
- ^ Буткан, Дирк; Коссманн, Мартен (2001). «К этимологии слова «Серебро» ». NOWELE: Эволюция языков Северо-Западной Европы . 38 (1): 3–15. дои : 10.1075/nowele.38.01bou .
- ^ Недели, с. 4
- ^ Перейти обратно: а б с Гринвуд и Эрншоу, стр. 1173–74.
- ^ Ридон, Артур К. (2011). Металлургия для неметаллурга . АСМ Интернешнл. стр. 73–84. ISBN 978-1-61503-821-3 .
- ^ Перейти обратно: а б с д и Уикс, стр. 14–19.
- ^ Перейти обратно: а б с д и ж г час Брамби и др., стр. 16–19.
- ^ Мелис, Мария Грация (2014). «Серебро в неолитической и энеолитической Сардинии». В Меллере, Х.; Риш, Р.; Перницка, Э. (ред.). Раннее золото и серебро. Металлы власти – Государственное управление по сохранению памятников и археологии Саксония-Анхальт. ISBN 978-3944507057 .
- ^ Перейти обратно: а б Эмсли, Джон (2011). Строительные блоки природы: путеводитель по элементам от Аризоны . Издательство Оксфордского университета. стр. 492–98. ISBN 978-0-19-960563-7 .
- ^ Паттерсон, CC (1972). «Запасы серебра и потери в древние и средневековые времена». Обзор экономической истории . 25 (2): 205235 (216, табл.2, 228, табл.6). дои : 10.1111/j.1468-0289.1972.tb02173.x .
- ^ де Каллатаи, Франсуа (2005). «Греко-римская экономика в сверхдолгосрочной перспективе: свинец, медь и кораблекрушения». Журнал римской археологии . 18 : 361–72 [365 и далее]. дои : 10.1017/s104775940000742x . S2CID 232346123 .
- ^ Шульце, Кэрол А.; Стэниш, Чарльз; Скотт, Дэвид А.; Ререн, Тило; Кюнер, Скотт; Перья, Джеймс К. (2009). «Прямое свидетельство 1900-летней местной добычи серебра в бассейне озера Титикака на юге Перу» . Труды Национальной академии наук Соединенных Штатов Америки . 106 (41): 17280–83. Бибкод : 2009PNAS..10617280S . дои : 10.1073/pnas.0907733106 . ПМК 2754926 . ПМИД 19805127 .
- ^ Франк, Андре Гундер (1998). Переориентация: глобальная экономика в эпоху Азии . Беркли: Издательство Калифорнийского университета. п. 131. ИСБН 0520214749 .
- ^ фон Глан, Ричард (1996). «Миф и реальность валютного кризиса семнадцатого века в Китае». Журнал экономической истории . 56 (2): 429–454. дои : 10.1017/S0022050700016508 . JSTOR 2123972 . S2CID 154126073 .
- ^ Флинн, Деннис О.; Хиральдес, Артуро (1995). «Рожденный с «серебряной ложкой» » (PDF) . Журнал всемирной истории . 2 : 210. JSTOR 20078638 .
- ^ Фонтенроуз, Джозеф (1974). «Работа, справедливость и пять веков Гесиода». Классическая филология . 69 (1): 1–16. дои : 10.1086/366027 . JSTOR 268960 . S2CID 161808359 .
- ^ Джексон, Роберт (1995). Колдовство и оккультизм . Девизес, Издательство Квинтет. п. 25. ISBN 978-1-85348-888-7 .
- ^ Стойкова, Стефана. «Дело Гайдутин» . Болгарская народная поэзия и проза в семи томах (на болгарском языке). Том. Т. III. Народные песни и исторические песни. Варна: ОИ «ЛитерНет». ISBN 978-954-304-232-6 .
- ^ Перейти обратно: а б Сент-Клер, Кассия (2016). Тайная жизнь цвета . Лондон: Джон Мюррей. п. 49. ИСБН 9781473630819 . OCLC 936144129 .
- ^ Брукс, Фредерик. П. младший (1987). «Серебряной пули нет – суть и случайность в разработке программного обеспечения» (PDF) . Компьютер . 20 (4): 10–19. CiteSeerX 10.1.1.117.315 . дои : 10.1109/MC.1987.1663532 . S2CID 372277 .
- ^ Мэтью 26:15
- ^ Шевалье, Жан; Гербрант, Ален (2009). Словарь символов. Мифы, сны, обычаи, жесты, формы, фигуры, цвета, числа [ Словарь символов. Мифы, мечты, привычки, жесты, формы, фигуры, цвета, числа ] (на румынском языке). Полиром. 105. ИСБН 978-973-46-1286-4 .
- ^ Перейти обратно: а б Гринвуд и Эрншоу, стр. 1174–67.
- ^ Брамби и др., стр. 21–22.
- ^ Перейти обратно: а б Группа CPM (2011). Серебряный ежегодник CPM . Нью-Йорк: Книги Евромони. п. 68. ИСБН 978-0-9826741-4-7 .
- ^ «Технический отчет по предварительной экономической оценке 43-101» (PDF) . South American Silver Corp. Архивировано из оригинала (PDF) 19 января 2012 года.
- ^ «Почему Кыргызстан и Таджикистан настолько разошлись во взглядах на зарубежную добычу полезных ископаемых?» . Евразийнет . EurasiaNet.org. 7 августа 2013 года . Проверено 19 августа 2013 г.
- ^ Кассианиду, В. (2003). «Ранняя добыча серебра из сложных полиметаллических руд», стр. 198–206 в Крэддоке, ПТ и Лэнге, Дж. (ред.) Горное дело и производство металлов на протяжении веков . Лондон, издательство Британского музея.
- ^ Крэддок, ПТ (1995). Добыча и производство ранних металлов . Эдинбург: Издательство Эдинбургского университета. п. 223. ISBN 1560985356
- ^ Бэйли Дж., Кроссли Д. и Понтинг М. (ред.). (2008). [ https://www.researchgate.net/publication/271133104_Metals_and_Metalworking_A_Research_Framework_for_Archaeometallurgy Металлы и металлообработка. Основа исследования археометаллургии . Историческое металлургическое общество. п. 6. ISBN 978-0-9560225-0-9
- ^ Перницка, Э., Ререн, Т., Шмитт-Стрекер, С. (1998). «Производство серебра позднего Урука методом купелирования в Хабуба Кабира, Сирия» , стр. 123–34 в Metallurgica Antiqua , Немецкий горный музей.
- ^ Перейти обратно: а б Хиллиард, Генри Э. «Сильвер» . Геологическая служба США.
- ^ Перейти обратно: а б Барриада, Хосе Л.; Таппин, Алан Д.; Эванс, Э. Хиуэл; Ахтерберг, Эрик П. (2007). «Измерения растворенного серебра в морской воде». TrAC Тенденции в аналитической химии . 26 (8): 809–817. дои : 10.1016/j.trac.2007.06.004 .
- ^ Фишер, Лиза; Смит, Джеффри; Ханн, Стефан; Бруланд, Кеннет В. (2018). «Ультра-следовой анализ серебра и платины в морской воде методом ICP-SFMS после автономного матричного разделения и предварительного концентрирования» . Морская химия . 199 : 44–52. Бибкод : 2018Март.199...44F . дои : 10.1016/j.marchem.2018.01.006 .
- ^ Перейти обратно: а б Ндунгу, К.; Томас, Массачусетс; Флегал, Арканзас (2001). «Серебро в западной экваториальной и южной части Атлантического океана». Глубоководные исследования, часть II: Актуальные исследования в океанографии . 48 (13): 2933–2945. Бибкод : 2001DSRII..48.2933N . дои : 10.1016/S0967-0645(01)00025-X .
- ^ Перейти обратно: а б Чжан, Ян; Амакава, Хироши; Нодзаки, Ёсиюки (2001). «Океанические профили растворенного серебра: точные измерения в бассейнах западной части северной части Тихого океана, Охотского и Японского морей». Морская химия . 75 (1–2): 151–163. Бибкод : 2001Март..75..151Z . дои : 10.1016/S0304-4203(01)00035-4 .
- ^ Флегал, Арканзас; Саньюдо-Вильхельми, ЮАР; Шелфо, генеральный директор (1995). «Серебро в восточной части Атлантического океана». Морская химия . 49 (4): 315–320. Бибкод : 1995Март..49..315F . дои : 10.1016/0304-4203(95)00021-I .
- ^ Ранвилл, Мара А.; Флегал, А. Рассел (2005). «Серебро в северной части Тихого океана» . Геохимия, геофизика, геосистемы . 6 (3): н/д. Бибкод : 2005GGG.....6.3M01R . дои : 10.1029/2004GC000770 .
- ^ Ратте, Ханс Тони (1999). «Биоаккумуляция и токсичность соединений серебра: обзор» . Экологическая токсикология и химия . 18 (1): 89–108. дои : 10.1002/etc.5620180112 . S2CID 129765758 .
- ^ Лакав, Жозеф Мэри; Викарий-Пара, Унаи; Бильбао, Эйдер; Гиллиланд, Дуглас; Уолл, Франческо; Дини, Лусиана; Кахаравиль, Мирен П.; Орбея, Амайя (2018). «Воздействие наночастиц серебра и ионного серебра на взрослых особей рыбок данио с водой приводит к дифференциальному накоплению серебра и эффектам на клеточном и молекулярном уровнях». Наука об общей окружающей среде . 642 : 1209–1220. Бибкод : 2018ScTEn.642.1209L doi : 10.1016/j.scitotenv.2018.06.128 . ПМИД 30045502 . S2CID 51719111 .
- ^ Калабрезе, А.; Терберг, ФП; Гулд, Э. (1977). «Воздействие кадмия, ртути и серебра на морских животных» . Обзор морского рыболовства . 39 (4): 5–11. Архивировано из оригинала 26 января 2021 года.
- ^ Чен, Мэн-Сянь; Чжуан, Мин-Фэн; Чжоу, Лянь-Сян; Лю, Жан-И; Ши, Чие-Чи; Чен, Чи-Янг (2017). «Концентрация тканей четырех тайваньских зубатых китообразных, указывающая на загрязнение серебром и кадмием западной части Тихого океана». Бюллетень о загрязнении морской среды . 124 (2): 993–1000. Бибкод : 2017MarPB.124..993C . doi : 10.1016/j.marpolbul.2017.03.028 . ПМИД 28442199 .
- ^ Перейти обратно: а б «Истоки чеканки монет» . britishmuseum.org. Архивировано из оригинала 2 мая 2019 года . Проверено 21 сентября 2015 г.
- ^ «Тетрадрахма» . Мерриам-Вебстер . Проверено 20 января 2008 г.
- ^ Кроуфорд, Майкл Х. (1974). Чеканка римских республиканцев, издательство Кембриджского университета, 2 тома. ISBN 0-521-07492-4
- ^ Оксфордский словарь английского языка , 1-е издание, sv 'dirhem'. Архивировано 9 февраля 2020 г. в Wayback Machine.
- ^ etymonline.com (20 сентября 2008 г.). «Этимология рупии» . Проверено 20 сентября 2008 г.
- ^ Осборн, Томас Дж. (2012). Тихоокеанское Эльдорадо: история Большой Калифорнии . Джон Уайли и сыновья. п. 31. ISBN 978-1-118-29217-4 .
- ^ Перейти обратно: а б Брамби и др., стр. 63–65.
- ^ «Текущий список кодов валют и фондов – валюта ISO» . СНВ . Проверено 29 марта 2020 г.
- ^ «Цена серебра LBMA» . ЛБМА . Проверено 29 марта 2020 г.
- ^ Латка, Марцин. «Серебряный саркофаг Святого Станислава» . артинпл . Проверено 3 августа 2019 г.
- ^ Перейти обратно: а б Брамби и др., стр. 65–67.
- ^ Перейти обратно: а б Брамби и др. стр. 67–71
- ^ Битти, М.; Тейлор, Дж. (2011). «Сплав серебра против мочевых катетеров без покрытия: систематический обзор литературы». Журнал клинического ухода . 20 (15–16): 2098–108. дои : 10.1111/j.1365-2702.2010.03561.x . ПМИД 21418360 .
- ^ Буадма, Л.; Вольф, М.; Люсет, JC (август 2012 г.). «Вентилятор-ассоциированная пневмония и ее профилактика». Современное мнение об инфекционных заболеваниях . 25 (4): 395–404. дои : 10.1097/QCO.0b013e328355a835 . ПМИД 22744316 . S2CID 41051853 .
- ^ Майяр, Жан-Ив; Хартеманн, Филипп (2012). «Серебро как противомикробное средство: факты и пробелы в знаниях». Критические обзоры по микробиологии . 39 (4): 373–83. дои : 10.3109/1040841X.2012.713323 . ПМИД 22928774 . S2CID 27527124 .
- ^ Перейти обратно: а б с Брамби и др., стр. 83–84.
- ^ Паначек, Алеш; Квитек, Либор; Смекалова, Моника; Вечерова, Рената; Колар, Милан; Рёдер, Магдалена; Дычка, Филип; Шебела, Марек; Пручек, Роберт; Томанец, Ондржей; Зборил, Радек (январь 2018 г.). «Бактериальная устойчивость к наночастицам серебра и как ее преодолеть». Природные нанотехнологии . 13 (1): 65–71. Бибкод : 2018НатНа..13...65П . дои : 10.1038/s41565-017-0013-y . ПМИД 29203912 . S2CID 26783560 .
- ^ Розенблатт, А.; Стэмфорд, TCM; Нидерман, Р. (2009). «Фторид серебра диамина: кариес «фторсеребряная пуля» ». Журнал стоматологических исследований . 88 (2): 116–25. дои : 10.1177/0022034508329406 . ПМИД 19278981 . S2CID 30730306 .
- ^ Никитин Павел Владимирович; Лам, Сандер и Рао, КВС (2005). «Недорогие антенны RFID-меток с серебряными чернилами» (PDF) . 2005 Международный симпозиум Общества антенн и распространения IEEE . Том. 2Б. п. 353. дои : 10.1109/APS.2005.1552015 . ISBN 978-0-7803-8883-3 . S2CID 695256 . Архивировано из оригинала (PDF) 21 марта 2016 года.
- ^ Брамби и др., стр. 71–78.
- ^ Брамби и др., стр. 78–81.
- ^ Перейти обратно: а б Брамби и др., стр. 81–82.
- ^ Брамби и др., с. 82
- ^ «Исчез большой источник спроса на серебряные слитки» . БуллионВолт . Проверено 20 июля 2014 г.
- ^ Чжан, Цзюньхуэй; Ахмади, Мазиар; Фаргас, Джемма; Перинка, Никола; Регера, Хавьер; Лансерос-Мендес, Сененчу; Льянес, Луис; Хименес-Пике, Эмилио (февраль 2022 г.). «Наночастицы серебра для проводящих чернил: от синтеза и рецептуры чернил до их использования в полиграфических технологиях» . Металлы . 12 (2): 234. дои : 10.3390/met12020234 . ISSN 2075-4701 .
- ^ «Пигменты – ЭХА» . euon.echa.europa.eu . [ постоянная мертвая ссылка ]
- ^ «Каталог косметических ингредиентов – ECHA» . euon.echa.europa.eu . [ постоянная мертвая ссылка ]
- ^ Мартинес-Абад, А.; Осио, MJ; Лагарон, Ж.М.; Санчес, Г. (2013). «Оценка полилактидных пленок, наполненных серебром, на предмет инактивации сальмонеллы и кошачьего калицивируса in vitro и на свежесрезанных овощах». Международный журнал пищевой микробиологии . 162 (1): 89–94. doi : 10.1016/j.ijfoodmicro.2012.12.024 . ПМИД 23376782 .
- ^ Сарвате, Сарита (4 апреля 2005 г.). «Серебряное покрытие» . Индийские течения . Архивировано из оригинала 14 февраля 2009 года . Проверено 5 июля 2009 г.
- ^ Мейслер, Энди (18 декабря 2005 г.). «Буря на чайной тележке» . Лос-Анджелес Таймс .
- ^ Хэтч, Рози (ред.) (2022). Техасский альманах 2022–2023 гг . Остин, Техас: Историческая ассоциация штата Техас. п. 23. ISBN 9781625110664 .
- ^ «Мсдс – 373249» . Сигма Олдрич.
- ^ Перейти обратно: а б с д и Брамби и др., стр. 88–91.
Цитируемые источники
- Брамби, Андреас; и др. (2008). «Серебро, соединения серебра и сплавы серебра». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a24_107.pub2 . ISBN 978-3527306732 .
- Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . ISBN 978-0-08-037941-8 .
- Уикс, Мэри Эльвира ; Лечестер, Генри М. (1968). Открытие элементов . Истон, Пенсильвания: Журнал химического образования. ISBN 978-0-7661-3872-8 . LCCN 68-15217 .
Внешние ссылки
- Серебро в периодической таблице видео (Ноттингемский университет)
- The Silver Institute , отраслевой ассоциации сайт
- Коллекция серебряных изделий и образцов от Теодора Грея
- Серебряная запись в Карманном справочнике по химическим опасностям NIOSH, опубликованном Центров по контролю и профилактике заболеваний США. Национальным институтом безопасности и гигиены труда
- Цены на серебро – текущие спотовые цены на мировых товарных рынках , от Bloomberg LP.
- Серебро
- Химические элементы
- Переходные металлы
- Благородные металлы
- Драгоценные металлы
- Кубические минералы
- Минералы пространственной группы 225
- Электрические проводники
- Минералы самородных элементов
- Добавки для электронного номера
- Химические элементы с гранецентрированной кубической структурой
- Чеканка металлов и сплавов


















