Серебро
 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Серебро | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Появление | блестящий белый металл | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Стандартный атомный вес А р °(В) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Серебро в таблице Менделеева | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Атомный номер ( Z ) | 47 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Группа | группа 11 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Период | период 5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Блокировать | d-блок | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Электронная конфигурация | [ Кр ] 4д 10 5 с 1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Электроны на оболочку | 2, 8, 18, 18, 1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Физические свойства | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Фаза в СТП | твердый | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Температура плавления | 1234,93 К (961,78 °С, 1763,2 °F) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Точка кипения | 2435 К (2162 °С, 3924 °F) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Плотность (при 20°С) | 10,503 г/см 3 [3] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| в жидком состоянии (при температуре плавления ) | 9,320 г/см 3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Теплота плавления | 11,28 кДж/моль | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Теплота испарения | 254 кДж/моль | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Молярная теплоемкость | 25350 Дж/(моль К) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Давление пара
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Атомные свойства | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Стадии окисления | −2, −1, 0, [4] +1 , +2, +3 ( амфотерный оксид) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Электроотрицательность | Шкала Полинга: 1,93. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Энергии ионизации |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Атомный радиус | эмпирический: 144 вечера | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ковалентный радиус | 145±17:00 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Радиус Ван-дер-Ваальса | 172 вечера | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Другие объекты недвижимости | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Естественное явление | первобытный | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Кристаллическая структура | гранецентрированная кубическая (ГЦК) ( cF4 ) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Постоянная решетки | а = 408,60 вечера (при 20 ° C) [3] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Тепловое расширение | 18.92 × 10 −6 /К (при 20 °С) [3] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Теплопроводность | 429 Вт/(м⋅К) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Температуропроводность | 174 мм 2 /с (при 300 К) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Электрическое сопротивление | 15,87 нОм⋅м (при 20 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Магнитный заказ | диамагнитный [5] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Молярная магнитная восприимчивость | −19.5 × 10 −6 см 3 /mol (296 K) [6] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Модуль Юнга | 83 ГПа | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Модуль сдвига | 30 ГПа | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Объемный модуль | 100 ГПа | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Скорость звука тонкого стержня | 2680 м/с (при комнатной температуре ) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| коэффициент Пуассона | 0.37 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Твердость по шкале Мооса | 2.5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Твердость по Виккерсу | 251 МПа | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Твердость по Бринеллю | 206–250 МПа | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Номер CAS | 7440-22-4 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| История | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Открытие | до 5000 г. до н.э. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Символ | «Ag»: от латинского argentum. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Изотопы серебра | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Серебро — химический элемент ; он имеет символ Ag (от латинского argentum «серебро», происходящего от протоиндоевропейского *h₂erϵ « блестящий, белый » )) и атомный номер 47. Мягкий, белый, блестящий переходный металл , он демонстрирует высочайшую электропроводность , теплопроводность. проводимость и отражательная способность любого металла . [8] Металл встречается в земной коре в чистой, свободной элементарной форме (« самородное серебро»), в виде сплава с золотом и другими металлами, а также в таких минералах, как аргентит и хлораргирит . Большая часть серебра производится как побочный продукт меди , золота, свинца и цинка переработки .
Серебро издавна ценилось как драгоценный металл . Металлическое серебро используется во многих инвестиционных монетах , иногда вместе с золотом : [9] хотя его больше, чем золота, его гораздо меньше, чем самородного металла . [10] Его чистота обычно измеряется на промилле ; сплав с чистотой 94% описывается как «тонкий 0,940». Серебро , как один из семи металлов древности , играло непреходящую роль в большинстве человеческих культур.
Помимо валюты и инвестиционного средства ( монеты и слитки ), серебро используется в солнечных батареях , фильтрации воды , ювелирных изделиях , украшениях, дорогой посуде и утварях (отсюда и термин « серебряные изделия »), в электрических контактах и проводниках , в специализированных зеркалах, покрытиях для окон, в катализе химических реакций, в качестве красителя в витражах и в специализированных кондитерских изделиях. Его соединения используются в фото- и рентгеновской пленке. Разбавленные растворы нитрата серебра и других соединений серебра применяют как дезинфицирующие и микробиоциды ( олигодинамический эффект ), добавляют в повязки , раневые повязки, катетеры и др. медицинский инструментарий .
Характеристики

Серебро по своим физическим и химическим свойствам похоже на двух своих соседей по вертикали в 11-й группе таблицы Менделеева : медь и золото . Его 47 электронов расположены в конфигурации [Kr]4d 10 5 с 1 , аналогично меди ([Ar]3d 10 4 с 1 ) и золото ([Xe]4f 14 5д 10 6 с 1 ); группа 11 — одна из немногих групп d-блока , имеющая полностью согласованный набор электронных конфигураций. [12] Эта характерная электронная конфигурация с единственным электроном в самой высокой занятой подоболочке s над заполненной подоболочкой d, объясняет многие необычные свойства металлического серебра. [13]
Серебро — относительно мягкий, чрезвычайно пластичный и податливый переходный металл , хотя он немного менее податлив, чем золото. Серебро кристаллизуется в гранецентрированной кубической решетке с объемным координационным числом 12, в которой делокализован только один 5s-электрон, подобно меди и золоту. [14] В отличие от металлов с неполной d-оболочкой металлические связи в серебре не имеют ковалентного характера и относительно слабы. Это наблюдение объясняет низкую твердость и высокую пластичность монокристаллов серебра. [15]
Серебро имеет блестящий белый металлический блеск, который можно полировать до блеска . [16] и который настолько характерен, что название самого металла превратилось в название цвета . [13] Защищенное серебро имеет большую оптическую отражательную способность , чем алюминий, на всех длинах волн длиннее ~ 450 нм. [17] На длинах волн короче 450 нм отражательная способность серебра уступает отражательной способности алюминия и падает до нуля вблизи 310 нм. [18]
Элементам группы 11 свойственна очень высокая электро- и теплопроводность, поскольку их единственный s-электрон свободен и не взаимодействует с заполненной d-подоболочкой, поскольку такие взаимодействия (которые происходят в предыдущих переходных металлах) снижают подвижность электронов. [19] Теплопроводность сверхтекучего гелия серебра одна из самых высоких из всех материалов, хотя теплопроводность углерода (в алмаза аллотропе ) и -4 выше. [12] Электропроводность . серебра самая высокая из всех металлов, даже выше, чем у меди Серебро также имеет самое низкое контактное сопротивление среди всех металлов. [12] Серебро редко используется из-за его электропроводности из-за его высокой стоимости, хотя исключение составляет радиочастотная техника , особенно на УКВ и более высоких частотах, где серебряное покрытие улучшает электропроводность, поскольку эти токи имеют тенденцию течь по поверхности проводников, а не по поверхности. через интерьер. Во время Второй мировой войны в США было использовано 13540 тонн серебра для изготовления электромагнитов в калютронах для обогащения урана , главным образом из-за дефицита меди во время войны. [20] [21] [22]
Серебро легко образует сплавы с медью, золотом и цинком . Сплавы цинка с серебром с низкой концентрацией цинка можно рассматривать как гранецентрированные кубические твердые растворы цинка в серебре, поскольку структура серебра практически не меняется, а концентрация электронов возрастает по мере добавления цинка. Дальнейшее увеличение концентрации электронов приводит к образованию объемноцентрированной кубической (концентрация электронов 1,5), сложной кубической (1,615) и гексагональной плотноупакованных фаз (1,75). [14]
изотопы
Встречающееся в природе серебро состоит из двух стабильных изотопов : 107 АГ и 109 Аг, с 107 Ag немного более распространен (51,839% естественной распространенности ). Такое почти равное содержание редко встречается в периодической таблице. Атомный вес 107,8682(2) u ; [23] [24] это значение очень важно из-за важности соединений серебра, особенно галогенидов, в гравиметрическом анализе . [23] Оба изотопа серебра производятся в звездах посредством s-процесса (медленный захват нейтронов), а также в сверхновых посредством r-процесса (быстрый захват нейтронов). [25]
двадцать восемь радиоизотопов , наиболее стабильным из которых является Охарактеризовано 105 Ag с периодом полураспада 41,29 дней, 111 Ag с периодом полураспада 7,45 дней и 112 Ag с периодом полураспада 3,13 часа. Серебро имеет множество ядерных изомеров , наиболее стабильным из которых является 108 м Ag ( t 1/2 = 418 лет), 110 м Ag ( t 1/2 = 249,79 дней) и 106 м Ag ( t 1/2 = 8,28 суток). Период полураспада всех остальных радиоактивных изотопов составляет менее часа, а период полураспада большинства из них составляет менее трех минут. [26]
Изотопы серебра имеют относительную атомную массу от 92,950 u ( 93 Ag) до 129,950 ед. ( 130 В); [27] первичный режим распада перед наиболее распространенным стабильным изотопом, 107 Ag — захват электронов , а основной режим после него — бета-распад . Первичные продукты распада до 107 Ag — это изотопы палладия (элемент 46), а первичными продуктами после них являются изотопы кадмия (элемент 48). [26]
палладия Изотоп 107 Pd распадается за счет бета-излучения до 107 Ag с периодом полураспада 6,5 миллионов лет. Железные метеориты — единственные объекты с достаточно высоким соотношением палладия к серебру, позволяющим получать измеримые изменения в 107 Изобилие Ag. Радиогенный 107 Ag был впервые обнаружен в метеорите Санта-Клара в 1978 году. [28] 107 Pd– 107 Корреляции Ag, наблюдаемые в телах, которые явно расплавились с момента аккреции Солнечной системы, должны отражать присутствие нестабильных нуклидов в ранней Солнечной системе. [29]
Химия
| Окисление состояние |
Координация число |
Стереохимия | Представитель сложный |
|---|---|---|---|
| 0 (д 10 с 1 ) | 3 | Планарный | Ag(CO) 3 |
| 1 (д 10 ) | 2 | Линейный | [В(CN) 2 ] − |
| 3 | Тригональная плоская | AgI(PEt 2 Ar) 2 | |
| 4 | Тетраэдрический | [Аг(диары) 2 ] + | |
| 6 | Октаэдрический | AgF, AgCl, AgBr | |
| 2 (д 9 ) | 4 | Квадратный плоский | [Ag(py) 4 ] 2+ |
| 3 (д 8 ) | 4 | Квадратный плоский | [AgF 4 ] − |
| 6 | Октаэдрический | [AgF 6 ] 3− |
Серебро – довольно инертный металл. Это связано с тем, что его заполненная 4d-оболочка не очень эффективно экранирует электростатические силы притяжения ядра к самому внешнему 5s-электрону, и, следовательно, серебро находится в нижней части электрохимического ряда ( E 0 (Аг + /Ag) = +0,799 В). [13] В группе 11 серебро имеет самую низкую первую энергию ионизации (что указывает на нестабильность 5s-орбитали), но имеет более высокие вторую и третью энергии ионизации, чем медь и золото (что указывает на стабильность 4d-орбиталей), так что химический состав серебра преимущественно степень окисления +1, что отражает все более ограниченный диапазон состояний окисления вдоль переходного ряда по мере заполнения и стабилизации d-орбиталей. [31] В отличие от меди , для которой большая энергия гидратации Cu 2+ по сравнению с Cu + Это причина, по которой первый более стабилен в водном растворе и твердых веществах, несмотря на отсутствие у последнего стабильной заполненной d-подоболочки, а в случае с серебром этот эффект затмевается его большей второй энергией ионизации. Следовательно, Ag + - стабильная разновидность в водных растворах и твердых веществах, Ag 2+ гораздо менее стабилен, поскольку окисляет воду. [31]
Большинство соединений серебра имеют значительный ковалентный характер из-за небольшого размера и высокой энергии первой ионизации (730,8 кДж/моль) серебра. [13] Полинга серебра Кроме того, электроотрицательность , равная 1,93, выше, чем у свинца (1,87), а его сродство к электрону , равное 125,6 кДж/моль, намного выше, чем у водорода (72,8 кДж/моль) и ненамного меньше, чем у кислорода (141,0 кДж/ моль). /моль). [32] Из-за своей полной d-подоболочки серебро в своей основной степени окисления +1 проявляет относительно мало свойств собственно переходных металлов из групп с 4 по 10, образуя довольно нестабильные металлоорганические соединения , образуя линейные комплексы с очень низкими координационными числами, такими как 2, и образуя амфотерный оксид [33] а также фазы Цинтла, такие как постпереходные металлы . [34] В отличие от предыдущих переходных металлов, степень окисления серебра +1 стабильна даже в отсутствие π-акцепторных лигандов . [31]
Серебро не вступает в реакцию с воздухом даже при красном калении, поэтому алхимики считали его благородным металлом наряду с золотом. Его реакционная способность занимает промежуточное положение между медью (которая образует оксид меди (I) при нагревании на воздухе до красного каления) и золотом. Подобно меди, серебро реагирует с серой и ее соединениями; в их присутствии серебро тускнеет на воздухе с образованием черного сульфида серебра (вместо этого медь образует зеленый сульфат , а золото не вступает в реакцию). Хотя серебро не подвергается воздействию неокисляющих кислот, металл легко растворяется в горячей концентрированной серной кислоте , а также в разбавленной или концентрированной азотной кислоте . В присутствии воздуха и особенно в присутствии перекиси водорода серебро легко растворяется в водных растворах цианида . [30]
Тремя основными формами порчи исторических серебряных артефактов являются потускнение, образование хлорида серебра вследствие длительного погружения в соленую воду, а также реакция с нитрат -ионами или кислородом. Свежий хлорид серебра имеет бледно-желтый цвет, под воздействием света становится пурпурным; он слегка выступает над поверхностью артефакта или монеты. Осаждение меди в древнем серебре можно использовать для датировки артефактов, поскольку медь почти всегда входит в состав серебряных сплавов. [35]
Металлическое серебро подвергается воздействию сильных окислителей, таких как перманганат калия ( KMnO
4 ) и дихромат калия ( K
2 Кр
22О
7 ), а также в присутствии бромида калия ( KBr ). Эти соединения используются в фотографии для отбеливания изображений серебра, превращая их в бромид серебра, который можно либо зафиксировать тиосульфатом , либо повторно проявить для усиления исходного изображения. Серебро образует цианидные комплексы ( цианид серебра ), растворимые в воде при наличии избытка цианид-ионов. Растворы цианида серебра используются при гальванопокрытии серебра. [36]
Распространенными степенями окисления серебра являются (в порядке общности): +1 (наиболее стабильное состояние; например, нитрат серебра , AgNO 3 ); +2 (высокоокислительные; например, фторид серебра(II) , AgF 2 ); и даже очень редко +3 (чрезвычайно окислительные; например, тетрафтораргентат(III) калия, KAgF 4 ). [37] Для достижения состояния +3 требуются очень сильные окислители, такие как фтор или пероксодисульфат , а некоторые соединения серебра (III) реагируют с атмосферной влагой и разъедают стекло. [38] Действительно, фторид серебра(III) обычно получают путем взаимодействия серебра или монофторида серебра с самым сильным известным окислителем, дифторидом криптона . [39]
Соединения
Оксиды и халькогениды

Серебро и золото имеют довольно низкое химическое сродство к кислороду, меньшее, чем у меди, и поэтому ожидается, что оксиды серебра термически весьма нестабильны. Растворимые соли серебра(I) выпадают в осадок темно-коричневого оксида серебра(I) Ag 2 при добавлении щелочи O. (Гидроксид AgOH существует только в растворе; в противном случае он самопроизвольно разлагается до оксида.) Оксид серебра (I) очень легко восстанавливается до металлического серебра и при температуре выше 160 ° C разлагается на серебро и кислород. [40] Это и другие соединения серебра (I) могут быть окислены сильным окислителем пероксодисульфатом до черного AgO, смешанного оксида серебра (I, III) формулы Ag. я В III О 2 . некоторые другие смешанные оксиды с серебром в нецелых степенях окисления, а именно Ag 2 O 3 и Ag 3 O 4 Известны также , а также Ag 3 O, который ведет себя как металлический проводник. [40]
Сульфид серебра(I) Ag 2 S очень легко образуется из составляющих его элементов и является причиной потускнения некоторых старых серебряных предметов. Он также может образовываться в результате реакции сероводорода с металлическим серебром или водным раствором Ag. + ионы. многие нестехиометрические селениды и теллуриды Известны ; в частности, AgTe ~3 является низкотемпературным сверхпроводником . [40]
Галогениды

Единственным известным дигалогенидом серебра является дифторид AgF 2 , который можно получить из элементов при нагревании. Сильный, но термически стабильный и, следовательно, безопасный фторирующий агент, фторид серебра (II) часто используется для синтеза гидрофторуглеродов . [41]
В отличие от этого, известны все четыре галогенида серебра (I). Фторид хлорид , ; и бромид имеют структуру хлорида натрия, но йодид имеет три известные стабильные формы при разных температурах что при комнатной температуре это кубическая структура цинковой обманки . Все они могут быть получены путем прямой реакции соответствующих элементов. [41] По мере опускания галогенной группы галогенид серебра приобретает все более и более ковалентный характер, растворимость уменьшается, а цвет меняется от белого хлорида к желтому йодиду в зависимости от энергии, необходимой для переноса заряда лиганд-металл (X − В + → XAg) снижается. [41] Фторид является аномальным, поскольку ион фтора настолько мал, что имеет значительную энергию сольватации и, следовательно, хорошо растворим в воде и образует ди- и тетрагидраты. [41] Остальные три галогенида серебра плохо растворяются в водных растворах и очень часто используются в гравиметрических аналитических методах. [23] Все четыре фоточувствительны (хотя монофторид светочувствителен только к ультрафиолетовому свету), особенно бромид и йодид, которые фоторазлагаются до металлического серебра и поэтому использовались в традиционной фотографии . [41] Реакция: [42]
- Х − + hν → X + е − (возбуждение галогенид-иона, который отдает свой лишний электрон в зону проводимости)
- В + + и − → Ag (высвобождение иона серебра, который присоединяет электрон и становится атомом серебра)
Этот процесс необратим, поскольку высвободившийся атом серебра обычно находится в дефекте кристалла или в месте примеси, так что энергия электрона снижается настолько, что он «захватывается». [42]
Другие неорганические соединения

Белый нитрат серебра AgNO 3 является универсальным предшественником многих других соединений серебра, особенно галогенидов, и гораздо менее чувствителен к свету. Когда-то его называли лунной едкой, потому что древние алхимики называли серебро луной , веря, что серебро связано с Луной. [43] [44] Его часто используют для гравиметрического анализа, используя нерастворимость более тяжелых галогенидов серебра, распространенным предшественником которых он является. [23] Нитрат серебра используется многими способами в органическом синтезе , например, для снятия защиты и окисления. Аг + обратимо связывает алкены , а нитрат серебра использовался для разделения смесей алкенов путем селективного поглощения. Полученный аддукт можно разложить аммиаком с выделением свободного алкена. [45]
Желтый карбонат серебра Ag 2 CO 3 легко получить взаимодействием водных растворов карбоната натрия с недостатком нитрата серебра. [46] Его основное применение — производство серебряного порошка для использования в микроэлектронике. Восстанавливается формальдегидом с образованием серебра, свободного от щелочных металлов: [47]
- Ag 2 CO 3 + CH 2 O → 2 Ag + 2 CO 2 + H 2
Карбонат серебра также используется в качестве реагента в органическом синтезе, например, в реакции Кенигса-Кнорра . При окислении Фетизона карбонат серебра на целите действует как окислитель, образуя лактоны из диолов . Он также используется для превращения алкилбромидов в спирты . [46]
Гремучее серебро , AgCNO, мощное, чувствительное к прикосновению взрывчатое вещество , используемое в капсюлях , производится реакцией металлического серебра с азотной кислотой в присутствии этанола . Другими взрывоопасными соединениями серебра являются азид серебра AgN 3 , образующийся в результате реакции нитрата серебра с азидом натрия . [48] и ацетилид серебра Ag 2 C 2 , образующийся при реакции серебра с газообразным ацетиленом в растворе аммиака. [31] В своей наиболее характерной реакции азид серебра взрывоопасно разлагается с выделением газообразного азота: учитывая фоточувствительность солей серебра, такое поведение можно вызвать, освещая его кристаллы светом. [31]
- 2 АгН
3 (с) → 3 Н
2 (г) + 2 Ag (т)
Координационные соединения

Комплексы серебра имеют тенденцию быть похожими на комплексы его более легкого гомолога меди. Комплексы серебра (III), как правило, редки и очень легко восстанавливаются до более стабильных низших степеней окисления, хотя они немного более стабильны, чем комплексы меди (III). Например, плоский квадратный периодат [Ag(IO 5 OH) 2 ] 5− и теллурат [Ag{TeO 4 (OH) 2 } 2 ] 5− Комплексы можно получить окислением серебра(I) щелочным пероксодисульфатом . Желтый диамагнетик [AgF 4 ] − гораздо менее стабилен, дымит во влажном воздухе и реагирует со стеклом. [38]
Комплексы серебра(II) встречаются чаще. Как и валентные изоэлектронные комплексы меди(II), они обычно имеют плоскую квадратную форму и парамагнитны, что усиливается за счет большего расщепления поля для 4d-электронов, чем для 3d-электронов. Водный Ag 2+ , полученный окислением Ag + под действием озона является очень сильным окислителем даже в кислых растворах: стабилизируется в фосфорной кислоте за счет комплексообразования. Пероксодисульфатное окисление обычно необходимо для получения более стабильных комплексов с гетероциклическими аминами , такими как [Ag(py) 4 ] 2+ и [Ag(bipy) 2 ] 2+ : они стабильны при условии, что противоион не может восстановить серебро обратно до степени окисления +1. [AgF 4 ] 2− также известен в виде фиолетовой бариевой соли, а также некоторых комплексов серебра (II) с N- или O -донорными лигандами, такими как пиридинкарбоксилаты. [49]
Безусловно, наиболее важной степенью окисления серебра в комплексах является +1. АГ + катион диамагнитен, как и его гомологи Cu + и Ау + , поскольку все три имеют электронную конфигурацию с закрытой оболочкой без неспаренных электронов: его комплексы бесцветны при условии, что лиганды не слишком легко поляризуются, такие как I − . В + образует соли с большинством анионов, но неохотно координируется с кислородом, и поэтому большинство этих солей нерастворимы в воде: исключениями являются нитрат, перхлорат и фторид. Тетракоординатный тетраэдрический водный ион [Ag(H 2 O) 4 ] + известна, но характерная геометрия Ag + катион является 2-координатным линейным. Например, хлорид серебра легко растворяется в избытке водного аммиака с образованием [Ag(NH 3 ) 2 ] + ; соли серебра растворяются на фотографии за счет образования тиосульфатного комплекса [Ag(S 2 O 3 ) 2 ] 3− ; и цианидная экстракция для серебряных (и золотых) производств путем образования комплекса [Ag(CN) 2 ] − . Цианид серебра образует линейный полимер {Ag–C≡N→Ag–C≡N→}; серебра Тиоцианат имеет аналогичную структуру, но вместо этого образует зигзаг из-за sp. 3 - гибридизованный атом серы. Хелатирующие лиганды не способны образовывать линейные комплексы, поэтому комплексы серебра (I) с ними имеют тенденцию образовывать полимеры; существует несколько исключений, таких как околотетраэдрические комплексы дифосфина и диарсина [Ag(L–L) 2 ] + . [50]
Металлоорганический
В стандартных условиях серебро не образует простых карбонилов из-за слабости связи Ag–C. Некоторые из них известны при очень низких температурах около 6–15 К, например, зеленый плоский парамагнитный Ag(CO) 3 , который димеризуется при 25–30 К, вероятно, образуя связи Ag-Ag. карбонил серебра [Ag(CO)] [B(OTeF 5 ) 4 Кроме того, известен полимерные комплексы AgLX с алкенами и алкинами ]. Известны , но их связи термодинамически слабее, чем даже у комплексов платины (хотя они образуются легче, чем у аналогичных комплексов золота): они также весьма несимметричны, что свидетельствует о слабой π- связи. в группе 11. σ- связи Ag–C также могут образовываться серебром (I), как медь (I) и золото (I), но простые алкилы и арилы серебра (I) еще менее стабильны, чем алкилы меди (I). I) (которые имеют тенденцию взрываться в условиях окружающей среды). Например, плохая термическая стабильность отражается на относительных температурах разложения AgMe (-50 °C) и CuMe (-15 °C), а также PhAg (74 °C) и PhCu (100 °C). [51]
Связь C–Ag стабилизируется перфторалкильными лигандами, например в AgCF(CF 3 ) 2 . [52] Соединения алкенилсеребра также более стабильны, чем их аналоги из алкилсеребра. [53] серебро Комплексы -NHC легко получить, и их обычно используют для получения других комплексов NHC путем замены лабильных лигандов. Например, реакция комплекса бис(NHC)серебра(I) с дихлоридом бис(ацетонитрил)палладия или хлоридо(диметилсульфид)золотом(I) : [54]
Интерметаллид

Серебро образует сплавы с большинством других элементов таблицы Менделеева. Элементы 1–3 групп, за исключением водорода , лития и бериллия , хорошо смешиваются с серебром в конденсированной фазе и образуют интерметаллиды; из групп 4–9 смешиваются плохо; элементы 10–14 групп (кроме бора и углерода ) имеют очень сложные фазовые диаграммы Ag–M и образуют наиболее коммерчески важные сплавы; а остальные элементы таблицы Менделеева не имеют согласованности в своих фазовых диаграммах Ag – M. Безусловно, наиболее важными из таких сплавов являются сплавы с медью: большая часть серебра, используемого для чеканки монет и ювелирных изделий, на самом деле представляет собой сплав серебра и меди, а эвтектическая смесь используется при вакуумной пайке . Эти два металла полностью смешиваются в жидком, но не в твердом состоянии; их важность в промышленности обусловлена тем фактом, что их свойства, как правило, подходят для широкого диапазона изменений концентрации серебра и меди, хотя большинство полезных сплавов, как правило, богаче серебром, чем эвтектическая смесь (71,9% серебра и 28,1% меди по вес, а также 60,1% серебра и 28,1% меди по атому). [55]
Большинство других бинарных сплавов малопригодны: например, сплавы серебро–золото слишком мягки, а сплавы серебро– кадмий слишком токсичны. Гораздо большее значение имеют тройные сплавы: зубные амальгамы обычно представляют собой сплавы серебро-олово-ртуть, сплавы серебро-медь-золото очень важны в ювелирном деле (обычно богаты золотом) и имеют широкий диапазон твердости и цветов, серебро-медь-золото. медно-цинковые сплавы полезны в качестве легкоплавких припоев, а серебро-кадмий- индий (включающий три соседних элемента в таблице Менделеева) полезен в ядерных реакторах из-за его высокого сечения захвата тепловых нейтронов , хорошей теплопроводности, механическая стабильность и устойчивость к коррозии в горячей воде. [55]
Этимология
Слово серебро встречается в древнеанглийском языке в различных вариантах написания, например, seolfor и siolfor . Это родственно древневерхненемецкому силабару ; Готический силубр ; или древнескандинавское silfr , все они в конечном итоге произошли от протогерманского *silubra . Балто -славянские слова, обозначающие серебро, очень похожи на германские (например, русское серебро [ serebró ], польское srebro , литовское sidãbras ), как и кельтиберийская форма silabur . Они могут иметь общее индоевропейское происхождение, хотя их морфология скорее предполагает неиндоевропейский Wanderwort . [56] [57] Таким образом, некоторые ученые предположили палеолатиноамериканское происхождение, указывая на баскскую форму zilharr . в качестве доказательства [58]
Химический символ Ag происходит от латинского слова, обозначающего серебро , argentum (сравните древнегреческое ἄργυρος , árgyros ), от протоиндоевропейского корня * h₂erٵ- (ранее реконструированного как *arϵ- ), означающего « белый » или « сияющий ». . Это было обычное протоиндоевропейское слово для обозначения металла, рефлексы которого отсутствуют в германском и балтославянском языках. [57]
История


Серебро было известно еще в доисторические времена: [59] Три металла группы 11 — медь, серебро и золото — встречаются в природе в элементарной форме и, вероятно, использовались в качестве первых примитивных форм денег , а не простого бартера. [60] Однако, в отличие от меди, серебро не привело к развитию металлургии из -за своей низкой структурной прочности и чаще использовалось в качестве украшений или денег. [61] Поскольку серебро более реакционноспособно, чем золото, запасы самородного серебра были гораздо более ограниченными, чем запасы золота. [60] Например, серебро было дороже золота в Египте примерно до пятнадцатого века до нашей эры: [62] Считается, что египтяне отделили золото от серебра, нагревая металлы с солью, а затем восстанавливая полученный хлорид серебра до металла. [63]
Ситуация изменилась с открытием купелирования — метода, позволяющего извлекать металлическое серебро из руд. В то время как шлаковые кучи, найденные в Малой Азии и на островах Эгейского моря, указывают на то, что серебро отделялось от свинца еще в IV тысячелетии до нашей эры . [12] и одним из первых центров добычи серебра в Европе была Сардиния в период раннего энеолита , [64] эти методы получили широкое распространение лишь позже, когда оно распространилось по всему региону и за его пределы. [62] Истоки производства серебра в Индии , Китае и Японии почти наверняка были одинаково древними, но недостаточно документированы из-за их большого возраста. [63]

Когда финикийцы впервые пришли на территорию нынешней Испании , они получили так много серебра, что не могли уместить его все на свои корабли, и в результате для утяжеления своих якорей использовали серебро вместо свинца. [62] Ко времени возникновения греческой и римской цивилизаций серебряные монеты были основным продуктом экономики: [60] греки уже добывали серебро из галенита к VII веку до нашей эры, [62] а подъем Афин частично стал возможен благодаря близлежащим серебряным рудникам в Лаурии , из которых они добывали около 30 тонн в год с 600 по 300 гг. до н.э. [65] Стабильность римской валюты в значительной степени зависела от поставок серебряных слитков, в основном из Испании, которые римские горняки производили в масштабах, не имеющих себе равных до открытия Нового Света . обращались примерно 10 000 тонн серебра в римской экономике Достигнув пикового производства в 200 тонн в год, в середине второго века нашей эры , что в пять-десять раз больше, чем совокупное количество серебра, доступное средневековой Европе и Аббасидскому халифату. около 800 г. н.э. [66] [67] Римляне также зарегистрировали добычу серебра в Центральной и Северной Европе в тот же период. Это производство почти полностью прекратилось с падением Римской империи и не возобновилось до времен Карла Великого : к тому времени уже были добыты десятки тысяч тонн серебра. [63]
Центральная Европа стала центром производства серебра в средние века , поскольку средиземноморские месторождения, эксплуатируемые древними цивилизациями, были исчерпаны. Серебряные рудники были открыты в Богемии , Саксонии , Эльзасе , регионе Лан , Зигерланде , Силезии , Венгрии , Норвегии , Штирии , Шваце и южном Шварцвальде . Большинство этих руд были весьма богаты серебром, и их можно было просто вручную отделить от оставшейся породы, а затем переплавить; встречены также месторождения самородного серебра. Многие из этих рудников вскоре были исчерпаны, но некоторые из них оставались действующими до промышленной революции , до которой мировое производство серебра составляло всего лишь 50 тонн в год. [63] В Америке технология высокотемпературного купелирования серебром и свинцом была разработана цивилизациями до инков еще в 60–120 годах нашей эры; В это время продолжали разрабатывать месторождения серебра в Индии, Китае, Японии и доколумбовой Америке. [63] [68]
С открытием Америки и разграблением серебра испанскими конкистадорами Центральная и Южная Америка стали доминирующими производителями серебра примерно до начала 18 века, особенно Перу , Боливия , Чили и Аргентина : [63] последняя из этих стран позже получила свое название от металла, составлявшего большую часть ее минеральных богатств. [65] Торговля серебром уступила место глобальной сети обмена . Как выразился один историк, серебро «ходило по миру и заставляло мир вращаться». [69] Большая часть этого серебра оказалась в руках китайцев. Португальский купец в 1621 году заметил, что серебро «скитается по всему миру... прежде чем попасть в Китай, где оно остается как бы в своем естественном центре». [70] Тем не менее, большая часть этих денег досталась Испании, что позволило испанским правителям реализовать военные и политические амбиции как в Европе, так и в Америке. «Рудники Нового Света», заключили несколько историков, «поддержали Испанскую империю». [71]
В XIX веке первичное производство серебра переместилось в Северную Америку, особенно в Канаду , Мексику и Неваду в США : некоторое вторичное производство из свинцовых и цинковых руд также имело место в Европе, а также на месторождениях в Сибири и на Дальнем Востоке России . так же как и в Австралии были добыты. [63] Польша стала важным производителем в 1970-х годах после открытия месторождений меди, богатых серебром, прежде чем в следующем десятилетии центр производства вернулся в Америку. Сегодня Перу и Мексика по-прежнему входят в число основных производителей серебра, но распределение производства серебра по всему миру вполне сбалансировано, и около одной пятой поставок серебра поступает за счет переработки, а не нового производства. [63]
-
Протоэламский бык, стоящий на коленях и держащий сосуд с фонтаном; 3100–2900 гг. до н. э.; 16,3×6,3×10,8 см; Метрополитен-музей (Нью-Йорк)
-
Древнеегипетская фигурка Гора в образе бога-сокола с египетской короной; в. 500 г. до н.э .; серебро и электрум ; высота: 26,9 см; Государственная коллекция египетского искусства ( Мюнхен , Германия)
-
Древнегреческая тетрадрахма ; 315–308 гг. до н. э.; диаметр: 2,7 см; Метрополитен-музей
-
Древнегреческая позолоченная чаша; 2–1 век до н. э.; высота: 7,6 см, диаметр: 14,8 см; Метрополитен-музей
-
римская тарелка; I – II века нашей эры; высота: 0,1 см, диаметр: 12,7 см; Метрополитен-музей
-
Римский бюст Сераписа ; 2 ст.; 15,6×9,5 см; Метрополитен-музей
-
Аурикулярный таз со сценами из истории Дианы и Актеона; 1613; длина: 50 см, высота: 6 см, ширина: 40 см; Рейксмузеум ( Амстердам , Нидерланды )
-
супница во французском стиле рококо ; 1749 г.; высота: 26,3 см, ширина: 39 см, глубина: 24 см; Метрополитен-музей
-
кофейник французского рококо; 1757 г.; высота: 29,5 см; Метрополитен-музей
-
Французский неоклассический кувшин; 1784–1785; высота: 32,9 см; Метрополитен-музей
-
в стиле неорококо кофейник ; 1845 г.; общий размер: 32×23,8×15,4 см; Кливлендский художественный музей ( Кливленд , Огайо , США)
-
французского модерна десертные ложки ; около 1890 г.; Купер Хьюитт, Смитсоновский музей дизайна (Нью-Йорк)
-
жардиньерка в стиле модерн; около 1905–1910 гг.; высота: 22 см, ширина: 47 см, глубина: 22,5 см; Купер Хьюитт, Смитсоновский музей дизайна
Символическая роль

Серебро играет определенную роль в мифологии и нашло различное использование в качестве метафоры и в фольклоре. Греческий поэт Гесиод в «Трудах и днях » (строки 109–201) перечисляет разные возрасты человека, названные в честь таких металлов, как золото, серебро, бронза и железо, чтобы объяснить последовательные эпохи человечества. [72] содержат » Овидия «Метаморфозы еще один пересказ истории, содержащий иллюстрацию метафорического использования серебра для обозначения второго лучшего в ряду, лучшего, чем бронза, но хуже, чем золото:
Но когда добрый Сатурн изгнан сверху,
Был загнан в ад, мир находился под властью Юпитера .
Наступают последующие времена, вот серебряный век,
Превосходная латунь, но еще более превосходящая золото.- Овидий, Метаморфозы , Книга I, пер. Джон Драйден
В фольклоре обычно считалось, что серебро обладает мистическими способностями: например, пуля, отлитая из серебра, часто считается в таком фольклоре единственным оружием, эффективным против оборотня , ведьмы или других монстров . [73] [74] [75] Отсюда идиома « серебряная пуля» превратилась в образное обозначение любого простого решения с очень высокой эффективностью или почти чудесными результатами, как в широко обсуждаемой статье по разработке программного обеспечения « Нет серебряной пули ». [76] Другие способности, приписываемые серебру, включают обнаружение яда и облегчение перехода в мифическое царство фей . [75]
Производство серебра также вдохновило образный язык. Явные упоминания о купелировании встречаются в Ветхом Завете Библии . , например, в упреке Иеремии Иуде: «Мехи сгорают, свинец сгорает в огне, плавит напрасно, ибо нечестивые не исторгаются» ... Нечестивым серебром назовут их люди, потому что Господь отверг их». (Иеремия 6:19–20) Иеремия также знал о листовом серебре, которое служило примером ковкости и пластичности металла: «Серебро, разложенное на пластины, привозится из Фарсиса, а золото из Уфаза, дело рук и рук основателя: синяя и пурпурная одежда их: все они — дело хитрых людей». (Иеремия 10:9) [62]
Серебро также имеет более негативное культурное значение: идиома «тридцать сребреников» , относящаяся к награде за предательство, отсылает к взятке, которую, Иуда Искариот как сказано в Новом Завете, взял у еврейских лидеров в Иерусалиме, чтобы передать Иисуса из Назарета солдатам первосвященник Каиафа. [77] С этической точки зрения серебро также символизирует жадность и деградацию сознания; это отрицательный аспект, извращение его ценности. [78]
Возникновение и производство

Содержание серебра в земной коре составляет 0,08 частей на миллион , что почти точно такое же, как у ртути . Чаще всего он встречается в сульфидных рудах, особенно в акантите и аргентите , Ag 2 S. Месторождения аргентита иногда содержат и самородное серебро, когда они встречаются в восстановительных средах, а при контакте с соленой водой превращаются в хлораргирит (в том числе роговое серебро ), AgCl, который распространен в Чили и Новом Южном Уэльсе . [79] Большинство других минералов серебра представляют собой пниктиды или халькогениды серебра ; Обычно это блестящие полупроводники. Большинство настоящих месторождений серебра, в отличие от серебристых месторождений других металлов, произошло в результате вулканизма третичного периода . [80]
Основные источники серебра — руды меди, медно-никелевые, свинцовые и свинцово-цинковые, добываемые в Перу , Боливии , Мексике , Китае , Австралии , Чили , Польше и Сербии . [12] Перу, Боливия и Мексика добывают серебро с 1546 года и до сих пор являются крупнейшими мировыми производителями. Крупнейшие рудники по добыче серебра — Каннингтон (Австралия), Фреснильо (Мексика), Сан-Кристобаль (Боливия), Антамина (Перу), Рудна (Польша) и Пенаскито (Мексика). [81] Крупнейшими проектами разработки месторождений на ближайшую перспективу до 2015 года являются Паскуа Лама (Чили), Навидад (Аргентина), Хаунисипио (Мексика), Малку Хота (Боливия), [82] и река Хакетт (Канада). [81] Известно, что в Центральной Азии Таджикистан обладает одними из крупнейших месторождений серебра в мире. [83]
Серебро обычно встречается в природе в сочетании с другими металлами или в минералах, содержащих соединения серебра, обычно в форме сульфидов , таких как галенит (сульфид свинца) или церуссит (карбонат свинца). Таким образом, первичное производство серебра требует плавки, а затем купелирования серебристосодержащих свинцовых руд, что является исторически важным процессом. [84] Свинец плавится при 327 °С, оксид свинца — при 888 °С, серебро — при 960 °С. Для отделения серебра сплав снова плавят при высокой температуре от 960°С до 1000°С в окислительной среде. Свинец окисляется до монооксида свинца , известного тогда как глет , который захватывает кислород из других присутствующих металлов. Жидкий оксид свинца удаляется или впитывается под действием капиллярных сил в футеровку пода. [85] [86] [87]
- Ag (s) + 2 Pb (s) + O
2 (г) → 2 PbO (поглощенный) + Ag(л)
Сегодня металлическое серебро в основном производится как вторичный побочный продукт электролитического рафинирования меди, свинца и цинка, а также путем применения процесса Паркса к слиткам свинца из руды, которая также содержит серебро. [88] В таких процессах серебро следует за рассматриваемым цветным металлом через его концентрацию и плавку, а затем очищается. Например, при производстве меди очищенная медь электролитически осаждается на катоде, в то время как менее реакционноспособные драгоценные металлы, такие как серебро и золото, собираются под анодом в виде так называемого «анодного шлама». Затем его отделяют и очищают от неблагородных металлов путем обработки горячей аэрированной разбавленной серной кислотой и нагревания с известью или кремнеземным флюсом, после чего серебро очищается до чистоты более 99,9% посредством электролиза в нитратном растворе. [79]
Чистота технического серебра составляет не менее 99,9%, но доступно серебро с чистотой более 99,999%. В 2022 году Мексика была крупнейшим производителем серебра (6300 тонн или 24,2% от мирового объема в 26 000 тонн), за ней следовали Китай (3600 тонн) и Перу (3100 тонн). [88]
В морской среде
низкая Концентрация серебра в морской воде (пмоль/л). Уровни варьируются в зависимости от глубины и между водоемами. Концентрация растворенного серебра колеблется от 0,3 пмоль/л в прибрежных поверхностных водах до 22,8 пмоль/л в пелагических глубоких водах. [89] Анализ присутствия и динамики серебра в морской среде затруднен из-за особенно низких концентраций и сложных взаимодействий в окружающей среде. [90] Несмотря на то, что металл является редким микроэлементом, на его концентрацию сильно влияют речные, эоловые, атмосферные и апвеллинговые поступления, а также антропогенные поступления в виде сбросов, удаления отходов и выбросов промышленных компаний. [91] [92] Другие внутренние процессы, такие как разложение органического вещества, могут быть источником растворенного серебра в более глубоких водах, которое попадает в некоторые поверхностные воды посредством апвеллинга и вертикального перемешивания. [92]
В Атлантическом и Тихом океанах концентрации серебра минимальны на поверхности, но возрастают в более глубоких водах. [93] Серебро поглощается планктоном в фотической зоне, ремобилизуется с глубиной и обогащается в глубоких водах. Серебро транспортируется из Атлантики в другие океанические водные массы. [91] В водах северной части Тихого океана серебро ремобилизуется медленнее и все больше обогащается по сравнению с глубокими водами Атлантического океана. Концентрация серебра увеличивается, следуя за основным океаническим конвейером, который перемещает воду и питательные вещества из Северной Атлантики в Южную Атлантику и в северную часть Тихого океана. [94]
Не существует большого количества данных о том, как серебро влияет на морскую жизнь, несмотря на вероятное вредное воздействие, которое оно может оказать на организмы посредством биоаккумуляции , связи с твердыми частицами и сорбции . [89] Лишь примерно в 1984 году ученые начали понимать химические характеристики серебра и его потенциальную токсичность. Фактически, ртуть — единственный микроэлемент, который превосходит по токсичному воздействию серебро; однако полная степень токсичности серебра не ожидается в условиях океана из-за его способности переходить в нереактивные биологические соединения. [95]
В одном исследовании присутствие избытка ионного серебра и наночастиц серебра вызывало эффект биоаккумуляции в органах рыбок данио и изменяло химические пути в их жабрах. [96] Кроме того, очень ранние экспериментальные исследования показали, как токсическое воздействие серебра колеблется в зависимости от солености и других параметров, а также от стадии жизни и различных видов, таких как рыбы, моллюски и ракообразные. [97] Другое исследование обнаружило повышенную концентрацию серебра в мышцах и печени дельфинов и китов, что указывает на загрязнение этого металла в последние десятилетия. Серебро — металл, который нелегко вывести из организма, и повышенные концентрации могут привести к смерти. [98]
Денежное использование

царстве Самые ранние известные монеты были отчеканены в Лидийском в Малой Азии около 600 г. до н.э. [99] Монеты Лидии были изготовлены из электрума — природного сплава золота и серебра, доступного на территории Лидии. [99] С этого времени серебряные стандарты , в которых стандартной экономической единицей расчета является фиксированный вес серебра, получили широкое распространение во всем мире вплоть до 20 века. Известные серебряные монеты на протяжении веков включают греческую драхму , [100] римский денарий , [101] исламский дирхам , [102] каршапана Империи Великих из древней Индии и рупия времен Моголов (сгруппированная с медными и золотыми монетами для создания триметаллического стандарта), [103] и испанский доллар . [104]
Соотношение количества серебра, используемого для чеканки монет, и количества серебра, используемого для других целей, со временем сильно менялось; например, в военное время больше серебра, как правило, использовалось для чеканки монет для финансирования войны. [105]
Сегодня серебряные слитки имеют код валюты XAG по стандарту ISO 4217 , один из четырех драгоценных металлов, имеющих такой код (остальные — палладий , платина и золото). [106] Серебряные монеты производятся из литых стержней или слитков, прокатываются до нужной толщины, подвергаются термообработке, а затем используются для вырезания заготовок . Эти заготовки затем фрезеруются и чеканятся в чеканном прессе; современные чеканочные станки могут производить 8000 серебряных монет в час. [105]
Цена
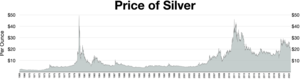
Цены на серебро обычно указываются в тройских унциях . Одна тройская унция равна 31,1034768 грамма. Лондонский фиксинг серебра публикуется каждый рабочий день в полдень по лондонскому времени. [107] Эта цена определяется несколькими крупными международными банками и используется участниками лондонского рынка драгоценных металлов для торгов в этот день. Цены чаще всего указываются в долларах США (USD), фунтах стерлингов (GBP) и евро (EUR).
Приложения
Ювелирные изделия и серебро


На протяжении большей части истории серебро, помимо чеканки монет, главным образом использовалось в производстве ювелирных изделий и других предметов общего пользования, и это продолжает оставаться основным применением и сегодня. Примеры включают столовое серебро для столовых приборов, для которого серебро очень подходит из-за его антибактериальных свойств. Западные концертные флейты или изготавливаются из него обычно покрываются серебром ; [109] на самом деле, большая часть столового серебра всего лишь посеребрена, а не сделана из чистого серебра; серебро обычно наносится гальванопокрытием . Посеребренное стекло (в отличие от металлического) используется для изготовления зеркал, термосов и елочных украшений. [110]
Поскольку чистое серебро очень мягкое, большая часть серебра, используемого для этих целей, легирована медью, причем обычно используются пробы 925/1000, 835/1000 и 800/1000. Одним из недостатков является легкое потускнение серебра в присутствии сероводорода и его производных. Включение драгоценных металлов, таких как палладий, платина и золото, обеспечивает устойчивость к потускнению, но обходится довольно дорого; базовые металлы, такие как цинк , кадмий , кремний и германий, не полностью предотвращают коррозию и имеют тенденцию влиять на блеск и цвет сплава. Электролитически очищенное покрытие серебром эффективно повышает устойчивость к потускнению. Обычными решениями для восстановления блеска потускневшего серебра являются окунающие ванны, восстанавливающие поверхность сульфида серебра до металлического серебра, и очистка слоя потускнения пастой; Последний подход также имеет приятный побочный эффект, заключающийся в одновременной полировке серебра. [109]
Лекарство
В медицине серебро добавляют в повязки на раны и используют в качестве антибиотического покрытия в медицинских устройствах. Раневые повязки, содержащие сульфадиазин серебра или наноматериалы серебра, используются для лечения внешних инфекций. Серебро также используется в некоторых медицинских целях, таких как мочевые катетеры (где предварительные данные указывают на то, что оно снижает риск возникновения катетер-ассоциированных инфекций мочевыводящих путей ) и в эндотрахеальных дыхательных трубках , связанной с аппаратом искусственной вентиляции легких (где данные свидетельствуют о том, что оно снижает риск возникновения пневмонии ). [111] [112] серебра Ион биоактивен концентрации и в достаточной легко убивает бактерии in vitro . Ионы серебра мешают ферментам бактерий, которые транспортируют питательные вещества, формируют структуры и синтезируют клеточные стенки; эти ионы также связываются с генетическим материалом бактерий. Серебро и наночастицы серебра используются в качестве противомикробного средства в различных отраслях промышленности, здравоохранения и быта: например, наполнение одежды частицами наносеребра позволяет ей дольше оставаться без запаха. [113] [114] Однако бактерии могут развить устойчивость к противомикробному действию серебра. [115] Соединения серебра усваиваются организмом так же, как соединения ртути , но лишены токсичности последних. Серебро и его сплавы применяют в черепной хирургии для замещения кости, а амальгамы серебра, олова и ртути — в стоматологии. [110] Фторид диаммина серебра , фторидная соль координационного комплекса с формулой [Ag(NH 3 ) 2 ]F, представляет собой лекарственное средство (лекарство) местного действия, используемое для лечения и профилактики зубов и снятия гиперчувствительности дентина. кариеса (кариеса) [116]
Электроника
Серебро очень важно в электронике для изготовления проводников и электродов из-за его высокой электропроводности, даже если оно потускнело. Объемное серебро и серебряная фольга использовались для изготовления электронных ламп и продолжают использоваться сегодня в производстве полупроводниковых приборов, схем и их компонентов. Например, серебро используется в высококачественных разъемах для ВЧ , УКВ и более высоких частот, особенно в настроенных схемах, таких как резонаторные фильтры , где проводники не могут масштабироваться более чем на 6%. Печатные схемы и RFID- антенны выполнены серебристыми красками. [12] [117] Порошковое серебро и его сплавы используются при приготовлении паст для проводящих слоев и электродов, керамических конденсаторов и других керамических компонентов. [118]
Припои
Серебросодержащие припои используются для пайки металлических материалов, в основном сплавов на основе кобальта , никеля и меди, инструментальных сталей и драгоценных металлов. Основными компонентами являются серебро и медь, а другие элементы выбираются в соответствии с конкретным желаемым применением: например, цинк, олово, кадмий, палладий, марганец и фосфор . Серебро обеспечивает повышенную обрабатываемость и устойчивость к коррозии во время использования. [119]
Химическое оборудование
Серебро полезно при производстве химического оборудования из-за его низкой химической активности, высокой теплопроводности и легкости обработки. Для проведения щелочной плавки применяют серебряные тигли (легированные 0,15% никеля во избежание рекристаллизации металла при красном калении). Медь и серебро также используются при проведении химии с фтором . Оборудование, предназначенное для работы при высоких температурах, часто бывает посеребренным. Серебро и его сплавы с золотом применяют в качестве проволочных или кольцевых уплотнений кислородных компрессоров и вакуумного оборудования. [120]
Катализ
Металлическое серебро является хорошим катализатором реакций окисления ; на самом деле оно слишком хорошо для большинства целей, поскольку мелкодисперсное серебро имеет тенденцию приводить к полному окислению органических веществ до углекислого газа и воды, и, следовательно, вместо него обычно используется более крупнозернистое серебро. Например, 15% серебра, нанесенного на α-Al 2 O 3 или силикаты, является катализатором окисления этилена в оксид этилена при 230–270 °С. Дегидрирование метанола в формальдегид проводится при 600–720 ° C на серебряной сетке или кристаллах в качестве катализатора, как и дегидрирование изопропанола в ацетон . В газовой фазе гликоль дает глиоксаль , а этанол дает ацетальдегид , а органические амины дегидратируются до нитрилов . [120]
Фотография
До появления цифровой фотографии , которая сейчас доминирует, светочувствительность галогенидов серебра использовалась для использования в традиционной пленочной фотографии. используемая Светочувствительная эмульсия, в черно-белой фотографии, представляет собой суспензию кристаллов галогенида серебра в желатине , возможно, смешанную с некоторыми соединениями благородных металлов для улучшения светочувствительности, проявления и настройки. [ объяснить ] .
Цветная фотография требует добавления специальных красящих компонентов и сенсибилизаторов, так что исходное черно-белое серебряное изображение сочетается с другим красящим компонентом. Оригинальные серебряные изображения отбеливаются, а затем серебро восстанавливается и перерабатывается. Нитрат серебра во всех случаях является исходным материалом. [121]
Рынок нитрата серебра и галогенидов серебра для фотографии быстро сократился с появлением цифровых камер. С пикового мирового спроса на фотосеребро в 1999 году (267 000 000 тройских унций или 8 304,6 тонны ) к 2013 году рынок сократился почти на 70%. [122]
Наночастицы
Частицы наносеребра размером от 10 до 100 нанометров используются во многих приложениях. Они используются в проводящих чернилах для печатной электроники и имеют гораздо более низкую температуру плавления, чем более крупные частицы серебра микрометрового размера. [123] Они также используются в медицинских целях в антибактериальных и противогрибковых средствах почти так же, как и более крупные частицы серебра. [114] Кроме того, по данным Обсерватории наноматериалов Европейского Союза (EUON), наночастицы серебра используются как в пигментах, так и в косметике. [124] [125]
Разнообразный

Чистый металл серебра используется в качестве пищевого красителя. Он имеет обозначение E174 и одобрен в Европейском Союзе . [126] Традиционные индийские и пакистанские блюда иногда включают в себя декоративную серебряную фольгу, известную как варк . [127] а в других культурах серебряное драже используется для украшения тортов, печенья и других десертов. [128]
Фотохромные линзы содержат галогениды серебра, поэтому ультрафиолетовый свет при естественном дневном свете высвобождает металлическое серебро, затемняя линзы. Галогениды серебра реформируются при более низкой интенсивности света. Бесцветные пленки хлорида серебра используются в детекторах радиации . Цеолитовые сита с содержанием Ag + ионы используются для опреснения морской воды во время спасательных операций, используя ионы серебра для осаждения хлорида в виде хлорида серебра. Серебро также используется из-за его антибактериальных свойств для дезинфекции воды, но его применение ограничено ограничениями на потребление серебра. Коллоидное серебро также используется для дезинфекции закрытых бассейнов; хотя оно имеет то преимущество, что не выделяет запаха, как обработка гипохлоритом , коллоидное серебро недостаточно эффективно для более загрязненных открытых бассейнов. Маленькие кристаллы йодида серебра используются при засеве облаков, вызывающих дождь. [114]
Законодательное собрание Техаса объявило серебро официальным драгоценным металлом Техаса в 2007 году. [129]
Меры предосторожности
| Опасности | |
|---|---|
| СГС Маркировка : | |

| |
| Предупреждение | |
| H410 | |
| П273 , П391 , П501 [130] | |
| NFPA 704 (огненный алмаз) | |
Соединения серебра обладают низкой токсичностью по сравнению с соединениями большинства других тяжелых металлов , поскольку они плохо усваиваются организмом человека при попадании в организм, а то, что усваивается, быстро превращается в нерастворимые соединения серебра или образует комплекс с металлотионеином . Однако фторид серебра и нитрат серебра являются едкими и могут вызвать повреждение тканей, что приводит к гастроэнтериту , диарее , падению артериального давления , судорогам, параличу и остановке дыхания . У животных, неоднократно получавших соли серебра, наблюдалась анемия , замедление роста, некроз печени и жировая дегенерация печени и почек; у крыс, которым имплантировали серебряную фольгу или вводили коллоидное серебро , наблюдалось развитие локализованных опухолей. При парентеральном введении коллоидное серебро вызывает острое отравление серебром. [131] Некоторые водные виды особенно чувствительны к солям серебра и других драгоценных металлов; однако в большинстве ситуаций серебро не представляет серьезной опасности для окружающей среды. [131]
В больших дозах серебро и содержащие его соединения могут всасываться в систему кровообращения и откладываться в различных тканях организма, что приводит к аргирии , приводящей к сине-сероватой пигментации кожи, глаз и слизистых оболочек . Аргирия встречается редко и, насколько известно, не причиняет иного вреда здоровью человека, хотя уродует и обычно необратима. Легкие формы аргирии иногда ошибочно принимают за цианоз — синий оттенок кожи, вызванный недостатком кислорода. [131] [12]
Металлическое серебро, как и медь, является антибактериальным агентом, который был известен древним людям и впервые научно исследован , названным олигодинамическим эффектом Карлом Нэгели . Ионы серебра повреждают метаболизм бактерий даже в таких низких концентрациях, как 0,01–0,1 миллиграмма на литр; металлическое серебро оказывает аналогичный эффект из-за образования оксида серебра. Этот эффект теряется в присутствии серы из-за крайней нерастворимости сульфида серебра. [131]
Некоторые соединения серебра очень взрывоопасны, например, соединения азота азид серебра, амид серебра и гремучее серебро, а также ацетилид серебра , оксалат серебра и оксид серебра (II). Они могут взрываться при нагревании, силе, высыхании, освещении, а иногда и самопроизвольно. Чтобы избежать образования таких соединений, аммиак и ацетилен следует хранить подальше от серебряного оборудования. Соли серебра с сильно окисляющими кислотами, такими как хлорат серебра и нитрат серебра, могут взрываться при контакте с легко окисляющимися материалами, такими как органические соединения, сера и сажа. [131]
См. также
- Серебряная монета
- Серебряная медаль
- Бесплатное серебро
- Список стран по производству серебра
- Список соединений серебра
- Серебро как инвестиция
- Сильверпойнт Рисунок
Ссылки
- ^ «Стандартный атомный вес: серебро» . ЦИАВ . 1985.
- ^ Прохаска, Томас; Ирргехер, Йоханна; Бенефилд, Жаклин; Бёлке, Джон К.; Чессон, Лесли А.; Коплен, Тайлер Б.; Дин, Типинг; Данн, Филип Дж. Х.; Грёнинг, Манфред; Холден, Норман Э.; Мейер, Харро Эй Джей (4 мая 2022 г.). «Стандартные атомные веса элементов 2021 (Технический отчет ИЮПАК)» . Чистая и прикладная химия . дои : 10.1515/pac-2019-0603 . ISSN 1365-3075 .
- ^ Перейти обратно: а б с Арбластер, Джон В. (2018). Некоторые значения кристаллографических свойств элементов . Парк материалов, Огайо: ASM International. ISBN 978-1-62708-155-9 .
- ^ Ag(0) наблюдался в карбонильных комплексах в низкотемпературных матрицах: см. Макинтош, Д.; Озин, Г.А. (1976). «Синтез с использованием паров металлов. Карбонилы серебра. Матричные инфракрасные, ультрафиолето-видимые и электронные спектры спинового резонанса, структуры и связывание трикарбонила серебра, дикарбонила серебра, монокарбонила серебра и гексакарбонила дисеребра». Дж. Ам. хим. Соц . 98 (11): 3167–75. дои : 10.1021/ja00427a018 .
- ^ Лиде, Д.Р., изд. (2005). «Магнитная восприимчивость элементов и неорганических соединений». Справочник CRC по химии и физике (PDF) (86-е изд.). Бока-Ратон (Флорида): CRC Press. ISBN 0-8493-0486-5 .
- ^ Уэст, Роберт (1984). CRC, Справочник по химии и физике . Бока-Ратон, Флорида: Издательство компании Chemical Rubber Company. стр. E110. ISBN 0-8493-0464-4 .
- ^ Кондев, ФГ; Ван, М.; Хуанг, WJ; Наими, С.; Ауди, Г. (2021). «Оценка ядерных свойств NUBASE2020» (PDF) . Китайская физика C . 45 (3): 030001. doi : 10.1088/1674-1137/abddae .
- ^ Пул, Чарльз П. младший (11 марта 2004 г.). Энциклопедический словарь по физике конденсированного состояния . Академическая пресса. ISBN 978-0-08-054523-3 .
- ^ «Слитки и нумизматические монеты: разница между слитками и нумизматическими монетами» . Providentmetals.com . Проверено 17 декабря 2017 г.
- ^ « В мире в 5 раз больше золота, чем серебра» | Последние новости и обновления в Daily News & Analysis» . ДНК . 3 марта 2009 года . Проверено 17 декабря 2017 г.
- ^ Масуда, Хидеки (2016). «Комбинированная просвечивающая электронная микроскопия - наблюдение процесса формирования in situ и измерение физических свойств металлических проводов одиночного атомного размера». В Янечеке, Милош; Крал, Роберт (ред.). Современная электронная микроскопия в физических и биологических науках . ИнТех. дои : 10.5772/62288 . ISBN 978-953-51-2252-4 . S2CID 58893669 .
- ^ Перейти обратно: а б с д и ж г Хаммонд, ЧР (2004). Элементы в Справочнике по химии и физике (81-е изд.). ЦРК Пресс. ISBN 978-0-8493-0485-9 .
- ^ Перейти обратно: а б с д Гринвуд и Эрншоу, с. 1177
- ^ Перейти обратно: а б Гринвуд и Эрншоу, с. 1178
- ^ Джордж Л. Тригг; Эдмунд Х. Иммергут (1992). Энциклопедия прикладной физики . Том. 4: Горение до диамагнетизма. Издательство ВЧ. стр. 267–72. ISBN 978-3-527-28126-8 . Проверено 2 мая 2011 г.
- ^ Остин, Алекс (2007). Ремесло серебряного дела: методы, проекты, вдохновение . Стерлинг Паблишинг Компани, Инк. 43. ИСБН 978-1-60059-131-0 .
- ^ Эдвардс, HW; Петерсен, Р.П. (1936). «Отражательная способность пленок напыленного серебра». Физический обзор . 50 (9): 871. Бибкод : 1936PhRv...50..871E . дои : 10.1103/PhysRev.50.871 .
- ^ «Серебро против алюминия» . Обсерватория Джемини . Проверено 1 августа 2014 г.
- ^ Рассел, Алан М.; Ли, Кок Лунг (2005). Соотношения структура-свойство в цветных металлах . Нью-Йорк: Джон Уайли и сыновья. п. 302. дои : 10.1002/0471708542 . ISBN 9780471649526 .
- ^ Николс, Кеннет Д. (1987). Дорога к Троице . Морроу, Нью-Йорк: Морроу. п. 42. ИСБН 978-0-688-06910-0 .
- ^ Янг, Ховард (11 сентября 2002 г.). «Истман в Ок-Ридже во время Второй мировой войны» . Архивировано из оригинала 8 февраля 2012 года.
- ^ Оман, Х. (1992). «Не здесь изобретено? Проверьте свою историю». Журнал аэрокосмических и электронных систем . 7 (1): 51–53. дои : 10.1109/62.127132 . S2CID 22674885 .
- ^ Перейти обратно: а б с д «Атомные массы элементов 2007 (ИЮПАК)» . Архивировано из оригинала 6 сентября 2017 года . Проверено 11 ноября 2009 г.
- ^ «Атомный вес и изотопный состав всех элементов (NIST)» . Проверено 11 ноября 2009 г.
- ^ Кэмерон, AGW (1973). «Изобилие элементов в Солнечной системе» (PDF) . Обзоры космической науки . 15 (1): 121–46. Бибкод : 1973ССРв...15..121С . дои : 10.1007/BF00172440 . S2CID 120201972 .
- ^ Перейти обратно: а б Ауди, Жорж; Берсильон, Оливье; Блашо, Жан; Вапстра, Аалдерт Хендрик (2003), « Оценка NUBASE свойств ядра и распада» , Nuclear Physics A , 729 : 3–128, Бибкод : 2003NuPhA.729....3A , doi : 10.1016/j.nuclphysa.2003.11 .001
- ^ «Атомный вес и изотопный состав серебра (NIST)» . Проверено 11 ноября 2009 г.
- ^ Келли, Уильям Р.; Вассербург, Дж.Дж. (1978). «Доказательства существования 107 Pd в ранней солнечной системе » (PDF) . Geophysical Research Letters . 5 (12): 1079–82. Bibcode : 1978GeoRL...5.1079K . doi : 10.1029/GL005i012p01079 .
- ^ Рассел, Сара С .; Гунель, Матье; Хатчисон, Роберт (2001). «Происхождение короткоживущих радионуклидов». Философские труды Королевского общества А. 359 (1787): 1991–2004. Бибкод : 2001RSPTA.359.1991R . дои : 10.1098/rsta.2001.0893 . JSTOR 3066270 . S2CID 120355895 .
- ^ Перейти обратно: а б Гринвуд и Эрншоу, с. 1179
- ^ Перейти обратно: а б с д и Гринвуд и Эрншоу, с. 1180
- ^ Гринвуд и Эрншоу, с. 1176
- ^ Лидин Р.А. 1996, Справочник по неорганическим веществам , Begell House, Нью-Йорк, ISBN 1-56700-065-7 . п. 5
- ^ Гудвин Ф., Гурусвами С., Кайнер К.У., Каммер С., Кнабл В., Кете А., Лейхтфрид Г., Шламп Г., Стиклер Р. и Варлимонт Х. 2005, «Благородные металлы и сплавы благородных металлов», в Springer Handbook of Condensed Matter and Materials Data. , В. Мартиенссен и Х. Варлимонт (редакторы), Springer, Берлин, стр. 329–406, ISBN 3-540-44376-2 . п. 341
- ^ «Серебряные артефакты» в книге «Коррозия – Артефакты» . Ресурсный центр NACE
- ^ Бьелхаген, Ганс И. (1995). Галогенсеребряные записывающие материалы: для голографии и их обработка . Спрингер. стр. 156–66 . ISBN 978-3-540-58619-7 .
- ^ Ридель, Себастьян; Каупп, Мартин (2009). «Высшие степени окисления элементов переходных металлов». Обзоры координационной химии . 253 (5–6): 606–24. дои : 10.1016/j.ccr.2008.07.014 .
- ^ Перейти обратно: а б Гринвуд и Эрншоу, с. 1188
- ^ Гринвуд и Эрншоу, с. 903
- ^ Перейти обратно: а б с Гринвуд и Эрншоу, стр. 1181–82.
- ^ Перейти обратно: а б с д и Гринвуд и Эрншоу, стр. 1183–85.
- ^ Перейти обратно: а б Гринвуд и Эрншоу, стр. 1185–87.
- ^ Аббри, Фердинандо (2019). «Золото и серебро: совершенство металлов в средневековой и ранней современной алхимии» . Сущность : 39–44. doi : 10.13128/Субстанция-603 . Проверено 8 апреля 2022 г.
- ^ «Определение лунной каустики» . словарь.die.net . Архивировано из оригинала 31 января 2012 года.
- ^ Коуп, AC; Бах, Р.Д. (1973). «транс-циклооктен» . Органические синтезы ; Сборник томов , т. 5, с. 315 .
- ^ Перейти обратно: а б Макклоски CM; Коулман, GH (1955). «β-d-Глюкоза-2,3,4,6-Тетраацетат» . Органические синтезы ; Сборник томов , т. 3, с. 434 .
- ^ Брамби и др.
- ^ Мейер, Рудольф; Кёлер, Йозеф и Хомбург, Аксель (2007). Взрывчатые вещества . Уайли – ВЧ. стр. 284 . ISBN 978-3-527-31656-4 .
- ^ Гринвуд и Эрншоу, с. 1189
- ^ Гринвуд и Эрншоу, стр. 1195–96.
- ^ Гринвуд и Эрншоу, стр. 1199–200.
- ^ Миллер, WT; Бернард, Р.Дж. (1968). «Перфторалкилсеребряные соединения». Дж. Ам. хим. Соц. 90 (26): 7367–68. дои : 10.1021/ja01028a047 .
- ^ Холлидей, А.; Пендлбери, RE (1967). «Соединения винилсвинца I. Отщепление винильных групп тетравинилсвинца». Дж. Органомет. хим. 7 (2): 281–84. дои : 10.1016/S0022-328X(00)91078-7 .
- ^ Ван, Харрисон MJ; Лин, Иван Дж.Б. (1998). «Простой синтез комплексов серебра (I)-карбена. Полезные агенты переноса карбена». Металлоорганические соединения . 17 (5): 972–75. дои : 10.1021/om9709704 .
- ^ Перейти обратно: а б Брамби и др., стр. 54–61.
- ^ Кроонен, Гус (2013). Этимологический словарь прагерманского языка . Брилл. п. 436. ИСБН 978-90-04-18340-7 .
- ^ Перейти обратно: а б Мэллори, Джеймс П .; Адамс, Дуглас К. (2006). Оксфордское введение в протоиндоевропейский и протоиндоевропейский мир . Издательство Оксфордского университета. стр. 241–242. ISBN 978-0-19-928791-8 .
- ^ Буткан, Дирк; Коссманн, Мартен (2001). «К этимологии слова «Серебро» ». NOWELE: Эволюция языков Северо-Западной Европы . 38 (1): 3–15. дои : 10.1075/nowele.38.01bou .
- ^ Недели, с. 4
- ^ Перейти обратно: а б с Гринвуд и Эрншоу, стр. 1173–74.
- ^ Ридон, Артур К. (2011). Металлургия для неметаллурга . АСМ Интернешнл. стр. 73–84. ISBN 978-1-61503-821-3 .
- ^ Перейти обратно: а б с д и Уикс, стр. 14–19.
- ^ Перейти обратно: а б с д и ж г час Брамби и др., стр. 16–19.
- ^ Мелис, Мария Грация (2014). «Серебро в неолитической и энеолитической Сардинии». В Меллере, Х.; Риш, Р.; Перницка, Э. (ред.). Раннее золото и серебро. Металлы власти – Государственное управление по сохранению памятников и археологии Саксония-Анхальт. ISBN 978-3944507057 .
- ^ Перейти обратно: а б Эмсли, Джон (2011). Строительные блоки природы: путеводитель по элементам от Аризоны . Издательство Оксфордского университета. стр. 492–98. ISBN 978-0-19-960563-7 .
- ^ Паттерсон, CC (1972). «Запасы серебра и потери в древние и средневековые времена». Обзор экономической истории . 25 (2): 205235 (216, табл.2, 228, табл.6). дои : 10.1111/j.1468-0289.1972.tb02173.x .
- ^ де Каллатаи, Франсуа (2005). «Греко-римская экономика в сверхдолгосрочной перспективе: свинец, медь и кораблекрушения». Журнал римской археологии . 18 : 361–72 [365 и далее]. дои : 10.1017/s104775940000742x . S2CID 232346123 .
- ^ Шульце, Кэрол А.; Стэниш, Чарльз; Скотт, Дэвид А.; Ререн, Тило; Кюнер, Скотт; Перья, Джеймс К. (2009). «Прямое свидетельство 1900-летней местной добычи серебра в бассейне озера Титикака на юге Перу» . Труды Национальной академии наук Соединенных Штатов Америки . 106 (41): 17280–83. Бибкод : 2009PNAS..10617280S . дои : 10.1073/pnas.0907733106 . ПМЦ 2754926 . ПМИД 19805127 .
- ^ Франк, Андре Гундер (1998). Переориентация: глобальная экономика в эпоху Азии . Беркли: Издательство Калифорнийского университета. п. 131. ИСБН 0520214749 .
- ^ фон Глан, Ричард (1996). «Миф и реальность валютного кризиса семнадцатого века в Китае». Журнал экономической истории . 56 (2): 429–454. дои : 10.1017/S0022050700016508 . JSTOR 2123972 . S2CID 154126073 .
- ^ Флинн, Деннис О.; Хиральдес, Артуро (1995). «Рожденный с «серебряной ложкой» » (PDF) . Журнал всемирной истории . 2 : 210. JSTOR 20078638 .
- ^ Фонтенроуз, Джозеф (1974). «Работа, справедливость и пять веков Гесиода». Классическая филология . 69 (1): 1–16. дои : 10.1086/366027 . JSTOR 268960 . S2CID 161808359 .
- ^ Джексон, Роберт (1995). Колдовство и оккультизм . Девизес, Издательство Квинтет. п. 25. ISBN 978-1-85348-888-7 .
- ^ Стойкова, Стефана. «Дело Гайдутин» . Болгарская народная поэзия и проза в семи томах (на болгарском языке). Том. Т. III. Народные песни и исторические песни. Варна: ОИ «ЛитерНет». ISBN 978-954-304-232-6 .
- ^ Перейти обратно: а б Сент-Клер, Кассия (2016). Тайная жизнь цвета . Лондон: Джон Мюррей. п. 49. ИСБН 9781473630819 . OCLC 936144129 .
- ^ Брукс, Фредерик. П. младший (1987). «Серебряной пули нет – суть и случайность в разработке программного обеспечения» (PDF) . Компьютер . 20 (4): 10–19. CiteSeerX 10.1.1.117.315 . дои : 10.1109/MC.1987.1663532 . S2CID 372277 .
- ^ Мэтью 26:15
- ^ Шевалье, Жан; Гербрант, Ален (2009). Словарь символов. Мифы, сны, обычаи, жесты, формы, фигуры, цвета, числа [ Словарь символов. Мифы, мечты, привычки, жесты, формы, фигуры, цвета, числа ] (на румынском языке). Полиром. 105. ИСБН 978-973-46-1286-4 .
- ^ Перейти обратно: а б Гринвуд и Эрншоу, стр. 1174–67.
- ^ Брамби и др., стр. 21–22.
- ^ Перейти обратно: а б Группа CPM (2011). Серебряный ежегодник CPM . Нью-Йорк: Книги Евромони. п. 68. ИСБН 978-0-9826741-4-7 .
- ^ «Технический отчет по предварительной экономической оценке 43-101» (PDF) . South American Silver Corp. Архивировано из оригинала (PDF) 19 января 2012 года.
- ^ «Почему Кыргызстан и Таджикистан настолько разошлись во взглядах на зарубежную добычу полезных ископаемых?» . Евразийнет . EurasiaNet.org. 7 августа 2013 года . Проверено 19 августа 2013 г.
- ^ Кассианиду, В. (2003). «Ранняя добыча серебра из сложных полиметаллических руд», стр. 198–206 в Крэддоке, ПТ и Лэнге, Дж. (ред.) Горное дело и производство металлов на протяжении веков . Лондон, издательство Британского музея.
- ^ Крэддок, ПТ (1995). Добыча и производство ранних металлов . Эдинбург: Издательство Эдинбургского университета. п. 223. ISBN 1560985356
- ^ Бэйли Дж., Кроссли Д. и Понтинг М. (ред.). (2008). [ https://www.researchgate.net/publication/271133104_Metals_and_Metalworking_A_Research_Framework_for_Archaeometallurgy Металлы и металлообработка. Основа исследования археометаллургии . Историческое металлургическое общество. п. 6. ISBN 978-0-9560225-0-9
- ^ Перницка, Э., Ререн, Т., Шмитт-Стрекер, С. (1998). «Производство серебра позднего Урука методом купелирования в Хабуба Кабира, Сирия» , стр. 123–34 в Metallurgica Antiqua , Немецкий горный музей.
- ^ Перейти обратно: а б Хиллиард, Генри Э. «Сильвер» . Геологическая служба США.
- ^ Перейти обратно: а б Барриада, Хосе Л.; Таппин, Алан Д.; Эванс, Э. Хиуэл; Ахтерберг, Эрик П. (2007). «Измерения растворенного серебра в морской воде». TrAC Тенденции в аналитической химии . 26 (8): 809–817. дои : 10.1016/j.trac.2007.06.004 .
- ^ Фишер, Лиза; Смит, Джеффри; Ханн, Стефан; Бруланд, Кеннет В. (2018). «Ультра-следовой анализ серебра и платины в морской воде методом ICP-SFMS после автономного матричного разделения и предварительного концентрирования» . Морская химия . 199 : 44–52. Бибкод : 2018Март.199...44F . дои : 10.1016/j.marchem.2018.01.006 .
- ^ Перейти обратно: а б Ндунгу, К.; Томас, Массачусетс; Флегал, Арканзас (2001). «Серебро в западной экваториальной и южной части Атлантического океана». Глубоководные исследования, часть II: Актуальные исследования в океанографии . 48 (13): 2933–2945. Бибкод : 2001DSRII..48.2933N . дои : 10.1016/S0967-0645(01)00025-X .
- ^ Перейти обратно: а б Чжан, Ян; Амакава, Хироши; Нодзаки, Ёсиюки (2001). «Океанические профили растворенного серебра: точные измерения в бассейнах западной части северной части Тихого океана, Охотского и Японского морей». Морская химия . 75 (1–2): 151–163. Бибкод : 2001Март..75..151Z . дои : 10.1016/S0304-4203(01)00035-4 .
- ^ Флегал, Арканзас; Саньюдо-Вильхельми, ЮАР; Шелфо, генеральный директор (1995). «Серебро в восточной части Атлантического океана». Морская химия . 49 (4): 315–320. Бибкод : 1995Март..49..315F . дои : 10.1016/0304-4203(95)00021-I .
- ^ Ранвилл, Мара А.; Флегал, А. Рассел (2005). «Серебро в северной части Тихого океана» . Геохимия, геофизика, геосистемы . 6 (3): н/д. Бибкод : 2005GGG.....6.3M01R . дои : 10.1029/2004GC000770 .
- ^ Ратте, Ханс Тони (1999). «Биоаккумуляция и токсичность соединений серебра: обзор» . Экологическая токсикология и химия . 18 (1): 89–108. дои : 10.1002/etc.5620180112 . S2CID 129765758 .
- ^ Лакав, Жозеф Мэри; Викарий-Пара, Унаи; Бильбао, Эйдер; Гиллиланд, Дуглас; Уолл, Франческо; Дини, Лусиана; Кахаравиль, Мирен П.; Орбея, Амайя (2018). «Воздействие наночастиц серебра и ионного серебра на взрослых рыбок данио с водой приводит к дифференцированному накоплению серебра и оказывает влияние на клеточном и молекулярном уровнях». Наука об общей окружающей среде . 642 : 1209–1220. Бибкод : 2018ScTEn.642.1209L doi : 10.1016/j.scitotenv.2018.06.128 . ПМИД 30045502 . S2CID 51719111 .
- ^ Калабрезе, А.; Терберг, ФП; Гулд, Э. (1977). «Воздействие кадмия, ртути и серебра на морских животных» . Обзор морского рыболовства . 39 (4): 5–11. Архивировано из оригинала 26 января 2021 года.
- ^ Чен, Мэн-Сянь; Чжуан, Мин-Фэн; Чжоу, Лянь-Сян; Лю, Жан-И; Ши, Чие-Чи; Чен, Чи-Янг (2017). «Концентрация тканей четырех тайваньских зубатых китообразных, указывающая на загрязнение серебром и кадмием западной части Тихого океана». Бюллетень о загрязнении морской среды . 124 (2): 993–1000. Бибкод : 2017MarPB.124..993C . doi : 10.1016/j.marpolbul.2017.03.028 . ПМИД 28442199 .
- ^ Перейти обратно: а б «Истоки чеканки монет» . britishmuseum.org. Архивировано из оригинала 2 мая 2019 года . Проверено 21 сентября 2015 г.
- ^ «Тетрадрахма» . Мерриам-Вебстер . Проверено 20 января 2008 г.
- ^ Кроуфорд, Майкл Х. (1974). Чеканка римских республиканцев, издательство Кембриджского университета, 2 тома. ISBN 0-521-07492-4
- ^ Оксфордский словарь английского языка , 1-е издание, sv 'dirhem'. Архивировано 9 февраля 2020 г. в Wayback Machine.
- ^ etymonline.com (20 сентября 2008 г.). «Этимология рупии» . Проверено 20 сентября 2008 г.
- ^ Осборн, Томас Дж. (2012). Тихоокеанское Эльдорадо: история Большой Калифорнии . Джон Уайли и сыновья. п. 31. ISBN 978-1-118-29217-4 .
- ^ Перейти обратно: а б Брамби и др., стр. 63–65.
- ^ «Текущий список кодов валют и фондов – валюта ISO» . СНВ . Проверено 29 марта 2020 г.
- ^ «Цена серебра LBMA» . ЛБМА . Проверено 29 марта 2020 г.
- ^ Латка, Марцин. «Серебряный саркофаг Святого Станислава» . артинпл . Проверено 3 августа 2019 г.
- ^ Перейти обратно: а б Брамби и др., стр. 65–67.
- ^ Перейти обратно: а б Брамби и др. стр. 67–71
- ^ Битти, М.; Тейлор, Дж. (2011). «Сплав серебра против мочевых катетеров без покрытия: систематический обзор литературы». Журнал клинического ухода . 20 (15–16): 2098–108. дои : 10.1111/j.1365-2702.2010.03561.x . ПМИД 21418360 .
- ^ Буадма, Л.; Вольф, М.; Люсет, JC (август 2012 г.). «Вентилятор-ассоциированная пневмония и ее профилактика». Современное мнение об инфекционных заболеваниях . 25 (4): 395–404. дои : 10.1097/QCO.0b013e328355a835 . ПМИД 22744316 . S2CID 41051853 .
- ^ Майяр, Жан-Ив; Хартеманн, Филипп (2012). «Серебро как противомикробное средство: факты и пробелы в знаниях». Критические обзоры по микробиологии . 39 (4): 373–83. дои : 10.3109/1040841X.2012.713323 . ПМИД 22928774 . S2CID 27527124 .
- ^ Перейти обратно: а б с Брамби и др., стр. 83–84.
- ^ Паначек, Алеш; Квитек, Либор; Смекалова, Моника; Вечерова, Рената; Колар, Милан; Рёдер, Магдалена; Дычка, Филип; Шебела, Марек; Пручек, Роберт; Томанец, Ондржей; Зборил, Радек (январь 2018 г.). «Бактериальная устойчивость к наночастицам серебра и как ее преодолеть». Природные нанотехнологии . 13 (1): 65–71. Бибкод : 2018НатНа..13...65П . дои : 10.1038/s41565-017-0013-y . ПМИД 29203912 . S2CID 26783560 .
- ^ Розенблатт, А.; Стэмфорд, TCM; Нидерман, Р. (2009). «Фторид серебра диамина: кариес «фторсеребряная пуля» ». Журнал стоматологических исследований . 88 (2): 116–25. дои : 10.1177/0022034508329406 . ПМИД 19278981 . S2CID 30730306 .
- ^ Никитин Павел Владимирович; Лам, Сандер и Рао, КВС (2005). «Недорогие антенны RFID-меток с серебряными чернилами» (PDF) . 2005 Международный симпозиум Общества антенн и распространения IEEE . Том. 2Б. п. 353. дои : 10.1109/APS.2005.1552015 . ISBN 978-0-7803-8883-3 . S2CID 695256 . Архивировано из оригинала (PDF) 21 марта 2016 года.
- ^ Брамби и др., стр. 71–78.
- ^ Брамби и др., стр. 78–81.
- ^ Перейти обратно: а б Брамби и др., стр. 81–82.
- ^ Брамби и др., с. 82
- ^ «Исчез большой источник спроса на серебряные слитки» . БуллионВолт . Проверено 20 июля 2014 г.
- ^ Чжан, Цзюньхуэй; Ахмади, Мазиар; Фаргас, Джемма; Перинка, Никола; Регера, Хавьер; Лансерос-Мендес, Сененчу; Льянес, Луис; Хименес-Пике, Эмилио (февраль 2022 г.). «Наночастицы серебра для проводящих чернил: от синтеза и рецептуры чернил до их использования в полиграфических технологиях» . Металлы . 12 (2): 234. дои : 10.3390/met12020234 . ISSN 2075-4701 .
- ^ «Пигменты – ЭХА» . euon.echa.europa.eu . [ постоянная мертвая ссылка ]
- ^ «Каталог косметических ингредиентов – ECHA» . euon.echa.europa.eu . [ постоянная мертвая ссылка ]
- ^ Мартинес-Абад, А.; Осио, MJ; Лагарон, Ж.М.; Санчес, Г. (2013). «Оценка полилактидных пленок, наполненных серебром, на предмет инактивации сальмонеллы и кошачьего калицивируса in vitro и на свежесрезанных овощах». Международный журнал пищевой микробиологии . 162 (1): 89–94. doi : 10.1016/j.ijfoodmicro.2012.12.024 . ПМИД 23376782 .
- ^ Сарвате, Сарита (4 апреля 2005 г.). «Серебряное покрытие» . Индийские течения . Архивировано из оригинала 14 февраля 2009 года . Проверено 5 июля 2009 г.
- ^ Мейслер, Энди (18 декабря 2005 г.). «Буря на чайной тележке» . Лос-Анджелес Таймс .
- ^ Хэтч, Рози (ред.) (2022). Техасский альманах 2022–2023 гг . Остин, Техас: Историческая ассоциация штата Техас. п. 23. ISBN 9781625110664 .
- ^ «Мсдс – 373249» . Сигма Олдрич.
- ^ Перейти обратно: а б с д и Брамби и др., стр. 88–91.
Цитируемые источники
- Брамби, Андреас; и др. (2008). «Серебро, соединения серебра и сплавы серебра». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a24_107.pub2 . ISBN 978-3527306732 .
- Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . ISBN 978-0-08-037941-8 .
- Уикс, Мэри Эльвира ; Лечестер, Генри М. (1968). Открытие элементов . Истон, Пенсильвания: Журнал химического образования. ISBN 978-0-7661-3872-8 . LCCN 68-15217 .
Внешние ссылки
- Серебро в периодической таблице видео (Ноттингемский университет)
- The Silver Institute , отраслевой ассоциации сайт
- Коллекция серебряных изделий и образцов от Теодора Грея
- Серебряная запись в Карманном справочнике по химическим опасностям NIOSH, опубликованном Центров по контролю и профилактике заболеваний США. Национальным институтом безопасности и гигиены труда
- Цены на серебро — текущие спотовые цены на мировых товарных рынках , от Bloomberg LP.
- Серебро
- Химические элементы
- Переходные металлы
- Благородные металлы
- Драгоценные металлы
- Кубические минералы
- Минералы пространственной группы 225
- Электрические проводники
- Минералы самородных элементов
- Добавки для электронного номера
- Химические элементы с гранецентрированной кубической структурой
- Чеканка металлов и сплавов


















