Чарко -мари -тит болезнь
| Чарко -мари -тит болезнь | |
|---|---|
| Другие имена | Невропатия Шарко-Мари-Тит, мышечная атрофия, синдром дежерина-соттас |
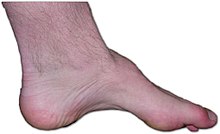 | |
| Нога человека с болезнью Чарко -Мари -Тиба: отсутствие мышц, высокая арка и пальцы ног является признаком этого генетического заболевания. | |
| Произношение | |
| Специальность | Неврология , подиатрия , ортопедия , физическая медицина и реабилитация |
| Симптомы | Общее : высокоартские ноги , шахмерто , капля ног , походка с высокой темой , слабость, жесткость и мышечная потерь нижних ног, рук и рук, а также уменьшенные рефлексы сухожилий. Иногда : плоские ноги , деформации позвоночника. [ 1 ] [ 2 ] |
| Обычное начало | Детство - раннее взросление |
| Продолжительность | На всю жизнь |
| Причины | Семейная история (генетика) |
| Факторы риска | Семейная история (генетика) |
| Диагностический метод | Генетическое тестирование , исследование нервной проводимости или электромиограмма (EMG) |
| Дифференциальный диагноз | Мышечная дистрофия |
| Уход | Управление для поддержания функции |
| Прогноз | Прогрессивный |
| Частота | Распространенность: 1 из 2500 [ 3 ] [ 4 ] |
Болезнь Чарко -Мари -Тит ( CMT ) является наследственной моторной и сенсорной невропатией периферической нервной системы , характеризующейся прогрессирующей потерей мышечной ткани и сенсорных ощущений в различных частях тела. Это заболевание является наиболее часто унаследованным неврологическим расстройством , затрагивающее около одного из 2500 человек. [ 5 ] [ 6 ] Он назван в честь тех, кто классически описал это: француз Жан-Мартин Чарко (1825–1893), его ученик Пьер Мари (1853–1940),), [ 7 ] и британец Говард Генри Зуб (1856–1925). [ 8 ] [ 9 ]
Там нет известного лекарства. Уход фокусируется на поддержании функции. CMT ранее был классифицирован как подтип мышечной дистрофии . [ 5 ]
Признаки и симптомы
[ редактировать ]Симптомы CMT обычно начинаются в раннем детстве или раннем взрослом возрасте, но могут начаться позже. Некоторые люди не испытывают симптомов до 30 или 40 лет. Обычно первоначальным симптомом является падение ног или высокие арки на ранних этапах заболевания. Это может сопровождаться Hammertoe , где пальцы всегда свернуты. Потратив атрофия мышечной ткани нижних частей ног может привести к появлению «аической ноги» или «перевернутой бутылки с шампанским». Слабость в руках и предплечьях происходит у многих людей по мере развития болезни. [ 10 ]
Высоко-арочные ноги ( PES Cavus ) или плоские ноги ( PES PLANUS ) классически связаны с расстройством. [ 11 ] Потеря сенсации в ногах, лодыжках и ногах, а также в руках, запястьях и руках происходит с различными типами заболевания. Формы раннего и позднего начала возникают с «вскрытиями» болезненными спазматическими мышечными сокращениями, которые могут инвалидно, когда заболевание активируется. Сенсорные и проприоцептивные нервы в руках и ногах часто повреждены, в то время как немиелинизированные болевые нервы остаются нетронутыми. Чрезмерное использование пораженной руки или конечности может активировать симптомы, включая онемение, спазм и болезненные спазмы. [ 10 ]
Симптомы и прогрессирование заболевания могут варьироваться. Неотложное шлифование зубов и прищущение прищущения распространено и часто остается незамеченным от пострадавшего человека. На дыхание может быть затронуто у некоторых, как и мышцы слуха, зрение и мышцы шеи и плеча. Сколиоз распространен, вызывает добычу и потерю высоты. Назрачные розетки могут быть уродливыми. Желудочно -кишечные проблемы могут быть частью CMT, [ 12 ] [ 13 ] как может затруднить жевание, глотание и разговор (из -за атрофии голосовых связок ). [ 14 ] Тремор . может развиваться как мышечные отходы беременность Известно, что усугубляет CMT, а также тяжелый эмоциональный стресс. Пациенты с CMT должны избегать периодов длительной неподвижности, например, при восстановлении после вторичного травмы, поскольку длительные периоды ограниченной подвижности могут резко ускорить симптомы CMT. [ 15 ]
Боль из -за постуральных изменений, деформаций скелета, мышечной усталости и спазмов довольно распространена у людей с CMT. Его можно смягчить или лечить физической терапией, операций и корректирующих или вспомогательных устройств. Анальгетические препараты также могут потребоваться, если другие методы лечения не обеспечивают облегчения от боли. [ 16 ] Нейропатическая боль часто является симптомом CMT, как и другие симптомы CMT, его присутствие и тяжесть варьируются от случая к случаю. Для некоторых людей боль может быть значительной для тяжелых и мешать повседневной жизни. Тем не менее, боль не испытывает всех людей с CMT. Когда невропатическая боль присутствует в качестве симптома CMT, она сопоставима с тем, что наблюдается у других периферических невропатий , а также посттерпетической невралгии и сложного регионального боли , среди других заболеваний. [ 17 ]
Атипичные презентации CMT также могут привести к мышцам ног, в частности телят, увеличиваясь. [ 18 ] Этот гипертрофический тип CMT не вызван непосредственным увеличением мышц, а псевдогипертрофией ног, когда жирная ткань попадает в мышцы ног. [ 19 ] [ 20 ] [ 21 ]
Причины
[ редактировать ]
Заболевание Charcot -Marie -Tooth вызвано генетическими мутациями , которые вызывают дефекты в нейрональных белках. Нервные сигналы проводятся аксоном с миелиновой оболочкой , обернутой вокруг нее. Большинство мутаций в CMT влияют на миелиновую оболочку, но некоторые влияют на аксон. [ 22 ]
Классификация
[ редактировать ]CMT является гетерогенным заболеванием , и связанные с ней мутации могут возникать в ряде различных генов. [ 23 ] Основываясь на пораженном геном, CMT классифицируется на несколько типов и подтипов. [ 24 ]
Хромосома 17
[ редактировать ]Наиболее распространенной причиной CMT (70–80% случаев) является дублирование большой области на коротком руке хромосомы 17 , которая включает ген PMP22 . [ 25 ]
Хромосома 1
[ редактировать ]Некоторые мутации влияют на ген MFN2 на хромосоме 1 , которая кодирует митохондриальный белок. Мутированный MFN2 заставляет митохондрии образовывать большие кластеры или сгустки, которые не могут перемещаться по аксону к синапсам . Это предотвращает функционирование синапсов. [ 26 ]
X-связанные клетки CMT и Schwann
[ редактировать ]CMT также может быть получен с помощью X-связанных мутаций и называется X-связанный CMT (CMTX). В CMTX мутированные коннексоны создают нефункциональные перехода зазоров, которые прерывают молекулярный обмен и транспорт сигнала. [ 27 ] [ 28 ] [ 29 ]
Мутация может появляться в гене GJB1, кодирующем белок коннексина 32 , белок разрывного соединения, экспрессируемый в клетках Шванна. Поскольку этот белок также присутствует в олигодендроцитах , демиелинизация может появляться в ЦНС. [ 30 ]
Клетки Schwann создают миелиновую оболочку, обернув его плазматическую мембрану вокруг аксона. [ 27 ]
Нейроны, клетки Шванна и фибробласты работают вместе, чтобы создать функциональный нерв. Клетки и нейроны Шванна обмениваются молекулярными сигналами с помощью щелевых соединений , которые регулируют выживаемость и дифференцировку [ 31 ]
Демиелинизирующие клетки Шванна вызывает аномальную структуру и функцию аксонов. Они могут вызвать дегенерацию аксонов, или они могут просто вызвать неисправность аксонов. [ 5 ]
Миелиновая оболочка позволяет нервным клеткам быстрее проводить сигналы. Когда миелиновая оболочка повреждена, нервные сигналы медленнее, и это может быть измерено с помощью общего неврологического теста, электромиографии . Однако, когда аксон поврежден, это приводит к уменьшению потенциала действия мышечной мышцы . [ 32 ]
Связанная с GARS1 аксональная невропатия
Типы CMT2 обычно называют аксоническими невропатиями из -за наблюдаемой аксональной дегенерации. Типы CMT2 являются результатом повреждения нервных аксонов , а не повреждения миелиновой оболочки (как в случае с CMT1). Поврежденные аксоны вызывают замедленную передачу сигналов мышцам и мозгу, вызывая симптомы, включая атрофию мышц, слабость, снижение чувствительности и деформацию стопы. Симптомы типов CMT2 обычно появляются в возрасте от 5 до 25 лет. [ 33 ] CMT2D является одной из 31 форм 1 Charcot -Marie -Tooth типа 1 и диагностируется только в том случае, если наблюдается сенсорный дефицит (такой как потеря ощущения из -за деградации сенсорных аксонов), наряду с дефицитом двигателя; В противном случае дистальная наследственная моторная невропатия типа V. диагностируется Неизвестно, почему сенсорное вовлечение настолько изменяется между пациентами с невропатией GARS1. [ 34 ] Симптомы CMT2D включают деформацию стопы, мышечную слабость и спазмы, скомпрометированные рефлексы, потерю ощущения и атрофию мышц и сходны с симптомами других типов CMT1 и CMT2. Симптомы и тяжесть варьируются от пациента к пациенту. [ 35 ]
Мыши часто используются для моделирования CMT2D и обычно демонстрируют аберрантную нервно -мышечную функцию на нервно -мышечном соединении (NMJ). [ 36 ] [ 37 ] [ 38 ] Нервно -мышечное соединение является ненормальным у мышей CMT2D, причем субъекты, демонстрирующие дегенерацию нервно -мышечного соединения в индиционных мышцах. Ганглии дорсального корня (DRG) также влияют на судьбу аберрантной сенсорной нейронов, что означает, что судьбы сенсорных нейрон клеток аномально определены. У мышей CMT2D есть меньше проприоцептивных и механочувствительных нейронов, но имеют больше ноцицептивных нейронов, возможно, из -за мутантных глир, аберрально взаимодействующих с внеклеточной областью рецептор -киназы тропомиозина или TRK, рецепторов. [ 39 ] Рецепторы TRK имеют решающее значение для выживания и развития сенсорных нейронов; При разрушении, развитие и выживание нерва также нарушаются, возможно, что приводит к аномальному количеству сенсорных нейронов, наблюдаемых у мышей CMT2D. [ 34 ]
CMT2D является результатом аутосомно -доминантных мутаций в гене GARS1 человека, расположенном по адресу 7P14.3 [ 40 ] и считается вызванным аберрантным миссенс-мутациями с аберрантным преимуществом . [ 34 ] Ген GARS1 представляет собой ген, кодирующий белок, ответственный за кодирование глицил-тРНК-синтетазы (GLYRS). класса II Глицил-тРНК-синтетаза представляет собой аминоацил-синтетазу и действует как катализатор синтеза глицил-тРНК путем ковалентно связывания аминокислот с их соответствующими родственными тРНК для трансляции белка . Глицил-тРНК-синтетаза является неотъемлемой частью трансляции белка и прикрепляет глицин к его родственной тРНК. [ 41 ]
Many different mutations have been found in CMT2D patients and it remains unclear how mutations in GARS1 cause CMT2D. However, it is thought that mutant glycyl-tRNA synthetase (GlyRS) interferes with transmembrane receptors, causing motor disease[42][43] and that mutations in the gene could disrupt the ability of GlyRS to interact with its cognate RNA, disrupting protein production. The GARS1 mutations present in CMT2D cause a deficient amount of glycyl-tRNA in cells, preventing the elongation phase of protein synthesis. Because elongation is a key step in protein production, ribosomes are unable to continue protein synthesis at glycine sites. GARS1 mutations also stall initiation of translation. Glycine addition failure causes a stress response that further stalls protein production, preventing initiation of translation. By stalling elongation and initiation of translation, CMT2D mutations in the GARS1 gene cause translational repression, meaning that overall translation is inhibited.[44]
GARS1-associated axonal neuropathy is progressive, meaning that it worsens over time. Unknown mechanisms are thought to cause the chronic neurodegeneration resulting from the aberrant GlyRS; however, one theory for disease is VEGF-deficiency. Mutant GlysRS interferes with neuronal transmembrane receptors, including neuropilin 1 (Nrp1) and vascular endothelial growth factor (VEGF), causing neuropathy.[43] GARS-CMT2D mutations alter GlyRS and allow it to bind to the Nrp1 receptor, interfering with the normal binding of Nrp1 to VEGF. While enhanced expression of VEGF improves motor function, reduced expression of Nrp1 worsens CMT2D; because Nrp1 binds to mutant GlyRS in mutant GARS1-CMT2D individuals, Nrp1 expression is reduced, in turn worsening motor function. Mice with deficient VEGF demonstrate motor-neuron disease over time. Thus, the VEGF/Nrp1 pathway is considered to be targetable for CMT2D treatment.[33]
Diagnosis
[edit]CMT can be diagnosed through three different forms of tests: measurement of the speed of nerve impulses (nerve conduction studies), a biopsy of the nerve, and DNA testing. DNA testing can give a definitive diagnosis, but not all the genetic markers for CMT are known. CMT is first most noticed when someone develops lower leg weakness, such as foot drop, or foot deformities, including hammertoes and high arches, but signs alone do not lead to diagnosis. Patients must be referred to a physician specialising in neurology or rehabilitation medicine. To see signs of muscle weakness, the neurologist may ask patients to walk on their heels or to move part of their leg against an opposing force. To identify sensory loss, the neurologist tests for deep-tendon reflexes, such as the knee jerk, which are reduced or absent in CMT. The doctor may also ask the patient's family history since CMT is hereditary. The lack of family history does not rule out CMT, but is helpful to rule out other causes of neuropathy, such as diabetes or exposure to certain chemicals or drugs.[45]
In 2010, CMT was one of the first diseases where the genetic cause of a particular patient's disease was precisely determined by sequencing the whole genome of an affected individual. This was done by the scientists employed by the Charcot Marie Tooth Association (CMTA).[46][24] Two mutations were identified in a gene, SH3TC2, known to cause CMT. Researchers then compared the affected patient's genome to the genomes of the patient's mother, father, and seven siblings with and without the disease. The mother and father each had one normal and one mutant copy of this gene, and had mild or no symptoms. The offspring who inherited two mutant genes presented fully with the disease.[24]
Histology
[edit]
The constant cycle of demyelination and remyelination, which occurs in CMT, can lead to the formation of layers of myelin around some nerves, termed an "onion bulb". These are also seen in chronic inflammatory demyelinating polyneuropathy.[47] Muscles show fiber type grouping, a similarly nonspecific finding that indicates a cycle of denervation/reinnervation. Normally, type I and type II muscle fibers show a checkerboard-like random distribution. However, when reinnervation occurs, the group of fibers associated with one nerve are of the same type. The standard for indicating fiber type is histoenzymatic adenosine triphosphatase (ATPase at pH 9.4).[48]
Management
[edit]Often, the most important goal for patients with CMT is to maintain movement, muscle strength, and flexibility. Therefore, an interprofessional team approach with occupational therapy (OT), physical therapy (PT), orthotist, podiatrist, and or orthopedic surgeon is recommended.[10]
Appropriate footwear is also very important for people with CMT, but they often have difficulty finding well-fitting shoes because of their high-arched feet and hammertoes. Due to the lack of good sensory reception in the feet, CMT patients may also need to see a podiatrist for assistance in trimming nails or removing calluses that develop on the pads of the feet. Lastly, patients can also decide to have surgery performed by a podiatrist or an orthopedic surgeon. Surgery may help to stabilize the patients' feet or correct progressive problems. These procedures include straightening and pinning the toes, lowering the arch, and sometimes, fusing the ankle joint to provide stability.[15] CMT patients must take extra care to avoid falling as fractures take longer to heal in someone with an underlying disease process. Additionally, the resulting inactivity may cause the CMT to worsen.[15] The Charcot–Marie–Tooth Association classifies the chemotherapy drug vincristine as a "definite high risk" and states, "vincristine has been proven hazardous and should be avoided by all CMT patients, including those with no symptoms."[49] Several corrective surgical procedures can be done to improve the physical condition of the affected individuals.[50]
Orthotics
[edit]
If the muscles of the lower extremities are weak, it makes sense to prescribe custom-fabricated orthotics. Depending on which muscle groups are affected, the correct orthoses with appropriate functional elements should be prescribed. A weakness of the tibialis anterior muscle, which lifts the feet, is usually accompanied by an atrophy of the gastrocnemius muscle which, together with the soleus muscle, forms the triceps surae muscles (distal calf muscles), occurs causing the known "stork leg deformity".[51] In most cases, ankle-foot orthoses that have functional elements for the foot lifting and adjustable control of the lowering of the forefoot make sense. Weak calf muscles lead to insufficient activation of the forefoot lever. This leads to an additional increasing uncertainty when standing and walking. If the calf muscles are weak, an orthosis should therefore be equipped with functional elements to activate the forefoot lever. An orthotic joint with an adjustable dynamic dorsiflexion stop with strong spring in combination with a lower leg shell in front of the shin is recommended for this. Such orthoses help to control foot drop, instability of the foot and ankle and offer the patient a better sense of balance when standing and walking without restricting mobility and the dynamics of the ankle joint. Studies confirm the positive effect of orthoses with adjustable functional elements in patients with paralysis of these muscle groups.[52][53][54][55] It is of great advantage if the resistances of the two functional elements can be set separately from one another in the two directions of movement, dorsiflexion and plantar flexion.[56]
Prognosis
[edit]The severity of symptoms varies widely even for the same type of CMT. Cases of monozygotic twins with varying levels of disease severity have been reported, showing that identical genotypes are associated with different levels of severity (see penetrance). Some patients are able to live a normal life and are almost or entirely asymptomatic.[57] A 2007 review stated that, "life expectancy is not known to be altered in the majority of cases."[58]
History
[edit]The disease is named after those who classically described it: the Frenchman Jean-Martin Charcot (1825–1893), his pupil Pierre Marie (1853–1940),[7] and the Briton Howard Henry Tooth (1856–1925).[8]
See also
[edit]- Charcot–Marie–Tooth disease classifications
- Palmoplantar keratoderma and spastic paraplegia
- Hereditary motor and sensory neuropathies
- Hereditary motor neuropathies
- Low copy repeats
- Christina's World
References
[edit]- ^ Szigeti K, Lupski JR (2009). "Charcot–Marie–Tooth disease". European Journal of Human Genetics. 17 (6): 703–710. doi:10.1038/ejhg.2009.31. ISSN 1018-4813. PMC 2947101. PMID 19277060.
- ^ Nagappa M, Sharma S, Taly AB (2024), "Charcot-Marie-Tooth Disease", StatPearls, Treasure Island (FL): StatPearls Publishing, PMID 32965834, retrieved 2024-09-20
- ^ Cornett KM, Menezes MP, Bray P, Halaki M, Shy RR, Yum SW, et al. (June 2016). "Phenotypic Variability of Childhood Charcot-Marie-Tooth Disease". JAMA Neurology. 73 (6): 645–651. doi:10.1001/jamaneurol.2016.0171. PMC 4916861. PMID 27043305.
- ^ Skre H (2008-04-23). "Genetic and clinical aspects of Charcot-Marie-Tooth's disease". Clinical Genetics. 6 (2): 98–118. doi:10.1111/j.1399-0004.1974.tb00638.x. PMID 4430158. S2CID 45225191.
- ^ Jump up to: a b c Krajewski KM, Lewis RA, Fuerst DR, Turansky C, Hinderer SR, Garbern J, et al. (July 2000). "Neurological dysfunction and axonal degeneration in Charcot-Marie-Tooth disease type 1A". Brain. 123 (7): 1516–1527. doi:10.1093/brain/123.7.1516. PMID 10869062.
- ^ "Physical Medicine and Rehabilitation for Charcot–Marie–Tooth Disease: Background, Pathophysiology, Epidemiology". Emedicine.medscape.com. Retrieved 2016-11-13.
- ^ Jump up to: a b Charcot JM (1886). "Sur une forme particulière d'atrophie musculaire progressive, souvent familiale débutant par les pieds et les jambes et atteignant plus tard les mains" [On a particular form of progressive muscular atrophy, often familial, beginning with the feet and legs and later reaching the hands]. Revue Médicale (in French). 6: 97–138.
- ^ Jump up to: a b Tooth HH (1886). The peroneal type of progressive muscular atrophy (MD thesis). London.
- ^ Kumar DR, Aslinia F, Yale SH, Mazza JJ (March 2011). "Jean-Martin Charcot: The Father of Neurology". Clinical Medicine & Research. 9 (1): 46–49. doi:10.3121/cmr.2009.883. ISSN 1539-4182. PMC 3064755. PMID 20739583.
- ^ Jump up to: a b c "Charcot-Marie-Tooth Disease Fact Sheet". National Institute of Neurological Disorders and Stroke. Retrieved 2022-04-23.
- ^ Le T, Bhushan V (6 January 2014). First Aid for the USMLE Step 1 2014. McGraw-Hill Education. ISBN 978-0-07-183142-0. Retrieved 4 September 2014.
Typically autosomal dominant inheritance pattern associated with scoliosis and foot deformities (high or flat arches).
- ^ "CMT News". Lindacrabtree.com. Archived from the original on 2016-08-05. Retrieved 2016-11-13.
- ^ Soykan I, McCallum RW (January 1997). "Gastrointestinal involvement in neurologic disorders: Stiff-man and Charcot-Marie-Tooth syndromes". The American Journal of the Medical Sciences. 313 (1): 70–73. doi:10.1097/00000441-199701000-00012. PMID 9001170.
- ^ "Charcot-Marie-Tooth Disease Fact Sheet". National Institute of Neurological Disorders and Stroke. 2016-01-14. Archived from the original on 2016-11-19. Retrieved 2016-11-13.
- ^ Jump up to: a b c "Treatment and Management of CMT" (Press release). Charcot-Marie-Tooth Association. October 6, 2010. Retrieved August 26, 2011.
- ^ "Charcot-Marie-Tooth Syndrome. CMT information". Patient. 20 August 2021.
- ^ Carter GT, Jensen MP, Galer BS, Kraft GH, Crabtree LD, Beardsley RM, et al. (December 1998). "Neuropathic pain in Charcot-Marie-Tooth disease". Archives of Physical Medicine and Rehabilitation. 79 (12): 1560–1564. doi:10.1016/S0003-9993(98)90421-X. PMID 9862301.
- ^ Nan H, Wu Y, Cui S, Sun H, Wang J, Li Y, et al. (2022). "Coexistence of Charcot-Marie-Tooth 1A and nondystrophic myotonia due to PMP22 duplication and SCN4A pathogenic variants: a case report". BMC Neurology. 22 (1): 17. doi:10.1186/s12883-021-02538-5. ISSN 1471-2377. PMC 8740465. PMID 34996390.
- ^ Krampitz DE, Wolfe GI, Fleckenstein JL, Barohn RJ (1998). "Charcot-Marie-Tooth disease type 1A presenting as calf hypertrophy and muscle cramps". Neurology. 51 (5): 1508–1509. doi:10.1212/WNL.51.5.1508. ISSN 0028-3878. PMID 9818900.
- ^ Smith TW, Bhawan J, Keller RB, Degirolami U (1980). "Charcot-Marie-Tooth Disease Associated with Hypertrophic Neuropathy: A Neuropathologic Study of Two Cases". Journal of Neuropathology and Experimental Neurology. 39 (4): 420–440. doi:10.1097/00005072-198007000-00003. ISSN 0022-3069. PMID 6260904.
- ^ Brusse E, Perumpillichira J (2014). "G.P.294". Neuromuscular Disorders. 24 (9–10): 910. doi:10.1016/j.nmd.2014.06.384.
- ^ Niemann A, Berger P, Suter U (March 2006). "Pathomechanisms of mutant proteins in Charcot-Marie-Tooth disease". NeuroMolecular Medicine. 8 (1–2): 217–241. doi:10.1385/NMM:8:1-2:217 (inactive 2024-03-14). hdl:20.500.11850/422903. ISSN 1535-1084. PMID 16775378. S2CID 17130051.
{{cite journal}}: CS1 maint: DOI inactive as of March 2024 (link)[permanent dead link] - ^ Hoyle JC, Isfort MC, Roggenbuck J, Arnold WD (2015). "The genetics of Charcot-Marie-Tooth disease: current trends and future implications for diagnosis and management". The Application of Clinical Genetics. 8: 235–243. doi:10.2147/TACG.S69969. PMC 4621202. PMID 26527893.
- ^ Jump up to: a b c Lupski JR, Reid JG, Gonzaga-Jauregui C, Rio Deiros D, Chen DC, Nazareth L, et al. (April 2010). "Whole-genome sequencing in a patient with Charcot-Marie-Tooth neuropathy". The New England Journal of Medicine. 362 (13): 1181–1191. doi:10.1056/NEJMoa0908094. PMC 4036802. PMID 20220177.
- ^ Florescu C, Albu CV, Dumitrescu C, Târtea GC, Florescu OA, Târtea EA (2017). "Sleep and Memory Disorders in a Patient Suffering from Charcot-Marie-Tooth Disease". Current Health Sciences Journal. 43 (1): 73–77. doi:10.12865/CHSJ.43.01.11. PMC 6286719. PMID 30595858.
- ^ Baloh RH, Schmidt RE, Pestronk A, Milbrandt J (January 2007). "Altered axonal mitochondrial transport in the pathogenesis of Charcot-Marie-Tooth disease from mitofusin 2 mutations". The Journal of Neuroscience. 27 (2): 422–430. doi:10.1523/JNEUROSCI.4798-06.2007. PMC 6672077. PMID 17215403.
- ^ Jump up to: a b Berger P, Young P, Suter U (March 2002). "Molecular cell biology of Charcot-Marie-Tooth disease". Neurogenetics. 4 (1): 1–15. doi:10.1007/s10048-002-0130-z. PMID 12030326. S2CID 25129077.
- ^ Kleopa KA (December 2011). "The role of gap junctions in Charcot-Marie-Tooth disease". The Journal of Neuroscience. 31 (49): 17753–17760. doi:10.1523/JNEUROSCI.4824-11.2011. PMC 6634164. PMID 22159091.
- ^ Szigeti K, Lupski JR (June 2009). "Charcot-Marie-Tooth disease". European Journal of Human Genetics. 17 (6): 703–710. doi:10.1038/ejhg.2009.31. PMC 2947101. PMID 19277060.
- ^ Koutsis G, Breza M, Velonakis G, Tzartos J, Kasselimis D, Kartanou C, et al. (February 2019). "X linked Charcot-Marie-Tooth disease and multiple sclerosis: emerging evidence for an association". Journal of Neurology, Neurosurgery, and Psychiatry. 90 (2): 187–194. doi:10.1136/jnnp-2018-319014. PMID 30196252. S2CID 52175657.
- ^ Amiott EA, Lott P, Soto J, Kang PB, McCaffery JM, DiMauro S, et al. (May 2008). "Mitochondrial Fusion and Function in Charcot-Marie-Tooth Type 2A Patient Fibroblasts with Mitofusin 2 Mutations". Experimental Neurology. 211 (1): 115–127. doi:10.1016/j.expneurol.2008.01.010. PMC 2409111. PMID 18316077.
- ^ Yiu EM, Burns J, Ryan MM, Ouvrier RA (September 2008). "Neurophysiologic abnormalities in children with Charcot-Marie-Tooth disease type 1A". Journal of the Peripheral Nervous System. 13 (3): 236–241. doi:10.1111/j.1529-8027.2008.00182.x. PMID 18844790. S2CID 205694771.
- ^ Jump up to: a b "CMT2 - Types of Charcot-Marie-Tooth Disease (CMT) - Diseases". Muscular Dystrophy Association. 2015-12-23. Retrieved 2022-05-10.
- ^ Jump up to: a b c Sleigh JN, Mech AM, Aktar T, Zhang Y, Schiavo G (2020). "Altered Sensory Neuron Development in CMT2D Mice Is Site-Specific and Linked to Increased GlyRS Levels". Frontiers in Cellular Neuroscience. 14: 232. doi:10.3389/fncel.2020.00232. PMC 7431706. PMID 32848623.
- ^ "Charcot-Marie-Tooth disease type 2D (Concept Id: C1832274)". MedGen - NCBI. Retrieved 2022-05-10.
- ^ Sleigh JN, Grice SJ, Burgess RW, Talbot K, Cader MZ (2014). "Neuromuscular junction maturation defects precede impaired lower motor neuron connectivity in Charcot-Marie-Tooth type 2D mice". Hum Mol Genet. 15 (10): 2639–50. doi:10.1093/hmg/ddt659. PMC 3990164. PMID 24368416.
- ^ Spaulding EL, Sleigh JN, Morelli KH, Pinter MJ, Burgess RW, Seburn KL (2016). "Synaptic Deficits at Neuromuscular Junctions in Two Mouse Models of Charcot-Marie-Tooth Type 2d". J Neurosci. 16 (11): 3254–67. doi:10.1523/JNEUROSCI.1762-15.2016. PMC 4792937. PMID 26985035.
- ^ Sleigh JN, Mech AM, Schiavo G (2020). "Developmental demands contribute to early neuromuscular degeneration in CMT2D mice". Cell Death Dis. 11 (7): 564. doi:10.1038/s41419-020-02798-y. PMC 7378196. PMID 32703932.
- ^ Sleigh JN, Dawes JM, West SJ, Wei N, Spaulding EL, Gómez-Martín A, et al. (2017). "Trk receptor signaling and sensory neuron fate are perturbed in human neuropathy caused by Gars mutations". Proc Natl Acad Sci U S A. 114 (16): E3324–E3333. Bibcode:2017PNAS..114E3324S. doi:10.1073/pnas.1614557114. PMC 5402433. PMID 28351971.
- ^ "OMIM Entry - # 601472 - Charcot–Marie–Tooth disease, axonal, type 2D; CMT2D". Online Mendelian Inheritance in Man. Retrieved 2022-05-10.
- ^ "OMIM Entry- * 600287 - Glycl-tRNA Synthetase 1; GARS1". Online Mendelian Inheritance in Man. Retrieved 2022-05-10.
- ^ Wei N, Zhang Q, Yang XL (2019). "Neurodegenerative Charcot-Marie-Tooth disease as a case study to decipher novel functions of aminoacyl-tRNA synthetases". J Biol Chem. 294 (14): 5321–5339. doi:10.1074/jbc.REV118.002955. PMC 6462521. PMID 30643024.
- ^ Jump up to: a b He W, Bai G, Zhou H, Wei N, White NM, Lauer J, et al. (October 2015). "CMT2D neuropathy is linked to the neomorphic binding activity of glycyl-tRNA synthetase". Nature. 526 (7575): 710–714. Bibcode:2015Natur.526..710H. doi:10.1038/nature15510. PMC 4754353. PMID 26503042.
- ^ Mendonsa S, von Kuegelgen N, Bujanic L, Chekulaeva M (September 2021). "Charcot-Marie-Tooth mutation in glycyl-tRNA synthetase stalls ribosomes in a pre-accommodation state and activates integrated stress response". Nucleic Acids Research. 49 (17): 10007–10017. doi:10.1093/nar/gkab730. PMC 8464049. PMID 34403468.
- ^ "Diagnosing CMT". Charcot–Marie–Tooth Association. Retrieved 2020-05-30.
- ^ Wade N (2010-03-10). "Disease Cause Is Pinpointed With Genome". New York Times. Archived from the original on 2022-01-01.
- ^ Midroni G, Bilbao JM, Cohen SM (1995). Biopsy diagnosis of peripheral neuropathy. Boston: Butterworth-Heinemann. pp. 75–103. ISBN 978-0-7506-9552-7.
- ^ Dubowitz V, Sewry CA, Oldfors A, Lane R (2013). Muscle biopsy : a practical approach (Fourth ed.). Philadelphia: Saunders/Elsevier. ISBN 978-0-7020-4340-6.
- ^ "Medical Alert". Charcot-Marie-Tooth Association. Archived from the original on 2007-07-02. Retrieved 2007-08-21.
- ^ Anand N, Levine, DB, Burke S, Bansal M. Neuropathic spinal atrophy in Charcot–Marie–Tooth disease. J Bone Joint Surg. 1997; 79-A:1235–39.
- ^ Aguirre-Rodríguez FJ, Lucenilla MI, Alvarez-Cubero MJ, Mata C, Entrala-Bernal C, Fernandez-Rosado F (October 2015). "Novel FA2H mutation in a girl with familial spastic paraplegia". Journal of the Neurological Sciences. 357 (1–2): 332–334. doi:10.1016/j.jns.2015.08.1183. PMID 26344562.
- ^ Kobayashi T, Leung AK, Akazawa Y, Hutchins SW (March 2013). "The effect of varying the plantarflexion resistance of an ankle-foot orthosis on knee joint kinematics in patients with stroke". Gait & Posture. 37 (3): 457–459. doi:10.1016/j.gaitpost.2012.07.028. PMID 22921491.
- ^ Meyns P, Kerkum YL, Brehm MA, Becher JG, Buizer AI, Harlaar J (May 2020). "Ankle foot orthoses in cerebral palsy: Effects of ankle stiffness on trunk kinematics, gait stability and energy cost of walking". European Journal of Paediatric Neurology. 26: 68–74. doi:10.1016/j.ejpn.2020.02.009. PMID 32147412. S2CID 212641072.
- ^ Meyns P, Kerkum Y, Buizer A, Becher J, Brehm M, Harlaar J (2016-09-01). "The effect of ankle foot orthosis stiffness on trunk movement and walking energy cost in cerebral palsy". Gait & Posture (in German). 49. p. 2. doi:10.1016/j.gaitpost.2016.07.070. ISSN 0966-6362.
- ^ Kerkum YL, Buizer AI, van den Noort JC, Becher JG, Harlaar J, Brehm MA (2015-11-23). "The Effects of Varying Ankle Foot Orthosis Stiffness on Gait in Children with Spastic Cerebral Palsy Who Walk with Excessive Knee Flexion". PLOS ONE (in German). 10 (11): e0142878. Bibcode:2015PLoSO..1042878K. doi:10.1371/journal.pone.0142878. PMC 4658111. PMID 26600039.
- ^ Ploeger HE, Waterval NF, Nollet F, Bus SA, Brehm MA (2019). "Stiffness modification of two ankle-foot orthosis types to optimize gait in individuals with non-spastic calf muscle weakness - a proof-of-concept study". Journal of Foot and Ankle Research (in German). 12: 41. doi:10.1186/s13047-019-0348-8. PMC 6686412. PMID 31406508.
- ^ Pareyson D, Marchesi C (July 2009). "Diagnosis, natural history, and management of Charcot-Marie-Tooth disease". The Lancet. Neurology. 8 (7): 654–667. doi:10.1016/S1474-4422(09)70110-3. PMID 19539237. S2CID 665324.
- ^ Aboussouan LS, Lewis RA, Shy ME (2007-02-09). "Disorders of pulmonary function, sleep, and the upper airway in Charcot-Marie-Tooth disease". Lung. 185 (1): 1–7. doi:10.1007/s00408-006-0053-9. PMID 17294338. S2CID 12889721.
External links
[edit] Media related to Charcot-Marie-Tooth disease at Wikimedia Commons
Media related to Charcot-Marie-Tooth disease at Wikimedia Commons


