Эстер

В химии сложный эфир — это функциональная группа, полученная из кислоты (органической или неорганической), в которой атом водорода (Н) по крайней мере одной кислой гидроксильной группы ( −OH ) этой кислоты заменяется органильной группой ( −Р ). Аналоги, полученные из кислорода , замененного другими халькогенами, также относятся к категории сложных эфиров. [ 1 ] По мнению некоторых авторов, органильные производные кислого водорода других кислот также являются сложными эфирами (например, амидами ), но не по данным ИЮПАК . [ 1 ]
Глицериды представляют собой эфиры жирных кислот и глицерина ; они важны в биологии, поскольку являются одним из основных классов липидов и составляют основную часть животных жиров и растительных масел . Лактоны представляют собой сложные эфиры циклических карбоновых кислот; Встречающиеся в природе лактоны представляют собой в основном 5- и 6-членные кольцевые лактоны. Лактоны придают аромат фруктам, маслу, сыру, овощам , например сельдерею , и другим продуктам.
Эфиры могут образовываться из оксокислот (например, эфиры уксусной кислоты , угольной кислоты , серной кислоты , фосфорной кислоты , азотной кислоты , ксантиновой кислоты ), а также из кислот, не содержащих кислорода (например, эфиров тиоциановой кислоты и тритиоугольной кислоты ). Примером образования сложного эфира является реакция замещения кислоты карбоновой ( R-C(=O)-OH ) и спирт ( R'-OH ), образуя сложный эфир ( R-C(=O)-O-R' ), где R означает любую группу (обычно водородную или органильную), а R ' означает органильную группу.
Органиловые эфиры карбоновых кислот обычно имеют приятный запах; те, что имеют низкую молекулярную массу, обычно используются в качестве ароматизаторов и содержатся в эфирных маслах и феромонах . Они действуют как высококачественные растворители для широкого спектра пластмасс , пластификаторов , смол и лаков . [ 2 ] и являются одним из крупнейших классов синтетических смазочных материалов на коммерческом рынке. [ 3 ] Полиэфиры являются важными пластиками, мономеры которых связаны сложноэфирными фрагментами . Эфиры фосфорной кислоты составляют основу молекул ДНК . Эфиры азотной кислоты , например нитроглицерин , известны своими взрывчатыми свойствами.
Существуют соединения, в которых кислый водород кислот, упомянутых в этой статье, заменен не органилом, а какой-либо другой группой. По мнению некоторых авторов, эти соединения также являются сложными эфирами, особенно когда первый атом углерода органильной группы, заменяющий кислый водород, заменен другим атомом из 14-й группы элементов ( Si , Ge , Sn , Pb ); например, по их словам, триметилстаннилацетат (или ацетат триметилолова) CH 3 COOSn(CH 3 ) 3 представляет собой триметилстанниловый эфир уксусной кислоты и дилаурат дибутилолова. (CH 3 (CH 2 ) 10 COO) 2 Sn((CH 2 ) 3 CH 3 ) 2 представляет собой дибутилстанниленовый эфир лауриновой кислоты и катализатор Филлипса . CrO 2 (OSi(OCH 3 ) 3 ) 2 представляет собой триметоксисилиловый эфир хромовой кислоты ( Н 2 CrO 4 ). [ 4 ] [ 5 ]
Номенклатура
[ редактировать ]Этимология
[ редактировать ]Слово «эфир» было придумано в 1848 году немецким химиком Леопольдом Гмелином . [ 6 ] вероятно, как сокращение немецкого Essigäther , « уксусный эфир ».
номенклатура ИЮПАК
[ редактировать ]Названия сложных эфиров, образующихся из спирта и кислоты, происходят от исходного спирта и исходной кислоты, причем последняя может быть органической или неорганической. Сложные эфиры, полученные из простейших карбоновых кислот , обычно называют в соответствии с более традиционными, так называемыми « тривиальными названиями », например, формиат, ацетат, пропионат и бутират, в отличие от номенклатуры ИЮПАК метаноат, этаноат, пропаноат и бутаноат. С другой стороны, сложные эфиры, полученные из более сложных карбоновых кислот, чаще называют систематическим названием IUPAC, основанным на названии кислоты, за которым следует суффикс -оат . Например, сложный эфир гексилоктаноата, также известный под тривиальным названием гексилкаприлат , имеет формулу СН 3 (СН 2 ) 6 СО 2 ( СН 2 ) 5 СН 3 .

Химические формулы органических эфиров, образующихся из карбоновых кислот и спиртов, обычно имеют вид RCO 2 R' или RCOOR', где R и R' представляют собой органильные части карбоновой кислоты и спирта соответственно, а R может представлять собой водород в случае эфиров муравьиной кислоты . Например, бутилацетат (систематически бутилэтаноат), полученный из бутанола и уксусной кислоты (систематически этановая кислота), будет записываться СН 3 СО 2 (СН 2 ) 3 СН 3 . Альтернативные презентации распространены, включая BuOAc и СН 3 СОО(СН 2 ) 3 СН 3 .
Циклические эфиры называются лактонами независимо от того, являются ли они производными органической или неорганической кислоты. Одним из примеров органического лактона является γ-валеролактон .
Ортоэфиры
[ редактировать ]Необычным классом сложных эфиров являются ортоэфиры . Одними из них являются эфиры ортокарбоновых кислот. Эти сложные эфиры имеют формулу RC(OR') 3 , где R означает любую группу (органическую или неорганическую), а R ' означает органильную группу. Например, триэтилортоформиат ( HC(OCH 2 CH 3 ) 3 ) получают, согласно названию (но не синтезу), в результате этерификации ортомуравьиной кислоты ( HC(OH) 3 ) с этанолом .
Эфиры неорганических кислот
[ редактировать ]
Эфиры также могут быть получены из неорганических кислот.
- Хлорная кислота образует перхлоратные эфиры, например, метилперхлорат ( CH 3 -O-Cl(=O) 3 )
- Серная кислота образует сульфатные эфиры , например, диметилсульфат ( (CH 3 -O-) 2 S(=O) 2 ) и метилбисульфат ( CH 3 -O-S(=O) 2 -OH )
- Азотная кислота образует нитратные эфиры , например метилнитрат ( CH 3 -O-NO 2 ) и нитроглицерин ( CH(-O-NO 2 )(-CH 2 -O-NO 2 ) 2 )
- Фосфорная кислота образует сложные эфиры фосфорной кислоты , например трифенилфосфат ( O=P(-O-C 6 H 5 ) 3 ) и метилдигидрофосфат ( O=P(-O-CH 3 )(-OH) 2 )
- Пирофосфорная (дифосфорная) кислота образует пирофосфатные эфиры, например тетраэтилпирофосфат , ADP , dADP , ADPR , cADPR , CDP , dCDP , GDP , dGDP , UDP , dTDP , MEcPP , HMBPP , DMAPP , IPP , GPP , FPP , GGPP , ThDP , FAD . , НАД , НАДФ .
- Трифосфорная кислота образует трифосфатные эфиры, например АТФ , dATP , CTP , dCTP , GTP , dGTP , UTP , dTTP , ITP , XTP , ThTP , AThTP .
- Угольная кислота образует сложные эфиры карбонатов , например диметилкарбонат ( (CH 3 -O-) 2 C=O ) и 5-членный циклический этиленкарбонат ( (-CH 2 -O-) 2 C=O ) (если угольную кислоту относить к неорганическим соединениям)
- Тритиокарбоновая кислота образует сложные эфиры тритиокарбоната , например диметилтритиокарбонат ( (CH 3 -S-) 2 C=S ) (если тритиокарбоновую кислоту относить к неорганическим соединениям)
- Хлоромуравьиная кислота образует сложные эфиры хлормуравьиной кислоты, например метилхлормуравьиную кислоту ( Cl-C(=O)-O-CH 3 ) (если хлормуравьиную кислоту относят к неорганическим соединениям)
- Борная кислота образует сложные эфиры борной кислоты , например триметилборат ( Б(-О-СН 3 ) 3 )
- Хромовая кислота образует ди - трет-бутилхромат ( ((CH 3 ) 3 C-O-) 2 Cr(=O) 2 )
Неорганические кислоты, существующие в виде таутомеров, образуют два или более типов сложных эфиров.
- Тиосерная кислота образует два типа эфиров тиосульфата , например O , O -диметилтиосульфат ( (CH 3 -O-) 2 S(=O)(=S) ) и O , S -диметилтиосульфат ( (CH 3 -O-)(CH 3 -S-)S(=O) 2 )
- Тиоциановая кислота образует сложные эфиры роданида , например метилтиоцианат ( CH 3 -S-C≡N ) (если относить тиоциановую кислоту к неорганическому соединению), но образует изотиоцианатные также «сложные эфиры», например метилизотиоцианат ( CH 3 -N=C=S ), хотя органилизотиоцианаты не классифицируются ИЮПАК как сложные эфиры .
- Фосфористая кислота образует два типа сложных эфиров: фосфитные эфиры , например триэтилфосфит ( P(-O-CH 2 CH 3 ) 3 ) и сложные эфиры фосфоновой кислоты , например диэтилфосфонат ( H-P(=O)(-O-CH 2 CH 3 ) 2 )
Некоторые неорганические кислоты, которые нестабильны или неуловимы, образуют стабильные сложные эфиры.
- Сернистая кислота , которая нестабильна, образует стабильный диметилсульфит ( (CH 3 -O-) 2 S=O )
- Дикарбоновая кислота , которая нестабильна, образует стабильный диметилдикарбонат ( CH 3 -O-C(=O)-O-C(=O)-O-CH 3 )
В принципе, часть алкоксидов металлов и металлоидов , которых известны многие сотни, можно отнести к эфирам соответствующих кислот (например, триэтоксида алюминия ( Al(OCH 2 CH 3 ) 3 ) можно классифицировать как сложный эфир алюминиевой кислоты, который представляет собой гидроксид алюминия , тетраэтилортосиликат ( Si(OCH 2 CH 3 ) 4 ) можно классифицировать как эфир ортокремниевой кислоты и этоксид титана ( Ti(OCH 2 CH 3 ) 4 ) можно классифицировать как сложный эфир ортотитановой кислоты .
Структура и связь
[ редактировать ]Эфиры карбоновых кислот и спиртов содержат карбонильную группу C=O, которая представляет собой двухвалентную группу при атоме C , что приводит к образованию углов C–C–O и O–C–O 120°. В отличие от амидов , эфиры карбоновых кислот представляют собой структурно гибкие функциональные группы, поскольку вращение вокруг связей C–O–C имеет низкий барьер. Их гибкость и малая полярность проявляются в их физических свойствах; они имеют тенденцию быть менее жесткими (более низкая температура плавления) и более летучими (более низкая температура кипения), чем соответствующие амиды . [ 7 ] P карбонильной K a альфа-водородов эфиров карбоновых кислот составляет около 25 (альфа-водород представляет собой водород, связанный с углеродом, соседним с группой (C=O) сложных эфиров карбоновых кислот). [ 8 ]
Многие эфиры карбоновых кислот обладают потенциалом конформационной изомерии , но они склонны принимать S - цис (или Z ) конформацию, а не альтернативу S - транс (или E ) из-за комбинации эффектов гиперконъюгации и дипольной минимизации . На предпочтение Z- конформации влияет природа заместителей и растворителя, если он присутствует. [ 9 ] [ 10 ] Лактоны с небольшими кольцами ограничены s -транс-конформацией (т.е. E ) из-за их циклической структуры.

Физические свойства и характеристики
[ редактировать ]Сложные эфиры, полученные из карбоновых кислот и спиртов, более полярны, чем простые эфиры , но менее полярны, чем спирты. Они участвуют в водородных связях как акцепторы водородных связей, но не могут выступать в качестве доноров водородных связей, в отличие от своих исходных спиртов. Эта способность участвовать в образовании водородных связей придает некоторую растворимость в воде. Из-за отсутствия способности донора водородных связей сложные эфиры не самоассоциируются. Следовательно, сложные эфиры более летучи, чем карбоновые кислоты с аналогичной молекулярной массой. [ 7 ]
Характеристика и анализ
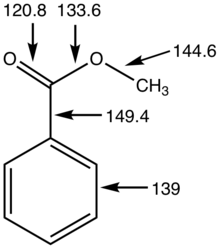
[ редактировать ]Сложные эфиры обычно идентифицируются с помощью газовой хроматографии, учитывая их летучесть. ИК-спектры сложных эфиров имеют интенсивную резкую полосу в диапазоне 1730–1750 см-1. −1 присвоено ν C=O . Этот пик меняется в зависимости от функциональных групп, присоединенных к карбонилу. Например, бензольное кольцо или двойная связь в сочетании с карбонилом уменьшит волновое число примерно на 30 см-1. −1 .
Применение и возникновение
[ редактировать ]Эфиры широко распространены в природе и широко используются в промышленности. В природе жиры , как правило, представляют собой триэфиры, полученные из глицерина и жирных кислот . [ 12 ] Эфиры отвечают за аромат многих фруктов, включая яблоки , дурианы , груши , бананы , ананасы и клубнику . [ 13 ] несколько миллиардов килограммов полиэфиров Ежегодно в промышленности производится , важными продуктами являются полиэтилентерефталат , сложные эфиры акрилата и ацетат целлюлозы . [ 14 ]

Типичный триглицерид, обнаруженный в льняном масле, триэфире глицерина (в центре, черный), полученном из линолевой кислоты (внизу справа, зеленый), альфа-линоленовой кислоты (слева, красный) и олеиновой кислоты (вверху справа, синий).
Подготовка
[ редактировать ]Этерификация — это общее название химической реакции , в которой два реагента (обычно спирт и кислота) образуют в качестве продукта реакции сложный эфир . Эфиры широко распространены в органической химии и биологических материалах и часто имеют приятный характерный фруктовый запах. Это приводит к их широкому использованию в парфюмерной и вкусовой промышленности. Эфирные связи также встречаются во многих полимерах .
Этерификация карбоновых кислот спиртами.
[ редактировать ]Классическим синтезом является этерификация Фишера , которая включает обработку карбоновой кислоты спиртом в присутствии дегидратирующего агента:
- RCO 2 H + R'OH ⇌ RCO 2 R' + H 2 O
Константа равновесия для таких реакций составляет около 5 для типичных эфиров, например этилацетата. [ 15 ] Реакция протекает медленно в отсутствие катализатора. Серная кислота является типичным катализатором этой реакции. Также используются многие другие кислоты, такие как полимерные сульфоновые кислоты . Поскольку этерификация весьма обратима, выход сложного эфира можно улучшить, используя принцип Ле Шателье :
- Использование спирта в большом избытке (т.е. в качестве растворителя).
- Использование дегидратирующего агента: серная кислота не только катализирует реакцию, но и связывает воду (продукт реакции). Другие осушители, такие как молекулярные сита, также эффективны.
- Удаление воды физическими способами, такими как перегонка низкокипящего азеотропа с толуолом в сочетании с аппаратом Дина-Старка .
Известны реагенты, вызывающие дегидратацию смесей спиртов и карбоновых кислот. Одним из примеров является этерификация Стеглиха , которая представляет собой метод образования сложных эфиров в мягких условиях. Этот метод популярен в синтезе пептидов , где субстраты чувствительны к суровым условиям, таким как высокая температура. DCC ( дициклогексилкарбодиимид ) используется для активации карбоновой кислоты для дальнейшей реакции. 4-диметиламинопиридин переноса ацила используется В качестве катализатора (DMAP) . [ 16 ]
Другим методом дегидратации смесей спиртов и карбоновых кислот является реакция Мицунобу :
- RCO 2 H + R'OH + P(C 6 H 5 ) 3 + R 2 N 2 → RCO 2 R' + OP(C 6 H 5 ) 3 + R 2 N 2 H 2
Карбоновые кислоты можно этерифицировать диазометаном :
- RCO 2 H + CH 2 N 2 → RCO 2 CH 3 + N 2
Используя этот диазометан, смеси карбоновых кислот можно преобразовать в их метиловые эфиры с близкими к количественным выходам, например, для анализа с помощью газовой хроматографии . Этот метод полезен в специализированных операциях по органическому синтезу, но считается слишком опасным и дорогим для крупномасштабного применения.
Этерификация карбоновых кислот эпоксидами.
[ редактировать ]Карбоновые кислоты этерифицируются обработкой эпоксидами с образованием β-гидроксиэфиров:
- RCO 2 H + RCHCH 2 O → RCO 2 CH 2 CH(OH)R
Эта реакция используется при производстве винилэфирной смолы из акриловой кислоты .
Алкоголиз ацилхлоридов и ангидридов кислот
[ редактировать ]Спирты реагируют с ацилхлоридами и ангидридами кислот с образованием сложных эфиров:
- RCOCl + R'OH → RCO 2 R' + HCl
- (RCO) 2 O + R'OH → RCO 2 R' + RCO 2 H
Реакции необратимы, что упрощает исследование . Поскольку ацилхлориды и ангидриды кислот также реагируют с водой, предпочтительными являются безводные условия. Аналогичные ацилирования аминов с образованием амидов менее чувствительны, поскольку амины являются более сильными нуклеофилами и реагируют быстрее, чем вода. Этот метод используется только для процедур лабораторного масштаба, поскольку он дорог.
Алкилирование карбоновых кислот и их солей
[ редактировать ]Тетрафторборат триметилоксония можно использовать для этерификации карбоновых кислот в условиях, когда кислотно-катализируемые реакции невозможны: [ 17 ]
- RCO 2 H + (CH 3 ) 3 OBF 4 → RCO 2 CH 3 + (CH 3 ) 2 O + HBF 4
) редко используются для этерификации, Хотя соли карбоксилатов (часто образующиеся in situ они реагируют с электрофильными алкилирующими агентами , такими как алкилгалогениды , с образованием сложных эфиров. [ 14 ] [ 18 ] Наличие анионов может ингибировать эту реакцию, что, соответственно, выгодно при использовании катализаторов фазового переноса или таких высокополярных апротонных растворителей, как ДМФ . Дополнительная йодистая соль может посредством реакции Финкельштейна катализировать реакцию упорного алкилгалогенида. Альтернативно, соли координирующего металла, такого как серебро, могут улучшить скорость реакции за счет облегчения удаления галогенидов.
Переэтерификация
[ редактировать ]Широко практикуется переэтерификация , заключающаяся в превращении одного сложного эфира в другой:
- RCO 2 R' + CH 3 OH → RCO 2 CH 3 + R'OH
Как и гидролиз, переэтерификация катализируется кислотами и основаниями. Реакция широко используется для разложения триглицеридов , например, при производстве эфиров жирных кислот и спиртов. Поли(этилентерефталат) получают переэтерификацией диметилтерефталата и этиленгликоля: [ 14 ]
- n (C 6 H 4 )(CO 2 CH 3 ) 2 + 2 n C 2 H 4 (OH) 2 → [(C 6 H 4 )(CO 2 ) 2 (C 2 H 4 )] n + 2 n CH 3OH
Подвидом переэтерификации является алкоголиз дикетена . Эта реакция дает 2-кетоэфиры. [ 14 ]
- (CH 2 CO) 2 + ROH → CH 3 C(O)CH 2 CO 2 R
Карбонилирование
[ редактировать ]Алкены подвергаются « гидроэтерификации » в присутствии металлических карбонильных катализаторов. Эфиры пропановой кислоты производятся в промышленных масштабах следующим методом:
- H 2 C=CH 2 + ROH + CO → CH 3 CH 2 CO 2 R
Одним из показательных примеров является получение метилпропионата .
- H 2 C=CH 2 + CO + CH 3 OH → CH 3 CH 2 CO 2 CH 3
Карбонилирование метанола дает метилформиат , который является основным коммерческим источником муравьиной кислоты . Реакция катализируется метоксидом натрия :
- СН 3 ОН + СО → HCO 2 СН 3
Присоединение карбоновых кислот к алкенам и алкинам
[ редактировать ]При гидроэтерификации алкены и алкины встраиваются в Связь O-H карбоновых кислот. Винилацетат получают в промышленности добавлением уксусной кислоты к ацетилену в присутствии катализаторов из ацетата цинка : [ 19 ]
- HC≡CH + CH 3 CO 2 H → CH 3 CO 2 CH=CH 2
Винилацетат также можно получить катализируемой палладием реакцией этилена, уксусной кислоты и кислорода :
- 2 H 2 C=CH 2 + 2 CH 3 CO 2 H + O 2 → 2 CH 3 CO 2 CH=CH 2 + 2 H 2 O
Кремневольфрамовая кислота используется для производства этилацетата путем алкилирования уксусной кислоты этиленом:
- H 2 C=CH 2 + CH 3 CO 2 H → CH 3 CO 2 CH 2 CH 3
Из альдегидов
[ редактировать ]Реакция Тищенко включает диспропорционирование альдегида . в присутствии безводного основания с образованием сложного эфира Катализаторами являются алкоксиды алюминия или алкоксиды натрия. Бензальдегид реагирует с бензилоксидом натрия (полученным из натрия и бензилового спирта ) с образованием бензилбензоата . [ 20 ] Метод применяется при производстве этилацетата из ацетальдегида . [ 14 ]
Другие методы
[ редактировать ]- Перегруппировка Фаворского α-галогенкетонов в присутствии основания
- по Байеру – Виллигеру пероксидами. Окисление кетонов
- Реакция Пиннера нитрилов . со спиртом
- Нуклеофильное отщепление металлоацильного комплекса
- Гидролиз ортоэфиров в водной кислоте
- Целлюлолиз посредством этерификации [ 21 ]
- Озонолиз алкенов и при обработке в присутствии соляной кислоты различных спиртов . [ 22 ]
- Анодное окисление метилкетонов . с образованием метиловых эфиров [ 23 ]
- Переэтерификация заменяет группы жирных кислот различных эфиров.
Реакции
[ редактировать ]Эфиры реагируют с нуклеофилами по карбонильному углероду. Карбонил слабо электрофилен, но подвергается атаке сильных нуклеофилов (аминов, алкоксидов, источников гидридов, литийорганических соединений и др.). Связи C–H, прилегающие к карбонилу, слабокислые, но подвергаются депротонированию сильными основаниями. Именно этот процесс обычно инициирует реакции конденсации. Карбонильный кислород в сложных эфирах является слабоосновным, в меньшей степени, чем карбонильный кислород в амидах из-за резонансного донорства электронной пары от азота в амидах, но образует аддукты .
Гидролиз и омыление
[ редактировать ]Этерификация является обратимой реакцией. Сложные эфиры подвергаются гидролизу в кислых и основных условиях. В кислых условиях реакция является обратной реакцией этерификации Фишера . В основных условиях гидроксид действует как нуклеофил, а алкоксид — уходящая группа. Эта реакция, омыление , лежит в основе изготовления мыла.
Алкоксидная группа также может быть замещена более сильными нуклеофилами, такими как аммиак или первичные или вторичные амины, с образованием амидов (реакция аммонолиза):
- RCO 2 R' + NH 2 R″ → RCONHR″ + R'OH
Эта реакция обычно необратима. Вместо аминов можно использовать гидразины и гидроксиламин. Эфиры могут быть преобразованы в изоцианаты через промежуточные гидроксамовые кислоты в перегруппировке Лоссена .
Источники углеродных нуклеофилов, например реактивы Гриньяра и литийорганические соединения, легко присоединяются к карбонилу.
Снижение
[ редактировать ]По сравнению с кетонами и альдегидами сложные эфиры относительно устойчивы к восстановлению . Введение каталитического гидрирования в начале 20 века стало прорывом; эфиры жирных кислот гидрируются до жирных спиртов .
- RCO 2 R' + 2 H 2 → RCH 2 OH + R'OH
Типичным катализатором является хромит меди . До развития каталитического гидрирования сложные эфиры восстанавливались в больших масштабах с использованием восстановления Буво-Блана . В этом методе, который в значительной степени устарел, используется натрий в присутствии источников протонов.
Специально для тонкого химического синтеза алюмогидрид лития используется для восстановления сложных эфиров до двух первичных спиртов. Соответствующий реагент боргидрид натрия в этой реакции протекает медленно. ДИБАГ восстанавливает сложные эфиры до альдегидов. [ 24 ]
Прямое восстановление с получением соответствующего эфира затруднено, поскольку промежуточный полуацеталь имеет тенденцию разлагаться с образованием спирта и альдегида (который быстро восстанавливается с образованием второго спирта). Реакцию можно провести, используя триэтилсилан с различными кислотами Льюиса. [ 25 ] [ 26 ]
Конденсация Клайзена и родственные реакции
[ редактировать ]Что касается альдегидов , атомы водорода на атоме углерода, примыкающем («α к») к карбоксильной группе в сложных эфирах, достаточно кислые, чтобы подвергаться депротонированию, что, в свою очередь, приводит к множеству полезных реакций. Для депротонирования требуются относительно сильные основания, такие как алкоксиды . Депротонирование дает нуклеофильный енолят , который может далее реагировать, например, с конденсацией Кляйзена и ее внутримолекулярным эквивалентом, конденсацией Дикмана . Это преобразование используется в синтезе эфира малоновой кислоты , где диэфир малоновой кислоты реагирует с электрофилом (например, алкилгалогенидом ) и впоследствии декарбоксилируется. Другой вариант - алкилирование Фратера-Зеебаха .
Другие реакции
[ редактировать ]- Метиловые эфиры часто подвержены декарбоксилированию при декарбоксилировании Крапчо .
- Фениловые эфиры реагируют с гидроксиарилкетонами в перегруппировке Фриса .
- Конкретные сложные эфиры функционализированы α-гидроксильной группой при перегруппировке Чана .
- Эфиры с β-атомами водорода можно превратить в алкены при пиролизе сложных эфиров .
- Прямое преобразование сложных эфиров в нитрилы . [ 27 ]
- Пары сложных эфиров соединяются с образованием α-гидроксикетонов при конденсации ацилоина.
Защитные группы
[ редактировать ]Как класс, сложные эфиры служат защитными группами для карбоновых кислот . Защита карбоновой кислоты полезна при синтезе пептидов, чтобы предотвратить самореакции бифункциональных аминокислот . Метиловые и этиловые эфиры обычно доступны для многих аминокислот; т - бутиловый эфир имеет тенденцию быть более дорогим. Однако трет -бутиловые эфиры особенно полезны, поскольку в сильнокислых условиях трет -бутиловые эфиры подвергаются элиминированию с образованием карбоновой кислоты и изобутилена , что упрощает обработку.
Опасности
[ редактировать ]Эфиры реагируют с сильными окисляющими кислотами , что может вызвать бурную реакцию, достаточно экзотермическую, чтобы воспламенить эфиры и продукты реакции. Тепло также выделяется при взаимодействии сложных эфиров с щелочей растворами . Очень легковоспламеняющийся газообразный водород образуется при смешивании сложных эфиров с щелочными металлами и ионными гидридами . [ 28 ]
Список эфирных отдушек
[ редактировать ]Многие сложные эфиры имеют характерный фруктовый запах, и многие из них встречаются в природе в эфирных маслах растений. Это также привело к их широкому использованию в искусственных ароматизаторах и ароматизаторах, имитирующих эти запахи.
См. также
[ редактировать ]- Список эфиров
- Амид
- Тиоамид
- Карбоксимидат
- Карбамат
- Ксантогенат
- Амидин
- Цианат
- тиоцианат
- селеноцианат
- Теллуроцианат
- Полиэстер , пластмассы из сложных полимерных эфиров
- Олигоэфир , полимерный сложный эфир, состоящий из небольшого количества сложноэфирных мономеров.
- Полиэстер — сложный эфир, представляющий собой синтетическое масло, используемое в холодильных компрессорах.
- Тиоэфир
- Переэтерификация
- Эфирный липид , сложный эфир, который представляет собой липид и эфир.
- Ацилал ( (Р 1 −C(=O)−O−)(R 2 −C(=O)−O−)CH−R 3 )
- Ортоэфир , сложный эфир ортокислоты ( например, эфиры ортокарбоновых кислот , ортоугольной кислоты , ортокремниевой кислоты , ортотеллуровой кислоты , ортофосфорной кислоты , ортоборной кислоты , ...)
- Депсид , полимерный сложный эфир, тип полифенольного соединения, состоящий из двух или более моноциклических ароматических звеньев, связанных сложноэфирной группой.
- Депсипептид , тип сложного эфира, который представляет собой пептид , в котором одна или несколько амидных групп ( −C(=O)−NH− ) заменяются соответствующими сложноэфирными группами ( −C(=O)−O− ) [ 29 ]
- Глицерид ( (Р 1 −C(=O)−O−CH 2 −)(R 2 −C(=O)−O−CH 2 −)(R 3 −C(=O)−O−)CH ), сложный эфир жирных кислот и глицерина.
- Лактон , циклический эфир карбоновой кислоты.
- Лактид , разновидность сложного эфира лактона.
- Витамин С (аскорбиновая кислота), сложный эфир лактона, необходимое питательное вещество для человека и других животных.
- Фталид , разновидность сложного эфира лактона.
- Кумарин , разновидность сложного эфира лактона.
- Макролиды — класс природных сложных эфиров, которые состоят из большого макроциклического лактонного кольца, к которому один или несколько дезоксисахаров . может быть присоединен
- ФОРМАТЫ
- хлорформиат
Ссылки
[ редактировать ]- ^ Jump up to: а б ИЮПАК , Сборник химической терминологии , 2-е изд. («Золотая книга») (1997). Интернет-исправленная версия: (2006–) « Эфиры ». doi : 10.1351/goldbook.E02219
- ^ Кэмерон Райт (1986). Руководство для рабочих по опасностям, связанным с растворителями . Группа. п. 48. ИСБН 9780969054542 .
- ^ Э. Ричард Бузер (21 декабря 1993 г.). Справочник CRC по смазке и трибологии, том III: Мониторинг, материалы, синтетические смазочные материалы и применение . КПР. п. 237. ИСБН 978-1-4200-5045-5 .
- ^ «Ацетокситриметилолово» .
- ^ «Ацетат триметилолова | C5H12O2Sn | ChemSpider» .
- ^ Леопольд Гмелин, Справочник по химии , том. 4: Справочник по органической химии (том 1) (Гейдельберг, Баден (Германия): Карл Винтер, 1848), стр. 182 .
Исходный текст:
Перевод:б. Эфиры или эфиры кислородной кислоты.
Эфиры третьего рода.
Многие минеральные и органические кислородные кислоты соединяются со спиртами, образуя нейтральные летучие эфирные соединения, которые можно рассматривать как парные соединения спирта и кислоты-воды или, согласно радикальной теории, как соли, в которых кислота соединяется с подключен один эфир.б. Сложный эфир или эфиры оксикислот.
Эфиры третьего типа.
Многие минеральные и органические кислоты, содержащие кислород, при отщеплении воды соединяются со спиртом с образованием нейтральных летучих эфирных соединений, которые можно рассматривать как сопряженные соединения спирта и кислоты с водой или, согласно теории радикалов, как соли. в котором кислота связана с эфиром. - ^ Jump up to: а б Марч, Дж. Продвинутая органическая химия, 4-е изд. Дж. Уайли и сыновья, 1992: Нью-Йорк. ISBN 0-471-60180-2 .
- ^ «Химия енолов и енолятов – Кислотность альфа-водородов» . 13 февраля 2011 г.
- ^ Дивакар М. Павар; Абдельнасер А. Халил; Дениз Р. Хукс; Кеннет Коллинз; Тихуана Эллиотт; Джеффори Стаффорд; Люсиль Смит; Эрик А. Ноэ (1998). « E и Z -конформации сложных эфиров, тиоловых эфиров и амидов». Журнал Американского химического общества . 120 (9): 2108–2112. дои : 10.1021/ja9723848 .
- ^ Кристоф Дюгав; Люк Деманж (2003). «Цис-транс-изомеризация органических молекул и биомолекул: последствия и приложения». Химические обзоры . 103 (7): 2475–2932. дои : 10.1021/cr0104375 . ПМИД 12848578 .
- ^ А.А. Яковенко; Дж. Х. Гальегос; М. Ю. Антипин; А. Масунов; Т.В. Тимофеева (2011). «Кристаллическая морфология как свидетельство супрамолекулярной организации аддуктов 1,2-бис(хлормеркурио)тетрафторбензола с органическими эфирами». Рост и дизайн кристаллов . 11 (9): 3964–3978. дои : 10.1021/cg200547k .
- ^ Выделение триглицерида из мускатного ореха: Органический синтез GD Beal "Trimyristen", Coll. Том. 1, с.538 (1941). Связь
- ^ МакГи, Гарольд. О еде и кулинарии . 2003, Скрибнер, Нью-Йорк.
- ^ Jump up to: а б с д и Рименшнейдер, Вильгельм; Болт, Герман М. «Органические сложные эфиры». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a09_565.pub2 . ISBN 978-3527306732 .
- ^ Уильямс, Роджер Дж.; Габриэль, Альтон; Эндрюс, Рой К. (1928). «Связь между константой равновесия гидролиза сложных эфиров и силой соответствующих кислот». Журнал Американского химического общества . 50 (5): 1267–1271. дои : 10.1021/ja01392a005 .
- ^ Б. Нейсес и В. Стеглих. «Этерификация карбоновых кислот дициклогексилкарбодиимидом/4-диметиламинопиридином: трет -бутилэтилфумарат» . Органические синтезы ; Сборник томов , т. 7, с. 93 .
- ^ Рабер, Дуглас Дж.; Гариано-младший, Патрик; Брод, Альберт О.; Гариано, Энн Л.; Гуида, Уэйн К. (1977). «Этерификация карбоновых кислот солями триалкилоксония: этил- и метил-4-ацетоксибензоаты». Органические синтезы . 56 : 59. дои : 10.15227/orgsyn.056.0059 .
- ^ Мацумото, Коити; Симадзаки, Хаято; Миямото, Ю; Симада, Кадзуаки; Хага, Фуми; Ямада, Юки; Миядзава, Хироцугу; Нишиваки, Кейджи; Касимура, Сигенори (2014). «Простой и удобный синтез эфиров карбоновых кислот и алкилгалогенидов с использованием фторида тетрабутиламмония» . Журнал Oleo Science . 63 (5): 539–544. дои : 10.5650/jos.ess13199 . ISSN 1345-8957 . ПМИД 24770480 .
- ^ Биневальд, Франк; Лейболд, Эдгар; Тужина, Павел; Рошер, Гюнтер (2019). «Виниловые эфиры». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. стр. 1–16. дои : 10.1002/14356007.a27_419.pub2 . ISBN 9783527303854 .
- ^ Камм, О.; Камм, ВФ (1922). «Бензилбензоат» . Органические синтезы . 2 : 5. дои : 10.15227/orgsyn.002.0005 ; Сборник томов , т. 1, с. 104 .
- ^ Игнатьев Игорь; Чарли Ван Дорслер; Паскаль Г.Н. Мертенс; Коэн Биннеманс; Дирк. Э. де Вос (2011). «Синтез эфиров глюкозы из целлюлозы в ионных жидкостях» . Исследования древесины . 66 (4): 417–425. дои : 10.1515/hf.2011.161 . S2CID 101737591 .
- ^ Ноймайстер, Иоахим; Кеул, Хельмут; Пратап Саксена, Махендра; Грисбаум, Карл (1978). «Расщепление олефинов озоном с образованием эфирных фрагментов». Международное издание «Прикладная химия» на английском языке . 17 (12): 939–940. дои : 10.1002/anie.197809392 .
- ^ Махова Ирина Владимировна; Элинсон, Михаил Н.; Никишин, Геннадий Иванович (1991). «Электрохимическое окисление кетонов в метаноле в присутствии бромидов щелочных металлов». Тетраэдр . 47 (4–5): 895–905. дои : 10.1016/S0040-4020(01)87078-2 .
- ^ В. Ройш. «Реакционная способность карбоксильных производных» . Виртуальный учебник органической химии . Архивировано из оригинала 16 мая 2016 г.
- ^ Ято, Мичихиса; Хомма, Коичи; Исида, Акихико (июнь 2001 г.). «Восстановление сложных эфиров карбоновых кислот до простых эфиров триэтилсиланом при совместном использовании тетрахлорида титана и триметилсилилтрифторметансульфоната». Тетраэдр . 57 (25): 5353–5359. дои : 10.1016/S0040-4020(01)00420-3 .
- ^ Сакаи, Норио; Мория, Тосимицу; Конакахара, Такео (июль 2007 г.). «Эффективный однореакторный синтез несимметричных эфиров: прямо восстановительное дезоксигенирование сложных эфиров с использованием каталитической системы InBr3/Et3SiH». Журнал органической химии . 72 (15): 5920–5922. дои : 10.1021/jo070814z . ПМИД 17602594 .
- ^ Вуд, Дж.Л.; Хатри, Н.А.; Вайнреб, С.М. (1979). «Прямое преобразование сложных эфиров в нитрилы». Буквы тетраэдра . 20 (51): 4907. doi : 10.1016/S0040-4039(01)86746-0 .
- ^ «ПабХим» . pubchem.ncbi.nlm.nih.gov . Проверено 20 апреля 2023 г. [ не удалось пройти проверку ]
- ^ ИЮПАК , Сборник химической терминологии , 2-е изд. («Золотая книга») (1997). Интернет-исправленная версия: (2006–) « Депсипептиды ». дои : 10.1351/goldbook.D01604