Интерферон гамма
| ИФНГ | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | IFNG , IFG, IFI, интерферон, гамма, гамма-интерферон, IMD69 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | Опустить : 147570 ; МГИ : 107656 ; Гомологен : 55526 ; GeneCards : IFNG ; ОМА : IFNG — ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Интерферон гамма | |||
|---|---|---|---|
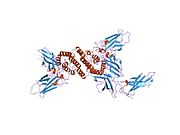
 Кристаллическая структура биологически активного одноцепочечного мутанта гамма-интерферона человека | |||
| Идентификаторы | |||
| Символ | ИФН гамма | ||
| Пфам | PF00714 | ||
| Пфам Клан | CL0053 | ||
| ИнтерПро | ИПР002069 | ||
| ОБЛАСТЬ ПРИМЕНЕНИЯ 2 | 1рфб / СКОПе / СУПФАМ | ||
| |||
| Клинические данные | |
|---|---|
| Торговые названия | Актиммун |
| AHFS / Drugs.com | Монография |
| МедлайнПлюс | а601152 |
| код АТС | |
| Идентификаторы | |
| Номер CAS | |
| Лекарственный Банк | |
| ХимическийПаук |
|
| НЕКОТОРЫЙ | |
| ХЭМБЛ | |
| Химические и физические данные | |
| Формула | С 761 Ч 1206 Н 214 О 225 С 6 |
| Молярная масса | 17 145 .65 g·mol −1 |
| | |
Интерферон гамма ( IFNG или IFN-γ) представляет собой димеризованный растворимый цитокин , который является единственным членом класса типа интерферонов II . [ 5 ] Существование этого интерферона, который в начале своей истории был известен как иммунный интерферон, было описано Э. Ф. Уилоком как продуктом человеческих лейкоцитов, стимулированных фитогемагглютинином , а другими - как продуктом антиген-стимулированных лимфоцитов . [ 6 ] Было также показано, что он вырабатывается в лимфоцитах человека. [ 7 ] или сенсибилизированные туберкулином мыши перитонеальные лимфоциты [ 8 ] поставлена проба Манту (PPD); Было показано, что полученные супернатанты ингибируют рост вируса везикулярного стоматита . Эти отчеты также содержали основные наблюдения, лежащие в основе широко используемого в настоящее время анализа высвобождения гамма-интерферона, используемого для тестирования на туберкулез . У человека белок IFNG кодируется IFNG геном . [ 9 ] [ 10 ]
Посредством клеточной передачи сигналов гамма-интерферон играет роль в регуляции иммунного ответа клетки-мишени. [ 11 ] Ключевым сигнальным путем, который активируется ИФН типа II, является сигнальный путь JAK-STAT . [ 12 ] IFNG играет важную роль как во врожденном , так и в адаптивном иммунитете. Интерферон типа II секретируется преимущественно CD4. + Т-хелперы 1 (Th1), естественные клетки-киллеры (NK) и CD8. + цитотоксические Т-клетки . Экспрессия IFN типа II регулируется цитокинами. [ 13 ] Путем активации сигнальных путей в клетках, таких как макрофаги , В-клетки и CD8. + цитотоксические Т-клетки , он способен стимулировать воспаление, противовирусную или антибактериальную активность, а также пролиферацию и дифференцировку клеток . [ 14 ] ИФН типа II серологически отличается от интерферона типа 1 , связывается с разными рецепторами и кодируется отдельным хромосомным локусом. [ 15 ] Интерферон типа II сыграл роль в разработке методов иммунотерапии рака благодаря своей способности предотвращать рост опухоли. [ 13 ]
Функция
[ редактировать ]ИФНГ, или интерферон типа II, представляет собой цитокин, который имеет решающее значение для врожденного и адаптивного иммунитета против вирусных , некоторых бактериальных и протозойных инфекций . ИФНГ является важным активатором макрофагов и индуктором экспрессии молекул главного комплекса гистосовместимости класса II . Аберрантная экспрессия IFNG связана с рядом аутовоспалительных и аутоиммунных заболеваний . Важность ИФНГ в иммунной системе частично обусловлена его способностью напрямую ингибировать репликацию вируса и, что наиболее важно, его иммуностимулирующим и иммуномодулирующим действием. IFNG продуцируется преимущественно природными киллерными клетками (NK) и природными киллерными Т-клетками (NKT) как часть врожденного иммунного ответа, а также ) CD4 Th1 и CD8 эффекторными Т-клетками цитотоксических Т-лимфоцитов ( CTL после развития антигенспецифического иммунитета . [ 16 ] [ 17 ] как часть адаптивного иммунного ответа. IFNG также продуцируется нецитотоксичными врожденными лимфоидными клетками (ILC), семейством иммунных клеток, впервые обнаруженных в начале 2010-х годов. [ 18 ]
Первичными клетками, секретирующими IFN II типа, являются CD4. + Т-хелперы 1 (Th1), естественные клетки-киллеры (NK) и CD8. + цитотоксические Т-клетки . Он также может секретироваться антигенпрезентирующими клетками ( АПК ), такими как дендритные клетки ( ДК ), макрофаги ( МФ ) и В-клетки в меньшей степени. Экспрессия IFN типа II усиливается за счет продукции цитокинов -интерлейкинов , таких как IL-12 , IL-15 , IL-18 , а также интерферонов I типа (IFN-α и IFN-β). [ 13 ] Между тем, известно, что IL-4 , IL-10 , трансформирующий фактор роста-бета (TGF-β) и глюкокортикоиды подавляют экспрессию IFN типа II. [ 14 ]
Интерферон типа II представляет собой цитокин, то есть он действует, передавая сигналы другим клеткам иммунной системы и влияя на их иммунный ответ. Существует множество иммунных клеток, на которые действует IFN II типа. Некоторые из его основных функций заключаются в индуцировании IgG переключения изотипа в В-клетках ; активировать главного комплекса гистосовместимости (MHC) класса II экспрессию на APC ; индуцировать CD8 + дифференцировка, активация и пролиферация цитотоксических Т-клеток; и активировать макрофаги . В макрофагах ИФН типа II стимулирует экспрессию IL-12 . IL-12, в свою очередь, способствует секреции IFNG NK-клетками и клетками Th1 и сигнализирует наивным Т-хелперным клеткам (Th0) о дифференцировке в клетки Th1. [ 11 ]
Структура
[ редактировать ]IFNG Мономер состоит из ядра из шести α-спиралей и расширенной развернутой последовательности в С-концевой области. [ 19 ] [ 20 ] Это показано на структурных моделях ниже. α-спирали в ядре структуры пронумерованы от 1 до 6.

Биологически активный димер образуется путем антипараллельного соединения двух мономеров, как показано ниже. В мультяшной модели один мономер показан красным, другой — синим.

Связывание рецептора
[ редактировать ]
Клеточные ответы на IFNG активируются посредством его взаимодействия с гетеродимерным рецептором, состоящим из рецептора гамма-интерферона 1 (IFNGR1) и рецептора гамма-интерферона 2 (IFNGR2). Связывание IFN-γ с рецептором активирует путь JAK-STAT . Активация пути JAK-STAT вызывает активацию интерферон-стимулируемых генов (ISG), включая MHC II. [ 21 ] IFNG также связывается с гликозаминогликаном гепарансульфатом (HS) на поверхности клетки. Однако, в отличие от многих других белков, связывающих гепарансульфат, связывание которых способствует биологической активности , связывание IFNG с HS ингибирует его биологическую активность. [ 22 ]
Структурные модели для IFNG показаны на рисунках 1-3. [ 20 ] все они укорочены на С-концах на 17 аминокислот. Полная длина IFNG составляет 143 аминокислоты, модели — 126 аминокислот. Сродство к гепарансульфату находится исключительно в пределах удаленной последовательности из 17 аминокислот. [ 23 ] Внутри этой последовательности из 17 аминокислот находятся два кластера основных аминокислот, называемых D1 и D2 соответственно. Гепарансульфат взаимодействует с обоими этими кластерами. [ 24 ] В отсутствие гепарансульфата присутствие последовательности D1 увеличивает скорость образования комплексов IFNG-рецептор. [ 22 ] Взаимодействие между кластером аминокислот D1 и рецептором может быть первым шагом в образовании комплекса. Связываясь с D1, HS может конкурировать с рецептором и предотвращать образование активных рецепторных комплексов. [ нужна ссылка ]
Биологическое значение взаимодействия гепарансульфатов с ИФНГ неясно; однако связывание кластера D1 с HS может защитить его от протеолитического расщепления . [ 24 ]
Сигнализация
[ редактировать ]IFNG связывается с рецептором клеточной поверхности типа II, также известным как гамма-рецептор IFN (IFNGR), который является частью семейства цитокиновых рецепторов класса II. IFNGR состоит из двух субъединиц: IFNGR1 и IFNGR2 . IFNGR1 связан с JAK1 , а IFNGR2 связан с JAK2 . После связывания IFNG с рецептором IFNGR1 и IFNGR2 претерпевают конформационные изменения, которые приводят к аутофосфорилированию и активации JAK1 и JAK2. Это приводит к сигнальному каскаду и возможной транскрипции генов-мишеней. [ 12 ] Экспрессия 236 различных генов связана с передачей сигналов, опосредованной IFN типа II. Белки, экспрессируемые посредством IFN-опосредованной передачи сигналов типа II, в первую очередь участвуют в стимулировании воспалительных иммунных ответов и регуляции других клеточно-опосредованных иммунных ответов, таких как апоптоз , внутриклеточный IgG транспорт цитокинов , передача и продукция , гемопоэз , а также пролиферация и дифференцировка клеток . [ 14 ]
JAK-STAT путь
[ редактировать ]Одним из ключевых путей, запускаемых IFNG-связыванием IFNGR, является путь Янус-киназы, преобразователя сигнала и активатора транскрипции, чаще называемый путем JAK-STAT . В пути JAK-STAT активированные белки JAK1 и JAK2 регулируют фосфорилирование тирозина в факторах транскрипции STAT1 . Тирозины фосфорилируются в очень специфическом месте, что позволяет активированным белкам STAT1 взаимодействовать друг с другом, образуя гомодимеры STAT1-STAT1 . Затем гомодимеры STAT1-STAT1 могут проникнуть в ядро клетки. Затем они инициируют транскрипцию путем связывания с элементами сайта активации гамма-интерферона (GAS), [ 12 ] которые расположены в промоторной области интерферон-стимулируемых генов (ISG), которые экспрессируют противовирусные эффекторные белки, а также положительные и отрицательные регуляторы сигнальных путей IFN типа II. [ 25 ]

Белки JAK также приводят к активации фосфатидилинозитол-3-киназы ( PI3K ). PI3K приводит к активации протеинкиназы C дельта-типа ( PKC-δ ), которая фосфорилирует аминокислоту серин в факторах транскрипции STAT1. Фосфорилирование серина в гомодимерах STAT1-STAT1 необходимо для осуществления полного процесса транскрипции. [ 12 ]
Другие сигнальные пути
[ редактировать ]Другими сигнальными путями, которые запускаются IFNG, являются сигнальный путь mTOR , сигнальный путь MAPK и сигнальный путь PI3K/AKT . [ 14 ]
Биологическая активность
[ редактировать ]IFNG секретируется Т-хелперными клетками (в частности, клетками Th1 ), цитотоксическими Т-клетками (TC - клетками), макрофагами, эпителиальными клетками слизистой оболочки и NK-клетками . IFNG является одновременно важным аутокринным сигналом для профессиональных APC при раннем врожденном иммунном ответе и важным паракринным сигналом при адаптивном иммунном ответе. Экспрессия IFNG индуцируется цитокинами IL-12, IL-15, IL-18 и IFN типа I. [ 26 ] IFNG является единственным интерфероном типа II и серологически отличается от интерферонов типа I; он кислотолабилен, тогда как варианты типа I кислотоустойчивы. [ нужна ссылка ]
ИФНГ обладает противовирусными, иммунорегуляторными и противоопухолевыми свойствами. [ 27 ] Он изменяет транскрипцию до 30 генов, вызывая различные физиологические и клеточные реакции. Среди эффектов:
- Стимулирует NK-клеток активность [ 28 ]
- Повышает презентацию антигена и лизосомальную активность макрофагов .
- Активирует индуцибельную синтазу оксида азота (iNOS)
- Индуцирует выработку IgG2a и IgG3 активированными В-клетками плазмы.
- Вызывает в нормальных клетках увеличение экспрессии молекул MHC класса I , а также MHC класса II на антигенпрезентирующих клетках, в частности, посредством индукции генов процессинга антигенов , включая субъединицы иммунопротеасомы ( MECL1, LMP2, LMP7), а также TAP и ERAAP в дополнение, возможно, к прямой активации тяжелых цепей MHC и самого B2-микроглобулина.
- Способствует адгезии и связыванию, необходимым для лейкоцитов. миграции
- Индуцирует экспрессию внутренних защитных факторов — например, в отношении ретровирусов соответствующие гены включают TRIM5alpha , APOBEC и Tetherin , оказывающие непосредственное противовирусное действие.
- Направляет альвеолярные макрофаги против вторичных бактериальных инфекций. [ 29 ] [ 30 ]
IFNG является основным цитокином , который определяет клетки Th 1: клетки Th 1 секретируют IFNG, что, в свою очередь, вызывает появление большего количества недифференцированных CD4. + клетки (клетки Th0) для дифференцировки в клетки Th1 , [ 31 ] представляет собой петлю положительной обратной связи — при подавлении дифференцировки клеток Th2 . (Эквивалентные определяющие цитокины для других клеток включают IL-4 для клеток Th2 и IL-17 для клеток Th17 .)
NK-клетки и цитотоксические Т-клетки CD8+ также продуцируют ИФНГ. IFNG подавляет образование остеокластов за счет быстрого разрушения RANK адаптерного белка TRAF6 в сигнальном пути RANK - RANKL , что в противном случае стимулирует выработку NF-κB . [ нужна ссылка ]
Активность в формировании гранулем
[ редактировать ]Гранулема — это способ организма справиться с веществом, которое он не может удалить или стерилизовать. Инфекционные причины гранулем (инфекции обычно являются наиболее распространенной причиной гранулем) включают туберкулез , проказу , гистоплазмоз , криптококкоз , кокцидиоидомикоз , бластомикоз и токсоплазмоз. Примерами неинфекционных гранулематозных заболеваний являются саркоидоз , болезнь Крона , бериллиоз , гигантоклеточный артериит , гранулематоз с полиангиитом , эозинофильный гранулематоз с полиангиитом , легочные ревматоидные узелки , а также аспирация пищи и других твердых частиц в легкие. [ 32 ] В первую очередь здесь обсуждается инфекционная патофизиология гранулем. [ нужна ссылка ]
Ключевая связь между IFNG и гранулемами заключается в том, что IFNG активирует макрофаги, благодаря чему они становятся более мощными в уничтожении внутриклеточных организмов. [ 33 ] Активация макрофагов ИФНГ из микобактериальных хелперных клеток Th 1 при инфекциях позволяет макрофагам преодолеть ингибирование созревания фаголизосом, вызванное микобактериями (остаться живыми внутри макрофагов). [ 34 ] [ 35 ] Первыми шагами в формировании гранулем, индуцированных IFNG, являются активация хелперных клеток Th1 макрофагами, высвобождающими IL-1 и IL-12 в присутствии внутриклеточных патогенов, и презентация антигенов этих патогенов. Затем хелперные клетки Th1 агрегируют вокруг макрофагов и высвобождают IFNG, который активирует макрофаги. Дальнейшая активация макрофагов вызывает цикл дальнейшего уничтожения внутриклеточных бактерий и дальнейшего представления антигенов клеткам-хелперам Th 1 с дальнейшим высвобождением IFNG. Наконец, макрофаги окружают хелперные клетки Th1 и становятся фибробластоподобными клетками, защищающими инфекцию. [ нужна ссылка ]
Активность во время беременности
[ редактировать ]Естественные клетки-киллеры матки (NK) секретируют высокие уровни хемоаттрактантов , таких как IFNG у мышей. IFNG расширяет и истончает стенки материнских спиральных артерий, чтобы улучшить приток крови к месту имплантации . Это ремоделирование способствует развитию плаценты, поскольку она проникает в матку в поисках питательных веществ. Мыши с нокаутом IFNG не могут инициировать нормальную модификацию децидуальных артерий, вызванную беременностью. Эти модели демонстрируют аномально низкое количество клеток или некроз децидуальной оболочки. [ 36 ]
У людей повышенные уровни гамма-интерферона связаны с повышенным риском выкидыша. Корреляционные исследования выявили высокие уровни ИФНГ у женщин с историей самопроизвольного выкидыша по сравнению с женщинами, у которых в анамнезе не было самопроизвольных выкидышей. [ 37 ] Кроме того, низкий уровень ИФНГ связан с женщинами, которые успешно вынашивают ребенка. Возможно, ИФНГ цитотоксичен для трофобластов , что приводит к выкидышу. [ 38 ] Однако причинно-следственные исследования взаимосвязи между ИФНГ и выкидышем не проводились из-за этических ограничений . [ нужна ссылка ]
Производство
[ редактировать ]Рекомбинантный человеческий ИФНГ, как дорогой биофармацевтический препарат, экспрессируется в различных системах экспрессии, включая прокариотические, простейшие, грибковые (дрожжи), клетки растений, насекомых и млекопитающих. Человеческий IFNG обычно экспрессируется в Escherichia coli , продаваемой как ACTIMMUNE®, однако полученный продукт прокариотической системы экспрессии не гликозилируется и имеет короткий период полураспада в кровотоке после инъекции; процесс очистки от бактериальной системы экспрессии также очень дорог. Другие системы экспрессии, такие как Pichia Pastoris, не показали удовлетворительных результатов с точки зрения урожайности. [ 39 ] [ 40 ]
Терапевтическое использование
[ редактировать ]Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США одобрило интерферон гамма-1b для лечения хронической гранулематозной болезни. [ 41 ] (ХГД) и остеопетроз . [ 42 ] Механизм, посредством которого ИФНГ приносит пользу ХГД, заключается в повышении эффективности нейтрофилов против каталазоположительных бактерий путем коррекции окислительного метаболизма пациентов. [ 43 ]
Он не был одобрен для лечения идиопатического фиброза легких (ИЛФ). В 2002 году производитель InterMune выпустил пресс-релиз, в котором говорилось, что данные фазы III продемонстрировали улучшение выживаемости при ИЛФ и снижение смертности на 70% у пациентов с легкой и умеренной формой заболевания. Министерство юстиции США обвинило пресс-релиз в том, что он содержит ложные и вводящие в заблуждение утверждения. Исполнительный директор InterMune Скотт Харконен был обвинен в манипулировании данными судебного разбирательства, в 2009 году был признан виновным в мошенничестве с использованием электронных средств связи и приговорен к штрафам и общественным работам. Харконен обжаловал приговор в Апелляционном суде девятого округа США и проиграл. [ 44 ] 20 января 2021 года Харконен был полностью помилован. [ 45 ]
Предварительное исследование роли ИФНГ в лечении атаксии Фридрейха (ФА), проведенное Детской больницей Филадельфии, не выявило положительных эффектов при краткосрочном (<6 месяцев) лечении. [ 46 ] [ 47 ] [ 48 ] Однако исследователи в Турции обнаружили значительные улучшения в походке и осанке пациентов после 6 месяцев лечения. [ 49 ]
Хотя это официально не одобрено, гамма-интерферон также показал свою эффективность при лечении пациентов с атопическим дерматитом средней и тяжелой степени . [ 50 ] [ 51 ] [ 52 ] В частности, рекомбинантная терапия ИФНГ оказалась многообещающей у пациентов со сниженной экспрессией ИФНГ, например, у пациентов с предрасположенностью к вирусу простого герпеса, а также у пациентов детского возраста. [ 53 ]
Возможное использование в иммунотерапии.
[ редактировать ]IFNG усиливает антипролиферативное состояние раковых клеток, одновременно усиливая экспрессию MHC I и MHC II, что увеличивает иммунораспознавание и удаление патогенных клеток. [ 54 ] IFNG также уменьшает метастазирование в опухолях за счет повышения регуляции фибронектина , что отрицательно влияет на архитектуру опухоли. [ 55 ] Повышенные уровни мРНК IFNG в опухолях при постановке диагноза связаны с лучшим ответом на иммунотерапию. [ 56 ]
Иммунотерапия рака
[ редактировать ]Целью иммунотерапии рака является запуск иммунного ответа иммунных клеток пациента на атаку и уничтожение злокачественных (вызывающих рак) опухолевых клеток. Дефицит IFN типа II связан с несколькими типами рака, включая B-клеточную лимфому и рак легких. Кроме того, было обнаружено, что у пациентов, получавших препарат дурвалумаб для лечения немелкоклеточной карциномы легкого и переходно-клеточной карциномы, наблюдался более высокий уровень ответа на препарат, а препарат задерживал прогрессирование обоих типов рака на более длительный период времени. . Таким образом, было доказано, что содействие повышению регуляции IFN типа II является решающим фактором в создании эффективных методов иммунотерапии рака. [ 57 ]
ИФНГ еще не одобрен для применения в какой-либо иммунотерапии рака . Однако улучшение выживаемости наблюдалось при назначении ИФНГ пациентам с раком мочевого пузыря и меланомой . Наиболее многообещающий результат достигнут у пациенток со 2 и 3 стадией рака яичников . Напротив, было подчеркнуто: «Интерферон-γ, секретируемый CD8-позитивными лимфоцитами, активирует PD-L1 на клетках рака яичников и способствует росту опухоли». [ 58 ] Исследование ИФНГ в раковых клетках in vitro является более обширным, и результаты указывают на антипролиферативную активность ИФНГ, приводящую к ингибированию роста или гибели клеток, обычно индуцируемой апоптозом, но иногда и аутофагией . [ 39 ] Кроме того, сообщалось, что гликозилирование рекомбинантного , улучшает его терапевтическую эффективность по сравнению с негликозилированной формой , человеческого IFNG у млекопитающих, экспрессируемого в HEK293 которая экспрессируется в E. coli . [ 59 ]
Участие в противоопухолевом иммунитете
[ редактировать ]Интерферон типа II усиливает активность клеток Th1, цитотоксических Т-клеток и APC, что приводит к усилению иммунного ответа против клеток злокачественной опухоли, что приводит к апоптозу и некроптозу опухолевых клеток (гибель клеток). Кроме того, интерферон типа II подавляет активность регуляторных Т-клеток , которые отвечают за подавление иммунного ответа против патогенов, предотвращая дезактивацию иммунных клеток, участвующих в уничтожении опухолевых клеток. Интерферон типа II предотвращает деление опухолевых клеток, непосредственно воздействуя на опухолевые клетки, что приводит к усилению экспрессии белков, которые препятствуют продолжению клеточного цикла опухолевых клеток (т. е. остановке клеточного цикла). Интерферон типа II может также предотвращать рост опухоли, косвенно воздействуя на эндотелиальные клетки, выстилающие кровеносные сосуды вблизи места опухоли, перекрывая приток крови к опухолевым клеткам и, таким образом, обеспечивая поставку необходимых ресурсов для выживания и пролиферации опухолевых клеток. [ 57 ]
Барьеры
[ редактировать ]Важность IFN типа II в иммунотерапии рака признана; текущие исследования изучают влияние интерферона II типа на рак как в качестве самостоятельной формы лечения, так и в качестве формы лечения, назначаемой вместе с другими противораковыми препаратами. не одобрило IFN типа II Однако Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) для лечения рака, за исключением злокачественного остеопороза . Скорее всего, это связано с тем, что, хотя ИФН II типа участвует в противоопухолевом иммунитете, некоторые из его функций могут усиливать прогрессирование рака. Когда IFN типа II действует на опухолевые клетки, он может индуцировать экспрессию трансмембранного белка, известного как лиганд запрограммированной смерти 1 ( PDL1 ), который позволяет опухолевым клеткам уклоняться от атаки иммунных клеток. Передача сигналов, опосредованная IFN типа II, может также способствовать ангиогенезу (образованию новых кровеносных сосудов в месте опухоли) и пролиферации опухолевых клеток. [ 57 ]
Взаимодействия
[ редактировать ]Было показано, что интерферон гамма взаимодействует с рецептором интерферона гамма 1 и рецептором интерферона гамма 2 . [ 60 ] [ 61 ]
Болезни
[ редактировать ]Было показано, что гамма-интерферон играет решающую роль в иммунном ответе против некоторых внутриклеточных патогенов, включая болезнь Шагаса . [ 62 ] Также было установлено, что он играет роль в развитии себорейного дерматита. [ 63 ]
ИФНГ оказывает значительный противовирусный эффект при инфекции вируса простого герпеса I (ВПГ). IFNG повреждает микротрубочки , которые используют HSV для транспорта в ядро инфицированной клетки, подавляя способность HSV к репликации. [ 64 ] [ 65 ] Исследования на мышах герпеса, устойчивого к ацикловиру, показали, что лечение ИФНГ может значительно снизить вирусную нагрузку герпеса. Механизм, с помощью которого ИФНГ ингибирует размножение герпеса, не зависит от Т-клеток, а это означает, что ИФНГ может быть эффективным средством лечения людей с низким уровнем Т-клеток. [ 66 ] [ 67 ] [ 68 ]
На хламидийную инфекцию влияет IFNG в клетках-хозяевах. В эпителиальных клетках человека IFNG усиливает экспрессию индоламин-2,3-диоксигеназы , которая, в свою очередь, истощает запасы триптофана в организме хозяина и препятствует размножению хламидий. [ 69 ] [ 70 ] Кроме того, в эпителиальных клетках грызунов ИФНГ активирует ГТФазу , которая ингибирует пролиферацию хламидий. [ 71 ] Как в организме человека, так и в организме грызунов хламидии развили механизмы, позволяющие обойти негативные последствия поведения клеток-хозяев. [ 72 ]
Регулирование
[ редактировать ]Имеются доказательства того, что экспрессия гамма-интерферона регулируется псевдоузловатым элементом в его 5'-UTR . [ 73 ] Есть также свидетельства того, что гамма-интерферон регулируется прямо или косвенно микроРНК : миР-29. [ 74 ] Кроме того, есть доказательства того, что экспрессия гамма-интерферона регулируется через GAPDH в Т-клетках. Это взаимодействие происходит в 3'UTR, где связывание GAPDH предотвращает трансляцию последовательности мРНК. [ 75 ]
Ссылки
[ редактировать ]- ^ Перейти обратно: а б с GRCh38: Версия Ensembl 89: ENSG00000111537 – Ensembl , май 2017 г.
- ^ Перейти обратно: а б с GRCm38: выпуск Ensembl 89: ENSMUSG00000055170 – Ensembl , май 2017 г.
- ^ «Ссылка на Human PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Ссылка на Mouse PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ Грей П.В., Гёддель Д.В. (август 1982 г.). «Структура гена иммунного интерферона человека». Природа . 298 (5877): 859–863. Бибкод : 1982Natur.298..859G . дои : 10.1038/298859a0 . ПМИД 6180322 . S2CID 4275528 .
- ^ Уилок Э.Ф. (июль 1965 г.). «Ингибитор интерфероноподобного вируса, индуцируемый в лейкоцитах человека фитогемагглютинином». Наука . 149 (3681): 310–311. Бибкод : 1965Sci...149..310W . дои : 10.1126/science.149.3681.310 . ПМИД 17838106 . S2CID 1366348 .
- ^ Грин Дж.А., Купербэнд С.Р., Кибрик С. (июнь 1969 г.). «Иммунноспецифическая индукция продукции интерферона в культурах лимфоцитов крови человека». Наука . 164 (3886): 1415–1417. Бибкод : 1969Sci...164.1415G . дои : 10.1126/science.164.3886.1415 . ПМИД 5783715 . S2CID 32651832 .
- ^ Милстон Л.М., Ваксман Б.Х. (ноябрь 1970 г.). «Высвобождение ингибитора вируса из сенсибилизированных туберкулином клеток брюшины, стимулированное антигеном» . Журнал иммунологии . 105 (5): 1068–1071. дои : 10.4049/jimmunol.105.5.1068 . ПМИД 4321289 . S2CID 29861335 .
- ^ Нэйлор С.Л., Сакагути А.Ю., Шоу ТБ, Лоу М.Л., Гёддел Д.В., Грей П.В. (март 1983 г.). «Ген иммунного интерферона человека расположен на хромосоме 12» . Журнал экспериментальной медицины . 157 (3): 1020–1027. дои : 10.1084/jem.157.3.1020 . ПМК 2186972 . ПМИД 6403645 .
- ^ «Энтрез Ген: IFNGR2» .
- ^ Перейти обратно: а б Тау Дж., Ротман П. (декабрь 1999 г.). «Биологические функции рецепторов ИФН-гамма» . Аллергия . 54 (12): 1233–1251. дои : 10.1034/j.1398-9995.1999.00099.x . ПМЦ 4154595 . PMID 10688427 .
- ^ Перейти обратно: а б с д Платаниас LC (май 2005 г.). «Механизмы передачи сигналов, опосредованных интерфероном типа I и типа II» . Обзоры природы. Иммунология . 5 (5): 375–386. дои : 10.1038/nri1604 . ПМИД 15864272 . S2CID 1472195 .
- ^ Перейти обратно: а б с Кастро Ф., Кардозу А.П., Гонсалвес Р.М., Серр К., Оливейра М.Дж. (2018). «Интерферон-гамма на перекрестке иммунного надзора или уклонения от опухолей» . Границы в иммунологии . 9 : 847. дои : 10.3389/fimmu.2018.00847 . ПМЦ 5945880 . ПМИД 29780381 .
- ^ Перейти обратно: а б с д Бхат М.Ю., Соланки Х.С., Адвани Дж., Хан А.А., Кешава Прасад Т.С., Гауда Х. и др. (декабрь 2018 г.). «Комплексная сетевая карта гамма-сигнализации интерферона» . Журнал сотовой связи и сигнализации . 12 (4): 745–751. дои : 10.1007/s12079-018-0486-y . ПМК 6235777 . ПМИД 30191398 .
- ^ Ли Эй Джей, Ашкар А. А. (2018). «Двойная природа интерферонов типа I и типа II» . Границы в иммунологии . 9 : 2061. дои : 10.3389/fimmu.2018.02061 . ПМК 6141705 . ПМИД 30254639 .
- ^ «Энтрез Джин: ИНФГ» .
- ^ Шенборн-младший, Уилсон CB (2007). «Регуляция интерферона-γ во время врожденных и адаптивных иммунных реакций». Регуляция гамма-интерферона во время врожденных и адаптивных иммунных реакций . Достижения иммунологии. Том. 96. стр. 41–101. дои : 10.1016/S0065-2776(07)96002-2 . ISBN 978-0-12-373709-0 . ПМИД 17981204 .
- ^ Артис Д., Спитс Х. (январь 2015 г.). «Биология врожденных лимфоидных клеток». Природа . 517 (7534): 293–301. Бибкод : 2015Natur.517..293A . дои : 10.1038/nature14189 . ПМИД 25592534 . S2CID 4386692 .
- ^ Илик С.Е., Кук В.Дж., Виджай-Кумар С., Карсон М., Нагабхушан Т.Л., Тротта П.П. и др. (май 1991 г.). «Трехмерная структура рекомбинантного человеческого интерферона-гамма». Наука . 252 (5006): 698–702. Бибкод : 1991Sci...252..698E . дои : 10.1126/science.1902591 . ПМИД 1902591 .
- ^ Перейти обратно: а б с д и ПДБ : 1FG9 ; Тиль Д.Д., Ле Дю М.Х., Уолтер Р.Л., Д'Арси А., Шен С., Фунтулакис М. и др. (сентябрь 2000 г.). «Наблюдение неожиданной третьей молекулы рецептора в кристаллической структуре комплекса человеческого интерферона-гамма-рецептора» . Структура . 8 (9): 927–936. дои : 10.1016/S0969-2126(00)00184-2 . ПМИД 10986460 .
- ^ Ху Х, Ивашкив Л.Б. (октябрь 2009 г.). «Перекрестная регуляция сигнальных путей гамма-интерфероном: значение для иммунных реакций и аутоиммунных заболеваний» . Иммунитет . 31 (4): 539–550. doi : 10.1016/j.immuni.2009.09.002 . ПМЦ 2774226 . ПМИД 19833085 .
- ^ Перейти обратно: а б Садир Р., Форест Э., Лортат-Джейкоб Х. (май 1998 г.). «Последовательность, связывающая гепарансульфат гамма-интерферона, увеличивала скорость образования комплекса интерферон-гамма-интерферон-гамма-рецептор» . Журнал биологической химии . 273 (18): 10919–10925. дои : 10.1074/jbc.273.18.10919 . ПМИД 9556569 .
- ^ Ванхавербеке С., Симорре Дж.П., Садир Р., Ганс П., Лортат-Джейкоб Х. (ноябрь 2004 г.). «ЯМР-характеристика взаимодействия между С-концевым доменом гамма-интерферона и олигосахаридами, полученными из гепарина» . Биохимический журнал . 384 (Часть 1): 93–99. дои : 10.1042/BJ20040757 . ПМК 1134092 . ПМИД 15270718 .
- ^ Перейти обратно: а б Лортат-Джейкоб Х., Гримо Дж.А. (март 1991 г.). «Интерферон-гамма связывается с гепарансульфатом с помощью группы аминокислот, расположенной в С-концевой части молекулы» . Письма ФЭБС . 280 (1): 152–154. Бибкод : 1991FEBSL.280..152L . дои : 10.1016/0014-5793(91)80225-R . ПМИД 1901275 . S2CID 45942972 .
- ^ Шнайдер В.М., Чевиллотт, доктор медицины, Райс К.М. (21 марта 2014 г.). «Гены, стимулируемые интерфероном: сложная сеть защитных механизмов хозяина» . Ежегодный обзор иммунологии . 32 (1): 513–545. doi : 10.1146/annurev-immunol-032713-120231 . ПМЦ 4313732 . ПМИД 24555472 .
- ^ Кастро Ф., Кардозу А.П., Гонсалвес Р.М., Серр К., Оливейра М.Дж. (2018). «Интерферон-гамма на перекрестке иммунного надзора или уклонения от опухолей» . Границы в иммунологии . 9 : 847. дои : 10.3389/fimmu.2018.00847 . ПМЦ 5945880 . ПМИД 29780381 .
- ^ Шредер К., Герцог П.Дж., Раваси Т., Хьюм Д.А. (февраль 2004 г.). «Интерферон-гамма: обзор сигналов, механизмов и функций». Журнал биологии лейкоцитов . 75 (2): 163–189. дои : 10.1189/jlb.0603252 . ПМИД 14525967 . S2CID 15862242 .
- ^ Коневич Г.М., Вулетич А.М., Мирьячич Мартинович К.М., Ларсен А.К., Юришич В.Б. (май 2019 г.). «Роль цитокинов в регуляции NK-клеток в опухолевой среде». Цитокины . 117 : 30–40. дои : 10.1016/j.cyto.2019.02.001 . PMID 30784898 . S2CID 73482632 .
- ^ Хойер Ф.Ф., Наксерова К., Шлосс М.Дж., Хульсманс М., Наир А.В., Дутта П. и др. (ноябрь 2019 г.). «Тканеспецифическая реакция макрофагов на отдаленное повреждение влияет на результат последующего локального иммунного воздействия» . Иммунитет . 51 (5): 899–914.e7. doi : 10.1016/j.immuni.2019.10.010 . ПМК 6892583 . ПМИД 31732166 .
- ^ Яо Ю., Джеянатан М., Хаддади С., Барра Н.Г., Васеги-Шанджани М., Дамьянович Д. и др. (ноябрь 2018 г.). «Индукция альвеолярных макрофагов автономной памяти требует помощи Т-клеток и имеет решающее значение для тренированного иммунитета» . Ячейка 175 (6):1634–1650.e17. дои : 10.1016/j.cell.2018.09.042 . ПМИД 30433869 .
- ^ Лакхирам Р.В., Чжоу Р., Верма А.Д., Ся Б (2012). «CD4⁺T-клетки: дифференцировка и функции» . Клиническая и развивающая иммунология . 2012 : 925135. doi : 10.1155/2012/925135 . ПМЦ 3312336 . ПМИД 22474485 .
- ^ Мукхопадьяй С., Фарвер К.Ф., Васзар Л.Т., Демпси О.Дж., Поппер Х.Х., Мани Х. и др. (январь 2012 г.). «Причины легочных гранулем: ретроспективное исследование 500 случаев из семи стран». Журнал клинической патологии . 65 (1): 51–57. doi : 10.1136/jclinpath-2011-200336 . ПМИД 22011444 . S2CID 28504428 .
- ^ Ву С, Сюэ Ю, Ван П, Линь Л, Лю Ц, Ли Н и др. (сентябрь 2014 г.). «ИФН-γ стимулирует активацию макрофагов за счет увеличения гомолога фосфатазы и тензина посредством подавления миР-3473b» . Журнал иммунологии . 193 (6): 3036–3044. doi : 10.4049/jimmunol.1302379 . ПМИД 25092892 . S2CID 90897269 .
- ^ Хербст С., Шайбл У.Е., Шнайдер Б.Е. (май 2011 г.). «Макрофаги, активированные гамма-интерфероном, убивают микобактерии путем апоптоза, индуцированного оксидом азота» . ПЛОС ОДИН . 6 (5): e19105. Бибкод : 2011PLoSO...619105H . дои : 10.1371/journal.pone.0019105 . ПМК 3085516 . ПМИД 21559306 .
- ^ Харрис Дж., Мастер СС, Де Аро С.А., Дельгадо М., Робертс Э.А., Хоуп Дж.К. и др. (март 2009 г.). «Поляризация Th1-Th2 и аутофагия в контроле внутриклеточных микобактерий макрофагами» . Ветеринарная иммунология и иммунопатология . 128 (1–3): 37–43. дои : 10.1016/j.vetimm.2008.10.293 . ПМЦ 2789833 . ПМИД 19026454 .
- ^ Ашкар А.А., Ди Санто Дж.П., Крой Б.А. (июль 2000 г.). «Интерферон гамма способствует инициированию сосудистой модификации матки, целостности децидуальной ткани и созреванию естественных клеток-киллеров матки во время нормальной мышиной беременности» . Журнал экспериментальной медицины . 192 (2): 259–270. дои : 10.1084/jem.192.2.259 . ПМК 2193246 . ПМИД 10899912 .
- ^ Микаллеф А., Греч Н., Фарруджа Ф., Шембри-Висмайер П., Каллея-Агиус Дж. (январь 2014 г.). «Роль интерферонов на ранних сроках беременности». Гинекологическая эндокринология . 30 (1): 1–6. дои : 10.3109/09513590.2012.743011 . ПМИД 24188446 . S2CID 207489059 .
- ^ Берковиц Р.С., Хилл Дж.А., Курц CB, Андерсон DJ (январь 1988 г.). «Влияние продуктов активированных лейкоцитов (лимфокинов и монокинов) на рост злокачественных клеток трофобласта in vitro». Американский журнал акушерства и гинекологии . 158 (1): 199–203. дои : 10.1016/0002-9378(88)90810-1 . ПМИД 2447775 .
- ^ Перейти обратно: а б Разаги А., Оуэнс Л., Хейманн К. (декабрь 2016 г.). «Обзор рекомбинантного человеческого гамма-интерферона как иммунотерапевтического средства: влияние производственных платформ и гликозилирования». Журнал биотехнологии . 240 : 48–60. дои : 10.1016/j.jbiotec.2016.10.022 . ПМИД 27794496 .
- ^ Разаги А., Тан Э., Луа Л.Х., Оуэнс Л., Картикеян О.П., Хейманн К. (январь 2017 г.). «Является ли Pichia Pastoris реальной платформой для промышленного производства рекомбинантного человеческого гамма-интерферона?» . Биологические препараты 45 : 52–60. doi : 10.1016/j.biologicals.2016.09.015 . ПМИД 27810255 . S2CID 28204059 .
- ^ Тодд П.А., Гоа К.Л. (январь 1992 г.). «Интерферон гамма-1b. Обзор его фармакологии и терапевтического потенциала при хронической гранулематозной болезни». Наркотики . 43 (1): 111–122. дои : 10.2165/00003495-199243010-00008 . ПМИД 1372855 . S2CID 46986837 .
- ^ Ки Л.Л., Райс В.Л., Родригис Р.М., Хэтчер ХК (июль 1992 г.). «Гамма-терапия рекомбинантным человеческим интерфероном при остеопетрозе». Журнал педиатрии . 121 (1): 119–124. дои : 10.1016/s0022-3476(05)82557-0 . ПМИД 1320672 .
- ^ Errante PR, Frazão JB, Condino-Neto A (ноябрь 2008 г.). «Применение интерферон-гамма-терапии при хронической гранулематозной болезни». Недавние патенты на открытие противоинфекционных препаратов . 3 (3): 225–230. дои : 10.2174/157489108786242378 . ПМИД 18991804 .
- ^ Сильверман Э. (сентябрь 2013 г.). «Маркетинг лекарств. Граница между научной неопределенностью и продвижением змеиного масла». БМЖ . 347 : ф5687. дои : 10.1136/bmj.f5687 . ПМИД 24055923 . S2CID 27716008 .
- ^ «Заявление пресс-секретаря по поводу помилования» . Белый дом . 20 января 2021 г. – через Национальный архив .
- ^ Уэллс М., Сейер Л., Шадт К., Линч Д.Р. (декабрь 2015 г.). «ИФН-γ при атаксии Фридрейха: настоящие доказательства». Управление нейродегенеративными заболеваниями . 5 (6): 497–504. дои : 10.2217/nmt.15.52 . ПМИД 26634868 .
- ^ Сейер Л., Грили Н., Ферстер Д., Строузер С., Гелбард С., Донг Ю. и др. (июль 2015 г.). «Открытое пилотное исследование интерферона гамма-1b при атаксии Фридрейха» . Acta Neurologica Scandinavica . 132 (1): 7–15. дои : 10.1111/ane.12337 . ПМИД 25335475 . S2CID 207014054 .
- ^ Линч Д.Р., Хаузер Л., МакКормик А., Уэллс М., Донг Ю.Н., МакКормак С. и др. (март 2019 г.). «Рандомизированное двойное слепое плацебо-контролируемое исследование интерферона- γ 1b при атаксии Фридрейха» . Анналы клинической и трансляционной неврологии . 6 (3): 546–553. дои : 10.1002/acn3.731 . ПМК 6414489 . ПМИД 30911578 .
- ^ Йеткин М.Ф., Гюльтекин М. (декабрь 2020 г.). «Эффективность и переносимость гамма-интерферона при лечении атаксии Фридрейха: ретроспективное исследование» . Норо Псикиятри Арсиви . 57 (4): 270–273. дои : 10.29399/npa.25047 . ПМЦ 7735154 . ПМИД 33354116 .
- ^ Ахаван А, Рудикофф Д (июнь 2008 г.). «Атопический дерматит: системная иммуносупрессивная терапия». Семинары по кожной медицине и хирургии . 27 (2): 151–155. дои : 10.1016/j.sder.2008.04.004 . ПМИД 18620137 .
- ^ Шнайдер Л.К., Баз З., Зарконе С., Зураковски Д. (март 1998 г.). «Длительная терапия рекомбинантным интерфероном-гамма (риФН-гамма) при атопическом дерматите». Анналы аллергии, астмы и иммунологии . 80 (3): 263–268. дои : 10.1016/S1081-1206(10)62968-7 . ПМИД 9532976 .
- ^ Ханифин Дж.М., Шнайдер Л.К., Люнг Д.Ю., Эллис К.Н., Джаффе Х.С., Изу А.Е. и др. (февраль 1993 г.). «Рекомбинантный интерферон гамма-терапия при атопическом дерматите». Журнал Американской академии дерматологии . 28 (2 ч. 1): 189–197. дои : 10.1016/0190-9622(93)70026-п . ПМИД 8432915 .
- ^ Брар К., Люнг Д.Ю. (2016). «Последние соображения по использованию рекомбинантного гамма-интерферона для биологической терапии атопического дерматита» . Экспертное мнение о биологической терапии . 16 (4): 507–514. дои : 10.1517/14712598.2016.1135898 . ПМЦ 4985031 . ПМИД 26694988 .
- ^ Как Г, Раза М, Тивари Б.К. (май 2018 г.). «Интерферон-гамма (ИФН-γ): изучение его значения при инфекционных заболеваниях» . Биомолекулярные концепции . 9 (1): 64–79. дои : 10.1515/bmc-2018-0007 . ПМИД 29856726 . S2CID 46922378 .
- ^ Йоргованович Д., Сонг М., Ван Л., Чжан Юй (29 сентября 2020 г.). «Роль IFN-γ в прогрессировании и регрессии опухоли: обзор» . Биомаркерное исследование . 8 (1): 49. дои : 10.1186/s40364-020-00228-x . ПМЦ 7526126 . ПМИД 33005420 .
- ^ Касаррубиос М., Провенсио М., Надаль Э., Инса А., дель Росарио Гарсиа-Кампело М., Ласаро-Кинтела М. и др. (сентябрь 2022 г.). «Профили экспрессии генов микроокружения опухоли, связанные с полным патологическим ответом и прогрессированием заболевания у резектабельных пациентов с НМРЛ, получающих неоадъювантную химиоиммунотерапию» . Журнал иммунотерапии рака . 10 (9): e005320. doi : 10.1136/jitc-2022-005320 . HDL : 2445/190198 . ПМЦ 9528578 . ПМИД 36171009 .
- ^ Перейти обратно: а б с Ни Л, Лу Дж (сентябрь 2018 г.). «Интерферон гамма в иммунотерапии рака» . Раковая медицина . 7 (9): 4509–4516. дои : 10.1002/cam4.1700 . ПМК 6143921 . ПМИД 30039553 .
- ^ Абико К., Мацумура Н., Хаманиши Дж., Хорикава Н., Мураками Р., Ямагути К. и др. (апрель 2015 г.). «ИФН-γ из лимфоцитов индуцирует экспрессию PD-L1 и способствует прогрессированию рака яичников» . Британский журнал рака . 112 (9): 1501–1509. дои : 10.1038/bjc.2015.101 . ПМЦ 4453666 . ПМИД 25867264 .
- ^ Разаги А., Вильякрес С., Юнг В., Машкур Н., Батлер М., Оуэнс Л. и др. (октябрь 2017 г.). «Повышение терапевтической эффективности экспрессированного рекомбинантного гамма-интерферона млекопитающих против клеток рака яичников». Экспериментальные исследования клеток . 359 (1): 20–29. дои : 10.1016/j.yexcr.2017.08.014 . ПМИД 28803068 . S2CID 12800448 .
- ^ Тиль Д.Д., Ле Дю М.Х., Уолтер Р.Л., Д'Арси А., Шен С., Фунтулакис М. и др. (сентябрь 2000 г.). «Наблюдение неожиданной третьей молекулы рецептора в кристаллической структуре комплекса человеческого интерферона-гамма-рецептора» . Структура . 8 (9): 927–936. дои : 10.1016/S0969-2126(00)00184-2 . ПМИД 10986460 .
- ^ Котенко С.В., Изотова Л.С., Поллак Б.П., Мариано Т.М., Доннелли Р.Дж., Мутукумаран Г. и др. (сентябрь 1995 г.). «Взаимодействие между компонентами гамма-рецепторного комплекса интерферона» . Журнал биологической химии . 270 (36): 20915–20921. дои : 10.1074/jbc.270.36.20915 . ПМИД 7673114 .
- ^ Леон Родригес Д.А., Кармона Ф.Д., Эчеверриа Л.Е., Гонсалес К.И., Мартин Дж. (март 2016 г.). «Варианты гена IL18 влияют на восприимчивость к болезни Шагаса» . PLOS Забытые тропические болезни . 10 (3): e0004583. дои : 10.1371/journal.pntd.0004583 . ПМЦ 4814063 . ПМИД 27027876 .
- ^ Тшнадель-Гродска Е, Блашковски М, Ротштейн Х (ноябрь 2012 г.). «Исследование себорейного дерматита. Часть I. Роль отдельных цитокинов в патогенезе себорейного дерматита» . Достижения гигиены и экспериментальной медицины . 66 : 843–847. дои : 10.5604/17322693.1019642 . ПМИД 23175340 .
- ^ Бигли, Нью-Джерси (06 февраля 2014 г.). «Сложность взаимодействия интерферона-γ с ВПГ-1» . Границы в иммунологии . 5:15 . дои : 10.3389/fimmu.2014.00015 . ПМЦ 3915238 . ПМИД 24567732 .
- ^ Содейк Б., Эберсолд М.В., Хелениус А. (март 1997 г.). «Микротрубочки-опосредованный транспорт поступающих капсидов вируса простого герпеса 1 в ядро» . Журнал клеточной биологии . 136 (5): 1007–1021. дои : 10.1083/jcb.136.5.1007 . ПМК 2132479 . ПМИД 9060466 .
- ^ Хуан В.Ю., Су Ю.Х., Яо Х.В., Лин П., Тунг Ю.Й., Чен Ш. и др. (март 2010 г.). «Бета-интерферон в сочетании с гамма-интерфероном эффективно снижает инфекцию вируса простого герпеса, устойчивого к ацикловиру, у мышей независимым от Т-клеток способом» . Журнал общей вирусологии . 91 (Часть 3): 591–598. дои : 10.1099/vir.0.016964-0 . ПМИД 19906941 .
- ^ Сайнс Б., Хэлфорд В.П. (ноябрь 2002 г.). «Альфа/бета-интерферон и гамма-интерферон совместно подавляют репликацию вируса простого герпеса 1 типа» . Журнал вирусологии . 76 (22): 11541–11550. doi : 10.1128/JVI.76.22.11541-11550.2002 . ПМК 136787 . ПМИД 12388715 .
- ^ Ханна К.М., Леписто А.Дж., Декман В., Хендрикс Р.Л. (август 2004 г.). «Иммунный контроль вируса простого герпеса в латентном периоде». Современное мнение в иммунологии . 16 (4): 463–469. дои : 10.1016/j.coi.2004.05.003 . ПМИД 15245740 .
- ^ Роттенберг М.Е., Джильотти-Ротфукс А., Вигцелл Х. (август 2002 г.). «Роль ИФН-гамма в исходе хламидийной инфекции». Современное мнение в иммунологии . 14 (4): 444–451. дои : 10.1016/s0952-7915(02)00361-8 . ПМИД 12088678 .
- ^ Тейлор М.В., Фэн Г.С. (август 1991 г.). «Связь между гамма-интерфероном, индоламин-2,3-диоксигеназой и катаболизмом триптофана» . Журнал ФАСЭБ . 5 (11): 2516–2522. дои : 10.1096/fasebj.5.11.1907934 . ПМИД 1907934 . S2CID 25298471 .
- ^ Бернштейн-Хэнли И., Коерс Дж., Бальсара З.Р., Тейлор Г.А., Штарнбах М.Н., Дитрих В.Ф. (сентябрь 2006 г.). «P47 GTPases Igtp и Irgb10 картируются с локусом чувствительности Chlamydia trachomatis Ctrq-3 и опосредуют клеточную резистентность у мышей» . Труды Национальной академии наук Соединенных Штатов Америки . 103 (38): 14092–14097. Бибкод : 2006PNAS..10314092B . дои : 10.1073/pnas.0603338103 . ПМЦ 1599917 . ПМИД 16959883 .
- ^ Нельсон Д.Е., Вирок Д.П., Вуд Х., Рошик С., Джонсон Р.М., Уитмир В.М. и др. (июль 2005 г.). «Уклонение хламидий от IFN-гамма от иммунитета связано с тропизмом инфекции хозяина» . Труды Национальной академии наук Соединенных Штатов Америки . 102 (30): 10658–10663. Бибкод : 2005PNAS..10210658N . дои : 10.1073/pnas.0504198102 . ПМК 1180788 . ПМИД 16020528 .
- ^ Бен-Асули Ю., Банаи Ю., Пел-Ор Ю., Шир А., Кемпфер Р. (январь 2002 г.). «МРНК гамма-интерферона человека автоматически регулирует свою трансляцию через псевдоузел, который активирует индуцируемую интерфероном протеинкиназу PKR» . Клетка . 108 (2): 221–232. дои : 10.1016/S0092-8674(02)00616-5 . ПМИД 11832212 . S2CID 14722737 .
- ^ Асирватам А.Дж., Грегори С.Дж., Ху З., Магнер В.Дж., Томази Т.Б. (апрель 2008 г.). «МикроРНК нацелены на иммунные гены и компоненты механизмов Dicer/Argonaute и ARE» . Молекулярная иммунология . 45 (7): 1995–2006. дои : 10.1016/j.molimm.2007.10.035 . ПМЦ 2678893 . ПМИД 18061676 .
- ^ Чанг Ч., Кертис Дж.Д., Мэгги Л.Б., Фобер Б., Вилларино А.В., О'Салливан Д. и др. (июнь 2013 г.). «Посттранскрипционный контроль эффекторной функции Т-клеток посредством аэробного гликолиза» . Клетка . 153 (6): 1239–1251. дои : 10.1016/j.cell.2013.05.016 . ПМЦ 3804311 . ПМИД 23746840 .
Дальнейшее чтение
[ редактировать ]- Зал СК (1997). Переполох в крови: жизнь, смерть и иммунная система . Нью-Йорк: Генри Холт. ISBN 978-0-8050-5841-3 .
- Икеда Х., старый LJ, Шрайбер Р.Д. (апрель 2002 г.). «Роль гамма-интерферона в защите от развития опухолей и иммуноредактировании рака». Обзоры цитокинов и факторов роста . 13 (2): 95–109. дои : 10.1016/S1359-6101(01)00038-7 . ПМИД 11900986 .
- Чеслер Д.А., Рейсс CS (декабрь 2002 г.). «Роль ИФН-гамма в иммунных реакциях на вирусные инфекции центральной нервной системы». Обзоры цитокинов и факторов роста . 13 (6): 441–454. дои : 10.1016/S1359-6101(02)00044-8 . ПМИД 12401479 .
- Дессейн А., Куриба Б., Эбумбу С., Дессейн Х., Аргиро Л., Марке С. и др. (октябрь 2004 г.). «Интерлейкин-13 в коже и гамма-интерферон в печени играют ключевую роль в иммунной защите при шистосомозе человека». Иммунологические обзоры . 201 : 180–190. дои : 10.1111/j.0105-2896.2004.00195.x . ПМИД 15361241 . S2CID 25378236 .
- Джозеф А.М., Кумар М., Митра Д. (январь 2005 г.). «Нэф: «необходимый и принудительный фактор» при ВИЧ-инфекции». Текущие исследования ВИЧ . 3 (1): 87–94. дои : 10.2174/1570162052773013 . ПМИД 15638726 .
- Коупленд К.Ф. (декабрь 2005 г.). «Модуляция транскрипции ВИЧ-1 цитокинами и хемокинами». Мини-обзоры по медицинской химии . 5 (12): 1093–1101. дои : 10.2174/138955705774933383 . ПМИД 16375755 .
- Чиба Х., Кодзима Т., Осанаи М., Савада Н. (январь 2006 г.). «Значение интерферон-гамма-индуцированной интернализации белков с плотными соединениями при воспалительных заболеваниях кишечника». СТКЭ науки . 2006 (316): пе1. дои : 10.1126/stke.3162006pe1 . ПМИД 16391178 . S2CID 85320208 .
- Теллидес Г., Побер Дж.С. (март 2007 г.). «Интерферон-гамма-ось при атеросклерозе трансплантата». Исследование кровообращения . 100 (5): 622–632. CiteSeerX 10.1.1.495.2743 . дои : 10.1161/01.RES.0000258861.72279.29 . ПМИД 17363708 . S2CID 254247 .
Внешние ссылки
[ редактировать ]- Обзор всей структурной информации, доступной в PDB для UniProt : P01579 (гамма-интерферон) в PDBe-KB .
- Интерферон + Тип + II в Национальной медицинской библиотеке США по медицинским предметным рубрикам (MeSH)
- «Интерферон II типа» . Информационный портал о наркотиках . Национальная медицинская библиотека США.
Эта статья включает текст из Национальной медицинской библиотеки США , который находится в свободном доступе .