Ангиотензин-конвертирующий фермент
 Ангиотензин-конвертирующий фермент мономер, Drosophila melanogaster | |||
| Идентификаторы | |||
|---|---|---|---|
| ЕС №. | 3.4.15.1 | ||
| CAS №. | 9015-82-1 | ||
| Базы данных | |||
| Intenz | Intenz View | ||
| Бренда | Бренда вход | ||
| Расширение | Вид Nicezyme | ||
| Кегг | Кегг вход | ||
| Метатический | Метаболический путь | ||
| Напрямую | профиль | ||
| PDB Структуры | RCSB PDB PDBE PDBSUM | ||
| |||
| ТУЗ | |||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | Аз , ангиотензин I преобразующий фермент, ACE1, CD143, DCP, DCP1, ICH, MVCD3, ангиотензин-конвертирующий фермент | ||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | Омим : 106180 ; MGI : 87874 ; Гомологен : 37351 ; GeneCards : Ace ; OMA : Ace - ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Викидид | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
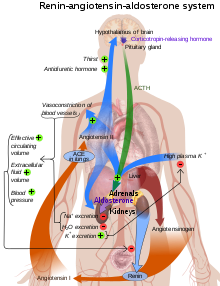
Ангиотензин-конвертирующий фермент ( EC 3.4.15.1 ), или ACE , является центральным компонентом системы ренин-ангиотензина (RAS), которая контролирует артериальное давление, регулируя объем жидкостей в организме. Он превращает гормон ангиотензин I в активное вазоконстриктор ангиотензин II . Следовательно, АПФ косвенно повышает кровяное давление, вызывая кровеносные сосуды сжимать. Ингибиторы АПФ широко используются в качестве фармацевтических препаратов для лечения сердечно -сосудистых заболеваний . [ 5 ]
Другими менее известными функциями ACE является деградация брадикинина , [ 6 ] вещество с [ 7 ] и амилоидный бета-белок . [ 8 ]
Номенклатура
[ редактировать ]ACE также известен под следующими именами:
- Дипептидил карбоксипептидаза i
- пептидаза р
- дипептидная гидролаза
- пептидилпептидаза
- Ангиотензин превращающий фермент
- Кинина II
- Ангиотензин I-конвертирующий фермент
- Карбоксикатепсин
- Дипептидил карбоксипептидаза
- «Гипертензин преобразующий фермент» пептидилпептидаза I
- пептидилдепептид гидролаза
- Пептидидипептидная гидролаза
- эндотелиальная пептидил дипептидаза
- пептидилпептидаза-4
- PDH
- Пептидилпептидная гидролаза
- DCP
- CD143
Функция
[ редактировать ]ЭЗ гидролизует пептиды путем удаления дипептида с С-конца. Аналогично он превращает неактивный декапептидный ангиотензин I в октапептидный ангиотензин II, удаляя дипептид His-Leu. [ 9 ]

ACE является центральным компонентом системы ренин -ангиотензина (RAS), которая контролирует артериальное давление, регулируя объем жидкостей в организме.

Ангиотензин II является мощным вазоконстриктором в зависимости от концентрации субстрата. [ 10 ] Ангиотензин II связывается с рецептором ангиотензина II типа 1 (AT1) , который устанавливает ряд действий, которые приводят к вазоконстрикции и, следовательно, повышению кровяного давления.
ACE также является частью системы Kinin -Kallikrein, где он разрушает брадикинин , мощный вазодилататор и другие вазоактивные пептиды. [ 12 ]
Кининаза II то же самое, что и ангиотензин-конвертирующий фермент. Таким образом, тот же фермент (туз), который генерирует вазоконстриктор (ANG II), также распоряжается вазодилататорами (брадикинином). [ 11 ]
Механизм
[ редактировать ]ACE - это цинковая металлопротеиназа . [ 13 ] Центр цинка катализирует гидролиз пептида. Отражая критическую роль цинка, ACE может быть ингибирован металлическими агентами. [ 14 ]

Остаток E384 механически критичен. Как общее основание, он депротонирует воду, связанную с цинком , производя нуклеофильный центр Zn-OH. Полученная группа аммония затем служит общей кислотой для расщепления связи CN. [ 16 ]
Функция иона хлорида очень сложна и широко обсуждается. Анионная активация хлоридом является характерной особенностью ACE. [ 17 ] Было экспериментально определено, что активация гидролиза хлоридом сильно зависит от субстрата. В то время как он увеличивает скорость гидролиза, например, хип-хип-лей, он ингибирует гидролиз других субстратов, таких как хип-ала-Pro. [ 16 ] В физиологических условиях фермент достигает около 60% своей максимальной активности в направлении ангиотензина I, пока он достигает своей полной активности в отношении брадикинина. Поэтому предполагается, что функция анионной активации в ACE обеспечивает высокую субстратную специфичность. [ 17 ] Другие теории говорят, что хлорид может просто стабилизировать общую структуру фермента. [ 16 ]
Генетика
[ редактировать ]Ген Ace, Ace , кодирует два изозима . Соматический изозим экспрессируется во многих тканях, в основном в легких, включая эндотелиальные клетки сосудов, эпителиальные почечные клетки и Leginking клетки Leydig , тогда как зародыш экспрессируется только в сперме . Ткань головного мозга имеет фермент ACE, который принимает участие в локальных Ras и преобразует Aβ42 (который агрегирует в бляшки) в Aβ40 (который, как считается, менее токсичная) формы бета -амилоида . Последнее является преимущественно функцией n доменной части на ферменте ACE. Ингибиторы АПФ, которые пересекают барьер кровавого мозга и имеют преимущественно выбранную N-концевую активность, могут, следовательно, могут вызвать накопление Aβ42 и прогрессирование деменции. [ Цитация необходима ]
Актуальность заболевания
[ редактировать ]Ингибиторы АПФ широко используются в качестве фармацевтических препаратов при лечении таких состояний, как высокое кровяное давление , сердечная недостаточность , диабетическая нефропатия и сахарный диабет 2 типа .
Ингибиторы ACE ингибируют ACE конкурентно. [ 18 ] Это приводит к снижению образования ангиотензина II и снижению метаболизма брадекинина , что приводит к систематическому расширению артерий и вен и снижению артериального давления артерии. Кроме того, ингибирование образования ангиотензина II уменьшает ангиотензин-опосредованную секрецию альдостерона из коры надпочечников , что приводит к снижению реабсорбции воды и натрия и снижению внеклеточного объема. [ 19 ]
Эффект Эйса на болезнь Альцгеймера до сих пор обсуждается. Пациенты с болезнью Альцгеймера обычно демонстрируют более высокие уровни ACE в своем мозге. Некоторые исследования показывают, что ингибиторы АПФ, способные проходить кровь-мозговой барьер (BBB), могут усилить активность основных амилоид-бета-пептидных ферментов, таких как неприлизин в мозге, приводящих к более медленному развитию болезни Альцгеймера. [ 20 ] Более поздние исследования показывают, что ингибиторы АПФ могут снизить риск болезни Альцгеймера в отсутствие аллелей аполипопротеинов E4 (APOE4) , но не будут влиять на носители APOE4. [ 21 ] Еще одна более недавняя гипотеза заключается в том, что более высокие уровни АПФ могут предотвратить болезнь Альцгеймера. Предполагается, что туз может разлагать бета-амилоид в кровеносных сосудах головного мозга и, следовательно, помогает предотвратить прогрессирование заболевания. [ 22 ]
отрицательная корреляция между частотой D-аллель ACE1 и распространенностью и смертностью COVID-19 . Была установлена [ 23 ]
Патология
[ редактировать ]- Повышенные уровни АПФ также обнаруживаются при саркоидозе и используются для диагностики и мониторинга этого заболевания. Повышенные уровни АПФ также обнаруживаются при проказе , гипертиреозе , островом гепатите , первичном билиарном циррозе , сахарном диабете , множественном миеломе , остеоартрите , амилоидозе , болезне Гаушера , пневмокониозе , хемоплазмозе и туберкулезе мили . Это также отмечено у некоторых пациентов с обширным псориазом.
- Уровни в сыворотке снижаются при заболевании почек , обструктивной болезни легких и гипотиреозе .
Влияние на спортивные результаты
[ редактировать ]Ген ангиотензина, преобразовавший фермент, имеет более 160 полиморфизмов, описанных по состоянию на 2018 год. [ 24 ]
Исследования показали, что различные генотипы ангиотензинного фермента могут привести к различному влиянию на спортивные показатели. [ 25 ] [ 26 ]
Полиморфизм I/D RS1799752 состоит из вставки (I) или отсутствия (D) пары аланиновой пары базы 287 в интроне 16 гена. [ 24 ] Генотип DD связан с более высокими уровнями в плазме белка ACE, генотипом DI с промежуточными уровнями и II с более низкими уровнями. [ 24 ] Во время физических упражнений, из-за более высоких уровней ACE для носителей D-аллелей, следовательно, более высокая способность производить ангиотензин II, кровяное давление увеличится раньше, чем для носителей I-аллелей. Это приводит к более низкой максимальной частоте сердечных сокращений и более низкому максимальному поглощению кислорода (VO 2MAX ). Следовательно, носители D-аллеля имеют повышенный риск сердечно-сосудистых заболеваний на 10%. Кроме того, D-Аллель связан с большим увеличением роста левого желудочка в ответ на тренировки по сравнению с I-аллелой. [ 27 ] С другой стороны, носители I-аллеля обычно показывают увеличенную максимальную частоту сердечных сокращений из-за более низких уровней ACE, более высокого максимального поглощения кислорода и, следовательно, демонстрируют повышенную производительность выносливости. [ 27 ] Аллель I найден с повышенной частотой у бегунов, гребцов и велосипедистов элиты. Плотки на коротких расстояниях показывают повышенную частоту D-аллеля, поскольку их дисциплина больше зависит от силы, чем на выносливость. [ 28 ] [ 29 ]
История
[ редактировать ]В 1956 году об ферменте сообщил Леонард Т. Скеггс -младший. [ 30 ] Кристаллическая структура человеческого яичка была решена в 2002 году Раманатаном Натехом, Сильвой Швагером и Эдвардом Старроком в лаборатории К. Рави Ачарья. [ 15 ] Он расположен в основном в капиллярах легких, но также может быть обнаружен в эндотелиальных и эпителиальных клетках почек . [ 31 ]
Смотрите также
[ редактировать ]- Ингибиторы АПФ
- Ангиотензин-конвертирующий фермент 2 (ACE2)
- Гипотензивная реакция переливания
- Ренин -ангиотензиновая система
Ссылки
[ редактировать ]- ^ Подпрыгнуть до: а беременный в GRCH38: Ensembl Release 89: ENSG00000159640 - ENSEMBL , май 2017 г.
- ^ Подпрыгнуть до: а беременный в GRCM38: Ensembl Release 89: ENSMUSG00000020681 - Ensembl , май 2017 г.
- ^ «Человеческая PubMed ссылка:» . Национальный центр информации о биотехнологии, Национальная медицина США .
- ^ «Мышь Pubmed ссылка:» . Национальный центр информации о биотехнологии, Национальная медицина США .
- ^ Основы Каплана сердечной анестезии . Elsevier. 2018. DOI : 10.1016/C2012-0-06151-0 . ISBN 978-0-323-49798-5 Полем
Механизмы действия: ингибиторы ACE действуют, ингибируя одну из нескольких протеаз, ответственных за расщепление декапептида Ang I, чтобы сформировать октапептид ANG II. Поскольку ACE также является ферментом, который деградирует брадикинин, ингибиторы ACE увеличивают циркулирующие и уровни ткани брадикинина (рис. 8.4).
- ^ Филди П.П. (2015). ACEI и ARBS в гипертонии и сердечной недостаточности . Тол. 5. Швейцария: Springer International Publishing. С. 10–13. ISBN 978-3-319-09787-9 .
- ^ Dicpinigaitis PV (январь 2006 г.). «Ангиотензин-ревертирующий фермент индуцированный ингибитор кашель: Руководство по клинической практике на основе фактических данных ACCP». Грудь . 129 (1 Suppl): 169S - 173S. doi : 10.1378/грудь.129.1_suppl.169s . PMID 16428706 .
- ^ Hemming ML, Selkoe DJ (ноябрь 2005 г.). «Амилоидный бета-белок деградируется клеточным ангиотензином-конвертирующим ферментом (ACE) и повышается ингибитором ACE» . Журнал биологической химии . 280 (45): 37644–37650. doi : 10.1074/jbc.m508460200 . PMC 2409196 . PMID 16154999 .
- ^ Коутс D (июнь 2003 г.). «Ангиотензин превращающий фермент (туз)». Международный журнал биохимии и клеточной биологии . Ренин -ангиотензиновые системы: состояние искусства. 35 (6): 769–773. doi : 10.1016/s1357-2725 (02) 00309-6 . PMID 12676162 .
- ^ Zhang R, Xu X, Chen T, Li L, Rao P (май 2000). «Анализ на ангиотензин-ревертирующий фермент с использованием электрофореза капиллярной зоны» . Аналитическая биохимия . 280 (2): 286–290. doi : 10.1006/abio.2000.4535 . PMID 10790312 .
- ^ Подпрыгнуть до: а беременный «Интеграция соли и водного баланса». Медицинская физиология: клеточный и молекулярный подход . Филадельфия, Пенсильвания: Elsevier Saunders. 2005. С. 866–867. ISBN 978-1-4160-2328-9 .
- ^ Imig JD (март 2004 г.). «Ингибирование ACE и опосредованные брадикинином почечные сосудистые реакции: вовлечение EDHF» . Гипертония . 43 (3): 533–535. doi : 10.1161/01.hyp.0000118054.86193.ce . PMID 14757781 .
- ^ Ван В., Маккинни С.М., Фархан М., Пол М., Макдональд Т., Маклин Б. и др. (Август 2016 г.). «Ангиотензин-конвертирующий фермент 2 метаболизирует и частично инактивирует PYR-апелин-13 и апелин-17: физиологические эффекты в сердечно-сосудистой системе» . Гипертония . 68 (2): 365–377. doi : 10.1161/hypertensionaha.115.06892 . PMID 27217402 . S2CID 829514 .
- ^ Bünning P, Riordan JF (июль 1985 г.). «Функциональная роль цинка в ангиотензинном ферменте: последствия для механизма фермента». Журнал неорганической биохимии . 24 (3): 183–198. doi : 10.1016/0162-0134 (85) 85002-9 . PMID 2995578 .
- ^ Подпрыгнуть до: а беременный Natesh R, Schwager SL, Sturrock ED, Acharya KR (январь 2003 г.). «Кристаллическая структура комплекса фермента-лизиноприла, конвертирующего ангиотензина,» . Природа . 421 (6922): 551–554. Bibcode : 2003natur.421..551n . doi : 10.1038/nature01370 . PMID 12540854 . S2CID 4137382 . Архивировано из оригинала 26 ноября 2022 года . Получено 22 мая 2020 года .
- ^ Подпрыгнуть до: а беременный в Zhang C, Wu S, Xu D (июнь 2013 г.). «Каталитический механизм ангиотензин-конвертационного фермента и эффекты хлоридного иона». Журнал физической химии б . 117 (22): 6635–6645. doi : 10.1021/jp400974n . PMID 23672666 .
- ^ Подпрыгнуть до: а беременный Бюннинг П. (1983). «Каталитический механизм ангиотензинного фермента». Клиническая и экспериментальная гипертония. Часть A, теория и практика . 5 (7–8): 1263–1275. doi : 10.3109/10641968309048856 . PMID 6315268 .
- ^ «Ангиотензиновые ингибиторы преобразования (ACE)» (PDF) . Британское общество гипертонии . Архивировано из оригинала (PDF) 18 ноября 2017 года.
- ^ Klabunde re. «Ингибиторы ACE» . Концепции сердечно -сосудистой фармакологии . cvpharmacology.com. Архивировано из оригинала 2 февраля 2009 года . Получено 26 марта 2009 года .
- ^ «Важность лечения артериального давления: ингибиторы АПФ могут замедлить болезнь Альцгеймера» . Medscape . Medscape Cardiology. 2004. Архивировано из оригинала 31 августа 2016 года . Получено 1 марта 2016 года .
- ^ Qiu WQ, Mwamburi M, Besser LM, Zhu H, Li H, Wallack M, et al. (1 января 2013 г.). «Ингибиторы ангиотензинного фермента и снижение риска болезни Альцгеймера в отсутствие аллеля аполипопротеина E4» . Журнал болезни Альцгеймера . 37 (2): 421–428. doi : 10.3233/jad-130716 . PMC 3972060 . PMID 23948883 .
- ^ «Фермент ACE может усилить иммунные ответы и предотвратить болезнь Альцгеймера» . Science 2.0 . 27 августа 2014 года. Архивировано с оригинала 7 марта 2016 года . Получено 1 марта 2016 года .
- ^ Delanghe Jr, Speeckaert MM, De Buyzere ML (июнь 2020 г.). «Полиморфизм ангиотензин-ангиотензин-конвертирующий фермент может объяснить эпидемиологические результаты при инфекциях Covid-19» . Clinica Chimica Acta; Международный журнал клинической химии . 505 : 192–193. doi : 10.1016/j.cca.2020.03.031 . PMC 7102561 . PMID 32220422 .
- ^ Подпрыгнуть до: а беременный в Cintra MT, Balarin MA, Tanaka SC, Silva VI, Marqui AB, Resende EA, et al. (Ноябрь 2018). «Синдром поликистозных яичников: RS1799752 полиморфизм гена ACE» . Журнал бразильской медицинской ассоциации . 64 (11): 1017–1022. Doi : 10.1590/1806-9282.64.11.1017 . PMID 30570054 .
- ^ Flück M, Kramer M, Fitze DP, Kasper S, Franchi MV, Valdivieso P (8 мая 2019 г.). «Клеточные аспекты специализации мышц демонстрируют эффекты взаимодействия генотипа - фенотипа у спортсменов» . Границы в физиологии . 10 : 526. doi : 10.3389/fphys.2019.00526 . PMC 6518954 . PMID 31139091 .
- ^ Ван П., Федорук М.Н., Руперт Дж.Л. (2008). «Не отставая от ACE: являются ли ингибиторы ACE и антагонисты рецепторов ангиотензина II типа 1 потенциальные допинг -агенты?». Спортивная медицина . 38 (12): 1065–1079. doi : 10.2165/00007256-200838120-00008 . PMID 19026021 . S2CID 7614657 .
- ^ Подпрыгнуть до: а беременный Montgomery HE, Clarkson P, Dollery CM, Prasad K, Losi MA, Hemingway H, et al. (Август 1997). «Ассоциация ангиотензин-конвертирующего ферментного гена I/D полиморфизма с изменением массы левого желудочка в ответ на физическую тренировку». Циркуляция . 96 (3): 741–747. doi : 10.1161/01.cir.96.3.741 . PMID 9264477 .
- ^ Сандерс Дж., Монтгомери Х, Вудс Д. (2001). «Адаптация сердца к физической подготовке» [сердечный ответ на физическую подготовку] (PDF) . Немецкий журнал спортивной медицины (на немецком языке). 52 (3): 86–92. Архивировано (PDF) из оригинала 8 марта 2016 года . Получено 1 марта 2016 года .
- ^ Коста А.М., Сильва А.Дж., Гарридо Н.Д., Лоро Х., Де Оливейра Р.Дж., Брейтенфельд Л (август 2009 г.). «Ассоциация между аллелем Ace D и элитным коротким расстоянием». Европейский журнал прикладной физиологии . 106 (6): 785–790. doi : 10.1007/s00421-009-1080-z . HDL : 10400.15/3565 . PMID 19458960 . S2CID 21167767 .
- ^ Skeggs LT, Kahn Jr, Shumway NP (март 1956 г.). «Приготовление и функция фермента, конвертирующего гипертензин» . Журнал экспериментальной медицины . 103 (3): 295–299. doi : 10.1084/jem.103.3.295 . PMC 2136590 . PMID 13295487 .
- ^ Kierszenbaum, Abraham L. (2007). Гистология и клеточная биология: введение в патологию . Mosby Elsevier. ISBN 978-0-323-04527-8 .
Дальнейшее чтение
[ редактировать ]- Niu T, Chen X, Xu X (2002). «Ангиотензин преобразующий фермент вставка/делеция полиморфизма и сердечно -сосудистых заболеваний: терапевтические последствия». Наркотики . 62 (7): 977–993. doi : 10.2165/00003495-200262070-00001 . PMID 11985486 . S2CID 46986772 .
- Roĭtberg GE, Tikhonravov AV, Dorosh ZV (2004). "Rol' polimorfizma gena angiotenzinprevrashchaiushchego fermenta v razvitii metabolicheskogo sindroma" [Role of angiotensin-converting enzyme gene polymorphism in the development of metabolic syndrome]. Terapevticheskii Arkhiv (in Russian). 75 (12): 72–77. PMID 14959477 .
- Vynohradova SV (2005). «Роль ангиотензин-конвертирующего гена фермента I/D полиморфизм в развитии метаболических нарушений у пациентов с сердечно-сосудистой патологией]». Tsitologiia I Genetika . 39 (1): 63–70. PMID 16018179 .
- Кениг С., Лугер Т.А., Шолзен Т.Е. (октябрь 2006 г.). «Мониторинг нейропептид-специфических протеаз: обработка пропиомеланокортиновых пептидов адренокортикотропин и альфа-меланоцит-стимулирующий гормон в коже» . Экспериментальная дерматология . 15 (10): 751–761. doi : 10.1111/j.1600-0625.2006.00472.x . PMID 16984256 . S2CID 32034934 .
- Саббах А.С., Оток З.К., Махфуд Зр, Заатари Г.С., Махфуз Р.А. (март 2007 г.). «Полиморфизм гена ангиотензина и частоты аллелей в ливанской популяции: распространенность и обзор литературы». Молекулярная биология отчетов . 34 (1): 47–52. doi : 10.1007/s11033-006-9013-y . PMID 17103020 . S2CID 9939390 .
- Castellon R, Hamdi HK (2007). «Демистификация полиморфизма ACE: от генетики до биологии». Текущий фармацевтический дизайн . 13 (12): 1191–1198. doi : 10.2174/138161207780618902 . PMID 17504229 .
- Lazartigues E, Feng Y, Lavoie JL (2007). «Две грани тканевых ренин-ангиотензиновых систем: значение при сердечно-сосудистых заболеваниях». Текущий фармацевтический дизайн . 13 (12): 1231–1245. doi : 10.2174/138161207780618911 . PMID 17504232 .
Внешние ссылки
[ редактировать ]- Протеопедия ангиотензин- конвертинг
- Ангиотензин+преобразование+фермент в Национальной библиотеке медицины Медицинской библиотеки США (Mesh)
- человеческого генома Расположение генома и страница детали гена Ace в браузере UCSC Genome .