Генная терапия
| Часть серии на |
| Генетическая инженерия |
|---|
 |
| Генетически модифицированные организмы |
| История и регулирование |
| Процесс |
| Applications |
| Controversies |
Генная терапия - это медицинская технология , которая направлена на создание терапевтического эффекта посредством манипулирования экспрессией генов или путем изменения биологических свойств живых клеток. [ 1 ] [ 2 ] [ 3 ]
Первая попытка модифицировать ДНК человека была выполнена в 1980 году Мартином Клайном , но первый успешный передача ядерного гена у людей, одобренный Национальным институтом здравоохранения , была выполнена в мае 1989 года. [ 4 ] Первое терапевтическое использование переноса генов, а также первую прямую вставку ДНК человека в ядерный геном был проведен французским Андерсоном в ходе исследования, начиная с сентября 1990 года. В период с 1989 по декабрь 2018 года было проведено более 2900 клинических испытаний, с более чем, чем, чем более чем, чем больше, чем, чем больше, чем чем половина из них на фазе I. [ 5 ] В 2003 году гендицина стала первой генной терапией, получившей одобрение регулятора. Since that time, further gene therapy drugs were approved, such as alipogene tiparvovec (2012), Strimvelis (2016), tisagenlecleucel (2017), voretigene neparvovec (2017), patisiran (2018), onasemnogene abeparvovec (2019), idecabtagene vicleucel (2021 ), Надофараген FiradeNovec , Valoctocogene roxaparvovec и Etranacogene dezaparvovec (все 2022). В большинстве из этих подходов используются адено, ассоциированные с вирусами (AAV), и лентивирусы для выполнения вставки генов, in vivo и ex vivo , соответственно. AAV характеризуются путем стабилизации вирусного капсида , более низкой иммуногенности, способности трансдуцировать как делящие, так и невидимые клетки, потенциал для специфической интеграции сайтов и достижения долгосрочной экспрессии в лечении in vivo. [6] ASO / siRNA approaches such as those conducted by Alnylam and Ionis Pharmaceuticals require non-viral delivery systems, and utilize alternative mechanisms for trafficking to liver cells by way of GalNAc transporters.
Not all medical procedures that introduce alterations to a patient's genetic makeup can be considered gene therapy. Bone marrow transplantation and organ transplants in general have been found to introduce foreign DNA into patients.[7]
Background
[edit]Gene therapy was first conceptualized in the 1960s, when the feasibility of adding new genetic functions to mammalian cells began to be researched. Several methods to do so were tested, including injecting genes with a micropipette directly into a living mammalian cell, and exposing cells to a precipitate of DNA that contained the desired genes. Scientists theorized that a virus could also be used as a vehicle, or vector, to deliver new genes into cells.
One of the first scientists to report the successful direct incorporation of functional DNA into a mammalian cell was biochemist Dr. Lorraine Marquardt Kraus (6 September 1922 – 1 July 2016)[8] at the University of Tennessee Health Science Center in Memphis, Tennessee. In 1961, she managed to genetically alter the hemoglobin of cells from bone marrow taken from a patient with sickle cell anaemia. She did this by incubating the patient's cells in tissue culture with DNA extracted from a donor with normal hemoglobin. In 1968, researchers Theodore Friedmann, Jay Seegmiller, and John Subak-Sharpe at the National Institutes of Health (NIH), Bethesda, in the United States successfully corrected genetic defects associated with Lesch-Nyhan syndrome, a debilitating neurological disease, by adding foreign DNA to cultured cells collected from patients suffering from the disease.[9]
The first attempt, an unsuccessful one, at gene therapy (as well as the first case of medical transfer of foreign genes into humans not counting organ transplantation) was performed by geneticist Martin Cline of the University of California, Los Angeles in California, United States on 10 July 1980.[10][11] Cline claimed that one of the genes in his patients was active six months later, though he never published this data or had it verified.[12]
After extensive research on animals throughout the 1980s and a 1989 bacterial gene tagging trial on humans, the first gene therapy widely accepted as a success was demonstrated in a trial that started on 14 September 1990, when Ashanthi DeSilva was treated for ADA-SCID.[13]
The first somatic treatment that produced a permanent genetic change was initiated in 1993.[14] The goal was to cure malignant brain tumors by using recombinant DNA to transfer a gene making the tumor cells sensitive to a drug that in turn would cause the tumor cells to die.[15]
The polymers are either translated into proteins, interfere with target gene expression, or possibly correct genetic mutations. The most common form uses DNA that encodes a functional, therapeutic gene to replace a mutated gene. The polymer molecule is packaged within a "vector", which carries the molecule inside cells.[medical citation needed]
Early clinical failures led to dismissals of gene therapy. Clinical successes since 2006 regained researchers' attention, although as of 2014[update], it was still largely an experimental technique.[16] These include treatment of retinal diseases Leber's congenital amaurosis[17][18][19][20] and choroideremia,[21] X-linked SCID,[22] ADA-SCID,[23][24] adrenoleukodystrophy,[25] chronic lymphocytic leukemia (CLL),[26] acute lymphocytic leukemia (ALL),[27] multiple myeloma,[28] haemophilia,[24] and Parkinson's disease.[29] Between 2013 and April 2014, US companies invested over $600 million in the field.[30]
The first commercial gene therapy, Gendicine, was approved in China in 2003, for the treatment of certain cancers.[31] In 2011, Neovasculgen was registered in Russia as the first-in-class gene-therapy drug for treatment of peripheral artery disease, including critical limb ischemia.[32] In 2012, alipogene tiparvovec, a treatment for a rare inherited disorder, lipoprotein lipase deficiency, became the first treatment to be approved for clinical use in either the European Union or the United States after its endorsement by the European Commission.[16][33]
Following early advances in genetic engineering of bacteria, cells, and small animals, scientists started considering how to apply it to medicine. Two main approaches were considered – replacing or disrupting defective genes.[34] Scientists focused on diseases caused by single-gene defects, such as cystic fibrosis, haemophilia, muscular dystrophy, thalassemia, and sickle cell anemia. alipogene tiparvovec treats one such disease, caused by a defect in lipoprotein lipase.[33]
DNA must be administered, reach the damaged cells, enter the cell and either express or disrupt a protein.[35] Multiple delivery techniques have been explored. The initial approach incorporated DNA into an engineered virus to deliver the DNA into a chromosome.[36][37] Naked DNA approaches have also been explored, especially in the context of vaccine development.[38]
Generally, efforts focused on administering a gene that causes a needed protein to be expressed. More recently, increased understanding of nuclease function has led to more direct DNA editing, using techniques such as zinc finger nucleases and CRISPR. The vector incorporates genes into chromosomes. The expressed nucleases then knock out and replace genes in the chromosome. As of 2014[update] these approaches involve removing cells from patients, editing a chromosome and returning the transformed cells to patients.[39]
Gene editing is a potential approach to alter the human genome to treat genetic diseases,[40] viral diseases,[41] and cancer.[42][43] As of 2020[update] these approaches are being studied in clinical trials.[44][45]
Classification
[edit]Breadth of definition
[edit]
In 1986, a meeting at the Institute Of Medicine defined gene therapy as the addition or replacement of a gene in a targeted cell type. In the same year, the FDA announced that it had jurisdiction over approving "gene therapy" without defining the term. The FDA added a very broad definition in 1993 of any treatment that would 'modify or manipulate the expression of genetic material or to alter the biological properties of living cells'. In 2018 this was narrowed to 'products that mediate their effects by transcription or translation of transferred genetic material or by specifically altering host (human) genetic sequences'.[46]
Writing in 2018, in the Journal of Law and the Biosciences, Sherkow et al. argued for a narrower definition of gene therapy than the FDA's in light of new technology that would consist of any treatment that intentionally and permanently modified a cell's genome, with the definition of genome including episomes outside the nucleus but excluding changes due to episomes that are lost over time. This definition would also exclude introducing cells that did not derive from a patient themselves, but include ex vivo approaches, and would not depend on the vector used.[46]
During the COVID-19 pandemic, some academics insisted that the mRNA vaccines for COVID were not gene therapy to prevent the spread of incorrect information that the vaccine could alter DNA, other academics maintained that the vaccines were a gene therapy because they introduced genetic material into a cell.[47] Fact-checkers, such as Full Fact,[48] Reuters,[49] PolitiFact,[50] and FactCheck.org[51] said that calling the vaccines a gene therapy was incorrect. Podcast host Joe Rogan was criticized for calling mRNA vaccines gene therapy as was British politician Andrew Bridgen, with fact checker Full Fact calling for Bridgen to be removed from the conservative party for this and other statements.[52][53]
Genes present or added
[edit]Gene therapy encapsulates many forms of adding different nucleic acids to a cell. Gene augmentation adds a new protein coding gene to a cell. One form of gene augmentiation is gene replacement therapy, a treatment for monogenic recessive disorders where a single gene is not functional an additional functional gene is added. For diseases caused by multiple genes or a dominant gene, gene silencing or gene editing approaches are more appropriate but gene addition, a form of gene augmentation where new gene is added, may improve a cells function without modifying the genes that cause a disorder.[54]: 117
Cell types
[edit]Gene therapy may be classified into two types by the type of cell it affects: somatic cell and germline gene therapy.
In somatic cell gene therapy (SCGT), the therapeutic genes are transferred into any cell other than a gamete, germ cell, gametocyte, or undifferentiated stem cell. Any such modifications affect the individual patient only, and are not inherited by offspring. Somatic gene therapy represents mainstream basic and clinical research, in which therapeutic DNA (either integrated in the genome or as an external episome or plasmid) is used to treat disease.[55] Over 600 clinical trials utilizing SCGT are underway[when?] in the US. Most focus on severe genetic disorders, including immunodeficiencies, haemophilia, thalassaemia, and cystic fibrosis. Such single gene disorders are good candidates for somatic cell therapy. The complete correction of a genetic disorder or the replacement of multiple genes is not yet possible. Only a few of the trials are in the advanced stages.[56][needs update]
In germline gene therapy (GGT), germ cells (sperm or egg cells) are modified by the introduction of functional genes into their genomes. Modifying a germ cell causes all the organism's cells to contain the modified gene. The change is therefore heritable and passed on to later generations. Australia, Canada, Germany, Israel, Switzerland, and the Netherlands[57] prohibit GGT for application in human beings, for technical and ethical reasons, including insufficient knowledge about possible risks to future generations[57] and higher risks versus SCGT.[58] The US has no federal controls specifically addressing human genetic modification (beyond FDA regulations for therapies in general).[57][59][60][61]
In vivo versus ex vivo therapies
[edit]
In in vivo gene therapy, a vector (typically, a virus) is introduced to the patient, which then achieves the desired biological effect by passing the genetic material (e.g. for a missing protein) into the patient's cells. In ex vivo gene therapies, such as CAR-T therapeutics, the patient's own cells (autologous) or healthy donor cells (allogeneic) are modified outside the body (hence, ex vivo) using a vector to express a particular protein, such as a chimeric antigen receptor.[62]
In vivo gene therapy is seen as simpler, since it does not require the harvesting of mitotic cells. However, ex vivo gene therapies are better tolerated and less associated with severe immune responses.[63] The death of Jesse Gelsinger in a trial of an adenovirus-vectored treatment for ornithine transcarbamylase deficiency due to a systemic inflammatory reaction led to a temporary halt on gene therapy trials across the United States.[64] As of 2021[update], in vivo and ex vivo therapeutics are both seen as safe.[65]
Gene editing
[edit]
The concept of gene therapy is to fix a genetic problem at its source. If, for instance, a mutation in a certain gene causes the production of a dysfunctional protein resulting (usually recessively) in an inherited disease, gene therapy could be used to deliver a copy of this gene that does not contain the deleterious mutation and thereby produces a functional protein. This strategy is referred to as gene replacement therapy and could be employed to treat inherited retinal diseases.[17][66]
While the concept of gene replacement therapy is mostly suitable for recessive diseases, novel strategies have been suggested that are capable of also treating conditions with a dominant pattern of inheritance.
- The introduction of CRISPR gene editing has opened new doors for its application and utilization in gene therapy, as instead of pure replacement of a gene, it enables correction of the particular genetic defect.[40] Solutions to medical hurdles, such as the eradication of latent human immunodeficiency virus (HIV) reservoirs and correction of the mutation that causes sickle cell disease, may be available as a therapeutic option in the future.[67][68][69]
- Prosthetic gene therapy aims to enable cells of the body to take over functions they physiologically do not carry out. One example is the so-called vision restoration gene therapy, that aims to restore vision in patients with end-stage retinal diseases.[70][71] In end-stage retinal diseases, the photoreceptors, as the primary light sensitive cells of the retina are irreversibly lost. By the means of prosthetic gene therapy light sensitive proteins are delivered into the remaining cells of the retina, to render them light sensitive and thereby enable them to signal visual information towards the brain.
In vivo, gene editing systems using CRISPR have been used in studies with mice to treat cancer and have been effective at reducing tumors.[72]: 18 In vitro, the CRISPR system has been used to treat HPV cancer tumors. Adeno-associated virus, Lentivirus based vectors have been to introduce the genome for the CRISPR system.[72]: 6
Vectors
[edit]The delivery of DNA into cells can be accomplished by multiple methods. The two major classes are recombinant viruses (sometimes called biological nanoparticles or viral vectors) and naked DNA or DNA complexes (non-viral methods).[73]
Viruses
[edit]
In order to replicate, viruses introduce their genetic material into the host cell, tricking the host's cellular machinery into using it as blueprints for viral proteins.[54]: 39 Retroviruses go a stage further by having their genetic material copied into the nuclear genome of the host cell. Scientists exploit this by substituting part of a virus's genetic material with therapeutic DNA or RNA.[54]: 40 [74] Like the genetic material (DNA or RNA) in viruses, therapeutic genetic material can be designed to simply serve as a temporary blueprint that degrades naturally, as in a non-integrative vectors, or to enter the host's nucleus becoming a permanent part of the host's nuclear DNA in infected cells.[54]: 50
A number of viruses have been used for human gene therapy, including viruses such as lentivirus, adenoviruses, herpes simplex, vaccinia, and adeno-associated virus.[5]
Adenovirus viral vectors (Ad) temporarily modify a cell's genetic expression with genetic material that is not integrated into the host cell's DNA.[75]: 5 As of 2017, such vectors were used in 20% of trials for gene therapy.[74]: 10 Adenovirus vectors are mostly used in cancer treatments and novel genetic vaccines such as the Ebola vaccine, vaccines used in clinical trials for HIV and SARS-CoV-2, or cancer vaccines.[75]: 5
Lentiviral vectors based on lentivirus, a retrovirus, can modify a cell's nuclear genome to permanently express a gene, although vectors can be modified to prevent integration.[54]: 40,50 Retroviruses were used in 18% of trials before 2018.[74]: 10 Libmeldy is an ex vivo stem cell treatment for metachromatic leukodystrophy which uses a lentiviral vector and was approved by the european medical agency in 2020.[76]
Adeno-associated virus (AAV) is a virus that is incapable of transmission between cells unless the cell is infected by another virus, a helper virus. Adenovirus and the herpes viruses act as helper viruses for AAV. AAV persists within the cell outside of the cell's nuclear genome for an extended period of time through the formation of concatemers mostly organized as episomes.[77]: 4 Genetic material from AAV vectors is integrated into the host cell's nuclear genome at a low frequency and likely mediated by the DNA-modifying enzymes of the host cell.[78]: 2647 Animal models suggest that integration of AAV genetic material into the host cell's nuclear genome may cause hepatocellular carcinoma, a form of liver cancer.[78] Several AAV investigational agents have been explored in treatment of wet age related macular degeneration by both intravitreal and subretinal approaches as a potential application of AAV gene therapy for human disease. [79] [80]
Non-viral
[edit]This section needs additional citations for verification. (April 2021) |
Non-viral vectors for gene therapy[81] present certain advantages over viral methods, such as large scale production and low host immunogenicity. However, non-viral methods initially produced lower levels of transfection and gene expression, and thus lower therapeutic efficacy. Newer technologies offer promise of solving these problems, with the advent of increased cell-specific targeting and subcellular trafficking control.
Methods for non-viral gene therapy include the injection of naked DNA, electroporation, the gene gun, sonoporation, magnetofection, the use of oligonucleotides, lipoplexes, dendrimers, and inorganic nanoparticles. These therapeutics can be administered directly or through scaffold enrichment.[82][83]
More recent approaches, such as those performed by companies such as Ligandal, offer the possibility of creating cell-specific targeting technologies for a variety of gene therapy modalities, including RNA, DNA and gene editing tools such as CRISPR. Other companies, such as Arbutus Biopharma and Arcturus Therapeutics, offer non-viral, non-cell-targeted approaches that mainly exhibit liver trophism. In more recent years, startups such as Sixfold Bio, GenEdit, and Spotlight Therapeutics have begun to solve the non-viral gene delivery problem. Non-viral techniques offer the possibility of repeat dosing and greater tailorability of genetic payloads, which in the future will be more likely to take over viral-based delivery systems.
Companies such as Editas Medicine, Intellia Therapeutics, CRISPR Therapeutics, Casebia, Cellectis, Precision Biosciences, bluebird bio, Excision BioTherapeutics, and Sangamo have developed non-viral gene editing techniques, however frequently still use viruses for delivering gene insertion material following genomic cleavage by guided nucleases. These companies focus on gene editing, and still face major delivery hurdles.
BioNTech, Moderna Therapeutics and CureVac focus on delivery of mRNA payloads, which are necessarily non-viral delivery problems.
Alnylam, Dicerna Pharmaceuticals, and Ionis Pharmaceuticals focus on delivery of siRNA (antisense oligonucleotides) for gene suppression, which also necessitate non-viral delivery systems.
In academic contexts, a number of laboratories are working on delivery of PEGylated particles, which form serum protein coronas and chiefly exhibit LDL receptor mediated uptake in cells in vivo.[84]
Treatment
[edit]Cancer
[edit]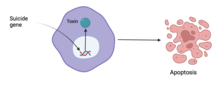
There have been attempts to treat cancer using gene therapy. As of 2017, 65% of gene therapy trials were for cancer treatment.[74]: 7
Adenovirus vectors are useful for some cancer gene therapies because adenovirus can transiently insert genetic material into a cell without permanently altering the cell's nuclear genome. These vectors can be used to cause antigens to be added to cancers causing an immune response, or hinder angiogenesis by expressing certain proteins.[85]: 5 An Adenovirus vector is used in the commercial products Gendicine and Oncorine.[85]: 10 Another commercial product, Rexin G, uses a retrovirus-based vector and selectively binds to receptors that are more expressed in tumors.[85]: 10
One approach, suicide gene therapy, works by introducing genes encoding enzymes that will cause a cancer cell to die. Another approach is the use oncolytic viruses, such as Oncorine,[86]: 165 which are viruses that selectively reproduce in cancerous cells leaving other cells unaffected.[87]: 6 [88]: 280
mRNA has been suggested as a non-viral vector for cancer gene therapy that would temporarily change a cancerous cell's function to create antigens or kill the cancerous cells and there have been several trials.[89]
Afamitresgene autoleucel, sold under the brand name Tecelra, is an autologous T cell immunotherapy used for the treatment of synovial sarcoma. It is a T cell receptor (TCR) gene therapy.[90] It is the first FDA-approved engineered cell therapy for a solid tumor.[91] It uses a self-inactivating lentiviral vector to express a T-cell receptor specific for MAGE-A4, a melanoma-associated antigen.[medical citation needed]
Genetic diseases
[edit]Gene therapy approaches to replace a faulty gene with a healthy gene have been proposed and are being studied for treating some genetic diseases. As of 2017, 11.1% of gene therapy clinical trials targeted monogenic diseases.[74]: 9
Diseases such as sickle cell disease that are caused by autosomal recessive disorders for which a person's normal phenotype or cell function may be restored in cells that have the disease by a normal copy of the gene that is mutated, may be a good candidate for gene therapy treatment.[92][93] The risks and benefits related to gene therapy for sickle cell disease are not known.[93]
Gene therapy has been used in the eye. The eye is especially suitable for adeno-associated virus vectors. Voretigene neparvovec is an approved gene therapy to treat Leber's hereditary optic neuropathy.[94]: 1354 alipogene tiparvovec, a treatment for pancreatitis caused by a genetic condition, and Zolgensma for the treatment of spinal muscular atrophy both use an adeno-associated virus vector.[78]: 2647
Infectious diseases
[edit]As of 2017, 7% of genetic therapy trials targeted infectious diseases. 69.2% of trials targeted HIV, 11% hepatitis B or C, and 7.1% malaria.[74]
List of gene therapies for treatment of disease
[edit]Some genetic therapies have been approved by the U.S. Food and Drug Administration (FDA), the European Medicines Agency (EMA), and for use in Russia and China.
| INN | Brand name | Type | Manufacturer | Target | US Food and Drug Administration (FDA) approved | European Medicines Agency (EMA) authorized |
|---|---|---|---|---|---|---|
| afamitresgene autoleucel | Tecelra | Ex vitro | Adaptimmune | synovial sarcoma | August 2024[90] | |
| alipogene tiparvovec | Glybera | In vivo | Chiesi Farmaceutici | lipoprotein lipase deficiency | No | Withdrawn |
| atidarsagene autotemcel | Libmeldy, Lenmeldy
(Arylsulfatase A gene encoding autologous CD34+ cells) |
Ex vitro | Orchard Therapeutics | metachromatic leukodystrophy | 18 March 2024[95] | 17 December 2020[96] |
| autologous CD34+ | Strimvelis | adenosine deaminase deficiency (ADA-SCID) | 26 May 2016 | |||
| axicabtagene ciloleucel | Yescarta | Ex vitro | Kite pharma | large B-cell lymphoma | 18 October 2017 | 23 August 2018 |
| beremagene geperpavec | Vyjuvek | In vivo | Krystal Biotech | Dystrophic epidermolysis bullosa (DEB) | 19 May 2023[97] | No |
| betibeglogene autotemcel | Zynteglo | beta thalassemia | 17 August 2022[98] | 29 May 2019 | ||
| brexucabtagene autoleucel | Tecartus | Ex vitro | Kite Pharma | mantle cell lymphoma and acute lymphoblastic leukemia | 24 July 2020[99][100] | 14 December 2020[101] |
| cambiogenplasmid | Neovasculgen | vascular endothelial growth factor peripheral artery disease | ||||
| delandistrogene moxeparvovec | Elevidys | In vivo | Catalent | Duchenne muscular dystrophy | 22 June 2023[102] | No |
| elivaldogene autotemcel | Skysona | cerebral adrenoleukodystrophy | 16 July 2021 | |||
| exagamglogene autotemcel | Casgevy | Ex vivo | Vertex Pharmaceuticals | sickle cell disease | December 2023[103] | |
| gendicine | head and neck squamous cell carcinoma | |||||
| idecabtagene vicleucel | Abecma | Ex vivo | Celgene | multiple myeloma | 26 March 2021[104] | No |
| lisocabtagene maraleucel | Breyanzi | Ex vivo | Juno Therapeutics | B-cell lymphoma | 5 February 2021[105] | No |
| lovotibeglogene autotemcel | Lyfgenia | Ex vivo | Bluebird Bio | sickle cell disease | December 2023[106] | |
| nadofaragene firadenovec | Adstiladrin | Ferring Pharmaceuticals | high-risk Bacillus Calmette-Guérin (BCG)-unresponsive non-muscle-invasive bladder cancer (NMIBC) with carcinoma in situ (CIS) | Yes[107] | No | |
| onasemnogene abeparvovec | Zolgensma | In vivo | Novartis Gene Therapies | Spinal muscular atrophy Type I | 24 May 2019[108] | 26 March 2020[109] |
| talimogene laherparepvec | Imlygic | In vivo | Amgen | melanoma | 27 October 2015[110] | 16 December 2015[111] |
| tisagenlecleucel | Kymriah | B cell lymphoblastic leukemia | 22 August 2018 | |||
| valoctocogene roxaparvovec | Roctavian | BioMarin International Limited | hemophilia A | August 2022[112][113][114] | ||
| voretigene neparvovec | Luxturna | In vivo | Spark Therapeutics | biallelic RPE65 mutation associated Leber congenital amaurosis | 18 December 2017[115] | 22 November 2018[116] |
Adverse effects, contraindications and hurdles for use
[edit]Some of the unsolved problems include:
- Off-target effects – The possibility of unwanted, likely harmful, changes to the genome present a large barrier to the widespread implementation of this technology.[117] Improvements to the specificity of gRNAs and Cas enzymes present viable solutions to this issue as well as the refinement of the delivery method of CRISPR.[118] It is likely that different diseases will benefit from different delivery methods.
- Short-lived nature – Before gene therapy can become a permanent cure for a condition, the therapeutic DNA introduced into target cells must remain functional and the cells containing the therapeutic DNA must be stable. Problems with integrating therapeutic DNA into the nuclear genome and the rapidly dividing nature of many cells prevent it from achieving long-term benefits. Patients require multiple treatments.
- Immune response – Any time a foreign object is introduced into human tissues, the immune system is stimulated to attack the invader. Stimulating the immune system in a way that reduces gene therapy effectiveness is possible. The immune system's enhanced response to viruses that it has seen before reduces the effectiveness to repeated treatments.
- Problems with viral vectors – Viral vectors carry the risks of toxicity, inflammatory responses, and gene control and targeting issues.
- Multigene disorders – Some commonly occurring disorders, such as heart disease, high blood pressure, Alzheimer's disease, arthritis, and diabetes, are affected by variations in multiple genes, which complicate gene therapy.
- Some therapies may breach the Weismann barrier (between soma and germ-line) protecting the testes, potentially modifying the germline, falling afoul of regulations in countries that prohibit the latter practice.[119]
- Insertional mutagenesis – If the DNA is integrated in a sensitive spot in the genome, for example in a tumor suppressor gene, the therapy could induce a tumor. This has occurred in clinical trials for X-linked severe combined immunodeficiency (X-SCID) patients, in which hematopoietic stem cells were transduced with a corrective transgene using a retrovirus, and this led to the development of T cell leukemia in 3 of 20 patients.[120][121] One possible solution is to add a functional tumor suppressor gene to the DNA to be integrated. This may be problematic since the longer the DNA is, the harder it is to integrate into cell genomes.[122] CRISPR technology allows researchers to make much more precise genome changes at exact locations.[123]
- Cost – alipogene tiparvovec (Glybera), for example, at a cost of $1.6 million per patient, was reported in 2013, to be the world's most expensive drug.[124][125]
Deaths
[edit]Three patients' deaths have been reported in gene therapy trials, putting the field under close scrutiny. The first was that of Jesse Gelsinger, who died in 1999, because of immune rejection response.[126][127] One X-SCID patient died of leukemia in 2003.[13] In 2007, a rheumatoid arthritis patient died from an infection; the subsequent investigation concluded that the death was not related to gene therapy.[128]
Regulations
[edit]Regulations covering genetic modification are part of general guidelines about human-involved biomedical research.[citation needed] There are no international treaties which are legally binding in this area, but there are recommendations for national laws from various bodies.[citation needed]
The Helsinki Declaration (Ethical Principles for Medical Research Involving Human Subjects) was amended by the World Medical Association's General Assembly in 2008. This document provides principles physicians and researchers must consider when involving humans as research subjects. The Statement on Gene Therapy Research initiated by the Human Genome Organization (HUGO) in 2001, provides a legal baseline for all countries. HUGO's document emphasizes human freedom and adherence to human rights, and offers recommendations for somatic gene therapy, including the importance of recognizing public concerns about such research.[129]
United States
[edit]No federal legislation lays out protocols or restrictions about human genetic engineering. This subject is governed by overlapping regulations from local and federal agencies, including the Department of Health and Human Services, the FDA and NIH's Recombinant DNA Advisory Committee. Researchers seeking federal funds for an investigational new drug application, (commonly the case for somatic human genetic engineering,) must obey international and federal guidelines for the protection of human subjects.[130]
NIH serves as the main gene therapy regulator for federally funded research. Privately funded research is advised to follow these regulations. NIH provides funding for research that develops or enhances genetic engineering techniques and to evaluate the ethics and quality in current research. The NIH maintains a mandatory registry of human genetic engineering research protocols that includes all federally funded projects.[131]
An NIH advisory committee published a set of guidelines on gene manipulation.[132] The guidelines discuss lab safety as well as human test subjects and various experimental types that involve genetic changes. Several sections specifically pertain to human genetic engineering, including Section III-C-1. This section describes required review processes and other aspects when seeking approval to begin clinical research involving genetic transfer into a human patient.[133] The protocol for a gene therapy clinical trial must be approved by the NIH's Recombinant DNA Advisory Committee prior to any clinical trial beginning; this is different from any other kind of clinical trial.[132]
As with other kinds of drugs, the FDA regulates the quality and safety of gene therapy products and supervises how these products are used clinically. Therapeutic alteration of the human genome falls under the same regulatory requirements as any other medical treatment. Research involving human subjects, such as clinical trials, must be reviewed and approved by the FDA and an Institutional Review Board.[134][135]
Gene doping
[edit]Athletes may adopt gene therapy technologies to improve their performance.[136] Gene doping is not known to occur, but multiple gene therapies may have such effects. Kayser et al. argue that gene doping could level the playing field if all athletes receive equal access. Critics claim that any therapeutic intervention for non-therapeutic/enhancement purposes compromises the ethical foundations of medicine and sports.[137]
Genetic enhancement
[edit]Genetic engineering could be used to cure diseases, but also to change physical appearance, metabolism, and even improve physical capabilities and mental faculties such as memory and intelligence. Ethical claims about germline engineering include beliefs that every fetus has a right to remain genetically unmodified, that parents hold the right to genetically modify their offspring, and that every child has the right to be born free of preventable diseases.[138][139][140] For parents, genetic engineering could be seen as another child enhancement technique to add to diet, exercise, education, training, cosmetics, and plastic surgery.[141][142] Another theorist claims that moral concerns limit but do not prohibit germline engineering.[143]
A 2020 issue of the journal Bioethics was devoted to moral issues surrounding germline genetic engineering in people.[144]
Possible regulatory schemes include a complete ban, provision to everyone, or professional self-regulation. The American Medical Association's Council on Ethical and Judicial Affairs stated that "genetic interventions to enhance traits should be considered permissible only in severely restricted situations: (1) clear and meaningful benefits to the fetus or child; (2) no trade-off with other characteristics or traits; and (3) equal access to the genetic technology, irrespective of income or other socioeconomic characteristics."[145]
As early in the history of biotechnology as 1990, there have been scientists opposed to attempts to modify the human germline using these new tools,[146] and such concerns have continued as technology progressed.[147][148] With the advent of new techniques like CRISPR, in March 2015 a group of scientists urged a worldwide moratorium on clinical use of gene editing technologies to edit the human genome in a way that can be inherited.[149][150][151][152] In April 2015, researchers sparked controversy when they reported results of basic research to edit the DNA of non-viable human embryos using CRISPR.[153][154] A committee of the American National Academy of Sciences and National Academy of Medicine gave qualified support to human genome editing in 2017[155][156] once answers have been found to safety and efficiency problems "but only for serious conditions under stringent oversight."[157]
History
[edit]This section may be too long and excessively detailed. (November 2018) |
1970s and earlier
[edit]In 1972, Friedmann and Roblin authored a paper in Science titled "Gene therapy for human genetic disease?".[158] Rogers (1970) was cited for proposing that exogenous good DNA be used to replace the defective DNA in those with genetic defects.[159]
1980s
[edit]In 1984, a retrovirus vector system was designed that could efficiently insert foreign genes into mammalian chromosomes.[160]
1990s
[edit]The first approved gene therapy clinical research in the US took place on 14 September 1990, at the National Institutes of Health (NIH), under the direction of William French Anderson.[161] Four-year-old Ashanti DeSilva received treatment for a genetic defect that left her with adenosine deaminase deficiency (ADA-SCID), a severe immune system deficiency. The defective gene of the patient's blood cells was replaced by the functional variant. Ashanti's immune system was partially restored by the therapy. Production of the missing enzyme was temporarily stimulated, but the new cells with functional genes were not generated. She led a normal life only with the regular injections performed every two months. The effects were successful, but temporary.[162]
Cancer gene therapy was introduced in 1992/93 (Trojan et al. 1993).[163] The treatment of glioblastoma multiforme, the malignant brain tumor whose outcome is always fatal, was done using a vector expressing antisense IGF-I RNA (clinical trial approved by NIH protocol no.1602 24 November 1993,[164] and by the FDA in 1994). This therapy also represents the beginning of cancer immunogene therapy, a treatment which proves to be effective due to the anti-tumor mechanism of IGF-I antisense, which is related to strong immune and apoptotic phenomena.
In 1992, Claudio Bordignon, working at the Vita-Salute San Raffaele University, performed the first gene therapy procedure using hematopoietic stem cells as vectors to deliver genes intended to correct hereditary diseases.[165] In 2002, this work led to the publication of the first successful gene therapy treatment for ADA-SCID. The success of a multi-center trial for treating children with SCID (severe combined immune deficiency or "bubble boy" disease) from 2000 and 2002, was questioned when two of the ten children treated at the trial's Paris center developed a leukemia-like condition. Clinical trials were halted temporarily in 2002, but resumed after regulatory review of the protocol in the US, the United Kingdom, France, Italy, and Germany.[166]
In 1993, Andrew Gobea was born with SCID following prenatal genetic screening. Blood was removed from his mother's placenta and umbilical cord immediately after birth, to acquire stem cells. The allele that codes for adenosine deaminase (ADA) was obtained and inserted into a retrovirus. Retroviruses and stem cells were mixed, after which the viruses inserted the gene into the stem cell chromosomes. Stem cells containing the working ADA gene were injected into Andrew's blood. Injections of the ADA enzyme were also given weekly. For four years T cells (white blood cells), produced by stem cells, made ADA enzymes using the ADA gene. After four years more treatment was needed.[167]
In 1996, Luigi Naldini and Didier Trono developed a new class of gene therapy vectors based on HIV capable of infecting non-dividing cells that have since then been widely used in clinical and research settings, pioneering lentivirals vector in gene therapy.[168]
Jesse Gelsinger's death in 1999 impeded gene therapy research in the US.[169][170] As a result, the FDA suspended several clinical trials pending the reevaluation of ethical and procedural practices.[171]
2000s
[edit]The modified gene therapy strategy of antisense IGF-I RNA (NIH n˚ 1602)[164] using antisense / triple helix anti-IGF-I approach was registered in 2002, by Wiley gene therapy clinical trial - n˚ 635 and 636. The approach has shown promising results in the treatment of six different malignant tumors: glioblastoma, cancers of liver, colon, prostate, uterus, and ovary (Collaborative NATO Science Programme on Gene Therapy USA, France, Poland n˚ LST 980517 conducted by J. Trojan) (Trojan et al., 2012). This anti-gene antisense/triple helix therapy has proven to be efficient, due to the mechanism stopping simultaneously IGF-I expression on translation and transcription levels, strengthening anti-tumor immune and apoptotic phenomena.
2002
[edit]Sickle cell disease can be treated in mice.[172] The mice – which have essentially the same defect that causes human cases – used a viral vector to induce production of fetal hemoglobin (HbF), which normally ceases to be produced shortly after birth. In humans, the use of hydroxyurea to stimulate the production of HbF temporarily alleviates sickle cell symptoms. The researchers demonstrated this treatment to be a more permanent means to increase therapeutic HbF production.[173]
A new gene therapy approach repaired errors in messenger RNA derived from defective genes. This technique has the potential to treat thalassaemia, cystic fibrosis and some cancers.[174]
Researchers created liposomes 25 nanometers across that can carry therapeutic DNA through pores in the nuclear membrane.[175]
2003
[edit]In 2003, a research team inserted genes into the brain for the first time. They used liposomes coated in a polymer called polyethylene glycol, which unlike viral vectors, are small enough to cross the blood–brain barrier.[176]
Short pieces of double-stranded RNA (short, interfering RNAs or siRNAs) are used by cells to degrade RNA of a particular sequence. If a siRNA is designed to match the RNA copied from a faulty gene, then the abnormal protein product of that gene will not be produced.[177]
Gendicine is a cancer gene therapy that delivers the tumor suppressor gene p53 using an engineered adenovirus. In 2003, it was approved in China for the treatment of head and neck squamous cell carcinoma.[31]
2006
[edit]In March, researchers announced the successful use of gene therapy to treat two adult patients for X-linked chronic granulomatous disease, a disease which affects myeloid cells and damages the immune system. The study is the first to show that gene therapy can treat the myeloid system.[178]
In May, a team reported a way to prevent the immune system from rejecting a newly delivered gene.[179] Similar to organ transplantation, gene therapy has been plagued by this problem. The immune system normally recognizes the new gene as foreign and rejects the cells carrying it. The research utilized a newly uncovered network of genes regulated by molecules known as microRNAs. This natural function selectively obscured their therapeutic gene in immune system cells and protected it from discovery. Mice infected with the gene containing an immune-cell microRNA target sequence did not reject the gene.
In August, scientists successfully treated metastatic melanoma in two patients using killer T cells genetically retargeted to attack the cancer cells.[180]
In November, researchers reported on the use of VRX496, a gene-based immunotherapy for the treatment of HIV that uses a lentiviral vector to deliver an antisense gene against the HIV envelope. In a phase I clinical trial, five subjects with chronic HIV infection who had failed to respond to at least two antiretroviral regimens were treated. A single intravenous infusion of autologous CD4 T cells genetically modified with VRX496 was well tolerated. All patients had stable or decreased viral load; four of the five patients had stable or increased CD4 T cell counts. All five patients had stable or increased immune response to HIV antigens and other pathogens. This was the first evaluation of a lentiviral vector administered in a US human clinical trial.[181][182]
2007
[edit]In May 2007, researchers announced the first gene therapy trial for inherited retinal disease. The first operation was carried out on a 23-year-old British male, Robert Johnson, in early 2007.[183]
2008
[edit]Leber's congenital amaurosis is an inherited blinding disease caused by mutations in the RPE65 gene. The results of a small clinical trial in children were published in April.[17] Delivery of recombinant adeno-associated virus (AAV) carrying RPE65 yielded positive results. In May, two more groups reported positive results in independent clinical trials using gene therapy to treat the condition. In all three clinical trials, patients recovered functional vision without apparent side-effects.[17][18][19][20]
2009
[edit]In September researchers were able to give trichromatic vision to squirrel monkeys.[184] In November 2009, researchers halted a fatal genetic disorder called adrenoleukodystrophy in two children using a lentivirus vector to deliver a functioning version of ABCD1, the gene that is mutated in the disorder.[185]
2010s
[edit]2010
[edit]An April paper reported that gene therapy addressed achromatopsia (color blindness) in dogs by targeting cone photoreceptors. Cone function and day vision were restored for at least 33 months in two young specimens. The therapy was less efficient for older dogs.[186]
In September it was announced that an 18-year-old male patient in France with beta thalassemia major had been successfully treated.[187] Beta thalassemia major is an inherited blood disease in which beta haemoglobin is missing and patients are dependent on regular lifelong blood transfusions.[188] The technique used a lentiviral vector to transduce the human β-globin gene into purified blood and marrow cells obtained from the patient in June 2007.[189] The patient's haemoglobin levels were stable at 9 to 10 g/dL. About a third of the hemoglobin contained the form introduced by the viral vector and blood transfusions were not needed.[189][190] Further clinical trials were planned.[191] Bone marrow transplants are the only cure for thalassemia, but 75% of patients do not find a matching donor.[190]
Cancer immunogene therapy using modified antigene, antisense/triple helix approach was introduced in South America in 2010/11 in La Sabana University, Bogota (Ethical Committee 14 December 2010, no P-004-10). Considering the ethical aspect of gene diagnostic and gene therapy targeting IGF-I, the IGF-I expressing tumors i.e. lung and epidermis cancers were treated (Trojan et al. 2016).[192][193]
2011
[edit]In 2007 and 2008, a man (Timothy Ray Brown) was cured of HIV by repeated hematopoietic stem cell transplantation (see also allogeneic stem cell transplantation, allogeneic bone marrow transplantation, allotransplantation) with double-delta-32 mutation which disables the CCR5 receptor. This cure was accepted by the medical community in 2011.[194] It required complete ablation of existing bone marrow, which is very debilitating.[195]
In August two of three subjects of a pilot study were confirmed to have been cured from chronic lymphocytic leukemia (CLL). The therapy used genetically modified T cells to attack cells that expressed the CD19 protein to fight the disease.[26] In 2013, the researchers announced that 26 of 59 patients had achieved complete remission and the original patient had remained tumor-free.[196]
Human HGF plasmid DNA therapy of cardiomyocytes is being examined as a potential treatment for coronary artery disease as well as treatment for the damage that occurs to the heart after myocardial infarction.[197][198]
In 2011, Neovasculgen was registered in Russia as the first-in-class gene-therapy drug for treatment of peripheral artery disease, including critical limb ischemia; it delivers the gene encoding for VEGF.[32] Neovasculogen is a plasmid encoding the CMV promoter and the 165 amino acid form of VEGF.[199][200]
2012
[edit]The FDA approved Phase I clinical trials on thalassemia major patients in the US for 10 participants in July.[201] The study was expected to continue until 2015.[191]
In July 2012, the European Medicines Agency recommended approval of a gene therapy treatment for the first time in either Europe or the United States. The treatment used Alipogene tiparvovec (Glybera) to compensate for lipoprotein lipase deficiency, which can cause severe pancreatitis.[202] The recommendation was endorsed by the European Commission in November 2012,[16][33][203][204] and commercial rollout began in late 2014.[205] Alipogene tiparvovec was expected to cost around $1.6 million per treatment in 2012,[206] revised to $1 million in 2015,[207] making it the most expensive medicine in the world at the time.[208] As of 2016[update], only the patients treated in clinical trials and a patient who paid the full price for treatment have received the drug.[209]
In December 2012, it was reported that 10 of 13 patients with multiple myeloma were in remission "or very close to it" three months after being injected with a treatment involving genetically engineered T cells to target proteins NY-ESO-1 and LAGE-1, which exist only on cancerous myeloma cells.[28]
2013
[edit]In March researchers reported that three of five adult subjects who had acute lymphocytic leukemia (ALL) had been in remission for five months to two years after being treated with genetically modified T cells which attacked cells with CD19 genes on their surface, i.e. all B cells, cancerous or not. The researchers believed that the patients' immune systems would make normal T cells and B cells after a couple of months. They were also given bone marrow. One patient relapsed and died and one died of a blood clot unrelated to the disease.[27]
Following encouraging Phase I trials, in April, researchers announced they were starting Phase II clinical trials (called CUPID2 and SERCA-LVAD) on 250 patients[210] at several hospitals to combat heart disease. The therapy was designed to increase the levels of SERCA2, a protein in heart muscles, improving muscle function.[211] The U.S. Food and Drug Administration (FDA) granted this a breakthrough therapy designation to accelerate the trial and approval process.[212] In 2016, it was reported that no improvement was found from the CUPID 2 trial.[213]
In July researchers reported promising results for six children with two severe hereditary diseases had been treated with a partially deactivated lentivirus to replace a faulty gene and after 7–32 months. Three of the children had metachromatic leukodystrophy, which causes children to lose cognitive and motor skills.[214] The other children had Wiskott–Aldrich syndrome, which leaves them to open to infection, autoimmune diseases, and cancer.[215] Follow up trials with gene therapy on another six children with Wiskott–Aldrich syndrome were also reported as promising.[216][217]
In October researchers reported that two children born with adenosine deaminase severe combined immunodeficiency disease (ADA-SCID) had been treated with genetically engineered stem cells 18 months previously and that their immune systems were showing signs of full recovery. Another three children were making progress.[24] In 2014, a further 18 children with ADA-SCID were cured by gene therapy.[218] ADA-SCID children have no functioning immune system and are sometimes known as "bubble children".[24]
Also in October researchers reported that they had treated six people with haemophilia in early 2011 using an adeno-associated virus. Over two years later all six were producing clotting factor.[24][219]
2014
[edit]In January researchers reported that six choroideremia patients had been treated with adeno-associated virus with a copy of REP1. Over a six-month to two-year period all had improved their sight.[66][220] By 2016, 32 patients had been treated with positive results and researchers were hopeful the treatment would be long-lasting.[21] Choroideremia is an inherited genetic eye disease with no approved treatment, leading to loss of sight.
In March researchers reported that 12 HIV patients had been treated since 2009 in a trial with a genetically engineered virus with a rare mutation (CCR5 deficiency) known to protect against HIV with promising results.[221][222]
Clinical trials of gene therapy for sickle cell disease were started in 2014.[223][224]
In February LentiGlobin BB305, a gene therapy treatment undergoing clinical trials for treatment of beta thalassemia gained FDA "breakthrough" status after several patients were able to forgo the frequent blood transfusions usually required to treat the disease.[225]
In March researchers delivered a recombinant gene encoding a broadly neutralizing antibody into monkeys infected with simian HIV; the monkeys' cells produced the antibody, which cleared them of HIV. The technique is named immunoprophylaxis by gene transfer (IGT). Animal tests for antibodies to ebola, malaria, influenza, and hepatitis were underway.[226][227]
In March, scientists, including an inventor of CRISPR, Jennifer Doudna, urged a worldwide moratorium on germline gene therapy, writing "scientists should avoid even attempting, in lax jurisdictions, germline genome modification for clinical application in humans" until the full implications "are discussed among scientific and governmental organizations".[149][150][151][152]
In December, scientists of major world academies called for a moratorium on inheritable human genome edits, including those related to CRISPR-Cas9 technologies[228] but that basic research including embryo gene editing should continue.[229]
2015
[edit]Researchers successfully treated a boy with epidermolysis bullosa using skin grafts grown from his own skin cells, genetically altered to repair the mutation that caused his disease.[230]
In November, researchers announced that they had treated a baby girl, Layla Richards, with an experimental treatment using donor T cells genetically engineered using TALEN to attack cancer cells. One year after the treatment she was still free of her cancer (a highly aggressive form of acute lymphoblastic leukaemia [ALL]).[231] Children with highly aggressive ALL normally have a very poor prognosis and Layla's disease had been regarded as terminal before the treatment.[232][233]
2016
[edit]In April the Committee for Medicinal Products for Human Use of the European Medicines Agency endorsed a gene therapy treatment called Strimvelis[234][235] and the European Commission approved it in June.[236] This treats children born with adenosine deaminase deficiency and who have no functioning immune system. This was the second gene therapy treatment to be approved in Europe.[237]
In October, Chinese scientists reported they had started a trial to genetically modify T cells from 10 adult patients with lung cancer and reinject the modified T cells back into their bodies to attack the cancer cells. The T cells had the PD-1 protein (which stops or slows the immune response) removed using CRISPR-Cas9.[238][239]
A 2016 Cochrane systematic review looking at data from four trials on topical cystic fibrosis transmembrane conductance regulator (CFTR) gene therapy does not support its clinical use as a mist inhaled into the lungs to treat cystic fibrosis patients with lung infections. One of the four trials did find weak evidence that liposome-based CFTR gene transfer therapy may lead to a small respiratory improvement for people with CF. This weak evidence is not enough to make a clinical recommendation for routine CFTR gene therapy.[240]
2017
[edit]In February Kite Pharma announced results from a clinical trial of CAR-T cells in around a hundred people with advanced non-Hodgkin lymphoma.[241]
In March, French scientists reported on clinical research of gene therapy to treat sickle cell disease.[242]
In August, the FDA approved tisagenlecleucel for acute lymphoblastic leukemia.[243] Tisagenlecleucel is an adoptive cell transfer therapy for B-cell acute lymphoblastic leukemia; T cells from a person with cancer are removed, genetically engineered to make a specific T-cell receptor (a chimeric T cell receptor, or "CAR-T") that reacts to the cancer, and are administered back to the person. The T cells are engineered to target a protein called CD19 that is common on B cells. This is the first form of gene therapy to be approved in the United States. In October, a similar therapy called axicabtagene ciloleucel was approved for non-Hodgkin lymphoma.[244]
In October, biophysicist and biohacker Josiah Zayner claimed to have performed the very first in-vivo human genome editing in the form of a self-administered therapy.[245][246]
On 13 November, medical scientists working with Sangamo Therapeutics, headquartered in Richmond, California, announced the first ever in-body human gene editing therapy.[247][248] The treatment, designed to permanently insert a healthy version of the flawed gene that causes Hunter syndrome, was given to 44-year-old Brian Madeux and is part of the world's first study to permanently edit DNA inside the human body.[249] The success of the gene insertion was later confirmed.[250][251] Clinical trials by Sangamo involving gene editing using zinc finger nuclease (ZFN) are ongoing.[252]
In December the results of using an adeno-associated virus with blood clotting factor VIII to treat nine haemophilia A patients were published. Six of the seven patients on the high dose regime increased the level of the blood clotting VIII to normal levels. The low and medium dose regimes had no effect on the patient's blood clotting levels.[253][254]
In December, the FDA approved voretigene neparvovec, the first in vivo gene therapy, for the treatment of blindness due to Leber's congenital amaurosis.[255] The price of this treatment is US$850,000 for both eyes.[256][257]
2019
[edit]In May, the FDA approved onasemnogene abeparvovec (Zolgensma) for treating spinal muscular atrophy in children under two years of age. The list price of Zolgensma was set at US$2.125 million per dose, making it the most expensive drug ever.[258]
In May, the EMA approved betibeglogene autotemcel (Zynteglo) for treating beta thalassemia for people twelve years of age and older.[259][260]
In July, Allergan and Editas Medicine announced phase I/II clinical trial of AGN-151587 for the treatment of Leber congenital amaurosis 10.[261] This is the first study of a CRISPR-based in vivo human gene editing therapy, where the editing takes place inside the human body.[262] The first injection of the CRISPR-Cas System was confirmed in March 2020.[263]
2020s
[edit]2020
[edit]In May, onasemnogene abeparvovec (Zolgensma) was approved by the European Union for the treatment of spinal muscular atrophy in people who either have clinical symptoms of SMA type 1 or who have no more than three copies of the SMN2 gene, irrespective of body weight or age.[264]
In August, Audentes Therapeutics reported that three out of 17 children with X-linked myotubular myopathy participating the clinical trial of a AAV8-based gene therapy treatment AT132 have died. It was suggested that the treatment, whose dosage is based on body weight, exerts a disproportionately toxic effect on heavier patients, since the three patients who died were heavier than the others.[265][266] The trial has been put on clinical hold.[267]
On 15 October, the Committee for Medicinal Products for Human Use (CHMP) of the European Medicines Agency (EMA) adopted a positive opinion, recommending the granting of a marketing authorisation for the medicinal product Libmeldy (autologous CD34+ cell enriched population that contains hematopoietic stem and progenitor cells transduced ex vivo using a lentiviral vector encoding the human arylsulfatase A gene), a gene therapy for the treatment of children with the "late infantile" (LI) or "early juvenile" (EJ) forms of metachromatic leukodystrophy (MLD).[268] The active substance of Libmeldy consists of the child's own stem cells which have been modified to contain working copies of the ARSA gene.[268] When the modified cells are injected back into the patient as a one-time infusion, the cells are expected to start producing the ARSA enzyme that breaks down the build-up of sulfatides in the nerve cells and other cells of the patient's body.[269] Libmeldy was approved for medical use in the EU in December 2020.[270]
On 15 October, Lysogene, a French biotechnological company, reported the death of a patient in who has received LYS-SAF302, an experimental gene therapy treatment for mucopolysaccharidosis type IIIA (Sanfilippo syndrome type A).[271]
2021
[edit]In May, a new method using an altered version of HIV as a lentivirus vector was reported in the treatment of 50 children with ADA-SCID obtaining positive results in 48 of them,[272][273][274] this method is expected to be safer than retroviruses vectors commonly used in previous studies of SCID where the development of leukemia was usually observed[275] and had already been used in 2019, but in a smaller group with X-SCID.[276][277][278][279]
In June a clinical trial on six patients affected with transthyretin amyloidosis reported a reduction the concentration of missfolded transthretin (TTR) protein in serum through CRISPR-based inactivation of the TTR gene in liver cells observing mean reductions of 52% and 87% among the lower and higher dose groups.This was done in vivo without taking cells out of the patient to edit them and reinfuse them later.[280][281][282]
In July results of a small gene therapy phase I study was published reporting observation of dopamine restoration on seven patients between 4 and 9 years old affected by aromatic L-amino acid decarboxylase deficiency (AADC deficiency).[283][284][285]
2022
[edit]In February, the first ever gene therapy for Tay–Sachs disease was announced, it uses an adeno-associated virus to deliver the correct instruction for the HEXA gene on brain cells which causes the disease. Only two children were part of a compassionate trial presenting improvements over the natural course of the disease and no vector-related adverse events.[286][287][288]
In May, eladocagene exuparvovec is recommended for approval by the European Commission.[289][290]
In July results of a gene therapy candidate for haemophilia B called FLT180 were announced, it works using an adeno-associated virus (AAV) to restore the clotting factor IX (FIX) protein, normal levels of the protein were observed with low doses of the therapy but immunosuppression was necessitated to decrease the risk of vector-related immune responses.[291][292][293]
In December, a 13-year girl that had been diagnosed with T-cell acute lymphoblastic leukaemia was successfully treated at Great Ormond Street Hospital (GOSH) in the first documented use of therapeutic gene editing for this purpose, after undergoing six months of an experimental treatment, where all attempts of other treatments failed. The procedure included reprogramming a healthy T-cell to destroy the cancerous T-cells to first rid her of leukaemia, and then rebuilding her immune system using healthy immune cells.[294] The GOSH team used BASE editing and had previously treated a case of acute lymphoblastic leukaemia in 2015 using TALENs.[233]
2023
[edit]In May 2023, the FDA approved beremagene geperpavec for the treatment of wounds in people with dystrophic epidermolysis bullosa (DEB) which is applied as a topical gel that delivers a herpes-simplex virus type 1 (HSV-1) vector encoding the collagen type VII alpha 1 chain (COL7A1) gene that is dysfunctional on those affected by DEB . One trial found 65% of the Vyjuvek-treated wounds completely closed while only 26% of the placebo-treated at 24 weeks.[97] It has been also reported its use as a eyedrops for a patient with DEB that had vision loss due to the widespread blistering with good results.[295]
In June 2023, the FDA gave an accelerated approval to Elevidys for Duchenne muscular dystrophy (DMD) only for boys 4 to 5 years old as they are more likely to benefit from the therapy which consists of one-time intravenous infusion of a virus (AAV rh74 vector) that delivers a functioning "microdystrophin" gene (138 kDa) into the muscle cells to act in place of the normal dystrophin (427 kDa) that is found mutated in this disease.[102]
In July 2023, it was reported that it had been developed a new method to affect genetic expressions through direct current.[296]
List of gene therapies
[edit]- Gene therapy for color blindness
- Gene therapy for epilepsy
- Gene therapy for osteoarthritis
- Gene therapy in Parkinson's disease
- Gene therapy of the human retina
References
[edit]- ^ Kaji EH, Leiden JM (February 2001). "Gene and stem cell therapies". JAMA. 285 (5): 545–550. doi:10.1001/jama.285.5.545. PMID 11176856.
- ^ Ermak G (2015). Emerging Medical Technologies. World Scientific. ISBN 978-981-4675-81-9.
- ^ "What is Gene Therapy?". U.S. Food and Drug Administration (FDA). 9 December 2020.
- ^ Rosenberg SA, Aebersold P, Cornetta K, Kasid A, Morgan RA, Moen R, et al. (August 1990). "Gene transfer into humans--immunotherapy of patients with advanced melanoma, using tumor-infiltrating lymphocytes modified by retroviral gene transduction". The New England Journal of Medicine. 323 (9): 570–578. doi:10.1056/NEJM199008303230904. PMID 2381442.
- ^ Jump up to: a b "Gene Therapy Clinical Trials Worldwide Database". The Journal of Gene Medicine. Wiley. June 2016. Archived from the original on 31 July 2020.
- ^ Gorell E, Nguyen N, Lane A, Siprashvili Z (апрель 2014 г.). «Генная терапия при кожных заболеваниях» . Перспективы Cold Spring Harbor в медицине . 4 (4): A015149. doi : 10.1101/cshperspect.a015149 . PMC 3968787 . PMID 24692191 .
- ^ Циммер С (16 сентября 2013 г.). "Два двойной возьми" . New York Times . Архивировано из оригинала 2 января 2022 года.
- ^ «Некролог Лорейн Краус» . Коммерческая апелляция . Получено 7 июля 2023 года .
- ^ «Генная терапия» . Whatisbiotechnology.org . Биотехнология и медицина образования (Biotechmet) . Получено 7 июля 2023 года .
- ^ Конгресс США, Управление по оценке технологий (декабрь 1984 г.). Человеческая генная терапия - фоновая бумага . Дайан издательство. ISBN 978-1-4289-2371-3 .
- ^ Sun M (октябрь 1982). «Мартин Клайн теряет апелляцию на грант NIH». Наука . 218 (4567): 37. Bibcode : 1982sci ... 218 ... 37 с . doi : 10.1126/science.7123214 . PMID 7123214 .
- ^ Lowenstein PR (2008). «Генная терапия при неврологических расстройствах: новая терапия или эксперименты человека?» Полем В Burley J, Harris J (Eds.). Компаньон генотики . Джон Уайли и сыновья. ISBN 978-0-470-75637-9 .
- ^ Подпрыгнуть до: а беременный Шеридан С (февраль 2011 г.). «Генная терапия находит свою нишу». Nature Biotechnology . 29 (2): 121–128. doi : 10.1038/nbt.1769 . PMID 21301435 . S2CID 5063701 .
- ^ О'Мэлли Б.В., Ледли Ф.Д. (октябрь 1993). «Соматическая генная терапия. Методы для настоящего и будущего». Arch Otolaryngol Head Neck Surg . 119 (10): 1100–7. doi : 10.1001/archotol.1993.01880220044007 . PMID 8398061 .
- ^ Oldfield EH, Ram Z, Culver KW, Blaese RM, Devroom HL, Anderson WF (февраль 1993 г.). «Генная терапия для лечения опухолей головного мозга с использованием внутрилуморальной трансдукции геном тимидинкиназы и внутривенным ганцикловиром». Генная терапия человека . 4 (1): 39–69. doi : 10.1089/hum.1993.4.1-39 . PMID 8384892 .
- ^ Подпрыгнуть до: а беременный в Ричардс (6 ноября 2012 г.). «Генная терапия прибывает в Европу» . Ученый .
- ^ Подпрыгнуть до: а беременный в дюймовый Магуайр А.М., Симонелли Ф., Пирс Э.А., Пью Эн, Мингоцци Ф., Бенничелли Дж. И др. (Май 2008 г.). «Безопасность и эффективность переноса генов для врожденного амаредоза Либер » » Журнал медицины Новой Англии 358 (21): 2240–2248. doi : 10.1056/NEJMoa0802315 . 2829748PMC 18441370PMID
- ^ Подпрыгнуть до: а беременный Simonelli F, Maguire AM, Testa F, Pierce EA, Mingozzi F, Bennicelli JL, et al. (Март 2010 г.). "Gene therapy for Leber's congenital amaurosis is safe and effective through 1.5 years after vector administration" . Молекулярная терапия . 18 (3): 643–650. doi : 10.1038/mt.2009.277 . PMC 2839440 . PMID 19953081 .
- ^ Подпрыгнуть до: а беременный СРЕДНИЙ. Видение 1 год . Новый английский журнал медицины 361 (7): 725–727. doi : 10.1056/NEJMc0903652 . PMC 284775 . PMID 19675341 .
- ^ Подпрыгнуть до: а беременный Bainbridge JW, Smith AJ, Barker SS, Robbie S, Henderson R, Balaggan K, et al. (Май 2008 г.). «Влияние генной терапии на визуальную функцию при врожденном амаурозе Лебера». Новая Англия Журнал медицины . 358 (21): 2231–2239. doi : 10.1056/nejmoa0802268 . HDL : 10261/271174 . PMID 18441371 .
- ^ Подпрыгнуть до: а беременный Гош П (28 апреля 2016 г.). «Генная терапия переворачивает потерю зрений и длится долгое время» . BBC News Online . Получено 29 апреля 2016 года .
- ^ Fischer A, Hacein-Bey-I-Abina S, Cavazzana-Calvo M (июнь 2010 г.). «20 лет генной терапии для SCID». Природа иммунология . 11 (6): 457–460. doi : 10.1038/ni0610-457 . PMID 20485269 . S2CID 11300348 .
- ^ Ferrua F, Brigida I, Aiuti A (декабрь 2010 г.). «Обновление генной терапии при тяжелой комбинированной иммунодефиците аденозин-деаминазы». Современное мнение об аллергии и клинической иммунологии . 10 (6): 551–556. doi : 10.1097/aci.0b013e32833fea85 . PMID 20966749 . S2CID 205435278 .
- ^ Подпрыгнуть до: а беременный в дюймовый и Geddes L (30 октября 2013 г.). « Bubble Kid» успех возвращает генную терапию на путь » . Новый ученый . Получено 2 января 2022 года .
- ^ Cartier N, Aubourg P (июль 2010 г.). «Трансплантация гематопоэтических стволовых клеток и гена гена гематопоэтических стволовых клеток при x-связанной адренолекодистрофии» . Патология мозга . 20 (4): 857–862. doi : 10.1111/j.1750-3639.2010.00394.x . PMC 8094635 . PMID 20626747 . S2CID 24182017 .
- ^ Подпрыгнуть до: а беременный Ледфорд Х (2011). «Клеточная терапия борется с лейкемией». Природа . doi : 10.1038/news.2011.472 .
- ^ Подпрыгнуть до: а беременный Coghlan A (26 марта 2013 г.). «Генная терапия лечит лейкемию за восемь дней» . Новый ученый . Получено 15 апреля 2013 года .
- ^ Подпрыгнуть до: а беременный Coghlan A (11 декабря 2013 г.). «Объединенные иммунные клетки заставляют лейкемию в ремиссию» . Новый ученый . Получено 15 апреля 2013 года .
- ^ Lewitt PA, Rezai AR, Leehey MA, Ojemann SG, Flaherty AW, Eskandar EN, et al. (Апрель 2011). «Генная терапия AAV2-GAD для развитой болезни Паркинсона: двойное слепое, контролируемое фиктивной хирургией, рандомизированное исследование». Lancet. Неврология . 10 (4): 309–319. doi : 10.1016/s1474-4422 (11) 70039-4 . PMID 21419704 . S2CID 37154043 .
- ^ Herper M (26 марта 2014 г.). «Большое возвращение генной терапии» . Форбс . Получено 28 апреля 2014 года .
- ^ Подпрыгнуть до: а беременный Пирсон С., Цзя Х, Кандачи К (январь 2004 г.). "China approves first gene therapy" . Nature Biotechnology . 22 (1): 3–4. doi : 10.1038/nbt0104-3 . PMC 7097065 . PMID 14704685 .
- ^ Подпрыгнуть до: а беременный «Генная терапия для PAD одобрена» . 6 декабря 2011 года . Получено 5 августа 2015 года .
- ^ Подпрыгнуть до: а беременный в Галлахер J (2 ноября 2012 г.). «Генная терапия: Глибера, одобренная Европейской комиссией» . BBC News . Получено 15 декабря 2012 года .
- ^ "Что такое генная терапия?" Полем Генетика дома ссылка . 28 марта 2016 года. Архивировано с оригинала 6 апреля 2016 года . Получено 2 января 2022 года .
- ^ "Как работает генная терапия?" Полем Геномика домашняя ссылка . Национальная библиотека медицины США.
- ^ Pezzoli D, Chiesa R, De Nardo L, Candiani G (сентябрь 2012 г.). «Нам еще предстоит пройти долгий путь, чтобы эффективно доставить гены!». Журнал прикладных биоматериалов и функциональных материалов . 10 (2): 82–91. doi : 10.5301/jabfm.2012.9707 . PMID 23015375 . S2CID 6283455 .
- ^ Vannucci L, Lai M, Chiuppesi F, Ceccherini-Nelli L, Pistello M (январь 2013 г.). «Вирусные векторы: оглядываться назад и впереди на технологии передачи генов». Новая микробиологика . 36 (1): 1–22. PMID 23435812 .
- ^ Gothelf A, Gehl J (ноябрь 2012 г.). «Что вам всегда нужно было знать о вакцинах ДНК на основе электропорации» . Human Vaccines & Immunotherapeutics . 8 (11): 1694–1702. doi : 10.4161/hv.22062 . PMC 3601144 . PMID 23111168 .
- ^ Урнов Ф.Д., Репор Э.Дж., Холмс М.К., Чжан Х.С., Грегори П.Д. (сентябрь 2010 г.). «Редактирование генома с помощью инженерных нуклеасов цинковых пальцев». Nature Reviews Genetics . 11 (9): 636–646. doi : 10.1038/nrg2842 . PMID 20717154 . S2CID 205484701 .
- ^ Подпрыгнуть до: а беременный Bak Ro, Gomez-Ospina N, Porteus MH (август 2018 г.). «Редактирование генов на центральной сцене». Тенденции в генетике . 34 (8): 600–611. doi : 10.1016/j.tig.2018.05.004 . PMID 29908711 . S2CID 49269023 .
- ^ Stone D, Niyonzima N, Jerome KR (сентябрь 2016 г.). «Редактирование генома и следующее поколение антивирусной терапии» . Человеческая генетика . 135 (9): 1071–82. doi : 10.1007/s00439-016-1686-2 . PMC 5002242 . PMID 27272125 .
- ^ Cross D, Burmester JK (сентябрь 2006 г.). «Генная терапия при лечении рака: прошлое, настоящее и будущее» . Клиническая медицина и исследования . 4 (3): 218–27. doi : 10.3121/cmr.4.3.218 . PMC 1570487 . PMID 16988102 .
- ^ Maeder ML, Gersbach CA (март 2016 г.). «Технологии редактирования генома для генной и клеточной терапии» . Молекулярная терапия . 24 (3): 430–46. doi : 10.1038/mt.2016.10 . PMC 4786923 . PMID 26755333 .
- ^ «Тесты предполагают, что ученые достигли 1 -го» в редактировании генов тела » . AP News . 7 февраля 2019 года . Получено 17 ноября 2020 года .
- ^ «Первая терапия CRISPR дозилась» . Nature Biotechnology . 38 (4): 382. 1 апреля 2020 года. DOI : 10.1038/S41587-020-0493-4 . ISSN 1546-1696 . PMID 32265555 . S2CID 215406440 .
- ^ Подпрыгнуть до: а беременный Sherkow JS, Zettler PJ, Greely HT (декабрь 2018 г.). "Это« генная терапия »?" Полем Журнал права и биологических наук . 5 (3): 786–793. doi : 10.1093/jlb/lsy020 . PMC 6534757 . PMID 31143463 .
- ^ Асалех А., Чжоу Дж, Рахманн Н (ноябрь 2022 г.). « Письмо редактору: урок для семантической неоднозначности в будущем, приводил к распространению антинаучных отношений о вакцинах вакцинов мРНК COVID-19» . Генная терапия человека . 33 (21–22): 1213–1216. doi : 10.1089/hum.2022.29223.AAS (неактивный 7 сентября 2024 г.). PMID 36375123 .
{{cite journal}}: CS1 Maint: doi неактивен по состоянию на сентябрь 2024 года ( ссылка ) - ^ «Эндрю Бридген ошибается, чтобы назвать генную терапию вакцины вакцины мРНК» . Полный факт . 12 января 2023 года . Получено 19 февраля 2023 года .
- ^ «Вакцины проверки фактов-мРНК отличаются от генной терапии, которая изменяет гены реципиента» . Рейтер . 10 августа 2021 года . Получено 19 февраля 2023 года .
- ^ «Джо Роган ложно говорит, что вакцины мРНК -« генная терапия » » . Политифакт . Получено 19 февраля 2023 года .
- ^ Спенсер Ш. (28 июня 2022 г.). «Веб-сайт торчат старым, разоблаченная ложь о вакцинах мРНК COVID-19» . Factcheck.org . Получено 19 февраля 2023 года .
- ^ «Эти эксперты говорят, что Джо Роган« чрезвычайно опасен »для общества - вот почему» . Независимый . 2 февраля 2022 года . Получено 19 февраля 2023 года .
- ^ «Ложные претензии Эндрю Бриджена депутата ставят под угрозу жизни» . Полный факт . 11 января 2023 года . Получено 19 февраля 2023 года .
- ^ Подпрыгнуть до: а беременный в дюймовый и Nobrega C, Mendonça L, Matos CA (2020). Справочник по генной и клеточной терапии . Чам: Спрингер. ISBN 978-3-030-41333-0 Полем OCLC 1163431307 .
- ^ Уильямс Д.А., Оркин Ш.Х. (апрель 1986 г.). «Соматическая генная терапия. Текущее состояние и будущие перспективы» . Журнал клинических исследований . 77 (4): 1053–6. doi : 10.1172/jci112403 . PMC 424438 . PMID 3514670 .
- ^ Mavilio F, Ferrari G (июль 2008 г.). «Генетическая модификация соматических стволовых клеток. Прогресс, проблемы и перспективы новой терапевтической технологии» . EMBO Reports . 9 (Suppl 1): S64–69. doi : 10.1038/inbom.2008.81 . PMC 3327547 . PMID 18578029 .
- ^ Подпрыгнуть до: а беременный в «Международное право» . Центр генетики и государственной политики, Институт биоэтики Университета Джонса Хопкинса. 2010. Архивировано из оригинала 2 сентября 2014 года.
- ^ Strachnan T, Read AP (2004). Молекулярная генетика человека (3 -е изд.). Garland Publishing. п. 616 . ISBN 978-0-8153-4184-0 .
- ^ Ханна К (2006). «Перенос гена зародышевой линии» . Национальный институт исследований генома человека.
- ^ «Клонирование человека и генетическая модификация» . Ассоциация чиновников репродуктивного здоровья. 2013. Архивировано из оригинала 18 июня 2013 года.
- ^ «Генная терапия» . Ama-Assn.org . 4 апреля 2014 года. Архивировано с оригинала 15 марта 2015 года . Получено 22 марта 2015 года .
- ^ "Gene & Cell Therapy FAQs | ASGCT - American Society of Gene & Cell Therapy | ASGCT - American Society of Gene & Cell Therapy" . asgct.org . Получено 23 июля 2021 года .
- ^ «Оценка клинического успеха ex vivo и генной терапии in vivo» . Журнал молодых следователей . Январь 2009 . Получено 23 июля 2021 года .
- ^ «Проблемы в генной терапии» . Learn.genetics.utah.edu . Получено 23 июля 2021 года .
- ^ Маллард А (июнь 2020 г.). «Редантирующий ген трубопровод взлетел». Природные обзоры. Открытие наркотиков . 19 (6): 367–372. doi : 10.1038/d41573-020-00096-y . PMID 32415249 . S2CID 218657910 .
- ^ Подпрыгнуть до: а беременный Maclaren RE, Groppe M, Barnard AR, Cottriall CL, Tolmachova T, Seymour L, Clark KR, во время MJ, Cremers FP, Black GC, Lotery AJ, Downes SM, Webster AR, Seabra MC (март 2014 г.). «Генная терапия сетчатки у пациентов с choroideremia: первоначальные результаты из фазы 1/2 клинического испытания» . Лансет . 383 (9923): 1129–1137. doi : 10.1016/s0140-6736 (13) 62117-0 . PMC 4171740 . PMID 24439297 .
- ^ Dever DP, Bak Ro, Reinisch A, Camarena J, Washington G, Nicolas CE, et al. (Ноябрь 2016). «Ген β-глобина CRISPR/CAS9, нацеленный на гематопоэтические стволовые клетки человека» . Природа . 539 (7629): 384–389. Bibcode : 2016nater.539..384d . doi : 10.1038/nature20134 . PMC 5898607 . PMID 27820943 .
- ^ Гупта Р.М., Мусунуру К (октябрь 2014 г.). «Расширение набора инструментов генетического редактирования: ZFNS, Talens и Crispr-Cas9» . Журнал клинических исследований . 124 (10): 4154–61. doi : 10.1172/jci72992 . PMC 4191047 . PMID 25271723 .
- ^ Sanches-Da-Silva GN, Medeiros LF, Lima FM (21 августа 2019 г.). "The Potential Use of the CRISPR-Cas System for HIV-1 Gene Therapy" . Международный журнал геномики . 2019 : 8458263. DOI : 10.1155/2019/8458263 . PMC 6721108 . PMID 31531340 .
- ^ Patent: US7824869B2
- ^ Bi A, Cui J, Ma YP, Ольшевская Е., Пу м, Дицхур А.М., Пан Ч.Х. (апрель 2006 г.). «Эктопическая экспрессия родопсина микробного типа восстанавливает визуальные ответы у мышей с дегенерацией фоторецептора» . Нейрон . 50 (1): 23–33. doi : 10.1016/j.neuron.2006.02.026 . PMC 1459045 . PMID 16600853 .
- ^ Подпрыгнуть до: а беременный Песня, Сянгронг; Лю, Чао; Ван, Нин; Хуан, Хай; Он, Сиян; Гонг, Чаньянг; Вэй, Юкюан (1 января 2021 года). «Доставка систем CRISPR/CAS для генной терапии рака и иммунотерапии» . Расширенные обзоры доставки наркотиков . Доставка биомакромолекул для редактирования терапевтического генома. 168 : 158–180. doi : 10.1016/j.addr.2020.04.010 . ISSN 0169-409X . PMID 32360576 . S2CID 218493473 .
- ^ Nayerossadat N, Maedeh T, Ali Pa (2012). «Вирусные и невирусные системы доставки для доставки генов» . Усовершенствованные биомедицинские исследования . 1 (1): 27. doi : 10.4103/2277-9175.98152 . PMC 3507026 . PMID 23210086 .
- ^ Подпрыгнуть до: а беременный в дюймовый и фон Джинн С.Л., Амайя А.К., Александр И.Е., Эдельштейн М., Абеди М.Р. (май 2018). «Клинические испытания генной терапии по всему миру до 2017 года: обновление» . Журнал генной медицины . 20 (5): E3015. doi : 10.1002/jgm.3015 . PMID 29575374 . S2CID 4966300 .
- ^ Подпрыгнуть до: а беременный Bulcha JT, Wang Y, Ma H, Tai PW, Gao G (февраль 2021 г.). «Вирусные векторные платформы в среде генной терапии» . Signal Transduction and Targeted Therapy . 6 (1): 53. doi : 10.1038/s41392-021-00487-6 . PMC 7868676 . PMID 33558455 .
- ^ Дженсен, Томас Лет; Gøtzsche, Casper René; WOLDBYE, DAVID PD (2021). «Современные и будущие перспективы генной терапии для редких генетических заболеваний, влияющих на мозг и спинной мозг» . Границы в молекулярной нейробиологии . 14 : 695937. DOI : 10.3389/fnmol.2021.695937 . ISSN 1662-5099 . PMC 8527017 . PMID 34690692 .
- ^ Манини А., Абати Е., Нюринни А., Корти С., Коми Г.П. (2022). «Аденоассоциированная генная терапия вирусом (AAV) для мышечной дистрофии Дюшенна: проблема стойкости трансгена» . Границы в неврологии . 12 : 814174. DOI : 10.3389/fneur.2021.814174 . PMC 8797140 . PMID 35095747 .
- ^ Подпрыгнуть до: а беременный в Sabatino DE, Bushman FD, Chandler RJ, Crystal RG, Davidson BL, Dolmetsch R, et al. (Август 2022). «Оценка состояния науки для аденоассоциированной интеграции вирусов: интегрированная перспектива» . Молекулярная терапия . 30 (8): 2646–2663. doi : 10.1016/j.ymthe.2022.06.004 . PMC 9372310 . PMID 35690906 .
- ^ Кампочиаро, Пенсильвания; Эйвери, Р.; Браун, DM; Heier, JS; Хо, ac; Huddleston, SM; Jaffe, GJ; Ханани, Ам; Pakola, S.; Pearamici, DJ; Wykoff, CC; Ван Эверен, С. (2024). «Генная терапия для неоваскулярной возрастной дегенерации желтого пятна путем субретинальной доставки RGX-314: исследование дозы фазы 1/2A». Лансет . 403 (10436): 1563–1573. doi : 10.1016/S0140-6736(24)00310-6 . PMID 38554726 .
- ^ Ханани, Ам; Бойер, DS; Wykoff, CC; Regillo, CD; Busbee, Bg; Pearamici, D.; Данциг, CJ; Джондеф, Британская Колумбия; Major Jr, JC; Turpcu, A.; KISS, S. (2024). «Безопасность и эффективность Ixoberogene Soroparvovec в неоваскулярной возрастной дегенерации макулах в Соединенных Штатах (Optic): проспективное двухлетнее, многоцентровое исследование фазы 1» . EclinicalMedicine . 67 doi : 10.1016/j.eclinm.2023.102394 . PMC 10751837 . PMID 38152412 .
- ^ Инь Х, Канасти Р.Л., Элтухи А.А., Вегас А.Дж., Доркин младший, Андерсон Д.Г. (август 2014 г.). «Невирусные векторы для генной терапии». Природные обзоры. Генетика . 15 (8): 541–555. doi : 10.1038/nrg3763 . PMID 25022906 . S2CID 15273455 .
- ^ Krasilnikova, O.; Якимова, а.; Иванов, с.; Atiakshin, D.; Костин, Аа; Сосин, Д.; Shegay, P.; Каприн, AD; Клабуков, И. (2023). «Активированные генов материалы в регенеративной стоматологии: повествовательный обзор технологий и результатов исследования» . Международный журнал молекулярных наук . 24 (22): 16250. DOI : 10.3390/IJMS242216250 . ISSN 1422-0067 . PMC 10671237 . PMID 38003439 .
- ^ FOLTVARI, M.; Чен, DW; Нафисси, н.; Calderon, D.; Narsineni, L.; Rafiee, A. (2016). «Невирусная генная терапия: выгоды и проблемы неинвазивных методов введения» . Журнал контролируемого выпуска . 240 : 165–190. doi : 10.1016/j.jconrel.2015.12.012 . ISSN 1873-4995 . PMID 26686079 .
- ^ Бертран Н., Гренер П., Махмуди М., Лима Э.М., Аппель Е.А., Дормонт Ф. и др. (Октябрь 2017). «Механистическое понимание образования короны белка in vivo на полимерных наночастицах и влияние на фармакокинетику» . Природная связь . 8 (1): 777. Bibcode : 2017natco ... 8..777b . doi : 10.1038/s41467-017-00600-w . PMC 5626760 . PMID 28974673 .
- ^ Подпрыгнуть до: а беременный в Госвами Р., Субраманян Г., Силайева Л., Ньюкирк И., Доктор Д., Чавла К. и др. (24 апреля 2019 г.). «Генная терапия оставляет порочный цикл» . Границы в онкологии . 9 : 297. DOI : 10.3389/fonc.2019.00297 . PMC 6491712 . PMID 31069169 .
- ^ Вирт Т., Паркер Н., Верхняя Герттуала С (август 2013 г.). «История генной терапии». Ген . 525 (2): 162–169. doi : 10.1016/j.gene.2013.03.137 . PMID 23618815 .
- ^ Сингх В., Хан Н., Джаяндхаран Гр (май 2022). «Векторная инженерия, стратегии и мишени в генной терапии рака». Генная терапия рака . 29 (5): 402–417. doi : 10.1038/s41417-021-00331-7 . PMID 33859378 . S2CID 233258994 .
- ^ Ангила XM, High Ka (январь 2019 г.). «Вход в современную эру генной терапии» . Ежегодный обзор медицины . 70 (1): 273–288. doi : 10.1146/annurev-med-012017-0433332 . PMID 30477394 . S2CID 53750215 .
- ^ Ван Ю, Чжан Р., Тан Л., Ян Л (февраль 2022 г.). «Невирусные системы доставки вакцин против мРНК для генной терапии рака» . Фармацевтика . 14 (3): 512. doi : 10.3390/pharmaceutics14030512 . PMC 8949480 . PMID 35335891 .
- ^ Подпрыгнуть до: а беременный «FDA предоставляет ускоренное одобрение Afamitresgene Autoleucel для неоперабельной или метастатической синовиальной саркомы» . США Управление по контролю за продуктами и лекарствами (FDA) . 2 августа 2024 года . Получено 19 сентября 2024 года .
 Эта статья включает текст из этого источника, который находится в общественном доступе .
Эта статья включает текст из этого источника, который находится в общественном доступе .
- ^ «FDA одобряет первую генную терапию рецептора Т-клеток для солидных опухолей» . AABB News & Resources . 6 августа 2024 года . Получено 19 сентября 2024 года .
- ^ Monga I, Qureshi A, Thakur N, Gupta AK, Kumar M (сентябрь 2017 г.). «Аспсирна: ресурс ASP-сирНК, обладающий терапевтическим потенциалом для генетических расстройств человека и алгоритма для прогнозирования их ингибирующей эффективности» . G3 . 7 (9): 2931–2943. doi : 10.1534/g3.117.044024 . PMC 5592921 . PMID 28696921 .
- ^ Подпрыгнуть до: а беременный Olowoyeye A, Okwundu CI (ноябрь 2020 г.). «Генная терапия при серповидно -клеточной анемии» . Кокрановская база данных систематических обзоров . 2020 (11): CD007652. doi : 10.1002/14651858.cd007652.pub7 . PMC 8275984 . PMID 33251574 .
- ^ Chen W, Hu Y, Ju D (август 2020 г.). «Генная терапия при нейродегенеративных расстройствах: достижения, понимание и перспективы » Acta Pharmaceutica Sinica B . 10 (8): 1347–1 Doi : 10.1016/ j.apsb.2020.01.0 7488363PMC 32963936PMID
- ^ «FDA одобряет первую генную терапию для детей с метахроматической лейкодистрофией» . США Управление по контролю за продуктами и лекарствами (FDA) (пресс -релиз). 9 августа 2024 года.
- ^ «Orchard Therapeutics получает одобрение EC для Libmeldy для лечения ранней метахроматической лейкодистрофии (MLD)» (пресс-релиз). Сад -терапия. 21 декабря 2020 года . Получено 23 июля 2021 года - Via Globenewswire.
- ^ Подпрыгнуть до: а беременный «FDA одобряет первую актуальную генную терапию для лечения ран у пациентов с дистрофическим эпидермолизом Bullosa» . США Управление по контролю за продуктами и лекарствами (FDA) (пресс -релиз). 19 мая 2023 года . Получено 31 июля 2023 года .
- ^ «FDA одобряет первую клеточную генную терапию для лечения взрослых и педиатрических пациентов с бета-талассемией, которым требуются регулярные переливания крови» . США Управление по контролю за продуктами и лекарствами (FDA) (пресс -релиз). 17 августа 2022 года . Получено 31 августа 2022 года .
- ^ «FDA одобряет первую клеточную генную терапию для взрослых пациентов с рецидивом или рефрактерным MCL» . США Управление по контролю за продуктами и лекарствами (FDA) (пресс -релиз). 24 июля 2020 года . Получено 24 июля 2020 года .
- ^ «FDA одобряет брексукабтаген Autoleucel для рецидивирования или рефрактерного B-клеточного предшественника острого лимфобластного лейкоза» . США Управление по контролю за продуктами и лекарствами (FDA) . 1 октября 2021 года . Получено 2 октября 2021 года .
- ^ "Текарт" . Европейское агентство лекарств . 13 октября 2020 года.
- ^ Подпрыгнуть до: а беременный «FDA одобряет первую генную терапию для лечения некоторых пациентов с мышечной дистрофией Дюшенна» . США Управление по контролю за продуктами и лекарствами (FDA) (пресс -релиз). 23 июня 2023 года . Получено 12 июля 2023 года .
- ^ "Касгеви" . США Управление по контролю за продуктами и лекарствами (FDA) . 8 декабря 2023 года . Получено 8 декабря 2023 года .
- ^ «Абекма (Idecabtagene vicleucel)» . США Управление по контролю за продуктами и лекарствами (FDA). 21 апреля 2021 года.
- ^ «Брейанзи (лизокабтаген Маралеусель)» . США Управление по контролю за продуктами и лекарствами (FDA). 4 марта 2021 года.
- ^ «Лифтия» . США Управление по контролю за продуктами и лекарствами (FDA) . 8 декабря 2023 года. Архивировано с оригинала 8 декабря 2023 года . Получено 9 декабря 2023 года .
- ^ «FDA одобряет первую генную терапию для лечения рака мочевого пузыря высокого риска» . США Управление по контролю за продуктами и лекарствами (FDA) (пресс -релиз). 16 декабря 2022 года . Получено 16 декабря 2022 года .
- ^ "Золгенсма" . США Управление по контролю за продуктами и лекарствами (FDA). 16 марта 2021 года.
- ^ «Одобренное EMA приложение для Zolgensma» . ATETION (пресс -релиз) . Получено 23 июля 2021 года .
- ^ «FDA одобряет T-VEC для лечения метастатической меланомы» . Национальный институт рака . 25 ноября 2015 года . Получено 23 июля 2021 года .
- ^ "Имлигик" . Европейское агентство по лекарственным средствам (EMA) . 17 сентября 2018 года.
- ^ «Первая генная терапия для лечения тяжелой гемофилии А» . Европейское агентство по лекарственным средствам (EMA) (пресс -релиз). 24 июня 2022 года. Архивировано с оригинала 26 июня 2022 года . Получено 26 июня 2022 года .
- ^ «Roctavian: в ожидании решения EC» . Европейское агентство по лекарственным средствам (EMA) . 23 июня 2022 года. Архивировано с оригинала 26 июня 2022 года . Получено 26 июня 2022 года .
- ^ "Roctavian" . Союз Регистр лекарственных средств . 25 августа 2022 года . Получено 6 сентября 2022 года .
- ^ «FDA одобряет новую генную терапию для лечения пациентов с редкой формой наследственной потери зрения» . США Управление по контролю за продуктами и лекарствами (FDA) (пресс -релиз). 24 марта 2020 года . Получено 23 июля 2021 года .
- ^ "Luxturna" . Европейское агентство по лекарственным средствам (EMA) . 24 сентября 2018 года.
- ^ Го, конфликт; MA, Xioateng; Гао, Фэй; Го, Юксуан (9 марта 2023 г.). «Заключенные эффекты в редактировании генов CRISPR/CAS9» . Границы в биоинженерии и биотехнологии . 11 : 1143157. DOI : 10.3389/fbioe.2023.1143157 . ISSN 2296-4185 . PMC 10034092 . PMID 36970624 .
- ^ Ву, Шао-Шуай; Ли, Цин-Куй; Инь, Чанг-Цин; Сюэ, Вэнь; Песня, Чун-Цин (15 марта 2020 г.). «Достижения в генной терапии на основе CRISPR/CAS при генетических заболеваниях человека» . Тераностика . 10 (10): 4374–4382. doi : 10.7150/thno.43360 . ISSN 1838-7640 . PMC 7150498 . PMID 32292501 .
- ^ Korthof G. «Последствия обратной связи Стила для генной терапии человека» .
- ^ Вудс Н.Б., Боттеро В., Шмидт М., фон Калле С., Верма Им (апрель 2006 г.). «Генная терапия: терапевтический ген, вызывающий лимфому» . Природа . 440 (7088): 1123. Bibcode : 2006natur.440.1123W . doi : 10.1038/4401123a . PMID 16641981 . S2CID 4372110 .
- ^ Thrasher AJ, Gaspar HB, Baum C, Modlich U, Schambach A, Candotti F, et al. (Сентябрь 2006 г.). «Генная терапия: X-S-Scid Leukaemogicity». Природа . 443 (7109): E5-6, обсуждение E6-7. Bibcode : 2006natur.443e ... 5t . doi : 10.1038/nature05219 . PMID 16988659 . S2CID 4301764 .
- ^ Bak Ro, Porteus MH (июль 2017 г.). «CRISPR-опосредованная интеграция больших генов с использованием донорских векторов AAV» . Сотовые отчеты . 20 (3): 750–756. doi : 10.1016/j.celrep.2017.06.064 . PMC 5568673 . PMID 28723575 .
- ^ Rojahn Sy (11 февраля 2014 г.). «Хирургия генома» . MIT Technology Review . Архивировано из оригинала 15 февраля 2014 года . Получено 17 февраля 2014 года .
- ^ «Генной терапии нуждается в герои, чтобы оправдать шумиху» . Новый ученый . 30 октября 2013 года . Получено 2 января 2022 года .
- ^ Crasto Am (7 июля 2013 г.). «Glybera - самый дорогой препарат в мире и впервые утвердил генную терапию на Западе» . Все о наркотиках . Получено 2 ноября 2013 года .
- ^ «Генная терапия» . Национальная лаборатория Оук -Риджа . 20 декабря 2012 года. Архивировано с оригинала 20 декабря 2012 года . Получено 2 января 2022 года .
- ^ Raper SE, Chirmule N, Lee FS, Wivel NA, Bagg A, Gao GP, et al. (Сентябрь 2003 г.). «Синдром фатального системного воспалительного ответа у пациента с дефицитом орнитина транскарбамилазы после переноса аденовирусного гена». Молекулярная генетика и метаболизм . 80 (1–2): 148–58. doi : 10.1016/j.ymgme.2003.08.016 . PMID 14567964 .
- ^ Фрэнк К.М., Хогарт Д.К., Миллер Дж.Л., Мандал С., Миз П.Дж., Самулски Р.Дж. и др. (Июль 2009 г.). «Исследование причины смерти в исследовании генной терапии» . Новая Англия Журнал медицины . 361 (2): 161–9. doi : 10.1056/nejmoa0801066 . PMID 19587341 .
- ^ Комитет по этике Хьюго (апрель 2001 г.). «Заявление о исследованиях генной терапии» (PDF) . Организация генома человека . Архивировано из оригинала (PDF) 7 сентября 2008 года.
- ^ Исаси Р.М., Нгуен Т.М., Кнопперс Б.М. (октябрь 2006 г.). «Национальные нормативные рамки, касающиеся технологий генетической модификации человека (соматическая модификация и зародышевая линия)» (PDF) . Центр генетики и государственной политики. Архивировано из оригинала (PDF) 17 сентября 2014 года.
- ^ «Дом - NIH Genetic Testsing Registry (GTR) - NCBI» . www.ncbi.nlm.nih.gov . Получено 2 мая 2022 года .
- ^ Подпрыгнуть до: а беременный «Руководство NIH для исследований, включающих рекомбинантные или синтетические молекулы нуклеиновой кислоты» . Национальные институты здравоохранения США . Апрель 2016 года. Архивировано с оригинала 28 мая 2016 года.
- ^ «Прочитайте отчет Belmont» . HHS.gov . 15 января 2018 года . Получено 2 января 2022 года .
- ^ Управление по контролю за продуктами и лекарствами США (14 октября 1993 г.). «Применение современных законодательных органов к продуктам соматической клеточной терапии человека и продуктов генной терапии» (PDF) . Федеральный реестр . 58 (197). Архивировано (PDF) из оригинала 21 июня 2009 года.
- ^ «Руководство для промышленности: Руководство по соматической клеточной терапии человека и генной терапии» . США Управление по контролю за продуктами и лекарствами (FDA) . 9 июля 2009 г. Архивировано с оригинала 9 июля 2009 года . Получено 2 января 2022 года .
- ^ «Допинг гена WADA» . Вада. Архивировано из оригинала 21 ноября 2009 года . Получено 27 сентября 2013 года .
- ^ Кайзер Б., Маурон А., Миа А (март 2007 г.). «Текущая антидопинговая политика: критическая оценка» . Медицинская этика BMC . 8 : 2. DOI : 10.1186/1472-6939-8-2 . PMC 1851967 . PMID 17394662 .
- ^ Пауэлл Р., Бьюкенен А (февраль 2011 г.). «Разрушение цепей эволюции: перспектива преднамеренной генетической модификации у людей». Журнал медицины и философии . 36 (1): 6–27. doi : 10.1093/jmp/jhq057 . PMID 21228084 .
- ^ Baylis F, Robert JS (2004). «Неизбежность технологий генетического улучшения». Биоэтика . 18 (1): 1–26. doi : 10.1111/j.1467-8519.2004.00376.x . PMID 15168695 .
- ^ Эванс Дж. (2002). Играя в Бога?: Человеческая генетическая инженерия и рационализация публичных биоэтических дебатов . Университет Чикагской Прессы. ISBN 978-0-226-22262-2 .
- ^ «Центр этики здравоохранения - Медицинская школа Университета Миссури - генная терапия и генетическая инженерия» . ethics.missouri.edu . 3 декабря 2013 года. Архивировано с оригинала 3 декабря 2013 года . Получено 2 января 2022 года .
- ^ Roco MC, Bainbridge WS (2002). «Сходящиеся технологии для повышения производительности человека: интеграция из наноразмерного». Журнал исследований наночастиц . 4 (4): 281–295. Bibcode : 2002jnr ..... 4..281r . doi : 10.1023/a: 1021152023349 . S2CID 136290217 .
- ^ Allhoff F (март 2005 г.). «Генетическое улучшение зародышевой линии и первичные товары Rawlsian» (PDF) . Кеннеди Институт этики журнал . 15 (1): 39–56. Citeseerx 10.1.1.566.171 . doi : 10.1353/ken.2005.0007 . PMID 15881795 . S2CID 14432440 . Архивировано (PDF) из оригинала 30 января 2012 года.
- ^ Раниш Р. (январь 2020 г.). «Специальный выпуск: редактирование человеческой зародышевой линии» . Биоэтика . 34 (1): 1–143.
- ^ «Этические вопросы, связанные с пренатальным генетическим тестированием. Совет по этическим и судебным делам, Американская медицинская ассоциация». Архив семейной медицины . 3 (7): 633–642. Июль 1994 г. DOI : 10.1001/ARCHFAMI.3.7.633 . PMID 7921302 .
- ^ «Декларация Инуямы: картирование генома человека, генетический скрининг и генная терапия» . Совет международных организаций медицинских наук . Архивировано из оригинала 5 августа 2001 года.
- ^ Смит К.Р., Чан С., Харрис Дж (октябрь 2012 г.). «Генетическая модификация зародышевой линии человека: научные и биоэтические перспективы». Архив медицинских исследований . 43 (7): 491–513. doi : 10.1016/j.arcmed.2012.09.003 . PMID 23072719 .
- ^ Рирдон S (14 февраля 2017 г.). «US Science Consumpers измеряет путь к генетически модифицированным детям» . Природа . doi : 10.1038/nature.2017.21474 .
- ^ Подпрыгнуть до: а беременный Уэйд N (19 марта 2015 г.). «Ученые ищут запрет на метод редактирования человеческого генома» . New York Times . Архивировано из оригинала 2 января 2022 года . Получено 20 марта 2015 года .
- ^ Подпрыгнуть до: а беременный Поллак A (3 марта 2015 г.). «Мощный новый способ редактирования ДНК» . New York Times . Архивировано из оригинала 2 января 2022 года . Получено 20 марта 2015 года .
- ^ Подпрыгнуть до: а беременный Балтимор Д., Берг П., Ботчан М., Кэрролл Д., Чаро Р.А., Черч Г. и др. (Апрель 2015). «Биотехнология. Представленный путь вперед для геномной инженерии и модификации генов зародышевой линии» . Наука . 348 (6230): 36–38. Bibcode : 2015sci ... 348 ... 36b . doi : 10.1126/science.aab1028 . PMC 4394183 . PMID 25791083 .
- ^ Подпрыгнуть до: а беременный Lanphier E, Urnov F, Haecker SE, Werner M, Smolenski J (март 2015 г.). «Не редактируйте человеческую линию зародышей» . Природа . 519 (7544): 410–411. Bibcode : 2015natur.519..410L . doi : 10.1038/519410a . PMID 25810189 .
- ^ Liang P, Xu Y, Zhang X, Ding C, Huang R, Zhang Z, et al. (Май 2015). "CRISPR/Cas9-mediated gene editing in human tripronuclear zygotes" . Белок и клетка . 6 (5): 363–372. doi : 10.1007/s13238-015-0153-5 . PMC 4417674 . PMID 25894090 .
- ^ Kolata G (23 апреля 2015 г.). "Chinese Scientists Edit Genes of Human Embryos, Raising Concerns" . New York Times . Архивировано из оригинала 2 января 2022 года . Получено 24 апреля 2015 года .
- ^ Хармон А (14 февраля 2017 г.). «Редактирование человеческого гена получает поддержку научной панели» . New York Times . ISSN 0362-4331 . Архивировано из оригинала 2 января 2022 года . Получено 17 февраля 2017 года .
- ^ Комитет по редактированию генов человека: научные, медицинские и этические соображения. «Редактирование генома человека: наука, этика и управление» . Nationalacademies.org . Национальная академия наук; Национальная медицинская академия . Получено 21 февраля 2017 года .
- ^ «Ученые ОК, генетически инженерные дети» . New York Post . Рейтер. 14 февраля 2017 года . Получено 17 февраля 2017 года .
- ^ Friedmann T, Roblin R (март 1972 г.). «Генная терапия генетического заболевания человека?». Наука . 175 (4025): 949–955. Bibcode : 1972sci ... 175..949f . doi : 10.1126/science.175.4025.949 . PMID 5061866 . S2CID 19952096 .
- ^ Rogers S, New Scientist 1970, p. 194
- ^ Cepko CL, Roberts BE, Mulligan RC (июль 1984 г.). «Строительство и применение очень трансмиссивного вектора шаттла мышиного ретровируса. Этот вектор используется для входа в клетку в тело клетки человека». Клетка . 37 (3): 1053–1062. doi : 10.1016/0092-8674 (84) 90440-9 . PMID 6331674 . S2CID 34544709 .
- ^ «Первая генная терапия» . Фонд наук о жизни. 21 июня 2011 года. Архивировано с оригинала 28 ноября 2012 года . Получено 7 января 2014 года .
- ^ Blaese RM, Culver KW, Miller AD, Carter CS, Fleisher T, Clerici M, et al. (Октябрь 1995). «Генная терапия, направленная на T-лимфоциты для Adacid: начальные результаты исследования через 4 года» . Наука . 270 (5235): 475–480. Bibcode : 1995sci ... 270..475b . doi : 10.1126/science.270.5235.475 . PMID 7570001 . S2CID 46339645 .
- ^ Trojan J, Johnson TR, Rudin SD, Ilan J, Tykocinski ML, Ilan J (январь 1993 г.). «Лечение и профилактика глиобластомы крысы иммуногенными клетками C6, экспрессирующими антисмысловую инсулиноподобную РНК-фактор роста». Наука . 259 (5091): 94–97. Bibcode : 1993sci ... 259 ... 94t . doi : 10.1126/science.8418502 . PMID 8418502 .
- ^ Подпрыгнуть до: а беременный Trojan J, Pan YX, Wei MX, Ly A, Sheveve A, Bierwagen M, et al. (2012). «Методология антигеновой анти-IGF-I терапии злокачественными опухолями» . Исследования и практика химиотерапии . 2012 : 1–12. doi : 10.1155/2012/721873 . PMC 3287029 . PMID 22400112 .
- ^ Эбботт А (апрель 1992 г.). «Генная терапия. Итальянцы сначала используют стволовые клетки» . Природа . 356 (6369): 465. Bibcode : 1992nater.356..465a . doi : 10.1038/356465A0 . PMID 1560817 . S2CID 4319842 .
- ^ Cavazzana-Calvo M, Thrasher A, Mavilio F (февраль 2004 г.). «Будущее генной терапии». Природа . 427 (6977): 779–781. Bibcode : 2004natur.427..779c . doi : 10.1038/427779a . PMID 14985734 . S2CID 4421364 .
- ^ Blakeslee S (18 мая 1993 г.). «Лечение от« болезней -пузырькового мальчика » . New York Times . ISSN 0362-4331 . Получено 9 февраля 2018 года .
- ^ Налдини, Луиджи; Blömer, Ulrike; Галлай, Филипп; Ори, Даниэль; Маллиган, Ричард; Гейдж, Фред Х.; Верма, Индер М.; Троно, Дидье (12 апреля 1996 г.). «Доставка генов in vivo и стабильная трансдукция нендивирующихся клеток лентивирусным вектором» . Наука . 272 (5259): 263–267. Bibcode : 1996sci ... 272..263n . doi : 10.1126/science.272.5259.263 . ISSN 0036-8075 . PMID 8602510 . S2CID 18997464 .
- ^ Stein R (11 октября 2010 г.). «Первый пациент, получавший лечение в исследовании стволовых клеток» . The Washington Post . Получено 10 ноября 2010 года .
- ^ «Смерть побуждает FDA для суспендирования исследования генной терапии артрита» . Medpage сегодня. 27 июля 2007 г. Получено 10 ноября 2010 года .
- ^ Столберг С.Г. (22 января 2000 г.). «Заказанная генная терапия остановилась в университете» . New York Times . Получено 10 ноября 2010 года .
- ^ Wilson JF (18 марта 2002 г.). «Мышиная генная терапия исправляет симптомы серповидно -клеточной анемии» . Ученый - журнал наук о жизни . Получено 17 августа 2010 года .
- ^ «Генная терапия корректирует серповидно -клеточную болезнь в лабораторном исследовании» . Учебная больница Св. Иуды . 4 декабря 2008 г. Получено 29 декабря 2012 года - через ScienceDaily.
- ^ Пенман D (11 октября 2002 г.). «Тонкая генная терапия справляется с расстройством крови» . Новый ученый . Получено 17 августа 2010 года .
- ^ «ДНК нанобаллы повышают генную терапию» . Новый ученый . 12 мая 2002 г. Получено 17 августа 2010 года .
- ^ Ananthaswamy A (20 марта 2003 г.). "Undercover genes slip into the brain" . Новый ученый . Получено 17 августа 2010 года .
- ^ Холмс Р. (13 марта 2003 г.). «Генная терапия может отключить Хантингтон» . Новый ученый . Получено 17 августа 2010 года .
- ^ Ott MG, Schmidt M, Schwarzwaelder K, Stein S, Siler U, Koehl U, et al. (Апрель 2006 г.). «Коррекция x-связанных хронических гранулематозных заболеваний с помощью генной терапии, усиленная вставкой активации MDS1-EVI1, PRDM16 или SETBP1» . Природная медицина . 12 (4): 401–409. doi : 10.1038/nm1393 . PMID 16582916 . S2CID 7601162 .
- ^ Браун Б.Д., Веннери М.А., Зингале А., Серги Серги Л, Налдини Л (май 2006 г.). «Регуляция эндогенной микроРНК подавляет экспрессию трансгена в гематопоэтических линиях и обеспечивает стабильный перенос генов». Природная медицина . 12 (5): 585–591. doi : 10.1038/nm1398 . PMID 16633348 . S2CID 11114427 .
- ^ Morgan RA, Dudley ME, Wunderlich JR, Hughes MS, Yang JC, Sherry RM, et al. (Октябрь 2006 г.). «Регрессия рака у пациентов после переноса генетически инженерных лимфоцитов» . Наука . 314 (5796): 126–129. Bibcode : 2006sci ... 314..126M . doi : 10.1126/science.1129003 . PMC 2267026 . PMID 16946036 .
- ^ Levine BL, Humeau LM, Boyer J, MacGregor RR, Rebello T, Lu X, et al. (Ноябрь 2006 г.). «Передача генов у людей с использованием условно реплицирующего лентивирусного вектора» . Труды Национальной академии наук Соединенных Штатов Америки . 103 (46): 17372–17377. Bibcode : 2006pnas..10317372L . doi : 10.1073/pnas.0608138103 . PMC 1635018 . PMID 17090675 .
- ^ «Penn Medicine представляет данные исследования генной терапии ВИЧ в Croi 2009» . Эврикалерт! Полем 10 февраля 2009 года. Архивировано с оригинала 25 августа 2012 года . Получено 19 ноября 2009 года .
- ^ «Генная терапия сначала для плохого зрения» . BBC News . 1 мая 2007 г. Retrieved 3 May 2010 .
- ^ Dolgin E (2009). «Толковая слепота, скорректированная генной терапией» . Природа . doi : 10.1038/news.2009.921 .
- ^ Cartier N, Hacein-Bey-Abina S, Bartholomae CC, Veres G, Schmidt M, Kutschera I, et al. (Ноябрь 2009 г.). «Гена гематопоэтическая генная терапия стволовыми клетками с лентивирусным вектором в x-связанной адренолекодистрофии» (PDF) . Наука . 326 (5954): 818–823. Bibcode : 2009sci ... 326..818c . doi : 10.1126/science.1171242 . PMID 19892975 . S2CID 27783 .
- ^ Комаром А.М., Александр Дж.Дж., Роулан Дж.С., Гарсия М.М., Чиодо В.А., Кая А. и др. (Июль 2010). «Генная терапия спасает функцию конуса в врожденной архизии » человека Молекулярная генетика 19 (13): 2581–2 Doi : 10.1093/ hmg/ ddq1 2883338PMC 20378608PMID
- ^ Каваззана-Кальво М, Пейен Е., Негере О., Ван Г., Хехир К., Фузил Ф. и др. (Сентябрь 2010). «Независимость трансфузии и активация HMGA2 после генной терапии β-талассиемии человека» . Природа . 467 (7313): 318–322. BIBCODE : 2010NATR.467..318C . doi : 10.1038/nature09328 . PMC 3355472 . PMID 20844535 .
- ^ Galanello R, Origra R (май 2010 г.). «Бета-талассемия» . ОРФАНЕТНЫЙ ЖУРНАЛ РЕДИЧНЫХ БОЛЬШЕ . 5 : 11. DOI : 10.1186/1750-1172-5-11 . PMC 2893117 . PMID 20492708 .
- ^ Подпрыгнуть до: а беременный Билс JK (16 сентября 2010 г.). «Генная терапия освобождает пациента с бета-талассемией от переливаний в течение 2+ лет» . Medscape . Получено 15 декабря 2012 года .
- ^ Подпрыгнуть до: а беременный Leboulch P (20 марта 2013 г.). «Пятилетний результат лентивирусной генной терапии для бета-талассемии человека, уроков и перспектив» . Thalassemia Reports . 3 (1S): 108. doi : 10.4081/thal.2013.s1.e43 .
- ^ Подпрыгнуть до: а беременный Номер клинического испытания NCT01639690 лентивирусным вектором, кодирующим нормальный ген β-глобина человека». для «β-талассемии с аутологичными CD34+ гематопоэтическими клетками-предшественниками, трансдуцированными TNS9.3.55
- ^ Page PJ, Trojan J (2016). «Испытание на биомаркер IGF-I-это этический контекст» Adv Modern Oncol Res 2 (4): 188–2 doi : 10.18282/amor.v2.i4 .
{{cite journal}}: CS1 Maint: doi неактивен по состоянию на сентябрь 2024 года ( ссылка ) - ^ Castillo T, Trojan A, Noguera MC, Jay LM, Crane C, Alvarez A, et al. (2016). «Эпистемологический опыт разработки биомолекулярной технологии для стратегии иммунотерапии генов» [эпистемологический опыт в разработке технологии молекулярной биологии для стратегии иммуногенной терапии]. Rev Cien (in Spanish). 2 (25): 228–240. Doi : 10.14483 // uudistital.jour.rc.2016.25.a6 .
- ^ Розенберг Т (27 мая 2011 г.). «Человек, который был вылечен от ВИЧ и что это значит для лекарства от СПИДа» . Нью-Йорк . Получено 2 января 2022 года .
- ^ «Письма от директора: вспоминать Тимоти Рэй Браун: чемпион для исследования по лечению ВИЧ | NIH Офис исследований СПИДа» . www.oar.nih.gov . Получено 26 июня 2022 года .
- ^ «Генная терапия вызывает у нескольких пациентов с лейкемией без рака. Будет ли она работать и для других видов рака?» Полем Сингулярность Хаб. 6 января 2014 года . Получено 7 января 2014 года .
- ^ Ян З.Дж., Чжан Юр, Чен Б., Чжан С.Л., Цзя Эз, Ван Л.С. и др. (Июль 2009 г.). «Фаза I Клиническое исследование по внутрикоронарному введению AD-HHGF, лечившего тяжелое заболевание коронарной артерии». Молекулярная биология отчетов . 36 (6): 1323–1329. doi : 10.1007/s11033-008-9315-3 . PMID 18649012 . S2CID 23419866 .
- ^ Hahn W, Pyun WB, Kim DS, Yoo WS, Lee SD, Won JH, et al. (Октябрь 2011). «Увеличенные кардиопротективные эффекты путем коэкспрессии двух изоформ фактора роста гепатоцитов из голой плазмидной ДНК в модели ишемической болезни сердца крысы». Журнал генной медицины . 13 (10): 549–555. doi : 10.1002/jgm.1603 . PMID 21898720 . S2CID 26812780 .
- ^ «Неоваскулоген» . Евролаб . Получено 4 августа 2015 года .
- ^ Deev RV, Bozo IY, Mzhavanadze ND, Voronov DA, Gavrilenko AV, Chervyakov YV, et al. (Сентябрь 2015). «PCMV-VEGF165 Внутримышечный перенос гена является эффективным методом лечения пациентов с хронической ишемией нижней конечности». Журнал сердечно -сосудистой фармакологии и терапии . 20 (5): 473–482. doi : 10.1177/1074248415574336 . PMID 25770117 . S2CID 13443907 .
- ^ «При раке: Исследование терапии стволовыми клетками дает надежду для пациентов с наследственным заболеванием крови» . Мемориал Слоан-Кеттеринг онкологический центр. 16 июля 2012 года . Получено 15 декабря 2012 года .
- ^ Поллак A (20 июля 2012 г.). «Европейское агентство рекомендует одобрить генную терапию» . New York Times . Получено 2 января 2022 года .
- ^ «Первая генная терапия, одобренная Европейской комиссией» . Uniqure (пресс -релиз). 2 ноября 2012 года. Архивировано с оригинала 5 ноября 2012 года . Получено 2 января 2022 года .
- ^ «Chiesi и Uniqure задерживают запуск Glybera для добавления данных» . Биотехнология . Письмо фармацевтическое . 4 августа 2014 года . Получено 28 августа 2014 года .
- ^ Burger L, Hirschler B (26 ноября 2014 г.). «Первая генная терапия лекарства устанавливает цену на миллион евро» . Рейтер . Получено 30 марта 2015 года .
- ^ Whalen J (2 ноября 2012 г.). «Ген-терапия знаменует собой основную веху» . Wall Street Journal .
- ^ Моррисон С (3 марта 2015 г.). «Цена в размере 1 миллиона долларов США для генной терапии Glybera». Торговые декле . 33 (3): 217–218. doi : 10.1038/nbt0315-217 . PMID 25748892 . S2CID 205266596 .
- ^ «Генная терапия одобрена в Европе впервые» . Архивировано с оригинала 4 января 2014 года.
- ^ Regalado A (4 мая 2016 г.). «Самая дорогая медицина в мире - это бюст» . MIT Technology Review .
- ^ Bosely S (30 апреля 2013 г.). «Новаторские испытания генной терапии дают надежду для пациентов с сердцем» . Хранитель . Получено 28 апреля 2014 года .
- ^ «Новости генной терапии сердца: клиника врачей» . thyphysiciansclinic.co.uk . 8 сентября 2013 года. Архивировано с оригинала 29 апреля 2014 года . Получено 2 января 2022 года .
- ^ «Celladon получает прорывную терапию от FDA для Mydicar, новая, первая в своем классе терапию в разработке для лечения сердечной недостаточности» . Моран . 10 июля 2015 года. Архивировано с оригинала 10 июля 2015 года . Получено 2 января 2022 года .
- ^ Fernàndez-Ruiz I (март 2016 г.). «Генная терапия: нет улучшения результатов с генной терапией при сердечной недостаточности». Природные обзоры. Кардиология . 13 (3): 122–123. doi : 10.1038/nrcardio.2016.14 . PMID 26843287 . S2CID 205472001 .
- ^ Biffi A, Montini E, Lorioli L, Cesani M, Fumagalli F, Plati T, et al. (Август 2013). «Летчевирусная гематопоэтическая гена стволовых клеток приносит пользу метахроматической лейкодистрофии» . Наука . 341 (6148): 1233158. DOI : 10.1126/Science.1233158 . PMID 23845948 . S2CID 206546808 .
- ^ Aiuti A, Biasco L, Scaramuzza S, Ferrua F, Cicalese MP, Baricordi C, et al. (Август 2013). «Гену -терапия лентивирусной гематопоэтической геновой терапией у пациентов с синдромом Вискотт -Альдрича» . Наука . 341 (6148): 1233151. DOI : 10.1126/Science.1233151 . PMC 4375961 . PMID 23845947 .
- ^ Галлахер J (21 апреля 2015 г.). «Генная терапия:« Ручный ВИЧ », используемый для лечения болезни» . BBC News, здоровье . Получено 21 апреля 2015 года .
- ^ Малех HL, OCHS HD (апрель 2015 г.). «Новая эра клинической пользы от генной терапии». Джама . 313 (15): 1522–1523. doi : 10.1001/Jama.2015.2055 . PMID 25898049 .
- ^ «Генная терапия лекарство для детей с болезнью« пузырька ребенка » . Наука ежедневно . 18 ноября 2014 года.
- ^ «Генная терапия обеспечивает безопасное, долгосрочное облегчение для пациентов с тяжелой гемофилией В» . Наука ежедневно . 20 ноября 2014 года.
- ^ Beali A (25 января 2014 г.). "Gene therapy restores sight in people with eye disease" . Новый ученый . Получено 25 января 2014 года .
- ^ Tebas P, Stein D, Tang WW, Frank I, Wang SQ, Lee G, et al. (Март 2014 г.). «Редактирование генов CCR5 в аутологичных CD4 T -клетках лиц, инфицированных ВИЧ» . Новая Англия Журнал медицины . 370 (10): 901–910. doi : 10.1056/nejmoa1300662 . PMC 4084652 . PMID 24597865 .
- ^ Дворский G (6 марта 2014 г.). «Ученые создают генетически модифицированные клетки, которые защищают от ВИЧ» . IO9, биотехнология . Получено 6 марта 2014 года .
- ^ Клиническое исследование Номер NCT02247843 для «генной терапии стволовых клеток при серповидно -клеточной анемии» на клинике.
- ^ Номер клинического испытания NCT00012545 для «сбора и хранения стволовых клеток пуповины для лечения серповидноклеточной анемии» на Clinicaltrials.gov
- ^ «Десять вещей, которые вы, возможно, пропустили в понедельник из мира бизнеса» . Бостонский глобус . 3 февраля 2015 года . Получено 13 февраля 2015 года .
- ^ Zimmer C (9 марта 2015 г.). "Protection Without a Vaccine" . New York Times . Архивировано из оригинала 2 января 2022 года . Получено 30 марта 2015 года .
- ^ Гарднер М.Р., Каттенхорн Л.М., Кондур Х.Р., фон Шауен М., Дорфман Т., Чианг Дж.Дж. и др. (Март 2015 г.). «AAV-экспрессированный ECD4-IG обеспечивает прочную защиту от нескольких проблем SHIV» . Природа . 519 (7541): 87–91. Bibcode : 2015natur.519 ... 87G . doi : 10.1038/nature14264 . PMC 4352131 . PMID 25707797 .
- ^ WADE N (3 декабря 2015 г.). «Ученые помещают мораторию в редактирование генома человека, которые можно было бы унаследовать» . New York Times . Архивировано из оригинала 2 января 2022 года . Получено 3 декабря 2015 года .
- ^ Уолш Ф. (3 декабря 2015 г.). "Редактирование генов: эра дизайнеров людей становится ближе?" Полем BBC News Health . Получено 31 декабря 2015 года .
- ^ «Генетически измененная кожа спасает мальчика, умирающего от редкого заболевания» . Npr.org .
- ^ Генри Р. (19 февраля 2017 г.). «Лейкемия лечебные надежды поднимаются по мере того, как девушка отредактирована» . Время . Получено 20 февраля 2017 года .
- ^ Образец I (5 ноября 2015 г.). «Малышка первой в мире, которая лечится« дизайнерскими иммунными клетками » . Хранитель . Получено 6 ноября 2015 года .
- ^ Подпрыгнуть до: а беременный « Дизайнерские ячейки» обращают рак одного года » . BBC News . 5 ноября 2015 года . Получено 11 декабря 2022 года .
- ^ «Сводка мнения1 (первоначальное разрешение) Strimvelis» (PDF) . Европейское агентство лекарств . 1 апреля 2016 года. С. 1–2. Архивировано из оригинала (PDF) 28 января 2018 года . Получено 13 апреля 2016 года .
- ^ Hirscheler B (1 апреля 2016 года). «Европа дает зеленый свет первой генной терапии для детей» . Рейтер . Получено 13 апреля 2016 года .
- ^ Ривз Р. (6 июня 2016 года). «Вторая генная терапия выигрывает одобрение в Европе» . Бионев . Архивировано из оригинала 21 февраля 2017 года . Получено 20 февраля 2017 года .
- ^ Coghlan A (9 апреля 2016 г.). «Генная терапия одобрена» . Новый ученый . № 3068. С. 8–9.
- ^ Сираноски Д (июль 2016 г.). «Китайские ученые для первого испытания первого человеческого CRISPR» . Природа . 535 (7613): 476–477. Bibcode : 2016natur.535..476c . doi : 10.1038/nature.2016.20302 . PMID 27466105 .
- ^ Беннетт Дж. (15 ноября 2016 г.). «Китайские ученые становятся первыми, чтобы использовать редактирование генов CRISPR на людей» . Популярная механика . Получено 16 ноября 2016 года .
- ^ Ли Т.В., Южный К.В., Перри Л.А., Пенни-Димри Дж.С., Аслам А.А. (июнь 2016 г.). Южный KW (ред.). «Актуальное муковисцидозом трансмембранного проводимости регулятора замена гена для заболевания легких, связанных с муковисцидозом» . Кокрановская база данных систематических обзоров . 2016 (6): CD005599. doi : 10.1002/14651858.cd005599.pub5 . PMC 8682957 . PMID 27314455 .
- ^ Whipple T (1 марта 2017 г.). «Новая генная терапия« уменьшает опухоли, такие как кубики льда » . Время . Получено 1 марта 2017 года .
- ^ Coghlan A (март 2017 г.). «Генная терапия» лечит мальчик крови, которая поражает миллионы » . Новый ученый .
- ^ «Одобрение FDA приносит первую генную терапию в Соединенные Штаты» (пресс -релиз). США Управление по контролю за продуктами и лекарствами (FDA). 30 августа 2017 года.
- ^ «FDA одобряет аксимиабтагенную цилолеукель для большой B-клеточной лимфомы» . США Управление по контролю за продуктами и лекарствами (FDA) . Получено 5 января 2018 года .
- ^ Зейнер Дж (6 октября 2017 г.). «DIY Human Crispr Myostatin Knockout» . YouTube . Архивировано с оригинала 11 ноября 2017 года . Получено 20 мая 2020 года .
- ^ Зейнер Дж. «Первая попытка редактирования гена человеческого гена» . Получено 20 мая 2020 года .
- ^ «AP Exclusive: США, ученые, пробуют 1 -е редактирование генов в теле» . AP News . 15 ноября 2017 года . Получено 17 ноября 2020 года .
- ^ Kaiser J (ноябрь 2017 г.). «Человеку вводили инструменты редактирования генов, чтобы вылечить его инвалидирующую болезнь. Вот что вам нужно знать» . Наука . doi : 10.1126/science.aar5098 .
- ^ Чжан С (15 ноября 2017 г.). «Первый человек, который отредактировал его гены в его теле» . Атлантика . Получено 17 ноября 2020 года .
- ^ Ледфорд H (5 сентября 2018 г.). «Первый тест редактирования генов в теле показывает обещание» . Природа . doi : 10.1038/d41586-018-06195-6 . S2CID 92840885 .
- ^ Marchione M (7 февраля 2019 г.). «Тесты предполагают, что ученые достигли 1 -го» в редактировании генов тела » . AP News . Получено 7 февраля 2019 года .
- ^ Персонал (2 февраля 2019 г.). «Восходящая доза-исследование редактирования генома с помощью нуклеазы цинкового пальца (ZFN) терапевтической SB-913 у субъектов с MPS II» . Clinicaltrials.gov . Национальная библиотека медицины США . Получено 7 февраля 2019 года .
- ^ Рангарджан С., Уолш Л., Лестер В., Перри Д., Мадан Б., Труд М. и др. (Декабрь 2017). "Передача гена AV5-Factator VII при тяжелой гемофилии А " Журнал медицины Новой Англии 377 (26): 2519–2530. doi : 10.1056/nejmoa1708483 . HDL : 10044/1/5 29224506PMID
- ^ Ван Ден Берг HM (декабрь 2017 г.). «Лечение от гемофилии в пределах досягаемости». Новая Англия Журнал медицины . 377 (26): 2592–2593. doi : 10.1056/nejme1713888 . PMID 29224412 .
- ^ «FDA одобряет новую генную терапию для лечения пациентов с редкой формой наследственной потери зрения» . США Управление по контролю за продуктами и лекарствами (FDA) (пресс -релиз). 19 декабря 2017 года . Получено 20 декабря 2017 года .
- ^ Herper M (2 января 2018 г.). «Spark Therapeutics устанавливает цену генной терапии слепоты в 850 000 долларов» . Форбс . Получено 4 января 2018 года .
- ^ Шеридан К (19 декабря 2017 г.). «FDA одобрила генную терапию для лечения слепоты в революционный момент для медицины на основе ДНК» . Newsweek . Получено 20 декабря 2017 года .
- ^ Stein R (24 мая 2019 г.). «За 2,1 миллиона долларов, новая генная терапия - самый дорогой препарат за всю историю» . ЭНЕРГЕТИЧЕСКИЙ ЯДЕРНЫЙ РЕАКТОР . Получено 24 мая 2019 года .
- ^ Тонг А (3 июня 2019 г.). «ЕС маркирует историческую ОК на генной терапии Bluebird для β-талассемии-теперь сидите и ждите цены» . Получено 4 июня 2019 года .
- ^ "Zynteglo Epar" . Европейское агентство по лекарственным средствам (EMA) . 25 марта 2019 года . Получено 8 июня 2020 года . Текст был скопирован из этого источника, которое является авторским европейским агентством лекарств. Воспроизведение разрешено при условии, что источник признан.
- ^ «Одиночное исследование дозы у участников с LCA10» . Clinicaltrials.gov . Получено 20 августа 2019 года .
- ^ «Allergan и Editas Medicine инициируют клиническое исследование 1/2 фазы Brilliance 1/2 AGN-151587 (Edit-101) для лечения LCA10» . Редакция медицины . Получено 20 августа 2019 года .
- ^ Ледфорд H (март 2020 г.). "CRISPR treatment inserted directly into the body for first time" . Природа . 579 (7798): 185. Bibcode : 2020nater.579..185L . doi : 10.1038/d41586-020-00655-8 . PMID 32157225 .
- ^ "Zolgensma Epar" . Европейское агентство по лекарственным средствам (EMA) . 24 марта 2020 года . Получено 16 октября 2020 года .
- ^ «Audentes Therapeutics предоставляет обновленную информацию о клиническом исследовании ASPIRO, оценивающем AT132 у пациентов с X-связанной миотубулярной миопатией» . Audentes Therapeutics . 10 августа 2020 года. Архивировано с оригинала 27 октября 2020 года . Получено 21 сентября 2020 года .
- ^ «Astellas 'Audentes сообщает о третьей смерти в исследовании генной терапии» . Жесткая биотехнология . 21 августа 2020 года . Получено 21 сентября 2020 года .
- ^ «Высокие дозы генной терапии AAV смерти» . Nature Biotechnology . 38 (8): 910. 1 августа 2020 года. DOI : 10.1038/S41587-020-0642-9 . ISSN 1546-1696 . PMID 32760031 . S2CID 220981004 .
- ^ Подпрыгнуть до: а беременный «Либмельди: в ожидании решения ЕС» . Европейское агентство по лекарственным средствам (EMA) . 16 октября 2020 года. Архивировано с оригинала 17 октября 2020 года . Получено 16 октября 2020 года . Текст был скопирован из этого источника, которое является авторским европейским агентством лекарств. Воспроизведение разрешено при условии, что источник признан.
- ^ «Новая генная терапия для лечения редкого генетического заболевания метахроматической лейкодистрофии» . Европейское агентство лекарств . 16 октября 2020 года . Получено 16 октября 2020 года . Текст был скопирован из этого источника, которое является авторским европейским агентством лекарств. Воспроизведение разрешено при условии, что источник признан.
- ^ "Libmeldy Epar" . Европейское агентство по лекарственным средствам (EMA) . 13 октября 2020 года . Получено 22 декабря 2020 года .
- ^ Лизоген (15 октября 2020 года). «Лизоген предоставляет обновленную информацию о клиническом исследовании Aavance, оценивающем Lys-SAF302 у пациентов с MPS IIIA-лизогеном» . Архивировано из оригинала 17 октября 2020 года . Получено 17 октября 2020 года .
- ^ Кон Д.Б., Бут С., Шоу К.Л., Сюй-Байфорд Дж., Гарабадиан Э., Тревисан В. и др. (Май 2021 г.). «Аутологичная лентивирусная генная терапия ex vivo для дефицита аденозин -деаминазы» . Новая Англия Журнал медицины . 384 (21): 2002–2013. doi : 10.1056/nejmoa2027675 . PMC 8240285 . PMID 33974366 .
- ^ Marchione M (11 мая 2021 г.). «Вирус СПИДа, используемый в генной терапии, чтобы исправить« пузырьковую детскую болезнь » . Статистика Получено 19 июля 2021 года .
- ^ «Генная терапия восстанавливает иммунную функцию у детей с редким иммунодефицитом» . Национальные институты здравоохранения (NIH) . 11 мая 2021 года . Получено 19 июля 2021 года .
- ^ «Почему генная терапия вызвала лейкемию у некоторых« пациентов с синдромом пузырьков » . Scienceday . Получено 19 июля 2021 года .
- ^ Mamcarz E, Zhou S, Lockey T, Abdelsamed H, Cross SJ, Kang G, et al. (Апрель 2019). «Лентивирусная генная терапия в сочетании с низкими дозами Бульфана у детей с SCID-X1» . Новая Англия Журнал медицины . 380 (16): 1525–1534. doi : 10.1056/nejmoa1815408 . PMC 6636624 . PMID 30995372 .
- ^ «ВИЧ использовался для лечения болезни пузырькового мальчика» . BBC News . 17 апреля 2019 года . Получено 19 июля 2021 года .
- ^ Питман Дж., Равиц Дж.Д. «Эти ученые, возможно, нашли лекарство от болезни« пузырькового мальчика » . Смитсоновский журнал . Получено 19 июля 2021 года .
- ^ Рор К (17 апреля 2019 г.). «Генная терапия восстанавливает иммунитет у детей с редким заболеванием иммунодефицита» . Национальные институты здравоохранения (NIH) . Получено 4 июня 2020 года .
- ^ Gillmore JD, Gane E, Taubel J, Kao J, Fontana M, Maitland ML, et al. (Август 2021 г.). «Редактирование генов генов CRISPR-Cas9 in vivo для амилоидоза транстиретина» . Новая Англия Журнал медицины . 385 (6): 493–502. doi : 10.1056/nejmoa2107454 . PMID 34215024 . S2CID 235722446 .
- ^ «Новости: обновление клинических испытаний: положительные данные для первой в истории медицины Crispr» in vivo » . CRISPR Medicine . Получено 16 декабря 2021 года .
- ^ «Новости о науке, которые сформировались в 2021 году: природные выборы». Природа . Декабрь 2021 года. DOI : 10.1038/D41586-021-03734-6 . PMID 34907370 . S2CID 245144020 .
- ^ Пирсон Т.С., Гупта Н., Сан-Себастьян В., Имамура-Чинг Дж., Вье-эвер А., Гриджалво-Перес А. и др. (Июль 2021 г.). «Генная терапия при дефиците декарбоксилазы L-аминокислот путем прямой доставки AAV2-AADC в дофаминергические нейроны AAV2-AADC в средний мозг» . Природная связь . 12 (1): 4251. Bibcode : 2021Natco..12.4251p . doi : 10.1038/s41467-021-24524-8 . PMC 8275582 . PMID 34253733 .
- ^ Ибрагим М (14 июля 2021 года). «Генная терапия восстанавливает отсутствующий дофамин у детей с редкой болезнью мозга» . Наука . Получено 18 июля 2021 года .
- ^ «Испытание генной терапии указывает на более широкое окно, чтобы изменить курс редкого заболевания» . Статистика 12 июля 2021 года . Получено 18 июля 2021 года .
- ^ Flotte TR, Catallepe O, Puri A, Batista AR, Moser R, McKenna-Yasek D, et al. (Февраль 2022 г.). «Генная терапия AAV при болезни Тей-Сакс» . Природная медицина . 28 (2): 251–259. doi : 10.1038/s41591-021-01664-4 . PMC 10786171 . PMID 35145305 . S2CID 246748772 .
- ^ Sena-Esteves M (14 февраля 2022 года). «Первая генная терапия при болезни Тей-Сакса успешно дана двум детям» . Разговор . Получено 7 марта 2022 года .
- ^ «Родители высказывают прорывную генную терапию для детей с болезнью Тей-Сакса» . Независимый . 18 февраля 2022 года . Получено 7 марта 2022 года .
- ^ «Upstaza: в ожидании решения EC» . Европейское агентство лекарств . 19 мая 2022 года. Архивировано из оригинала 25 мая 2022 года . Получено 22 мая 2022 года .
- ^ «PTC Therapeutics получает положительное мнение CHMP для Upstaza для лечения дефицита AADC» . PTC Therapeutics (пресс -релиз). 20 мая 2022 года . Получено 22 мая 2022 года .
- ^ Chowdary P, Shapiro S, Makris M, Evans G, Boyce S, Talks K, et al. (Июль 2022 г.). «Фаза 1-2 Исследование генной терапии AAVS3 у пациентов с гемофилией В» . Новая Англия Журнал медицины . 387 (3): 237–247. doi : 10.1056/nejmoa21199913 . PMID 35857660 . S2CID 250697905 .
- ^ «Новая генная терапия может снизить риск кровотечения для пациентов с гемофилией» . Scienceday . Получено 3 августа 2022 года .
- ^ «Трансформационная терапия лечит гемофилию B» . BBC News . 21 июля 2022 года . Получено 3 августа 2022 года .
- ^ «Редактирование базы: революционная терапия очищает неизлечимый рак девушки» . BBC News . 11 декабря 2022 года . Получено 11 декабря 2022 года .
- ^ «Генерапия глазки восстановили зрение мальчика. Подобные методы лечения могли бы помочь миллионам» . AP News . 24 июля 2023 года . Получено 31 июля 2023 года .
- ^ Хуан, Джинбо; Сюэ, Шуай; Бухманн, Петр; Тейксейра, я Пальма; Fussenegger, Мартин (16 августа 2023 г.). «Электрогенетическое интерфейс для программирования экспрессии генов млекопитающих с помощью постоянного тока » Природа метаболизм 5 (8): 1395–1407. Doi : 10.1038/ s42255-023-00850-7 10447240PMC 37524785PMID
Дальнейшее чтение
[ редактировать ]- «Генная терапия: обзор утвержденных и трубопроводных технологий» (PDF) . Cadth (171). Март 2018 года. Архивировал (PDF) из оригинала 19 октября 2018 года.
- Baum C, Düllmann J, Li Z, Fehse B, Meyer J, Williams DA, Von Kalle C (март 2003 г.). «Побочные эффекты ретровирусного переноса генов в гематопоэтические стволовые клетки». Кровь . 101 (6): 2099–2114. doi : 10.1182/blood-2002-07-2314 . PMID 12511419 . S2CID 8489829 .
- Дейли Дж (январь 2020 г.). «Приходит генная терапия: после ложных заводов лекарства, которые манипулируют кодексом жизни, наконец меняют жизнь» . Scientific American . 322 (1): нет. doi : 10.1038/scientificamerican012020-2sglzyn24kkpjwduvucdme . PMID 39014835 .
- Gardlík R, Pálffy R, Hodosy J, Lukács J, Turna J, Celec P (апрель 2005 г.). «Векторы и системы доставки в генной терапии». Медицинский научный монитор . 11 (4): RA110–121. PMID 15795707 .
- Хорн П.А., Моррис Дж.С., Нефф Т., Ким Х.П. (сентябрь 2004 г.). «Передача гена стволовых клеток - эффективность и безопасность в исследованиях крупных животных» . Молекулярная терапия . 10 (3): 417–431. doi : 10.1016/j.ymthe.2004.05.017 . PMID 15336643 .
- Parambi DG, Alharbi KS, Kumar R, Harilal S, Batiha GE, Cruz-Martins N, Magdy O, Musa A, Panda DS, Mathew B (октябрь 2021 г.). «Подход генной терапии с акцентом на факторы роста: теоретические и клинические результаты при нейродегенеративных заболеваниях » Molecular Neurobiology . 59 (1): 191–2 Doi : 10.1007/s12035-021-02555- Y 8518903PMC PMID 34655056
- Salmons B, Günzburg WH (апрель 1993 г.). «Целью ретровирусных векторов для генной терапии». Генная терапия человека . 4 (2): 129–141. doi : 10.1089/hum.1993.4.2-129 . PMID 8494923 .
- Персонал (18 ноября 2005 г.). «Генная терапия» . Информация о проекте генома человека . Национальная лаборатория Оук -Риджа . Архивировано из оригинала (FAQ) 27 апреля 2006 года . Получено 28 мая 2006 года .
- Tinkov S, Bekeredjian R, Winter G, Coester C (20 ноября 2000 г.). «Полиплекс-конъюгированные микропузырьки для повышенной генной терапии нацеленной на ультразвук» (PDF) . Центр Всемирного конгресса Джорджии , Атланта, Джорджия: 2008 г. Годовое собрание и экспозиция AAPS. Архивировано из оригинала (PDF) 7 июля 2012 года . Получено 26 января 2009 года .
- Ван Х., Шаяхметов Д.М., Лиге Т., Харки М., Ли К, Папайаннопулу Т., Стаматоянополеус Г., Либер А (сентябрь 2005 г.). «Капсид-модифицированный вспомогательный аденовирусный вектор, содержащий вектор, содержащий бета-глобина локуса, отображает нерушительную интеграцию и обеспечивает стабильную эритроид-специфическую экспрессию генов» . Журнал вирусологии . 79 (17): 10999–11013. doi : 10.1128/jvi.79.17.10999-11013.2005 . PMC 1193620 . PMID 16103151 .
