Деменция
| Деменция | |
|---|---|
| Другие имена | Старость, [ 1 ] старческое слабоумие |
 | |
| Lithograph of a man diagnosed with dementia in the 1800s | |
| Specialty | Neurology, psychiatry |
| Symptoms | Decreased ability to think and remember, emotional problems, problems with language, decreased motivation, general decline in cognitive abilities[2] |
| Complications | Malnutrition, aspiration pneumonia, inability to perform self-care tasks, personal safety challenges, akinetic mutism[3] |
| Usual onset | Varies, usually gradual[2] |
| Duration | Varies, usually long term[2] |
| Causes | Alzheimer's disease, vascular dementia, Lewy body disease, frontotemporal dementia, and others[2] |
| Risk factors | Lack of education and socialization, family history |
| Diagnostic method | Cognitive testing (mini–mental state examination)[4] |
| Differential diagnosis | Delirium, hypothyroidism[5][6] |
| Prevention | Early education, prevent high blood pressure, prevent obesity, no smoking, social engagement[7] |
| Treatment | Varies, some types can be reversed, but supportive care is given to people suffering from irreversible forms of dementia.[2] |
| Medication | Varies depending on the type, most medications have a small benefit[8] |
| Prognosis | Varies, life expectancy usually shortened |
| Frequency | 55 million (2021)[2] |
| Deaths | 2.4 million (2016)[9] |
Деменция — синдром , связанный со многими нейродегенеративными заболеваниями , характеризующийся общим снижением когнитивных способностей, что влияет на способность человека выполнять повседневную деятельность . Обычно это связано с проблемами памяти , мышления , поведения и моторики . [ 10 ] Помимо ухудшения памяти и нарушения образа мышления , наиболее распространенными симптомами деменции являются эмоциональные проблемы, трудности с речью и снижение мотивации . [ 2 ] Симптомы можно описать как возникающие в континууме на нескольких стадиях. [ 11 ] [ а ] В конечном итоге деменция оказывает значительное влияние на человека, тех, кто за ним ухаживает , и его социальные отношения в целом. [ 2 ] Диагностика деменции требует наблюдения за изменением обычного психического функционирования человека и более значительным снижением когнитивных функций , чем это может быть вызвано нормальным процессом старения . [ 13 ]
Several diseases and injuries to the brain, such as a stroke, can give rise to dementia. However, the most common cause is Alzheimer's disease, a neurodegenerative disorder.[2] The Diagnostic and Statistical Manual of Mental Disorders, Fifth Edition (DSM-5), has re-described dementia as a mild or major neurocognitive disorder with varying degrees of severity and many causative subtypes. The International Classification of Diseases (ICD-11) also classifies dementia as a neurocognitive disorder (NCD) with many forms or subclasses.[14] Dementia is listed as an acquired brain syndrome, marked by a decline in cognitive function, and is contrasted with neurodevelopmental disorders.[15] It is also described as a spectrum of disorders with causative subtypes of dementia based on a known disorder, such as Parkinson's disease for Parkinson's disease dementia, Huntington's disease for Huntington's disease dementia, vascular disease for vascular dementia, HIV infection causing HIV dementia, frontotemporal lobar degeneration for frontotemporal dementia, Lewy body disease for dementia with Lewy bodies, and prion diseases.[16] Subtypes of neurodegenerative dementias may also be based on the underlying pathology of misfolded proteins, such as synucleinopathies and tauopathies.[16] The coexistence of more than one type of dementia is known as mixed dementia.[15]
Many neurocognitive disorders may be caused by another medical condition or disorder, including brain tumours and subdural hematoma, endocrine disorders such as hypothyroidism and hypoglycemia, nutritional deficiencies including thiamine and niacin, infections, immune disorders, liver or kidney failure, metabolic disorders such as Kufs disease, some leukodystrophies, and neurological disorders such as epilepsy and multiple sclerosis. Some of the neurocognitive deficits may sometimes show improvement with treatment of the causative medical condition.[17]
Diagnosis of dementia is usually based on history of the illness and cognitive testing with imaging. Blood tests may be taken to rule out other possible causes that may be reversible, such as hypothyroidism (an underactive thyroid), and to determine the dementia subtype. One commonly used cognitive test is the mini–mental state examination. Although the greatest risk factor for developing dementia is aging, dementia is not a normal part of the aging process; many people aged 90 and above show no signs of dementia.[18] Several risk factors for dementia, such as smoking and obesity, are preventable by lifestyle changes. Screening the general older population for the disorder is not seen to affect the outcome.[19]
Dementia is currently the seventh leading cause of death worldwide and has 10 million new cases reported every year (approximately one every three seconds).[2] There is no known cure for dementia. Acetylcholinesterase inhibitors such as donepezil are often used and may be beneficial in mild to moderate disorder, but the overall benefit may be minor. There are many measures that can improve the quality of life of a person with dementia and their caregivers. Cognitive and behavioral interventions may be appropriate for treating the associated symptoms of depression.[20]
Signs and symptoms
[edit]The signs and symptoms of dementia are termed as the neuropsychiatric symptoms—also known as the behavioral and psychological symptoms—of dementia.[21][22] The behavioral symptoms can include agitation, restlessness, inappropriate behavior, sexual disinhibition, and verbal or physical aggression.[23] These symptoms may result from impairments in cognitive inhibition.[24] The psychological symptoms can include depression, hallucinations (most often visual),[25] delusions, apathy, and anxiety.[23][26] The most commonly affected areas of brain function include memory, language, attention, problem solving, and visuospatial function affecting perception and orientation. The symptoms progress at a continuous rate over several stages, and they vary across the dementia subtypes.[27][11] Most types of dementia are slowly progressive with some deterioration of the brain well established before signs of the disorder become apparent. There are often other conditions present, such as high blood pressure or diabetes, and there can sometimes be as many as four of these comorbidities.[28]
Signs of dementia include getting lost in a familiar neighborhood, using unusual words to refer to familiar objects, forgetting the name of a close family member or friend, forgetting old memories, and being unable to complete tasks independently.[29] People with developing dementia often fall behind on bill payments; specifically mortgage and credit cards, and a crashing credit score can be an early indicator of the disease.[30][31]
People with dementia are more likely to have problems with incontinence than those of a comparable age without dementia; they are three times more likely to have urinary incontinence and four times more likely to have fecal incontinence.[32][33]
Stages
[edit]The course of dementia is often described in four stages – pre-dementia, early, middle, and late, that show a pattern of progressive cognitive and functional impairment. More detailed descriptions can be arrived at by the use of numeric scales. These scales include the Global Deterioration Scale for Assessment of Primary Degenerative Dementia (GDS or Reisberg Scale), the Functional Assessment Staging Test (FAST), and the Clinical Dementia Rating (CDR).[34] Using the GDS, which more accurately identifies each stage of the disease progression, a more detailed course is described in seven stages – two of which are broken down further into five and six degrees. Stage 7(f) is the final stage.[35][36]
Pre-dementia
[edit]Pre-dementia includes pre-clinical and prodromal stages. The latter stage includes mild cognitive impairment (MCI), delirium-onset, and psychiatric-onset presentations.[37]
Pre-clinical
[edit]Sensory dysfunction is claimed for the pre-clinical stage, which may precede the first clinical signs of dementia by up to ten years.[11] Most notably the sense of smell is lost,[11][38] associated with depression and a loss of appetite leading to poor nutrition.[39] It is suggested that this dysfunction may come about because the olfactory epithelium is exposed to the environment, and the lack of blood–brain barrier protection allows toxic elements to enter and cause damage to the chemosensory networks.[11]
Prodromal
[edit]Pre-dementia states considered as prodromal are mild cognitive impairment (MCI) and mild behavioral impairment (MBI).[40][41][42]
Kynurenine is a metabolite of tryptophan that regulates microbiome signalling, immune cell response, and neuronal excitation. A disruption in the kynurenine pathway may be associated with the neuropsychiatric symptoms and cognitive prognosis in mild dementia.[43][44]
Signs and symptoms at the prodromal stage may be subtle, and the early signs often become apparent only in hindsight.[45] Of those diagnosed with MCI, 70% later progress to dementia.[13] In MCI, changes in the person's brain have been happening for a long time, but the symptoms are just beginning to appear. These problems, however, are not severe enough to affect daily function. If and when they do, the diagnosis becomes dementia. The person may have some memory problems and trouble finding words, but they can solve everyday problems and competently handle their life affairs.[46] During this stage, it is ideal to ensure that advance care planning has occurred to protect the person's wishes. Advance directives exist that are specific to sufferers of dementia;[47] these can be particularly helpful in addressing the decisions related to feeding which come with the progression of the illness.
MCI has been relisted in both DSM-5 and ICD-11 as "mild neurocognitive disorders", i.e. milder forms of the major neurocognitive disorder (dementia) subtypes.[48]
Early
[edit]In the early stage of dementia, symptoms become noticeable to other people. In addition, the symptoms begin to interfere with daily activities, and will register a score on a mini–mental state examination (MMSE). MMSE scores are set at 24 to 30 for a normal cognitive rating and lower scores reflect severity of symptoms. The symptoms are dependent on the type of dementia. More complicated chores and tasks around the house or at work become more difficult. The person can usually still take care of themselves but may forget things like taking pills or doing laundry and may need prompting or reminders.[49]
The symptoms of early dementia usually include memory difficulty, but can also include some word-finding problems, and problems with executive functions of planning and organization.[50] Managing finances may prove difficult. Other signs might be getting lost in new places, repeating things, and personality changes.[51]
In some types of dementia, such as dementia with Lewy bodies and frontotemporal dementia, personality changes and difficulty with organization and planning may be the first signs.[52]
Middle
[edit]As dementia progresses, initial symptoms generally worsen. The rate of decline is different for each person. MMSE scores between 6–17 signal moderate dementia. For example, people with moderate Alzheimer's dementia lose almost all new information. People with dementia may be severely impaired in solving problems, and their social judgment is often impaired. They cannot usually function outside their own home, and generally should not be left alone. They may be able to do simple chores around the house but not much else, and begin to require assistance for personal care and hygiene beyond simple reminders.[13] A lack of insight into having the condition will become evident.[53][54]
Late
[edit]People with late-stage dementia typically turn increasingly inward and need assistance with most or all of their personal care. People with dementia in the late stages usually need 24-hour supervision to ensure their personal safety, and meeting of basic needs. If left unsupervised, they may wander or fall; may not recognize common dangers such as a hot stove; or may not realize that they need to use the bathroom and become incontinent.[46] They may not want to get out of bed, or may need assistance doing so. Commonly, the person no longer recognizes familiar faces. They may have significant changes in sleeping habits or have trouble sleeping at all.[13]
Changes in eating frequently occur. Cognitive awareness is needed for eating and swallowing and progressive cognitive decline results in eating and swallowing difficulties. This can cause food to be refused, or choked on, and help with feeding will often be required.[55] For ease of feeding, food may be liquidized into a thick purée. They may also struggle to walk, particularly among those with Alzheimer's disease.[56][57][58] In some cases, terminal lucidity, a form of paradoxical lucidity, occurs immediately before death; in this phenomenon, there is an unexpected recovery of mental clarity.[59]
Causes
[edit]Many causes of dementia are neurodegenerative, and protein misfolding is a cardinal feature of these.[60] Other common causes include vascular dementia, dementia with Lewy bodies, frontotemporal dementia, and mixed dementia (commonly Alzheimer's disease and vascular dementia).[2][b][64] Less common causes include normal pressure hydrocephalus, Parkinson's disease dementia, syphilis, HIV, and Creutzfeldt–Jakob disease.[65]
Alzheimer's disease
[edit]
Alzheimer's disease accounts for 60–70% of cases of dementia worldwide. The most common symptoms of Alzheimer's disease are short-term memory loss and word-finding difficulties. Trouble with visuospatial functioning (getting lost often), reasoning, judgment and insight fail. Insight refers to whether or not the person realizes they have memory problems.
The part of the brain most affected by Alzheimer's is the hippocampus. Other parts that show atrophy (shrinking) include the temporal and parietal lobes. Although this pattern of brain shrinkage suggests Alzheimer's, it is variable and a brain scan is insufficient for a diagnosis.
Little is known about the events that occur during and that actually cause Alzheimer's disease. This is due to the fact that brain tissue from patients with the disease can only be studied after the person's death. However, it is known that one of the first aspects of the disease is a dysfunction in the gene that produces amyloid. Extracellular senile plaques (SPs), consisting of beta-amyloid (Aβ) peptides, and intracellular neurofibrillary tangles (NFTs) that are formed by hyperphosphorylated tau proteins, are two well-established pathological hallmarks of AD.[66] Amyloid causes inflammation around the senile plaques of the brain, and too much build-up of this inflammation leads to changes in the brain that cannot be controlled, leading to the symptoms of Alzheimer's.[67]
Several articles have been published on a possible relationship (as an either primary cause or exacerbation of Alzheimer's disease) between general anesthesia and Alzheimer's in specifically the elderly.[68]
Vascular
[edit]Vascular dementia accounts for at least 20% of dementia cases, making it the second most common type.[69] It is caused by disease or injury affecting the blood supply to the brain, typically involving a series of mini-strokes. The symptoms of this dementia depend on where in the brain the strokes occurred and whether the blood vessels affected were large or small.[13] Repeated injury can cause progressive dementia over time, while a single injury located in an area critical for cognition such as the hippocampus, or thalamus, can lead to sudden cognitive decline.[69] Elements of vascular dementia may be present in all other forms of dementia.[70]
Brain scans may show evidence of multiple strokes of different sizes in various locations. People with vascular dementia tend to have risk factors for disease of the blood vessels, such as tobacco use, high blood pressure, atrial fibrillation, high cholesterol, diabetes, or other signs of vascular disease such as a previous heart attack or angina.[71]
Lewy bodies
[edit]The prodromal symptoms of dementia with Lewy bodies (DLB) include mild cognitive impairment, and delirium onset.[72] The symptoms of DLB are more frequent, more severe, and earlier presenting than in the other dementia subtypes.[73] Dementia with Lewy bodies has the primary symptoms of fluctuating cognition, alertness or attention; REM sleep behavior disorder (RBD); one or more of the main features of parkinsonism, not due to medication or stroke; and repeated visual hallucinations.[74] The visual hallucinations in DLB are generally vivid hallucinations of people or animals and they often occur when someone is about to fall asleep or wake up. Other prominent symptoms include problems with planning (executive function) and difficulty with visual-spatial function,[13] and disruption in autonomic bodily functions.[75] Abnormal sleep behaviors may begin before cognitive decline is observed and are a core feature of DLB.[74] RBD is diagnosed either by sleep study recording or, when sleep studies cannot be performed, by medical history and validated questionnaires.[74]
Parkinson's disease
[edit]Parkinson's disease is associated with Lewy body dementia that often progresses to Parkinson's disease dementia following a period of dementia-free Parkinson's disease.[76]
Frontotemporal
[edit]Frontotemporal dementias (FTDs) are characterized by drastic personality changes and language difficulties. In all FTDs, the person has a relatively early social withdrawal and early lack of insight. Memory problems are not a main feature.[13][77] There are six main types of FTD. The first has major symptoms in personality and behavior. This is called behavioral variant FTD (bv-FTD) and is the most common. The hallmark feature of bv-FTD is impulsive behavior, and this can be detected in pre-dementia states.[42] In bv-FTD, the person shows a change in personal hygiene, becomes rigid in their thinking, and rarely acknowledges problems; they are socially withdrawn, and often have a drastic increase in appetite. They may become socially inappropriate. For example, they may make inappropriate sexual comments, or may begin using pornography openly. One of the most common signs is apathy, or not caring about anything. Apathy, however, is a common symptom in many dementias.[13]
Two types of FTD feature aphasia (language problems) as the main symptom. One type is called semantic variant primary progressive aphasia (SV-PPA). The main feature of this is the loss of the meaning of words. It may begin with difficulty naming things. The person eventually may lose the meaning of objects as well. For example, a drawing of a bird, dog, and an airplane in someone with FTD may all appear almost the same.[13] In a classic test for this, a patient is shown a picture of a pyramid and below it a picture of both a palm tree and a pine tree. The person is asked to say which one goes best with the pyramid. In SV-PPA the person cannot answer that question. The other type is called non-fluent agrammatic variant primary progressive aphasia (NFA-PPA). This is mainly a problem with producing speech. They have trouble finding the right words, but mostly they have a difficulty coordinating the muscles they need to speak. Eventually, someone with NFA-PPA only uses one-syllable words or may become totally mute.
A frontotemporal dementia associated with amyotrophic lateral sclerosis (ALS) known as (FTD-ALS) includes the symptoms of FTD (behavior, language and movement problems) co-occurring with amyotrophic lateral sclerosis (loss of motor neurons). Two FTD-related disorders are progressive supranuclear palsy (also classed as a Parkinson-plus syndrome),[78][79] and corticobasal degeneration.[13] These disorders are tau-associated.
Huntington's disease
[edit]Huntington's disease is a neurodegenerative disease caused by mutations in a single gene HTT, that encodes for huntingtin protein. Symptoms include cognitive impairment and this usually declines further into dementia.[80]
The first main symptoms of Huntington's disease often include:
- difficulty concentrating
- memory lapses
- depression - this can include low mood, lack of interest in things, or just abnormal feelings of hopelessness
- stumbling and clumsiness that is out of the ordinary
- mood swings, such as irritability or aggressive behavior to insignificant things[81]
HIV
[edit]HIV-associated dementia results as a late stage from HIV infection, and mostly affects younger people.[82] The essential features of HIV-associated dementia are disabling cognitive impairment accompanied by motor dysfunction, speech problems and behavioral change.[82] Cognitive impairment is characterised by mental slowness, trouble with memory and poor concentration. Motor symptoms include a loss of fine motor control leading to clumsiness, poor balance and tremors. Behavioral changes may include apathy, lethargy and diminished emotional responses and spontaneity. Histopathologically, it is identified by the infiltration of monocytes and macrophages into the central nervous system (CNS), gliosis, pallor of myelin sheaths, abnormalities of dendritic processes and neuronal loss.[83]
Creutzfeldt–Jakob disease
[edit]Creutzfeldt–Jakob disease is a rapidly progressive prion disease that typically causes dementia that worsens over weeks to months. Prions are disease-causing pathogens created from abnormal proteins.[84]
Alcoholism
[edit]Alcohol-related dementia, also called alcohol-related brain damage, occurs as a result of excessive use of alcohol particularly as a substance abuse disorder. Different factors can be involved in this development including thiamine deficiency and age vulnerability.[85][86] A degree of brain damage is seen in more than 70% of those with alcohol use disorder. Brain regions affected are similar to those that are affected by aging, and also by Alzheimer's disease. Regions showing loss of volume include the frontal, temporal, and parietal lobes, as well as the cerebellum, thalamus, and hippocampus.[86] This loss can be more notable, with greater cognitive impairments seen in those aged 65 years and older.[86]
Mixed dementia
[edit]More than one type of dementia, known as mixed dementia, may exist together in about 10% of dementia cases.[2] The most common type of mixed dementia is Alzheimer's disease and vascular dementia.[87] This particular type of mixed dementia's main onsets are a mixture of old age, high blood pressure, and damage to blood vessels in the brain.[15]
Diagnosis of mixed dementia can be difficult, as often only one type will predominate. This makes the treatment of people with mixed dementia uncommon, with many people missing out on potentially helpful treatments. Mixed dementia can mean that symptoms onset earlier, and worsen more quickly since more parts of the brain will be affected.[15]
Other
[edit]Chronic inflammatory conditions that may affect the brain and cognition include Behçet's disease, multiple sclerosis, sarcoidosis, Sjögren's syndrome, lupus, celiac disease, and non-celiac gluten sensitivity.[88][89] These types of dementias can rapidly progress, but usually have a good response to early treatment. This consists of immunomodulators or steroid administration, or in certain cases, the elimination of the causative agent.[89] A 2019 review found no association between celiac disease and dementia overall but a potential association with vascular dementia.[90] A 2018 review found a link between celiac disease or non-celiac gluten sensitivity and cognitive impairment and that celiac disease may be associated with Alzheimer's disease, vascular dementia, and frontotemporal dementia.[91] A strict gluten-free diet started early may protect against dementia associated with gluten-related disorders.[90][91]
Cases of easily reversible dementia include hypothyroidism, vitamin B12 deficiency, Lyme disease, and neurosyphilis. For Lyme disease and neurosyphilis, testing should be done if risk factors are present. Because risk factors are often difficult to determine, testing for neurosyphilis and Lyme disease, as well as other mentioned factors, may be undertaken as a matter of course where dementia is suspected.[13]: 31–32
Many other medical and neurological conditions include dementia only late in the illness. For example, a proportion of patients with Parkinson's disease develop dementia, though widely varying figures are quoted for this proportion.[92] When dementia occurs in Parkinson's disease, the underlying cause may be dementia with Lewy bodies or Alzheimer's disease, or both.[93] Cognitive impairment also occurs in the Parkinson-plus syndromes of progressive supranuclear palsy and corticobasal degeneration (and the same underlying pathology may cause the clinical syndromes of frontotemporal lobar degeneration). Although the acute porphyrias may cause episodes of confusion and psychiatric disturbance, dementia is a rare feature of these rare diseases. Limbic-predominant age-related TDP-43 encephalopathy (LATE) is a type of dementia that primarily affects people in their 80s or 90s and in which TDP-43 protein deposits in the limbic portion of the brain.[94]
Hereditary disorders that can also cause dementia include: some metabolic disorders such as lysosomal storage disorders, leukodystrophies, and spinocerebellar ataxias.
Diagnosis
[edit]Symptoms are similar across dementia types and it is difficult to diagnose by symptoms alone. Diagnosis may be aided by brain scanning techniques. In many cases, the diagnosis requires a brain biopsy to become final, but this is rarely recommended (though it can be performed at autopsy). In those who are getting older, general screening for cognitive impairment using cognitive testing or early diagnosis of dementia has not been shown to improve outcomes.[19][95] However, screening exams are useful in 65+ persons with memory complaints.[13]
Normally, symptoms must be present for at least six months to support a diagnosis.[96] Cognitive dysfunction of shorter duration is called delirium. Delirium can be easily confused with dementia due to similar symptoms. Delirium is characterized by a sudden onset, fluctuating course, a short duration (often lasting from hours to weeks), and is primarily related to a somatic (or medical) disturbance. In comparison, dementia has typically a long, slow onset (except in the cases of a stroke or trauma), slow decline of mental functioning, as well as a longer trajectory (from months to years).[97]
Some mental illnesses, including depression and psychosis, may produce symptoms that must be differentiated from both delirium and dementia.[98] These are differently diagnosed as pseudodementias, and any dementia evaluation needs to include a depression screening such as the Neuropsychiatric Inventory or the Geriatric Depression Scale.[99][13] Physicians used to think that people with memory complaints had depression and not dementia (because they thought that those with dementia are generally unaware of their memory problems). However, researchers have realized that many older people with memory complaints in fact have mild cognitive impairment the earliest stage of dementia. Depression should always remain high on the list of possibilities, however, for an elderly person with memory trouble. Changes in thinking, hearing and vision are associated with normal ageing and can cause problems when diagnosing dementia due to the similarities.[100] Given the challenging nature of predicting the onset of dementia and making a dementia diagnosis clinical decision making aids underpinned by machine learning and artificial intelligence have the potential to enhance clinical practice.[101]
Cognitive testing
[edit]| Test | Sensitivity | Specificity | Reference |
| MMSE | 71–92% | 56–96% | [102] |
| 3MS | 83–93% | 85–90% | [103] |
| AMTS | 73–100% | 71–100% | [103] |
Various brief cognitive tests (5–15 minutes) have reasonable reliability to screen for dementia, but may be affected by factors such as age, education and ethnicity.[104] Age and education have a significant influence on the diagnosis of dementia. For example, Individuals with lower education are more likely to be diagnosed with dementia than their educated counterparts.[105] While many tests have been studied,[106][107][108] presently the mini mental state examination (MMSE) is the best studied and most commonly used. The MMSE is a useful tool for helping to diagnose dementia if the results are interpreted along with an assessment of a person's personality, their ability to perform activities of daily living, and their behaviour.[4] Other cognitive tests include the abbreviated mental test score (AMTS), the, "modified mini–mental state examination" (3MS),[109] the Cognitive Abilities Screening Instrument (CASI),[110] the Trail-making test,[111] and the clock drawing test.[34] The MoCA (Montreal Cognitive Assessment) is a reliable screening test and is available online for free in 35 different languages.[13] The MoCA has also been shown somewhat better at detecting mild cognitive impairment than the MMSE.[112][41] People with hearing loss, which commonly occurs alongside dementia, score worse in the MoCA test, which could lead to a false diagnosis of dementia. Researchers have developed an adapted version of the MoCA test, which is accurate and reliable and avoids the need for people to listen and respond to questions.[113][114] The AD-8 – a screening questionnaire used to assess changes in function related to cognitive decline – is potentially useful, but is not diagnostic, is variable, and has risk of bias.[115] An integrated cognitive assessment (CognICA) is a five-minute test that is highly sensitive to the early stages of dementia, and uses an application deliverable to an iPad.[116][117] Previously in use in the UK, in 2021 CognICA was given FDA approval for its commercial use as a medical device.[117]
Another approach to screening for dementia is to ask an informant (relative or other supporter) to fill out a questionnaire about the person's everyday cognitive functioning. Informant questionnaires provide complementary information to brief cognitive tests. Probably the best known questionnaire of this sort is the Informant Questionnaire on Cognitive Decline in the Elderly (IQCODE).[118] Evidence is insufficient to determine how accurate the IQCODE is for diagnosing or predicting dementia.[119] The Alzheimer's Disease Caregiver Questionnaire is another tool. It is about 90% accurate for Alzheimer's when by a caregiver.[13] The General Practitioner Assessment Of Cognition combines both a patient assessment and an informant interview. It was specifically designed for use in the primary care setting.
Clinical neuropsychologists provide diagnostic consultation following administration of a full battery of cognitive testing, often lasting several hours, to determine functional patterns of decline associated with varying types of dementia. Tests of memory, executive function, processing speed, attention and language skills are relevant, as well as tests of emotional and psychological adjustment. These tests assist with ruling out other etiologies and determining relative cognitive decline over time or from estimates of prior cognitive abilities.[120]
Laboratory tests
[edit]Routine blood tests are usually performed to rule out treatable causes. These include tests for vitamin B12, folic acid, thyroid-stimulating hormone (TSH), C-reactive protein, full blood count, electrolytes, calcium, renal function, and liver enzymes. Abnormalities may suggest vitamin deficiency, infection, or other problems that commonly cause confusion or disorientation in the elderly.[121]
Imaging
[edit]A CT scan or MRI scan is commonly performed to possibly find either normal pressure hydrocephalus, a potentially reversible cause of dementia, or connected tumor. The scans can also yield information relevant to other types of dementia, such as infarction (stroke) that would point at a vascular type of dementia. These tests do not pick up diffuse metabolic changes associated with dementia in a person who shows no gross neurological problems (such as paralysis or weakness) on a neurological exam.[122]
The functional neuroimaging modalities of SPECT and PET are more useful in assessing long-standing cognitive dysfunction, since they have shown similar ability to diagnose dementia as a clinical exam and cognitive testing.[123] The ability of SPECT to differentiate vascular dementia from Alzheimer's disease, appears superior to differentiation by clinical exam.[124]
The value of PiB-PET imaging using Pittsburgh compound B (PiB) as a radiotracer has been established in predictive diagnosis, particularly Alzheimer's disease.[125]
Prevention
[edit]Risk factors
[edit]Risk factors for dementia include high blood pressure, hearing loss, smoking, obesity, depression, inactivity, diabetes, lower levels of education and low social contact. Over-indulgence in alcohol, lack of sleep, anemia, traumatic brain injury, and air pollution can also increase the chance of developing dementia.[7][126] Many of these risk factors, including the lower level of education, smoking, physical inactivity and diabetes, are modifiable.[127] Several of the group are known as vascular risk factors that may be possible to be reduced or eliminated.[128] Managing these risk factors can reduce the risk of dementia in individuals in their late midlife or older age. A reduction in a number of these risk factors can give a positive outcome.[129] The decreased risk achieved by adopting a healthy lifestyle is seen even in those with a high genetic risk.[130]
In addition to the above risk factors, other psychological features, including certain personality traits (high neuroticism, and low conscientiousness), low purpose in life, and high loneliness, are risk factors for Alzheimer's disease and related dementias.[131][132][133] For example, based on the English Longitudinal Study of Ageing (ELSA), research found that loneliness in older people can increase the risk of dementia by one-third. Not having a partner (being single, divorced, or widowed) can double the risk of dementia. However, having two or three closer relationships might reduce the risk by three-fifths.[134][135]
The two most modifiable risk factors for dementia are physical inactivity and lack of cognitive stimulation.[136] Physical activity, in particular aerobic exercise, is associated with a reduction in age-related brain tissue loss, and neurotoxic factors thereby preserving brain volume and neuronal integrity. Cognitive activity strengthens neural plasticity and together they help to support cognitive reserve. The neglect of these risk factors diminishes this reserve.[136]
Sensory impairments of vision and hearing are modifiable risk factors for dementia.[137] These impairments may precede the cognitive symptoms of Alzheimer's disease for example, by many years.[138] Hearing loss may lead to social isolation which negatively affects cognition.[139] Social isolation is also identified as a modifiable risk factor.[138] Age-related hearing loss in midlife is linked to cognitive impairment in late life, and is seen as a risk factor for the development of Alzheimer's disease and dementia. Such hearing loss may be caused by a central auditory processing disorder that makes the understanding of speech against background noise difficult. Age-related hearing loss is characterised by slowed central processing of auditory information.[138][140] Worldwide, mid-life hearing loss may account for around 9% of dementia cases.[141]
Frailty may increase the risk of cognitive decline, and dementia, and the inverse also holds of cognitive impairment increasing the risk of frailty. Prevention of frailty may help to prevent cognitive decline.[138]
There are no medications that can prevent cognitive decline and dementia.[142] However blood pressure lowering medications might decrease the risk of dementia or cognitive problems by around 0.5%.[143]
Economic disadvantage has been shown to have a strong link to higher dementia prevalence,[144] which cannot yet be fully explained by other risk factors.
Dental health
[edit]Limited evidence links poor oral health to cognitive decline. However, failure to perform tooth brushing and gingival inflammation can be used as dementia risk predictors.[145]
Oral bacteria
[edit]The link between Alzheimer's and gum disease is oral bacteria.[146] In the oral cavity, bacterial species include P. gingivalis, F. nucleatum, P. intermedia, and T. forsythia. Six oral treponema spirochetes have been examined in the brains of Alzheimer's patients.[147] Spirochetes are neurotropic in nature, meaning they act to destroy nerve tissue and create inflammation. Inflammatory pathogens are an indicator of Alzheimer's disease and bacteria related to gum disease have been found in the brains of patients with Alzheimer's disease.[147] The bacteria invade nerve tissue in the brain, increasing the permeability of the blood–brain barrier and promoting the onset of Alzheimer's. Individuals with a plethora of tooth plaque risk cognitive decline.[148] Poor oral hygiene can have an adverse effect on speech and nutrition, causing general and cognitive health decline.
Oral viruses
[edit]Herpes simplex virus (HSV) has been found in more than 70% of those aged over 50. HSV persists in the peripheral nervous system and can be triggered by stress, illness or fatigue.[147] High proportions of viral-associated proteins in amyloid plaques or neurofibrillary tangles (NFTs) confirm the involvement of HSV-1 in Alzheimer's disease pathology. NFTs are known as the primary marker of Alzheimer's disease. HSV-1 produces the main components of NFTs.[149]
Diet
[edit]Diet is seen to be a modifiable risk factor for the development of dementia. Thiamine deficiency is identified to increase the risk of Alzheimer's disease in adults.[150] The role of thiamine in brain physiology is unique and essential for the normal cognitive function of older people.[151] Many dietary choices of the elderly population, including the higher intake of gluten-free products, compromise the intake of thiamine as these products are not fortified with thiamine.[152]
The Mediterranean and DASH diets are both associated with less cognitive decline. A different approach has been to incorporate elements of both of these diets into one known as the MIND diet.[153] These diets are generally low in saturated fats while providing a good source of carbohydrates, mainly those that help stabilize blood sugar and insulin levels.[154] Raised blood sugar levels over a long time, can damage nerves and cause memory problems if they are not managed.[155] Nutritional factors associated with the proposed diets for reducing dementia risk include unsaturated fatty acids, vitamin E, vitamin C, flavonoids, vitamin B, and vitamin D.[156][157] A study conducted at the University of Exeter in the United Kingdom seems to have confirmed these findings with fruits, vegetables, whole grains, and healthy fats creating an optimum diet that can help reduce the risk of dementia by roughly 25%.[158]
The MIND diet may be more protective but further studies are needed. The Mediterranean diet seems to be more protective against Alzheimer's than DASH but there are no consistent findings against dementia in general. The role of olive oil needs further study as it may be one of the most important components in reducing the risk of cognitive decline and dementia.[153][159]
In those with celiac disease or non-celiac gluten sensitivity, a strict gluten-free diet may relieve the symptoms given a mild cognitive impairment.[90][91] Once dementia is advanced no evidence suggests that a gluten-free diet is useful.[90]
Omega-3 fatty acid supplements do not appear to benefit or harm people with mild to moderate symptoms.[160] However, there is good evidence that omega-3 incorporation into the diet is of benefit in treating depression, a common symptom,[161] and potentially modifiable risk factor for dementia.[7]
Management
[edit]There are limited options for treating dementia, with most approaches focused on managing or reducing individual symptoms. There are no treatment options available to delay the onset of dementia.[162] Acetylcholinesterase inhibitors are often used early in the disorder course; however, benefit is generally small.[8][163] More than half of people with dementia may experience psychological or behavioral symptoms including agitation, sleep problems, aggression, and/or psychosis. Treatment for these symptoms is aimed at reducing the person's distress and keeping the person safe. Treatments other than medication appear to be better for agitation and aggression.[164] Cognitive and behavioral interventions may be appropriate. Some evidence suggests that education and support for the person with dementia, as well as caregivers and family members, improves outcomes.[165] Palliative care interventions may lead to improvements in comfort in dying, but the evidence is low.[166] Exercise programs are beneficial with respect to activities of daily living, and potentially improve dementia.[167]
The effect of therapies can be evaluated for example by assessing agitation using the Cohen-Mansfield Agitation Inventory (CMAI); by assessing mood and engagement with the Menorah Park Engagement Scale (MPES);[168] and the Observed Emotion Rating Scale (OERS)[169] or by assessing indicators for depression using the Cornell Scale for Depression in Dementia (CSDD)[170] or a simplified version thereof.[171]
Often overlooked in treating and managing dementia is the role of the caregiver and what is known about how they can support multiple interventions. Findings from a 2021 systematic review of the literature found caregivers of people with dementia in nursing homes do not have sufficient tools or clinical guidance for behavioral and psychological symptoms of dementia (BPSD) along with medication use.[172] Simple measures like talking to people about their interests can improve the quality of life for care home residents living with dementia. A programme showed that such simple measures reduced residents' agitation and depression. They also needed fewer GP visits and hospital admissions, which also meant that the programme was cost-saving.[173][174]
Psychological and psychosocial therapies
[edit]Psychological therapies for dementia include some limited evidence for reminiscence therapy (namely, some positive effects in the areas of quality of life, cognition, communication and mood – the first three particularly in care home settings),[175] some benefit for cognitive reframing for caretakers,[176] unclear evidence for validation therapy[177] and tentative evidence for mental exercises, such as cognitive stimulation programs for people with mild to moderate dementia.[178] Offering personally tailored activities may help reduce challenging behavior and may improve quality of life.[179] It is not clear if personally tailored activities have an impact on affect or improve for the quality of life for the caregiver.[179]
Adult daycare centers as well as special care units in nursing homes often provide specialized care for dementia patients. Daycare centers offer supervision, recreation, meals, and limited health care to participants, as well as providing respite for caregivers. In addition, home care can provide one-to-one support and care in the home allowing for more individualized attention that is needed as the disorder progresses. Psychiatric nurses can make a distinctive contribution to people's mental health.[180]
Since dementia impairs normal communication due to changes in receptive and expressive language, as well as the ability to plan and problem solve, agitated behavior is often a form of communication for the person with dementia. Actively searching for a potential cause, such as pain, physical illness, or overstimulation can be helpful in reducing agitation.[181] Additionally, using an "ABC analysis of behavior" can be a useful tool for understanding behavior in people with dementia. It involves looking at the antecedents (A), behavior (B), and consequences (C) associated with an event to help define the problem and prevent further incidents that may arise if the person's needs are misunderstood.[182] The strongest evidence for non-pharmacological therapies for the management of changed behaviors in dementia is for using such approaches.[183] Low quality evidence suggests that regular (at least five sessions of) music therapy may help institutionalized residents. It may reduce depressive symptoms and improve overall behaviors. It may also supply a beneficial effect on emotional well-being and quality of life, as well as reduce anxiety.[184] In 2003, The Alzheimer's Society established 'Singing for the Brain' (SftB) a project based on pilot studies which suggested that the activity encouraged participation and facilitated the learning of new songs. The sessions combine aspects of reminiscence therapy and music.[185] Musical and interpersonal connectedness can underscore the value of the person and improve quality of life.[186]
Some London hospitals found that using color, designs, pictures and lights helped people with dementia adjust to being at the hospital. These adjustments to the layout of the dementia wings at these hospitals helped patients by preventing confusion.[187]
Life story work as part of reminiscence therapy, and video biographies have been found to address the needs of clients and their caregivers in various ways, offering the client the opportunity to leave a legacy and enhance their personhood and also benefitting youth who participate in such work. Such interventions can be more beneficial when undertaken at a relatively early stage of dementia. They may also be problematic in those who have difficulties in processing past experiences[186]
Animal-assisted therapy has been found to be helpful. Drawbacks may be that pets are not always welcomed in a communal space in the care setting. An animal may pose a risk to residents, or may be perceived to be dangerous. Certain animals may also be regarded as "unclean" or "dangerous" by some cultural groups.[186]
Occupational therapy also addresses psychological and psychosocial needs of patients with dementia through improving daily occupational performance and caregivers' competence.[188] When compensatory intervention strategies are added to their daily routine, the level of performance is enhanced and reduces the burden commonly placed on their caregivers.[188] Occupational therapists can also work with other disciplines to create a client centered intervention.[189] To manage cognitive disability, and coping with behavioral and psychological symptoms of dementia, combined occupational and behavioral therapies can support patients with dementia even further.[189]
Cognitive training and rehabilitation
[edit]There is no strong evidence to suggest that cognitive training is beneficial for people with Parkinson's disease, dementia, or mild cognitive impairment.[190] However, a 2023 review found that cognitive rehabilitation may be effective in helping individuals with mild to moderate dementia to manage their daily activities.[191]
Personally tailored activities
[edit]Offering personally tailored activity sessions to people with dementia in long-term care homes may slightly reduce challenging behavior.[192]
Medications
[edit]No medications have been shown to prevent or cure dementia.[193] Medications may be used to treat the behavioral and cognitive symptoms, but have no effect on the underlying disease process.[13][194]
Acetylcholinesterase inhibitors, such as donepezil, may be useful for Alzheimer's disease,[195] Parkinson's disease dementia, DLB, or vascular dementia.[194] The quality of the evidence is poor[196] and the benefit is small.[8] No difference has been shown between the agents in this family.[197] In a minority of people side effects include a slow heart rate and fainting.[198] Rivastigmine is recommended for treating symptoms in Parkinson's disease dementia.[64]
Medications that have anticholinergic effects increase all-cause mortality in people with dementia, although the effect of these medications on cognitive function remains uncertain, according to a systematic review published in 2021.[199]
Before prescribing antipsychotic medication in the elderly, an assessment for an underlying cause of the behavior is needed.[200] Severe and life-threatening reactions occur in almost half of people with DLB,[75][201] and can be fatal after a single dose.[202] People with Lewy body dementias who take neuroleptics are at risk for neuroleptic malignant syndrome, a life-threatening illness.[203] Extreme caution is required in the use of antipsychotic medication in people with DLB because of their sensitivity to these agents.[74] Antipsychotic drugs are used to treat dementia only if non-drug therapies have not worked, and the person's actions threaten themselves or others.[204][205][206][207] Aggressive behavior changes are sometimes the result of other solvable problems, that could make treatment with antipsychotics unnecessary.[204] Because people with dementia can be aggressive, resistant to their treatment, and otherwise disruptive, sometimes antipsychotic drugs are considered as a therapy in response.[204] These drugs have risky adverse effects, including increasing the person's chance of stroke and death.[204] Given these adverse events and small benefit antipsychotics are avoided whenever possible.[183] Generally, stopping antipsychotics for people with dementia does not cause problems, even in those who have been on them a long time.[208]
N-methyl-D-aspartate (NMDA) receptor blockers such as memantine may be of benefit but the evidence is less conclusive than for AChEIs.[195] Due to their differing mechanisms of action memantine and acetylcholinesterase inhibitors can be used in combination however the benefit is slight.[209][210]
An extract of Ginkgo biloba known as EGb 761 has been widely used for treating mild to moderate dementia and other neuropsychiatric disorders.[211] Its use is approved throughout Europe.[212] The World Federation of Biological Psychiatry guidelines lists EGb 761 with the same weight of evidence (level B) given to acetylcholinesterase inhibitors, and memantine. EGb 761 is the only one that showed improvement of symptoms in both AD and vascular dementia. EGb 761 is seen as being able to play an important role either on its own or as an add-on particularly when other therapies prove ineffective.[211] EGb 761 is seen to be neuroprotective; it is a free radical scavenger, improves mitochondrial function, and modulates serotonin and dopamine levels. Many studies of its use in mild to moderate dementia have shown it to significantly improve cognitive function, activities of daily living, neuropsychiatric symptoms, and quality of life.[211][213] However, its use has not been shown to prevent the progression of dementia.[211]
While depression is frequently associated with dementia, the use of antidepressants such as selective serotonin reuptake inhibitors (SSRIs) do not appear to affect outcomes.[214][215] However, the SSRIs sertraline and citalopram have been demonstrated to reduce symptoms of agitation, compared to placebo.[216]
No solid evidence indicates that folate or vitamin B12 improves outcomes in those with cognitive problems.[217] Statins have no benefit in dementia.[218] Medications for other health conditions may need to be managed differently for a person who has a dementia diagnosis. It is unclear whether blood pressure medication and dementia are linked. People may experience an increase in cardiovascular-related events if these medications are withdrawn.[219]
The Medication Appropriateness Tool for Comorbid Health Conditions in Dementia (MATCH-D) criteria can help identify ways that a diagnosis of dementia changes medication management for other health conditions.[220] These criteria were developed because people with dementia live with an average of five other chronic diseases, which are often managed with medications. The systematic review that informed the criteria were published subsequently in 2018 and updated in 2022.[221]
Sleep disturbances
[edit]Over 40% of people with dementia report sleep problems. Approaches to treating these sleep problems include medications and non-pharmacological approaches.[222] The use of medications to alleviate sleep disturbances that people with dementia often experience has not been well researched, even for medications that are commonly prescribed.[223] In 2012 the American Geriatrics Society recommended that benzodiazepines such as diazepam, and non-benzodiazepine hypnotics, be avoided for people with dementia due to the risks of increased cognitive impairment and falls.[224] Benzodiazepines are also known to promote delirium.[225] Additionally, little evidence supports the effectiveness of benzodiazepines in this population.[223][226] No clear evidence shows that melatonin or ramelteon improves sleep for people with dementia due to Alzheimer's,[223] but it is used to treat REM sleep behavior disorder in dementia with Lewy bodies.[75] Limited evidence suggests that a low dose of trazodone may improve sleep, however more research is needed.[223]
Non-pharmacological approaches have been suggested for treating sleep problems for those with dementia, however, there is no strong evidence or firm conclusions on the effectiveness of different types of interventions, especially for those who are living in an institutionalized setting such as a nursing home or long-term care home.[222]
Pain
[edit]As people age, they experience more health problems, and most health problems associated with aging carry a substantial burden of pain; therefore, between 25% and 50% of older adults experience persistent pain. Seniors with dementia experience the same prevalence of conditions likely to cause pain as seniors without dementia.[227] Pain is often overlooked in older adults and, when screened for, is often poorly assessed, especially among those with dementia, since they become incapable of informing others of their pain.[227][228] Beyond the issue of humane care, unrelieved pain has functional implications. Persistent pain can lead to decreased ambulation, depressed mood, sleep disturbances, impaired appetite, and exacerbation of cognitive impairment[228] and pain-related interference with activity is a factor contributing to falls in the elderly.[227][229]
Although persistent pain in people with dementia is difficult to communicate, diagnose, and treat, failure to address persistent pain has profound functional, psychosocial and quality of life implications for this vulnerable population. Health professionals often lack the skills and usually lack the time needed to recognize, accurately assess and adequately monitor pain in people with dementia.[227][230] Family members and friends can make a valuable contribution to the care of a person with dementia by learning to recognize and assess their pain. Educational resources and observational assessment tools are available.[227][231][232]
Eating difficulties
[edit]Persons with dementia may have difficulty eating. Whenever it is available as an option, the recommended response to eating problems is having a caretaker assist them.[204] A secondary option for people who cannot swallow effectively is to consider gastrostomy feeding tube placement as a way to give nutrition. However, in bringing comfort and maintaining functional status while lowering risk of aspiration pneumonia and death, assistance with oral feeding is at least as good as tube feeding.[204][233] Tube-feeding is associated with agitation, increased use of physical and chemical restraints and worsening pressure ulcers. Tube feedings may cause fluid overload, diarrhea, abdominal pain, local complications, less human interaction and may increase the risk of aspiration.[234][235]
Benefits in those with advanced dementia has not been shown.[236] The risks of using tube feeding include agitation, rejection by the person (pulling out the tube, or otherwise physical or chemical immobilization to prevent them from doing this), or developing pressure ulcers.[204] The procedure is directly related to a 1% fatality rate[237] with a 3% major complication rate.[238] The percentage of people at end of life with dementia using feeding tubes in the US has dropped from 12% in 2000 to 6% as of 2014.[239][240]
The immediate and long-term effects of modifying the thickness of fluids for swallowing difficulties in people with dementia are not well known.[241] While thickening fluids may have an immediate positive effect on swallowing and improving oral intake, the long-term impact on the health of the person with dementia should also be considered.[241]
Exercise
[edit]Exercise programs may improve the ability of people with dementia to perform daily activities, but the best type of exercise is still unclear.[242] Getting more exercise can slow the development of cognitive problems such as dementia, proving to reduce the risk of Alzheimer's disease by about 50%. A balance of strength exercise, to help muscles pump blood to the brain, and balance exercises are recommended for aging people. A suggested amount of about 2+1⁄2 hours per week can reduce risks of cognitive decay as well as other health risks like falling.[243]
Assistive technology
[edit]There is a lack of high-quality evidence to determine whether assistive technology effectively supports people with dementia to manage memory issues.[244] Some of the specific things that are used today that helps with dementia today are: clocks, communication aids, electrical appliances the use monitoring, GPS location/ tracking devices, home care robots, in-home cameras, and medication management are just to name a few.[245] Technology has the potential to be a valuable intervention for alleviating loneliness and promoting social connections, supported by available evidence.[246]
Alternative medicine
[edit]Evidence of the therapeutic values of aromatherapy and massage is unclear.[247][248] It is not clear if cannabinoids are harmful or effective for people with dementia.[249]
Palliative care
[edit]Given the progressive and terminal nature of dementia, palliative care can be helpful to patients and their caregivers by helping people with the disorder and their caregivers understand what to expect, deal with loss of physical and mental abilities, support the person's wishes and goals including surrogate decision making, and discuss wishes for or against CPR and life support.[250][251] Because the decline can be rapid, and because most people prefer to allow the person with dementia to make their own decisions, palliative care involvement before the late stages of dementia is recommended.[252][253] Further research is required to determine the appropriate palliative care interventions and how well they help people with advanced dementia.[166]
Person-centered care helps maintain the dignity of people with dementia.[254]
Remotely delivered information for caregivers
[edit]Remotely delivered interventions including support, training and information may reduce the burden for the informal caregiver and improve their depressive symptoms.[255] There is no certain evidence that they improve health-related quality of life.[255]
In several localities in Japan, digital surveillance may be made available to family members, if a dementia patient is prone to wandering and going missing.[256]
Epidemiology
[edit]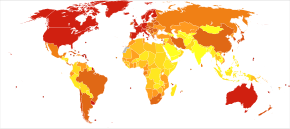
0–4 5–8 9–10 11–13 14–17 | 18–24 25–45 46–114 115–375 376–1266 |

<100 100–120 120–140 140–160 160–180 180–200 | 200–220 220–240 240–260 260–280 280–300 >300 |
The number of cases of dementia worldwide in 2021 was estimated at 55 million, with close to 10 million new cases each year.[2] By 2050, the number of people living with dementia is estimated to be over 150 million globally.[257] Around 7% of people over the age of 65 have dementia, with slightly higher rates (up to 10% of those over 65) in places with relatively high life expectancy.[258] An estimated 58% of people with dementia are living in low and middle income countries.[259][260] The prevalence of dementia differs in different world regions, ranging from 4.7% in Central Europe to 8.7% in North Africa/Middle East; the prevalence in other regions is estimated to be between 5.6 and 7.6%.[259] The number of people living with dementia is estimated to double every 20 years. In 2016 dementia resulted in about 2.4 million deaths,[9] up from 0.8 million in 1990.[261] The genetic and environmental risk factors for dementia disorders vary by ethnicity.[262][263] For instance, Alzheimer's disease among Hispanic/Latino and African American subjects exhibit lower risks associated with gene changes in the apolipoprotein E gene than do non-Hispanic white subjects.[264]
The annual incidence of dementia diagnosis is nearly 10 million worldwide.[166] Almost half of new dementia cases occur in Asia, followed by Europe (25%), the Americas (18%) and Africa (8%). The incidence of dementia increases exponentially with age, doubling with every 6.3-year increase in age.[259] Dementia affects 5% of the population older than 65 and 20–40% of those older than 85.[265] Rates are slightly higher in women than men at ages 65 and greater.[265] The disease trajectory is varied and the median time from diagnosis to death depends strongly on age at diagnosis, from 6.7 years for people diagnosed aged 60–69 to 1.9 years for people diagnosed at 90 or older.[166]
Dementia impacts not only individuals with dementia, but also their carers and the wider society. Among people aged 60 years and over, dementia is ranked the 9th most burdensome condition according to the 2010 Global Burden of Disease (GBD) estimates. The global costs of dementia was around US$818 billion in 2015, a 35.4% increase from US$604 billion in 2010.[259]
Affected ages
[edit]About 3% of people between the ages of 65–74 have dementia, 19% between 75 and 84, and nearly half of those over 85 years of age. As more people are living longer, dementia is becoming more common.[266] For people of a specific age, however, it may be becoming less frequent in the developed world, due to a decrease in modifiable risk factors made possible by greater financial and educational resources. It is one of the most common causes of disability among the elderly but can develop before the age of 65 when it is known as early-onset dementia or presenile dementia.[267][268] Less than 1% of those with Alzheimer's have gene mutations that cause a much earlier development of the disease, around the age of 45, known as early-onset Alzheimer's disease.[269] More than 95% of people with Alzheimer's disease have the sporadic form (late onset, 80–90 years of age).[269] Worldwide the cost of dementia in 2015 was put at US$818 billion. People with dementia are often physically or chemically restrained to a greater degree than necessary, raising issues of human rights.[2][270] Social stigma is commonly perceived by those with the condition, and also by their caregivers.[95]
History
[edit]This section needs additional citations for verification. (November 2015) |
Until the end of the 19th century, dementia was a much broader clinical concept. It included mental illness and any type of psychosocial incapacity, including reversible conditions.[271] Dementia at this time simply referred to anyone who had lost the ability to reason, and was applied equally to psychosis, "organic" diseases like syphilis that destroy the brain, and to the dementia associated with old age, which was attributed to "hardening of the arteries".

Dementia has been referred to in medical texts since antiquity. One of the earliest known allusions to dementia is attributed to the 7th-century BC Greek philosopher Pythagoras, who divided the human lifespan into six distinct phases: 0–6 (infancy), 7–21 (adolescence), 22–49 (young adulthood), 50–62 (middle age), 63–79 (old age), and 80–death (advanced age). The last two he described as the "senium", a period of mental and physical decay, and that the final phase was when "the scene of mortal existence closes after a great length of time that very fortunately, few of the human species arrive at, where the mind is reduced to the imbecility of the first epoch of infancy".[272] In 550 BC, the Athenian statesman and poet Solon argued that the terms of a man's will might be invalidated if he exhibited loss of judgement due to advanced age. Chinese medical texts made allusions to the condition as well, and the characters for "dementia" translate literally to "foolish old person".[273]
Athenian philosophers Aristotle and Plato discussed the mental decline that can come with old age and predicted that this affects everyone who becomes old and nothing can be done to stop this decline from taking place. Plato specifically talked about how the elderly should not be in positions that require responsibility because, "There is not much acumen of the mind that once carried them in their youth, those characteristics one would call judgement, imagination, power of reasoning, and memory. They see them gradually blunted by deterioration and can hardly fulfill their function."[274]
For comparison, the Roman statesman Cicero held a view much more in line with modern-day medical wisdom that loss of mental function was not inevitable in the elderly and "affected only those old men who were weak-willed". He spoke of how those who remained mentally active and eager to learn new things could stave off dementia. However, Cicero's views on aging, although progressive, were largely ignored in a world that would be dominated for centuries by Aristotle's medical writings. Physicians during the Roman Empire, such as Galen and Celsus, simply repeated the beliefs of Aristotle while adding few new contributions to medical knowledge.
Byzantine physicians sometimes wrote of dementia. It is recorded that at least seven emperors whose lifespans exceeded 70 years displayed signs of cognitive decline. In Constantinople, special hospitals housed those diagnosed with dementia or insanity, but these did not apply to the emperors, who were above the law and whose health conditions could not be publicly acknowledged.
Otherwise, little is recorded about dementia in Western medical texts for nearly 1700 years. One of the few references was the 13th-century friar Roger Bacon, who viewed old age as divine punishment for original sin. Although he repeated existing Aristotelian beliefs that dementia was inevitable, he did make the progressive assertion that the brain was the center of memory and thought rather than the heart.
Poets, playwrights, and other writers made frequent allusions to the loss of mental function in old age. William Shakespeare notably mentions it in plays such as Hamlet and King Lear.
During the 19th century, doctors generally came to believe that elderly dementia was the result of cerebral atherosclerosis, although opinions fluctuated between the idea that it was due to blockage of the major arteries supplying the brain or small strokes within the vessels of the cerebral cortex.
In 1907, Bavarian psychiatrist Alois Alzheimer was the first to identify and describe the characteristics of progressive dementia in the brain of 51-year-old Auguste Deter.[275] Deter had begun to behave uncharacteristically, including accusing her husband of adultery, neglecting household chores, exhibiting difficulties writing and engaging in conversations, heightened insomnia, and loss of directional sense.[276] At one point, Deter was reported to have "dragged a bed sheet outside, wandered around wildly, and cried for hours at midnight."[276] Alzheimer began treating Deter when she entered a Frankfurt mental hospital on November 25, 1901.[276] During her ongoing treatment, Deter and her husband struggled to afford the cost of the medical care, and Alzheimer agreed to continue her treatment in exchange for Deter's medical records and donation of her brain upon death.[276] Deter died on April 8, 1906, after succumbing to sepsis and pneumonia.[276] Alzheimer conducted the brain biopsy using the Bielschowsky stain method, which was a new development at the time, and he observed senile plaques, neurofibrillary tangles, and atherosclerotic alteration.[275] At the time, the consensus among medical doctors had been that senile plaques were generally found in older patients, and the occurrence of neurofibrillary tangles was an entirely new observation at the time.[276] Alzheimer presented his findings at the 37th psychiatry conference of southwestern Germany in Tübingen on April 11, 1906; however, the information was poorly received by his peers.[276] By 1910, Alois Alzheimer's teacher, Emil Kraepelin, published a book in which he coined the term "Alzheimer's disease" in an attempt to acknowledge the importance of Alzheimer's discovery.[275][276]
By the 1960s, the link between neurodegenerative diseases and age-related cognitive decline had become more established. By the 1970s, the medical community maintained that vascular dementia was rarer than previously thought and Alzheimer's disease caused the vast majority of old age mental impairments. More recently however, it is believed that dementia is often a mixture of conditions.
In 1976, neurologist Robert Katzmann suggested a link between senile dementia and Alzheimer's disease.[277] Katzmann suggested that much of the senile dementia occurring (by definition) after the age of 65, was pathologically identical with Alzheimer's disease occurring in people under age 65 and therefore should not be treated differently.[278] Katzmann thus suggested that Alzheimer's disease, if taken to occur over age 65, is actually common, not rare, and was the fourth- or 5th-leading cause of death, even though rarely reported on death certificates in 1976.
A helpful finding was that although the incidence of Alzheimer's disease increased with age (from 5–10% of 75-year-olds to as many as 40–50% of 90-year-olds), no threshold was found by which age all persons developed it. This is shown by documented supercentenarians (people living to 110 or more) who experienced no substantial cognitive impairment. Some evidence suggests that dementia is most likely to develop between ages 80 and 84 and individuals who pass that point without being affected have a lower chance of developing it. Women account for a larger percentage of dementia cases than men, although this can be attributed to their longer overall lifespan and greater odds of attaining an age where the condition is likely to occur.[279]
Much like other diseases associated with aging, dementia was comparatively rare before the 20th century, because few people lived past 80. Conversely, syphilitic dementia was widespread in the developed world until it was largely eradicated by the use of penicillin after World War II. With significant increases in life expectancy thereafter, the number of people over 65 started rapidly climbing. While elderly persons constituted an average of 3–5% of the population prior to 1945, by 2010 many countries reached 10–14% and in Germany and Japan, this figure exceeded 20%. Public awareness of Alzheimer's Disease greatly increased in 1994 when former US president Ronald Reagan announced that he had been diagnosed with the condition.
In the 21st century, other types of dementia were differentiated from Alzheimer's disease and vascular dementias (the most common types). This differentiation is on the basis of pathological examination of brain tissues, by symptomatology, and by different patterns of brain metabolic activity in nuclear medical imaging tests such as SPECT and PET scans of the brain. The various forms have differing prognoses and differing epidemiologic risk factors. The main cause for many diseases, including Alzheimer's disease, remains unclear.[280]
Terminology
[edit]Dementia in the elderly was once called senile dementia or senility, and viewed as a normal and somewhat inevitable aspect of aging.[281][282]
By 1913–20 the term dementia praecox was introduced to suggest the development of senile-type dementia at a younger age. Eventually the two terms fused, so that until 1952 physicians used the terms dementia praecox (precocious dementia) and schizophrenia interchangeably. Since then, science has determined that dementia and schizophrenia are two different disorders, though they share some similarities.[283] The term precocious dementia for a mental illness suggested that a type of mental illness like schizophrenia (including paranoia and decreased cognitive capacity) could be expected to arrive normally in all persons with greater age (see paraphrenia). After about 1920, the beginning use of dementia for what is now understood as schizophrenia and senile dementia helped limit the word's meaning to "permanent, irreversible mental deterioration". This began the change to the later use of the term. In recent studies, researchers have seen a connection between those diagnosed with schizophrenia and patients who are diagnosed with dementia, finding a positive correlation between the two diseases.[284]
The view that dementia must always be the result of a particular disease process led for a time to the proposed diagnosis of "senile dementia of the Alzheimer's type" (SDAT) in persons over the age of 65, with "Alzheimer's disease" diagnosed in persons younger than 65 who had the same pathology. Eventually, however, it was agreed that the age limit was artificial, and that Alzheimer's disease was the appropriate term for persons with that particular brain pathology, regardless of age.
After 1952, mental illnesses including schizophrenia were removed from the category of organic brain syndromes, and thus (by definition) removed from possible causes of "dementing illnesses" (dementias). At the same, however, the traditional cause of senile dementia – "hardening of the arteries" – now returned as a set of dementias of vascular cause (small strokes). These were now termed multi-infarct dementias or vascular dementias.
Society and culture
[edit]
The societal cost of dementia is high, especially for caregivers.[285] According to a UK-based study, almost two out of three carers of people with dementia feel lonely. Most of the carers in the study were family members or friends.[286][287]
As of 2015[update], the annual cost per Alzheimer's patient in the United States was around $19,144.36. The total costs for the nation is estimated to be about $167.74 billion. By 2030, it is predicted the annual socioeconomic cost will total to about $507 billion, and by 2050 that number is expected to reach $1.89 trillion. This steady increase will be seen not just within the United States but globally. Global estimates for the costs of dementia were $957.56 billion in 2015, but by 2050 the estimated global cost is $9.12 trillion.[288]
Many countries consider the care of people living with dementia a national priority and invest in resources and education to better inform health and social service workers, unpaid caregivers, relatives and members of the wider community. Several countries have authored national plans or strategies.[289][290] These plans recognize that people can live reasonably with dementia for years, as long as the right support and timely access to a diagnosis are available. Former British Prime Minister David Cameron described dementia as a "national crisis", affecting 800,000 people in the United Kingdom.[291] In fact, dementia has become the leading cause of death for women in England.[292]
There, as with all mental disorders, people with dementia could potentially be a danger to themselves or others, they can be detained under the Mental Health Act 1983 for assessment, care and treatment. This is a last resort, and is usually avoided by people with family or friends who can ensure care.
Some hospitals in Britain work to provide enriched and friendlier care. To make the hospital wards calmer and less overwhelming to residents, staff replaced the usual nurses' station with a collection of smaller desks, similar to a reception area. The incorporation of bright lighting helps increase positive mood and allow residents to see more easily.[293]
Driving with dementia can lead to injury or death. Doctors should advise appropriate testing on when to quit driving.[294] The United Kingdom DVLA (Driver & Vehicle Licensing Agency) states that people with dementia who specifically have poor short-term memory, disorientation, or lack of insight or judgment are not allowed to drive, and in these instances the DVLA must be informed so that the driving license can be revoked. They acknowledge that in low-severity cases and those with an early diagnosis, drivers may be permitted to continue driving.
Many support networks are available to people with dementia and their families and caregivers. Charitable organizations aim to raise awareness and campaign for the rights of people living with dementia. Support and guidance are available on assessing testamentary capacity in people with dementia.[295]
In 2015, Atlantic Philanthropies announced a $177 million gift aimed at understanding and reducing dementia. The recipient was Global Brain Health Institute, a program co-led by the University of California, San Francisco and Trinity College Dublin. This donation is the largest non-capital grant Atlantic has ever made, and the biggest philanthropic donation in Irish history.[296]
In October 2020, the Caretaker's last music release, Everywhere at the End of Time, was popularized by TikTok users for its depiction of the stages of dementia.[297] Caregivers were in favor of this phenomenon; Leyland Kirby, the creator of the record, echoed this sentiment, explaining it could cause empathy among a younger public.[298]
On November 2, 2020, Scottish billionaire Sir Tom Hunter donated £1 million to dementia charities, after watching a former music teacher with dementia, Paul Harvey, playing one of his own compositions on the piano in a viral video. The donation was announced to be split between the Alzheimer's Society and Music for Dementia.[299]
Awareness
Celebrities have used their platforms to raise awareness for the different forms of dementia and the need for further support, including former First Lady of California Maria Shriver, Maria Shriver | My Brain™ | Alzheimer’s Association Academy Award Winning actor Samuel L. Jackson, Editor-in-Chief of ELLE Magazine Nina Garcia, professional skateboarder Tony Hawk, and others.[300]
Additional Alzheimer's awareness has been raised through the diagnoses of high-profile persons themselves, including
- Actor Bruce Willis[301]
- Actor Robin Williams[302]
- Activist Rosa Parks[303]
- 40th President of the United States, Ronald Reagan[304]
- Former Mrs. Colorado Springs Joanna Fix Mrs. Colorado Springs uses title, young-onset Alzheimer's diagnosis to spread awareness about dementia
- TV Host Wendy Williams Wendy Williams diagnosed with same form of dementia as Bruce Willis
- Musician Tony Bennet[305]
- Musician Maureen McGovern[306]
- Dancer and pin-up model Rita Hayworth Rita Hayworth's misdiagnosed struggle
Notes
[edit]- ^ Prodromal subtypes of delirium-onset dementia with Lewy bodies have been proposed as of 2020.[12]
- ^ Kosaka (2017) writes: "Dementia with Lewy bodies (DLB) is now well known to be the second most frequent dementia following Alzheimer disease (AD). Of all types of dementia, AD is known to account for about 50%, DLB about 20% and vascular dementia (VD) about 15%. Thus, AD, DLB, and VD are now considered to be the three major dementias."[61] The NINDS (2020) says that Lewy body dementia "is one of the most common causes of dementia, after Alzheimer's disease and vascular disease."[62] Hershey (2019) says, "DLB is the third most common of all the neurodegenerative diseases behind both Alzheimer's disease and Parkinson's disease".[63]
References
[edit]- ^ "Dementia". medlineplus.gov. Retrieved January 20, 2022.
- ^ Jump up to: a b c d e f g h i j k l m n "Dementia". who.int. Retrieved September 26, 2022.
- ^ "Dementia". mayoclinic.org. Mayo Clinic. Retrieved June 5, 2022.
- ^ Jump up to: a b Creavin ST, Wisniewski S, Noel-Storr AH, Trevelyan CM, Hampton T, Rayment D, et al. (January 2016). "Mini-Mental State Examination (MMSE) for the detection of dementia in clinically unevaluated people aged 65 and over in community and primary care populations". The Cochrane Database of Systematic Reviews. 2016 (1): CD011145. doi:10.1002/14651858.CD011145.pub2. hdl:1983/00876aeb-2061-43f5-b7e1-938c666030ab. PMC 8812342. PMID 26760674.
- ^ "Differential diagnosis dementia". NICE. Retrieved January 20, 2022.
- ^ Hales RE (2008). The American Psychiatric Publishing Textbook of Psychiatry. American Psychiatric Pub. p. 311. ISBN 978-1-58562-257-3. Archived from the original on September 8, 2017.
- ^ Jump up to: a b c Livingston G, Huntley J, Sommerlad A, et al. (August 2020). "Dementia prevention, intervention, and care: 2020 report of the Lancet Commission". Lancet. 396 (10248): 413–446. doi:10.1016/S0140-6736(20)30367-6. PMC 7392084. PMID 32738937.
- ^ Jump up to: a b c Commission de la transparence (June 2012). "Drugs for Alzheimer's disease: best avoided. No therapeutic advantage" [Drugs for Alzheimer's disease: best avoided. No therapeutic advantage]. Prescrire International. 21 (128): 150. PMID 22822592.
- ^ Jump up to: a b Nichols E, Szoeke CE, Vollset SE, Abbasi N, Abd-Allah F, Abdela J, et al. (GBD 2016 Dementia Collaborators) (January 2019). "Global, regional, and national burden of Alzheimer's disease and other dementias, 1990–2016: a systematic analysis for the Global Burden of Disease Study 2016". The Lancet. Neurology. 18 (1): 88–106. doi:10.1016/S1474-4422(18)30403-4. PMC 6291454. PMID 30497964.
- ^ "Dementia". who.int. Retrieved April 4, 2024.
- ^ Jump up to: a b c d e Bathini P, Brai E, Auber LA (November 2019). "Olfactory dysfunction in the pathophysiological continuum of dementia" (PDF). Ageing Research Reviews. 55: 100956. doi:10.1016/j.arr.2019.100956. PMID 31479764. S2CID 201742825.
- ^ McKeith IG, Ferman TJ, Thomas AJ, et al. (April 2020). "Research criteria for the diagnosis of prodromal dementia with Lewy bodies". Neurology (Review). 94 (17): 743–755. doi:10.1212/WNL.0000000000009323. PMC 7274845. PMID 32241955.
- ^ Jump up to: a b c d e f g h i j k l m n o p Budson A, Solomon P (2011). Memory loss : a practical guide for clinicians. [Edinburgh?]: Elsevier Saunders. ISBN 978-1-4160-3597-8.
- ^ "ICD-11 for Mortality and Morbidity Statistics". icd.who.int. Retrieved January 20, 2022.
- ^ Jump up to: a b c d "What is mixed dementia". Dementia UK. Archived from the original on November 1, 2020. Retrieved December 13, 2020.
- ^ Jump up to: a b Wilson H, Pagano G, Politis M (March 2019). "Dementia spectrum disorders: lessons learnt from decades with PET research". J Neural Transm (Vienna). 126 (3): 233–251. doi:10.1007/s00702-019-01975-4. PMC 6449308. PMID 30762136.
- ^ American Psychiatric Association (2013). Diagnostic and statistical manual of mental disorders : DSM-5 (5th ed.). Washington, DC: American Psychiatric Association. pp. 591–603. ISBN 978-0-89042-554-1.
- ^ "The Dementias: Hope Through Research | National Institute of Neurological Disorders and Stroke". ninds.nih.gov. Retrieved December 9, 2022.
- ^ Jump up to: a b Lin JS, O'Connor E, Rossom RC, Perdue LA, Eckstrom E (November 2013). "Screening for cognitive impairment in older adults: A systematic review for the U.S. Preventive Services Task Force". Annals of Internal Medicine. 159 (9): 601–612. doi:10.7326/0003-4819-159-9-201311050-00730. PMID 24145578.
- ^ Orgeta V, Leung P, Del-Pino-Casado R, Qazi A, Orrell M, Spector AE, Methley AM (April 2022). "Psychological treatments for depression and anxiety in dementia and mild cognitive impairment". The Cochrane Database of Systematic Reviews. 2022 (4): CD009125. doi:10.1002/14651858.CD009125.pub3. PMC 9035877. PMID 35466396.
- ^ Radue R, Walaszek A, Asthana S (2019). "Chapter 24 – Neuropsychiatric symptoms in dementia". Handbook of Clinical Neurology. Vol. 167. pp. 437–454. doi:10.1016/B978-0-12-804766-8.00024-8. ISBN 978-0-12-804766-8. PMID 31753148. S2CID 208230186.
- ^ Kales HC, Gitlin LN, Lyketsos CG (March 2015). "Assessment and management of behavioral and psychological symptoms of dementia". BMJ. 350: h369. doi:10.1136/bmj.h369. PMC 4707529. PMID 25731881.
- ^ Jump up to: a b Şahin Cankurtaran E (December 2014). "Management of Behavioral and Psychological Symptoms of Dementia". Noro Psikiyatri Arsivi. 51 (4): 303–312. doi:10.5152/npa.2014.7405. PMC 5353163. PMID 28360647.
- ^ "Inhibition in Cognition". apa.org. Retrieved February 7, 2021.
- ^ "Hallucinations: MedlinePlus Medical Encyclopedia". medlineplus.gov. Retrieved December 9, 2022.
- ^ Shub D, Kunik ME (April 16, 2009). "Psychiatric Comorbidity in Persons With Dementia: Assessment and Treatment Strategies". Psychiatric Times. 26 (4). Archived from the original on April 27, 2009.
- ^ "Dementia – Signs and Symptoms". American Speech Language D Association.
- ^ "Dementia: comorbidities in patients – data briefing". GOV.UK. Retrieved November 22, 2020.
- ^ "What Is Dementia? | CDC". cdc.gov. December 19, 2019. Retrieved October 3, 2022.
- ^ Gresenz CR, Mitchell JM, Rodriguez B, Turner RS, van der Klaauw W (May 2024). "The Financial Consequences of Undiagnosed Memory Disorders" (PDF). Federal Reserve Bank of New York Staff Reports (1106). doi:10.59576/sr.1106. Retrieved July 27, 2024.
- ^ Casselman B (May 31, 2024). "Alzheimer's Takes a Financial Toll Long Before Diagnosis, Study Finds". The New York Times. Archived from the original on June 30, 2024. Retrieved July 27, 2024.
Credit scores among people who later develop dementia begin falling sharply long before their disease is formally identified. A year before diagnosis, these people were 17.2 percent more likely to be delinquent on their mortgage payments than before the onset of the disease, and 34.3 percent more likely to be delinquent on their credit card bills.
- ^ "Continence, dementia, and care that preserves dignity". NIHR Evidence. June 21, 2022. doi:10.3310/nihrevidence_51255. S2CID 251785991.
- ^ Grant RL, Drennan VM, Rait G, Petersen I, Iliffe S (August 2013). Prince MJ (ed.). "First diagnosis and management of incontinence in older people with and without dementia in primary care: a cohort study using The Health Improvement Network primary care database". PLOS Medicine. 10 (8): e1001505. doi:10.1371/journal.pmed.1001505. PMC 3754889. PMID 24015113.
- ^ Jump up to: a b Sheehan B (November 2012). "Assessment scales in dementia". Therapeutic Advances in Neurological Disorders. 5 (6): 349–358. doi:10.1177/1756285612455733. PMC 3487532. PMID 23139705.
- ^ "Seven Stages of Dementia | Symptoms, Progression & Durations". Retrieved December 19, 2020.
- ^ "Clinical Stages of Alzheimer's". Fisher Center for Alzheimer's Research Foundation. January 29, 2014. Retrieved December 19, 2020.
- ^ Scharre DW (June 2019). "Preclinical, Prodromal, and Dementia Stages of Alzheimer's Disease". Practical Neurology. Retrieved June 28, 2022.
- ^ Bhatia-Dey N, Heinbockel T (June 2021). "The Olfactory System as Marker of Neurodegeneration in Aging, Neurological and Neuropsychiatric Disorders". Int J Environ Res Public Health. 18 (13): 6976. doi:10.3390/ijerph18136976. PMC 8297221. PMID 34209997.
- ^ Boesveldt S, Parma V (January 2021). "The importance of the olfactory system in human well-being, through nutrition and social behavior". Cell Tissue Res. 383 (1): 559–567. doi:10.1007/s00441-020-03367-7. PMC 7802608. PMID 33433688.
- ^ Sherman C, Liu CS, Herrmann N, Lanctôt KL (February 2018). "Prevalence, neurobiology, and treatments for apathy in prodromal dementia". Int Psychogeriatr. 30 (2): 177–184. doi:10.1017/S1041610217000527. PMID 28416030. S2CID 46788701.
- ^ Jump up to: a b Breton A, Casey D, Arnaoutoglou NA (February 2019). "Cognitive tests for the detection of mild cognitive impairment (MCI), the prodromal stage of dementia: Meta-analysis of diagnostic accuracy studies". International Journal of Geriatric Psychiatry. 34 (2): 233–242. doi:10.1002/gps.5016. PMID 30370616. S2CID 53097138.
- ^ Jump up to: a b Bateman DR, Gill S, Hu S, Foster ED, Ruthirakuhan MT, Sellek AF, Mortby ME, Matušková V, Ng KP, Tarawneh RM, Freund-Levi Y, Kumar S, Gauthier S, Rosenberg PB, Ferreira de Oliveira F, Devanand DP, Ballard C, Ismail Z (2020). "Agitation and impulsivity in mid and late life as possible risk markers for incident dementia". Alzheimer's & Dementia: Translational Research & Clinical Interventions. 6 (1): e12016. doi:10.1002/trc2.12016. PMC 7507499. PMID 32995467.
- ^ Cervenka I, Agudelo LZ, Ruas JL (July 2017). "Kynurenines: Tryptophan's metabolites in exercise, inflammation, and mental health". Science. 357 (6349): eaaf9794. doi:10.1126/science.aaf9794. PMID 28751584.
- ^ Solvang SH, Nordrehaug JE, Aarsland D, et al. (2019). "Kynurenines, Neuropsychiatric Symptoms, and Cognitive Prognosis in Patients with Mild Dementia". Int J Tryptophan Res. 12: 1178646919877883. doi:10.1177/1178646919877883. PMC 6769202. PMID 31632053.
- ^ Atri A (March 2019). "The Alzheimer's Disease Clinical Spectrum: Diagnosis and Management". Med Clin North Am. 103 (2): 263–293. doi:10.1016/j.mcna.2018.10.009. PMID 30704681.
- ^ Jump up to: a b Hugo J, Ganguli M (August 2014). "Dementia and cognitive impairment: epidemiology, diagnosis, and treatment". Clinics in Geriatric Medicine. 30 (3): 421–442. doi:10.1016/j.cger.2014.04.001. PMC 4104432. PMID 25037289.
- ^ "Advance Directive for Dementia". dementia-directive.org. Retrieved January 12, 2023.
- ^ American Psychiatric Association (2013). Diagnostic and statistical manual of mental disorders : DSM-5 (5th ed.). Washington, DC: American Psychiatric Association. pp. 591–603. ISBN 978-0-89042-554-1.
- ^ Jenkins C, Ginesi L, Keenan B (2016). Dementia care at a glance. Chichester, West Sussex: John Wiley & Sons. ISBN 978-1-118-85998-8. OCLC 905089525.
- ^ Rohrer JD, Knight WD, Warren JE, Fox NC, Rossor MN, Warren JD (January 2008). "Word-finding difficulty: a clinical analysis of the progressive aphasias". Brain. 131 (Pt 1): 8–38. doi:10.1093/brain/awm251. PMC 2373641. PMID 17947337.
- ^ Islam M, Mazumder M, Schwabe-Warf D, Stephan Y, Sutin AR, Terracciano A (February 2019). "Personality Changes With Dementia From the Informant Perspective: New Data and Meta-Analysis". Journal of the American Medical Directors Association. 20 (2): 131–137. doi:10.1016/j.jamda.2018.11.004. PMC 6432780. PMID 30630729.
- ^ "Diagnosing Lewy Body Dementia". National Institute on Aging. Retrieved May 10, 2020.
- ^ Wilson RS, Sytsma J, Barnes LL, Boyle PA (September 2016). "Anosognosia in Dementia". Current Neurology and Neuroscience Reports. 16 (9): 77. doi:10.1007/s11910-016-0684-z. PMID 27438597. S2CID 3331009.
- ^ Сундерараман П., Косентино С. (март 2017 г.). «Интеграция конструкций анозогнозии и метапознания: обзор недавних результатов в области деменции» . Текущие отчеты по неврологии и нейробиологии . 17 (3): 27. дои : 10.1007/s11910-017-0734-1 . ПМК 5650061 . ПМИД 28283961 .
- ^ Пейн М., Морли Дж. Э. (1 мая 2018 г.). «Редакционная статья: Дисфагия, слабоумие и слабость» . Журнал питания, здоровья и старения . 22 (5): 562–565. дои : 10.1007/s12603-018-1033-5 . ПМИД 29717753 . S2CID 13753522 .
- ^ Делла Сала С., Спиннлер Х., Веннери А. (февраль 2004 г.). «Трудности при ходьбе у пациентов с болезнью Альцгеймера могут быть вызваны апраксией походки» (PDF) . Журнал неврологии, нейрохирургии и психиатрии . 75 (2): 196–201. ПМЦ 1738895 . ПМИД 14742586 . Архивировано (PDF) из оригинала 9 октября 2022 г.
- ^ Мак Ардл Р., Гална Б., Донахи П., Томас А., Рочестер Л. (октябрь 2019 г.). «Имеют ли болезнь Альцгеймера и болезнь телец Леви отдельные патологические признаки походки?» . Болезнь Альцгеймера и деменция . 15 (10): 1367–1377. дои : 10.1016/j.jalz.2019.06.4953 . ПМИД 31548122 .
- ^ «Умственные, физические и речевые способности на поздних стадиях деменции» . Общество Альцгеймера . 29 июня 2022 г. . Проверено 30 июля 2022 г.
- ^ Машур Г.А., Фрэнк Л., Баттиани А., Колановски А.М., Нам М., Шульман-Грин Д. и др. (август 2019 г.). «Парадоксальная осознанность: потенциальный сдвиг парадигмы нейробиологии и лечения тяжелой деменции» . Болезнь Альцгеймера и деменция . 15 (8): 1107–1114. дои : 10.1016/j.jalz.2019.04.002 . hdl : 2027.42/153062 . ПМИД 31229433 .
- ^ Чунг К.Г., Ли Х., Ли С.Б. (сентябрь 2018 г.). «Механизмы белковой токсичности при нейродегенеративных заболеваниях» . Cell Mol Life Sci . 75 (17): 3159–3180. дои : 10.1007/s00018-018-2854-4 . ПМК 6063327 . ПМИД 29947927 .
- ^ Косака К , изд. (2017). Деменция с тельцами Леви: клинические и биологические аспекты (1-е изд.). Спрингер: Япония. дои : 10.1007/978-4-431-55948-1 . ISBN 978-4-431-55948-1 . S2CID 45950966 .
- ^ «Деменция с тельцами Леви: надежда на исследования» . Национальный институт неврологических расстройств и инсульта . Национальные институты здравоохранения США. 10 января 2020 г. Проверено 18 марта 2020 г.
- ^ Херши Лос-Анджелес, Коулман-Джексон Р. (апрель 2019 г.). «Фармакологическое лечение деменции с помощью Леви Доди» . Старение лекарств (обзор). 36 (4): 309–319. дои : 10.1007/s40266-018-00636-7 . ПМЦ 6435621 . ПМИД 30680679 .
- ^ Перейти обратно: а б Арванитакис З., Шах Р.К., Беннетт Д.А. (октябрь 2019 г.). «Диагностика и лечение деменции: обзор» . ДЖАМА . 322 (16): 1589–1599. дои : 10.1001/jama.2019.4782 . ПМЦ 7462122 . ПМИД 31638686 .
- ^ Готье С. (2006). Клиническая диагностика и лечение болезни Альцгеймера (3-е изд.). Абингдон, Оксон: Informa Healthcare. стр. 53–54. ISBN 978-0-203-93171-4 . Архивировано из оригинала 3 мая 2016 года.
- ^ Абьяде М., Гупта В., Читранши Н., Гупта В., Ву Й., Сакс Д. и др. (апрель 2021 г.). «Митохондриальная дисфункция при болезни Альцгеймера – взгляд на протеомику». Экспертное обозрение по протеомике . 18 (4): 295–304. дои : 10.1080/14789450.2021.1918550 . ПМИД 33874826 . S2CID 233310698 .
- ^ Венк Г.Л. (2003). «Нейропатологические изменения при болезни Альцгеймера» . Журнал клинической психиатрии . 64 (Приложение 9): 7–10. ПМИД 12934968 .
- ^ Папон М.А., Уиттингтон Р.А., Эль-Хури Н.Б., Planel E (2011). «Болезнь Альцгеймера и анестезия» . Границы в неврологии . 4 : 272. дои : 10.3389/fnins.2010.00272 . ПМЦ 3034231 . ПМИД 21344011 .
- ^ Перейти обратно: а б Ядекола C (ноябрь 2013 г.). «Патобиология сосудистой деменции» . Нейрон . 80 (4): 844–866. дои : 10.1016/j.neuron.2013.10.008 . ПМК 3842016 . ПМИД 24267647 .
- ^ Баскис А., Ченг JX (ноябрь 2012 г.). «Фармакологическая профилактика и лечение сосудистой деменции: подходы и перспективы». Опыт Геронтол . 47 (11): 887–891. дои : 10.1016/j.exger.2012.07.002 . ПМИД 22796225 . S2CID 1153876 .
- ^ «Сосудистая деменция – Симптомы и причины» . Клиника Мэйо . Проверено 8 июля 2021 г.
- ^ Маккейт И.Г., Ферман Т.Дж., Томас А.Дж. и др. (апрель 2020 г.). «Критерии исследования для диагностики продромальной деменции с тельцами Леви» . Неврология . 94 (17): 743–755. дои : 10.1212/WNL.0000000000009323 . ПМЦ 7274845 . ПМИД 32241955 .
- ^ Юрек Л., Херрманн М., Бонзе М. и др. (1 марта 2018 г.). «Поведенческие и психологические симптомы болезни телец Леви: обзор». Гериатрия и психология Нейропсихиатрия старения . 16 (1): 87–95. дои : 10.1684/pnv.2018.0723 . ПМИД 29569570 .
- ^ Перейти обратно: а б с д Маккейт И.Г., Боев Б.Ф., Диксон Д.В. и др. (июль 2017 г.). «Диагностика и лечение деменции с тельцами Леви: Четвертый консенсусный отчет Консорциума DLB» . Неврология (обзор). 89 (1): 88–100. дои : 10.1212/WNL.0000000000004058 . ПМК 5496518 . ПМИД 28592453 .
- ^ Перейти обратно: а б с Тейлор Дж.П., Маккейт И.Г., Берн DJ и др. (февраль 2020 г.). «Новые данные о лечении деменции с тельцами Леви» . Ланцет Нейрол (обзор). 19 (2): 157–169. дои : 10.1016/S1474-4422(19)30153-X . ПМК 7017451 . ПМИД 31519472 . Ссылка вежливости доступна здесь.
- ^ Гомпертс С.Н. (апрель 2016 г.). «Деменция с тельцами Леви: деменция с тельцами Леви и деменция при болезни Паркинсона» . Континуум (Миннеап, Минн) (обзор). 22 (2 деменция): 435–463. дои : 10.1212/CON.0000000000000309 . ПМК 5390937 . ПМИД 27042903 .
- ^ Finger EC (апрель 2016 г.). «Лобно-височная деменция» . Континуум . 22 (2 деменция): 464–489. дои : 10.1212/CON.0000000000000300 . ПМК 5390934 . ПМИД 27042904 .
- ^ «Информационный бюллетень о прогрессирующем супрануклеарном параличе | Национальный институт неврологических расстройств и инсульта» . ninds.nih.gov . Проверено 20 января 2021 г.
- ^ Лопес Г., Баюлкем К., Халлетт М. (октябрь 2016 г.). «Прогрессирующий супрануклеарный паралич (PSP): синдром Ричардсона и другие варианты PSP» . Акта Нейрол Сканд . 134 (4): 242–249. дои : 10.1111/ane.12546 . ПМЦ 7292631 . ПМИД 27070344 .
- ^ Фрэнк С. (январь 2014 г.). «Лечение болезни Гентингтона» . Нейротерапия . 11 (1): 153–160. дои : 10.1007/s13311-013-0244-z . ПМЦ 3899480 . ПМИД 24366610 .
- ^ «Болезнь Хантингтона – Симптомы» . nhs.uk. 16 февраля 2018 г. . Проверено 28 июня 2022 г.
- ^ Перейти обратно: а б «ВИЧ-ассоциированная деменция – неврологические расстройства» . Руководство MSD Профессиональная версия .
- ^ Грей Ф, Адль-Биассетт Х, Кретьен Ф, Лорен де ла Гранмезон Дж, Форс Дж, Кеохан С (2001). «Нейропатология и нейродегенерация при инфекции вируса иммунодефицита человека. Патогенез ВИЧ-индуцированных поражений головного мозга, корреляции с ВИЧ-ассоциированными расстройствами и модификации в зависимости от лечения». Клиническая невропатология . 20 (4): 146–155. ПМИД 11495003 .
- ^ Коллиндж Дж. (июль 2005 г.). «Молекулярная неврология прионных болезней» . Журнал неврологии, нейрохирургии и психиатрии . 76 (7): 906–919. дои : 10.1136/jnnp.2004.048660 . ПМЦ 1739714 . ПМИД 15965195 .
- ^ Ридли, Нью-Джерси, Дрейпер Б., Уиталл А (2013). «Алкогольная деменция: обновленные данные» . Ресурс Альцгеймера . 5 (1): 3. дои : 10.1186/alzrt157 . ПМЦ 3580328 . ПМИД 23347747 .
- ^ Перейти обратно: а б с Нуньес П.Т., Кипп Б.Т., Рейтц Н.Л., Сэвидж Л.М. (2019). «Старение с повреждением головного мозга, связанным с алкоголем: критические цепи мозга, связанные с когнитивной дисфункцией». Изменения чувствительности к алкоголю, нейроповеденческих функций и нейровоспаления, связанные с поздним старением . Международное обозрение нейробиологии. Том. 148. стр. 101–168. дои : 10.1016/bs.irn.2019.09.002 . ISBN 978-0-12-817530-9 . ПМЦ 7372724 . ПМИД 31733663 .
- ^ «Что такое смешанная деменция?» . Общество Альцгеймера . Проверено 13 декабря 2020 г.
- ^ Шофилд П. (2005). «Деменция, связанная с токсическими причинами и аутоиммунными заболеваниями». Международная психогериатрия (обзор). 17 (Приложение 1): S129–S147. дои : 10.1017/s1041610205001997 . hdl : 1959.13/24647 . ПМИД 16240488 . S2CID 11864913 .
- ^ Перейти обратно: а б Розенблум М.Х., Смит С., Акдал Г., Гешвинд, доктор медицины (сентябрь 2009 г.). «Иммунологически опосредованная деменция» . Текущие отчеты по неврологии и нейробиологии (обзор). 9 (5): 359–367. дои : 10.1007/s11910-009-0053-2 . ПМЦ 2832614 . ПМИД 19664365 .
- ^ Перейти обратно: а б с д Зис П., Хадживасилиу М. (26 февраля 2019 г.). «Лечение неврологических проявлений чувствительности к глютену и целиакии» . Curr Treat Options Neurol (обзор). 21 (3): 10. дои : 10.1007/s11940-019-0552-7 . ПМИД 30806821 .
- ^ Перейти обратно: а б с Махлуф С., Мессельмани М., Зауали Дж., Мрисса Р. (2018). «Когнитивные нарушения при целиакии и нецелиакийная чувствительность к глютену: обзор литературы об основных когнитивных нарушениях, визуализации и влиянии безглютеновой диеты». Acta Neurol Belg (обзор). 118 (1): 21–27. дои : 10.1007/s13760-017-0870-z . ПМИД 29247390 . S2CID 3943047 .
- ^ Аарсланд Д., Курц М.В. (февраль 2010 г.). «Эпидемиология деменции, связанной с болезнью Паркинсона». Журнал неврологических наук (обзор). 289 (1–2): 18–22. дои : 10.1016/j.jns.2009.08.034 . ПМИД 19733364 . S2CID 24541533 .
- ^ Гэлвин Дж. Э., Поллак Дж., Моррис Дж. К. (ноябрь 2006 г.). «Клинический фенотип деменции при болезни Паркинсона». Неврология . 67 (9): 1605–1611. дои : 10.1212/01.wnl.0000242630.52203.8f . ПМИД 17101891 . S2CID 25023606 .
- ^ Аббаси Дж. (сентябрь 2019 г.). «Дебаты разгораются по поводу ПОЗДНЕГО, недавно выявленного слабоумия». ДЖАМА . 322 (10): 914–916. дои : 10.1001/jama.2019.12232 . ПМИД 31433447 . S2CID 201118832 .
- ^ Перейти обратно: а б Мартин С., Келли С., Хан А., Каллум С., Денинг Т., Райт Дж., Фокс С., Катона С., Коско Т., Брейн С., Лафортун Л. (июнь 2015 г.). «Отношение и предпочтения к скринингу деменции: систематический обзор литературы» . БМК Гериатр . 15:66 . дои : 10.1186/s12877-015-0064-6 . ПМК 4469007 . ПМИД 26076729 .
- ^ «Определение деменции» . Рекомендации МД . Группа Рид. Архивировано из оригинала 29 июня 2009 года . Проверено 4 июня 2009 г.
- ^ Каплан Дж. П., Рабиновиц Т. (ноябрь 2010 г.). «Подход к пациенту с когнитивными нарушениями: делирий и деменция». Медицинские клиники Северной Америки . 94 (6): 1103–1116, ix. дои : 10.1016/j.mcna.2010.08.004 . ПМИД 20951272 .
- ^ Глисон OC (март 2003 г.). «Бред» . Американский семейный врач . 67 (5): 1027–1034. ПМИД 12643363 . Архивировано из оригинала 29 сентября 2007 года.
- ^ Лай СК (2014). «Достоинства и проблемы нейропсихиатрического опросника как инструмента оценки людей с деменцией и другими неврологическими расстройствами» . Клинические вмешательства в старение . 9 : 1051–1061. дои : 10.2147/CIA.S63504 . ПМК 4099101 . ПМИД 25031530 .
- ^ Уорролл Л., Хиксон Л.М. (2003). «Последствия для теории, практики и политики». В Уорролле Л.Е., Хиксоне Л.М. (ред.). Коммуникативная инвалидность в старении: от профилактики к вмешательству . Клифтон-Парк, Нью-Йорк: Delmar Learning. стр. 297–298. ISBN 978-0-7693-0015-3 .
- ^ Джеймс С., Рэнсон Дж. М., Эверсон Р., Ллевеллин DJ (декабрь 2021 г.). «Эффективность алгоритмов машинного обучения для прогнозирования прогрессирования деменции у пациентов клиники памяти» . Открытая сеть JAMA . 4 (12): e2136553. doi : 10.1001/jamanetworkopen.2021.36553 . ПМЦ 8678688 . ПМИД 34913981 .
- ^ Бустани М., Петерсон Б., Хэнсон Л., Харрис Р., Лор К.Н. (июнь 2003 г.). «Скрининг деменции в учреждениях первичной медико-санитарной помощи: краткое изложение данных для Целевой группы профилактических служб США». Анналы внутренней медицины . 138 (11): 927–937. дои : 10.7326/0003-4819-138-11-200306030-00015 . ПМИД 12779304 . S2CID 20779164 .
- ^ Перейти обратно: а б Каллен Б., О'Нил Б., Эванс Дж.Дж., Коэн Р.Ф., Лоулор Б.А. (август 2007 г.). «Обзор скрининговых тестов на когнитивные нарушения» . Журнал неврологии, нейрохирургии и психиатрии . 78 (8): 790–799. дои : 10.1136/jnnp.2006.095414 . ПМК 2117747 . ПМИД 17178826 .
- ^ Рэнсон Дж. М., Кузьма Э., Гамильтон В., Мунис-Террера Г., Ланга К. М., Ллевелин DJ (апрель 2019 г.). «Предикторы ошибочной классификации деменции при использовании кратких когнитивных оценок» . Неврология. Клиническая практика . 9 (2): 109–117. doi : 10.1212/CPJ.0000000000000566 . ПМК 6461420 . ПМИД 31041124 .
- ^ Контадор, И. и др. (2017) «Влияние грамотности и многолетнего образования на диагностику деменции: популяционное исследование», Журнал клинической и экспериментальной нейропсихологии, 39 (2), стр. 112–119. Доступно по адресу: https://doi. .org/10.1080/13803395.2016.1204992 .
- ^ Сагер М.А., Герман Б.П., Ла Рю А., Вудард Дж.Л. (октябрь 2006 г.). «Обследование деменции в общественных клиниках памяти» (PDF) . ВМЖ . 105 (7): 25–29. ПМИД 17163083 . Архивировано из оригинала (PDF) 26 июня 2010 г.
- ^ Флейшер А.С., Соуэлл Б.Б., Тейлор С., Гамст А.С., Петерсен Р.К., Тал Л.Дж. (май 2007 г.). «Клинические предикторы прогрессирования болезни Альцгеймера при амнестических легких когнитивных нарушениях». Неврология . 68 (19): 1588–1595. дои : 10.1212/01.wnl.0000258542.58725.4c . ПМИД 17287448 . S2CID 9129604 .
- ^ Карлавиш Дж. Х., Кларк К. М. (март 2003 г.). «Диагностическая оценка пожилых пациентов с легкими проблемами памяти». Анналы внутренней медицины . 138 (5): 411–419. дои : 10.7326/0003-4819-138-5-200303040-00011 . ПМИД 12614094 . S2CID 43798118 .
- ^ Тенг Э.Л., Чуй Х.К. (август 1987 г.). «Модифицированное обследование мини-психического состояния (3MS)». Журнал клинической психиатрии . 48 (8): 314–318. ПМИД 3611032 .
- ^ Тенг Э.Л., Хасегава К., Хомма А., Имаи Ю., Ларсон Э., Грейвс А. и др. (1994). «Инструмент скрининга когнитивных способностей (CASI): практический тест для межкультурных эпидемиологических исследований деменции». Международная психогериатрия . 6 (1): 45–58, обсуждение 62. doi : 10.1017/S1041610294001602 . ПМИД 8054493 . S2CID 25322040 .
- ^ Томбо, Теннесси (март 2004 г.). «Тест A и B по прокладке маршрута: нормативные данные, стратифицированные по возрасту и образованию» . Архив клинической нейропсихологии . 19 (2): 203–214. дои : 10.1016/S0887-6177(03)00039-8 . ПМИД 15010086 .
- ^ Насреддин З.С., Филлипс Н.А., Бедириан В., Шарбонно С., Уайтхед В., Коллин И. и др. (апрель 2005 г.). «Монреальская когнитивная оценка, MoCA: краткий инструмент выявления легких когнитивных нарушений». Журнал Американского гериатрического общества . 53 (4): 695–699. дои : 10.1111/j.1532-5415.2005.53221.x . ПМИД 15817019 . S2CID 9014589 .
- ^ Доус П., Ривз Д., Юнг В.К., Холланд Ф., Хараламбус А.П., Коте М. и др. (май 2023 г.). «Разработка и валидация Монреальской когнитивной оценки для людей с нарушениями слуха (MoCA-H)» . Журнал Американского гериатрического общества . 71 (5): 1485–1494. дои : 10.1111/jgs.18241 . ПМИД 36722180 . S2CID 256457783 .
- ^ «Как распознать деменцию у людей с потерей слуха» . Доказательства НИХР . 8 февраля 2023 г. doi : 10.3310/nihrevidence_59137 . S2CID 260465275 .
- ^ Хендри К., Грин С., МакШейн Р., Ноэль-Сторр А.Х., Стотт Д.Д., Анвер С. и др. (март 2019 г.). «AD-8 для выявления деменции в различных медицинских учреждениях» . Кокрановская база данных систематических обзоров . 3 (3): CD011121. дои : 10.1002/14651858.CD011121.pub2 . ПМК 6398085 . ПМИД 30828783 .
- ^ Би П. «Пятиминутный тест, который определит, находитесь ли вы на пути к слабоумию» . Проверено 1 января 2022 г.
- ^ Перейти обратно: а б «FDA разрешило 5-минутный тест на раннюю деменцию» . Медскейп . Проверено 1 января 2022 г.
- ^ Йорм А.Ф. (сентябрь 2004 г.). «Опросник для информатора о снижении когнитивных функций у пожилых людей (IQCODE): обзор». Международная психогериатрия . 16 (3): 275–293. дои : 10.1017/S1041610204000390 . ПМИД 15559753 . S2CID 145256616 .
- ^ Бертон Дж.К., Стотт Д.Д., МакШейн Р., Ноэль-Сторр А.Х., Суонн-Прайс Р.С., Куинн Т.Дж. (июль 2021 г.). «Опросник для информаторов о снижении когнитивных функций у пожилых людей (IQCODE) для раннего выявления деменции в различных медицинских учреждениях» . Кокрановская база данных систематических обзоров . 2021 (7): CD011333. дои : 10.1002/14651858.CD011333.pub3 . ПМЦ 8406787 . ПМИД 34275145 .
- ^ Якова С., Кертес А., Блэр М., Фиск Дж.Д., Фельдман Х.Х. (октябрь 2007 г.). «Нейропсихологическое тестирование и оценка деменции». Болезнь Альцгеймера и деменция . 3 (4): 299–317. дои : 10.1016/j.jalz.2007.07.011 . ПМИД 19595951 . S2CID 40462470 .
- ^ Бойсе Л., Камичиоли Р., Морган Д.Л., Роуз Дж.Х., Конглтон Л. (август 1999 г.). «Диагностика деменции: взгляды врачей первичного звена» . Геронтолог . 39 (4): 457–464. дои : 10.1093/геронт/39.4.457 . ПМИД 10495584 .
- ^ Эспино Д.В., Жюль-Брэдли AC, Джонстон CL, Мутон CP (март 1998 г.). «Диагностический подход к растерянному пожилому пациенту» . Американский семейный врач . 57 (6): 1358–1366. ПМИД 9531917 .
- ^ Бонте Ф.Дж., Харрис Т.С., Хайнан Л.С., Биджио Э.Х., Уайт CL (июль 2006 г.). «ОФЭКТ Tc-99m HMPAO в дифференциальной диагностике деменции с гистопатологическим подтверждением». Клиническая ядерная медицина . 31 (7): 376–378. дои : 10.1097/01.rlu.0000222736.81365.63 . ПМИД 16785801 . S2CID 39518497 .
- ^ Дугалл, Нью-Джерси, Бруггинк С., Эбмайер К.П. (2004). «Систематический обзор диагностической точности 99mTc-HMPAO-SPECT при деменции» (PDF) . Американский журнал гериатрической психиатрии . 12 (6): 554–570. дои : 10.1176/appi.ajgp.12.6.554 . ПМИД 15545324 . S2CID 12375536 . Архивировано из оригинала (PDF) 13 июля 2020 г.
- ^ Ангелопулу Э., Паудель Ю.Н., Шейх М.Ф., Пипери С. (март 2020 г.). «Флотиллин: многообещающий биомаркер болезни Альцгеймера» . Дж. Перс Мед . 10 (2): 20. дои : 10.3390/jpm10020020 . ПМЦ 7354424 . ПМИД 32225073 .
- ^ Чжан Ю.Р., Сюй В., Чжан В. и др. (октябрь 2022 г.). «Модифицируемые факторы риска развития деменции и когнитивных нарушений: общий обзор доказательств». J Аффект Беспорядка . 314 : 160–167. дои : 10.1016/j.jad.2022.07.008 . ПМИД 35863541 .
- ^ Хантли Дж., Корбетт А., Уэснес К., Брукер Х., Стентон Р., Хэмпшир А., Баллард С. (февраль 2018 г.). «Онлайн-оценка факторов риска деменции и когнитивных функций у здоровых взрослых» . Международный журнал гериатрической психиатрии . 33 (2): e286–e293. дои : 10.1002/gps.4790 . ПМИД 28960500 . S2CID 33822160 .
- ^ «Сосудистые факторы риска и здоровье мозга» (PDF) . Архивировано (PDF) оригинала 9 октября 2022 г. Проверено 1 января 2021 г.
- ^ Дин Дж., Дэвис-Плурд К.Л., Седагат С., Талли П.Дж., Ван В., Филлипс С. и др. (январь 2020 г.). «Антигипертензивные препараты и риск развития деменции и болезни Альцгеймера: метаанализ данных отдельных участников проспективных когортных исследований» . «Ланцет». Неврология . 19 (1): 61–70. дои : 10.1016/S1474-4422(19)30393-X . ПМЦ 7391421 . PMID 31706889 .
- ^ Лурида И, Хэннон Э, Литтлджонс Т.Дж., Ланга К.М., Хиппёнен Э., Кузьма Э., Ллевеллин DJ (июль 2019 г.). «Связь образа жизни и генетического риска с заболеваемостью деменцией» . ДЖАМА . 322 (5): 430–437. дои : 10.1001/jama.2019.9879 . ПМК 6628594 . ПМИД 31302669 .
- ^ Ашванден Д., Стрикхаузер Дж. Э., Лучетти М., Стефан Ю., Сутин А. Р., Терраччано А. (май 2021 г.). «Связана ли личность с риском деменции? Метааналитическое исследование» . Обзоры исследований старения . 67 : 101269. doi : 10.1016/j.arr.2021.101269 . ПМЦ 8005464 . ПМИД 33561581 .
- ^ Сутин А.Р., Ашванден Д., Лучетти М., Стефан Ю., Терраччано А. (2021). «Ощущение цели в жизни связано с более низким риском развития деменции: метаанализ» . Журнал болезни Альцгеймера . 83 (1): 249–258. дои : 10.3233/JAD-210364 . ПМЦ 8887819 . ПМИД 34275900 .
- ^ Лучетти М., Терраччано А., Ашванден Д., Ли Дж. Х., Стефан Ю., Сутин А. Р. (июль 2020 г.). «Одиночество связано с риском когнитивных нарушений в исследовании здоровья, старения и выхода на пенсию в Европе» . Международный журнал гериатрической психиатрии . 35 (7): 794–801. дои : 10.1002/gps.5304 . ПМЦ 7755119 . ПМИД 32250480 .
- ^ «Одиночество, а не социальная изоляция предсказывает развитие деменции у пожилых людей» . Доказательства NIHR (резюме на простом английском языке). 27 мая 2020 г. doi : 10.3310/alert_40330 . S2CID 241649845 .
- ^ Рафнссон С.Б., Оррелл М., д'Орси Э., Хогерворст Э., Степто А (январь 2020 г.). Карр Д. (ред.). «Одиночество, социальная интеграция и случайная деменция в течение 6 лет: перспективные результаты английского продольного исследования старения» . Журналы геронтологии. Серия B, Психологические науки и социальные науки . 75 (1): 114–124. дои : 10.1093/geronb/gbx087 . ПМК 6909434 . ПМИД 28658937 .
- ^ Перейти обратно: а б Ченг С.Т. (сентябрь 2016 г.). «Когнитивный резерв и профилактика деменции: роль физической и когнитивной деятельности» . Текущие отчеты психиатрии . 18 (9): 85. дои : 10.1007/s11920-016-0721-2 . ПМЦ 4969323 . ПМИД 27481112 .
- ^ Дауэс П. (март 2019 г.). «Слуховые вмешательства для предотвращения деменции» . ХНО . 67 (3): 165–171. дои : 10.1007/s00106-019-0617-7 . ПМК 6399173 . ПМИД 30767054 .
- ^ Перейти обратно: а б с д Панза Ф., Лозупоне М., Сардоне Р., Баттиста П., Пиччининни М., Дибелло В. и др. (2019). «Сенсорная слабость: возрастная потеря слуха и риск когнитивных нарушений и деменции в дальнейшей жизни» . Терапевтические достижения в области хронических заболеваний . 10 : 2040622318811000. дои : 10.1177/2040622318811000 . ПМК 6700845 . ПМИД 31452865 .
- ^ Томсон Р.С., Аудуонг П., Миллер А.Т., Гугель Р.К. (апрель 2017 г.). «Потеря слуха как фактор риска деменции: систематический обзор» . Ларингоскопическая исследовательская отоларингология . 2 (2): 69–79. дои : 10.1002/lio2.65 . ПМК 5527366 . ПМИД 28894825 .
- ^ Хаббард Х.И., Мамо С.К., Хоппер Т. (июль 2018 г.). «Слабоумие и потеря слуха: взаимосвязь и аспекты лечения». Семинары по речи и языку . 39 (3): 197–210. дои : 10.1055/s-0038-1660779 . ПМИД 29933487 . S2CID 49383232 .
- ^ Форд А.Х., Хэнки Дж.Дж., Йип Б.Б., Голледж Дж., Фликер Л., Алмейда ОП (июнь 2018 г.). «Потеря слуха и риск деменции в дальнейшей жизни». Матуритас . 112 : 1–11. дои : 10.1016/j.maturitas.2018.03.004 . ПМИД 29704910 . S2CID 13998812 .
- ^ Финк Х.А., Ютковиц Э., МакКартен Дж.Р., Хемми Л.С., Батлер М., Давила Х. и др. (январь 2018 г.). «Фармакологические вмешательства для предотвращения снижения когнитивных функций, легких когнитивных нарушений и клинической деменции альцгеймеровского типа: систематический обзор». Анналы внутренней медицины . 168 (1): 39–51. дои : 10.7326/M17-1529 . ПМИД 29255847 . S2CID 24193907 .
- ^ Хьюз Д., Судья С., Мерфи Р., Лафлин Е., Костелло М., Уайтли В. и др. (май 2020 г.). «Связь снижения артериального давления с возникновением деменции или когнитивных нарушений: систематический обзор и метаанализ» . ДЖАМА . 323 (19): 1934–1944. дои : 10.1001/jama.2020.4249 . ПМЦ 7237983 . ПМИД 32427305 .
- ^ Арапакис К., Бруннер Э., Френч Э., Макколи Дж. (октябрь 2021 г.). «Слабоумие и неблагополучие в США и Англии: сравнительное исследование населения» . БМЖ Опен . 11 (10): e045186. doi : 10.1136/bmjopen-2020-045186 . ПМЦ 8496387 . ПМИД 34615672 .
- ^ Дейли Б., Томпселл А., Шарплинг Дж., Руни Ю.М., Хиллман Л., Ваньони К.Л., Уайт С., Галлахер Дж.Э. (январь 2018 г.). «Сводка фактических данных: взаимосвязь между здоровьем полости рта и деменцией» (PDF) . Британский стоматологический журнал . 223 (11): 846–853. дои : 10.1038/sj.bdj.2017.992 . ПМИД 29192686 . S2CID 19633523 .
- ^ Миклосси Дж. (2015). «Исторические данные, подтверждающие причинно-следственную связь между спирохетальными инфекциями и болезнью Альцгеймера» . Границы стареющей неврологии . 7:46 . дои : 10.3389/fnagi.2015.00046 . ПМК 4399390 . ПМИД 25932012 .
- ^ Перейти обратно: а б с Олсен И., Синхрао СК (17 сентября 2015 г.). «Может ли инфекция полости рта быть фактором риска болезни Альцгеймера?» . Журнал оральной микробиологии . 7 : 29143. дои : 10.3402/jom.v7.29143 . ПМЦ 4575419 . ПМИД 26385886 .
- ^ «Может ли плохое здоровье полости рта привести к деменции?». Британский стоматологический журнал . 223 (11): 840. Декабрь 2017 г. doi : 10.1038/sj.bdj.2017.1064 . ПМИД 29243693 . S2CID 25898592 .
- ^ Картер Си Джей (февраль 2011 г.). «Бляшки и клубки болезни Альцгеймера: кладбища пирровой победы системы иммунной защиты против инфекции простого герпеса за счет разрушения нейронов, опосредованного комплементом и воспалением». Нейрохимия Интернэшнл . 58 (3): 301–320. дои : 10.1016/j.neuint.2010.12.003 . ПМИД 21167244 . S2CID 715832 .
- ^ Гибсон, Дж. Э., Хирш, Дж. А., Фонцетти, П. и др. (2016)Витамин B1 (тиамин) и деменция. Энн, Нью-Йоркская академия наук, 1367, 21–30.
- ^ Баттерворт, РФ (2003)Дефицит тиамина и заболевания головного мозга. Нутр Рес Ред. 16, 277–284.
- ^ Хоффман, Р. (2016). Дефицит тиамина в западной диете и риск деменции. Британский журнал питания, 116 (1), 188–189.
- ^ Перейти обратно: а б Домингес Л.Дж., Барбагалло М. (июнь 2018 г.). «Питательная профилактика снижения когнитивных функций и деменции» . Acta Bio Medica: Атенеум Парма . 89 (2): 276–290. дои : 10.23750/abm.v89i2.7401 . ПМК 6179018 . ПМИД 29957766 .
- ^ Гудман Б. «Диета влияет на маркеры болезни Альцгеймера» . ВебМД . Проверено 13 декабря 2020 г.
- ^ «Потеря памяти может быть вызвана рядом факторов: от краткосрочных причин, таких как низкий уровень сахара в крови или побочные эффекты лекарств, до долгосрочных проблем со здоровьем, таких как деменция» . Диабет . 15 января 2019 года . Проверено 13 декабря 2020 г.
- ^ Цао Л., Тан Л., Ван Х.Ф., Цзян Т., Чжу XC, Лу Х. и др. (ноябрь 2016 г.). «Схемы питания и риск деменции: систематический обзор и метаанализ когортных исследований». Молекулярная нейробиология . 53 (9): 6144–6154. дои : 10.1007/s12035-015-9516-4 . OCLC 6947867710 . ПМИД 26553347 . S2CID 8188716 .
- ^ Каневелли М., Луккини Ф., Куарата Ф., Бруно Дж., Чезари М. (март 2016 г.). «Питание и деменция: доказательства профилактических подходов?» . Питательные вещества . 8 (3). MDPI : 144. doi : 10.3390/nu8030144 . OCLC 8147564576 . ПМЦ 4808873 . ПМИД 26959055 .
- ^ Шеннон О.М., Рэнсон Дж.М., Грегори С., Макферсон Х., Милте С., Ленджес М., Маллиган А., МакЭвой С., Гриффитс А., Мату Дж., Хилл Т.Р., Адамсон А., Сьерво М., Минихейн А.М., Мунис-Терерра Г., Ричи С., Мазерс Дж.К., Ллевеллин DJ, Стивенсон Э. (март 2023 г.). «Соблюдение средиземноморской диеты связано с более низким риском деменции, независимо от генетической предрасположенности: результаты проспективного когортного исследования UK Biobank» . БМК Мед . 21 (1): 81. дои : 10.1186/s12916-023-02772-3 . ПМЦ 10012551 . ПМИД 36915130 . S2CID 257499227 .
- ^ Омар Ш. (июнь 2019 г.). «Средиземноморская диета и диета MIND, содержащая оливковые биофенолы, снижает распространенность болезни Альцгеймера» . Int J Mol Sci . 20 (11): 2797. doi : 10.3390/ijms20112797 . ПМК 6600544 . ПМИД 31181669 .
- ^ Буркхардт М., Херке М., Вустманн Т., Вацке С., Лангер Г., Финк А. (апрель 2016 г.). «Омега-3 жирные кислоты для лечения деменции» . Кокрановская база данных систематических обзоров . 2016 (4): CD009002. дои : 10.1002/14651858.CD009002.pub3 . ПМЦ 7117565 . ПМИД 27063583 .
- ^ Ферт Дж., Тисдейл С.Б., Аллотт К., Сискинд Д., Маркс В., Коттер Дж., Веронезе Н., Шух Ф, Смит Л., Солми М., Карвальо А.Ф., Ванкампфорт Д., Берк М., Стаббс Б., Саррис Дж. (октябрь 2019 г.). «Эффективность и безопасность пищевых добавок при лечении психических расстройств: метаобзор метаанализа рандомизированных контролируемых исследований» . Мировая психиатрия . 18 (3): 308–324. дои : 10.1002/wps.20672 . ПМК 6732706 . ПМИД 31496103 .
- ^ Хафди М., депутат Хувенар-Блома, Ричард Э. (ноябрь 2021 г.). «Многодоменные вмешательства для профилактики деменции и снижения когнитивных функций» . Кокрановская база данных систематических обзоров . 2021 (11): CD013572. дои : 10.1002/14651858.CD013572.pub2 . ПМЦ 8574768 . ПМИД 34748207 . S2CID 243846602 .
- ^ Шнайдер Л.С., Мангиалаше Ф., Андреасен Н., Фельдман Х., Джакобини Э., Джонс Р. и др. (март 2014 г.). «Клинические испытания и поздняя стадия разработки лекарств от болезни Альцгеймера: оценка с 1984 по 2014 год» . Журнал внутренней медицины . 275 (3): 251–283. дои : 10.1111/joim.12191 . ПМЦ 3956752 . ПМИД 24605808 .
- ^ Ватт Дж.А., Гударзи З., Вероники А.А., Нинчич В., Хан П.А., Гассеми М. и др. (ноябрь 2019 г.). «Сравнительная эффективность вмешательств при агрессивном и возбужденном поведении при деменции: систематический обзор и сетевой метаанализ». Анналы внутренней медицины . 171 (9): 633–642. дои : 10.7326/M19-0993 . ПМИД 31610547 . S2CID 204699972 .
- ^ Вандепитт С., Ван Ден Ноортгейт Н., Путман К., Верхаге С., Вердонк К., Аннеманс Л. (декабрь 2016 г.). «Эффективность временного ухода в поддержке лиц, осуществляющих неформальный уход за людьми с деменцией: систематический обзор». Международный журнал гериатрической психиатрии . 31 (12): 1277–1288. дои : 10.1002/gps.4504 . ПМИД 27245986 . S2CID 3464912 .
- ^ Перейти обратно: а б с д Уолш С.К., Мерфи Э., Девейн Д., Сэмпсон Э.Л., Коннолли С., Карни П., О'Ши Э. (сентябрь 2021 г.). «Паллиативная помощь при поздних стадиях деменции» . Кокрановская база данных систематических обзоров . 2021 (9): CD011513. дои : 10.1002/14651858.CD011513.pub3 . ПМЦ 8478014 . ПМИД 34582034 .
- ^ Forbes D, Forbes SC, Blake CM, Thiessen EJ, Forbes S (апрель 2015 г.). «Программы упражнений для людей с деменцией» . Кокрановская база данных систематических обзоров (представленная рукопись). 132 (4): CD006489. дои : 10.1002/14651858.CD006489.pub4 . ПМЦ 9426996 . ПМИД 25874613 .
- ^ Лагерь CJ (2010). «Истоки Монтессори-программирования при деменции» . Нефармакологические методы лечения деменции . 1 (2): 163–174. ПМЦ 3600589 . ПМИД 23515663 .
- ^ Чеонг С.И., Тан Дж.А., Фунг Ю.Л., Ко Х.М., Чен Д.З., Тан Дж.Дж., Нг С.Дж., Яп П. (2016). «Творческая музыкальная терапия в условиях неотложной помощи пожилым пациентам с делирием и деменцией» . Деменция и гериатрические когнитивные расстройства . 6 (2): 268–275. дои : 10.1159/000445883 . ПМЦ 4959431 . ПМИД 27489560 .
- ^ Чон Й.Х., Ли З., Лоу Л.Ф., Ченовет Л., О'Коннор Д., Битти Э., Лю З., Бродати Х. (август 2015 г.). «Клиническая полезность Корнельской шкалы депрессии при деменции в качестве рутинной оценки в домах престарелых». Американский журнал гериатрической психиатрии . 23 (8): 784–793. дои : 10.1016/j.jagp.2014.08.013 . ПМИД 25256214 .
- ^ Чон Й.Х., Лю З., Ли З. и др. (ноябрь 2016 г.). «Разработка и проверка краткой версии Корнеллской шкалы депрессии при деменции для обследования жителей домов престарелых» . Американский журнал гериатрической психиатрии . 24 (11): 1007–1016. дои : 10.1016/j.jagp.2016.05.012 . hdl : 1959.4/unsworks_39417 . ПМИД 27538349 .
- ^ Харпер А.Э., Роуч С., Леланд Н.Е., Тернер Р.Л., Мансбах В.Е., Дэй CE, Терхорст Л. (апрель 2022 г.). «Систематический обзор инструментов оценки перспектив лиц, осуществляющих уход за пациентами с деменцией». Журнал прикладной геронтологии . 41 (4): 1196–1208. дои : 10.1177/07334648211028692 . ПМИД 34229505 . S2CID 235758241 .
- ^ «Программа WHELD для людей с деменцией помогает персоналу домов престарелых оказывать личностно-ориентированную помощь» . Доказательства NIHR (резюме на простом английском языке). 26 ноября 2020 г. doi : 10.3310/alert_42713 . S2CID 240719455 .
- ^ Баллард С., Оррелл М., Мониз-Кук Е., Вудс Р., Уитакер Р., Корбетт А. и др. (июль 2020 г.). «Улучшение психического здоровья и сокращение использования антипсихотиков у людей с деменцией в домах престарелых: исследовательская программа WHELD, включающая два РКИ» . Программа грантов на прикладные исследования . 8 (6): 1–98. дои : 10.3310/pgfar08060 . ПМИД 32721145 . S2CID 225489651 .
- ^ Вудс Б., О'Филбин Л., Фаррелл Э.М., Спектор А.Е., Оррелл М. (март 2018 г.). «Терапия воспоминаний при деменции» . Кокрановская база данных систематических обзоров . 2018 (3): CD001120. дои : 10.1002/14651858.CD001120.pub3 . ПМК 6494367 . ПМИД 29493789 .
- ^ Верной-Дассен М., Драшкович И., МакКлири Дж., Даунс М. (ноябрь 2011 г.). «Когнитивный рефрейминг для лиц, осуществляющих уход за людьми с деменцией». Кокрейновская база данных систематических обзоров (11): CD005318. arXiv : 0706.4406 . дои : 10.1002/14651858.CD005318.pub2 . hdl : 2066/97731 . ПМИД 22071821 . S2CID 205178315 .
- ^ Нил М., Бартон Райт П. (2003). «Валидационная терапия деменции». Кокрейновская база данных систематических обзоров (3): CD001394. дои : 10.1002/14651858.CD001394 . ПМИД 12917907 .
- ^ Вудс Б., Агирре Э., Спектор А.Е., Оррелл М. (февраль 2012 г.). «Когнитивная стимуляция для улучшения когнитивных функций у людей с деменцией». Кокрановская база данных систематических обзоров . 2 (2): CD005562. дои : 10.1002/14651858.CD005562.pub2 . ПМИД 22336813 . S2CID 7086782 .
- ^ Перейти обратно: а б Мёлер Р., Реном А, Реном Х, Мейер Г (август 2020 г.). «Индивидуально подобранные мероприятия для улучшения психосоциальных результатов для людей с деменцией в условиях сообщества» . Кокрановская база данных систематических обзоров . 2020 (8): CD010515. дои : 10.1002/14651858.CD010515.pub2 . ПМК 8094398 . ПМИД 32786083 .
- ^ Баркер П. (2003). Сестринское дело в области психиатрии и психического здоровья: искусство ухода . Лондон: Арнольд. ISBN 978-0-340-81026-2 . OCLC 53373798 .
- ^ Вайцель Т., Робинсон С., Барнс М.Р. и др. (2011). «Особые потребности госпитализированного пациента с деменцией». Медсург Сестринское дело . 20 (1): 13–18, викторина 19. PMID 21446290 .
- ^ Каннингем С. (2006). «Понимание сложного поведения у пациентов с деменцией». Стандарт сестринского дела . 20 (47): 42–45. дои : 10.7748/ns2006.08.20.47.42.c4477 . ПМИД 16913375 .
- ^ Перейти обратно: а б Дайер С.М., Харрисон С.Л., Лейвер К., Уайтхед С., Кротти М. (март 2018 г.). «Обзор систематических обзоров фармакологических и нефармакологических вмешательств для лечения поведенческих и психологических симптомов деменции» . Международная психогериатрия . 30 (3): 295–309. дои : 10.1017/S1041610217002344 . ПМИД 29143695 .
- ^ ван дер Стин Дж.Т., Смалинг Х.Дж., ван дер Вуден Дж.К., Бруинсма М.С., Шолтен Р.Дж., Винк А.С. (июль 2018 г.). «Музыкальные терапевтические вмешательства для людей с деменцией» . Кокрановская база данных систематических обзоров . 2018 (7): CD003477. дои : 10.1002/14651858.CD003477.pub4 . hdl : 1874/350441 . ПМК 6513122 . ПМИД 30033623 .
- ^ Осман С.Е., Тишлер В., Шнайдер Дж. (ноябрь 2016 г.). « Пение для мозга: качественное исследование, изучающее пользу пения для здоровья и благополучия людей с деменцией и тех, кто за ними ухаживает» . Деменция . 15 (6): 1326–1339. дои : 10.1177/1471301214556291 . ПМК 5089222 . ПМИД 25425445 .
- ^ Перейти обратно: а б с Джонстон Б., Нараянасами М. (апрель 2016 г.). «Изучение психосоциальных вмешательств для людей с деменцией, которые улучшают личность и связаны с наследием - интегративный обзор» . BMC Гериатрия . 16:77 . дои : 10.1186/s12877-016-0250-1 . ПМЦ 4820853 . ПМИД 27044417 .
- ^ «Британские больницы перестраиваются для людей с деменцией» . Экономист . Проверено 19 сентября 2018 г.
- ^ Перейти обратно: а б Радж С.Э., Макинтош С., Фрайер С., Стэнли М. (1 января 2021 г.). «Трудотерапия на дому для взрослых с деменцией и их неформальных опекунов: систематический обзор». Американский журнал профессиональной терапии . 75 (1): 7501205060п1–7501205060п27. дои : 10.5014/ajot.2020.040782 . ПМИД 33399054 . S2CID 230618534 .
- ^ Перейти обратно: а б Франкенштейн Л.Л., Ян Дж. (20 апреля 2020 г.). «Поведенческая и профессиональная терапия для пациентов с деменцией и лиц, осуществляющих уход» . ГероПсих . 33 (2): 85–100. дои : 10.1024/1662-9647/a000225 . ISSN 1662-9647 . S2CID 219081899 .
- ^ Оргета В., Макдональд К.Р., Полякофф Э. и др. (февраль 2020 г.). «Вмешательства по когнитивной тренировке при деменции и легких когнитивных нарушениях при болезни Паркинсона» . Кокрейновская база данных систематических обзоров . 2020 (2): CD011961. дои : 10.1002/14651858.cd011961.pub2 . ПМК 7043362 . ПМИД 32101639 .
- ^ Кудличка А., Мученик А., Бахар-Фукс А. и др. (29 июня 2023 г.). Кокрейновская группа по деменции и улучшению когнитивных функций (ред.). «Когнитивная реабилитация для людей с легкой и умеренной деменцией» . Кокрейновская база данных систематических обзоров . 2023 (6): CD013388. дои : 10.1002/14651858.CD013388.pub2 . ПМЦ 10310315 . ПМИД 37389428 .
- ^ Мёлер Р., Кало С., Реном А, Реном Х., Мейер Г. (март 2023 г.). «Индивидуально подобранные мероприятия для улучшения психосоциальных результатов для людей с деменцией, находящихся на долгосрочном уходе» . Кокрановская база данных систематических обзоров . 2023 (3): CD009812. дои : 10.1002/14651858.CD009812.pub3 . ПМК 10010156 . ПМИД 36930048 .
- ^ Рафий М.С., Айсен П.С. (февраль 2009 г.). «Последние разработки в области лечения болезни Альцгеймера» . БМК Медицина . 7 :7. дои : 10.1186/1741-7015-7-7 . ПМК 2649159 . ПМИД 19228370 .
- ^ Перейти обратно: а б Ллео А., Гринберг С.М., Гроудон Дж.Х. (2006). «Современная фармакотерапия болезни Альцгеймера». Ежегодный обзор медицины . 57 (1): 513–533. дои : 10.1146/annurev.med.57.121304.131442 . ПМИД 16409164 .
- ^ Перейти обратно: а б Бонд М., Роджерс Г., Питерс Дж., Андерсон Р., Хойл М., Майнерс А. и др. (2012). «Эффективность и экономическая эффективность донепезила, галантамина, ривастигмина и мемантина для лечения болезни Альцгеймера (обзор Technology Appraisal № 111): систематический обзор и экономическая модель» . Оценка технологий здравоохранения . 16 (21): 1–470. дои : 10.3310/hta16210 . ПМЦ 4780923 . ПМИД 22541366 .
- ^ Родда Дж., Морган С., Уокер З. (октябрь 2009 г.). «Эффективны ли ингибиторы холинэстеразы в лечении поведенческих и психологических симптомов деменции при болезни Альцгеймера? Систематический обзор рандомизированных плацебо-контролируемых исследований донепезила, ривастигмина и галантамина». Международная психогериатрия . 21 (5): 813–824. дои : 10.1017/S1041610209990354 . ПМИД 19538824 . S2CID 206299435 .
- ^ Биркс Дж. (январь 2006 г.). Биркс Дж.С. (ред.). «Ингибиторы холинэстеразы при болезни Альцгеймера» . Кокрановская база данных систематических обзоров . 2016 (1): CD005593. дои : 10.1002/14651858.CD005593 . ПМЦ 9006343 . ПМИД 16437532 .
- ^ Гилл С.С., Андерсон Г.М., Фишер Х.Д., Белл С.М., Ли П., Норманд С.Л., Рошон П.А. (май 2009 г.). «Обморок и его последствия у пациентов с деменцией, получающих ингибиторы холинэстеразы: популяционное когортное исследование» . Архив внутренней медицины . 169 (9): 867–873. doi : 10.1001/archinternmed.2009.43 . ПМИД 19433698 .
- ^ Ван К., Алан Дж., Пейдж А.Т., Димопулос Э., Этертон-Бир С. (сентябрь 2021 г.). «Антихолинергические препараты и клинические результаты у людей с уже существующей деменцией: систематический обзор». Матуритас . 151 . Эльзевир Б.В.: 1–14. doi : 10.1016/j.maturitas.2021.06.004 . ПМИД 34446273 .
- ^ AMDA – Общество медицины пост-острого и долгосрочного ухода (февраль 2014 г.), «Десять вопросов, о которых должны спросить врачи и пациенты» , «Выбирая мудро» : инициатива Фонда ABIM , AMDA – Общество помощи после-острого и долгосрочного ухода Term Care Medicine, архивировано из оригинала 12 апреля 2015 г. , получено 20 апреля 2015 г.
- ^ Уокер З., Поссин К.Л., Боев Б.Ф., Аарсланд Д. (октябрь 2015 г.). «Деменция с тельцами Леви» . Ланцет (Обзор). 386 (10004): 1683–1697. дои : 10.1016/S0140-6736(15)00462-6 . ПМК 5792067 . ПМИД 26595642 .
- ^ Загрузочный БП (2015). «Комплексное лечение деменции с помощью телец Леви» . Alzheimers Res Ther (обзор). 7 (1): 45. дои : 10.1186/s13195-015-0128-z . ПМЦ 4448151 . ПМИД 26029267 .
- ^ Гомпертс С.Н. (апрель 2016 г.). «Деменция с тельцами Леви: деменция с тельцами Леви и деменция при болезни Паркинсона» . Континуум (Миннеап, Минн) (обзор). 22 (2 деменция): 435–463. дои : 10.1212/CON.0000000000000309 . ПМК 5390937 . ПМИД 27042903 .
- ^ Перейти обратно: а б с д и ж г Американское гериатрическое общество . «Пять вопросов, которые должны задать врачи и пациенты» . Выбираем мудро: инициатива Фонда ABIM . Архивировано из оригинала 1 сентября 2013 года . Проверено 1 августа 2013 г.
- ^ Американская психиатрическая ассоциация (сентябрь 2013 г.), «Пять вопросов, которые должны задать врачи и пациенты» , «Выбирая мудро : инициатива Фонда ABIM» , Американская психиатрическая ассоциация , заархивировано из оригинала 3 декабря 2013 г. , получено 30 декабря 2013 г.
- ^ «Деменция: оценка, ведение и поддержка людей, живущих с деменцией, и лиц, осуществляющих за ними уход | Руководства и рекомендации | NICE» . ХОРОШИЙ . 20 июня 2018 г. Проверено 18 декабря 2018 г.
- ^ Дайер С.М., Лейвер К., Понд К.Д., Камминг Р.Г., Уайтхед С., Кротти М. (декабрь 2016 г.). «Руководства по клинической практике и принципы ухода за людьми с деменцией в Австралии» . Австралийский семейный врач . 45 (12): 884–889. ПМИД 27903038 .
- ^ Деклерк Т., Петрович М., Азермай М., Вандер Стихеле Р., Де Саттер А.И., ван Дрил М.Л., Кристианс Т. (март 2013 г.). «Отмена и продолжение хронического приема антипсихотических препаратов при поведенческих и психологических симптомах у пожилых людей с деменцией» (PDF) . Кокрановская база данных систематических обзоров . 3 (3): CD007726. дои : 10.1002/14651858.CD007726.pub2 . hdl : 1854/LU-3109108 . ПМИД 23543555 .
- ^ Райна П., Сантагуида П., Исмаила А., Паттерсон С., Коуэн Д., Левин М. и др. (март 2008 г.). «Эффективность ингибиторов холинэстеразы и мемантина для лечения деменции: обзор доказательств для руководства по клинической практике» . Анналы внутренней медицины . 148 (5): 379–397. дои : 10.7326/0003-4819-148-5-200803040-00009 . ПМИД 18316756 .
- ^ Атри А., Шонесси Л.В., Локасио Дж.Дж., Гроудон Дж.Х. (2008). «Длительный курс и эффективность комбинированной терапии при болезни Альцгеймера» . Болезнь Альцгеймера и связанные с ней расстройства . 22 (3): 209–221. дои : 10.1097/WAD.0b013e31816653bc . ПМЦ 2718545 . ПМИД 18580597 .
- ^ Перейти обратно: а б с д Кандия Н., Онг П.А., Юда Т., Нг ЛЛ, Мамун К., Мерчант Р.А. и др. (февраль 2019 г.). «Лечение деменции и легких когнитивных нарушений с цереброваскулярными заболеваниями или без них: консенсус экспертов по использованию экстракта гинкго двулопастного, EGb 761 ® « . Нейронаука и терапия ЦНС . 25 (2): 288–298. : 10.1111 /cns.13095 . PMC 6488894. . PMID 30648358 doi
- ^ Маккидж К., Лисенг-Уильямсон К.А. (2018). « Экстракт гинкго двулопастного EGb 761 ® лечении легкой и умеренной деменции: профиль его использования» . Drugs & Therapy Perspectives . 34 (8): 358–366. doi : 10.1007/s40267-018-0537-8 . PMC 6267544. в симптоматическом PMID 30546253 .
- ^ Ван М., Пэн Х., Пэн З., Хуан К., Ли Т, Ли Л и др. (сентябрь 2020 г.). «Эффективность и безопасность препарата гинкго у пациентов с сосудистой деменцией: протокол систематического обзора и метаанализа» . Лекарство . 99 (37): e22209. дои : 10.1097/MD.0000000000022209 . ПМЦ 7489658 . ПМИД 32925798 .
- ^ Джонс Х.Э., Джоши А., Шенкин С., Мид Дж.Е. (июль 2016 г.). «Влияние лечения селективными ингибиторами обратного захвата серотонина по сравнению с плацебо на прогрессирование деменции: систематический обзор и метаанализ» . Возраст и старение . 45 (4): 448–456. doi : 10.1093/ageing/afw053 . hdl : 20.500.11820/56792c91-31f0-44cb-8ac0-7f50fad8d91e . ПМИД 27055878 .
- ^ Дудас Р., Малуф Р., Макклири Дж., Денинг Т. и др. (Кокрейновская группа по деменции и улучшению когнитивных функций) (август 2018 г.). «Антидепрессанты для лечения депрессии при деменции» . Кокрановская база данных систематических обзоров . 2018 (8): CD003944. дои : 10.1002/14651858.CD003944.pub2 . ПМК 6513376 . ПМИД 30168578 .
- ^ Зейтц Д.П., Адунури Н., Гилл С.С., Грюнейр А., Херрманн Н., Рошон П. (февраль 2011 г.). «Антидепрессанты при возбуждении и психозе при деменции». Кокрейновская база данных систематических обзоров (2): CD008191. дои : 10.1002/14651858.CD008191.pub2 . ПМИД 21328305 .
- ^ Малуф Р., Гримли Эванс Дж (октябрь 2008 г.). «Фолиевая кислота с витамином B12 или без него для профилактики и лечения здоровых пожилых людей и людей с деменцией». Кокрейновская база данных систематических обзоров (4): CD004514. дои : 10.1002/14651858.CD004514.pub2 . ПМИД 18843658 .
- ^ МакГиннесс Б., Крейг Д., Баллок Р., Малуф Р., Пассмор П. (июль 2014 г.). «Статины для лечения деменции» (PDF) . Кокрановская база данных систематических обзоров . 2014 (7): CD007514. дои : 10.1002/14651858.CD007514.pub3 . ПМЦ 11112650 . ПМИД 25004278 . Архивировано из оригинала (PDF) 3 сентября 2019 года . Проверено 3 сентября 2019 г.
- ^ Джонгстра С., Харрисон Дж. К., Куинн Т. Дж., Ричард Э. (ноябрь 2016 г.). «Антигипертензивная отмена для профилактики снижения когнитивных функций» . Кокрановская база данных систематических обзоров . 2016 (11): CD011971. дои : 10.1002/14651858.CD011971.pub2 . ПМК 6465000 . ПМИД 27802359 .
- ^ Пейдж А.Т., Поттер К., Клиффорд Р., Маклахлан А.Дж., Этертон-Бир С. (октябрь 2016 г.). «Инструмент подбора лекарств при сопутствующих заболеваниях при деменции: консенсусные рекомендации междисциплинарной группы экспертов» . Журнал внутренней медицины . 46 (10): 1189–1197. дои : 10.1111/imj.13215 . ПМК 5129475 . ПМИД 27527376 .
- ^ Ван К., Алан Дж., Пейдж А., Персиваль М., Этертон-Бир С. (2018). «Использование лекарств для лечения сопутствующих заболеваний у людей с деменцией: систематический обзор» . Журнал фармацевтической практики и исследований . 48 (4): 356–367. дои : 10.1002/jppr.1403 . ISSN 2055-2335 .
- ^ Перейти обратно: а б Вилфлинг Д., Кало С., Дихтер М.Н., Мейер Г., Мёлер Р., Кёпке С. (январь 2023 г.). «Нефармакологические вмешательства при нарушениях сна у людей с деменцией» . Кокрановская база данных систематических обзоров . 1 (1): CD011881. дои : 10.1002/14651858.CD011881.pub2 . ПМЦ 9808594 . ПМИД 36594432 .
- ^ Перейти обратно: а б с д Макклири Дж., Шарпли А.Л. (ноябрь 2020 г.). «Фармакотерапия нарушений сна при деменции» . Кокрановская база данных систематических обзоров . 2020 (11): CD009178. дои : 10.1002/14651858.CD009178.pub4 . ПМЦ 8094738 . ПМИД 33189083 .
- ^ Экспертная группа по обновлению критериев пива Американского гериатрического общества, 2012 г. (апрель 2012 г.). «Американское гериатрическое общество обновило критерии Бирса для потенциально ненадлежащего использования лекарств пожилыми людьми» . Журнал Американского гериатрического общества . 60 (4): 616–631. дои : 10.1111/j.1532-5415.2012.03923.x . ПМЦ 3571677 . ПМИД 22376048 .
- ^ Тишер А., Салардини А (апрель 2019 г.). «Комплексная информация о лечении деменции». Семинары по неврологии . 39 (2): 167–178. дои : 10.1055/s-0039-1683408 . ПМИД 30925610 . S2CID 88474685 .
- ^ Лолк А., Гульманн, Северная Каролина (октябрь 2006 г.). «[Психофармакологическое лечение поведенческих и психологических симптомов при деменции]». Ugeskrift для Laeger (на датском языке). 168 (40): 3429–3432. ПМИД 17032610 .
- ^ Перейти обратно: а б с д и Хаджиставропулос Т., Герр К., Тёрк Д.С., Файн П.Г., Дворкин Р.Х., Хельме Р., Джексон К., Пармели П.А., Руди Т.Э., Линн Битти Б., Чибналл Дж.Т., Крейг К.Д., Феррелл Б., Феррелл Б., Филлингим Р.Б., Галлезе Л., Галлахер Р., Гибсон С.Дж., Харрисон Э.Л., Кац Б., Киф Ф.Дж., Либер С.Дж., Люсье Д., Шмадер К.Е., Тейт Р.К., Вайнер Д.К., Уильямс Дж. (январь 2007 г.). «Междисциплинарное экспертное консенсусное заявление по оценке боли у пожилых людей». Клинический журнал боли . 23 (1 дополнение): S1–S43. дои : 10.1097/AJP.0b013e31802be869 . ПМИД 17179836 . S2CID 43777445 .
- ^ Перейти обратно: а б Шега Дж., Эмануэль Л., Варгиш Л., Левин С.К., Берш Х., Герр К., Карп Дж.Ф., Вайнер Д.К. (май 2007 г.). «Боль у людей с деменцией: сложная, распространенная и трудная» . Журнал боли . 8 (5): 373–378. дои : 10.1016/j.jpain.2007.03.003 . ПМИД 17485039 .
- ^ Блит Ф.М., Камминг Р., Митчелл П., Ван Дж.Дж. (июль 2007 г.). «Боль и падения у пожилых людей». Европейский журнал боли . 11 (5): 564–571. дои : 10.1016/j.ejpain.2006.08.001 . ПМИД 17015026 . S2CID 27460864 .
- ^ Браун С. (2009). «Боль, старение и деменция: кризис надвигается, но готовы ли мы?». Британский журнал профессиональной терапии . 72 (8): 371–375. дои : 10.1177/030802260907200808 . S2CID 73245194 .
- ^ Герр К., Бьоро К., Декер С. (февраль 2006 г.). «Инструменты для оценки боли у невербальных пожилых людей с деменцией: обзор современного состояния» . Журнал управления болью и симптомами . 31 (2): 170–192. дои : 10.1016/j.jpainsymman.2005.07.001 . PMID 16488350 .
- ^ Столи П., Хиллер Л.М., Эсбо Дж., Бол Н., МакКеллар Л., Готье Н. (февраль 2005 г.). «Приборы для оценки боли у пожилых людей с когнитивными нарушениями». Журнал Американского гериатрического общества . 53 (2): 319–326. дои : 10.1111/j.1532-5415.2005.53121.x . ПМИД 15673359 . S2CID 21006144 .
- ^ AMDA – Общество медицины пост-острого и долгосрочного ухода (февраль 2014 г.), «Пять вопросов, о которых должны спросить врачи и пациенты» , «Выбирая мудро» : инициатива Фонда ABIM , AMDA – Общество помощи после-острого и долгосрочного ухода Term Care Medicine, архивировано из оригинала 13 сентября 2014 г. , получено 10 февраля 2013 г.
- ^ AMDA – Общество медицины пост-острого и долгосрочного ухода (февраль 2014 г.), «Пять вопросов, о которых должны спросить врачи и пациенты» , «Выбирая мудро» : инициатива Фонда ABIM , AMDA – Общество помощи после-острого и долгосрочного ухода Term Care Medicine, заархивировано из оригинала 13 сентября 2014 г. , получено 10 февраля 2013 г. , в котором цитируется:
- Тено Дж.М., Гозало П.Л., Митчелл С.Л., Куо С., Роудс Р.Л., Байнум Дж.П., Мор В. (октябрь 2012 г.). «Улучшает ли установка зонда для кормления и своевременность его выживаемости?» . Журнал Американского гериатрического общества . 60 (10): 1918–1921. дои : 10.1111/j.1532-5415.2012.04148.x . ПМК 3470758 . ПМИД 23002947 .
- Палечек Э.Дж., Тено Дж.М., Казаретт Д.Д., Хэнсон Л.К., Роудс Р.Л., Митчелл С.Л. (март 2010 г.). «Только комфортное кормление: предложение внести ясность в процесс принятия решений относительно трудностей с приемом пищи у людей с поздними стадиями деменции» . Журнал Американского гериатрического общества . 58 (3): 580–584. дои : 10.1111/j.1532-5415.2010.02740.x . ПМЦ 2872797 . ПМИД 20398123 .
- Гиллик М.Р., Воландес А.Е. (июнь 2008 г.). «Стандарты ухода: почему мы до сих пор используем зонды для кормления у пациентов с выраженной деменцией?». Журнал Американской ассоциации медицинских директоров . 9 (5): 364–367. дои : 10.1016/j.jamda.2008.03.011 . ПМИД 18519120 .
- ^ Митчелл С.Л., Кили Д.К., Липсиц Л.А. (февраль 1997 г.). «Факторы риска и влияние на выживаемость установки зонда для кормления у жителей домов престарелых с тяжелыми когнитивными нарушениями». Архив внутренней медицины . 157 (3): 327–332. дои : 10.1001/archinte.1997.00440240091014 . ПМИД 9040301 .
- ^ Сэмпсон Э.Л., Кэнди Б., Джонс Л. (апрель 2009 г.). «Энтеральное зондовое питание для пожилых людей с прогрессирующей деменцией» . Кокрановская база данных систематических обзоров . 2009 (2): CD007209. дои : 10.1002/14651858.CD007209.pub2 . ПМЦ 7182132 . ПМИД 19370678 .
- ^ Локетт М.А., Темплтон М.Л., Бирн Т.К., Норкросс Э.Д. (февраль 2002 г.). «Осложнения чрескожной эндоскопической гастростомии в специализированном медицинском центре». Американский хирург . 68 (2): 117–120. дои : 10.1177/000313480206800202 . ПМИД 11842953 . S2CID 43796062 .
- ^ Финоккьяро С, Галлетти Р, Ровера Г, Феррари А, Тодрос Л, Вуоло А, Бальзола Ф (июнь 1997 г.). «Чрескожная эндоскопическая гастростомия: долгосрочное наблюдение». Питание . 13 (6): 520–523. дои : 10.1016/S0899-9007(97)00030-0 . ПМИД 9263232 .
- ^ Митчелл С.Л., Мор В., Гозало П.Л., Сервадио Дж.Л., Тено Дж.М. (август 2016 г.). «Зондовое питание жителей домов престарелых в США с прогрессирующей деменцией, 2000–2014 гг.» (PDF) . ДЖАМА . 316 (7): 769–770. дои : 10.1001/jama.2016.9374 . ПМЦ 4991625 . ПМИД 27533163 . Архивировано (PDF) из оригинала 21 сентября 2017 г.
- ^ Спан П (29 августа 2016 г.). «Снижение использования зондового питания для пациентов с деменцией» . Нью-Йорк Таймс . Архивировано из оригинала 3 сентября 2016 года . Проверено 31 августа 2016 г.
- ^ Перейти обратно: а б Флинн Э., Смит CH, Уолш К.Д., Уолш М. (сентябрь 2018 г.). «Изменение консистенции пищи и жидкостей для устранения затруднений с глотанием при деменции» . Кокрановская база данных систематических обзоров . 2018 (9): CD011077. дои : 10.1002/14651858.cd011077.pub2 . ПМЦ 6513397 . ПМИД 30251253 .
- ^ Forbes D, Forbes SC, Blake CM, Thiessen EJ, Forbes S (апрель 2015 г.). «Программы упражнений для людей с деменцией» . Кокрановская база данных систематических обзоров . 2015 (4): CD006489. дои : 10.1002/14651858.CD006489.pub4 . ПМЦ 9426996 . ПМИД 25874613 .
- ^ Смит М., Робинсон Л., Сигал Дж. «Профилактика болезни Альцгеймера – HelpGuide.org» . HelpGuide.org . Проверено 13 декабря 2020 г.
- ^ Ван дер Роест Х.Г., Венборн Дж., Пастинк С., Дрёес Р.М., Оррелл М. (июнь 2017 г.). «Вспомогательные технологии поддержки памяти при деменции» . Кокрановская база данных систематических обзоров . 2017 (6): CD009627. дои : 10.1002/14651858.cd009627.pub2 . ПМК 6481376 . ПМИД 28602027 .
- ^ «7 технологических инноваций для людей с деменцией» . Альцгеймерс.нет . Проверено 28 июня 2022 г.
- ^ Андерсон М., Менон Р., Оук К., Аллан Л. (июнь 2022 г.). «Использование технологий социального взаимодействия людьми с деменцией: обзорный обзор» . PLOS Цифровое здоровье . 1 (6): e0000053. doi : 10.1371/journal.pdig.0000053 . ПМЦ 9931370 . ПМИД 36812560 .
- ^ Вигго Хансен Н., Йоргенсен Т., Ортенблад Л. (октябрь 2006 г.). «Массаж и прикосновения при слабоумии» . Кокрановская база данных систематических обзоров . 2006 (4): CD004989. дои : 10.1002/14651858.CD004989.pub2 . ПМЦ 6823223 . ПМИД 17054228 .
- ^ Болл Э.Л., Оуэн-Бут Б., Грей А., Шенкин С.Д., Хьюитт Дж., Макклири Дж. (август 2020 г.). «Ароматерапия при деменции» . Кокрановская база данных систематических обзоров . 2020 (8): CD003150. дои : 10.1002/14651858.CD003150.pub3 . ПМЦ 7437395 . ПМИД 32813272 .
- ^ Босняк Кухарич Д., Маркович Д., Бркович Т., Джерич Кегаль М., Рубич З., Вуйка Вукасович А. и др. (сентябрь 2021 г.). «Каннабиноиды для лечения деменции» . Кокрановская база данных систематических обзоров . 2021 (9): CD012820. дои : 10.1002/14651858.CD012820.pub2 . ПМЦ 8446835 . ПМИД 34532852 .
- ^ Сэмпсон Э.Л., Ричи К.В., Лай Р., Рэйвен П.В., Бланшар М.Р. (март 2005 г.). «Систематический обзор научных данных об эффективности паллиативного подхода к лечению деменции на поздней стадии» (PDF) . Международная психогериатрия . 17 (1): 31–40. дои : 10.1017/S1041610205001018 . ПМИД 15945590 . S2CID 7861568 . Архивировано из оригинала (PDF) 24 февраля 2019 г.
- ^ Ван ден Блок L (октябрь 2014 г.). «Необходимость интеграции паллиативной помощи в политику старения и деменции» . Европейский журнал общественного здравоохранения . 24 (5): 705–706. дои : 10.1093/eurpub/cku084 . ПМИД 24997202 .
- ^ ван дер Стин Дж.Т., Радбрух Л., Хертог К.М., де Бур М.Э., Хьюз Дж.К., Ларкин П. и др. (март 2014 г.). «Белая книга, определяющая оптимальную паллиативную помощь пожилым людям с деменцией: исследование Delphi и рекомендации Европейской ассоциации паллиативной помощи» . Паллиативная медицина . 28 (3): 197–209. дои : 10.1177/0269216313493685 . hdl : 2066/137210 . ПМИД 23828874 .
- ^ Берч Д., Дрейпер Дж. (май 2008 г.). «Критический обзор литературы, исследующий проблемы оказания эффективной паллиативной помощи пожилым людям с деменцией» (PDF) . Журнал клинического ухода . 17 (9): 1144–1163. дои : 10.1111/j.1365-2702.2007.02220.x . ПМИД 18416791 .
- ^ Митчелл Дж., Аньелли Дж. (октябрь 2015 г.). «Лично-ориентированная помощь людям с деменцией: пересмотр Китвуда». Стандарт сестринского дела . 30 (7): 46–50. дои : 10.7748/ns.30.7.46.s47 . ПМИД 26463810 .
- ^ Перейти обратно: а б Гонсалес-Фрайле Э., Бальестерос Х., Руэда Х.Р., Сантос-Сорросуа Б., Сола И., Макклири Дж. (январь 2021 г.). «Удаленно предоставляемая информация, обучение и поддержка для неформальных лиц, осуществляющих уход за людьми с деменцией» . Кокрановская база данных систематических обзоров . 1 (1): CD006440. дои : 10.1002/14651858.cd006440.pub3 . ПМК 8094510 . ПМИД 33417236 .
- ^ Дули Б., Уэно Х. (2 февраля 2022 г.). «Тысяча цифровых глаз наблюдают за пожилыми людьми» . Нью-Йорк Таймс . ISSN 0362-4331 . Проверено 6 февраля 2022 г.
- ^ Николс Э., Стейнмец Дж.Д., Воллсет С.Е., Фукутаки К., Чалек Дж., Абдаллах Ф. и др. (Сотрудники ГББ по прогнозированию деменции 2019 г.) (февраль 2022 г.). «Оценка глобальной распространенности деменции в 2019 году и прогнозируемая распространенность в 2050 году: анализ для исследования глобального бремени болезней, 2019 год» . «Ланцет». Общественное здравоохранение . 7 (2): е105–е125. дои : 10.1016/S2468-2667(21)00249-8 . ПМЦ 8810394 . ПМИД 34998485 .
- ^ Гейл С.А., Акар Д., Даффнер К.Р. (октябрь 2018 г.). «Деменция». Я Джей Мед . 131 (10): 1161–1169. doi : 10.1016/j.amjmed.2018.01.022 . ПМИД 29425707 . S2CID 240122313 .
- ^ Перейти обратно: а б с д Международная организация по борьбе с болезнью Альцгеймера (сентябрь 2015 г.). «Всемирный доклад о болезни Альцгеймера, 2015 г.» (PDF) . Архивировано (PDF) оригинала 9 октября 2022 г. Проверено 30 октября 2018 г.
- ^ Принц М., Джексон Дж. (2009). «Всемирный доклад о болезни Альцгеймера, 2009 г.» . Alzheimer's Disease International : 38. Архивировано из оригинала 11 марта 2012 года . Проверено 11 марта 2012 г.
- ^ Ван Х., Нагави М., Аллен С., Барбер Р.М., Бхутта З.А., Картер А. и др. (ГББ, 2015 г. Смертность и причины смерти, сотрудники) (октябрь 2016 г.). «Глобальная, региональная и национальная продолжительность жизни, смертность от всех причин и смертность от конкретных причин по 249 причинам смерти, 1980–2015 гг.: систематический анализ для исследования глобального бремени болезней, 2015 г.» . Ланцет . 388 (10053): 1459–1544. дои : 10.1016/s0140-6736(16)31012-1 . ПМЦ 5388903 . ПМИД 27733281 .
- ^ Бриджнат Б., Крой С., Сабатес Дж., Тодис А., Эллис С., де Креспиньи Ф. и др. (2022). «Включение этнических меньшинств в исследования деменции: рекомендации обзорного обзора» . Болезнь Альцгеймера и деменция . 8 (1): e12222. дои : 10.1002/trc2.12222 . ПМЦ 9053375 . ПМИД 35505899 .
- ^ Сабаян Б., Вайман-Чик К.А., Седагат С. (февраль 2023 г.). «Бремя расстройств спектра деменции и связанных с ними коморбидных и демографических особенностей». Клиники гериатрической медицины . 39 (1): 1–14. дои : 10.1016/j.cger.2022.07.001 . ПМИД 36404023 . S2CID 253068389 .
- ^ Ариана М. Стикель, Эндрю С. Маккиннон, Стефани Матиевик, Мэтью Д. Грилли, Джон Руис, Ли Райам (26 февраля 2021 г.). «Различия в объемах мозга на основе аллели аполипопротеина E ε4 в значительной степени одинаковы у латиноамериканцев позднего среднего возраста и пожилых людей, латиноамериканцев и неиспаноязычных/латиноамериканцев без деменции» . Границы стареющей неврологии . 13 . дои : 10.3389/fnagi.2021.627322 . ПМЦ 7952627 . ПМИД 33716715 .
- ^ Перейти обратно: а б Садок Б.Дж., Садок В.А. (2008). «Делирий, слабоумие, амнестические и другие когнитивные расстройства и психические расстройства, вызванные общим заболеванием» . Краткий учебник по клинической психиатрии Каплана и Сэдока (3-е изд.). Филадельфия: Уолтерс Клювер/Липпинкотт Уильямс и Уилкинс. п. 52. ИСБН 978-0-7817-8746-8 .
- ^ «Что вызывает раннюю деменцию? | Общество Альцгеймера» . alzheimers.org.uk . Проверено 28 июня 2022 г.
- ^ «Что вызывает раннюю деменцию? | Общество Альцгеймера» . alzheimers.org.uk . Проверено 10 января 2022 г.
- ^ Виейра РТ, Кайшета Л, Мачадо С, Силва АС, Нарди А.Е., Ариас-Каррион О, Карта МГ (14 июня 2013 г.). «Эпидемиология раннего слабоумия: обзор литературы» . Клиническая практика и эпидемиология психического здоровья . 9 : 88–95. дои : 10.2174/1745017901309010088 . ПМЦ 3715758 . ПМИД 23878613 .
- ^ Перейти обратно: а б Мастерс CL, Бейтман Р., Бленноу К., Роу CC, Сперлинг Р.А., Каммингс Дж.Л. (октябрь 2015 г.). «Болезнь Альцгеймера». Обзоры природы. Праймеры по болезням . 1 : 15056. дои : 10.1038/nrdp.2015.56 . ПМИД 27188934 . S2CID 20844163 .
- ^ Джессоп Т., Пейса К. (июль 2021 г.). «Права человека и расширение возможностей в сфере ухода за престарелыми: сдержанность, согласие и достойная смерть» . Международный журнал экологических исследований и общественного здравоохранения . 18 (15): 7899. doi : 10.3390/ijerph18157899 . ПМЦ 8345762 . ПМИД 34360196 .
- ^ Берриос Г.Е. (ноябрь 1987 г.). «Слабоумие в семнадцатом и восемнадцатом веках: концептуальная история». Психологическая медицина . 17 (4): 829–837. дои : 10.1017/S0033291700000623 . ПМИД 3324141 . S2CID 8262492 .
- ^ Бертольд, Северная Каролина, Котман, CW (1998). «Эволюция концептуализации деменции и болезни Альцгеймера: от греко-римского периода до 1960-х годов». Нейробиол Старение . 19 (3): 173–189. дои : 10.1016/s0197-4580(98)00052-9 . ПМИД 9661992 . S2CID 24808582 .
- ^ Бергенер М., Райсберг Б. (1989). Диагностика и лечение старческого слабоумия . Берлин: Springer-Verlag. ISBN 0-387-50800-7 . OCLC 19455117 .
- ^ Сихуа Дж (1989). Диагностика и лечение старческого слабоумия: методы исследования и перспективы . Madhav Books (P) Limited, подразделение Serials Publications. п. 38. ISBN 93-80615-34-5 .
- ^ Перейти обратно: а б с Зилка Н. и Новак М. (2006). Запутанная история Алоиса Альцгеймера. Братиславские медицинские письма , 107 (9–10), 343–345.
- ^ Перейти обратно: а б с д и ж г час Ян Х.Д., Ким Д.Х., Ли С.Б., Янг Л.Д. (декабрь 2016 г.). «История болезни Альцгеймера» . Деменция и нейрокогнитивные расстройства . 15 (4): 115–121. дои : 10.12779/день.2016.15.4.115 . ПМК 6428020 . ПМИД 30906352 .
- ^ Колата Г. (17 июня 2010 г.). «Испытания лекарств проверяют смелый план по замедлению болезни Альцгеймера» . Нью-Йорк Таймс . Архивировано из оригинала 9 апреля 2012 года . Проверено 17 июня 2010 г.
- ^ Кацман Р. (апрель 1976 г.). «Редакционная статья: Распространенность и злокачественность болезни Альцгеймера. Главный убийца». Архив неврологии . 33 (4): 217–218. дои : 10.1001/archneur.1976.00500040001001 . ПМИД 1259639 .
- ^ «Распространенность по полу в Великобритании» . Центр статистики деменции . Проверено 4 октября 2021 г.
- ^ «Болезнь Альцгеймера – Симптомы и причины» . Клиника Мэйо . Проверено 1 октября 2021 г.
- ^ «Что такое деменция?» . Ассоциация Альцгеймера . Проверено 6 августа 2018 г.
Деменцию часто ошибочно называют «старческим слабоумием» или «старческим слабоумием», что отражает ранее широко распространенное, но неверное убеждение, что серьезное снижение умственных способностей является нормальной частью старения.
- ^ Тейлор, округ Колумбия. «Деменция» . МедицинаНет . Проверено 6 августа 2018 г.
Старческое слабоумие («старость») — термин, который когда-то использовался для описания всех видов деменции; этот термин больше не используется в качестве диагноза.
- ^ «Здорово» . Здорово . Проверено 13 декабря 2020 г.
- ^ «Связь между шизофренией и деменцией» . Психология сегодня . Проверено 13 декабря 2020 г.
- ^ Бродати Х., Донкин М. (29 апреля 2017 г.). «Семейные сиделки за людьми с деменцией» . Диалоги в клинической неврологии . 11 (2): 217–228. doi : 10.31887/DCNS.2009.11.2/hbrodaty . ПМК 3181916 . ПМИД 19585957 .
- ^ «Большинство людей, ухаживающих за родственниками, страдающими деменцией, испытывают одиночество» . Доказательства NIHR (резюме на простом английском языке). 22 июля 2020 г. doi : 10.3310/alert_40575 . S2CID 243269845 .
- ^ Виктор Ч.Р., Риппон И., Куинн С., Нелис С.М., Мартир А., Харт Н. и др. (июль 2021 г.). «Распространенность и предикторы одиночества у лиц, осуществляющих уход за людьми с деменцией: результаты программы IDEAL» . Старение и психическое здоровье . 25 (7): 1232–1238. дои : 10.1080/13607863.2020.1753014 . hdl : 10454/17813 . ПМИД 32306759 . S2CID 216028843 .
- ^ Цзя Дж., Вэй С., Чен С., Ли Ф., Тан Ю., Цинь В. и др. (апрель 2018 г.). «Цена болезни Альцгеймера в Китае и переоценка затрат во всем мире». Болезнь Альцгеймера и деменция . 14 (4): 483–491. дои : 10.1016/j.jalz.2017.12.006 . ПМИД 29433981 . S2CID 46762069 .
- ^ «Национальные планы и планы действий по борьбе с болезнью Альцгеймера и деменции (PDF)» (PDF) . Лондон: Международная организация по борьбе с болезнью Альцгеймера. Апрель 2012 г. Архивировано из оригинала (PDF) 18 мая 2012 г. . Проверено 3 декабря 2012 г.
- ^ «Борьба с болезнью Альцгеймера и другими видами деменции: сводный документ национальной стратегии Израиля Междисциплинарной межорганизационной группы экспертов » Брукдейл» . Брукдейл . Проверено 4 июня 2018 г.
- ^ Бозли С. (26 марта 2012 г.). «К 2015 году финансирование исследований деменции увеличится более чем вдвое и составит 66 миллионов фунтов стерлингов» . Хранитель . Лондон. ISSN 0261-3077 . OCLC 60623878 . Архивировано из оригинала 20 октября 2013 года . Проверено 27 апреля 2012 г.
- ^ О'Дауд А. (июль 2017 г.). «Слабоумие в настоящее время является основной причиной смертности женщин в Англии». БМЖ . 358 : j3445. дои : 10.1136/bmj.j3445 . ПМИД 28710087 . S2CID 29011449 . ПроКвест 1919058612 .
- ^ «Британские больницы перестраиваются для людей с деменцией» . Экономист . Проверено 17 сентября 2018 г.
- ^ «Водители с деменцией — растущая проблема, — предупреждают врачи» . Новости CBC, Канада. 19 сентября 2007 г. Архивировано из оригинала 2 октября 2007 г.
- ^ Томпсон С.Б. (2009). «Завещательная способность и когнитивная реабилитация: последствия для людей с травмами головы и неврологическими нарушениями». Журнал когнитивной реабилитации . 27 : 11–13. Также опубликовано в: Томпсон С. (сентябрь 2010 г.). «Завещательная способность и когнитивная реабилитация: последствия для людей с травмами головы и неврологическими нарушениями» . Расширение знаний в области клинической оценки деменции (Диссертация). стр. 372–381.
- ^ «Борьба с деменцией» . Журнал «Благотворительность» . Зима 2016. Архивировано из оригинала 11 февраля 2016 года.
- ^ Гарви М. (22 октября 2020 г.). «Что происходит, когда TikTok ищет вызов авангарду?» . ЭНЕРГЕТИЧЕСКИЙ ЯДЕРНЫЙ РЕАКТОР . Архивировано из оригинала 22 октября 2020 года . Проверено 6 апреля 2021 г.
- ^ Эзра М. (23 октября 2020 г.). «Почему подростки TikTok слушают альбом о слабоумии?» . Нью-Йорк Таймс . Архивировано из оригинала 23 октября 2020 года . Проверено 21 апреля 2021 г.
- ^ «Пол Харви: Композитор, страдающий слабоумием, вдохновил на пожертвование в 1 миллион фунтов стерлингов» . Новости Би-би-си . 2 ноября 2020 г. . Проверено 2 ноября 2020 г.
- ^ «Чемпионы знаменитостей Ассоциации Альцгеймера» . Ассоциация Альцгеймера . Проверено 19 июля 2024 г.
{{cite web}}: CS1 maint: статус URL ( ссылка ) - ^ «Заявление семьи Уиллис | AFTD» . 13 февраля 2023 г. . Проверено 19 июля 2024 г.
- ^ Роджерс К. (1 июля 2022 г.). «Что вдова Робина Уильямса хочет, чтобы вы знали о будущем деменции с тельцами Леви» . CNN . Проверено 19 июля 2024 г.
- ^ «Доктор: Роза Паркс страдает слабоумием» . НБК . 22 сентября 2004 г.
- ^ «Письмо Рейгана с объявлением о его диагнозе болезни Альцгеймера» . Рональд Рейган . Проверено 19 июля 2024 г.
- ^ «Что нужно знать о проблемах со здоровьем Тони Беннета, от болезни Альцгеймера до зависимости» . СЕГОДНЯ.com . 21 июля 2023 г. . Проверено 19 июля 2024 г.
- ^ «Морин Макговерн о жизни с болезнью Альцгеймера: «Вы идете один день за раз» » . Peoplemag . Проверено 19 июля 2024 г.
Внешние ссылки
[ редактировать ]- Деменция в Керли
- «Список результатов: PM 32016328: EBSCOhost» . web.s.ebscohost.com . Проверено 3 октября 2022 г.
- Ассоциация Альцгеймера
- Национальный институт старения – болезнь Альцгеймера