Сексуальный диморфизм

| Часть серии на |
| Секс |
|---|
 |
| Biological terms |
| Sexual reproduction |
| Sexuality |
| Sexual system |
Сексуальный диморфизм - это состояние, при котором полов одного и того же вида демонстрируют разные морфологические характеристики, включая характеристики, не связанные с непосредственно в воспроизведении . [ 1 ] Состояние происходит у большинства диологических видов, которые состоят из большинства животных и некоторых растений. Различия могут включать вторичные половые характеристики , размер, вес, цвет, маркировку или поведенческие или когнитивные признаки. Репродуктивная конкуренция мужского мужского мужчины развила разнообразные сексуально диморфные черты. Агрессивные признаки коммунальных услуг, такие как «боевые» зубы и тупые головы, усиленные в качестве избиения баранов, используются в качестве оружия в агрессивных взаимодействиях между соперниками. Пассивные дисплеи, такие как декоративное перья или вызов песен, также развивались в основном благодаря сексуальному отбору. [ 2 ] Эти различия могут быть тонкими или преувеличенными и могут быть подвергнуты сексуальному отбору и естественному отбору . Противоположностью диморфизма является мономорфизм , когда оба биологических полов фенотипически неотличимы друг от друга. [ 3 ]
Overview
[edit]

Ornamentation and coloration
[edit]
Common and easily identified types of dimorphism consist of ornamentation and coloration, though not always apparent. A difference in the coloration of sexes within a given species is called sexual dichromatism, commonly seen in many species of birds and reptiles.[4] Sexual selection leads to exaggerated dimorphic traits that are used predominantly in competition over mates.[5] The increased fitness resulting from ornamentation offsets its cost to produce or maintain, suggesting complex evolutionary implications, but the costs and evolutionary implications vary from species to species.[6]
The peafowl constitute conspicuous illustrations of the principle. The ornate plumage of peacocks, as used in the courting display, attracts peahens. At first sight, one might mistake peacocks and peahens for completely different species because of the vibrant colours and the sheer size of the male's plumage; the peahen is of a subdued brown coloration.[7] The plumage of the peacock increases its vulnerability to predators because it is a hindrance in flight, and it renders the bird conspicuous in general.[7] Similar examples are manifold, such as in birds of paradise[8] and argus pheasants.[citation needed]
Another example of sexual dichromatism is that of nestling blue tits. Males are chromatically more yellow than females. It is believed that this is obtained by the ingestion of green Lepidopteran larvae, which contain large amounts of the carotenoids lutein and zeaxanthin.[9] This diet also affects the sexually dimorphic colours in the human-invisible ultraviolet spectrum.[10][11] Hence, the male birds, although appearing yellow to humans, actually have a violet-tinted plumage that is seen by females. This plumage is thought to be an indicator of male parental abilities.[12] Perhaps this is a good indicator for females because it shows that they are good at obtaining a food supply from which the carotenoid is obtained. There is a positive correlation between the chromas of the tail and breast feathers and body condition.[13] Carotenoids play an important role in immune function for many animals, so carotenoid dependent signals might indicate health.[14]
Frogs constitute another conspicuous illustration of the principle. There are two types of dichromatism for frog species: ontogenetic and dynamic. Ontogenetic frogs are more common and have permanent color changes in males or females. Ranoidea lesueuri is an example of a dynamic frog with temporary color changes in males during the breeding season.[15] Hyperolius ocellatus is an ontogenetic frog with dramatic differences in both color and pattern between the sexes. At sexual maturity, the males display a bright green with white dorsolateral lines.[16] In contrast, the females are rusty red to silver with small spots. The bright coloration in the male population attracts females and is an aposematic sign to potential predators.
Females often show a preference for exaggerated male secondary sexual characteristics in mate selection.[17] The sexy son hypothesis explains that females prefer more elaborate males and select against males that are dull in color, independent of the species' vision.[18]
Similar sexual dimorphism and mating choice are also observed in many fish species. For example, male guppies have colorful spots and ornamentations, while females are generally grey. Female guppies prefer brightly colored males to duller males.[19][page needed]
In redlip blennies, only the male fish develops an organ at the anal-urogenital region that produces antimicrobial substances. During parental care, males rub their anal-urogenital regions over their nests' internal surfaces, thereby protecting their eggs from microbial infections, one of the most common causes for mortality in young fish.[20]
Plants
[edit]Most flowering plants are hermaphroditic but approximately 6% of species have separate males and females (dioecy).[21] Sexual dimorphism is common in dioecious plants[22]: 403 and dioicous species.[23]: 71
Males and females in insect-pollinated species generally look similar to one another because plants provide rewards (e.g. nectar) that encourage pollinators to visit another similar flower, completing pollination. Catasetum orchids are one interesting exception to this rule. Male Catasetum orchids violently attach pollinia to euglossine bee pollinators. The bees will then avoid other male flowers but may visit the female, which looks different from the males.[24]
Various other dioecious exceptions, such as Loxostylis alata have visibly different sexes, with the effect of eliciting the most efficient behavior from pollinators, who then use the most efficient strategy in visiting each gender of flower instead of searching, say, for pollen in a nectar-bearing female flower.[citation needed]
Some plants, such as some species of Geranium have what amounts to serial sexual dimorphism. The flowers of such species might, for example, present their anthers on opening, then shed the exhausted anthers after a day or two and perhaps change their colours as well while the pistil matures; specialist pollinators are very much inclined to concentrate on the exact appearance of the flowers they serve, which saves their time and effort and serves the interests of the plant accordingly. Some such plants go even further and change their appearance once fertilized, thereby discouraging further visits from pollinators. This is advantageous to both parties because it avoids damaging the developing fruit and wasting the pollinator's effort on unrewarding visits. In effect, the strategy ensures that pollinators can expect a reward every time they visit an appropriately advertising flower.[citation needed]
Females of the aquatic plant Vallisneria americana have floating flowers attached by a long flower stalk that are fertilized if they contact one of the thousands of free-floating flowers released by a male.[25][better source needed] Sexual dimorphism is most often associated with wind-pollination in plants due to selection for efficient pollen dispersal in males vs pollen capture in females, e.g. Leucadendron rubrum.[26]
Sexual dimorphism in plants can also be dependent on reproductive development. This can be seen in Cannabis sativa, a type of hemp, which have higher photosynthesis rates in males while growing but higher rates in females once the plants become sexually mature.[27]
Every sexually reproducing extant species of the vascular plant has an alternation of generations; the plants we see about us generally are diploid sporophytes, but their offspring are not the seeds that people commonly recognize as the new generation. The seed actually is the offspring of the haploid generation of microgametophytes (pollen) and megagametophytes (the embryo sacs in the ovules). Each pollen grain accordingly may be seen as a male plant in its own right; it produces a sperm cell and is dramatically different from the female plant, the megagametophyte that produces the female gamete.[citation needed]
Insects
[edit]
Insects display a wide variety of sexual dimorphism between taxa including size, ornamentation and coloration.[28] The female-biased sexual size dimorphism observed in many taxa evolved despite intense male-male competition for mates.[29] In Osmia rufa, for example, the female is larger/broader than males, with males being 8–10 mm in size and females being 10–12 mm in size.[30] In the hackberry emperor females are similarly larger than males.[31] The reason for the sexual dimorphism is due to provision size mass, in which females consume more pollen than males.[32]
In some species, there is evidence of male dimorphism, but it appears to be for distinctions of roles. This is seen in the bee species Macrotera portalis in which there is a small-headed morph, capable of flight, and large-headed morph, incapable of flight, for males.[33] Anthidium manicatum also displays male-biased sexual dimorphism. The selection for larger size in males rather than females in this species may have resulted due to their aggressive territorial behavior and subsequent differential mating success.[34] Another example is Lasioglossum hemichalceum, which is a species of sweat bee that shows drastic physical dimorphisms between male offspring.[35] Not all dimorphism has to have a drastic difference between the sexes. Andrena agilissima is a mining bee where the females only have a slightly larger head than the males.[36]
Weaponry leads to increased fitness by increasing success in male–male competition in many insect species.[37] The beetle horns in Onthophagus taurus are enlarged growths of the head or thorax expressed only in the males. Copris ochus also has distinct sexual and male dimorphism in head horns.[38] Another beetle with a distinct horn-related sexual dimorphism is Allomyrina dichotoma, also known as the Japanese rhinoceros beetle.[39] These structures are impressive because of the exaggerated sizes.[40] There is a direct correlation between male horn lengths and body size and higher access to mates and fitness.[40] In other beetle species, both males and females may have ornamentation such as horns.[38] Generally, insect sexual size dimorphism (SSD) within species increases with body size.[41]
Sexual dimorphism within insects is also displayed by dichromatism. In butterfly genera Bicyclus and Junonia, dimorphic wing patterns evolved due to sex-limited expression, which mediates the intralocus sexual conflict and leads to increased fitness in males.[42] The sexual dichromatic nature of Bicyclus anynana is reflected by female selection on the basis of dorsal UV-reflective eyespot pupils.[43] The common brimstone also displays sexual dichromatism; males have yellow and iridescent wings, while female wings are white and non-iridescent.[44] Naturally selected deviation in protective female coloration is displayed in mimetic butterflies.[45]
Spiders and sexual cannibalism
[edit]

Many arachnid groups exhibit sexual dimorphism,[46] but it is most widely studied in the spiders. In the orb-weaving spider Zygiella x-notata, for example, adult females have a larger body size than adult males.[47] Size dimorphism shows a correlation with sexual cannibalism,[48] which is prominent in spiders (it is also found in insects such as praying mantises). In the size dimorphic wolf spider Tigrosa helluo, food-limited females cannibalize more frequently.[49] Therefore, there is a high risk of low fitness for males due to pre-copulatory cannibalism, which led to male selection of larger females for two reasons: higher fecundity and lower rates of cannibalism.[49] In addition, female fecundity is positively correlated with female body size and large female body size is selected for, which is seen in the family Araneidae. All Argiope species, including Argiope bruennichi, use this method. Some males evolved ornamentation[vague] including binding the female with silk, having proportionally longer legs, modifying the female's web, mating while the female is feeding, or providing a nuptial gift in response to sexual cannibalism.[49] Male body size is not under selection due to cannibalism in all spider species such as Nephila pilipes, but is more prominently selected for in less dimorphic species of spiders, which often selects for larger male size.[50] In the species Maratus volans, the males are known for their characteristic colorful fan which attracts the females during mating.[51]
Fish
[edit]Ray-finned fish are an ancient and diverse class, with the widest degree of sexual dimorphism of any animal class. Fairbairn notes that "females are generally larger than males but males are often larger in species with male–male combat or male paternal care ... [sizes range] from dwarf males to males more than 12 times heavier than females."[52][page needed]
There are cases where males are substantially larger than females. An example is Lamprologus callipterus, a type of cichlid fish. In this fish, the males are characterized as being up to 60 times larger than the females. The male's increased size is believed to be advantageous because males collect and defend empty snail shells in each of which a female breeds.[53] Males must be larger and more powerful in order to collect the largest shells. The female's body size must remain small because in order for her to breed, she must lay her eggs inside the empty shells. If she grows too large, she will not fit in the shells and will be unable to breed. The female's small body size is also likely beneficial to her chances of finding an unoccupied shell. Larger shells, although preferred by females, are often limited in availability.[54] Hence, the female is limited to the growth of the size of the shell and may actually change her growth rate according to shell size availability.[55] In other words, the male's ability to collect large shells depends on his size. The larger the male, the larger the shells he is able to collect. This then allows for females to be larger in his brooding nest which makes the difference between the sizes of the sexes less substantial. Male–male competition in this fish species also selects for large size in males. There is aggressive competition by males over territory and access to larger shells. Large males win fights and steal shells from competitors. Another example is the dragonet, in which males are considerably larger than females and possess longer fins.
Sexual dimorphism also occurs in hermaphroditic fish. These species are known as sequential hermaphrodites. In fish, reproductive histories often include the sex-change from female to male where there is a strong connection between growth, the sex of an individual, and the mating system within which it operates.[56] In protogynous mating systems where males dominate mating with many females, size plays a significant role in male reproductive success.[57] Males have a propensity to be larger than females of a comparable age but it is unclear whether the size increase is due to a growth spurt at the time of the sexual transition or due to the history of faster growth in sex changing individuals.[58] Larger males are able to stifle the growth of females and control environmental resources.[citation needed]
Social organization plays a large role in the changing of sex by the fish. It is often seen that a fish will change its sex when there is a lack of a dominant male within the social hierarchy. The females that change sex are often those who attain and preserve an initial size advantage early in life. In either case, females which change sex to males are larger and often prove to be a good example of dimorphism.
In other cases with fish, males will go through noticeable changes in body size, and females will go through morphological changes that can only be seen inside of the body. For example, in sockeye salmon, males develop larger body size at maturity, including an increase in body depth, hump height, and snout length. Females experience minor changes in snout length, but the most noticeable difference is the huge increase in gonad size, which accounts for about 25% of body mass.[59]
Sexual selection was observed for female ornamentation in Gobiusculus flavescens, known as two-spotted gobies.[60] Traditional hypotheses suggest that male–male competition drives selection. However, selection for ornamentation within this species suggests that showy female traits can be selected through either female–female competition or male mate choice.[60] Since carotenoid-based ornamentation suggests mate quality, female two-spotted guppies that develop colorful orange bellies during breeding season are considered favorable to males.[61] The males invest heavily in offspring during incubation, which leads to the sexual preference in colorful females due to higher egg quality.[61]
Amphibians and non-avian reptiles
[edit]
In amphibians and reptiles, the degree of sexual dimorphism varies widely among taxonomic groups. The sexual dimorphism in amphibians and reptiles may be reflected in any of the following: anatomy; relative length of tail; relative size of head; overall size as in many species of vipers and lizards; coloration as in many amphibians, snakes, and lizards, as well as in some turtles; an ornament as in many newts and lizards; the presence of specific sex-related behaviour is common to many lizards; and vocal qualities which are frequently observed in frogs.[citation needed]
Anole lizards show prominent size dimorphism with males typically being significantly larger than females. For instance, the average male Anolis sagrei was 53.4 mm vs. 40 mm in females.[62] Different sizes of the heads in anoles have been explained by differences in the estrogen pathway.[63] The sexual dimorphism in lizards is generally attributed to the effects of sexual selection, but other mechanisms including ecological divergence and fecundity selection provide alternative explanations.[64] The development of color dimorphism in lizards is induced by hormonal changes at the onset of sexual maturity, as seen in Psamodromus algirus, Sceloporus gadoviae, and S. undulates erythrocheilus.[64] Sexual dimorphism in size is also seen in frog species like P. bibronii.
Male painted dragon lizards, Ctenophorus pictus. are brightly conspicuous in their breeding coloration, but male colour declines with aging. Male coloration appears to reflect innate anti-oxidation capacity that protects against oxidative DNA damage.[65] Male breeding coloration is likely an indicator to females of the underlying level of oxidative DNA damage (a significant component of aging) in potential mates.[65]
Birds
[edit]




Possible mechanisms have been proposed to explain macroevolution of sexual size dimorphism in birds. These include sexual selection, selection for fecundity in females, niche divergence between the sexes, and allometry, but their relative importance is still not fully understood .[66][67] Sexual dimorphism in birds can be manifested in size or plumage differences between the sexes. Sexual size dimorphism varies among taxa, with males typically being larger, though this is not always the case, e.g. birds of prey, hummingbirds, and some species of flightless birds.[68][69] Plumage dimorphism, in the form of ornamentation or coloration, also varies, though males are typically the more ornamented or brightly colored sex.[70] Such differences have been attributed to the unequal reproductive contributions of the sexes.[71] This difference produces a stronger female choice since they have more risk in producing offspring. In some species, the male's contribution to reproduction ends at copulation, while in other species the male becomes the main (or only) caregiver. Plumage polymorphisms have evolved to reflect these differences and other measures of reproductive fitness, such as body condition[72] or survival.[73] The male phenotype sends signals to females who then choose the 'fittest' available male.
Sexual dimorphism is a product of both genetics and environmental factors. An example of sexual polymorphism determined by environmental conditions exists in the red-backed fairywren. Red-backed fairywren males can be classified into three categories during breeding season: black breeders, brown breeders, and brown auxiliaries.[72] These differences arise in response to the bird's body condition: if they are healthy they will produce more androgens thus becoming black breeders, while less healthy birds produce less androgens and become brown auxiliaries.[72] The reproductive success of the male is thus determined by his success during each year's non-breeding season, causing reproductive success to vary with each year's environmental conditions.
Migratory patterns and behaviors also influence sexual dimorphisms. This aspect also stems back to size dimorphism in species. It has been shown that the larger males are better at coping with the difficulties of migration and thus are more successful in reproducing when reaching the breeding destination.[74] When viewing this from an evolutionary standpoint, many theories and explanations come into consideration. If these are the result for every migration and breeding season, the expected results should be a shift towards a larger male population through sexual selection. Sexual selection is strong when the factor of environmental selection is also introduced. Environmental selection may support a smaller chick size if those chicks were born in an area that allowed them to grow to a larger size, even though under normal conditions they would not be able to reach this optimal size for migration. When the environment gives advantages and disadvantages of this sort, the strength of selection is weakened and the environmental forces are given greater morphological weight. The sexual dimorphism could also produce a change in timing of migration leading to differences in mating success within the bird population.[75] When the dimorphism produces that large of a variation between the sexes and between the members of the sexes, multiple evolutionary effects can take place. This timing could even lead to a speciation phenomenon if the variation becomes strongly drastic and favorable towards two different outcomes. Sexual dimorphism is maintained by the counteracting pressures of natural selection and sexual selection. For example, sexual dimorphism in coloration increases the vulnerability of bird species to predation by European sparrowhawks in Denmark.[76] Presumably, increased sexual dimorphism means males are brighter and more conspicuous, leading to increased predation.[76] Moreover, the production of more exaggerated ornaments in males may come at the cost of suppressed immune function.[72] So long as the reproductive benefits of the trait due to sexual selection are greater than the costs imposed by natural selection, then the trait will propagate throughout the population. Reproductive benefits arise in the form of a larger number of offspring, while natural selection imposes costs in the form of reduced survival. This means that even if the trait causes males to die earlier, the trait is still beneficial so long as males with the trait produce more offspring than males lacking the trait. This balance keeps dimorphism alive in these species and ensures that the next generation of successful males will also display these traits that are attractive to females.
Such differences in form and reproductive roles often cause differences in behavior. As previously stated, males and females often have different roles in reproduction. The courtship and mating behavior of males and females are regulated largely by hormones throughout a bird's lifetime.[77] Activational hormones occur during puberty and adulthood and serve to 'activate' certain behaviors when appropriate, such as territoriality during breeding season.[77] Organizational hormones occur only during a critical period early in development, either just before or just after hatching in most birds, and determine patterns of behavior for the rest of the bird's life.[77] Such behavioral differences can cause disproportionate sensitivities to anthropogenic pressures.[78] Females of the whinchat in Switzerland breed in intensely managed grasslands.[78] Earlier harvesting of the grasses during the breeding season lead to more female deaths.[78] Populations of many birds are often male-skewed and when sexual differences in behavior increase this ratio, populations decline at a more rapid rate.[78] Also not all male dimorphic traits are due to hormones like testosterone, instead they are a naturally occurring part of development, for example plumage.[79] In addition, the strong hormonal influence on phenotypic differences suggests that the genetic mechanism and genetic basis of these sexually dimorphic traits may involve transcription factors or cofactors rather than regulatory sequences.[80]
Sexual dimorphism may also influence differences in parental investment during times of food scarcity. For example, in the blue-footed booby, the female chicks grow faster than the males, resulting in booby parents producing the smaller sex, the males, during times of food shortage. This then results in the maximization of parental lifetime reproductive success.[81] In Black-tailed Godwits Limosa limosa limosa females are also the larger sex, and the growth rates of female chicks are more susceptible to limited environmental conditions.[82]
Sexual dimorphism may also only appear during mating season; some species of birds only show dimorphic traits in seasonal variation. The males of these species will molt into a less bright or less exaggerated color during the off-breeding season.[80] This occurs because the species is more focused on survival than on reproduction, causing a shift into a less ornate state. [dubious – discuss]
Consequently, sexual dimorphism has important ramifications for conservation. However, sexual dimorphism is not only found in birds and is thus important to the conservation of many animals. Such differences in form and behavior can lead to sexual segregation, defined as sex differences in space and resource use.[83] Most sexual segregation research has been done on ungulates,[83] but such research extends to bats,[84] kangaroos,[85] and birds.[86] Sex-specific conservation plans have even been suggested for species with pronounced sexual segregation.[84]
The term sesquimorphism (the Latin numeral prefix sesqui- means one-and-one-half, so halfway between mono- (one) and di- (two)) has been proposed for bird species in which "both sexes have basically the same plumage pattern, though the female is clearly distinguishable by reason of her paler or washed-out colour".[87]: 14 Examples include Cape sparrow (Passer melanurus),[87]: 67 rufous sparrow (subspecies P. motinensis motinensis),[87]: 80 and saxaul sparrow (P. ammodendri).[87]: 245
Non-avian dinosaurs
[edit]Examining fossils of non-avian dinosaurs in search of sexually dimorphic characteristics requires the supply of complete and articulated skeletal and tissue remains. As terrestrial organisms, dinosaur carcasses are subject to ecological and geographical influence that inevitably constitutes the degree of preservation. The availability of well-preserved remains is not a probable outcome as a consequence of decomposition and fossilization. Some paleontologists have looked for sexual dimorphism among dinosaurs using statistics and comparison to ecologically or phylogenetically related modern animals.
Apatosaurus and Diplodocus
Female Apatosaurus and Diplodocus had interconnected caudal vertebrae that allowed them to keep their tails elevated to aid in copulation. Discovering that this fusion occurred in only 50% of Apatosaurus and Diplodocus skeletons and 25% of Camarasaurus skeletons indicated that this is a sexually dimorphic trait.
Theropoda
It has been hypothesized that male theropods possessed a retractable penis, a feature similar to modern day crocodilians. Crocodilian skeletons were examined to determine whether there is a skeletal component that is distinctive between both sexes, to help provide an insight on the physical disparities between male and female theropods. Findings revealed the caudal chevrons of male crocodiles, used to anchor the penis muscles, were significantly larger than those of females. There have been criticisms of these findings, but it remains a subject of debate among advocates and adversaries.[citation needed]
Ornithopoda
Исследования сексуального диморфизма у адрозавров , как правило, сосредоточены на характерных черепных гребнях , которые, вероятно, обеспечивали функцию в сексуальном дисплее. Биометрическое исследование 36 черепов обнаружило, что половой диморфизм был продемонстрирован в гребне 3 видов хадрозавридов. Гребники могут быть классифицированы как полные (мужские) или узкие (женские) и могли дать некоторое преимущество в интрасексуальном соревнованиях по спариванию.
Сератеры
По словам Скотта Д. Сэмпсона, если бы Ceratopsids проявил половой диморфизм, современные экологические аналоги предполагают, что он будет обнаружен в демонстрационных структурах, таких как рога и изличие. Никаких убедительных доказательств сексуального диморфизма в размере тела или символов спаривания не известно в Ceratopsids, хотя есть доказательства того, что более примитивные цератопсийские протокератопы Эндрюси обладали полами, которые были различимы на основе размера фрила и носового признания. Это согласуется с другими известными тетраподными группами, где животные среднего размера, как правило, демонстрируют заметно более половой диморфизм, чем более крупные. Тем не менее, было предложено, чтобы эти различия могли быть лучше объяснены внутривидовым и онтогенным изменением, а не половым диморфизмом. [ 88 ] Кроме того, многие сексуальные диморфные признаки, которые могли существовать в цератопсах, включают вариации мягких тканей, такие как окраска или росы , которые вряд ли будут сохранены в ископаемом отчете.
Стегозавры
Исследование, проведенное в 2015 году по образцам Hesperosaurus mjosi, обнаружило доказательства сексуального диморфизма в форме дермальных пластин. Были описаны два морфы тарелки: одно было коротким, шириной и овальной формой, другой выше и уже. [ 89 ] [ 90 ]
Млекопитающие
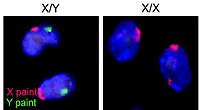
[ редактировать ]У большой части видов млекопитающих мужчины больше, чем женщины. Как гены , так и гормоны влияют на формирование многих животных мозгов до « рождения » (или вылупления ), а также поведения взрослых людей. Гормоны значительно влияют на образование мозга человека, а также на развитие мозга в период полового созревания. Обзор в 2004 году в природе обзор Neuroscience наблюдал, что «поскольку« поскольку легче манипулировать уровнем гормонов, чем экспрессия генов половых хромосом, эффекты гормонов изучались гораздо более широко и гораздо лучше поняты, чем прямые действия в мозге генов сексуальной хромосом ". Он пришел к выводу, что, хотя «дифференцирующие эффекты секреции гонад кажутся доминирующими,« существующий объем исследований »подтверждает идею о том, что половые различия в нейронной экспрессии генов X и Y значительно способствуют половым различиям в функциях мозга и болезнях». [ 91 ]
Выносливые
[ редактировать ]
Морские млекопитающие показывают некоторые из величайших различий в сексуальном размере у млекопитающих из -за сексуального отбора и факторов окружающей среды, таких как местоположение размножения. [ 92 ] Система спаривания выносливов варьируется от многоженства до последовательной моногамии . Выпечны известны ранним дифференциальным ростом и материнскими инвестициями, поскольку единственными питательными веществами для новорожденных щенков является молоко, обеспечиваемое матери. [ 93 ] Например, мужчины значительно больше (примерно на 10% тяжелее и на 2% длиннее), чем женщины при рождении у щенков морских львов. [ 94 ] Схема дифференциальных инвестиций может варьироваться в основном пренатально и пост-натально. [ 95 ] Мираунга Леонина , южный слон Печать , является одним из самых диморфных млекопитающих. [ 96 ]
Приматы
[ редактировать ]Люди
[ редактировать ] | |
 |
 |
|
Вверху: стилизованная иллюстрация людей на пионерской табличке , показывающая как мужской (слева, и женский (справа).
| |
По словам Кларка Спенсера Ларсена, современные Homo Sapiens демонстрируют ряд сексуального диморфизма, причем средняя масса тела между полами различается примерно на 15%. [ 97 ] Существенное обсуждение в академической литературе учитывает потенциальные эволюционные преимущества, связанные с сексуальной конкуренцией (как внутрисексуальной, так и межсексуальной), а также краткосрочные и долгосрочные сексуальные стратегии. [ 98 ] По словам Дейли и Уилсона, «полы больше различаются у людей, чем у моногамных млекопитающих, но гораздо меньше, чем у чрезвычайно полигамных млекопитающих». [ 99 ]
Средний базальный уровень метаболизма примерно на 6 процентов у подростков выше, чем у женщин, и увеличивается примерно на 10 процентов выше после полового созревания. Женщины, как правило, превращают больше пищи в жир , в то время как мужчины превращаются в мышечные и расходуемые энергетические запасы циркулирующих. По словам Тима Хьюитта, директора по исследованиям в Департаменте спортивной медицины в Медицинском центре Университета штата Огайо Уэкснер , у женщин в среднем 50–60% мужчин и 80-90% силы нижней части тела мужчин, относительно размера тела, но женщины имеют более высокую выносливость , чем мужчины. [ 100 ]
Разница в силе относительно массы тела менее выражена у обученных людей. В олимпийской тяжелой атлетике, мужские записи варьируются от 5,5 × массы тела в категории с самым низким весом до 4,2 × в категории с самым высоким весом, в то время как записи женщин варьируются от 4,4 × до 3,8 ×, разница с поправкой на вес составляет всего 10–20%, и и только 10–20%и Абсолютная разница около 30% (т. Е. 492 кг против 348 кг для неограниченных весовых категорий; см. Олимпийские записи о тяжелой атлетике ). Исследование, проведенное путем анализа ежегодных мировых рейтингов с 1980 по 1996 год, показало, что время бега мужчин было в среднем на 10% быстрее, чем женщины ». [ 101 ]
В раннем подростковом возрасте женщины в среднем выше, чем мужчины (поскольку женщины, как правило, проходят половое созревание раньше ), но мужчины в среднем превосходят их по высоте в более позднем подростковом и взрослой жизни. В Соединенных Штатах взрослые мужчины в среднем на 9% выше [ 102 ] и 16,5% тяжелее [ 103 ] чем взрослые женщины.
Мужчины обычно имеют большие трахей и разветвления бронхов , примерно на 30 процентов больший объем легких на массу тела . В среднем, у мужчин больше сердца , на 10 процентов выше количества эритроцитов , более высокий гемоглобин , следовательно, большую кислородную способность. Они также имеют более высокие коэффициенты свертывания циркуляции ( витамин К , про -тромбин и тромбоциты ). Эти различия приводят к более быстрому заживлению ран и снижению чувствительности к нервной боли после травмы. [ 104 ] У мужчин, вызывающее боль в периферическом нерве происходит через микроглию , в то время как у женщин это происходит через Т-клетки (за исключением беременных женщин, которые следуют мужской схеме). [ 105 ]
У самок обычно больше лейкоцитов (хранящихся и циркулирующих), а также больше гранулоцитов и В и Т -лимфоцитов . Кроме того, они производят больше антител более высокой скоростью, чем у мужчин, поэтому у них развивается меньше инфекционных заболеваний и поддается более коротким периодам. [ 104 ] Этологи утверждают, что женщины, взаимодействующие с другими женщинами и множественные потомства в социальных группах, испытывают такие черты, как селективное преимущество. [ 106 ] [ 107 ] [ 108 ] [ 109 ] [ 110 ] [ чрезмерные цитаты ] Самки обладают более высокой чувствительностью к боли из -за вышеупомянутых различий в нерве, которые увеличивают ощущение, и, таким образом, женщины требуют более высоких уровней обезболивающих после травмы. [ 105 ] Гормональные изменения у женщин влияют на чувствительность к боли, а беременные женщины обладают такой же чувствительностью, что и мужчины. Острая терпимость к боли также более последователен в течение всей жизни у женщин, чем у мужчин, несмотря на эти гормональные изменения. [ 111 ] Несмотря на различия в физическом чувстве, оба пола имеют сходную психологическую терпимость к (или способности справляться и игнорировать) боль. [ 112 ]
В человеческом мозге разница между полами наблюдалась в транскрипции пары генов PCDH11X /Y, уникальной для Homo Sapiens . [ 113 ] Сексуальная дифференциация в человеческом мозге из недифференцированного состояния вызвана тестостероном из яичка плода. Тестостерон превращается в эстроген в мозге посредством действия фермента ароматазы. Тестостерон действует на многих областях мозга, включая SDN-POA , чтобы создать мужской схему мозга. [ 114 ] Мозг беременных женщин, несущих мужские плоды, могут быть защищены от мужского воздействия андрогена за счет действия связующего полового гормона, связывающего глобулин . [ 115 ]
Взаимосвязь между половыми различиями в мозге и человеческим поведением является предметом противоречий в психологии и обществе в целом. [ 116 ] [ 117 ] Многие женщины, как правило, имеют более высокое соотношение серого вещества в левом полушарии мозга по сравнению с мужчинами. [ 118 ] [ 119 ] Мужчины в среднем имеют больший мозг, чем женщины; Однако при корректировке общего объема мозга различия в сером веществе между полами практически отсутствуют. Таким образом, процент серого вещества, по -видимому, больше связано с размером мозга, чем с сексом. [ 120 ] [ 121 ] Различия в физиологии мозга между полами не обязательно связаны с различиями в интеллекте. Haier et al. В исследовании 2004 года «мужчины и женщины, по -видимому, достигают сходных результатов IQ с различными областями мозга, что позволяет предположить, что нет единой, лежащей в основе нейроанатомической структуры в общем интеллекте и что различные типы конструкций мозга могут проявлять эквивалентную интеллектуальную эффективность». [ 122 ] (См. Статью о сексе и интеллекте для получения дополнительной информации по этому вопросу.) Выявленные строгие теоретические графические теоретические анализа связей человеческого мозга [ 123 ] Это в многочисленных теоретических параметрах (например, минимальная ширина двухпоставления, номер края, свойство с графом расширителя , минимальная крышка вершины ), структурный развязки женщин значительно «лучше» подключен, чем соединение мужчин. Это было показано [ 124 ] что теоретические различия графа связаны с полом, а не с различиями в объеме головного мозга путем анализа данных 36 женщин и 36 мужчин, где объем мозга каждого человека в группе был меньше объема мозга каждого женщина в группе.
Сексуальный диморфизм также был описан на уровне генов и показано, что он простирается от половых хромосом. В целом, было обнаружено, что около 6500 генов обладают сексуальной дифференциальной экспрессией по крайней мере в одной ткани. Многие из этих генов напрямую связаны с воспроизводством, а скорее связаны с более общими биологическими особенностями. Кроме того, было показано, что гены с пола-специфической экспрессией подвергаются снижению эффективности отбора, что приводит к более высоким частотам популяции вредных мутаций и способствует распространенности нескольких заболеваний человека. [ 125 ] [ 126 ]
Иммунная функция
[ редактировать ]Сексуальный диморфизм в иммунной функции является общей схемой у позвоночных, а также в ряде беспозвоночных. Чаще всего женщины более «иммунокомпетентны», чем мужчины. Эта черта не является согласованной среди всех животных, но отличается в зависимости от таксономии, причем у насекомых обнаруживается наибольшая иммунная система, представленная на жене. [ 127 ] У млекопитающих это приводит к более частым и тяжелым инфекциям у мужчин и более высоким показателям аутоиммунных расстройств у женщин. Одной из потенциальных причин могут быть различия в экспрессии генов иммунных клеток между полами. [ 128 ] Другое объяснение заключается в том, что эндокринологические различия между полами влияют на иммунную систему - например, тестостерон действует как иммунодепрессивный агент. [ 129 ]
Ячейки
[ редактировать ]Фенотипические различия между полами очевидны даже в культивируемых клетках из тканей. [ 130 ] Например, женские стволовые клетки, полученные из мышц , имеют лучшую эффективность регенерации мышц, чем мужские. [ 131 ] Есть сообщения о нескольких метаболических различиях между мужскими и женскими клетками [ 132 ] И они также реагируют на стресс по -разному. [ 133 ]
Репродуктивно выгодно
[ редактировать ]Теоретически, более крупные самки предпочитают конкуренцию за товарищей, особенно у полигамных видов. Более крупные женщины предлагают преимущество в фертильности, поскольку физиологические требования размножения ограничиваются у женщин. Следовательно, существует теоретическое ожидание того, что женщины, как правило, более крупны по видам, которые являются моногамными. Женщины больше во многих видах насекомых , многих пауков , многих рыб , многих рептилий, сов , хищных птиц и некоторых млекопитающих, таких как пятнистая гиена , и киты, такие как голубые киты . Например, у некоторых видов женщины сидячими, и поэтому мужчины должны искать их. Фриц Воллрат и Джефф Паркер утверждают, что эта разница в поведении приводит к радикально различным давлениям отбора на двух полов, очевидно, предпочитая меньших мужчин. [ 134 ] Случаи, когда мужчина больше, чем самка, также изучались, [ 134 ] и требуют альтернативных объяснений.
Одним из примеров такого типа диморфизма сексуального размера является миотис Bat Myotis Nigricans (Black Myotis Bat), где женщины значительно больше, чем мужчины с точки зрения массы тела, измерения черепа и длины предплечья. [ 135 ] Взаимодействие между полами и энергией, необходимой для производства жизнеспособного потомства, делает его благоприятным для женщин больше в этом виде. Женщины несут энергетическую стоимость производства яиц, что намного больше, чем стоимость изготовления спермы у мужчин. Гипотеза о преимуществах плодовитости гласит, что более крупная женщина может производить больше потомства и давать им более благоприятные условия для обеспечения их выживания; Это верно для большинства эктотерм. Большая женщина может обеспечить родительскую помощь в течение более длительного времени, пока потомство созревает. Периоды беременности и лактации довольно длинные у М. Нигриканов , женщины сосут свое потомство, пока не достигнут почти взрослого размера. [ 136 ] Они не смогут летать и ловить добычу, если в это время не компенсируют дополнительную массу потомства. Меньший размер мужского пола может быть адаптацией для повышения маневренности и ловкости, позволяя мужчинам лучше конкурировать с женщинами за продукты питания и другие ресурсы.

Некоторые виды рыболовов также демонстрируют чрезвычайный половой диморфизм. Женщины более типичны по внешнему виду для других рыб, тогда как мужчины являются крошечными рудиментарными существами с замедленными пищеварительными системами. Мужчина должен найти с ней женщину и слиться с ней: он затем живет паразитически, становясь чуть больше, чем телом, производящего спермы, в том, что составляет эффективно гермафродитный композитный организм. Аналогичная ситуация обнаруживается в Zeus Water Bug PhoreTicoVelia Disparata , где у самой железистой области на спине, которая может служить для кормления мужчины, что цепляется за нее (хотя мужчины могут выжить от женщин, они, как правило ) [ 137 ] Это доведено до логической крайности у ризоцефальских ракообразных, таких как Саккулина , где мужчина вводит себя в тело женщины и становится не чем иным, как клетки, продуцирующие сперму, до такой степени, что супер -заказ принимал за гермафродитическую. [ 138 ]
Некоторые виды растений также демонстрируют диморфизм, в котором самки значительно больше, чем у мужчин, например, в мохе дикранум [ 139 ] и печеночный Sphaerocarpos . [ 140 ] Есть некоторые доказательства того, что в этих родах диморфизм может быть связан с сексуальной хромосомой, [ 140 ] [ 141 ] или химическую передачу сигналов от женщин. [ 142 ]
Еще один сложный пример сексуального диморфизма - в Vespula Squamosa , южной желтой рубеже. У этого вида Wasp работники являются самыми маленькими, мужские работники немного больше, а женские королевы значительно больше, чем ее работники, и мужские коллеги. [ Цитация необходима ]
Эволюция
[ редактировать ]
В 1871 году Чарльз Дарвин выдвинул теорию сексуального отбора , которая связывала половой диморфизм с сексуальным отбором . [ 144 ]
Первым шагом к сексуальному диморфизму является размер дифференциация сперматозоидов и яиц ( анизогамия ). [ 145 ] [ 146 ] [ 147 ] [ 148 ] : 917 Анизогамия и обычно большое количество небольших мужских гамет по сравнению с более крупными женскими гаметами, как правило, заключается в разработке сильной конкуренции спермы , [ 149 ] [ 150 ] Поскольку небольшая сперма позволяет организмам производить большое количество сперматозоидов и создавать мужчин (или мужская функция гермафродитов [ 151 ] ) более избыточно.
Вольвоциновые водоросли были полезны для понимания эволюции сексуального диморфизма [ 152 ] и такие виды, как жук C. maculatus , где женщины больше, чем мужчины, используются для изучения его основных генетических механизмов. [ 153 ]
У многих немоногамных видов польза для репродуктивной пригодности для спаривания мужчины с несколькими женщинами является большим, тогда как польза для репродуктивной подготовки спаривания самки с несколькими мужчинами невелика или не существует. [ 154 ] У этих видов существует давление отбора на любые признаки, позволяющие мужчине иметь больше спасательных явлений. Поэтому у мужчины могут быть разные черты от женщины.

Эти черты могут быть теми, которые позволяют ему бороться с другими мужчинами за контроль над территорией или гаремом , таким как большой размер или оружие; [ 155 ] Или они могут быть чертами, что женщины, по какой -то причине, предпочитают в товарищах. [ 156 ] Соревнования по мужчинам -мужчинам не представляет глубоких теоретических вопросов [ 157 ] Но Mate Choice делает.
Женщины могут выбирать мужчин, которые кажутся сильными и здоровыми, поэтому, вероятно, обладают «хорошими аллелями » и приводят к здоровому потомству. [ 158 ] Однако у некоторых видов женщины, похоже, выбирают мужчин с чертами, которые не улучшают выживаемость потомства, и даже черты, которые уменьшают его (потенциально приводят к таким признакам, как хвост павлина). [ 157 ] Две гипотезы для объяснения этого факта - это гипотеза сексуального сына и принцип гандикапа .
Гипотеза сексуального сына гласит, что женщины могут изначально выбрать черту, потому что она улучшает выживание их молодых, но как только это предпочтение станет широко распространенным, женщины должны продолжать выбирать черту, даже если это становится вредным. У тех, у кого нет сыновей, которые непривлекательны для большинства женщин (поскольку предпочтение широко распространено) и поэтому получают несколько спасений. [ 159 ]
Принцип гандикапа гласит, что мужчина, который выживает, несмотря на то, что обладает каким -то гандикапом, доказывает, что остальные его гены являются «хорошими аллелями». Если мужчины с «плохими аллелями» не могут выжить в гандикапе, женщины могут развиваться, чтобы выбрать мужчин с такого рода гандикапом; Черта действует как трудный сигнал пригодности. [ 160 ]
Смотрите также
[ редактировать ]Ссылки
[ редактировать ]- ^ Энциклопедия поведения животных . Тол. 2. Академическая пресса. 21 января 2019 г. с. 7. ISBN 978-0-12-813252-4 .
- ^ Ralls K, Mesnick S (2009). «Сексуальный диморфизм» . Академическая пресса . 1 (1): 1005–1011. doi : 10.1016/b978-0-12-373553-9.00233-9 . ISBN 9780123735539 .
- ^ «Словарь эволюции и биологии человека» . Человеческая биология . Архивировано с оригинала 7 ноября 2017 года . Получено 3 ноября 2017 года .
- ^ Armenta JK, Dunn Po, Whittingham LA (август 2008 г.). «Количественная оценка сексуального дихроматизма птиц: сравнение методов» . Журнал экспериментальной биологии . 211 (Pt 15): 2423–30. doi : 10.1242/jeb.013094 . PMID 18626076 .
- ^ Андерссон 1994 , с
- ^ Захави А (сентябрь 1975 г.). «Мат-выбор-выбор для гандикапа» (PDF) . Журнал теоретической биологии . 53 (1): 205–14. Bibcode : 1975jthbi..53..205z . Citeseerx 10.1.1.586.3819 . doi : 10.1016/0022-5193 (75) 90111-3 . PMID 1195756 . Архивировано из оригинала (PDF) 10 августа 2017 года . Получено 14 мая 2011 года .
- ^ Jump up to: а беременный Zi J, Yu X, Li Y, Hu X, Xu C, Wang X, et al. (Октябрь 2003 г.). «Стратегии окрашивания в павлине перья» . Труды Национальной академии наук Соединенных Штатов Америки . 100 (22): 12576–8. Bibcode : 2003pnas..10012576Z . doi : 10.1073/pnas.2133313100 . PMC 240659 . PMID 14557541 .
- ^ «Птицы парадиса: короли красоты» . Национальное географическое общество. 19 октября 2023 года . Получено 22 ноября 2023 года .
- ^ Slagsvold T, Lifjeld JT (1985). «Различия в цвете оперения великолепного Parus Major в отношении среды обитания, сезона и еды». Журнал зоологии . 206 (3): 321–328. doi : 10.1111/j.1469-7998.1985.tb05661.x .
- ^ Bowmaker JK, Heath LA, Wilkie SE, Hunt DM (август 1997 г.). «Визуальные пигменты и капли масла из шести классов фоторецептора в сетчатке птиц» . Видение исследования . 37 (16): 2183–94. doi : 10.1098/rspb.1998.0315 . PMC 1688915 . PMID 9578901 .
- ^ Bowmaker JK, Heath LA, Wilkie SE , Hunt DM (август 1997 г.). «Визуальные пигменты и капли масла из шести классов фоторецептора в сетчатке птиц» . Видение исследования . 37 (16): 2183–94. doi : 10.1098/rspb.1998.0316 . JSTOR 50814 . PMC 1688906 . PMID 9578901 .
- ^ Senar JC, Figuerola J, Pascual J (февраль 2002 г.). «Яркие желтые синие сиськи делают лучших родителей» . Разбирательство. Биологические науки . 269 (1488): 257–61. doi : 10.1098/rspb.2001.1882 . PMC 1690890 . PMID 11839194 .
- ^ Johnsen A, Delhey K, Andersson S, Kempenaers B (июнь 2003 г.). «Цвет оперения в синих сиськах: сексуальный дихроматизм, зависимость от состояния и генетические эффекты» . Разбирательство. Биологические науки . 270 (1521): 1263–70. doi : 10.1098/rspb.2003.2375 . JSTOR 3558810 . PMC 1691364 . PMID 12816639 .
- ^ Лозано Г.А. (1994). «Каротиноиды, паразиты и половой отбор» (PDF) . Оикос . 70 (2): 309–311. Bibcode : 1994oikos..70..309L . doi : 10.2307/3545643 . JSTOR 3545643 .
- ^ Donnellan, SC, & Mahony, MJ (2004). Аллезим, хромосомная и морфологическая изменчивость в группе видов LeSueuri (Anura: Hylidae), включая описание нового вида. Австралийский журнал зоологии
- ^ Bell, RC, & Zamudio, KR (2012). Сексуальный дихроматизм у лягушек: естественный отбор, сексуальный отбор и неожиданное разнообразие. Труды Королевского общества B: Биологические науки.
- ^ Райан М.Дж., Рэнд как (апрель 1993 г.). «Распознавание видов и сексуальный отбор как унитарная проблема в общении с животными». Эволюция; Международный журнал органической эволюции . 47 (2): 647–657. doi : 10.2307/2410076 . JSTOR 2410076 . PMID 28568715 .
- ^ Рубелини Д., Спина Ф., Сайно Н. (2004). «Протейндри и сексуальный диморфизм у перелетных птиц Транс-Сахары». Поведенческая экология . 15 (4): 592–601. Citeseerx 10.1.1.498.7541 . doi : 10.1093/beheco/arh048 .
- ^ Короткий Р.В., Балабан Е (4 августа 1994 г.). Различия между полами . Издательство Кембриджского университета. ISBN 9780521448789 Полем Получено 3 ноября 2017 года - через Google Books.
- ^ Джакомелло Е., Маркини Д., Расотто М.Б. (сентябрь 2006 г.). «Мужская сексуальная диморфная черта обеспечивает антимикробные препараты яиц в бренни -рыбе» . Биологические письма . 2 (3): 330–3. doi : 10.1098/rsbl.2006.0492 . PMC 1686180 . PMID 17148395 .
- ^ Renner SS, Ricklefs RE (1995). «Dioecy и ее корреляты в цветущих растениях» . Американский журнал ботаники . 82 (5): 596–606. doi : 10.2307/2445418 . JSTOR 2445418 .
- ^ Behnke H, Lüttge U, Esser K, Kadereit JW, Runge M (6 декабря 2012 г.). Прогресс в ботанике / Прогресс ботаники: структурная ботаника Физиология Генетика Таксономия Геоботаника / Структура Физиология Генетика Систематика Геоботания . Springer Science & Business Media. ISBN 978-3-642-79844-3 .
- ^ Рамават К.Г., Мериллон Дж. М., Шиванна К.Р. (19 апреля 2016 г.). Репродуктивная биология растений . CRC Press. ISBN 978-1-4822-0133-8 .
- ^ Ромеро Г.А., Нельсон К.Е. (июнь 1986 г.). «Сексуальный диморфизм в орхидеях катазетки: насильственное размещение пыльцы и конкуренция мужского цветов». Наука . 232 (4757): 1538–40. Bibcode : 1986sci ... 232.1538r . doi : 10.1126/science.232.4757.1538 . JSTOR 1698050 . PMID 17773505 . S2CID 31296391 .
- ^ «Угорчатая трава (он же дикий сельдерей, ленточная трава)» . Университет Массачусетса . Архивировано из оригинала 12 июля 2011 года.
- ^ Фридман Дж., Барретт С.С. (июнь 2009 г.). «Ветер перемен: новое понимание экологии и эволюции опыления и спаривания у насыщенных ветряными растениями» . Анналы ботаники . 103 (9): 1515–27. doi : 10.1093/aob/mcp035 . PMC 2701749 . PMID 19218583 .
- ^ Гебер М.А. (1999). Пол и половой диморфизм в цветущих растениях . Берлин: Спрингер. ISBN 978-3-540-64597-9 Полем п. 206
- ^ Бондьюрианский Р (январь 2007 г.). «Эволюция зависимого от состояния полового диморфизма». Американский натуралист . 169 (1): 9–19. doi : 10.1086/510214 . PMID 17206580 . S2CID 17439073 .
- ^ Barreto FS, Avise JC (август 2011 г.). «Система генетического спаривания морского паука с диморфизмом сексуального размера, представленного мужчинами: доказательство искажения отцовства, несмотря на случайный успех спаривания» . Поведенческая экология и социобиология . 65 (8): 1595–1604. Bibcode : 2011becos..65.1595b . doi : 10.1007/s00265-011-1170-x . PMC 3134710 . PMID 21874083 .
- ^ Gruber B, Eckel K, Everaars J, Dormannn CF (30 июня 2011 г.). «На управлении пчелой Red Mason (Osmia bicornis) в яблочных садах» (PDF ) апидология 42 (5): 564–5 Doi : 10.1007/s13592-011-0059- z ISSN 0044-8 22935710S2CID
- ^ «Hackberry Emperor - Asterocampa Celtis (Boisduval & Leconte)» . entnemdept.ufl.edu . Получено 15 ноября 2017 года .
- ^ Rust R, Torchio P, Trostle G (1989). «Поздний эмбриогенез и незрелое развитие Osmia Rufa Cornigera (Rossi) (Hymenoptera: Megachilidae)» . Апидология . 20 (4): 359–367. doi : 10.1051/apido: 19890408 .
- ^ Danforth B (1991). «Морфология и поведение диморфных мужчин у Perdita portalis (Hymenoptera: Andrenidae)». Поведенческая экология и социобиология . 29 (4): 235–247. Bibcode : 1991becos..29..235d . doi : 10.1007/bf00163980 . S2CID 37651908 .
- ^ Jaycox Elbert R (1967). «Территориальное поведение среди мужчин Антидия Бамнгенса». Журнал Канзасского энтомологического общества . 40 (4): 565–570.
- ^ Kukuk PF (1 октября 1996 г.). «Мужской диморфизм в ласиоглоссме (чилаликт) полухлице: роль личиночного питания». Журнал Канзасского энтомологического общества . 69 (4): 147–157. JSTOR 25085712 .
- ^ Paxton RJ, Giovanetti F, Scamoni E, Scanni B (1 октября 1999 г.). «Спаривание в коммунальной пчеле, Андена ругает (Hymenoptera andreniidae)» ЭКОЛОГИЯ ИТОЛОГИЯ И ЭВОЛЮЦИЯ . 11 (4): 371–3 Bibcode : 19999tece..11..371p Doi : 10.1080/ 08927014.1999.9522 ISSN 0394-9
- ^ Wang MQ, Yang D (2005). «Сексуальный диморфизм у насекомых». Китайский бюллетень энтомологии . 42 : 721–725.
- ^ Jump up to: а беременный Sugiura S, Yamaura Y, Makihara H (ноябрь 2007 г.). «Сексуальный и мужской диморфизм рога у Copris Ochus (Coleoptera: Scarabaeidae)» . Зоологическая наука . 24 (11): 1082–1085. doi : 10.2108/zsj.24.1082 . PMID 18348608 . S2CID 34705415 .
- ^ Хонго, Йошихито (1 декабря 2007 г.). «Эволюция мужской диморфической аллометрии в популяции японской рогатой жука Трипоксил Дихотомис Septentrionalis» . Поведенческая экология и социобиология . 62 (2): 245–253. Bibcode : 2007becos..62..245h . doi : 10.1007/s00265-007-0459-2 . ISSN 1432-0762 .
- ^ Jump up to: а беременный Emlen DJ, Marangelo J, Ball B, Cunningham CW (май 2005). «Разнообразие в оружии сексуального отбора: эволюция рога в роде жуков Onthophagus (Coleoptera: Scarabaeidae)». Эволюция; Международный журнал органической эволюции . 59 (5): 1060–1084. Citeseerx 10.1.1.133.7557 . doi : 10.1111/j.0014-3820.2005.tb01044.x . PMID 16136805 . S2CID 221736269 .
- ^ Teder, T. & Tammaru, T. (2005). «Диморфизм сексуального размера внутри видов увеличивается с размером тела у насекомых». Оикос [ ISBN отсутствует ]
- ^ Оливер Дж.С., Монтейро А (июль 2011 г.). «О происхождении сексуального диморфизма у бабочек» . Разбирательство. Биологические науки . 278 (1714): 1981–1988. doi : 10.1098/rspb.2010.2220 . PMC 3107650 . PMID 21123259 .
- ^ Робертсон Ка, Монтейро А (август 2005 г.). «Женский Bicyclus Anynana Butterflies выбирают мужчин на основе своих спинных ультрафиолетовых учеников глаз» . Разбирательство. Биологические науки . 272 (1572): 1541–1546. doi : 10.1098/rspb.2005.3142 . PMC 1559841 . PMID 16048768 .
- ^ Wiklund C, Lindfors V, Forsberg J (1996). «Раннее появление мужчин и репродуктивная фенология взрослого взрослого, заинтересованного в бабочке Godpteryx Rhamni в Швеции». Оикос . 75 (2): 227–240. Bibcode : 1996oikos..75..227w . doi : 10.2307/3546246 . JSTOR 3546246 .
- ^ Kunte K (июль 2008 г.). «Миметические бабочки поддерживают модель сексуального диморфизма Уоллеса» . Разбирательство. Биологические науки . 275 (1643): 1617–1624. doi : 10.1098/rspb.2008.0171 . PMC 2602815 . PMID 18426753 .
- ^ McLean CJ, Garwood RJ, Brassey CA (2018). «Сексуальный диморфизм в арахнидных порядках» . ПЕРЕЙ . 6 : E5751. doi : 10.7717/peerj.5751 . PMC 6225839 . PMID 30416880 .
- ^ Смит Т. Обнаружение повседневной схемы активности Zygiella x-notata и его связь с светом (PDF) (тезис MS).
- ^ Prenter J, Elwood RW, Montgomery WI (декабрь 1999 г.). «Диморфизм сексуального размера и репродуктивные инвестиции женщин -пауков: сравнительный анализ». Эволюция; Международный журнал органической эволюции . 53 (6): 1987–1994. doi : 10.2307/2640458 . JSTOR 2640458 . PMID 28565440 .
- ^ Jump up to: а беременный в Wilder SM, Rypstra AL (2008). «Диморфизм сексуального размера опосредует возникновение зависимого от состояния сексуального каннибализма у паука волка». Поведение животных . 76 (2): 447–454. doi : 10.1016/j.anbehav.2007.12.023 . S2CID 54373571 .
- ^ Foellmer MW, Fairbairn DJ (2004). «Мужчины, находящиеся в атаке: сексуальный каннибализм и его последствия для мужской морфологии и поведения в пауке с шаром» . Эволюционные экологические исследования . 6 : 163–181.
- ^ Girard MB, Elias Do, Kasumovic MM (декабрь 2015 г.). «Женское предпочтение мультимодальному ухаживанию: множественные сигналы важны для успеха спаривания мужского пола у пауковых пауков» . Разбирательство. Биологические науки . 282 (1820): 20152222. DOI : 10.1098/rspb.2015.2222 . PMC 4685782 . PMID 26631566 .
- ^ Fairbairn D (28 апреля 2013 г.). Странные пары: необычные различия между полами в животном царстве . Принстон. ISBN 978-0691141961 .
- ^ Ota K, Kohda M, Sato T (июнь 2010 г.). «Необычная аллометрия для диморфизма сексуального размера в цихлиде, где мужчины чрезвычайно больше, чем женщины». Журнал биологических наук . 35 (2): 257–65. doi : 10.1007/s12038-010-0030-6 . PMID 20689182 . S2CID 12396902 .
- ^ Сато Т (1994). «Активное накопление нерестового субстрата: определяет экстремального полигинья в цихлидской рыбе, выращивающей раковину». Поведение животных . 48 (3): 669–678. doi : 10.1006/anbe.1994.1286 . S2CID 53192909 .
- ^ Schütz D, Taborsky M (2005). ( ) "Аранаета PDF . Журнал арахнологии 33 (3): 767–775. doi : 10.1636/s03-56.1 . S2CID S2CID the original (PDF)Марш Получено 14 мая
- ^ McCormick Mi, Ryen CA, Munday PL, Walker SP (май 2010). Бриффа М (ред.). «Различные механизмы лежат в основе сексуального диморфизма по размеру в двух популяциях рыб, изменяющей пол» . Plos один . 5 (5): E10616. Bibcode : 2010ploso ... 510616M . doi : 10.1371/journal.pone.0010616 . PMC 2868897 . PMID 20485547 .
- ^ Warner RR (июнь 1988 г.). «Изменение пола и модель по размеру». Тенденции в экологии и эволюции . 3 (6): 133–6. Bibcode : 1988tecoe ... 3..133W . doi : 10.1016/0169-5347 (88) 90176-0 . PMID 21227182 .
- ^ Адамс С., Уильямс А.Дж. (2001). «Предварительный тест гипотезы переходного роста с использованием протонитной коралловой форели Plectropomus maculatus ». Журнал рыбной биологии . 59 (1): 183–185. Bibcode : 2001jfbio..59..183a . doi : 10.1111/j.1095-8649.2001.tb02350.x .
- ^ Хендри А., Берг ОК (1999). «Вторичные сексуальные персонажи, использование энергии, старение и стоимость воспроизведения в лососе в Sockeye». Канадский журнал зоологии . 77 (11): 1663–1675. doi : 10.1139/cjz-77-11-1663 .
- ^ Jump up to: а беременный Amundsen T, Forsgren E (ноябрь 2001 г.). «Выбор мужского пола выбирает женскую окраску в рыбе» . Труды Национальной академии наук Соединенных Штатов Америки . 98 (23): 13155–60. Bibcode : 2001pnas ... 9813155a . doi : 10.1073/pnas.211439298 . PMC 60840 . PMID 11606720 .
- ^ Jump up to: а беременный Svensson PA, Pélabon C, Blount JD, Surai PF, Amundsen T (2006). «Отражает ли женская брачная окраска каротиноидов яиц и качества сцепления в Goby с двумя пятнами (Gobiusculus flavescens, Gobiidae)?» Полем Функциональная экология . 20 (4): 689–698. Bibcode : 2006fueco..20..689s . doi : 10.1111/j.1365-2435.2006.01151.x . HDL : 10536/dro/du: 30038904 .
- ^ Батлер М.А., Schoener TW, Losos JB (февраль 2000 г.). «Взаимосвязь между диморфизмом сексуального размера и использованием среды обитания в больших антильских анолис -ящерицах» . Эволюция; Международный журнал органической эволюции . 54 (1): 259–72. doi : 10.1111/j.0014-3820.2000.tb00026.x . PMID 10937202 . S2CID 7887284 .
- ^ Sanger TJ, Seav SM, Tokita M, Langerhans RB, Ross LM, Losos JB, Abzhanov A (июнь 2014 г.). «Путь эстрогена лежит в основе эволюции преувеличенных мужских черепных форм у ящериц анолиса» . Разбирательство. Биологические науки . 281 (1784): 20140329. DOI : 10.1098/rspb.2014.0329 . PMC 4043096 . PMID 24741020 .
- ^ Jump up to: а беременный Pinto, A., Wiederhecker, H. и Neck, G. (2005). Сексуальный диморфизм в неотропической ящерице, Tropidurus (Squamata, Tropiduridae). Амфибия-рептилии.
- ^ Jump up to: а беременный Олссон М., Тоблер М., Хили М., Перрин С., Уилсон М. (август 2012 г.). «Значительный компонент старения (повреждение ДНК) отражается в исчезающих цветах размножения: экспериментальный тест с использованием врожденных антиоксидантных миметиков у окрашенных ящериц драконов» . Эволюция; Международный журнал органической эволюции . 66 (8): 2475–83. doi : 10.1111/j.1558-5646.2012.01617.x . PMID 22834746 . S2CID 205783815 .
- ^ Caron FS, Pie MR (2024). «Макроэволюция диморфизма сексуального размера у птиц» . Биологический журнал Линневого общества . 141 (5): в печати. doi : 10.1093/biolinnean/blad168 .
- ^ Bravo CR, Bautista-Sopelana LM, Alonso JC (2024). «Пересмотр гипотезы дивергенции ниши у сексуально диморфных птиц: перекрывается ли диета с диморфизмом сексуального размера?». Журнал экологии животных . 93 (4): 460–474. Bibcode : 2024Janec..93..460b . doi : 10.1111/1365-2656.14058 . HDL : 10261/360371 . PMID 38462717 .
- ^ Андерссон 1994 , с
- ^ Berns CM, Adams DC (11 ноября 2012 г.). «Стать другим, но оставаться одинаково: модели сексуального размера и диморфизма формы в счетах колибри». Эволюционная биология . 40 (2): 246–260. doi : 10.1007/s11692-012-9206-3 . ISSN 0071-3260 . S2CID 276492 .
- ^ McGraw KJ, Hill GE, Stradi R, Parker RS (февраль 2002 г.). «Влияние доступа к каротиноидам в рационе на сексуальное дихроматизм и пигментную композицию оперения в американском Goldfinch» (PDF) . Сравнительная биохимия и физиология. Часть B, Биохимия и молекулярная биология . 131 (2): 261–9. doi : 10.1016/s1096-4959 (01) 00500-0 . PMID 11818247 . Архивировано из оригинала (PDF) 28 августа 2005 года.
- ^ Gibbs HL, Weatherhead PJ, Boag PT, White BN, Tabak LM, Hoysak DJ (декабрь 1990 г.). «Реализованный репродуктивный успех полигинозных красных крыльев, выявленных маркерами ДНК» . Наука . 250 (4986): 1394–7. doi : 10.1098/rspb.1998.0308 . JSTOR 50849 . PMC 1688905 . PMID 17754986 .
- ^ Jump up to: а беременный в дюймовый Линдси В.Р., Вебстер М.С., Вариан К.В., Швабл Х (2009). «Приобретение и поведение цвета оперения связаны с андрогенами в фенотипически пластической птице». Поведение животных . 77 (6): 1525–1532. doi : 10.1016/j.anbehav.2009.02.027 . S2CID 15799876 .
- ^ Петри М (1994). «Улучшенный рост и выживание потомков павлина с более сложными поездами». Природа . 371 (6498): 598–599. Bibcode : 1994natur.371..598p . doi : 10.1038/371598a0 . S2CID 4316752 .
- ^ Рубелини Д., Спина Ф., Сайно Н. (2004). «Протейндри и сексуальный диморфизм у перелетных птиц Транс-Сахары» . Поведенческая экология . 15 (4): 592–601. doi : 10.1093/beheco/arh048 .
- ^ Kissner KJ, Weatherhead PJ, Francis CM (январь 2003 г.). «Сексуальный размер диморфизм и сроки весенней миграции у птиц». Журнал эволюционной биологии . 16 (1): 154–62. Citeseerx 10.1.1.584.2867 . doi : 10.1046/j.1420-9101.2003.00479.x . PMID 14635890 . S2CID 13830052 .
- ^ Jump up to: а беременный Møller AP, Nielsen JT (2006). «Уязвимость добычи в отношении сексуальной окраски добычи». Поведенческая экология и социобиология . 60 (2): 227–233. Bibcode : 2006becos..60..227m . doi : 10.1007/s00265-006-0160-x . S2CID 36836956 .
- ^ Jump up to: а беременный в Адкинс-Реган Э. (2007). «Гормоны и развитие половых различий в поведении». Журнал орнитологии . 148 (Дополнение 1): S17 - S26. doi : 10.1007/S10336-007-0188-3 . S2CID 13868097 .
- ^ Jump up to: а беременный в дюймовый Martin U, Grüebler HS, Müller M, Spaar R, Horch P, Naef-Daenzer B (2008). «Предвзяточная смертность женщин, вызванная антропогенной потерей гнезда, способствует снижению численности населения и соотношению полов взрослых у птицы луга». Биологическое сохранение . 141 (12): 3040–3049. Bibcode : 2008bcons.141.3040g . doi : 10.1016/j.biocon.2008.09.008 .
- ^ Owens, Ipf, Short, RV,. (1995). Гормональная основа сексуального диморфизма у птиц: последствия для новых теорий сексуального отбора. Тенденции в экологии и эволюции., 10 (Ref), 44.
- ^ Jump up to: а беременный Койн Дж.А., Кей Эх, Прутт-Джонс (январь 2008 г.). «Генетическая основа сексуального диморфизма у птиц» . Эволюция; Международный журнал органической эволюции . 62 (1): 214–9. doi : 10.1111/j.1558-5646.2007.00254.x . PMID 18005159 . S2CID 11490688 .
- ^ Веландо А (2002). «Экспериментальная манипуляция с материнскими усилиями дает дифференциальные эффекты у сыновей и дочерей: последствия для адаптивных соотношений полов в сине-ногах» . Поведенческая экология . 13 (4): 443–449. doi : 10.1093/beheco/13.4.443 .
- ^ Loostra AJ, Verhoeven MA, Piersma T (2018). «Специфичный рост у цыплят из сексуально-диморфического чернохвового Годвита» (PDF) . Ибис . 160 (1): 89–100. doi : 10.1111/ibi.12541 . S2CID 90880117 .
- ^ Jump up to: а беременный Главный MB (март 2008 г.). «Примирение конкурирующих экологических объяснений сексуальной сегрегации в цветах». Экология . 89 (3): 693–704. Bibcode : 2008ecol ... 89..693m . doi : 10.1890/07-0645.1 . PMID 18459333 .
- ^ Jump up to: а беременный Сафи К., Кениг Б., Керт Г. (2007). «Половые различия в генетике популяции, размере домашнего диапазона и использовании среды обитания летучей мыши партий ( Vespertilio Murinus , Linnaeus 1758) в Швейцарии и их последствия для сохранения» (PDF) . Биологическое сохранение . 137 (1): 28–36. Bibcode : 2007bcons.137 ... 28 с . doi : 10.1016/j.biocon.2007.01.011 . Архивировано из оригинала (PDF) 25 сентября 2017 года . Получено 2 февраля 2019 года .
- ^ Coulson G, Macfarlane AM, Parsons SE, Cutter J (2006). «Эволюция сексуальной сегрегации у травоядных млекопитающих: кенгуру как сумчатые модели». Австралийский журнал зоологии . 54 (3): 217–224. doi : 10.1071/Zo05062 .
- ^ González-Solís J, Croxall JP, Wood AG (2000). «Сексуальный диморфизм и сексуальная сегрегация в стратегиях кормления северной гигантской бенров, Macranectes Halli , во время инкубации». Оикос . 90 (2): 390–398. Bibcode : 2000oikos..90..390g . doi : 10.1034/j.1600-0706.2000.900220.x .
- ^ Jump up to: а беременный в дюймовый Саммерс-Смит Д.Д. (1988). Воробьи . Калтон, Стаффордшир, Великобритания: T. & Ad Poyser . ISBN 978-0-85661-048-6 .
- ^ Майорино, Леонардо; Фарке, Эндрю А.; Кочакис, Тассос; Пирас, Паоло (7 мая 2015 г.). «Мужчины напоминают женщин: переоценка сексуального диморфизма в протокератопах Эндрюси (Неоцератопсия, Protoceratopsidae)» . Plos один . 10 (5): E0126464. doi : 10.1371/journal.pone.0126464 . ISSN 1932-6203 . PMC 4423778 . PMID 25951329 .
- ^ Сатта, Эван Томас (22 апреля 2015 г.). «Свидетельство о сексуальном диморфизме в высеченном динозавре Стегозавр Мьоси (Ornithischia, Stegosauria) из формирования Morrison (Верхняя юрская величина) западной США» . Plos один . 10 (4): E0123503. BIBCODE : 2015PLOSO..1023503S . doi : 10.1371/journal.pone.0123503 . ISSN 1932-6203 . PMC 4406738 . PMID 25901727 .
- ^ «Стегозавры могли различаться между мужчинами, женщинами» . Scienceday . Получено 12 марта 2024 года .
- ^ Арнольд А.П. (сентябрь 2004 г.). «Секс -хромосомы и пол мозга». Природные обзоры. Нейробиология . 5 (9): 701–8. doi : 10.1038/nrn1494 . PMID 15322528 . S2CID 7419814 .
- ^ Кассини М.Х. (январь 2020 г.). «Смешанная модель эволюции полигинья и диморфизма сексуального размера у млекопитающих». Обзор млекопитающих . 50 (1): 112–120. doi : 10.1111/mam.12171 . ISSN 0305-1838 . S2CID 208557639 .
- ^ Cappozzo HL, Campagna C, Monserrat J (1991). «Сексуальный диморфизм у новорожденных южных морских львов». Морские млекопитающие . 7 (4): 385–394. Bibcode : 1991mms ... 7..385c . doi : 10.1111/j.1748-7692.1991.tb00113.x .
- ^ Салогни Е., Галимберти Ф., Санвито С., Миллер Э.Х. (март 2019 г.). «Мужские и женские щенки очень сексуально диморфного уплотнения северного слона (Mirounga angustirostris) слегка различаются по размеру тела». Канадский журнал зоологии . 97 (3): 241–250. doi : 10.1139/cjz-2018-0220 . ISSN 0008-4301 . S2CID 91796880 .
- ^ Оно Ка, Бонесс DJ (январь 1996 г.). «Сексуальный диморфизм у щенков морских львов: дифференциальные материнские инвестиции или специфические для пола различия в распределении энергии?». Поведенческая экология и социобиология . 38 (1): 31–41. Bibcode : 1996becos..38 ... 31o . doi : 10.1007/s002650050214 . S2CID 25307359 .
- ^ Tarnawski BA, Cassini GH, Flores DA (2014). «Аллометрия черепа и половой диморфизм в онтогенезе южного слона (Мирунга Леонина)». Канадский журнал зоологии . 31 : 19–31. doi : 10.1139/cjz-2013-0106 . HDL : 11336/29893 .
- ^ Ларсен CS (август 2003 г.). «Равенство для полов в эволюции человека? Ранний сексуальный диморфизм гоминидов и последствия для систем спаривания и социального поведения» . Труды Национальной академии наук Соединенных Штатов Америки . 100 (16): 9103–4. Bibcode : 2003pnas..100.9103L . doi : 10.1073/pnas.1633678100 . PMC 170877 . PMID 12886010 .
- ^ Buss DM (2007). «Эволюция спаривания человека» (PDF) . Acta Psychologica Sinica . 39 (3): 502–512. Архивировано из оригинала (PDF) 12 августа 2011 года . Получено 14 мая 2011 года .
- ^ Дейли М., Уилсон М. (1996). «Эволюционная психология и семейный конфликт». В Бусс Д.М. , Маламут Н.М. (ред.). Секс, власть, конфликт: эволюционные и феминистские перспективы . Издательство Оксфордского университета . п. 13 ISBN 978-0-19-510357-1 .
- ^ Реттнер, Рэйчел (3 января 2014 г.). «Почему подтягивания труднее для женщин» . Livescience .
- ^ Sparling PB, O'Donnell EM, Snow TK (декабрь 1998 г.). «Гендерная разница в производительности на расстоянии проходила плато: анализ мировых рейтингов с 1980 по 1996 год» . Медицина и наука в спорте и упражнениях . 30 (12): 1725–9. doi : 10.1097/00005768-199812000-00011 . PMID 9861606 .
- ^ «Национальная статистика здравоохранения» (PDF) . Национальные отчеты о статистике здравоохранения . 10 22 октября 2008 г. Получено 21 апреля 2012 года .
- ^ «Национальное обследование здоровья и питания США, 1999–2002 гг.» (PDF) . Получено 1 мая 2014 года .
- ^ Jump up to: а беременный Глюксман А (1981). Сексуальный диморфизм в биологии и патологии человека и млекопитающих . Академическая пресса . С. 66–75. ISBN 978-0-12-286960-0 Полем OCLC 7831448 .
- ^ Jump up to: а беременный Танец А (27 марта 2019 г.). «Почему полов не чувствуют боли одинаково» . Природа . 567 (7749): 448–450. Bibcode : 2019natur.567..448d . doi : 10.1038/d41586-019-00895-3 . PMID 30918396 . S2CID 85527866 .
- ^ Durden-Smith J, Desimone D (1983). Секс и мозг . Нью -Йорк: Arbor House . ISBN 978-0-87795-484-2 .
- ^ Герш Э.С. , Герш I (1981). Биология женщин . Тол. 306. Балтимор: Университетский парк Пресс (оригинал из Мичиганского университета). п. 511. Bibcode : 1983natur.306..511. Полем doi : 10.1038/306511b0 . ISBN 978-0-8391-1622-6 Полем S2CID 28060318 .
{{cite book}}:|journal=игнорируется ( помощь ) - ^ Stein JH (1987). Внутренняя медицина (2 -е изд.). Бостон: Маленький, Браун . ISBN 978-0-316-81236-8 .
- ^ McLaughlin M, Shryer T (8 августа 1988 г.). «Мужчины против женщин: новые дебаты о сексуальных различиях». US News & World Report : 50–58.
- ^ McEwen BS (март 1981 г.). «Нейронные гонадные стероидные действия». Наука . 211 (4488): 1303–11. Bibcode : 1981sci ... 211.1303M . doi : 10.1126/science.6259728 . PMID 6259728 .
- ^ «Острая терпимость к боли со временем более последовательно у женщин, чем мужчин, согласно новым исследованиям» . NCCIH . Получено 11 мая 2022 года .
- ^ Возняки К. «Устойчивость к боли и чувствительность у мужчин, женщин, рыжеволоса и других» . Webmd . Получено 11 мая 2022 года .
- ^ Лопес А.М., Росс Н., Закрытие Дж., Дагналл А., Аморим А., Кроу Т.Дж. (апрель 2006 г.). «Статус инактивации PCDH11X: половые диморфизмы в уровнях экспрессии генов в мозге». Человеческая генетика . 119 (3): 267–75. doi : 10.1007/s00439-006-0134-0 . PMID 16425037 . S2CID 19323646 .
- ^ Lombardo MV, Ashwin E, Auyeung B, Chakrabarti B, Taylor K, Hackett G, et al. (Январь 2012 г.). «Тестостерон плода влияет на сексуально диморфное серое вещество в человеческом мозге» . Журнал нейробиологии . 32 (2): 674–80. doi : 10.1523/jneurosci.4389-11.2012 . PMC 3306238 . PMID 22238103 .
- ^ «Разнообразные роли для связывающего полового гормонов глобулина в репродукции» . biolreprod.org . Архивировано с оригинала 23 сентября 2015 года.
- ^ Fine C (август 2010 г.). Благословения пола: как наш разум, общество и неврозексизм создают разницу (1 -е изд.). WW Norton & Company . ISBN 978-0-393-06838-2 .
- ^ Jordan-Young R (сентябрь 2010 г.). Brain Storm: недостатки в науке о сексуальных различиях . Гарвардский университет издательство . ISBN 978-0-674-05730-2 .
- ^ Marner L, Nyengaard Jr, Tang Y, Pakkenberg B (июль 2003 г.). «Отмеченная потеря миелинизированных нервных волокон в человеческом мозге с возрастом». Журнал сравнительной неврологии . 462 (2): 144–52. doi : 10.1002/cne.10714 . PMID 12794739 . S2CID 35293796 .
- ^ Gur RC, Turetsky Bi, Matsui M, Yan M, Bilker W, Hughett P, Gur Re (май 1999). «Половые различия в мозговом сером и белом веществе у здоровых молодых людей: корреляции с когнитивными показателями» . Журнал нейробиологии . 19 (10): 4065–72. doi : 10.1523/jneurosci.19-10-04065.1999 . PMC 6782697 . PMID 10234034 .
- ^ Леонард С.М., Таулер С., Добро пожаловать С., Халдерман Л.К., Отто Р., Экерт М.А., Чиарелло С (декабрь 2008 г.). «Размер вопросов: церебральный объем влияет на половые различия в нейроанатомии» . Кора головного мозга . 18 (12): 2920–31. doi : 10.1093/cercor/bhn052 . PMC 2583156 . PMID 18440950 .
- ^ Людерс Э., Штайнмец Х., Янке Л. (декабрь 2002 г.). «Размер мозга и объем серого вещества в здоровом человеческом мозге». Нейрорепорт . 13 (17): 2371–4. doi : 10.1097/00001756-200212030-00040 . PMID 12488829 .
- ^ Haier RJ, Jung Re, Yeo Ra, Head K, Alkire Mt (март 2005 г.). «Нейроанатомия общего интеллекта: половые вопросы» (PDF) . Нейроамиж . 25 (1): 320–7. doi : 10.1016/j.neuroimage.2004.11.019 . PMID 15734366 . S2CID 4127512 . Архивировано из оригинала (PDF) 24 мая 2010 года.
- ^ Szalkai B, Varga B, Grolmusz V (2015). «Теоретический анализ графика показывает: женские мозги лучше связаны, чем мужчины» . Plos один . 10 (7): E0130045. Arxiv : 1501.00727 . BIBCODE : 2015PLOSO..1030045S . doi : 10.1371/journal.pone.0130045 . PMC 4488527 . PMID 26132764 .
- ^ Szalkai B, Varga B, Grolmusz V (июнь 2018 г.). «У смещения размера мозга компенсированные графические теоретические параметры также лучше в структурных разъемах женщин». Визуализация мозга и поведение . 12 (3): 663–673. doi : 10.1007/s11682-017-9720-0 . PMID 28447246 . S2CID 4028467 .
- ^ Гершони М., Пьетроковский С (февраль 2017 г.). «Ландшафт сексуального транскриптома и его последующий выбор у взрослых» . BMC Biology . 15 (1): 7. doi : 10.1186/s12915-017-0352-z . PMC 5297171 . PMID 28173793 .
- ^ Гершони М., Пьетроковский С (июль 2014 г.). «Снижение отбора и накопления вредных мутаций в генах, экспрессируемых исключительно у мужчин» . Природная связь . 5 : 4438. Bibcode : 2014natco ... 5.4438g . doi : 10.1038/ncomms5438 . PMID 25014762 .
- ^ Celly CD, Stoehr AM, Nunn C, Smyth KN, Prokop ZM (декабрь 2018 г.). «Сексуальный диморфизм в иммунитете между животными: метаанализ» . Экологические письма . 21 (12): 1885–1894. BIBCODE : 2018ECOLL..21.1885K . doi : 10.1111/ele.13164 . PMID 30288910 .
- ^ Gal-OZ ST, Maier B, Yoshida H, Seddu K, Elbaz N, Czysz C, et al. (Сентябрь 2019). «Immgen Report: половой диморфизм в транскриптом иммунной системы» . Природная связь . 10 (1): 4295. Bibcode : 2019natco..10.4295g . doi : 10.1038/s41467-019-12348-6 . PMC 6754408 . PMID 31541153 .
- ^ Гроссман С. (1989). «Возможно, основные механизмы сексуального диморфизма в иммунном ответе, факте и гипотезе». Журнал стероидной биохимии . 34 (1–6): 241–251. doi : 10.1016/0022-4731 (89) 90088-5 . PMID 2696846 .
- ^ Поллилик Е (август 2013 г.). «Биология: клеточный пол имеет значение» . Природа . 500 (7460): 23–4. Bibcode : 2013natur.500 ... 23 с . doi : 10.1038/500023a . PMID 23903733 . S2CID 4318641 .
- ^ Deasy BM, Lu A, Tebbets JC, Feduska JM, Schugar RC, Pollet JB, et al. (Апрель 2007 г.). «Роль для клеточного пола в регенерации стволовых клеток, опосредованной стволовыми клетками: женские клетки имеют более высокую эффективность регенерации мышц» . Журнал клеточной биологии . 177 (1): 73–86. doi : 10.1083/jcb.200612094 . PMC 2064113 . PMID 17420291 .
- ^ Mittelstrass K, Ried JS, Yu Z, Krumsiek J, Gieger C, Prehn C, et al. (Август 2011 г.). Маккарти Ми (ред.). «Открытие сексуальных диморфизмов в метаболических и генетических биомаркерах» . PLOS Genetics . 7 (8): E1002215. doi : 10.1371/journal.pgen.1002215 . PMC 3154959 . PMID 21852955 .
- ^ Penaloza C, Estevez B, Orlanski S, Sikorska M, Walker R, Smith C, et al. (Июнь 2009 г.). «Пол клеток диктует его ответ: дифференциальная экспрессия генов и чувствительность к стрессу, вызывающему гибель клеток в мужских и женских клетках» . FASEB Journal . 23 (6): 1869–79. doi : 10.1096/fj.08-119388 . PMC 2698656 . PMID 19190082 .
- ^ Jump up to: а беременный Vollrath F, Parker GA (1992). «Сексуальный диморфизм и искаженные половые соотношения у пауков». Природа . 360 (6400): 156–159. Bibcode : 1992natur.360..156V . doi : 10.1038/360156a0 . S2CID 4320130 .
- ^ Bornholdt R, Oliveira LR, Fabián Me (ноябрь 2008 г.). «Диморфизм сексуального размера у миотис -нигриканов (Schinz, 1821) (Chiroptera: Vespertilionidae) из Южной Бразилии» (PDF) . Бразильский журнал биологии . 68 (4): 897–904. doi : 10.1590/s1519-69842008000400028 . PMID 19197511 .
- ^ Hayssen V, Kunz TH (1996). «Аллометрия массы мусора в летучих мышах: сравнение с размером матери, морфология крыла и филогения» . Журнал млекопитающих . 77 (2): 476–490. doi : 10.2307/1382823 . JSTOR 1382823 .
- ^ Arnqvist G, Jones TM, Elgar Ma (июль 2003 г.). «Поведение насекомых: изменение сексуальных ролей в брачном кормлении» (PDF) . Природа . 424 (6947): 387. Bibcode : 2003natur.424..387a . doi : 10.1038/424387a . PMID 12879056 . S2CID 4382038 . Архивировано из оригинала (PDF) 15 сентября 2004 года.
- ^ Механизм оплодотворения: растения для людей , Под редакцией Брайана Дейла
- ^ Шоу А.Дж. (2000). «Экология населения, генетика населения и микроэволюция». В Шоу А.Дж., Гоффинет Б (ред.). Bryophyte Biology . Кембридж: издательство Кембриджского университета. С. 379–380. ISBN 978-0-521-66097-6 .
- ^ Jump up to: а беременный Schuster RM (1984). «Сравнительная анатомия и морфология печени». Новое руководство по браизенту . Тол. 2. Ничинан, Миядзаки, Япония: Ботаническая лаборатория Хаттори. п. 891.
- ^ Crum HA, Anderson Le (1980). Мосс восточной Северной Америки . Тол. 1. Нью -Йорк: издательство Колумбийского университета. п. 196. ISBN 978-0-231-04516-2 .
- ^ Бриггс Д. (1965). «Экспериментальная таксономия некоторых британских видов рода Dicranum » . Новый фитолог . 64 (3): 366–386. doi : 10.1111/j.1469-8137.1965.tb07546.x . JSTOR 2430169 .
- ^ Умирает Alvarez ME, Rushton AW, Gozalo R, Pillola GL, Linan and, Ahlberg P (2010). « Парадоксады Brachyrhachis Linnarsson, 1883 против парадоксидов Mediterraneus pompeckj, 1901: проблематичное определение» . Дар 132 (2): 95–104. Bibcode : 2010gff ... 132 ... 95d . Doi : 10.1080/11035897.2010.481363 . S2CID 129620469 .
- ^ Падиан К, Хорнер -младший (1 ноября 2014 г.). «Сексуальный отбор Дарвина: понимание его идей в контексте» . Comptes rendus palevol . 13 (8): 709–715. Bibcode : 2014crpal..13..709p . doi : 10.1016/j.crpv.2014.09.001 . ISSN 1631-0683 .
- ^ Togashi T, Bartelt JL, Yoshimura J, Tainaka K, Cox PA (август 2012 г.). «Эволюционные траектории объясняют диверсифицированную эволюцию изогамии и анизогамии в морских зеленых водорослях» . Труды Национальной академии наук Соединенных Штатов Америки . 109 (34): 13692–7. BIBCODE : 2012PNAS..10913692T . doi : 10.1073/pnas.1203495109 . PMC 3427103 . PMID 22869736 .
- ^ Ханшен, Эрик Р.; Херрон, Мэтью Д.; Винс, Джон Дж.; Носаки, Хисайоши; Мичод, Ричард Э. (сентябрь 2018 г.). «Многоклеточность стимулирует эволюцию сексуальных признаков» . Американский натуралист . 192 (3): E93 - E105. doi : 10.1086/698301 . ISSN 0003-0147 . PMC 6685534 . PMID 30125231 .
- ^ Сильжестам, Маттиас; Martinossi-Allibert, Ivain (2024). «Анизогамия не всегда способствует эволюции черт конкуренции спаривания у мужчин» . Американский натуралист . 203 (2): 230–253. doi : 10.1086/727968 . PMID 38306281 .
- ^ Реш, Винсент Х .; Cardé, Ring T. (22 июля 2009 г.). Энциклопедия насекомых . Академическая пресса. ISBN 978-0-08-092090-0 .
- ^ Паркер Г.А. (май 1982). «Почему так много крошечных сперматозоидов? Конкуренция спермы и поддержание двух полов». Журнал теоретической биологии . 96 (2): 281–94. Bibcode : 1982jthbi..96..281p . doi : 10.1016/0022-5193 (82) 90225-9 . PMID 7121030 . S2CID 29879237 .
- ^ Ян Дж.Н. (май 2010). «Сотрудничество и эволюция анизогамии». Журнал теоретической биологии . 264 (1): 24–36. Bibcode : 2010jthbi.264 ... 24y . doi : 10.1016/j.jtbi.2010.01.019 . PMID 20097207 .
- ^ Белл Г. (1985). «О функции цветов». Труды Королевского общества B: Биологические науки . 224 (1235): 223–266. Bibcode : 1985rspsb.224..223b . doi : 10.1098/rspb.1985.0031 . JSTOR 36033 . S2CID 84275261 .
- ^ Geng S, De Hoff P, Umen JG (июль 2014 г.). «Эволюция полов из пути спецификации сопряженного типа» . PLOS Биология . 12 (7): E1001904. doi : 10.1371/journal.pbio.1001904 . PMC 4086717 . PMID 25003332 .
- ^ Kaufmann P, Wolak Me, Husby A, Immonen E (октябрь 2021 г.). «Быстрая эволюция диморфизма сексуального размера, облегчаемого Y-связанной генетической дисперсией» . Природа экология и эволюция . 5 (10): 1394–1402. Bibcode : 2021natee ... 5.1394K . doi : 10.1038/s41559-021-01530-z . PMID 34413504 . S2CID 237242736 .
- ^ Futuyma 2005 , p. 330
- ^ Futuyma 2005 , p. 331
- ^ Futuyma 2005 , p. 332
- ^ Jump up to: а беременный Ридли 2004 , с. 328
- ^ Futuyma 2005 , p. 335
- ^ Ридли 2004 , с. 330
- ^ Ридли 2004 , с. 332
Источники
[ редактировать ]- Андерссон М.Б. (1994). Сексуальный отбор . ПРИЗНАЯ УНИВЕРСИТЕТА ПРИСЕТА . ISBN 978-0-691-00057-2 .
- Futuyma D (2005). Эволюция (1 -е изд.). Сандерленд, Массачусетс: Sinauer Associates. ISBN 978-0-87893-187-3 .
- Ридли М. (2004). Эволюция (3 -е изд.). Малден, Массачусетс: Blackwell Publishing. ISBN 978-1-4051-0345-9 .
Дальнейшее чтение
[ редактировать ]- Бондьюрианский Р (январь 2007 г.). «Эволюция зависимого от состояния полового диморфизма». Американский натуралист . 169 (1): 9–19. doi : 10.1086/510214 . PMID 17206580 . S2CID 17439073 .
- Figuerola J (1999). «Сравнительное исследование эволюции диморфизма обратного размера в моногамных куликах». Биологический журнал Линневого общества . 67 (1): 1–18. doi : 10.1111/j.1095-8312.1999.tb01926.x . HDL : 10261/44557 . S2CID 85330510 .
- Székely T, Lislevand T, Figuerola J, Fairbairn D, Blanckenhorn W (2007). Пол, размер и гендерные роли: эволюционные исследования диморфизма сексуального размера . С. 16–26.
Внешние ссылки
[ редактировать ]- Пол+диморфизм в Национальной библиотеке медицинской библиотеки Медицинской библиотеки Медицинской библиотеки (сетка)