Генная терапия
| Часть серии о |
| Генная инженерия |
|---|
 |
| Генетически модифицированные организмы |
| История и регулирование |
| Процесс |
| Applications |
| Controversies |
Генная терапия — это медицинская технология , целью которой является достижение терапевтического эффекта посредством манипулирования экспрессией генов или изменения биологических свойств живых клеток. [ 1 ] [ 2 ] [ 3 ]
Первая попытка модификации человеческой ДНК была предпринята в 1980 году Мартином Клайном , но первый успешный перенос ядерных генов у человека, одобренный Национальными институтами здравоохранения , был осуществлен в мае 1989 года. [ 4 ] Первое терапевтическое использование переноса генов, а также первое прямое встраивание ДНК человека в ядерный геном было осуществлено Френчем Андерсоном в ходе исследования, начавшегося в сентябре 1990 года. В период с 1989 по декабрь 2018 года было проведено более 2900 клинических испытаний, в которых участвовало более половина из них в фазе I. [ 5 ] В 2003 году Гендицин стал первой генной терапией, получившей одобрение регулирующих органов. С этого времени были одобрены и другие препараты генной терапии, такие как Glybera (2012), Стримвелис (2016), Kymriah (2017), Luxturna (2017), Onpattro (2018), Zolgensma (2019), Abecma (2021), Адстиладрин , Роктавиан и Хемгеникс (весь 2022 год). Большинство этих подходов используют аденоассоциированные вирусы (AAV) и лентивирусы для выполнения вставок генов in vivo и ex vivo соответственно. AAV характеризуются стабилизацией вирусного капсида , более низкой иммуногенностью, способностью трансдуцировать как делящиеся, так и неделящиеся клетки, способностью специфически интегрировать сайт и достигать долгосрочной экспрессии при лечении in vivo. [6] Подходы ASO / siRNA , подобные тем, которые применяются Alnylam и Ionis Pharmaceuticals , требуют невирусных систем доставки и используют альтернативные механизмы доставки в клетки печени посредством транспортеров GalNAc .
Not all medical procedures that introduce alterations to a patient's genetic makeup can be considered gene therapy. Bone marrow transplantation and organ transplants in general have been found to introduce foreign DNA into patients.[7]
Background
[edit]Gene therapy was first conceptualized in the 1960s, when the feasibility of adding new genetic functions to mammalian cells began to be researched. Several methods to do so were tested, including injecting genes with a micropipette directly into a living mammalian cell, and exposing cells to a precipitate of DNA that contained the desired genes. Scientists theorized that a virus could also be used as a vehicle, or vector, to deliver new genes into cells.
One of the first scientists to report the successful direct incorporation of functional DNA into a mammalian cell was biochemist Dr. Lorraine Marquardt Kraus (6 September 1922 – 1 July 2016)[8] at the University of Tennessee Health Science Center in Memphis, Tennessee, United States. In 1961, she managed to genetically alter the hemoglobin of cells from bone marrow taken from a patient with sickle cell anaemia. She did this by incubating the patient’s cells in tissue culture with DNA extracted from a donor with normal hemoglobin. In 1968, researchers Theodore Friedmann, Jay Seegmiller, and John Subak-Sharpe at the National Institutes of Health (NIH), Bethesda, in the United States successfully corrected genetic defects associated with Lesch-Nyhan syndrome, a debilitating neurological disease, by adding foreign DNA to cultured cells collected from patients suffering from the disease.[9]
The first attempt, an unsuccessful one, at gene therapy (as well as the first case of medical transfer of foreign genes into humans not counting organ transplantation) was performed by geneticist Martin Cline of the University of California, Los Angeles in California, United States on 10 July 1980.[10][11] Cline claimed that one of the genes in his patients was active six months later, though he never published this data or had it verified.[12]
After extensive research on animals throughout the 1980s and a 1989 bacterial gene tagging trial on humans, the first gene therapy widely accepted as a success was demonstrated in a trial that started on 14 September 1990, when Ashanthi DeSilva was treated for ADA-SCID.[13]
The first somatic treatment that produced a permanent genetic change was initiated in 1993.[14] The goal was to cure malignant brain tumors by using recombinant DNA to transfer a gene making the tumor cells sensitive to a drug that in turn would cause the tumor cells to die.[15]
The polymers are either translated into proteins, interfere with target gene expression, or possibly correct genetic mutations. The most common form uses DNA that encodes a functional, therapeutic gene to replace a mutated gene. The polymer molecule is packaged within a "vector", which carries the molecule inside cells.[medical citation needed]
Early clinical failures led to dismissals of gene therapy. Clinical successes since 2006 regained researchers' attention, although as of 2014[update], it was still largely an experimental technique.[16] These include treatment of retinal diseases Leber's congenital amaurosis[17][18][19][20] and choroideremia,[21] X-linked SCID,[22] ADA-SCID,[23][24] adrenoleukodystrophy,[25] chronic lymphocytic leukemia (CLL),[26] acute lymphocytic leukemia (ALL),[27] multiple myeloma,[28] haemophilia,[24] and Parkinson's disease.[29] Between 2013 and April 2014, US companies invested over $600 million in the field.[30]
The first commercial gene therapy, Gendicine, was approved in China in 2003, for the treatment of certain cancers.[31] In 2011, Neovasculgen was registered in Russia as the first-in-class gene-therapy drug for treatment of peripheral artery disease, including critical limb ischemia.[32] In 2012, Glybera, a treatment for a rare inherited disorder, lipoprotein lipase deficiency, became the first treatment to be approved for clinical use in either Europe or the United States after its endorsement by the European Commission.[16][33]
Following early advances in genetic engineering of bacteria, cells, and small animals, scientists started considering how to apply it to medicine. Two main approaches were considered – replacing or disrupting defective genes.[34] Scientists focused on diseases caused by single-gene defects, such as cystic fibrosis, haemophilia, muscular dystrophy, thalassemia, and sickle cell anemia. Glybera treats one such disease, caused by a defect in lipoprotein lipase.[33]
DNA must be administered, reach the damaged cells, enter the cell and either express or disrupt a protein.[35] Multiple delivery techniques have been explored. The initial approach incorporated DNA into an engineered virus to deliver the DNA into a chromosome.[36][37] Naked DNA approaches have also been explored, especially in the context of vaccine development.[38]
Generally, efforts focused on administering a gene that causes a needed protein to be expressed. More recently, increased understanding of nuclease function has led to more direct DNA editing, using techniques such as zinc finger nucleases and CRISPR. The vector incorporates genes into chromosomes. The expressed nucleases then knock out and replace genes in the chromosome. As of 2014[update] these approaches involve removing cells from patients, editing a chromosome and returning the transformed cells to patients.[39]
Gene editing is a potential approach to alter the human genome to treat genetic diseases,[40] viral diseases,[41] and cancer.[42][43] As of 2020[update] these approaches are being studied in clinical trials.[44][45]
Classification
[edit]Breadth of definition
[edit]
In 1986, a meeting at the Institute Of Medicine defined gene therapy as the addition or replacement of a gene in a targeted cell type. In the same year, the FDA announced that it had jurisdiction over approving "gene therapy" without defining the term. The FDA added a very broad definition in 1993 of any treatment that would ‘modify or manipulate the expression of genetic material or to alter the biological properties of living cells’. In 2018 this was narrowed to ‘products that mediate their effects by transcription or translation of transferred genetic material or by specifically altering host (human) genetic sequences’.[46]
Writing in 2018, in the Journal of Law and the Biosciences, Sherkow et al. argued for a narrower definition of gene therapy than the FDA's in light of new technology that would consist of any treatment that intentionally and permanently modified a cell's genome, with the definition of genome including episomes outside the nucleus but excluding changes due to episomes that are lost over time. This definition would also exclude introducing cells that did not derive from a patient themselves, but include ex vivo approaches, and would not depend on the vector used.[46]
During the COVID-19 pandemic, some academics insisted that the mRNA vaccines for COVID were not gene therapy to prevent the spread of incorrect information that the vaccine could alter DNA, other academics maintained that the vaccines were a gene therapy because they introduced genetic material into a cell.[47] Fact-checkers, such as Full Fact,[48] Reuters,[49] PolitiFact,[50] and FactCheck.org[51] said that calling the vaccines a gene therapy was incorrect. Podcast host Joe Rogan was criticized for calling mRNA vaccines gene therapy as was British politician Andrew Bridgen, with fact checker Full Fact calling for Bridgen to be removed from the conservative party for this and other statements.[52][53]
Genes present or added
[edit]Gene therapy encapsulates many forms of adding different nucleic acids to a cell. Gene augmentation adds a new protein coding gene to a cell. One form of gene augmentiation is gene replacement therapy, a treatment for monogenic recessive disorders where a single gene is not functional an additional functional gene is added. For diseases caused by multiple genes or a dominant gene, gene silencing or gene editing approaches are more appropriate but gene addition, a form of gene augmentation where new gene is added, may improve a cells function without modifying the genes that cause a disorder.[54]: 117
Cell types
[edit]Gene therapy may be classified into two types by the type of cell it affects: somatic cell and germline gene therapy.
In somatic cell gene therapy (SCGT), the therapeutic genes are transferred into any cell other than a gamete, germ cell, gametocyte, or undifferentiated stem cell. Any such modifications affect the individual patient only, and are not inherited by offspring. Somatic gene therapy represents mainstream basic and clinical research, in which therapeutic DNA (either integrated in the genome or as an external episome or plasmid) is used to treat disease.[55] Over 600 clinical trials utilizing SCGT are underway[when?] in the US. Most focus on severe genetic disorders, including immunodeficiencies, haemophilia, thalassaemia, and cystic fibrosis. Such single gene disorders are good candidates for somatic cell therapy. The complete correction of a genetic disorder or the replacement of multiple genes is not yet possible. Only a few of the trials are in the advanced stages.[56][needs update]
In germline gene therapy (GGT), germ cells (sperm or egg cells) are modified by the introduction of functional genes into their genomes. Modifying a germ cell causes all the organism's cells to contain the modified gene. The change is therefore heritable and passed on to later generations. Australia, Canada, Germany, Israel, Switzerland, and the Netherlands[57] prohibit GGT for application in human beings, for technical and ethical reasons, including insufficient knowledge about possible risks to future generations[57] and higher risks versus SCGT.[58] The US has no federal controls specifically addressing human genetic modification (beyond FDA regulations for therapies in general).[57][59][60][61]
In vivo versus ex vivo therapies
[edit]
In in vivo gene therapy, a vector (typically, a virus) is introduced to the patient, which then achieves the desired biological effect by passing the genetic material (e.g. for a missing protein) into the patient's cells. In ex vivo gene therapies, such as CAR-T therapeutics, the patient's own cells (autologous) or healthy donor cells (allogeneic) are modified outside the body (hence, ex vivo) using a vector to express a particular protein, such as a chimeric antigen receptor.[62]
In vivo gene therapy is seen as simpler, since it does not require the harvesting of mitotic cells. However, ex vivo gene therapies are better tolerated and less associated with severe immune responses.[63] The death of Jesse Gelsinger in a trial of an adenovirus-vectored treatment for ornithine transcarbamylase deficiency due to a systemic inflammatory reaction led to a temporary halt on gene therapy trials across the United States.[64] As of 2021[update], in vivo and ex vivo therapeutics are both seen as safe.[65]
Gene editing
[edit]
The concept of gene therapy is to fix a genetic problem at its source. If, for instance, a mutation in a certain gene causes the production of a dysfunctional protein resulting (usually recessively) in an inherited disease, gene therapy could be used to deliver a copy of this gene that does not contain the deleterious mutation and thereby produces a functional protein. This strategy is referred to as gene replacement therapy and could be employed to treat inherited retinal diseases.[17][66]
While the concept of gene replacement therapy is mostly suitable for recessive diseases, novel strategies have been suggested that are capable of also treating conditions with a dominant pattern of inheritance.
- The introduction of CRISPR gene editing has opened new doors for its application and utilization in gene therapy, as instead of pure replacement of a gene, it enables correction of the particular genetic defect.[40] Solutions to medical hurdles, such as the eradication of latent human immunodeficiency virus (HIV) reservoirs and correction of the mutation that causes sickle cell disease, may be available as a therapeutic option in the future.[67][68][69]
- Prosthetic gene therapy aims to enable cells of the body to take over functions they physiologically do not carry out. One example is the so-called vision restoration gene therapy, that aims to restore vision in patients with end-stage retinal diseases.[70][71] In end-stage retinal diseases, the photoreceptors, as the primary light sensitive cells of the retina are irreversibly lost. By the means of prosthetic gene therapy light sensitive proteins are delivered into the remaining cells of the retina, to render them light sensitive and thereby enable them to signal visual information towards the brain.
In vivo, gene editing systems using CRISPR have been used in studies with mice to treat cancer and have been effective at reducing tumors.[72]: 18 In vitro, the CRISPR system has been used to treat HPV cancer tumors. Adeno-associated virus, Lentivirus based vectors have been to introduce the genome for the CRISPR system.[72]: 6
Vectors
[edit]The delivery of DNA into cells can be accomplished by multiple methods. The two major classes are recombinant viruses (sometimes called biological nanoparticles or viral vectors) and naked DNA or DNA complexes (non-viral methods).[73]
Viruses
[edit]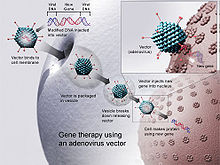
In order to replicate, viruses introduce their genetic material into the host cell, tricking the host's cellular machinery into using it as blueprints for viral proteins.[54]: 39 Retroviruses go a stage further by having their genetic material copied into the nuclear genome of the host cell. Scientists exploit this by substituting part of a virus's genetic material with therapeutic DNA or RNA.[54]: 40 [74] Like the genetic material (DNA or RNA) in viruses, therapeutic genetic material can be designed to simply serve as a temporary blueprint that degrades naturally, as in a non-integrative vectors, or to enter the host's nucleus becoming a permanent part of the host's nuclear DNA in infected cells.[54]: 50
A number of viruses have been used for human gene therapy, including viruses such as lentivirus, adenoviruses, herpes simplex, vaccinia, and adeno-associated virus.[5]
Adenovirus viral vectors (Ad) temporarily modify a cell's genetic expression with genetic material that is not integrated into the host cell's DNA.[75]: 5 As of 2017, such vectors were used in 20% of trials for gene therapy.[74]: 10 Adenovirus vectors are mostly used in cancer treatments and novel genetic vaccines such as the Ebola vaccine, vaccines used in clinical trials for HIV and SARS-CoV-2, or cancer vaccines.[75]: 5
Lentiviral vectors based on lentivirus, a retrovirus, can modify a cell's nuclear genome to permanently express a gene, although vectors can be modified to prevent integration.[54]: 40,50 Retroviruses were used in 18% of trials before 2018.[74]: 10 Libmeldy is an ex vivo stem cell treatment for metachromatic leukodystrophy which uses a lentiviral vector and was approved by the european medical agency in 2020.[76]
Adeno-associated virus (AAV) is a virus that is incapable of transmission between cells unless the cell is infected by another virus, a helper virus. Adenovirus and the herpes viruses act as helper viruses for AAV. AAV persists within the cell outside of the cell's nuclear genome for an extended period of time through the formation of concatemers mostly organized as episomes.[77]: 4 Genetic material from AAV vectors is integrated into the host cell's nuclear genome at a low frequency and likely mediated by the DNA-modifying enzymes of the host cell.[78]: 2647 Animal models suggest that integration of AAV genetic material into the host cell's nuclear genome may cause hepatocellular carcinoma, a form of liver cancer.[78] Several AAV investigational agents have been explored in treatment of wet age related macular degeneration by both intravitreal and subretinal approaches as a potential application of AAV gene therapy for human disease. [79] [80]
Non-viral
[edit]This section needs additional citations for verification. (April 2021) |
Non-viral vectors for gene therapy[81] present certain advantages over viral methods, such as large scale production and low host immunogenicity. However, non-viral methods initially produced lower levels of transfection and gene expression, and thus lower therapeutic efficacy. Newer technologies offer promise of solving these problems, with the advent of increased cell-specific targeting and subcellular trafficking control.
Methods for non-viral gene therapy include the injection of naked DNA, electroporation, the gene gun, sonoporation, magnetofection, the use of oligonucleotides, lipoplexes, dendrimers, and inorganic nanoparticles. These therapeutics can be administered directly or through scaffold enrichment.[82][83]
More recent approaches, such as those performed by companies such as Ligandal, offer the possibility of creating cell-specific targeting technologies for a variety of gene therapy modalities, including RNA, DNA and gene editing tools such as CRISPR. Other companies, such as Arbutus Biopharma and Arcturus Therapeutics, offer non-viral, non-cell-targeted approaches that mainly exhibit liver trophism. In more recent years, startups such as Sixfold Bio, GenEdit, and Spotlight Therapeutics have begun to solve the non-viral gene delivery problem. Non-viral techniques offer the possibility of repeat dosing and greater tailorability of genetic payloads, which in the future will be more likely to take over viral-based delivery systems.
Companies such as Editas Medicine, Intellia Therapeutics, CRISPR Therapeutics, Casebia, Cellectis, Precision Biosciences, bluebird bio, Excision BioTherapeutics, and Sangamo have developed non-viral gene editing techniques, however frequently still use viruses for delivering gene insertion material following genomic cleavage by guided nucleases. These companies focus on gene editing, and still face major delivery hurdles.
BioNTech, Moderna Therapeutics and CureVac focus on delivery of mRNA payloads, which are necessarily non-viral delivery problems.
Alnylam, Dicerna Pharmaceuticals, and Ionis Pharmaceuticals focus on delivery of siRNA (antisense oligonucleotides) for gene suppression, which also necessitate non-viral delivery systems.
In academic contexts, a number of laboratories are working on delivery of PEGylated particles, which form serum protein coronas and chiefly exhibit LDL receptor mediated uptake in cells in vivo.[84]
Treatment
[edit]Cancer
[edit]
There have been attempts to treat cancer using gene therapy. As of 2017, 65% of gene therapy trials were for cancer treatment.[74]: 7
Adenovirus vectors are useful for some cancer gene therapies because adenovirus can transiently insert genetic material into a cell without permanently altering the cell's nuclear genome. These vectors can be used to cause antigens to be added to cancers causing an immune response, or hinder angiogenesis by expressing certain proteins.[85]: 5 An Adenovirus vector is used in the commercial products Gendicine and Oncorine.[85]: 10 Another commercial product, Rexin G, uses a retrovirus-based vector and selectively binds to receptors that are more expressed in tumors.[85]: 10
One approach, suicide gene therapy, works by introducing genes encoding enzymes that will cause a cancer cell to die. Another approach is the use oncolytic viruses, such as Oncorine,[86]: 165 which are viruses that selectively reproduce in cancerous cells leaving other cells unaffected.[87]: 6 [88]: 280
mRNA has been suggested as a non-viral vector for cancer gene therapy that would temporarily change a cancerous cell's function to create antigens or kill the cancerous cells and there have been several trials.[89]
Genetic diseases
[edit]Gene therapy approaches to replace a faulty gene with a healthy gene have been proposed and are being studied for treating some genetic diseases. As of 2017, 11.1% of gene therapy clinical trials targeted monogenic diseases.[74]: 9
Diseases such as sickle cell disease that are caused by autosomal recessive disorders for which a person's normal phenotype or cell function may be restored in cells that have the disease by a normal copy of the gene that is mutated, may be a good candidate for gene therapy treatment.[90][91] The risks and benefits related to gene therapy for sickle cell disease are not known.[91]
Gene therapy has been used in the eye. The eye is especially suitable for adeno-associated virus vectors. Luxturna is an approved gene therapy to treat Leber's hereditary optic neuropathy.[92]: 1354 Glybera, a treatment for pancreatitis caused by a genetic condition, and Zolgensma for the treatment of spinal muscular atrophy both use an adeno-associated virus vector.[78]: 2647
Infectious diseases
[edit]As of 2017, 7% of genetic therapy trials targeted infectious diseases. 69.2% of trials targeted HIV, 11% hepatitis B or C, and 7.1% malaria.[74]
List of gene therapies for treatment of disease
[edit]Some genetic therapies have been approved by the U.S. Food and Drug Administration (FDA), the European Medicines Agency (EMA), and for use in Russia and China.
| INN | Brand name | Type | Manufacturer | Target | US Food and Drug Administration (FDA) approved | European Medicines Agency (EMA) authorized |
|---|---|---|---|---|---|---|
| alipogene tiparvovec | Glybera | In vivo | Chiesi Farmaceutici | lipoprotein lipase deficiency | No | Withdrawn |
| atidarsagene autotemcel | Libmeldy, Lenmeldy
(Arylsulfatase A gene encoding autologous CD34+ cells) |
Ex vitro | Orchard Therapeutics | metachromatic leukodystrophy | 18 March 2024[93] | 17 December 2020[94] |
| autologous CD34+ | Strimvelis | adenosine deaminase deficiency (ADA-SCID) | 26 May 2016 | |||
| axicabtagene ciloleucel | Yescarta | Ex vitro | Kite pharma | large B-cell lymphoma | 18 October 2017 | 23 August 2018 |
| beremagene geperpavec | Vyjuvek | In vivo | Krystal Biotech | Dystrophic epidermolysis bullosa (DEB) | 19 May 2023[95] | No |
| betibeglogene autotemcel | Zynteglo | beta thalassemia | 17 August 2022[96] | 29 May 2019 | ||
| brexucabtagene autoleucel | Tecartus | Ex vitro | Kite Pharma | mantle cell lymphoma and acute lymphoblastic leukemia | 24 July 2020[97][98] | 14 December 2020[99] |
| cambiogenplasmid | Neovasculgen | vascular endothelial growth factor peripheral artery disease | ||||
| delandistrogene moxeparvovec | Elevidys | In vivo | Catalent | Duchenne muscular dystrophy | 22 June 2023[100] | No |
| elivaldogene autotemcel | Skysona | cerebral adrenoleukodystrophy | 16 July 2021 | |||
| exagamglogene autotemcel | Casgevy | Ex vivo | Vertex Pharmaceuticals | sickle cell disease | December 2023[101] | |
| gendicine | head and neck squamous cell carcinoma | |||||
| idecabtagene vicleucel | Abecma | Ex vivo | Celgene | multiple myeloma | 26 March 2021[102] | No |
| lisocabtagene maraleucel | Breyanzi | Ex vivo | Juno Therapeutics | B-cell lymphoma | 5 February 2021[103] | No |
| lovotibeglogene autotemcel | Lyfgenia | Ex vivo | Bluebird Bio | sickle cell disease | December 2023[104] | |
| nadofaragene firadenovec | Adstiladrin | Ferring Pharmaceuticals | high-risk Bacillus Calmette-Guérin (BCG)-unresponsive non-muscle-invasive bladder cancer (NMIBC) with carcinoma in situ (CIS) | Yes[105] | No | |
| onasemnogene abeparvovec | Zolgensma | In vivo | Novartis Gene Therapies | Spinal muscular atrophy Type I | 24 May 2019[106] | 26 March 2020[107] |
| talimogene laherparepvec | Imlygic | In vivo | Amgen | melanoma | 27 October 2015[108] | 16 December 2015[109] |
| tisagenlecleucel | Kymriah | B cell lymphoblastic leukemia | 22 August 2018 | |||
| valoctocogene roxaparvovec | Roctavian | BioMarin International Limited | hemophilia A | August 2022[110][111][112] | ||
| voretigene neparvovec | Luxturna | In vivo | Spark Therapeutics | biallelic RPE65 mutation associated Leber congenital amaurosis | 18 December 2017[113] | 22 November 2018[114] |
Adverse effects, contraindications and hurdles for use
[edit]Some of the unsolved problems include:
- Off-target effects – The possibility of unwanted, likely harmful, changes to the genome present a large barrier to the widespread implementation of this technology.[115] Improvements to the specificity of gRNAs and Cas enzymes present viable solutions to this issue as well as the refinement of the delivery method of CRISPR.[116] It is likely that different diseases will benefit from different delivery methods.
- Short-lived nature – Before gene therapy can become a permanent cure for a condition, the therapeutic DNA introduced into target cells must remain functional and the cells containing the therapeutic DNA must be stable. Problems with integrating therapeutic DNA into the nuclear genome and the rapidly dividing nature of many cells prevent it from achieving long-term benefits. Patients require multiple treatments.
- Immune response – Any time a foreign object is introduced into human tissues, the immune system is stimulated to attack the invader. Stimulating the immune system in a way that reduces gene therapy effectiveness is possible. The immune system's enhanced response to viruses that it has seen before reduces the effectiveness to repeated treatments.
- Problems with viral vectors – Viral vectors carry the risks of toxicity, inflammatory responses, and gene control and targeting issues.
- Multigene disorders – Some commonly occurring disorders, such as heart disease, high blood pressure, Alzheimer's disease, arthritis, and diabetes, are affected by variations in multiple genes, which complicate gene therapy.
- Some therapies may breach the Weismann barrier (between soma and germ-line) protecting the testes, potentially modifying the germline, falling afoul of regulations in countries that prohibit the latter practice.[117]
- Insertional mutagenesis – If the DNA is integrated in a sensitive spot in the genome, for example in a tumor suppressor gene, the therapy could induce a tumor. This has occurred in clinical trials for X-linked severe combined immunodeficiency (X-SCID) patients, in which hematopoietic stem cells were transduced with a corrective transgene using a retrovirus, and this led to the development of T cell leukemia in 3 of 20 patients.[118][119] One possible solution is to add a functional tumor suppressor gene to the DNA to be integrated. This may be problematic since the longer the DNA is, the harder it is to integrate into cell genomes.[120] CRISPR technology allows researchers to make much more precise genome changes at exact locations.[121]
- Cost – Alipogene tiparvovec or Glybera, for example, at a cost of $1.6 million per patient, was reported in 2013, to be the world's most expensive drug.[122][123]
Deaths
[edit]Three patients' deaths have been reported in gene therapy trials, putting the field under close scrutiny. The first was that of Jesse Gelsinger, who died in 1999, because of immune rejection response.[124][125] One X-SCID patient died of leukemia in 2003.[13] In 2007, a rheumatoid arthritis patient died from an infection; the subsequent investigation concluded that the death was not related to gene therapy.[126]
Regulations
[edit]Regulations covering genetic modification are part of general guidelines about human-involved biomedical research.[citation needed] There are no international treaties which are legally binding in this area, but there are recommendations for national laws from various bodies.[citation needed]
The Helsinki Declaration (Ethical Principles for Medical Research Involving Human Subjects) was amended by the World Medical Association's General Assembly in 2008. This document provides principles physicians and researchers must consider when involving humans as research subjects. The Statement on Gene Therapy Research initiated by the Human Genome Organization (HUGO) in 2001, provides a legal baseline for all countries. HUGO's document emphasizes human freedom and adherence to human rights, and offers recommendations for somatic gene therapy, including the importance of recognizing public concerns about such research.[127]
United States
[edit]No federal legislation lays out protocols or restrictions about human genetic engineering. This subject is governed by overlapping regulations from local and federal agencies, including the Department of Health and Human Services, the FDA and NIH's Recombinant DNA Advisory Committee. Researchers seeking federal funds for an investigational new drug application, (commonly the case for somatic human genetic engineering,) must obey international and federal guidelines for the protection of human subjects.[128]
NIH serves as the main gene therapy regulator for federally funded research. Privately funded research is advised to follow these regulations. NIH provides funding for research that develops or enhances genetic engineering techniques and to evaluate the ethics and quality in current research. The NIH maintains a mandatory registry of human genetic engineering research protocols that includes all federally funded projects.[129]
An NIH advisory committee published a set of guidelines on gene manipulation.[130] The guidelines discuss lab safety as well as human test subjects and various experimental types that involve genetic changes. Several sections specifically pertain to human genetic engineering, including Section III-C-1. This section describes required review processes and other aspects when seeking approval to begin clinical research involving genetic transfer into a human patient.[131] The protocol for a gene therapy clinical trial must be approved by the NIH's Recombinant DNA Advisory Committee prior to any clinical trial beginning; this is different from any other kind of clinical trial.[130]
As with other kinds of drugs, the FDA regulates the quality and safety of gene therapy products and supervises how these products are used clinically. Therapeutic alteration of the human genome falls under the same regulatory requirements as any other medical treatment. Research involving human subjects, such as clinical trials, must be reviewed and approved by the FDA and an Institutional Review Board.[132][133]
Gene doping
[edit]Athletes may adopt gene therapy technologies to improve their performance.[134] Gene doping is not known to occur, but multiple gene therapies may have such effects. Kayser et al. argue that gene doping could level the playing field if all athletes receive equal access. Critics claim that any therapeutic intervention for non-therapeutic/enhancement purposes compromises the ethical foundations of medicine and sports.[135]
Genetic enhancement
[edit]Genetic engineering could be used to cure diseases, but also to change physical appearance, metabolism, and even improve physical capabilities and mental faculties such as memory and intelligence. Ethical claims about germline engineering include beliefs that every fetus has a right to remain genetically unmodified, that parents hold the right to genetically modify their offspring, and that every child has the right to be born free of preventable diseases.[136][137][138] For parents, genetic engineering could be seen as another child enhancement technique to add to diet, exercise, education, training, cosmetics, and plastic surgery.[139][140] Another theorist claims that moral concerns limit but do not prohibit germline engineering.[141]
A 2020 issue of the journal Bioethics was devoted to moral issues surrounding germline genetic engineering in people.[142]
Possible regulatory schemes include a complete ban, provision to everyone, or professional self-regulation. The American Medical Association's Council on Ethical and Judicial Affairs stated that "genetic interventions to enhance traits should be considered permissible only in severely restricted situations: (1) clear and meaningful benefits to the fetus or child; (2) no trade-off with other characteristics or traits; and (3) equal access to the genetic technology, irrespective of income or other socioeconomic characteristics."[143]
As early in the history of biotechnology as 1990, there have been scientists opposed to attempts to modify the human germline using these new tools,[144] and such concerns have continued as technology progressed.[145][146] With the advent of new techniques like CRISPR, in March 2015 a group of scientists urged a worldwide moratorium on clinical use of gene editing technologies to edit the human genome in a way that can be inherited.[147][148][149][150] In April 2015, researchers sparked controversy when they reported results of basic research to edit the DNA of non-viable human embryos using CRISPR.[151][152] A committee of the American National Academy of Sciences and National Academy of Medicine gave qualified support to human genome editing in 2017[153][154] once answers have been found to safety and efficiency problems "but only for serious conditions under stringent oversight."[155]
History
[edit]This section may be too long and excessively detailed. (November 2018) |
1970s and earlier
[edit]In 1972, Friedmann and Roblin authored a paper in Science titled "Gene therapy for human genetic disease?".[156] Rogers (1970) was cited for proposing that exogenous good DNA be used to replace the defective DNA in those with genetic defects.[157]
1980s
[edit]In 1984, a retrovirus vector system was designed that could efficiently insert foreign genes into mammalian chromosomes.[158]
1990s
[edit]The first approved gene therapy clinical research in the US took place on 14 September 1990, at the National Institutes of Health (NIH), under the direction of William French Anderson.[159] Four-year-old Ashanti DeSilva received treatment for a genetic defect that left her with adenosine deaminase deficiency (ADA-SCID), a severe immune system deficiency. The defective gene of the patient's blood cells was replaced by the functional variant. Ashanti's immune system was partially restored by the therapy. Production of the missing enzyme was temporarily stimulated, but the new cells with functional genes were not generated. She led a normal life only with the regular injections performed every two months. The effects were successful, but temporary.[160]
Cancer gene therapy was introduced in 1992/93 (Trojan et al. 1993).[161] The treatment of glioblastoma multiforme, the malignant brain tumor whose outcome is always fatal, was done using a vector expressing antisense IGF-I RNA (clinical trial approved by NIH protocol no.1602 24 November 1993,[162] and by the FDA in 1994). This therapy also represents the beginning of cancer immunogene therapy, a treatment which proves to be effective due to the anti-tumor mechanism of IGF-I antisense, which is related to strong immune and apoptotic phenomena.
In 1992, Claudio Bordignon, working at the Vita-Salute San Raffaele University, performed the first gene therapy procedure using hematopoietic stem cells as vectors to deliver genes intended to correct hereditary diseases.[163] In 2002, this work led to the publication of the first successful gene therapy treatment for ADA-SCID. The success of a multi-center trial for treating children with SCID (severe combined immune deficiency or "bubble boy" disease) from 2000 and 2002, was questioned when two of the ten children treated at the trial's Paris center developed a leukemia-like condition. Clinical trials were halted temporarily in 2002, but resumed after regulatory review of the protocol in the US, the United Kingdom, France, Italy, and Germany.[164]
In 1993, Andrew Gobea was born with SCID following prenatal genetic screening. Blood was removed from his mother's placenta and umbilical cord immediately after birth, to acquire stem cells. The allele that codes for adenosine deaminase (ADA) was obtained and inserted into a retrovirus. Retroviruses and stem cells were mixed, after which the viruses inserted the gene into the stem cell chromosomes. Stem cells containing the working ADA gene were injected into Andrew's blood. Injections of the ADA enzyme were also given weekly. For four years T cells (white blood cells), produced by stem cells, made ADA enzymes using the ADA gene. After four years more treatment was needed.[165]
In 1996, Luigi Naldini and Didier Trono developed a new class of gene therapy vectors based on HIV capable of infecting non-dividing cells that have since then been widely used in clinical and research settings, pioneering lentivirals vector in gene therapy.[166]
Jesse Gelsinger's death in 1999 impeded gene therapy research in the US.[167][168] As a result, the FDA suspended several clinical trials pending the reevaluation of ethical and procedural practices.[169]
2000s
[edit]The modified gene therapy strategy of antisense IGF-I RNA (NIH n˚ 1602)[162] using antisense / triple helix anti-IGF-I approach was registered in 2002, by Wiley gene therapy clinical trial - n˚ 635 and 636. The approach has shown promising results in the treatment of six different malignant tumors: glioblastoma, cancers of liver, colon, prostate, uterus, and ovary (Collaborative NATO Science Programme on Gene Therapy USA, France, Poland n˚ LST 980517 conducted by J. Trojan) (Trojan et al., 2012). This anti-gene antisense/triple helix therapy has proven to be efficient, due to the mechanism stopping simultaneously IGF-I expression on translation and transcription levels, strengthening anti-tumor immune and apoptotic phenomena.
2002
[edit]Sickle cell disease can be treated in mice.[170] The mice – which have essentially the same defect that causes human cases – used a viral vector to induce production of fetal hemoglobin (HbF), which normally ceases to be produced shortly after birth. In humans, the use of hydroxyurea to stimulate the production of HbF temporarily alleviates sickle cell symptoms. The researchers demonstrated this treatment to be a more permanent means to increase therapeutic HbF production.[171]
A new gene therapy approach repaired errors in messenger RNA derived from defective genes. This technique has the potential to treat thalassaemia, cystic fibrosis and some cancers.[172]
Researchers created liposomes 25 nanometers across that can carry therapeutic DNA through pores in the nuclear membrane.[173]
2003
[edit]In 2003, a research team inserted genes into the brain for the first time. They used liposomes coated in a polymer called polyethylene glycol, which unlike viral vectors, are small enough to cross the blood–brain barrier.[174]
Short pieces of double-stranded RNA (short, interfering RNAs or siRNAs) are used by cells to degrade RNA of a particular sequence. If a siRNA is designed to match the RNA copied from a faulty gene, then the abnormal protein product of that gene will not be produced.[175]
Gendicine is a cancer gene therapy that delivers the tumor suppressor gene p53 using an engineered adenovirus. In 2003, it was approved in China for the treatment of head and neck squamous cell carcinoma.[31]
2006
[edit]In March, researchers announced the successful use of gene therapy to treat two adult patients for X-linked chronic granulomatous disease, a disease which affects myeloid cells and damages the immune system. The study is the first to show that gene therapy can treat the myeloid system.[176]
In May, a team reported a way to prevent the immune system from rejecting a newly delivered gene.[177] Similar to organ transplantation, gene therapy has been plagued by this problem. The immune system normally recognizes the new gene as foreign and rejects the cells carrying it. The research utilized a newly uncovered network of genes regulated by molecules known as microRNAs. This natural function selectively obscured their therapeutic gene in immune system cells and protected it from discovery. Mice infected with the gene containing an immune-cell microRNA target sequence did not reject the gene.
In August, scientists successfully treated metastatic melanoma in two patients using killer T cells genetically retargeted to attack the cancer cells.[178]
In November, researchers reported on the use of VRX496, a gene-based immunotherapy for the treatment of HIV that uses a lentiviral vector to deliver an antisense gene against the HIV envelope. In a phase I clinical trial, five subjects with chronic HIV infection who had failed to respond to at least two antiretroviral regimens were treated. A single intravenous infusion of autologous CD4 T cells genetically modified with VRX496 was well tolerated. All patients had stable or decreased viral load; four of the five patients had stable or increased CD4 T cell counts. All five patients had stable or increased immune response to HIV antigens and other pathogens. This was the first evaluation of a lentiviral vector administered in a US human clinical trial.[179][180]
2007
[edit]In May, researchers announced the first gene therapy trial for inherited retinal disease. The first operation was carried out on a 23-year-old British male, Robert Johnson, in early 2007.[181]
2008
[edit]Leber's congenital amaurosis is an inherited blinding disease caused by mutations in the RPE65 gene. The results of a small clinical trial in children were published in April.[17] Delivery of recombinant adeno-associated virus (AAV) carrying RPE65 yielded positive results. In May, two more groups reported positive results in independent clinical trials using gene therapy to treat the condition. In all three clinical trials, patients recovered functional vision without apparent side-effects.[17][18][19][20]
2009
[edit]In September researchers were able to give trichromatic vision to squirrel monkeys.[182] In November 2009, researchers halted a fatal genetic disorder called adrenoleukodystrophy in two children using a lentivirus vector to deliver a functioning version of ABCD1, the gene that is mutated in the disorder.[183]
2010s
[edit]2010
[edit]An April paper reported that gene therapy addressed achromatopsia (color blindness) in dogs by targeting cone photoreceptors. Cone function and day vision were restored for at least 33 months in two young specimens. The therapy was less efficient for older dogs.[184]
In September it was announced that an 18-year-old male patient in France with beta thalassemia major had been successfully treated.[185] Beta thalassemia major is an inherited blood disease in which beta haemoglobin is missing and patients are dependent on regular lifelong blood transfusions.[186] The technique used a lentiviral vector to transduce the human β-globin gene into purified blood and marrow cells obtained from the patient in June 2007.[187] The patient's haemoglobin levels were stable at 9 to 10 g/dL. About a third of the hemoglobin contained the form introduced by the viral vector and blood transfusions were not needed.[187][188] Further clinical trials were planned.[189] Bone marrow transplants are the only cure for thalassemia, but 75% of patients do not find a matching donor.[188]
Cancer immunogene therapy using modified antigene, antisense/triple helix approach was introduced in South America in 2010/11 in La Sabana University, Bogota (Ethical Committee 14 December 2010, no P-004-10). Considering the ethical aspect of gene diagnostic and gene therapy targeting IGF-I, the IGF-I expressing tumors i.e. lung and epidermis cancers were treated (Trojan et al. 2016).[190][191]
2011
[edit]In 2007 and 2008, a man (Timothy Ray Brown) was cured of HIV by repeated hematopoietic stem cell transplantation (see also allogeneic stem cell transplantation, allogeneic bone marrow transplantation, allotransplantation) with double-delta-32 mutation which disables the CCR5 receptor. This cure was accepted by the medical community in 2011.[192] It required complete ablation of existing bone marrow, which is very debilitating.[193]
In August two of three subjects of a pilot study were confirmed to have been cured from chronic lymphocytic leukemia (CLL). The therapy used genetically modified T cells to attack cells that expressed the CD19 protein to fight the disease.[26] In 2013, the researchers announced that 26 of 59 patients had achieved complete remission and the original patient had remained tumor-free.[194]
Human HGF plasmid DNA therapy of cardiomyocytes is being examined as a potential treatment for coronary artery disease as well as treatment for the damage that occurs to the heart after myocardial infarction.[195][196]
In 2011, Neovasculgen was registered in Russia as the first-in-class gene-therapy drug for treatment of peripheral artery disease, including critical limb ischemia; it delivers the gene encoding for VEGF.[32] Neovasculogen is a plasmid encoding the CMV promoter and the 165 amino acid form of VEGF.[197][198]
2012
[edit]The FDA approved Phase I clinical trials on thalassemia major patients in the US for 10 participants in July.[199] The study was expected to continue until 2015.[189]
In July 2012, the European Medicines Agency recommended approval of a gene therapy treatment for the first time in either Europe or the United States. The treatment used Alipogene tiparvovec (Glybera) to compensate for lipoprotein lipase deficiency, which can cause severe pancreatitis.[200] The recommendation was endorsed by the European Commission in November 2012,[16][33][201][202] and commercial rollout began in late 2014.[203] Alipogene tiparvovec was expected to cost around $1.6 million per treatment in 2012,[204] revised to $1 million in 2015,[205] making it the most expensive medicine in the world at the time.[206] As of 2016[update], only the patients treated in clinical trials and a patient who paid the full price for treatment have received the drug.[207]
In December 2012, it was reported that 10 of 13 patients with multiple myeloma were in remission "or very close to it" three months after being injected with a treatment involving genetically engineered T cells to target proteins NY-ESO-1 and LAGE-1, which exist only on cancerous myeloma cells.[28]
2013
[edit]In March researchers reported that three of five adult subjects who had acute lymphocytic leukemia (ALL) had been in remission for five months to two years after being treated with genetically modified T cells which attacked cells with CD19 genes on their surface, i.e. all B cells, cancerous or not. The researchers believed that the patients' immune systems would make normal T cells and B cells after a couple of months. They were also given bone marrow. One patient relapsed and died and one died of a blood clot unrelated to the disease.[27]
Following encouraging Phase I trials, in April, researchers announced they were starting Phase II clinical trials (called CUPID2 and SERCA-LVAD) on 250 patients[208] at several hospitals to combat heart disease. The therapy was designed to increase the levels of SERCA2, a protein in heart muscles, improving muscle function.[209] The U.S. Food and Drug Administration (FDA) granted this a breakthrough therapy designation to accelerate the trial and approval process.[210] In 2016, it was reported that no improvement was found from the CUPID 2 trial.[211]
In July researchers reported promising results for six children with two severe hereditary diseases had been treated with a partially deactivated lentivirus to replace a faulty gene and after 7–32 months. Three of the children had metachromatic leukodystrophy, which causes children to lose cognitive and motor skills.[212] The other children had Wiskott–Aldrich syndrome, which leaves them to open to infection, autoimmune diseases, and cancer.[213] Follow up trials with gene therapy on another six children with Wiskott–Aldrich syndrome were also reported as promising.[214][215]
In October researchers reported that two children born with adenosine deaminase severe combined immunodeficiency disease (ADA-SCID) had been treated with genetically engineered stem cells 18 months previously and that their immune systems were showing signs of full recovery. Another three children were making progress.[24] In 2014, a further 18 children with ADA-SCID were cured by gene therapy.[216] ADA-SCID children have no functioning immune system and are sometimes known as "bubble children".[24]
Also in October researchers reported that they had treated six people with haemophilia in early 2011 using an adeno-associated virus. Over two years later all six were producing clotting factor.[24][217]
2014
[edit]In January researchers reported that six choroideremia patients had been treated with adeno-associated virus with a copy of REP1. Over a six-month to two-year period all had improved their sight.[66][218] By 2016, 32 patients had been treated with positive results and researchers were hopeful the treatment would be long-lasting.[21] Choroideremia is an inherited genetic eye disease with no approved treatment, leading to loss of sight.
In March researchers reported that 12 HIV patients had been treated since 2009 in a trial with a genetically engineered virus with a rare mutation (CCR5 deficiency) known to protect against HIV with promising results.[219][220]
Clinical trials of gene therapy for sickle cell disease were started in 2014.[221][222]
In February LentiGlobin BB305, a gene therapy treatment undergoing clinical trials for treatment of beta thalassemia gained FDA "breakthrough" status after several patients were able to forgo the frequent blood transfusions usually required to treat the disease.[223]
In March researchers delivered a recombinant gene encoding a broadly neutralizing antibody into monkeys infected with simian HIV; the monkeys' cells produced the antibody, which cleared them of HIV. The technique is named immunoprophylaxis by gene transfer (IGT). Animal tests for antibodies to ebola, malaria, influenza, and hepatitis were underway.[224][225]
In March, scientists, including an inventor of CRISPR, Jennifer Doudna, urged a worldwide moratorium on germline gene therapy, writing "scientists should avoid even attempting, in lax jurisdictions, germline genome modification for clinical application in humans" until the full implications "are discussed among scientific and governmental organizations".[147][148][149][150]
In December, scientists of major world academies called for a moratorium on inheritable human genome edits, including those related to CRISPR-Cas9 technologies[226] but that basic research including embryo gene editing should continue.[227]
2015
[edit]Researchers successfully treated a boy with epidermolysis bullosa using skin grafts grown from his own skin cells, genetically altered to repair the mutation that caused his disease.[228]
In November, researchers announced that they had treated a baby girl, Layla Richards, with an experimental treatment using donor T cells genetically engineered using TALEN to attack cancer cells. One year after the treatment she was still free of her cancer (a highly aggressive form of acute lymphoblastic leukaemia [ALL]).[229] Children with highly aggressive ALL normally have a very poor prognosis and Layla's disease had been regarded as terminal before the treatment.[230][231]
2016
[edit]In April the Committee for Medicinal Products for Human Use of the European Medicines Agency endorsed a gene therapy treatment called Strimvelis[232][233] and the European Commission approved it in June.[234] This treats children born with adenosine deaminase deficiency and who have no functioning immune system. This was the second gene therapy treatment to be approved in Europe.[235]
In October, Chinese scientists reported they had started a trial to genetically modify T cells from 10 adult patients with lung cancer and reinject the modified T cells back into their bodies to attack the cancer cells. The T cells had the PD-1 protein (which stops or slows the immune response) removed using CRISPR-Cas9.[236][237]
A 2016 Cochrane systematic review looking at data from four trials on topical cystic fibrosis transmembrane conductance regulator (CFTR) gene therapy does not support its clinical use as a mist inhaled into the lungs to treat cystic fibrosis patients with lung infections. One of the four trials did find weak evidence that liposome-based CFTR gene transfer therapy may lead to a small respiratory improvement for people with CF. This weak evidence is not enough to make a clinical recommendation for routine CFTR gene therapy.[238]
2017
[edit]In February Kite Pharma announced results from a clinical trial of CAR-T cells in around a hundred people with advanced non-Hodgkin lymphoma.[239]
In March, French scientists reported on clinical research of gene therapy to treat sickle cell disease.[240]
In August, the FDA approved tisagenlecleucel for acute lymphoblastic leukemia.[241] Tisagenlecleucel is an adoptive cell transfer therapy for B-cell acute lymphoblastic leukemia; T cells from a person with cancer are removed, genetically engineered to make a specific T-cell receptor (a chimeric T cell receptor, or "CAR-T") that reacts to the cancer, and are administered back to the person. The T cells are engineered to target a protein called CD19 that is common on B cells. This is the first form of gene therapy to be approved in the United States. In October, a similar therapy called axicabtagene ciloleucel was approved for non-Hodgkin lymphoma.[242]
In October, biophysicist and biohacker Josiah Zayner claimed to have performed the very first in-vivo human genome editing in the form of a self-administered therapy.[243][244]
On 13 November, medical scientists working with Sangamo Therapeutics, headquartered in Richmond, California, announced the first ever in-body human gene editing therapy.[245][246] The treatment, designed to permanently insert a healthy version of the flawed gene that causes Hunter syndrome, was given to 44-year-old Brian Madeux and is part of the world's first study to permanently edit DNA inside the human body.[247] The success of the gene insertion was later confirmed.[248][249] Clinical trials by Sangamo involving gene editing using zinc finger nuclease (ZFN) are ongoing.[250]
In December the results of using an adeno-associated virus with blood clotting factor VIII to treat nine haemophilia A patients were published. Six of the seven patients on the high dose regime increased the level of the blood clotting VIII to normal levels. The low and medium dose regimes had no effect on the patient's blood clotting levels.[251][252]
In December, the FDA approved Luxturna, the first in vivo gene therapy, for the treatment of blindness due to Leber's congenital amaurosis.[253] The price of this treatment is US$850,000 for both eyes.[254][255]
2019
[edit]In May, the FDA approved onasemnogene abeparvovec (Zolgensma) for treating spinal muscular atrophy in children under two years of age. The list price of Zolgensma was set at US$2.125 million per dose, making it the most expensive drug ever.[256]
In May, the EMA approved betibeglogene autotemcel (Zynteglo) for treating beta thalassemia for people twelve years of age and older.[257][258]
In July, Allergan and Editas Medicine announced phase I/II clinical trial of AGN-151587 for the treatment of Leber congenital amaurosis 10.[259] This is the first study of a CRISPR-based in vivo human gene editing therapy, where the editing takes place inside the human body.[260] The first injection of the CRISPR-Cas System was confirmed in March 2020.[261]
2020s
[edit]2020
[edit]In May, onasemnogene abeparvovec (Zolgensma) was approved by the European Union for the treatment of spinal muscular atrophy in people who either have clinical symptoms of SMA type 1 or who have no more than three copies of the SMN2 gene, irrespective of body weight or age.[262]
In August, Audentes Therapeutics reported that three out of 17 children with X-linked myotubular myopathy participating the clinical trial of a AAV8-based gene therapy treatment AT132 have died. It was suggested that the treatment, whose dosage is based on body weight, exerts a disproportionately toxic effect on heavier patients, since the three patients who died were heavier than the others.[263][264] The trial has been put on clinical hold.[265]
On 15 October, the Committee for Medicinal Products for Human Use (CHMP) of the European Medicines Agency (EMA) adopted a positive opinion, recommending the granting of a marketing authorisation for the medicinal product Libmeldy (autologous CD34+ cell enriched population that contains hematopoietic stem and progenitor cells transduced ex vivo using a lentiviral vector encoding the human arylsulfatase A gene), a gene therapy for the treatment of children with the "late infantile" (LI) or "early juvenile" (EJ) forms of metachromatic leukodystrophy (MLD).[266] The active substance of Libmeldy consists of the child's own stem cells which have been modified to contain working copies of the ARSA gene.[266] When the modified cells are injected back into the patient as a one-time infusion, the cells are expected to start producing the ARSA enzyme that breaks down the build-up of sulfatides in the nerve cells and other cells of the patient's body.[267] Libmeldy was approved for medical use in the EU in December 2020.[268]
On 15 October, Lysogene, a French biotechnological company, reported the death of a patient in who has received LYS-SAF302, an experimental gene therapy treatment for mucopolysaccharidosis type IIIA (Sanfilippo syndrome type A).[269]
2021
[edit]In May, a new method using an altered version of HIV as a lentivirus vector was reported in the treatment of 50 children with ADA-SCID obtaining positive results in 48 of them,[270][271][272] this method is expected to be safer than retroviruses vectors commonly used in previous studies of SCID where the development of leukemia was usually observed[273] and had already been used in 2019, but in a smaller group with X-SCID.[274][275][276][277]
In June a clinical trial on six patients affected with transthyretin amyloidosis reported a reduction the concentration of missfolded transthretin (TTR) protein in serum through CRISPR-based inactivation of the TTR gene in liver cells observing mean reductions of 52% and 87% among the lower and higher dose groups.This was done in vivo without taking cells out of the patient to edit them and reinfuse them later.[278][279][280]
In July results of a small gene therapy phase I study was published reporting observation of dopamine restoration on seven patients between 4 and 9 years old affected by aromatic L-amino acid decarboxylase deficiency (AADC deficiency).[281][282][283]
2022
[edit]In February, the first ever gene therapy for Tay–Sachs disease was announced, it uses an adeno-associated virus to deliver the correct instruction for the HEXA gene on brain cells which causes the disease. Only two children were part of a compassionate trial presenting improvements over the natural course of the disease and no vector-related adverse events.[284][285][286]
In May, eladocagene exuparvovec is recommended for approval by the European Commission.[287][288]
In July results of a gene therapy candidate for haemophilia B called FLT180 were announced, it works using an adeno-associated virus (AAV) to restore the clotting factor IX (FIX) protein, normal levels of the protein were observed with low doses of the therapy but immunosuppression was necessitated to decrease the risk of vector-related immune responses.[289][290][291]
In December, a 13-year girl that had been diagnosed with T-cell acute lymphoblastic leukaemia was successfully treated at Great Ormond Street Hospital (GOSH) in the first documented use of therapeutic gene editing for this purpose, after undergoing six months of an experimental treatment, where all attempts of other treatments failed. The procedure included reprogramming a healthy T-cell to destroy the cancerous T-cells to first rid her of leukaemia, and then rebuilding her immune system using healthy immune cells.[292] The GOSH team used BASE editing and had previously treated a case of acute lymphoblastic leukaemia in 2015 using TALENs.[231]
2023
[edit]In May the FDA approved Vyjuvek for the treatment of wounds in patients with dystrophic epidermolysis bullosa (DEB) which is applied as a topical gel that delivers a herpes-simplex virus type 1 (HSV-1) vector encoding the collagen type VII alpha 1 chain (COL7A1) gene that is dysfunctional on those affected by DEB . One trial found 65% of the Vyjuvek-treated wounds completely closed while only 26% of the placebo-treated at 24 weeks.[95] It has been also reported its use as a eyedrops for a patient with DEB that had vision loss due to the widespread blistering with good results.[293]
In June the FDA gave an accelerated approval to Elevidys for Duchenne muscular dystrophy (DMD) only for boys 4 to 5 years old as they are more likely to benefit from the therapy which consists of one-time intravenous infusion of a virus (AAV rh74 vector) that delivers a functioning “microdystrophin” gene (138 kDa) into the muscle cells to act in place of the normal dystrophin (427 kDa) that is found mutated in this disease.[100]
In July it was reported that it had been developed a new method to affect genetic expressions through direct current.[294]
List of gene therapies
[edit]- Gene therapy for color blindness
- Gene therapy for epilepsy
- Gene therapy for osteoarthritis
- Gene therapy in Parkinson's disease
- Gene therapy of the human retina
Gene therapies are under development for:
- Usher syndrome deafness
- Otoferlin mutation deafness
References
[edit]- ^ Kaji EH, Leiden JM (February 2001). "Gene and stem cell therapies". JAMA. 285 (5): 545–550. doi:10.1001/jama.285.5.545. PMID 11176856.
- ^ Ermak G (2015). Emerging Medical Technologies. World Scientific. ISBN 978-981-4675-81-9.
- ^ Research, Center for Biologics Evaluation and (9 December 2020). "What is Gene Therapy?". FDA.
- ^ Розенберг С.А., Эберсолд П., Корнетта К., Касид А., Морган Р.А., Моен Р. и др. (август 1990 г.). «Перенос генов человеку - иммунотерапия пациентов с прогрессирующей меланомой с использованием проникающих в опухоль лимфоцитов, модифицированных трансдукцией ретровирусных генов» . Медицинский журнал Новой Англии . 323 (9): 570–578. дои : 10.1056/NEJM199008303230904 . ПМИД 2381442 .
- ^ Перейти обратно: а б «Всемирная база данных клинических испытаний генной терапии» . Журнал генной медицины . Уайли. Июнь 2016. Архивировано из оригинала 31 июля 2020 года.
- ^ Горелл Э., Нгуен Н., Лейн А., Сипрашвили З. (апрель 2014 г.). «Генная терапия заболеваний кожи» . Перспективы Колд-Спринг-Харбора в медицине . 4 (4): а015149. doi : 10.1101/cshperspect.a015149 . ПМЦ 3968787 . ПМИД 24692191 .
- ^ Циммер С (16 сентября 2013 г.). «Двойной дубль ДНК» . Нью-Йорк Таймс . Архивировано из оригинала 2 января 2022 года.
- ^ «Некролог Лоррейн Краус» . Коммерческий призыв . Проверено 7 июля 2023 г.
- ^ «Генная терапия» . WhatIsBiotechnology.org . Фонд образования в области биотехнологии и медицины (Биотехмет) . Проверено 7 июля 2023 г.
- ^ Конгресс США, Управление по оценке технологий (декабрь 1984 г.). Генная терапия человека – Справочный документ . Издательство ДИАНА. ISBN 978-1-4289-2371-3 .
- ^ Сунь М (октябрь 1982 г.). «Мартин Клайн проигрывает апелляцию по гранту НИЗ». Наука . 218 (4567): 37. Бибкод : 1982Sci...218...37S . дои : 10.1126/science.7123214 . ПМИД 7123214 .
- ^ Ловенштейн PR (2008). «Генная терапия неврологических расстройств: новые методы лечения или эксперименты на людях?» . В Берли Дж., Харрис Дж. (ред.). Компаньон генетики . Джон Уайли и сыновья. ISBN 978-0-470-75637-9 .
- ^ Перейти обратно: а б Шеридан С. (февраль 2011 г.). «Генная терапия находит свою нишу». Природная биотехнология . 29 (2): 121–128. дои : 10.1038/nbt.1769 . ПМИД 21301435 . S2CID 5063701 .
- ^ О'Мэлли BW, Ледли FD (октябрь 1993 г.). «Соматическая генная терапия. Методы настоящего и будущего». Арка Отоларингол Хирургия головы и шеи . 119 (10): 1100–7. дои : 10.1001/archotol.1993.01880220044007 . ПМИД 8398061 .
- ^ Олдфилд Э.Х., Рэм З., Калвер К.В., Блез Р.М., ДеВрум Х.Л., Андерсон В.Ф. (февраль 1993 г.). «Генная терапия для лечения опухолей головного мозга с использованием внутриопухолевой трансдукции геном тимидинкиназы и внутривенного введения ганцикловира». Генная терапия человека . 4 (1): 39–69. дои : 10.1089/hum.1993.4.1-39 . ПМИД 8384892 .
- ^ Перейти обратно: а б с Ричардс С. (6 ноября 2012 г.). «Генная терапия приходит в Европу» . Ученый .
- ^ Перейти обратно: а б с д Магуайр А.М., Симонелли Ф., Пирс Э.А., Пью Э.Н., Мингоцци Ф., Бенничелли Дж. и др. (май 2008 г.). «Безопасность и эффективность переноса генов при врожденном амаврозе Лебера» . Медицинский журнал Новой Англии . 358 (21): 2240–2248. doi : 10.1056/NEJMoa0802315 . ПМЦ 2829748 . ПМИД 18441370 .
- ^ Перейти обратно: а б Симонелли Ф., Магуайр А.М., Теста Ф., Пирс Э.А., Мингоцци Ф., Бенничелли Дж.Л. и др. (март 2010 г.). «Генная терапия врожденного амавроза Лебера безопасна и эффективна в течение 1,5 лет после введения вектора» . Молекулярная терапия . 18 (3): 643–650. дои : 10.1038/mt.2009.277 . ПМЦ 2839440 . ПМИД 19953081 .
- ^ Перейти обратно: а б Сидециан А.В., Хаусвирт В.В., Алеман Т.С., Каушал С., Шварц С.Б., Бойе С.Л., Виндзор Э.А., Конлон Т.Дж., Сумарока А., Роман А.Дж., Бирн Б.Дж., Джейкобсон С.Г. (август 2009 г.). «Зрение через 1 год после генной терапии врожденного амавроза Лебера» . Медицинский журнал Новой Англии . 361 (7): 725–727. дои : 10.1056/NEJMc0903652 . ПМЦ 2847775 . ПМИД 19675341 .
- ^ Перейти обратно: а б Бейнбридж Дж.В., Смит А.Дж., Баркер С.С., Робби С., Хендерсон Р., Балагган К. и др. (май 2008 г.). «Влияние генной терапии на зрительную функцию при врожденном амаврозе Лебера». Медицинский журнал Новой Англии . 358 (21): 2231–2239. doi : 10.1056/NEJMoa0802268 . hdl : 10261/271174 . ПМИД 18441371 .
- ^ Перейти обратно: а б Гош П. (28 апреля 2016 г.). «Генная терапия обращает вспять потерю зрения и действует надолго» . Новости BBC онлайн . Проверено 29 апреля 2016 г.
- ^ Фишер А., Хасейн-Бей-Абина С., Каваццана-Кальво М. (июнь 2010 г.). «20 лет генной терапии ТКИН». Природная иммунология . 11 (6): 457–460. дои : 10.1038/ni0610-457 . ПМИД 20485269 . S2CID 11300348 .
- ^ Ферруа Ф, Бригида I, Аюти А (декабрь 2010 г.). «Обновленная информация о генной терапии тяжелого комбинированного иммунодефицита с дефицитом аденозиндезаминазы». Современное мнение в области аллергии и клинической иммунологии . 10 (6): 551–556. doi : 10.1097/ACI.0b013e32833fea85 . ПМИД 20966749 . S2CID 205435278 .
- ^ Перейти обратно: а б с д и Геддес Л. (30 октября 2013 г.). « Успех «ребенка-пузыря» возвращает генную терапию в нужное русло» . Новый учёный . Проверено 2 января 2022 г.
- ^ Картье Н., Обур П. (июль 2010 г.). «Трансплантация гемопоэтических стволовых клеток и генная терапия гемопоэтическими стволовыми клетками при Х-сцепленной адренолейкодистрофии» . Патология головного мозга . 20 (4): 857–862. дои : 10.1111/j.1750-3639.2010.00394.x . ПМЦ 8094635 . ПМИД 20626747 . S2CID 24182017 .
- ^ Перейти обратно: а б Ледфорд Х (2011). «Клеточная терапия борется с лейкемией». Природа . дои : 10.1038/news.2011.472 .
- ^ Перейти обратно: а б Коглан А. (26 марта 2013 г.). «Генная терапия лечит лейкемию за восемь дней» . Новый учёный . Проверено 15 апреля 2013 г.
- ^ Перейти обратно: а б Коглан А. (11 декабря 2013 г.). «Усиленные иммунные клетки приводят к ремиссии лейкемии» . Новый учёный . Проверено 15 апреля 2013 г.
- ^ Левитт П.А., Резай А.Р., Лихи М.А., Оджеманн С.Г., Флаэрти А.В., Эскандар Э.Н. и др. (апрель 2011 г.). «Генная терапия AAV2-GAD при прогрессирующей болезни Паркинсона: двойное слепое рандомизированное исследование, контролируемое ложной хирургической операцией». «Ланцет». Неврология . 10 (4): 309–319. дои : 10.1016/S1474-4422(11)70039-4 . ПМИД 21419704 . S2CID 37154043 .
- ^ Герпер М. (26 марта 2014 г.). «Большое возвращение генной терапии» . Форбс . Проверено 28 апреля 2014 г.
- ^ Перейти обратно: а б Пирсон С., Цзя Х., Кандачи К. (январь 2004 г.). «Китай одобряет первую генную терапию» . Природная биотехнология . 22 (1): 3–4. дои : 10.1038/nbt0104-3 . ПМК 7097065 . ПМИД 14704685 .
- ^ Перейти обратно: а б «Одобрена генная терапия при ЗПА» . 6 декабря 2011 года . Проверено 5 августа 2015 г.
- ^ Перейти обратно: а б с Галлахер Дж. (2 ноября 2012 г.). «Генная терапия: Glybera одобрена Европейской Комиссией» . Новости Би-би-си . Проверено 15 декабря 2012 г.
- ^ «Что такое генная терапия?» . Домашний справочник по генетике . 28 марта 2016 г. Архивировано из оригинала 6 апреля 2016 г. Проверено 2 января 2022 г.
- ^ «Как работает генная терапия?» . Домашний справочник по геномике . Национальная медицинская библиотека США.
- ^ Пеццоли Д., Кьеза Р., Де Нардо Л., Кандиани Дж. (сентябрь 2012 г.). «Нам еще предстоит пройти долгий путь до эффективной доставки генов!». Журнал прикладных биоматериалов и функциональных материалов . 10 (2): 82–91. дои : 10.5301/JABFM.2012.9707 . ПМИД 23015375 . S2CID 6283455 .
- ^ Ваннуччи Л., Лай М., Кьюппези Ф., Чеккерини-Нелли Л., Пистелло М. (январь 2013 г.). «Вирусные векторы: взгляд назад и вперед на технологию переноса генов». Новая микробиология . 36 (1): 1–22. ПМИД 23435812 .
- ^ Готелф А., Гейл Дж. (ноябрь 2012 г.). «Что вам всегда нужно было знать о ДНК-вакцинах на основе электропорации» . Человеческие вакцины и иммунотерапия . 8 (11): 1694–1702. дои : 10.4161/hv.22062 . ПМК 3601144 . ПМИД 23111168 .
- ^ Урнов Ф.Д., Ребар Э.Дж., Холмс М.К., Чжан Х.С., Грегори П.Д. (сентябрь 2010 г.). «Редактирование генома с помощью модифицированных нуклеаз с цинковыми пальцами». Обзоры природы Генетика . 11 (9): 636–646. дои : 10.1038/nrg2842 . ПМИД 20717154 . S2CID 205484701 .
- ^ Перейти обратно: а б Бак Р.О., Гомес-Оспина Н., Портеус М.Х. (август 2018 г.). «Редактирование генов в центре внимания». Тенденции в генетике . 34 (8): 600–611. дои : 10.1016/j.tig.2018.05.004 . ПМИД 29908711 . S2CID 49269023 .
- ^ Стоун Д., Нийонзима Н., Джером КР (сентябрь 2016 г.). «Редактирование генома и противовирусная терапия нового поколения» . Генетика человека . 135 (9): 1071–82. дои : 10.1007/s00439-016-1686-2 . ПМЦ 5002242 . ПМИД 27272125 .
- ^ Кросс Д., Бурместер Дж.К. (сентябрь 2006 г.). «Генная терапия для лечения рака: прошлое, настоящее и будущее» . Клиническая медицина и исследования . 4 (3): 218–27. дои : 10.3121/cmr.4.3.218 . ПМК 1570487 . ПМИД 16988102 .
- ^ Медер М.Л., Герсбах, Калифорния (март 2016 г.). «Технологии редактирования генома для генной и клеточной терапии» . Молекулярная терапия . 24 (3): 430–46. дои : 10.1038/mt.2016.10 . ПМЦ 4786923 . ПМИД 26755333 .
- ^ «Испытания показывают, что ученые впервые осуществили редактирование генов «в организме» . АП НОВОСТИ . 7 февраля 2019 года . Проверено 17 ноября 2020 г.
- ^ «Первая дозировка CRISPR-терапии» . Природная биотехнология . 38 (4): 382. 1 апреля 2020 г. doi : 10.1038/s41587-020-0493-4 . ISSN 1546-1696 . PMID 32265555 . S2CID 215406440 .
- ^ Перейти обратно: а б Шерков Дж.С., Зеттлер П.Дж., Грили Х.Т. (декабрь 2018 г.). «Это «генная терапия»?» . Журнал права и биологических наук . 5 (3): 786–793. дои : 10.1093/jlb/lsy020 . ПМК 6534757 . ПМИД 31143463 .
- ^ Асале А., Чжоу Дж., Рахманян Н. (ноябрь 2022 г.). « Письмо в редакцию: урок на будущее — Как семантическая неоднозначность привела к распространению антинаучных взглядов на мРНК-вакцины от COVID-19» . Генная терапия человека . 33 (21–22): 1213–1216. doi : 10.1089/hum.2022.29223.aas (неактивен 31 января 2024 г.). ПМИД 36375123 .
{{cite journal}}: CS1 maint: DOI неактивен по состоянию на январь 2024 г. ( ссылка ) - ^ «Эндрю Бриджен неправильно называл мРНК-вакцины генной терапией» . Полный факт . 12 января 2023 г. Проверено 19 февраля 2023 г.
- ^ «Вакцины Fact Check-mRNA отличаются от генной терапии, которая изменяет гены реципиента» . Рейтер . 10 августа 2021 г. Проверено 19 февраля 2023 г.
- ^ «Джо Роган ложно утверждает, что мРНК-вакцины — это «генная терапия» » . ПолитиФакт . Проверено 19 февраля 2023 г.
- ^ Спенсер С.Х. (28 июня 2022 г.). «Веб-сайт торгует старой, опровергнутой ложью о мРНК-вакцинах против COVID-19» . FactCheck.org . Проверено 19 февраля 2023 г.
- ^ «Эти эксперты говорят, что Джо Роган «чрезвычайно опасен» для общества – и вот почему» . Независимый . 2 февраля 2022 г. Проверено 19 февраля 2023 г.
- ^ «Ложные заявления депутата Эндрю Бриджена ставят под угрозу жизни людей» . Полный факт . 11 января 2023 г. Проверено 19 февраля 2023 г.
- ^ Перейти обратно: а б с д и Нобрега К., Мендонса Л., Матос К.А. (2020). Справочник по генной и клеточной терапии . Чам: Спрингер. ISBN 978-3-030-41333-0 . OCLC 1163431307 .
- ^ Уильямс Д.А., Оркин С.Х. (апрель 1986 г.). «Соматическая генная терапия. Современное состояние и перспективы» . Журнал клинических исследований . 77 (4): 1053–6. дои : 10.1172/JCI112403 . ПМЦ 424438 . ПМИД 3514670 .
- ^ Мавилио Ф, Феррари G (июль 2008 г.). «Генетическая модификация соматических стволовых клеток. Развитие, проблемы и перспективы новой терапевтической технологии» . Отчеты ЭМБО . 9 (Приложение 1): S64–69. дои : 10.1038/embor.2008.81 . ПМЦ 3327547 . ПМИД 18578029 .
- ^ Перейти обратно: а б с «Международное право» . Центр генетики и государственной политики Берманского института биоэтики при Университете Джонса Хопкинса. Архивировано 2010. 2 сентября 2014 года.
- ^ Страчнан Т., Рид AP (2004). Молекулярная генетика человека (3-е изд.). Издательство «Гирлянда». п. 616 . ISBN 978-0-8153-4184-0 .
- ^ Ханна К. (2006). «Перенос генов зародышевой линии» . Национальный институт исследования генома человека.
- ^ «Клонирование человека и генетическая модификация» . Ассоциация представителей репродуктивного здоровья. 2013. Архивировано из оригинала 18 июня 2013 года.
- ^ «Генная терапия» . ama-assn.org . 4 апреля 2014 г. Архивировано из оригинала 15 марта 2015 г. Проверено 22 марта 2015 г.
- ^ «Часто задаваемые вопросы по генной и клеточной терапии | ASGCT — Американское общество генной и клеточной терапии | ASGCT — Американское общество генной и клеточной терапии» . asgct.org . Проверено 23 июля 2021 г.
- ^ «Оценка клинического успеха генной терапии ex vivo и in vivo» . Журнал юных исследователей . Январь 2009 года . Проверено 23 июля 2021 г.
- ^ «Проблемы генной терапии» . Learn.genetics.utah.edu . Проверено 23 июля 2021 г.
- ^ Маллард А. (июнь 2020 г.). «Конвейер редактирования генов набирает обороты». Обзоры природы. Открытие наркотиков . 19 (6): 367–372. дои : 10.1038/d41573-020-00096-y . ПМИД 32415249 . S2CID 218657910 .
- ^ Перейти обратно: а б Макларен Р.Э., Гропп М., Барнард А.Р., Коттриалл С.Л., Толмачева Т., Сеймур Л., Кларк К.Р., Во время MJ, Кремерс Ф.П., Блэк GC, Лотери А.Дж., Даунс С.М., Вебстер А.Р., Сибра MC (март 2014 г.). «Генная терапия сетчатки у пациентов с хоридеремией: первые результаты клинического исследования фазы 1/2» . Ланцет . 383 (9923): 1129–1137. дои : 10.1016/S0140-6736(13)62117-0 . ПМК 4171740 . ПМИД 24439297 .
- ^ Девер Д.П., Бак Р.О., Рейниш А., Камарена Дж., Вашингтон Дж., Николас С.Э. и др. (ноябрь 2016 г.). «Нацеливание на ген CRISPR/Cas9 β-глобина в гемопоэтических стволовых клетках человека» . Природа . 539 (7629): 384–389. Бибкод : 2016Natur.539..384D . дои : 10.1038/nature20134 . ПМЦ 5898607 . ПМИД 27820943 .
- ^ Гупта Р.М., Мусунуру К. (октябрь 2014 г.). «Расширение набора инструментов генетического редактирования: ZFN, TALEN и CRISPR-Cas9» . Журнал клинических исследований . 124 (10): 4154–61. дои : 10.1172/JCI72992 . ПМК 4191047 . ПМИД 25271723 .
- ^ Санчес-да-Сильва Г.Н., Медейрос Л.Ф., Лима FM (21 августа 2019 г.). «Потенциальное использование системы CRISPR-Cas для генной терапии ВИЧ-1» . Международный журнал геномики . 2019 : 8458263. doi : 10.1155/2019/8458263 . ПМК 6721108 . ПМИД 31531340 .
- ^ Патент: US7824869B2.
- ^ Би А, Цуй Дж, Ма Ю.П., Ольшевская Е, Пу М, Дижоор А.М., Пан Ж. (апрель 2006 г.). «Эктопическая экспрессия родопсина микробного типа восстанавливает зрительные реакции у мышей с дегенерацией фоторецепторов» . Нейрон . 50 (1): 23–33. дои : 10.1016/j.neuron.2006.02.026 . ПМК 1459045 . ПМИД 16600853 .
- ^ Перейти обратно: а б Сун, Сянжун; Лю, Чао; Ван, Нин; Хуан, Хай; Он, Сиян; Гонг, Чанъян; Вэй, Юйцюань (1 января 2021 г.). «Поставка систем CRISPR/Cas для генной терапии и иммунотерапии рака» . Обзоры расширенной доставки лекарств . Доставка биомакромолекул для терапевтического редактирования генома. 168 : 158–180. дои : 10.1016/j.addr.2020.04.010 . ISSN 0169-409X . ПМИД 32360576 . S2CID 218493473 .
- ^ Найероссадат Н., Маеде Т., Али П.А. (2012). «Вирусные и невирусные системы доставки генов» . Передовые биомедицинские исследования . 1 (1): 27. дои : 10.4103/2277-9175.98152 . ПМК 3507026 . ПМИД 23210086 .
- ^ Перейти обратно: а б с д и ж Гинн С.Л., Амайя А.К., Александр И.Е., Эдельштейн М., Абеди М.Р. (май 2018 г.). «Клинические испытания генной терапии во всем мире до 2017 года: обновленная информация» . Журнал генной медицины . 20 (5): e3015. дои : 10.1002/jgm.3015 . ПМИД 29575374 . S2CID 4966300 .
- ^ Перейти обратно: а б Бульча Дж.Т., Ван Й., Ма Х., Тай П.В., Гао Дж. (февраль 2021 г.). «Платформы вирусных векторов в сфере генной терапии» . Сигнальная трансдукция и таргетная терапия . 6 (1): 53. дои : 10.1038/s41392-021-00487-6 . ПМЦ 7868676 . ПМИД 33558455 .
- ^ Дженсен, Томас Лет; Гётше, Каспер Рене; Уолдбай, Дэвид П.Д. (2021). «Текущие и будущие перспективы генной терапии редких генетических заболеваний, поражающих головной и спинной мозг» . Границы молекулярной нейронауки . 14 : 695937. doi : 10.3389/fnmol.2021.695937 . ISSN 1662-5099 . ПМЦ 8527017 . ПМИД 34690692 .
- ^ Манини А, Абати Е, Нуредини А, Корти С, Гран-при Коми (2022). «Генная терапия, опосредованная аденоассоциированным вирусом (AAV), при мышечной дистрофии Дюшенна: проблема персистенции трансгенов» . Границы в неврологии . 12 : 814174. doi : 10.3389/fneur.2021.814174 . ПМЦ 8797140 . ПМИД 35095747 .
- ^ Перейти обратно: а б с Сабатино Д.Е., Бушман Ф.Д., Чендлер Р.Дж., Кристал Р.Г., Дэвидсон Б.Л., Долметш Р. и др. (август 2022 г.). «Оценка состояния науки об интеграции аденоассоциированных вирусов: комплексный взгляд» . Молекулярная терапия . 30 (8): 2646–2663. дои : 10.1016/j.ymthe.2022.06.004 . ПМЦ 9372310 . ПМИД 35690906 .
- ^ Кампокьяро, Пенсильвания; Эйвери, Р.; Браун, DM; Хейер, Дж. С.; Хо, AC; Хаддлстон, С.М.; Яффе, Дж.Дж.; Ханани, AM; Пакола, С.; Пьерамичи, диджей; Вайкофф, CC; Ван Эверен, С. (2024). «Генная терапия неоваскулярной возрастной макулярной дегенерации путем субретинальной доставки RGX-314: исследование фазы 1/2а с увеличением дозы». Ланцет . 403 (10436): 1563–1573. дои : 10.1016/S0140-6736(24)00310-6 . ПМИД 38554726 .
- ^ Ханани, AM; Бойер, Д.С.; Вайкофф, CC; Реджило, CD; Басби, Б.Г.; Пьерамичи, Д.; Данциг, CJ; Джундеф, Британская Колумбия; Майор-младший, JC; Турпчу, А.; Кисс, С. (2024). «Безопасность и эффективность иксоберогена соропарвовека при неоваскулярной возрастной макулярной дегенерации в США (OPTIC): проспективное двухлетнее многоцентровое исследование фазы 1» . Электронная клиническая медицина . 67 . дои : 10.1016/j.eclinm.2023.102394 . ПМЦ 10751837 . ПМИД 38152412 .
- ^ Инь Х., Канасти Р.Л., Элтухи А.А., Вегас А.Дж., Доркин Дж.Р., Андерсон Д.Г. (август 2014 г.). «Невирусные векторы для генной терапии». Обзоры природы. Генетика . 15 (8): 541–555. дои : 10.1038/nrg3763 . ПМИД 25022906 . S2CID 15273455 .
- ^ Красильникова О.; Якимова А.; Иванов С.; Атиакшин Д.; Костин А.А.; Сосин Д.; Шегай, П.; Каприн А.Д.; Клабуков И. (2023). «Генно-активированные материалы в регенеративной стоматологии: описательный обзор технологий и результатов исследований» . Международный журнал молекулярных наук . 24 (22): 16250. doi : 10.3390/ijms242216250 . ISSN 1422-0067 . ПМЦ 10671237 . ПМИД 38003439 .
- ^ Фолдвари, М.; Чен, Д.В.; Нафиси, Н.; Кальдерон, Д.; Нарсинени, Л.; Рафи, А. (2016). «Невирусная генная терапия: преимущества и проблемы неинвазивных методов введения» . Журнал контролируемого выпуска . 240 : 165–190. дои : 10.1016/j.jconrel.2015.12.012 . ISSN 1873-4995 . ПМИД 26686079 .
- ^ Бертран Н., Гренье П., Махмуди М., Лима Э.М., Аппель Э.А., Дормон Ф. и др. (октябрь 2017 г.). «Механистическое понимание формирования белковой короны in vivo на полимерных наночастицах и влияние на фармакокинетику» . Природные коммуникации . 8 (1): 777. Бибкод : 2017NatCo...8..777B . дои : 10.1038/s41467-017-00600-w . ПМК 5626760 . ПМИД 28974673 .
- ^ Перейти обратно: а б с Госвами Р., Субраманиан Г., Силаева Л., Ньюкирк И., Доктор Д., Чавла К. и др. (24 апреля 2019 г.). «Генная терапия создает порочный круг» . Границы онкологии . 9 : 297. doi : 10.3389/fonc.2019.00297 . ПМК 6491712 . ПМИД 31069169 .
- ^ Вирт Т., Паркер Н., Юля-Херттуала С. (август 2013 г.). «История генной терапии». Джин . 525 (2): 162–169. дои : 10.1016/j.gene.2013.03.137 . ПМИД 23618815 .
- ^ Сингх В., Хан Н., Джаяндхаран Г.Р. (май 2022 г.). «Векторная инженерия, стратегии и цели в генной терапии рака». Генная терапия рака . 29 (5): 402–417. дои : 10.1038/s41417-021-00331-7 . ПМИД 33859378 . S2CID 233258994 .
- ^ Ангела XM, High KA (январь 2019 г.). «Вступая в современную эпоху генной терапии» . Ежегодный обзор медицины . 70 (1): 273–288. doi : 10.1146/annurev-med-012017-043332 . ПМИД 30477394 . S2CID 53750215 .
- ^ Ван Ю, Чжан Р., Тан Л., Ян Л. (февраль 2022 г.). «Невирусные системы доставки мРНК-вакцин для генной терапии рака» . Фармацевтика . 14 (3): 512. doi : 10.3390/pharmaceutics14030512 . ПМЦ 8949480 . ПМИД 35335891 .
- ^ Монга И., Куреши А., Тхакур Н., Гупта А.К., Кумар М. (сентябрь 2017 г.). «ASPsiRNA: ресурс ASP-siRNA, обладающий терапевтическим потенциалом в отношении генетических нарушений человека, и алгоритм прогнозирования их ингибирующей эффективности» . Г3 . 7 (9): 2931–2943. дои : 10.1534/g3.117.044024 . ПМК 5592921 . ПМИД 28696921 .
- ^ Перейти обратно: а б Оловойе А., Оквунду CI (ноябрь 2020 г.). «Генная терапия серповидноклеточной анемии» . Кокрановская база данных систематических обзоров . 2020 (11): CD007652. дои : 10.1002/14651858.CD007652.pub7 . ПМЦ 8275984 . ПМИД 33251574 .
- ^ Чен В., Ху Ю, Цзюй Д. (август 2020 г.). «Генная терапия нейродегенеративных заболеваний: достижения, идеи и перспективы» . Акта Фармацевтика Синика Б. 10 (8): 1347–1359. дои : 10.1016/j.apsb.2020.01.015 . ПМЦ 7488363 . ПМИД 32963936 .
- ^ «FDA одобрило первую генную терапию для детей с метахроматической лейкодистрофией» .
- ^ «Orchard Therapeutics получает одобрение ЕС на препарат Libmeldy для лечения метахроматической лейкодистрофии с ранним началом (MLD)» (пресс-релиз). Садовая терапия. 21 декабря 2020 г. Проверено 23 июля 2021 г. - через GlobeNewswire.
- ^ Перейти обратно: а б Комиссар Управления (19 мая 2023 г.). «FDA одобрило первый метод местной генной терапии для лечения ран у пациентов с буллезным дистрофическим эпидермолизом» . FDA . Проверено 31 июля 2023 г.
- ^ Офис комиссара (17 августа 2022 г.). «FDA одобрило первую клеточную генную терапию для лечения взрослых и детей с бета-талассемией, которым требуется регулярное переливание крови» . FDA . Проверено 31 августа 2022 г.
- ^ «FDA одобрило первую клеточную генную терапию для взрослых пациентов с рецидивирующим или рефрактерным MCL» . США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) (пресс-релиз). 24 июля 2020 г. Проверено 24 июля 2020 г.
- ^ «FDA одобрило аутолейцел брексукабтагена для лечения рецидивирующего или рефрактерного острого лимфобластного лейкоза-предшественника В-клеток» . США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) . 1 октября 2021 г. Проверено 2 октября 2021 г.
- ^ «Текарт» . Европейское агентство по лекарственным средствам . 13 октября 2020 г.
- ^ Перейти обратно: а б Комиссар Управления (23 июня 2023 г.). «FDA одобрило первую генную терапию для лечения некоторых пациентов с мышечной дистрофией Дюшенна» . FDA . Проверено 12 июля 2023 г.
- ^ «Касжеви» . США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) . 8 декабря 2023 г. Проверено 8 декабря 2023 г.
- ^ «Абекма (idecabtagene vicleucel)» . США Управление по контролю за продуктами и лекарствами (FDA). 21 апреля 2021 г.
- ^ «Бреянзи (лизокабтаген маралеуцел)» . США Управление по контролю за продуктами и лекарствами (FDA). 4 марта 2021 г.
- ^ «Лифгения» . США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) . 8 декабря 2023 года. Архивировано из оригинала 8 декабря 2023 года . Проверено 9 декабря 2023 г.
- ^ «FDA одобрило первую генную терапию для лечения неинвазивного рака мочевого пузыря высокого риска» . США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) (пресс-релиз). 16 декабря 2022 г. Проверено 16 декабря 2022 г.
- ^ «Золгенсма» . США Управление по контролю за продуктами и лекарствами (FDA). 16 марта 2021 г.
- ^ «Одобренное EMA приложение для Zolgensma» . Aetion (Пресс-релиз) . Проверено 23 июля 2021 г.
- ^ «FDA одобрило T-VEC для лечения метастатической меланомы - Национальный институт рака» . Национальный институт рака . 25 ноября 2015 года . Проверено 23 июля 2021 г.
- ^ «Имлыгический» . Европейское агентство лекарственных средств (EMA) . 17 сентября 2018 г.
- ^ «Первая генная терапия для лечения тяжелой гемофилии А» . Европейское агентство лекарственных средств (EMA) (пресс-релиз). 24 июня 2022 года. Архивировано из оригинала 26 июня 2022 года . Проверено 26 июня 2022 г.
- ^ «Роктавиан: Ожидается решение ЕС» . Европейское агентство лекарственных средств (EMA) . 23 июня 2022 года. Архивировано из оригинала 26 июня 2022 года . Проверено 26 июня 2022 г.
- ^ «Роктавиан» . Союзный реестр лекарственных средств . 25 августа 2022 г. Проверено 6 сентября 2022 г.
- ^ «FDA одобрило новую генную терапию для лечения пациентов с редкой формой наследственной потери зрения» . США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) (пресс-релиз). 24 марта 2020 г. Проверено 23 июля 2021 г.
- ^ «Люкстурна» . Европейское агентство лекарственных средств (EMA) . 24 сентября 2018 г.
- ^ Го, Цунтин; Ма, Сяотэн; Гао, Фэй; Го, Юйсюань (9 марта 2023 г.). «Нецелевые эффекты при редактировании генов CRISPR/Cas9» . Границы биоинженерии и биотехнологии . 11 : 1143157. дои : 10.3389/fbioe.2023.1143157 . ISSN 2296-4185 . ПМЦ 10034092 . ПМИД 36970624 .
- ^ У, Шао-Шуай; Ли, Цин-Цуй; Инь, Чан-Цин; Сюэ, Вэнь; Сун, Чунь-Цин (15 марта 2020 г.). «Достижения в области генной терапии на основе CRISPR/Cas при генетических заболеваниях человека» . Тераностика . 10 (10): 4374–4382. дои : 10.7150/thno.43360 . ISSN 1838-7640 . ПМК 7150498 . ПМИД 32292501 .
- ^ Кортхоф Г. «Значение обратной связи Стила от сомы к зародышевой линии для генной терапии человека» .
- ^ Вудс Н.Б., Боттеро В., Шмидт М., фон Калле С., Верма И.М. (апрель 2006 г.). «Генная терапия: терапевтический ген, вызывающий лимфому» . Природа . 440 (7088): 1123. Бибкод : 2006Natur.440.1123W . дои : 10.1038/4401123а . ПМИД 16641981 . S2CID 4372110 .
- ^ Трэшер А.Дж., Гаспар Х.Б., Баум С., Модлич У., Шамбах А., Кандотти Ф. и др. (сентябрь 2006 г.). «Генная терапия: трансгенная лейкемогенность X-SCID». Природа . 443 (7109): Е5-6, обсуждение Е6-7. Бибкод : 2006Natur.443E...5T . дои : 10.1038/nature05219 . ПМИД 16988659 . S2CID 4301764 .
- ^ Бак Р.О., Портеус М.Х. (июль 2017 г.). «CRISPR-опосредованная интеграция больших кассет генов с использованием донорских векторов AAV» . Отчеты по ячейкам . 20 (3): 750–756. дои : 10.1016/j.celrep.2017.06.064 . ПМЦ 5568673 . ПМИД 28723575 .
- ^ Роян С.Ю. (11 февраля 2014 г.). «Геномная хирургия» . Обзор технологий Массачусетского технологического института . Архивировано из оригинала 15 февраля 2014 года . Проверено 17 февраля 2014 г.
- ^ «Генной терапии нужен герой, который сможет оправдать шумиху» . Новый учёный . 30 октября 2013 года . Проверено 2 января 2022 г.
- ^ Красто AM (7 июля 2013 г.). «Глибера – самый дорогой препарат в мире и первая одобренная на Западе генная терапия» . Все о наркотиках . Проверено 2 ноября 2013 г.
- ^ «Генная терапия» . Окриджская национальная лаборатория . 20 декабря 2012 года. Архивировано из оригинала 20 декабря 2012 года . Проверено 2 января 2022 г.
- ^ Рэпер С.Э., Чирмул Н., Ли Ф.С., Вивел Н.А., Бэгг А., Гао Г.П. и др. (сентябрь 2003 г.). «Синдром фатального системного воспалительного ответа у пациента с дефицитом орнитинтранскарбамилазы после переноса аденовирусного гена». Молекулярная генетика и обмен веществ . 80 (1–2): 148–58. дои : 10.1016/j.ymgme.2003.08.016 . ПМИД 14567964 .
- ^ Фрэнк К.М., Хогарт Д.К., Миллер Дж.Л., Мандал С., Мис П.Дж., Самульски Р.Дж. и др. (июль 2009 г.). «Расследование причины смерти в ходе исследования генной терапии» . Медицинский журнал Новой Англии . 361 (2): 161–9. дои : 10.1056/NEJMoa0801066 . ПМИД 19587341 .
- ^ Комитет по этике Хьюго (апрель 2001 г.). «Заявление об исследованиях в области генной терапии» (PDF) . Организация генома человека . Архивировано из оригинала (PDF) 7 сентября 2008 года.
- ^ Исаси Р.М., Нгуен Т.М., Кнопперс Б.М. (октябрь 2006 г.). «Национальная нормативно-правовая база в отношении технологий генетической модификации человека (соматическая модификация и модификация зародышевой линии)» (PDF) . Центр генетики и государственной политики. Архивировано из оригинала (PDF) 17 сентября 2014 года.
- ^ «Главная страница — Реестр генетических тестов NIH (GTR) — NCBI» . www.ncbi.nlm.nih.gov . Проверено 2 мая 2022 г.
- ^ Перейти обратно: а б «Руководство Национального института здравоохранения США по исследованиям молекул рекомбинантных или синтетических нуклеиновых кислот» . Национальные институты здравоохранения США . Апрель 2016. Архивировано из оригинала 28 мая 2016 года.
- ^ «Читайте отчет Бельмонта» . HHS.gov . 15 января 2018 года . Проверено 2 января 2022 г.
- ^ Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (14 октября 1993 г.). «Применение действующих законодательных актов к продуктам соматической клеточной терапии человека и продуктам генной терапии» (PDF) . Федеральный реестр . 58 (197). Архивировано (PDF) из оригинала 21 июня 2009 г.
- ^ «Руководство для промышленности: Руководство по соматической клеточной терапии и генной терапии человека» . FDA.gov . 9 июля 2009 года. Архивировано из оригинала 9 июля 2009 года . Проверено 2 января 2022 г.
- ^ «Генный допинг ВАДА» . ВАДА. Архивировано из оригинала 21 ноября 2009 года . Проверено 27 сентября 2013 г.
- ^ Кайзер Б., Маурон А., Миа А. (март 2007 г.). «Текущая антидопинговая политика: критическая оценка» . Медицинская этика BMC . 8 :2. дои : 10.1186/1472-6939-8-2 . ЧВК 1851967 . ПМИД 17394662 .
- ^ Пауэлл Р., Бьюкенен А. (февраль 2011 г.). «Разрыв цепей эволюции: перспектива преднамеренной генетической модификации человека». Журнал медицины и философии . 36 (1): 6–27. дои : 10.1093/jmp/jhq057 . ПМИД 21228084 .
- ^ Бэйлис Ф., Роберт Дж.С. (2004). «Неизбежность технологий генетического улучшения». Биоэтика . 18 (1): 1–26. дои : 10.1111/j.1467-8519.2004.00376.x . ПМИД 15168695 .
- ^ Эванс Дж (2002). Играя в Бога?: Генная инженерия человека и рационализация общественных биоэтических дебатов . Издательство Чикагского университета. ISBN 978-0-226-22262-2 .
- ^ «Центр этики здоровья - Медицинский факультет Университета Миссури - Генная терапия и генная инженерия» . Ethics.missouri.edu . 3 декабря 2013 года. Архивировано из оригинала 3 декабря 2013 года . Проверено 2 января 2022 г.
- ^ Роко MC, Бейнбридж WS (2002). «Конвергентные технологии для улучшения деятельности человека: интеграция на наноуровне». Журнал исследований наночастиц . 4 (4): 281–295. Бибкод : 2002JNR.....4..281R . дои : 10.1023/A:1021152023349 . S2CID 136290217 .
- ^ Аллхофф Ф (март 2005 г.). «Генетическое улучшение зародышевой линии и первичные товары Ролза» (PDF) . Журнал Института этики Кеннеди . 15 (1): 39–56. CiteSeerX 10.1.1.566.171 . дои : 10.1353/ken.2005.0007 . ПМИД 15881795 . S2CID 14432440 . Архивировано (PDF) из оригинала 30 января 2012 года.
- ^ Раниш Р. (январь 2020 г.). «Специальный выпуск: Редактирование зародышевой линии человека» . Биоэтика . 34 (1): 1–143.
- ^ «Этические вопросы, связанные с пренатальным генетическим тестированием. Совет по этическим и юридическим вопросам Американской медицинской ассоциации». Архив семейной медицины . 3 (7): 633–642. Июль 1994 г. doi : 10.1001/archfami.3.7.633 . ПМИД 7921302 .
- ^ «Декларация Инуямы: картирование генома человека, генетический скрининг и генная терапия» . Совет международных организаций медицинских наук . Архивировано из оригинала 5 августа 2001 года.
- ^ Смит К.Р., Чан С., Харрис Дж. (октябрь 2012 г.). «Генетическая модификация зародышевой линии человека: научные и биоэтические перспективы». Архивы медицинских исследований . 43 (7): 491–513. doi : 10.1016/j.arcmed.2012.09.003 . ПМИД 23072719 .
- ^ Рирдон С. (14 февраля 2017 г.). «Американские научные консультанты намечают путь к генетически модифицированным детям» . Природа . дои : 10.1038/nature.2017.21474 .
- ^ Перейти обратно: а б Уэйд Н. (19 марта 2015 г.). «Ученые добиваются запрета метода редактирования генома человека» . Нью-Йорк Таймс . Архивировано из оригинала 2 января 2022 года . Проверено 20 марта 2015 г.
- ^ Перейти обратно: а б Поллак А (3 марта 2015 г.). «Новый мощный способ редактирования ДНК» . Нью-Йорк Таймс . Архивировано из оригинала 2 января 2022 года . Проверено 20 марта 2015 г.
- ^ Перейти обратно: а б Балтимор Д., Берг П., Ботчан М., Кэрролл Д., Чаро Р.А., Черч Дж. и др. (апрель 2015 г.). «Биотехнология. Разумный путь вперед в области геномной инженерии и модификации генов зародышевой линии» . Наука . 348 (6230): 36–38. Бибкод : 2015Sci...348...36B . дои : 10.1126/science.aab1028 . ПМЦ 4394183 . ПМИД 25791083 .
- ^ Перейти обратно: а б Ланфьер Э., Урнов Ф., Хеккер С.Е., Вернер М., Смоленский Дж. (март 2015 г.). «Не редактируйте зародышевую линию человека» . Природа . 519 (7544): 410–411. Бибкод : 2015Natur.519..410L . дои : 10.1038/519410a . ПМИД 25810189 .
- ^ Лян П., Сюй Ю, Чжан Х, Дин С., Хуан Р., Чжан З. и др. (май 2015 г.). «CRISPR/Cas9-опосредованное редактирование генов в трехпронуклеарных зиготах человека» . Белок и клетка . 6 (5): 363–372. дои : 10.1007/s13238-015-0153-5 . ПМЦ 4417674 . ПМИД 25894090 .
- ^ Колата Г (23 апреля 2015 г.). «Китайские ученые редактируют гены человеческих эмбрионов, вызывая обеспокоенность» . Нью-Йорк Таймс . Архивировано из оригинала 2 января 2022 года . Проверено 24 апреля 2015 г.
- ^ Хармон А (14 февраля 2017 г.). «Редактирование человеческого гена получает поддержку научной группы» . Нью-Йорк Таймс . ISSN 0362-4331 . Архивировано из оригинала 2 января 2022 года . Проверено 17 февраля 2017 г. .
- ^ Комитет по редактированию генов человека: научные, медицинские и этические соображения. «Редактирование генома человека: наука, этика и управление» . Nationalacademies.org . Национальная академия наук; Национальная Медицинская Академия . Проверено 21 февраля 2017 г.
- ^ «Ученые занимаются генной инженерией младенцев» . Нью-Йорк Пост . Рейтер. 14 февраля 2017 года . Проверено 17 февраля 2017 г. .
- ^ Фридман Т., Роблин Р. (март 1972 г.). «Генная терапия генетических заболеваний человека?». Наука . 175 (4025): 949–955. Бибкод : 1972Sci...175..949F . дои : 10.1126/science.175.4025.949 . ПМИД 5061866 . S2CID 19952096 .
- ^ Роджерс С., New Scientist 1970, стр. 194
- ^ Чепко CL, Робертс BE, Маллиган RC (июль 1984 г.). «Создание и применение высокотрансмиссивного челночного вектора мышиного ретровируса. Этот вектор используется для проникновения в клетку человеческого тела». Клетка . 37 (3): 1053–1062. дои : 10.1016/0092-8674(84)90440-9 . ПМИД 6331674 . S2CID 34544709 .
- ^ «Первая генная терапия» . Фонд наук о жизни. 21 июня 2011 года. Архивировано из оригинала 28 ноября 2012 года . Проверено 7 января 2014 г.
- ^ Блезе Р.М., Калвер К.В., Миллер А.Д., Картер К.С., Флейшер Т., Клеричи М. и др. (октябрь 1995 г.). «Генная терапия, направленная на Т-лимфоциты, при ADA-SCID: первые результаты испытаний через 4 года» . Наука . 270 (5235): 475–480. Бибкод : 1995Sci...270..475B . дои : 10.1126/science.270.5235.475 . ПМИД 7570001 . S2CID 46339645 .
- ^ Троян Дж., Джонсон Т.Р., Рудин С.Д., Илан Дж., Тыкочински М.Л., Илан Дж. (январь 1993 г.). «Лечение и профилактика глиобластомы крыс с помощью иммуногенных клеток C6, экспрессирующих антисмысловую РНК инсулиноподобного фактора роста I». Наука . 259 (5091): 94–97. Бибкод : 1993Sci...259...94T . дои : 10.1126/science.8418502 . ПМИД 8418502 .
- ^ Перейти обратно: а б Троян Дж., Пан YX, Вэй М.Х., Ли А., Шевелев А., Бирваген М. и др. (2012). «Методология антигенной анти-IGF-I терапии злокачественных опухолей» . Исследования и практика химиотерапии . 2012 : 1–12. дои : 10.1155/2012/721873 . ПМК 3287029 . ПМИД 22400112 .
- ^ Эбботт А. (апрель 1992 г.). «Генная терапия. Итальянцы первыми применили стволовые клетки» . Природа . 356 (6369): 465. Бибкод : 1992Natur.356..465A . дои : 10.1038/356465a0 . ПМИД 1560817 . S2CID 4319842 .
- ^ Каваццана-Кальво М., Трэшер А., Мавилио Ф. (февраль 2004 г.). «Будущее генной терапии». Природа . 427 (6977): 779–781. Бибкод : 2004Natur.427..779C . дои : 10.1038/427779a . ПМИД 14985734 . S2CID 4421364 .
- ^ Блейксли С. (18 мая 1993 г.). «Лечение «болезни мальчика-пузыря» » . Нью-Йорк Таймс . ISSN 0362-4331 . Проверено 9 февраля 2018 г.
- ^ Нальдини, Луиджи; Блёмер, Ульрике; Галлай, Филипп; Ори, Дэниел; Маллиган, Ричард; Гейдж, Фред Х.; Верма, Индер М.; Троно, Дидье (12 апреля 1996 г.). «Доставка генов in vivo и стабильная трансдукция неделящихся клеток лентивирусным вектором» . Наука . 272 (5259): 263–267. Бибкод : 1996Sci...272..263N . дои : 10.1126/science.272.5259.263 . ISSN 0036-8075 . ПМИД 8602510 . S2CID 18997464 .
- ^ Штейн Р. (11 октября 2010 г.). «Первый пациент, прошедший лечение в рамках исследования стволовых клеток» . Вашингтон Пост . Проверено 10 ноября 2010 г.
- ^ «Смерть побудила FDA приостановить исследование генной терапии артрита» . Медпейдж сегодня. 27 июля 2007 года . Проверено 10 ноября 2010 г.
- ^ Столберг С.Г. (22 января 2000 г.). «В университете приказано прекратить генную терапию» . Нью-Йорк Таймс . Проверено 10 ноября 2010 г.
- ^ Уилсон Дж. Ф. (18 марта 2002 г.). «Мышиная генная терапия корректирует симптомы серповидноклеточной анемии» . Ученый – журнал наук о жизни . Проверено 17 августа 2010 г.
- ^ «Генная терапия корректирует серповидноклеточную анемию в лабораторных исследованиях» . Детская исследовательская больница Св. Иуды . 4 декабря 2008 года . Проверено 29 декабря 2012 г. - через ScienceDaily.
- ^ Пенман Д. (11 октября 2002 г.). «Тонкая генная терапия борется с заболеваниями крови» . Новый учёный . Проверено 17 августа 2010 г.
- ^ «Наношарики ДНК ускоряют генную терапию» . Новый учёный . 12 мая 2002 года . Проверено 17 августа 2010 г.
- ^ Анантасвами А. (20 марта 2003 г.). «Тайные гены проникают в мозг» . Новый учёный . Проверено 17 августа 2010 г.
- ^ Холмс Р. (13 марта 2003 г.). «Генная терапия может выключить болезнь Хантингтона» . Новый учёный . Проверено 17 августа 2010 г.
- ^ Отт М.Г., Шмидт М., Шварцвальдер К., Штейн С., Силер У., Кёль У. и др. (апрель 2006 г.). «Коррекция Х-сцепленной хронической гранулематозной болезни с помощью генной терапии, дополненной инсерционной активацией MDS1-EVI1, PRDM16 или SETBP1» . Природная медицина . 12 (4): 401–409. дои : 10.1038/nm1393 . ПМИД 16582916 . S2CID 7601162 .
- ^ Браун Б.Д., Веннери М.А., Зингале А., Сержи Сержи Л., Налдини Л. (май 2006 г.). «Регуляция эндогенной микроРНК подавляет экспрессию трансгена в гемопоэтических линиях и обеспечивает стабильный перенос генов». Природная медицина . 12 (5): 585–591. дои : 10.1038/nm1398 . ПМИД 16633348 . S2CID 11114427 .
- ^ Морган Р.А., Дадли М.Э., Вундерлих Дж.Р., Хьюз М.С., Ян Дж.К., Шерри Р.М. и др. (октябрь 2006 г.). «Регрессия рака у больных после переноса генно-инженерных лимфоцитов» . Наука . 314 (5796): 126–129. Бибкод : 2006Sci...314..126M . дои : 10.1126/science.1129003 . ПМК 2267026 . ПМИД 16946036 .
- ^ Левин Б.Л., Юмо Л.М., Бойер Дж., МакГрегор Р.Р., Ребелло Т., Лу X и др. (ноябрь 2006 г.). «Перенос генов у человека с использованием условно реплицирующегося лентивирусного вектора» . Труды Национальной академии наук Соединенных Штатов Америки . 103 (46): 17372–17377. Бибкод : 2006PNAS..10317372L . дои : 10.1073/pnas.0608138103 . ПМК 1635018 . ПМИД 17090675 .
- ^ «Penn Medicine представляет данные испытаний генной терапии ВИЧ на CROI 2009» . ЭврекАлерт! . 10 февраля 2009 года. Архивировано из оригинала 25 августа 2012 года . Проверено 19 ноября 2009 г.
- ^ «Генная терапия в первую очередь при плохом зрении» . Новости Би-би-си . 1 мая 2007 года . Проверено 3 мая 2010 г.
- ^ Долгин Э (2009). «Цветовая слепота, исправленная генной терапией» . Природа . дои : 10.1038/news.2009.921 .
- ^ Картье Н., Хасейн-Бей-Абина С., Бартоломе К.С., Верес Г., Шмидт М., Кучера И. и др. (ноябрь 2009 г.). «Генная терапия гемопоэтическими стволовыми клетками с использованием лентивирусного вектора при Х-сцепленной адренолейкодистрофии» (PDF) . Наука . 326 (5954): 818–823. Бибкод : 2009Sci...326..818C . дои : 10.1126/science.1171242 . ПМИД 19892975 . S2CID 27783 .
- ^ Комароми А.М., Александр Дж.Дж., Роулан Дж.С., Гарсия М.М., Чиодо В.А., Кая А. и др. (июль 2010 г.). «Генная терапия спасает функцию колбочки при врожденной ахроматопсии» . Молекулярная генетика человека . 19 (13): 2581–2593. дои : 10.1093/hmg/ddq136 . ПМЦ 2883338 . ПМИД 20378608 .
- ^ Каваццана-Кальво М., Пайен Э., Негре О., Ван Г., Хехир К., Фусил Ф. и др. (сентябрь 2010 г.). «Независимость от трансфузии и активация HMGA2 после генной терапии β-талассемии человека» . Природа . 467 (7313): 318–322. Бибкод : 2010Natur.467..318C . дои : 10.1038/nature09328 . ПМЦ 3355472 . ПМИД 20844535 .
- ^ Галанелло Р., Орига Р. (май 2010 г.). «Бета-талассемия» . Сиротский журнал редких заболеваний . 5:11 . дои : 10.1186/1750-1172-5-11 . ПМЦ 2893117 . ПМИД 20492708 .
- ^ Перейти обратно: а б Билс Дж.К. (16 сентября 2010 г.). «Генная терапия освобождает пациента с бета-талассемией от переливания крови на 2+ года» . МедСкейп . Проверено 15 декабря 2012 г.
- ^ Перейти обратно: а б Лебулш П. (20 марта 2013 г.). «Пятилетние итоги лентивирусной генной терапии бета-талассемии человека, уроки и перспективы» . Отчеты о талассемии . 3 (1 с): 108. doi : 10.4081/thal.2013.s1.e43 .
- ^ Перейти обратно: а б Номер клинического исследования NCT01639690 для «Большая β-талассемия с аутологичными CD34+ гематопоэтическими клетками-предшественниками, трансдуцированными TNS9.3.55, лентивирусным вектором, кодирующим нормальный ген β-глобина человека» на сайте ClinicalTrials.gov
- ^ Троян А, Аристисабал Б.Х., Джей Л.М., Кастильо Т., Пенагос П.Дж., Брисеньо I, Троян Дж. (2016). «Тестирование биомаркера IGF-I в этическом контексте». Adv Modern Oncol Res . 2 (4): 188–200. doi : 10.18282/amor.v2.i4.58 (неактивен 31 января 2024 г.).
{{cite journal}}: CS1 maint: DOI неактивен по состоянию на январь 2024 г. ( ссылка ) - ^ Кастильо Т., Троян А., Ногера М.С., Джей Л.М., Крейн С., Альварес А. и др. (2016). «Эпистемологический опыт разработки технологий молекулярной биологии для стратегии иммуногенной терапии » . Преподобный Сьен (на испанском языке). 2 (25): 228–240. doi : 10.14483//udistrital.jour.RC.2016.25.a6 .
- ^ Розенберг Т. (27 мая 2011 г.). «Человек, который излечился от ВИЧ, и что это значит для лечения СПИДа» . Нью-Йорк . Проверено 2 января 2022 г.
- ^ «Письма директора: Вспоминая Тимоти Рэя Брауна: борца за исследования в области лечения ВИЧ | Управление исследований СПИДа Национального института здравоохранения» . www.oar.nih.gov . Проверено 26 июня 2022 г.
- ^ «Генная терапия избавляет некоторых пациентов от лейкемии от рака. Будет ли она работать и при других видах рака?» . Центр сингулярности. 6 января 2014 года . Проверено 7 января 2014 г.
- ^ Ян З.Дж., Чжан Ю.Р., Чен Б., Чжан С.Л., Цзя Э.З., Ван Л.С. и др. (июль 2009 г.). «Фаза I клинического исследования интракоронарного введения Ad-hHGF для лечения тяжелой ишемической болезни сердца». Отчеты по молекулярной биологии . 36 (6): 1323–1329. дои : 10.1007/s11033-008-9315-3 . ПМИД 18649012 . S2CID 23419866 .
- ^ Хан В., Пьюн В.Б., Ким Д.С., Ю В.С., Ли С.Д., Вон Дж.Х. и др. (октябрь 2011 г.). «Усиленное кардиопротекторное действие за счет совместной экспрессии двух изоформ фактора роста гепатоцитов из обнаженной плазмидной ДНК на модели ишемической болезни сердца у крыс». Журнал генной медицины . 13 (10): 549–555. дои : 10.1002/jgm.1603 . ПМИД 21898720 . S2CID 26812780 .
- ^ «Неоваскулоген» . Евролаб . Проверено 4 августа 2015 г.
- ^ Деев Р.В., Бозо И.Ю., Мжаванадзе Н.Д., Воронов Д.А., Гавриленко А.В., Червяков Ю.В. и др. (сентябрь 2015 г.). «Внутримышечный перенос гена pCMV-vegf165 — эффективный метод лечения пациентов с хронической ишемией нижних конечностей». Журнал сердечно-сосудистой фармакологии и терапии . 20 (5): 473–482. дои : 10.1177/1074248415574336 . ПМИД 25770117 . S2CID 13443907 .
- ^ «О раке: запуск исследования терапии стволовыми клетками дает надежду пациентам с наследственными заболеваниями крови» . Мемориальный онкологический центр Слоана-Кеттеринга. 16 июля 2012 года . Проверено 15 декабря 2012 г.
- ^ Поллак А (20 июля 2012 г.). «Европейское агентство рекомендует одобрить генную терапию» . Нью-Йорк Таймс . Проверено 2 января 2022 г.
- ^ «Первая генная терапия, одобренная Европейской комиссией» . UniQure (Пресс-релиз). 2 ноября 2012 года. Архивировано из оригинала 5 ноября 2012 года . Проверено 2 января 2022 г.
- ^ «Chiesi и uniQure откладывают запуск Glybera, чтобы добавить данные» . Биотехнология . Фармацевтическое письмо . 4 августа 2014 года . Проверено 28 августа 2014 г.
- ^ Бургер Л., Хиршлер Б. (26 ноября 2014 г.). «Первый препарат для генной терапии установил ценовой рекорд в миллион евро» . Рейтер . Проверено 30 марта 2015 г.
- ^ Уэлен Дж. (2 ноября 2012 г.). «Одобрение генной терапии знаменует собой важную веху» . Уолл Стрит Джорнал .
- ^ Моррисон С. (3 марта 2015 г.). «Установлен ценник в 1 миллион долларов за генную терапию Glybera» . Коммерческая тайна . 33 (3): 217–218. дои : 10.1038/nbt0315-217 . ПМИД 25748892 . S2CID 205266596 .
- ^ «Генная терапия впервые одобрена в Европе» . Архивировано из оригинала 4 января 2014 года.
- ^ Регаладо А (4 мая 2016 г.). «Самое дорогое лекарство в мире — крах» . Обзор технологий Массачусетского технологического института .
- ^ Босели С (30 апреля 2013 г.). «Новаторские испытания генной терапии дают надежду пациентам с сердечно-сосудистыми заболеваниями» . Хранитель . Проверено 28 апреля 2014 г.
- ^ «Новости сердечной генной терапии: Клиника врачей» . thePhysiciansclinic.co.uk . 8 сентября 2013 года. Архивировано из оригинала 29 апреля 2014 года . Проверено 2 января 2022 г.
- ^ «Селладон получил от FDA статус прорывной терапии для мидикара, нового, первого в своем классе разрабатываемого препарата для лечения сердечной недостаточности» . Селладон . 10 июля 2015 г. Архивировано из оригинала 10 июля 2015 г. Проверено 2 января 2022 г.
- ^ Фернандес-Руис I (март 2016 г.). «Генная терапия: отсутствие улучшения результатов при генной терапии сердечной недостаточности». Обзоры природы. Кардиология . 13 (3): 122–123. дои : 10.1038/nrcardio.2016.14 . ПМИД 26843287 . S2CID 205472001 .
- ^ Биффи А., Монтини Е., Лориоли Л., Чезани М., Фумагалли Ф., Плати Т. и др. (август 2013 г.). «Лентивирусная генная терапия гемопоэтическими стволовыми клетками приносит пользу при метахроматической лейкодистрофии» . Наука . 341 (6148): 1233158. doi : 10.1126/science.1233158 . ПМИД 23845948 . S2CID 206546808 .
- ^ Аюти А., Биаско Л., Скарамуцца С., Ферруа Ф., Чикалезе М.П., Барикорди С. и др. (август 2013 г.). «Лентивирусная генная терапия гемопоэтическими стволовыми клетками у пациентов с синдромом Вискотта-Олдрича» . Наука . 341 (6148): 1233151. doi : 10.1126/science.1233151 . ПМК 4375961 . ПМИД 23845947 .
- ^ Галлахер Дж. (21 апреля 2015 г.). «Генная терапия: «Прирученный ВИЧ» используется для лечения болезней» . Новости BBC, Здоровье . Проверено 21 апреля 2015 г.
- ^ Малех Х.Л., Окс HD (апрель 2015 г.). «Новая эра клинической пользы генной терапии». ДЖАМА . 313 (15): 1522–1523. дои : 10.1001/jama.2015.2055 . ПМИД 25898049 .
- ^ «Лечение генной терапией детей с болезнью «пузырного ребенка»» . Наука Дейли . 18 ноября 2014 г.
- ^ «Генная терапия обеспечивает безопасное и долгосрочное облегчение для пациентов с тяжелой формой гемофилии B» . Наука Дейли . 20 ноября 2014 г.
- ^ Беали А (25 января 2014 г.). «Генная терапия восстанавливает зрение людям с заболеваниями глаз» . Новый учёный . Проверено 25 января 2014 г.
- ^ Тебас П., Стейн Д., Тан В.В., Фрэнк И., Ван С.К., Ли Дж. и др. (март 2014 г.). «Редактирование гена CCR5 в аутологичных CD4 Т-клетках людей, инфицированных ВИЧ» . Медицинский журнал Новой Англии . 370 (10): 901–910. дои : 10.1056/NEJMoa1300662 . ПМК 4084652 . ПМИД 24597865 .
- ^ Дворский Г. (6 марта 2014 г.). «Ученые создают генетически модифицированные клетки, защищающие от ВИЧ» . io9, Биотехнология . Проверено 6 марта 2014 г.
- ^ Номер клинического исследования NCT02247843 «Генная терапия стволовыми клетками при серповидноклеточной анемии» на сайте ClinicalTrials.gov.
- ^ Номер клинического исследования NCT00012545 «Сбор и хранение стволовых клеток пуповины для лечения серповидноклеточной анемии» на сайте ClinicalTrials.gov.
- ^ «Десять вещей из мира бизнеса, которые вы могли пропустить в понедельник» . Бостон Глобус . 3 февраля 2015 года . Проверено 13 февраля 2015 г.
- ^ Циммер С (9 марта 2015 г.). «Защита без вакцины» . Нью-Йорк Таймс . Архивировано из оригинала 2 января 2022 года . Проверено 30 марта 2015 г.
- ^ Гарднер М.Р., Каттенхорн Л.М., Кондур Х.Р., фон Шавен М., Дорфман Т., Чианг Дж.Дж. и др. (март 2015 г.). «AAV-экспрессируемый eCD4-Ig обеспечивает надежную защиту от множества инфекций, вызванных вирусом SHIV» . Природа . 519 (7541): 87–91. Бибкод : 2015Natur.519...87G . дои : 10.1038/nature14264 . ПМЦ 4352131 . ПМИД 25707797 .
- ^ Уэйд Н. (3 декабря 2015 г.). «Ученые вводят мораторий на изменения генома человека, которые могут передаваться по наследству» . Нью-Йорк Таймс . Архивировано из оригинала 2 января 2022 года . Проверено 3 декабря 2015 г.
- ^ Уолш Ф. (3 декабря 2015 г.). «Редактирование генов: приближается ли эра дизайнерских людей?» . BBC News Здоровье . Проверено 31 декабря 2015 г.
- ^ «Генетически измененная кожа спасла мальчика, умирающего от редкой болезни» . NPR.org .
- ^ Генри Р. (19 февраля 2017 г.). «Надежды на излечение от лейкемии растут, поскольку генная редактирование девочки» . Таймс . Проверено 20 февраля 2017 г.
- ^ Образец I (5 ноября 2015 г.). «Девочку впервые в мире лечили «созданными иммунными клетками» » . Хранитель . Проверено 6 ноября 2015 г.
- ^ Перейти обратно: а б « Дизайнерские клетки» обращают вспять рак у годовалого ребенка» . Новости Би-би-си . 5 ноября 2015 года . Проверено 11 декабря 2022 г.
- ^ «Краткое заключение1 (первоначальное разрешение) Стримвелиса» (PDF) . Европейское агентство по лекарственным средствам . 1 апреля 2016 г. стр. 1–2. Архивировано из оригинала (PDF) 28 января 2018 года . Проверено 13 апреля 2016 г.
- ^ Хиршелер Б. (1 апреля 2016 г.). «Европа дает зеленый свет первой генной терапии для детей» . Рейтер . Проверено 13 апреля 2016 г.
- ^ Ривз Р. (6 июня 2016 г.). «Вторая генная терапия получает одобрение в Европе» . Бионьюс . Архивировано из оригинала 21 февраля 2017 года . Проверено 20 февраля 2017 г.
- ^ Коглан А. (9 апреля 2016 г.). «Генная терапия одобрена» . Новый учёный . № 3068. С. 8–9.
- ^ Сираноски Д. (июль 2016 г.). «Китайские учёные проведут первое испытание CRISPR на людях» . Природа . 535 (7613): 476–477. Бибкод : 2016Natur.535..476C . дои : 10.1038/nature.2016.20302 . ПМИД 27466105 .
- ^ Беннетт Дж. (15 ноября 2016 г.). «Китайские ученые стали первыми, кто применил редактирование генов CRISPR на людях» . Популярная механика . Проверено 16 ноября 2016 г.
- ^ Ли Т.В., Саузерн К.В., Перри Л.А., Пенни-Димри Дж.К., Аслам А.А. (июнь 2016 г.). Южный KW (ред.). «Местная замена гена регулятора трансмембранной проводимости при муковисцидозе при заболеваниях легких, связанных с муковисцидозом» . Кокрановская база данных систематических обзоров . 2016 (6): CD005599. дои : 10.1002/14651858.CD005599.pub5 . ПМЦ 8682957 . ПМИД 27314455 .
- ^ Уиппл Т. (1 марта 2017 г.). «Новая генная терапия «уменьшает опухоли, как кубики льда» » . Таймс . Проверено 1 марта 2017 г.
- ^ Коглан А. (март 2017 г.). «Генная терапия «вылечивает» мальчика от болезней крови, от которых страдают миллионы» . Новый учёный .
- ^ «Одобрение FDA приносит первую генную терапию в Соединенные Штаты» (пресс-релиз). США Управление по контролю за продуктами и лекарствами (FDA). 30 августа 2017 г.
- ^ «FDA одобрило аксикабтаген цилолеуцел для лечения крупноклеточной В-клеточной лимфомы» . США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) . Проверено 5 января 2018 г.
- ^ Зайнер Дж. (6 октября 2017 г.). «Нокаут миостатина CRISPR человека своими руками» . Ютуб . Архивировано из оригинала 11 ноября 2017 года . Проверено 20 мая 2020 г.
- ^ Зайнер Дж. «Первая попытка редактирования гена CRISPR человека» . Проверено 20 мая 2020 г.
- ^ «Эксклюзив AP: американские ученые впервые пробуют редактировать гены в организме» . АП НОВОСТИ . 15 ноября 2017 года . Проверено 17 ноября 2020 г.
- ^ Кайзер Дж. (ноябрь 2017 г.). «Человеку ввели инструменты редактирования генов, чтобы вылечить его инвалидизирующую болезнь. Вот что вам нужно знать» . Наука . дои : 10.1126/science.aar5098 .
- ^ Чжан С. (15 ноября 2017 г.). «Первый человек, гены которого были отредактированы внутри тела» . Атлантика . Проверено 17 ноября 2020 г.
- ^ Ледфорд Х (5 сентября 2018 г.). «Первые испытания редактирования генов в организме дают многообещающие результаты» . Природа . дои : 10.1038/d41586-018-06195-6 . S2CID 92840885 .
- ^ Маркионе М (7 февраля 2019 г.). «Испытания показывают, что ученые впервые осуществили редактирование генов «в организме» . АП Новости . Проверено 7 февраля 2019 г.
- ^ Персонал (2 февраля 2019 г.). «Исследование возрастающей дозы редактирования генома с помощью терапевтической нуклеазы цинковых пальцев (ZFN) SB-913 у субъектов с МПС II» . ClinicalTrials.gov . Национальная медицинская библиотека США . Проверено 7 февраля 2019 г.
- ^ Рангараджан С., Уолш Л., Лестер В., Перри Д., Мадан Б., Лаффан М. и др. (декабрь 2017 г.). «Перенос гена AAV5-фактора VIII при тяжелой гемофилии А» . Медицинский журнал Новой Англии . 377 (26): 2519–2530. дои : 10.1056/nejmoa1708483 . hdl : 10044/1/57163 . ПМИД 29224506 .
- ^ ван ден Берг HM (декабрь 2017 г.). «Лекарство от гемофилии в пределах досягаемости». Медицинский журнал Новой Англии . 377 (26): 2592–2593. дои : 10.1056/nejme1713888 . ПМИД 29224412 .
- ^ «FDA одобрило новую генную терапию для лечения пациентов с редкой формой наследственной потери зрения» . США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) (пресс-релиз). 19 декабря 2017 года . Проверено 20 декабря 2017 г.
- ^ Герпер М. (2 января 2018 г.). «Spark Therapeutics установила цену генной терапии для лечения слепоты в 850 000 долларов» . Форбс . Проверено 4 января 2018 г.
- ^ Шеридан К. (19 декабря 2017 г.). «FDA одобрило генную терапию для лечения слепоты, что стало революционным моментом для медицины, основанной на ДНК» . Newsweek . Проверено 20 декабря 2017 г.
- ^ Штейн Р. (24 мая 2019 г.). «Новая генная терапия стоимостью 2,1 миллиона долларов является самым дорогим препаратом за всю историю» . ЭНЕРГЕТИЧЕСКИЙ ЯДЕРНЫЙ РЕАКТОР . Проверено 24 мая 2019 г.
- ^ Тонг А (3 июня 2019 г.). «ЕС дает историческое одобрение генной терапии синей птицы для лечения β-талассемии – теперь расслабьтесь и ждите цены» . Проверено 4 июня 2019 г.
- ^ «Зинтегло ЭПАР» . Европейское агентство лекарственных средств (EMA) . 25 марта 2019 года . Проверено 8 июня 2020 г. Текст скопирован из источника, права на который принадлежат Европейскому агентству по лекарственным средствам. Воспроизведение разрешено при условии указания источника.
- ^ «Исследование однократной возрастающей дозы у участников с LCA10» . www.clinicaltrials.gov . Проверено 20 августа 2019 г.
- ^ «Allergan и Editas Medicine начинают клиническое исследование Brilliance Phase 1/2 AGN-151587 (EDIT-101) для лечения LCA10» . Эдитас Медицина . Проверено 20 августа 2019 г.
- ^ Ледфорд Х (март 2020 г.). «Лечение CRISPR впервые введено непосредственно в организм» . Природа . 579 (7798): 185. Бибкод : 2020Natur.579..185L . дои : 10.1038/d41586-020-00655-8 . ПМИД 32157225 .
- ^ «Золгенсма ЭПАР» . Европейское агентство лекарственных средств (EMA) . 24 марта 2020 г. Проверено 16 октября 2020 г.
- ^ «Audentes Therapeutics предоставляет обновленную информацию о клиническом исследовании ASPIRO по оценке AT132 у пациентов с Х-сцепленной миотубулярной миопатией» . Аудентес Терапевтик . 10 августа 2020 года. Архивировано из оригинала 27 октября 2020 года . Проверено 21 сентября 2020 г.
- ^ «Аудентес компании Astellas сообщает о третьей смерти в ходе испытания генной терапии» . Жестокие биотехнологии . 21 августа 2020 г. Проверено 21 сентября 2020 г.
- ^ «Смерть от генной терапии AAV в высоких дозах» . Природная биотехнология . 38 (8): 910. 1 августа 2020 г. doi : 10.1038/s41587-020-0642-9 . ISSN 1546-1696 . ПМИД 32760031 . S2CID 220981004 .
- ^ Перейти обратно: а б «Либмелди: Ожидается решение ЕС» . Европейское агентство лекарственных средств (EMA) . 16 октября 2020 года. Архивировано из оригинала 17 октября 2020 года . Проверено 16 октября 2020 г. Текст скопирован из источника, права на который принадлежат Европейскому агентству по лекарственным средствам. Воспроизведение разрешено при условии указания источника.
- ^ «Новая генная терапия для лечения редкого генетического заболевания — метахроматической лейкодистрофии» . Европейское агентство по лекарственным средствам . 16 октября 2020 г. Проверено 16 октября 2020 г. Текст скопирован из источника, права на который принадлежат Европейскому агентству по лекарственным средствам. Воспроизведение разрешено при условии указания источника.
- ^ «Либмелды ЭПАР» . Европейское агентство лекарственных средств (EMA) . 13 октября 2020 г. Проверено 22 декабря 2020 г.
- ^ Лизоген (15 октября 2020 г.). «Лизоген предоставляет обновленную информацию о клиническом исследовании AAVance по оценке LYS-SAF302 у пациентов с МПС IIIA – Лизоген» . Архивировано из оригинала 17 октября 2020 года . Проверено 17 октября 2020 г.
- ^ Кон Д.Б., Бут С., Шоу К.Л., Сюй-Бэйфорд Дж., Гарабедиан Э., Тревизан В. и др. (май 2021 г.). «Аутологичная лентивирусная генная терапия ex vivo при дефиците аденозиндезаминазы» . Медицинский журнал Новой Англии . 384 (21): 2002–2013. дои : 10.1056/NEJMoa2027675 . ПМК 8240285 . ПМИД 33974366 .
- ^ Маркионе М (11 мая 2021 г.). «Вирус СПИДа, используемый в генной терапии для лечения болезни «пузырного ребенка»» . Стат . Проверено 19 июля 2021 г.
- ^ «Генная терапия восстанавливает иммунную функцию у детей с редким иммунодефицитом» . Национальные институты здравоохранения (NIH) . 11 мая 2021 г. Проверено 19 июля 2021 г.
- ^ «Почему генная терапия вызвала лейкемию у некоторых пациентов с синдромом «мальчика в пузыре»» . ScienceDaily . Проверено 19 июля 2021 г.
- ^ Мамкарц Э., Чжоу С., Локки Т., Абдельсамед Х., Кросс С.Дж., Кан Г. и др. (апрель 2019 г.). «Лентивирусная генная терапия в сочетании с низкими дозами бусульфана у младенцев с SCID-X1» . Медицинский журнал Новой Англии . 380 (16): 1525–1534. дои : 10.1056/NEJMoa1815408 . ПМК 6636624 . ПМИД 30995372 .
- ^ «ВИЧ использовался для лечения болезни «мальчика-пузыря»» . Новости Би-би-си . 17 апреля 2019 года . Проверено 19 июля 2021 г.
- ^ Питтман Дж., Равиц Дж.Д. «Эти ученые, возможно, нашли лекарство от болезни «мальчика-пузыря»» . Смитсоновский журнал . Проверено 19 июля 2021 г.
- ^ Рор К. (17 апреля 2019 г.). «Генная терапия восстанавливает иммунитет у детей раннего возраста с редким иммунодефицитным заболеванием» . Национальные институты здравоохранения (NIH) . Проверено 4 июня 2020 г.
- ^ Гиллмор Дж.Д., Гейн Э., Таубель Дж., Као Дж., Фонтана М., Мейтленд М.Л. и др. (август 2021 г.). «Редактирование гена CRISPR-Cas9 in vivo при транстиретиновом амилоидозе» . Медицинский журнал Новой Англии . 385 (6): 493–502. дои : 10.1056/NEJMoa2107454 . ПМИД 34215024 . S2CID 235722446 .
- ^ «Новости: Обновление клинических испытаний: положительные данные о первом в истории лекарстве CRISPR in vivo» . CRISPR Медицина . Проверено 16 декабря 2021 г.
- ^ «Научные новости, определившие 2021 год: выбор природы». Природа . Декабрь 2021 г. doi : 10.1038/d41586-021-03734-6 . ПМИД 34907370 . S2CID 245144020 .
- ^ Пирсон Т.С., Гупта Н., Сан-Себастьян В., Имамура-Чинг Дж., Виховер А., Грихальво-Перес А. и др. (июль 2021 г.). «Генная терапия дефицита декарбоксилазы ароматических L-аминокислот путем прямой доставки AAV2-AADC под контролем МРТ в дофаминергические нейроны среднего мозга» . Природные коммуникации . 12 (1): 4251. Бибкод : 2021NatCo..12.4251P . дои : 10.1038/s41467-021-24524-8 . ПМЦ 8275582 . ПМИД 34253733 .
- ^ Ибрагим М (14 июля 2021 г.). «Генная терапия восстанавливает недостающий дофамин у детей с редким заболеванием головного мозга» . Наука . Проверено 18 июля 2021 г.
- ^ «Испытания генной терапии указывают на более широкие возможности для изменения течения редкого заболевания» . Стат . 12 июля 2021 г. Проверено 18 июля 2021 г.
- ^ Флотте Т.Р., Каталтепе О., Пури А., Батиста А.Р., Мозер Р., Маккенна-Ясек Д. и др. (февраль 2022 г.). «Генная терапия AAV при болезни Тея-Сакса» . Природная медицина . 28 (2): 251–259. дои : 10.1038/s41591-021-01664-4 . ПМЦ 10786171 . ПМИД 35145305 . S2CID 246748772 .
- ^ Сена-Эстевес М (14 февраля 2022 г.). «Первая генная терапия болезни Тея-Сакса успешно проведена двум детям» . Разговор . Проверено 7 марта 2022 г.
- ^ «Родители стали инициатором прорыва в генной терапии для детей с болезнью Тея-Сакса» . Независимый . 18 февраля 2022 г. Проверено 7 марта 2022 г.
- ^ «Упстаза: Ожидается решение ЕС» . Европейское агентство по лекарственным средствам . 19 мая 2022 года. Архивировано из оригинала 25 мая 2022 года . Проверено 22 мая 2022 г.
- ^ «PTC Therapeutics получила положительное заключение CHMP об использовании Upstaza для лечения дефицита AADC» . PTC Therapeutics (пресс-релиз). 20 мая 2022 г. Проверено 22 мая 2022 г.
- ^ Чоудари П., Шапиро С., Макрис М., Эванс Г., Бойс С., Толкс К. и др. (июль 2022 г.). «Фазы 1-2 исследования генной терапии AAVS3 у пациентов с гемофилией B» . Медицинский журнал Новой Англии . 387 (3): 237–247. дои : 10.1056/NEJMoa2119913 . ПМИД 35857660 . S2CID 250697905 .
- ^ «Новая генная терапия может снизить риск кровотечений у пациентов с гемофилией» . ScienceDaily . Проверено 3 августа 2022 г.
- ^ «Трансформационная терапия лечит гемофилию B» . Новости Би-би-си . 21 июля 2022 г. Проверено 3 августа 2022 г.
- ^ «Редактирование базы: революционная терапия избавляет девушку от неизлечимого рака» . Новости Би-би-си . 11 декабря 2022 г. Проверено 11 декабря 2022 г.
- ^ «Главные капли для генной терапии вернули мальчику зрение. Подобные методы лечения могут помочь миллионам» . АП Новости . 24 июля 2023 г. Проверено 31 июля 2023 г.
- ^ Хуан, Цзиньбо; Сюэ, Шуай; Бухманн, Питер; Тейшейра, Ханна Палм; Фюссенеггер, Мартин (16 августа 2023 г.). «Электрогенетический интерфейс для программирования экспрессии генов млекопитающих с помощью постоянного тока» . Природный метаболизм . 5 (8): 1395–1407. дои : 10.1038/ s42255-023-00850-7 ПМЦ 10447240 . ПМИД 37524785 .
Дальнейшее чтение
[ редактировать ]- «Генная терапия: обзор одобренных и разрабатываемых технологий» (PDF) . КАДТ (171). Март 2018 г. Архивировано (PDF) из оригинала 19 октября 2018 г.
- Баум С., Дюльманн Дж., Ли З., Фезе Б., Мейер Дж., Уильямс Д.А., фон Калле С. (март 2003 г.). «Побочные эффекты переноса ретровирусных генов в гемопоэтические стволовые клетки». Кровь . 101 (6): 2099–2114. дои : 10.1182/blood-2002-07-2314 . ПМИД 12511419 . S2CID 8489829 .
- Дейли Дж. (январь 2020 г.). «Прибытие генной терапии: после фальстарта лекарства, манипулирующие кодом жизни, наконец-то меняют жизнь» . Научный американец . 322 (1): Нет. doi : 10.1038/scientificamerican012020-2SglZYN24KkpjWDUVuCdME . ПМИД 39014835 .
- Гардлик Р., Палфи Р., Ходоси Дж., Лукач Дж., Турна Дж., Селец П. (апрель 2005 г.). «Векторы и системы доставки в генной терапии». Монитор медицинских наук . 11 (4): RA110–121. ПМИД 15795707 .
- Хорн П.А., Моррис Дж.К., Нефф Т., Кием Х.П. (сентябрь 2004 г.). «Перенос генов стволовых клеток – эффективность и безопасность в исследованиях на крупных животных» . Молекулярная терапия . 10 (3): 417–431. дои : 10.1016/j.ymthe.2004.05.017 . ПМИД 15336643 .
- Парамби Д.Г., Альхарби К.С., Кумар Р., Харилал С., Батиха Г.Е., Круз-Мартинс Н., Магди О., Мозес А., Панда Д.С., Мэтью Б. (октябрь 2021 г.). «Подход генной терапии с акцентом на факторы роста: теоретические и клинические результаты при нейродегенеративных заболеваниях» . Молекулярная нейробиология . 59 (1): 191–233. дои : 10.1007/s12035-021-02555-y . ПМЦ 8518903 . ПМИД 34655056 .
- Салмонс Б., Гюнцбург WH (апрель 1993 г.). «Нацеливание ретровирусных векторов на генную терапию». Генная терапия человека . 4 (2): 129–141. дои : 10.1089/hum.1993.4.2-129 . ПМИД 8494923 .
- Персонал (18 ноября 2005 г.). «Генная терапия» . Информация о проекте «Геном человека» . Окриджская национальная лаборатория . Архивировано из оригинала (FAQ) 27 апреля 2006 года . Проверено 28 мая 2006 г.
- Тиньков С., Бекереджян Р., Винтер Г., Костер С. (20 ноября 2000 г.). «Микропузырьки, конъюгированные с полиплексом, для усиленной генной терапии, нацеленной на ультразвук» (PDF) . Всемирный конгресс-центр Джорджии , Атланта, Джорджия: Ежегодное собрание и выставка AAPS 2008 г. Архивировано из оригинала (PDF) 7 июля 2012 года . Проверено 26 января 2009 г.
- Ван Х, Шаяхметов Д.М., Лидж Т., Харки М., Ли Кью, Папаяннопулу Т., Стаматояннопулус Г., Либер А. (сентябрь 2005 г.). «Модифицированный капсидом хелпер-зависимый аденовирусный вектор, содержащий контрольную область локуса бета-глобина, демонстрирует неслучайную картину интеграции и обеспечивает стабильную, специфичную для эритроида экспрессию генов» . Журнал вирусологии . 79 (17): 10999–11013. doi : 10.1128/JVI.79.17.10999-11013.2005 . ПМК 1193620 . ПМИД 16103151 .
