Wnt сигнальный путь
В клеточной биологии сигнальные пути Wnt представляют собой группу путей трансдукции сигнала , которые начинаются с белков , которые передают сигналы в клетку через рецепторы клеточной поверхности . Название Wnt-это портманто, созданное от имен бессмысленных и int-1. [ 1 ] Сигнальные пути Wnt используют либо близлежащую клеточную связь ( паракрин ), либо одноклеточную связь ( аутокрино ). Они высоко эволюционно сохраняются у животных, что означает, что они похожи по видам животных от плодовых мух до людей. [ 2 ] [ 3 ]
Были охарактеризованы три сигнального пути Wnt: канонический путь Wnt , неканонический путь полярности плоской клеток и неканонический путь Wnt/кальций . All three pathways are activated by the binding of a Wnt-protein ligand to a Frizzled family receptor , which passes the biological signal to the Dishevelled protein inside the cell. Канонический путь Wnt приводит к регуляции генов транскрипции и, как считается, частично регулируется геном Spats1 . [ 4 ] Неканонический путь полярности плоской клеток регулирует цитоскелет , который отвечает за форму клетки. Неканонический путь Wnt/кальция регулирует кальций внутри клетки.
Передача сигналов Wnt была впервые идентифицирована для его роли в канцерогенезе , а затем для его функции в эмбриональном развитии . Эмбриональные процессы, которые он контролирует, включают паттерн оси тела , судьбы клеток спецификацию , пролиферацию клеток и миграцию клеток . Эти процессы необходимы для правильного образования важных тканей, включая кость, сердце и мышцы. Его роль в эмбриональном развитии была обнаружена, когда генетические мутации в белках пути Wnt продуцировали аномальные фруктов эмбрионы . Более поздние исследования показали, что гены, ответственные за эти нарушения, также влияли на развитие рака молочной железы у мышей. Передача сигналов Wnt также контролирует регенерацию ткани у взрослого костного мозга, кожи и кишечника. [ 5 ]
Клиническое значение этого пути было продемонстрировано мутациями , которые приводят к различным заболеваниям, включая рак молочной железы и простаты , глиобластому , диабет II типа и другие. [ 6 ] [ 7 ] В последние годы исследователи сообщили о первом успешном использовании ингибиторов пути WNT на мышиных моделях заболевания. [ 8 ]
История и этимология
[ редактировать ]На обнаружение передачи сигналов Wnt повлияло исследования онкогенных (вызывающих рак) ретровирусов . В 1982 году мыши, инфицированные Roel Nusse и Harold Varmus, инфицировали мыши с вирусом опухоли молочной железы мыши , чтобы мутировать гены мыши, чтобы увидеть, какие мутированные гены могут вызывать опухоли молочной железы. Они определили новый протоонкоген мыши, который они назвали Int1 (интеграция 1). [ 3 ] [ 9 ]
Int1 высоко консервативен среди нескольких видов, включая людей и дрозофилу . Его присутствие в D. melanogaster привело к обнаружению исследователей в 1987 году, что ген Int1 в Drosophila на самом деле был уже известным и охарактеризованным геном Drosophila, известным как бесцветный (WG). [ 3 ] После предыдущих исследований Кристиана Нюслейна-Вольхарда и Эрика Висчауса (которые получили их Нобелевскую премию по физиологии или медицине в 1995 году) уже установили функцию WG как гена полярности сегмента , участвующего в формировании оси тела во время эмбриона , исследователи, исследователи, исследователи, исследователи, исследователи определил, что млекопитающий Int1, обнаруженный у мышей, также участвует в эмбриональном развитии. [ 10 ]
Продолжение исследования привело к открытию дальнейших генов, связанных с INT1; Однако, поскольку эти гены не были идентифицированы так же, как и int1, номенклатура гена int была неадекватной. Таким образом, семья Int/Bless стала семьей Wnt, и Int1 стал Wnt1. Название Wnt-это портманто INT и WG и означает «сайт интеграции, связанный с беской,». [ 3 ]
Белки
[ редактировать ]
WNT содержит разнообразное семейство секретируемых липидных сигнальных гликопротеинов 350–400 аминокислот . , которые имеют длину [ 11 ] Липидная модификация всех WNTS - пальмитолеоилирование одного полностью консервативного остатка цистеина. [ 12 ] Палмитолеоилирование необходимо, потому что для Wnt необходимо связываться с белком -носителем Wntless (WLS), чтобы его можно было транспортировать в плазматическую мембрану для секреции [ 13 ] и он позволяет белке Wnt связывать его рецептор [ 14 ] [ 15 ] Белки Wnt также подвергаются гликозилированию , которое прикрепляет углеводы , чтобы обеспечить надлежащую секрецию. [ 16 ] В передаче сигналов Wnt эти белки действуют как лиганды , чтобы активировать различные пути Wnt через паракринные и аутокринные маршруты. [ 2 ] [ 7 ]
Эти белки высоко консервативны по видам. [ 3 ] Их можно найти у мышей, людей, ксенопа , рыбок данио , дрозофилы и многих других. [ 17 ]
| Разновидность | Белки Wnt |
|---|---|
| Homo Sapiens | Wnt1 , Wnt2 , Wnt2b , Wnt3 , Wnt3a , Wnt4 , Wnt5a , Wnt5b , Wnt6 , Wnt7a , Wnt8a , Wnt8b , Wnt9a , Wnt9b , Wnt10a , Wnt10b , Wnt11 , Wnt16 , Wnt7b |
| Mus musculus (идентичные белки, как у H. sapiens) | Wnt1, Wnt2, Wnt2b, Wnt3, Wnt3a, Wnt4, Wnt5a, Wnt5b, Wnt6, Wnt7a, Wnt7b, Wnt8a, Wnt8b, Wnt9a, Wnt9b, Wnt10a, Wnt10b, Wnt11, Wnt16 |
| Xenopus | Wnt1, Wnt2, Wnt2b, Wnt3, Wnt3a, Wnt4, Wnt5a, Wnt5b, Wnt7a, Wnt7b, Wnt8a, Wnt8b, Wnt10a, Wnt10b, Wnt11, Wnt11r |
| Дания Ворс | Wnt1, Wnt2, Wnt2b, Wnt3, Wnt3a, Wnt4, Wnt5a, Wnt5b, Wnt6, Wnt7a, Wnt7b, Wnt8a, Wnt8b, Wnt10a, Wnt10b, Wnt11, Wnt16 |
| Drosophila | WG, DWNT2, DWNT3/5, DWN 4, DWNT6, WNTD/DWNT8, DWN10 |
| Гидра | hywnt1, hywnt5a, hywnt8, hywnt7, hywnt9/10a, hywnt9/10b, hywnt9/10c, hywnt11, hywnt16 |
| C. Elegans | Mom-2, Lin-44, EGL-20, Dog-1, Dog-2 [ 18 ] |
Механизм
[ редактировать ]

Фундамент
[ редактировать ]Передача сигналов Wnt начинается, когда белок Wnt связывается с N-концевым внеклеточным доменом, богатым цистеином рецептора семейного (FZ). [ 19 ] Эти рецепторы охватывают плазматическую мембрану семь раз и представляют собой отдельное семейство рецепторов, связанных с G-белком (GPCR). [ 20 ] Однако для облегчения передачи сигналов Wnt могут потребоваться совместные рецепторы наряду с взаимодействием между белком Wnt и рецептором FZ. Примеры включают связанный с рецептором липопротеина белок ( LRP ) -5/6, рецепторную тирозинкиназу (RTK) и ROR2 . [ 7 ] После активации рецептора сигнал отправляется на фосфопротеина посудоматку (DSH), который расположен в цитоплазме . Этот сигнал передается через прямое взаимодействие между FZ и DSH. Белки DSH присутствуют во всех организмах, и все они разделяют следующие высококонсервативные белковые домены : домен DIX амино-концевой DIX, центральный домен PDZ и карбокси-концевой DEP-домен . Эти разные домены важны, потому что после DSH сигнал Wnt может разветвляться в несколько путей, и каждый путь взаимодействует с различной комбинацией трех доменов. [ 21 ]
Канонические и неканонические пути
[ редактировать ]Три наиболее охарактеризованные сигнальные пути Wnt - это канонический путь Wnt, неканонический путь полярности плоских клеток и неканонический путь Wnt/кальций. Как предполагают их имена, эти пути принадлежат к одной из двух категорий: канонические или неканонические. Разница между категориями заключается в том, что канонический путь включает белок- бета-катенин (β-катенин), в то время как неканонический путь работает независимо от него. [ 19 ]

Канонический путь
[ редактировать ]Канонический путь Wnt (или путь Wnt/ β-катенин )-это путь Wnt, который вызывает накопление β-катенина в цитоплазме и его возможный транслокацию в ядро , чтобы действовать как транскрипционный коактиватор транскрипционных факторов , которые принадлежат TCF/ Семья Леф . Без WNT β-катенин не будет накапливаться в цитоплазме, так как комплекс разрушения обычно его унижает. Этот комплекс разрушения включает в себя следующие белки: аксин , полипоз аденоматоза (APC), белкопофосфатаза 2A (PP2A), гликоген -синтаза киназа 3 (GSK3) и казеинкиназа 1 α (CK1α). [ 22 ] [ 23 ] Он разрушает β-катенин, нацеливаясь на его на убиквитинирование , которое впоследствии отправляет его в протеасому для переваривания. [ 19 ] [ 24 ] Однако, как только Wnt связывает FZ и LRP5 / 6 , комплексная функция разрушения нарушается. Это связано с тем, что Wnt вызывает транслокацию отрицательного регулятора Wnt, Axin и комплекса разрушения в плазматическую мембрану. Фосфорилирование другими белками в комплексе разрушения впоследствии связывает аксин с цитоплазматическим хвостом LRP5/6. Аксин становится де-фосфорилируемым, а его стабильность и уровни снижаются. Затем DSH активируется посредством фосфорилирования, а его домены DIX и PDZ ингибируют активность GSK3 комплекса разрушения. Это позволяет β-катенину накапливаться и локализоваться в ядро и впоследствии индуцировать клеточный ответ посредством трансдукции генов наряду с TCF/LEF (фактор T-клеток/лимфоидный коэффициент) [ 25 ] факторы транскрипции. [ 24 ] β-катенин рекрутирует другие транскрипционные коактиваторы, такие как BCL9 , Pygopus [ 26 ] и парафибрамин/Hyrax. [ 27 ] Сложность транскрипционного комплекса, собранного β-катенином, начинает появляться благодаря новым протеомическим исследованиям с высокой пропускной способностью. [ 28 ] Тем не менее, единая теория того, как β-катенин приводит к тому, что экспрессия генов по-прежнему отсутствует, и тканеспецифические игроки могут помочь β-катенину определить его гены-мишени. [ 29 ] Экспрессивность взаимодействующих белков β-катенина усложняет наше понимание: β-катенин может быть непосредственно фосфорилирован в Ser552 с помощью Akt, что вызывает его диссоциация от клеточных контактов и накопления в цитозоле, а затем 14-3-3ζ взаимодействует с β-катенином в цитозоле. (PSER552) и усиливает его ядерную транслокацию. [ 30 ] BCL9 и Pygopus , на самом деле, были зарегистрированы, чтобы обладать несколькими β- катенинозависимыми функциями (следовательно, вероятно, независимых от Wnt). [ 31 ] [ 32 ] [ 33 ]
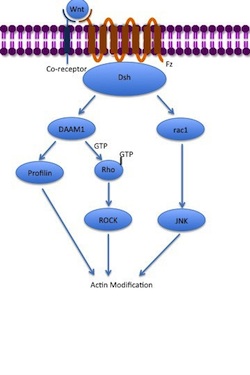
Неканонические пути
[ редактировать ]Путь неканонической плоской полярности клеток (PCP) не включает β-катенин. Он не использует LRP-5/6 в качестве со-рецептора и, как считается, использует NRH1 , RYK , PTK7 или ROR2 . Путь PCP активируется посредством связывания Wnt с FZ и его совместным рецептором. Затем рецептор рекрутирует DSH , который использует свои домены PDZ и DIX, чтобы сформировать комплекс с активатором Morphogenese 1 ( DAAM1 ), ассоциированного с DishEvended. Затем DAAM1 активирует небольшой G-белок RHO через фактор обмена гуанина . RHO активирует Rho-ассоциированную киназу (ROCK), которая является одним из основных регуляторов цитоскелета . DSH также образует комплекс с Rac1 и опосредует профилина связывание с актином . RAC1 активирует JNK и также может привести к актина полимеризации . Связывание профилина с актином может привести к реструктуризации цитоскелета и гаструляции . [ 7 ] [ 34 ]

Неканонический путь Wnt/кальция также не включает β-катенин . Его роль заключается в том, чтобы помочь регулировать высвобождение кальция из эндоплазматической ретикулумы (ER) для контроля внутриклеточного уровня кальция. Как и другие пути Wnt, после связывания лиганда, активированный рецептор FZ напрямую взаимодействует с DSH и активирует специфические домены DSH-протеина. Домены, участвующие в передаче сигналов Wnt/кальция, являются доменами PDZ и DEP. [ 7 ] Однако, в отличие от других путей WNT, рецептор FZ напрямую взаимодействует с тримерным G-белком. Эта костимуляция DSH и G-белка может привести к активации ПЛК или CGMP-специфического PDE . Если ПЛК активируется, компонент плазматической мембраны PIP2 расщепляется на DAG и IP3 . Когда IP3 связывает свой рецептор на ER, кальций высвобождается. Повышенные концентрации кальция и DAG могут активировать CDC42 через PKC . CDC42 является важным регулятором вентрального паттерна. Увеличение кальция также активирует кальциневрин и CAMKII . CAMKII индуцирует активацию NFAT транскрипции NFAT , который регулирует клеточную адгезию, миграцию и разделение тканей. [ 7 ] Кальциневрин активирует TAK1 и NLK- киназу, которая может мешать передаче сигналов TCF/β-катенина в каноническом пути WNT. [ 35 ] Однако, если PDE активируется, высвобождение кальция из ER ингибируется. PDE опосредует это посредством ингибирования PKG, что впоследствии вызывает ингибирование высвобождения кальция. [ 7 ]
Интегрированный путь Wnt
[ редактировать ]Бинарное различие канонических и неканонических сигнальных путей WNT подвергалось тщательному анализу, и был предложен интегрированный, сходимый путь WNT. [ 36 ] Некоторые доказательства этого были найдены для одного лиганда Wnt (Wnt5a). [ 37 ] Доказательства конвергентного сигнального пути Wnt, который показывает интегрированную активацию передачи сигналов Wnt/ CA2+ и Wnt/ β-катенина для множественных лигандов Wnt, было описано в клеточных линиях млекопитающих. [ 38 ]
Другие пути
[ редактировать ]Передача сигналов Wnt также регулирует ряд других сигнальных путей, которые не были так широко выяснены. Один такой путь включает взаимодействие между Wnt и GSK3 . Во время роста клеток WNT может ингибировать GSK3, чтобы активировать mTOR в отсутствие β-катенина. Тем не менее, WNT также может служить негативным регулятором mTOR посредством активации опухолевого супрессора TSC2 , который активируется с помощью взаимодействия DSH и GSK3. [ 39 ] Во время мигенеза WNT использует PA и CREB для активации MYOD и MYF5 . генов [ 40 ] Wnt также действует в сочетании с RYK и SRC , чтобы обеспечить регуляцию нейронов отталкивания во время наведения аксонов . Wnt регулирует гаструляцию , когда CK1 служит ингибитором RAP1-АТФазы для модуляции цитоскелета во время гаструляции. Дальнейшая регуляция гаструляции достигается, когда Wnt использует ROR2 вместе с путем CDC42 и JNK для регулирования экспрессии PAPC . DSH также может взаимодействовать с APKC, PA3 , PAR6 и LGL, чтобы контролировать полярность клеток и развитие цитоскелета микротрубочек . В то время как эти пути перекрываются с компонентами, связанными с PCP и передачей сигналов Wnt/Calcium, они считаются различными путями, потому что они дают разные ответы. [ 7 ]
Регулирование
[ редактировать ]Чтобы обеспечить правильное функционирование, передача сигналов Wnt постоянно регулируется в нескольких точках вдоль его сигнальных путей. [ 41 ] Например, белки Wnt имеют пальмитоилизированное . Белковый дикобран опосредует этот процесс, что означает, что он помогает регулировать, когда лиганд Wnt секретируется путем определения, когда он полностью сформирован. Секреция дополнительно контролируется белками, такими как GPR177 (Wntless) и прерывается ровность , а также комплексы, такие как ретромерный комплекс. [ 7 ] [ 24 ]
После секреции лиганд может быть предотвращено достичь своего рецептора посредством связывания белков, таких как стабилизаторы далли и глипикана 3 (GPC3), которые ингибируют диффузию. В раковых клетках обе гепаранские сульфатные цепи [ 42 ] [ 43 ] и основной белок [ 44 ] [ 45 ] GPC3 участвуют в регуляции связывания Wnt и активации для пролиферации клеток. [ 46 ] [ 47 ] Wnt распознает структуру гепаран сульфата на GPC3, которая содержит IDOA2S и GLCNS6S, а 3-O-Sulfation в GLCNS3S3S усиливает связывание WNT с глипиканом гепаран-сульфата. [ 48 ] Был идентифицирован богатый цистеином домен на N-лето GPC3, образуя Wnt-связывающую гидрофобную канавку, включая фенилаланин-41, который взаимодействует с Wnt. [ 45 ] [ 49 ] Блокирование домена связывания Wnt с использованием нанободии, называемой HN3, может ингибировать активацию Wnt. [ 45 ]
На рецепторе FZ связывание белков, кроме Wnt, может противодействовать передаче сигналов. Специфические антагонисты включают Dickkopf (DKK), ингибирующий фактор Wnt (WIF-1), [ 50 ] [ 51 ] Секретируемые белки, связанные с Frizzled (SFRP), Cerberus , FRZB , Мудрый , SOST и обнаженная кутикула . Они составляют ингибиторы передачи сигналов Wnt. Однако другие молекулы также действуют как активаторы. Norrin и R-Spondin2 активируют передачу сигналов Wnt в отсутствие лиганда Wnt.
Взаимодействие между сигнальными путями Wnt также регулирует передачу сигналов Wnt. Как упоминалось ранее, путь Wnt/кальция может ингибировать TCF/β-катенин, предотвращая каноническую передачу сигналов пути Wnt. [ 7 ] [ 24 ] Простагландин E2 (PGE2) является важным активатором канонического сигнального пути Wnt. Взаимодействие PGE2 с его рецепторами E2/E4 стабилизирует β-катенин посредством фосфорилирования ЦВЕТ/PKA. Синтез PGE2 необходим для передачи сигналов Wnt, таких как регенерация тканей и контроль популяции стволовых клеток у рыбок данио и мыши. [ 5 ] Интересно, что неструктурированные области нескольких негабаритных внутренних беспорядочных белков играют решающую роль в регуляции передачи сигналов Wnt. [ 52 ]
Индуцированные клеточные ответы
[ редактировать ]Эмбриональное развитие
[ редактировать ]Сигнализация Wnt играет важную роль в эмбриональном развитии. Он работает как у позвоночных , так и в беспозвоночных , включая людей, лягушек, рыбок данио, C. elegans , drosophila и других. Впервые он был обнаружен в полярности сегмента Drosophila, где помогает установить переднюю и заднюю полярность. Это связано с другими процессами развития . Как предполагает его функция в Drosophila , она играет ключевую роль в формировании оси тела , в частности, образование переднепосторных и дорсовентральных осей. Он участвует в индукции дифференцировки клеток для быстрого образования важных органов, таких как легкие и яичники . Далее WNT обеспечивает развитие этих тканей посредством правильной регуляции клеток пролиферации и миграции . Функции передачи сигналов Wnt можно разделить на паттерн оси, спецификацию судьбы клеток, пролиферацию клеток и миграцию клеток. [ 53 ]
Паттерн оси
[ редактировать ]В раннем развитии эмбрионов образование первичных оси тела является важным шагом в разработке общего плана тела организма. Оси включают переднюю ось, дорсовентуальную ось и правую левую ось. Передача сигналов Wnt вовлечена в образование переднепосторных и дорсовентральных (DV). Сигнальная активность Wnt в передне-ходовом развитии можно увидеть у млекопитающих, рыб и лягушек. У млекопитающих примитивная полоса и другие окружающие ткани продуцируют морфогенные соединения WNT, BMP , FGF , узловую и ретиноевую кислоту для установления задней области во время поздней гаструлы . Эти белки образуют градиенты концентрации. Области с самой высокой концентрацией устанавливают заднюю область, в то время как области с самой низкой концентрацией указывают на переднюю область. У рыб и лягушек β-катенин, продуцируемый каноническим сигналом Wnt, вызывает образование организационных центров, которые, наряду с BMP, вызывают заднее образование. Участие Wnt в образование оси DV можно увидеть в активности образования Организатор Spemann , который устанавливает дорсальный регион. Каноническая передача сигналов wnt β-катенина вызывает образование этого организатора посредством активации генов Twin и Siamois. [ 36 ] [ 53 ] Аналогично, в птичьей гаструляции клетки серпа Коллера экспрессируют различные мезодермальные маркерные гены, которые позволяют дифференциальному движению клеток во время образования примитивной полосы. Передача WNT, активированная FGFS, отвечает за это движение. [ 54 ] [ 55 ]
Передача сигналов Wnt также участвует в формировании оси определенных частей тела и систем органов позже в разработке. In vertebrates, sonic hedgehog (Shh) and Wnt morphogenetic signaling gradients establish the dorsoventral axis of the central nervous system during neural tube axial patterning. Высокая передача сигналов Wnt устанавливает дорсальную область, в то время как высокая передача сигналов Shh указывает на вентральную область. [ 56 ] WNT участвует в формировании DV центральной нервной системы посредством его участия в руководстве аксонов . Белки Wnt направляют аксоны спинного мозга в переднем заднем направлении. [ 57 ] Wnt также участвует в формировании оси конечности DV. В частности, Wnt7a помогает производить дорсальный паттерн развивающейся конечности. [ 36 ] [ 53 ]
In the embryonic differentiation waves model of development Wnt plays a critical role as part a signalling complex in competent cells ready to differentiate. Wnt reacts to the activity of the cytoskeleton, stabilizing the initial change created by a passing wave of contraction or expansion and simultaneously signals the nucleus through the use of its different signalling pathways as to which wave the individual cell has participated in. Wnt activity thereby amplifies mechanical signalling that occurs during development.[58][59]
Cell fate specification
[edit]Cell fate specification or cell differentiation is a process where undifferentiated cells can become a more specialized cell type. Wnt signaling induces differentiation of pluripotent stem cells into mesoderm and endoderm progenitor cells.[60] These progenitor cells further differentiate into cell types such as endothelial, cardiac and vascular smooth muscle lineages.[61] Wnt signaling induces blood formation from stem cells. Specifically, Wnt3 leads to mesoderm committed cells with hematopoietic potential.[62] Wnt1 antagonizes neural differentiation and is a major factor in self-renewal of neural stem cells. This allows for regeneration of nervous system cells, which is further evidence of a role in promoting neural stem cell proliferation.[60] Wnt signaling is involved in germ cell determination, gut tissue specification, hair follicle development, lung tissue development, trunk neural crest cell differentiation, nephron development, ovary development and sex determination.[53] Wnt signaling also antagonizes heart formation, and Wnt inhibition was shown to be a critical inducer of heart tissue during development,[63][64][65] and small molecule Wnt inhibitors are routinely used to produce cardiomyocytes from pluripotent stem cells.[66][67]
Cell proliferation
[edit]In order to have the mass differentiation of cells needed to form the specified cell tissues of different organisms, proliferation and growth of embryonic stem cells must take place. This process is mediated through canonical Wnt signaling, which increases nuclear and cytoplasmic β-catenin. Increased β-catenin can initiate transcriptional activation of proteins such as cyclin D1 and c-myc, which control the G1 to S phase transition in the cell cycle. Entry into the S phase causes DNA replication and ultimately mitosis, which are responsible for cell proliferation.[68] This proliferation increase is directly paired with cell differentiation because as the stem cells proliferate, they also differentiate. This allows for overall growth and development of specific tissue systems during embryonic development. This is apparent in systems such as the circulatory system where Wnt3a leads to proliferation and expansion of hematopoietic stem cells needed for red blood cell formation.[69]
The biochemistry of cancer stem cells is subtly different from that of other tumor cells. These so-called Wnt-addicted cells hijack and depend on constant stimulation of the Wnt pathway to promote their uncontrolled growth, survival and migration. In cancer, Wnt signaling can become independent of regular stimuli, through mutations in downstream oncogenes and tumor suppressor genes that become permanently activated even though the normal receptor has not received a signal. β-catenin binds to transcription factors such as the protein TCF4 and in combination the molecules activate the necessary genes. LF3 strongly inhibits this binding in vitro, in cell lines and reduced tumor growth in mouse models. It prevented replication and reduced their ability to migrate, all without affecting healthy cells. No cancer stem cells remained after treatment. The discovery was the product of "rational drug design", involving AlphaScreens and ELISA technologies.[70]
Cell migration
[edit]Cell migration during embryonic development allows for the establishment of body axes, tissue formation, limb induction and several other processes. Wnt signaling helps mediate this process, particularly during convergent extension. Signaling from both the Wnt PCP pathway and canonical Wnt pathway is required for proper convergent extension during gastrulation. Convergent extension is further regulated by the Wnt/calcium pathway, which blocks convergent extension when activated. Wnt signaling also induces cell migration in later stages of development through the control of the migration behavior of neuroblasts, neural crest cells, myocytes, and tracheal cells.[71]
Wnt signaling is involved in another key migration process known as the epithelial-mesenchymal transition (EMT). This process allows epithelial cells to transform into mesenchymal cells so that they are no longer held in place at the laminin. It involves cadherin down-regulation so that cells can detach from laminin and migrate. Wnt signaling is an inducer of EMT, particularly in mammary development.[72]
Insulin sensitivity
[edit]
Insulin is a peptide hormone involved in glucose homeostasis within certain organisms. Specifically, it leads to upregulation of glucose transporters in the cell membrane in order to increase glucose uptake from the bloodstream. This process is partially mediated by activation of Wnt/β-catenin signaling, which can increase a cell's insulin sensitivity. In particular, Wnt10b is a Wnt protein that increases this sensitivity in skeletal muscle cells.[73]
Clinical implications
[edit]Cancer
[edit]Since its initial discovery, Wnt signaling has had an association with cancer. When Wnt1 was discovered, it was first identified as a proto-oncogene in a mouse model for breast cancer. The fact that Wnt1 is a homolog of Wg shows that it is involved in embryonic development, which often calls for rapid cell division and migration. Misregulation of these processes can lead to tumor development via excess cell proliferation.[3]
Canonical Wnt pathway activity is involved in the development of benign and malignant breast tumors. The role of Wnt pathway in tumor chemoresistance has been also well documented, as well as its role in the maintenance of a distinct subpopulation of cancer-initiating cells.[74] Its presence is revealed by elevated levels of β-catenin in the nucleus and/or cytoplasm, which can be detected with immunohistochemical staining and Western blotting. Increased β-catenin expression is correlated with poor prognosis in breast cancer patients. This accumulation may be due to factors such as mutations in β-catenin, deficiencies in the β-catenin destruction complex, most frequently by mutations in structurally disordered regions of APC, overexpression of Wnt ligands, loss of inhibitors and/or decreased activity of regulatory pathways (such as the Wnt/calcium pathway).[52][75][76] Breast tumors can metastasize due to Wnt involvement in EMT. Research looking at metastasis of basal-like breast cancer to the lungs showed that repression of Wnt/β-catenin signaling can prevent EMT, which can inhibit metastasis.[77]
Wnt signaling has been implicated in the development of other cancers as well as in desmoid fibromatosis.[78] Changes in CTNNB1 expression, which is the gene that encodes β-catenin, can be measured in breast, colorectal, melanoma, prostate, lung, and other cancers. Increased expression of Wnt ligand-proteins such as Wnt1, Wnt2 and Wnt7A were observed in the development of glioblastoma, oesophageal cancer and ovarian cancer respectively. Other proteins that cause multiple cancer types in the absence of proper functioning include ROR1, ROR2, SFRP4, Wnt5A, WIF1 and those of the TCF/LEF family.[79] Wnt signaling is further implicated in the pathogenesis of bone metastasis from breast and prostate cancer with studies suggesting discrete on and off states. Wnt is down-regulated during the dormancy stage by autocrine DKK1 to avoid immune surveillance,[80] as well as during the dissemination stages by intracellular Dact1.[81] Meanwhile Wnt is activated during the early outgrowth phase by E-selectin.[82]
The link between PGE2 and Wnt suggests that a chronic inflammation-related increase of PGE2 may lead to activation of the Wnt pathway in different tissues, resulting in carcinogenesis.[5]
Type II diabetes
[edit]Diabetes mellitus type 2 is a common disease that causes reduced insulin secretion and increased insulin resistance in the periphery. It results in increased blood glucose levels, or hyperglycemia, which can be fatal if untreated. Since Wnt signaling is involved in insulin sensitivity, malfunctioning of its pathway could be involved. Overexpression of Wnt5b, for instance, may increase susceptibility due to its role in adipogenesis, since obesity and type II diabetes have high comorbidity.[83] Wnt signaling is a strong activator of mitochondrial biogenesis. This leads to increased production of reactive oxygen species (ROS) known to cause DNA and cellular damage.[84] This ROS-induced damage is significant because it can cause acute hepatic insulin resistance, or injury-induced insulin resistance.[85] Mutations in Wnt signaling-associated transcription factors, such as TCF7L2, are linked to increased susceptibility.[86]
See also
[edit]- AXIN1
- GSK-3
- Management of hair loss
- Wingless localisation element 3 (WLE3)
- WNT1-inducible-signaling pathway protein 1 (WISP1)
- WNT1-inducible-signaling pathway protein 2 (WISP2)
- WNT1-inducible-signaling pathway protein 3 (WISP3)
References
[edit]- ^ Nusse R, Brown A, Papkoff J, Scambler P, Shackleford G, McMahon A, et al. (January 1991). "A new nomenclature for int-1 and related genes: the Wnt gene family". Cell. 64 (2): 231. doi:10.1016/0092-8674(91)90633-a. PMID 1846319. S2CID 3189574.
- ^ Jump up to: a b Nusse R, Varmus HE (June 1992). "Wnt genes". Cell. 69 (7): 1073–87. doi:10.1016/0092-8674(92)90630-U. PMID 1617723. S2CID 10422968.
- ^ Jump up to: a b c d e f Nusse R (January 2005). "Wnt signaling in disease and in development". Cell Research. 15 (1): 28–32. doi:10.1038/sj.cr.7290260. PMID 15686623.
- ^ Zhang H, Zhang H, Zhang Y, Ng SS, Ren F, Wang Y, Duan Y, Chen L, Zhai Y, Guo Q, Chang Z (November 2010). "Dishevelled-DEP domain interacting protein (DDIP) inhibits Wnt signaling by promoting TCF4 degradation and disrupting the TCF4/beta-catenin complex". Cellular Signalling. 22 (11): 1753–60. doi:10.1016/j.cellsig.2010.06.016. PMID 20603214.
- ^ Jump up to: a b c Goessling W, North TE, Loewer S, Lord AM, Lee S, Stoick-Cooper CL, Weidinger G, Puder M, Daley GQ, Moon RT, Zon LI (March 2009). "Genetic interaction of PGE2 and Wnt signaling regulates developmental specification of stem cells and regeneration". Cell. 136 (6): 1136–47. doi:10.1016/j.cell.2009.01.015. PMC 2692708. PMID 19303855.
- ^ Logan CY, Nusse R (2004). "The Wnt signaling pathway in development and disease". Annual Review of Cell and Developmental Biology. 20: 781–810. CiteSeerX 10.1.1.322.311. doi:10.1146/annurev.cellbio.20.010403.113126. PMID 15473860.
- ^ Jump up to: a b c d e f g h i j Komiya Y, Habas R (April 2008). "Wnt signal transduction pathways". Organogenesis. 4 (2): 68–75. doi:10.4161/org.4.2.5851. PMC 2634250. PMID 19279717.
- ^ Zimmerli D, Hausmann G, Cantù C, Basler K (December 2017). "Pharmacological interventions in the Wnt pathway: inhibition of Wnt secretion versus disrupting the protein-protein interfaces of nuclear factors". British Journal of Pharmacology. 174 (24): 4600–4610. doi:10.1111/bph.13864. PMC 5727313. PMID 28521071.
- ^ Nusse R, van Ooyen A, Cox D, Fung YK, Varmus H (1984). "Mode of proviral activation of a putative mammary oncogene (int-1) on mouse chromosome 15". Nature. 307 (5947): 131–6. Bibcode:1984Natur.307..131N. doi:10.1038/307131a0. PMID 6318122. S2CID 4261052.
- ^ Klaus A, Birchmeier W (May 2008). "Wnt signalling and its impact on development and cancer". Nature Reviews. Cancer. 8 (5): 387–98. doi:10.1038/nrc2389. PMID 18432252. S2CID 31382024.
- ^ Cadigan KM, Nusse R (December 1997). "Wnt signaling: a common theme in animal development". Genes & Development. 11 (24): 3286–305. doi:10.1101/gad.11.24.3286. PMID 9407023.
- ^ Hannoush RN (October 2015). "Synthetic protein lipidation". Current Opinion in Chemical Biology. 28: 39–46. doi:10.1016/j.cbpa.2015.05.025. PMID 26080277.
- ^ Yu J, Chia J, Canning CA, Jones CM, Bard FA, Virshup DM (May 2014). "WLS retrograde transport to the endoplasmic reticulum during Wnt secretion". Developmental Cell. 29 (3): 277–91. doi:10.1016/j.devcel.2014.03.016. PMID 24768165.
- ^ Janda CY, Waghray D, Levin AM, Thomas C, Garcia KC (July 2012). "Structural basis of Wnt recognition by Frizzled". Science. 337 (6090): 59–64. Bibcode:2012Sci...337...59J. doi:10.1126/science.1222879. PMC 3577348. PMID 22653731.
- ^ Hosseini V, Dani C, Geranmayeh MH, Mohammadzadeh F, Nazari Soltan Ahmad S, Darabi M (June 2019). "Wnt lipidation: Roles in trafficking, modulation, and function". Journal of Cellular Physiology. 234 (6): 8040–8054. doi:10.1002/jcp.27570. PMID 30341908. S2CID 53009014.
- ^ Kurayoshi M, Yamamoto H, Izumi S, Kikuchi A (March 2007). "Post-translational palmitoylation and glycosylation of Wnt-5a are necessary for its signalling". The Biochemical Journal. 402 (3): 515–23. doi:10.1042/BJ20061476. PMC 1863570. PMID 17117926.
- ^ Nusse, Roel. "The Wnt Homepage". Retrieved 15 April 2013.
- ^ Sawa H, Korswagen HC (March 2013). "WNT signaling in C. Elegans". WormBook: 1–30. doi:10.1895/wormbook.1.7.2. PMC 5402212. PMID 25263666.
- ^ Jump up to: a b c Rao TP, Kühl M (June 2010). "An updated overview on Wnt signaling pathways: a prelude for more". Circulation Research. 106 (12): 1798–806. doi:10.1161/CIRCRESAHA.110.219840. PMID 20576942.
- ^ Schulte G, Bryja V (October 2007). "The Frizzled family of unconventional G-protein-coupled receptors". Trends in Pharmacological Sciences. 28 (10): 518–25. doi:10.1016/j.tips.2007.09.001. PMID 17884187.
- ^ Habas R, Dawid IB (February 2005). "Dishevelled and Wnt signaling: is the nucleus the final frontier?". Journal of Biology. 4 (1): 2. doi:10.1186/jbiol22. PMC 551522. PMID 15720723.
- ^ Minde DP, Anvarian Z, Rüdiger SG, Maurice MM (August 2011). "Messing up disorder: how do missense mutations in the tumor suppressor protein APC lead to cancer?". Molecular Cancer. 10: 101. doi:10.1186/1476-4598-10-101. PMC 3170638. PMID 21859464.
- ^ Minde DP, Radli M, Forneris F, Maurice MM, Rüdiger SG (2013). Buckle AM (ed.). "Large extent of disorder in Adenomatous Polyposis Coli offers a strategy to guard Wnt signalling against point mutations". PLOS ONE. 8 (10): e77257. Bibcode:2013PLoSO...877257M. doi:10.1371/journal.pone.0077257. PMC 3793970. PMID 24130866.
- ^ Jump up to: a b c d MacDonald BT, Tamai K, He X (July 2009). "Wnt/beta-catenin signaling: components, mechanisms, and diseases". Developmental Cell. 17 (1): 9–26. doi:10.1016/j.devcel.2009.06.016. PMC 2861485. PMID 19619488.
- ^ Staal FJ, Clevers H (February 2000). "Tcf/Lef transcription factors during T-cell development: unique and overlapping functions". The Hematology Journal. 1 (1): 3–6. doi:10.1038/sj.thj.6200001. PMID 11920163.
- ^ Kramps T, Peter O, Brunner E, Nellen D, Froesch B, Chatterjee S, Murone M, Züllig S, Basler K (April 2002). "Wnt/wingless signaling requires BCL9/legless-mediated recruitment of pygopus to the nuclear beta-catenin-TCF complex" (PDF). Cell. 109 (1): 47–60. doi:10.1016/s0092-8674(02)00679-7. PMID 11955446. S2CID 16720801. Archived from the original (PDF) on 2021-09-26. Retrieved 2020-06-03.
- ^ Mosimann C, Hausmann G, Basler K (April 2006). "Parafibromin/Hyrax activates Wnt/Wg target gene transcription by direct association with beta-catenin/Armadillo". Cell. 125 (2): 327–41. doi:10.1016/j.cell.2006.01.053. PMID 16630820.
- ^ van Tienen LM, Mieszczanek J, Fiedler M, Rutherford TJ, Bienz M (March 2017). "Constitutive scaffolding of multiple Wnt enhanceosome components by Legless/BCL9". eLife. 6: e20882. doi:10.7554/elife.20882. PMC 5352222. PMID 28296634.
- ^ Söderholm, Simon; Cantù, Claudio (21 October 2020). "The WNT/β-catenin dependent transcription: A tissue-specific business". WIREs Systems Biology and Medicine. 13 (3): e1511. doi:10.1002/wsbm.1511. PMC 9285942. PMID 33085215.
- ^ Fang D, Hawke D, Zheng Y, Xia Y, Meisenhelder J, Nika H, Mills GB, Kobayashi R, Hunter T, Lu Z (April 2007). "Phosphorylation of beta-catenin by AKT promotes beta-catenin transcriptional activity". Journal of Biological Chemistry. 282 (15): 11221–9. doi:10.1074/jbc.M611871200. PMC 1850976. PMID 17287208.
- ^ Cantù C, Valenta T, Hausmann G, Vilain N, Aguet M, Basler K (June 2013). "The Pygo2-H3K4me2/3 interaction is dispensable for mouse development and Wnt signaling-dependent transcription". Development. 140 (11): 2377–86. doi:10.1242/dev.093591. PMID 23637336.
- ^ Cantù C, Zimmerli D, Hausmann G, Valenta T, Moor A, Aguet M, Basler K (September 2014). "Pax6-dependent, but β-catenin-independent, function of Bcl9 proteins in mouse lens development". Genes & Development. 28 (17): 1879–84. doi:10.1101/gad.246140.114. PMC 4197948. PMID 25184676.
- ^ Cantù C, Pagella P, Shajiei TD, Zimmerli D, Valenta T, Hausmann G, Basler K, Mitsiadis TA (February 2017). "A cytoplasmic role of Wnt/β-catenin transcriptional cofactors Bcl9, Bcl9l, and Pygopus in tooth enamel formation". Science Signaling. 10 (465): eaah4598. doi:10.1126/scisignal.aah4598. PMID 28174279. S2CID 6845295.
- ^ Gordon MD, Nusse R (August 2006). "Wnt signaling: multiple pathways, multiple receptors, and multiple transcription factors". The Journal of Biological Chemistry. 281 (32): 22429–33. doi:10.1074/jbc.R600015200. PMID 16793760.
- ^ Sugimura R, Li L (December 2010). "Noncanonical Wnt signaling in vertebrate development, stem cells, and diseases". Birth Defects Research. Part C, Embryo Today. 90 (4): 243–56. doi:10.1002/bdrc.20195. PMID 21181886.
- ^ Jump up to: a b c van Amerongen R, Nusse R (October 2009). "Towards an integrated view of Wnt signaling in development". Development. 136 (19): 3205–14. doi:10.1242/dev.033910. PMID 19736321. S2CID 16120512.
- ^ van Amerongen R, Fuerer C, Mizutani M, Nusse R (September 2012). "Wnt5a can both activate and repress Wnt/β-catenin signaling during mouse embryonic development". Developmental Biology. 369 (1): 101–14. doi:10.1016/j.ydbio.2012.06.020. PMC 3435145. PMID 22771246.
- ^ Thrasivoulou C, Millar M, Ahmed A (December 2013). "Activation of intracellular calcium by multiple Wnt ligands and translocation of β-catenin into the nucleus: a convergent model of Wnt/Ca2+ and Wnt/β-catenin pathways". The Journal of Biological Chemistry. 288 (50): 35651–9. doi:10.1074/jbc.M112.437913. PMC 3861617. PMID 24158438.
- ^ Inoki K, Ouyang H, Zhu T, Lindvall C, Wang Y, Zhang X, Yang Q, Bennett C, Harada Y, Stankunas K, Wang CY, He X, MacDougald OA, You M, Williams BO, Guan KL (September 2006). "TSC2 integrates Wnt and energy signals via a coordinated phosphorylation by AMPK and GSK3 to regulate cell growth". Cell. 126 (5): 955–68. doi:10.1016/j.cell.2006.06.055. PMID 16959574. S2CID 16047397.
- ^ Kuroda K, Kuang S, Taketo MM, Rudnicki MA (March 2013). "Canonical Wnt signaling induces BMP-4 to specify slow myofibrogenesis of fetal myoblasts". Skeletal Muscle. 3 (1): 5. doi:10.1186/2044-5040-3-5. PMC 3602004. PMID 23497616.
- ^ Malinauskas T, Jones EY (December 2014). "Extracellular modulators of Wnt signalling". Current Opinion in Structural Biology. 29: 77–84. doi:10.1016/j.sbi.2014.10.003. PMID 25460271.
- ^ Gao W, Kim H, Feng M, Phung Y, Xavier CP, Rubin JS, Ho M (August 2014). "Inactivation of Wnt signaling by a human antibody that recognizes the heparan sulfate chains of glypican-3 for liver cancer therapy". Hepatology. 60 (2): 576–87. doi:10.1002/hep.26996. PMC 4083010. PMID 24492943.
- ^ Gao W, Xu Y, Liu J, Ho M (May 2016). "Epitope mapping by a Wnt-blocking antibody: evidence of the Wnt binding domain in heparan sulfate". Scientific Reports. 6: 26245. Bibcode:2016NatSR...626245G. doi:10.1038/srep26245. PMC 4869111. PMID 27185050.
- ^ Gao W, Tang Z, Zhang YF, Feng M, Qian M, Dimitrov DS, Ho M (March 2015). "Immunotoxin targeting glypican-3 regresses liver cancer via dual inhibition of Wnt signalling and protein synthesis". Nature Communications. 6: 6536. Bibcode:2015NatCo...6.6536G. doi:10.1038/ncomms7536. PMC 4357278. PMID 25758784.
- ^ Jump up to: a b c Li N, Wei L, Liu X, Bai H, Ye Y, Li D, et al. (April 2019). "A Frizzled-Like Cysteine-Rich Domain in Glypican-3 Mediates Wnt Binding and Regulates Hepatocellular Carcinoma Tumor Growth in Mice". Hepatology. 70 (4): 1231–1245. doi:10.1002/hep.30646. PMC 6783318. PMID 30963603.
- ^ Ho M, Kim H (February 2011). "Glypican-3: a new target for cancer immunotherapy". European Journal of Cancer. 47 (3): 333–8. doi:10.1016/j.ejca.2010.10.024. PMC 3031711. PMID 21112773.
- ^ Li N, Gao W, Zhang YF, Ho M (November 2018). "Glypicans as Cancer Therapeutic Targets". Trends in Cancer. 4 (11): 741–754. doi:10.1016/j.trecan.2018.09.004. PMC 6209326. PMID 30352677.
- ^ Gao, Wei; Xu, Yongmei; Liu, Jian; Ho, Mitchell (May 17, 2016). "Epitope mapping by a Wnt-blocking antibody: evidence of the Wnt binding domain in heparan sulfate". Scientific Reports. 6: 26245. Bibcode:2016NatSR...626245G. doi:10.1038/srep26245. ISSN 2045-2322. PMC 4869111. PMID 27185050.
- ^ Kolluri A, Ho M (2019-08-02). "The Role of Glypican-3 in Regulating Wnt, YAP, and Hedgehog in Liver Cancer". Frontiers in Oncology. 9: 708. doi:10.3389/fonc.2019.00708. PMC 6688162. PMID 31428581.
- ^ Malinauskas T, Aricescu AR, Lu W, Siebold C, Jones EY (July 2011). "Modular mechanism of Wnt signaling inhibition by Wnt inhibitory factor 1". Nature Structural & Molecular Biology. 18 (8): 886–93. doi:10.1038/nsmb.2081. PMC 3430870. PMID 21743455.
- ^ Malinauskas T (March 2008). "Docking of fatty acids into the WIF domain of the human Wnt inhibitory factor-1". Lipids. 43 (3): 227–30. doi:10.1007/s11745-007-3144-3. PMID 18256869. S2CID 31357937.
- ^ Jump up to: a b Minde DP, Radli M, Forneris F, Maurice MM, Rüdiger SG (2013). "Large extent of disorder in Adenomatous Polyposis Coli offers a strategy to guard Wnt signalling against point mutations". PLOS ONE. 8 (10): e77257. Bibcode:2013PLoSO...877257M. doi:10.1371/journal.pone.0077257. PMC 3793970. PMID 24130866.
- ^ Jump up to: a b c d Gilbert SF (2010). Developmental biology (9th ed.). Sunderland, Mass.: Sinauer Associates. ISBN 9780878933846.
- ^ Vasiev B, Balter A, Chaplain M, Glazier JA, Weijer CJ (May 2010). "Modeling gastrulation in the chick embryo: formation of the primitive streak". PLOS ONE. 5 (5): e10571. Bibcode:2010PLoSO...510571V. doi:10.1371/journal.pone.0010571. PMC 2868022. PMID 20485500.
- ^ Gilbert SF (2014). "Early Development in Birds". Developmental Biology (10th ed.). Sunderland (MA): Sinauer Associates.
- ^ Ulloa F, Martí E (January 2010). "Wnt won the war: antagonistic role of Wnt over Shh controls dorso-ventral patterning of the vertebrate neural tube". Developmental Dynamics. 239 (1): 69–76. doi:10.1002/dvdy.22058. PMID 19681160.
- ^ Zou Y (September 2004). "Wnt signaling in axon guidance". Trends in Neurosciences. 27 (9): 528–32. doi:10.1016/j.tins.2004.06.015. PMID 15331234. S2CID 15635026.
- ^ Gordon NK, Gordon R (March 2016). "The organelle of differentiation in embryos: the cell state splitter". Theoretical Biology & Medical Modelling. 13: 11. doi:10.1186/s12976-016-0037-2. PMC 4785624. PMID 26965444.
- ^ Gordon N, Gordon, R (2016). Embryogenesis Explained. Singapore: World Scientific Publishing. pp. 580–591. doi:10.1142/8152. ISBN 978-981-4740-69-2.
- ^ Jump up to: a b Nusse R (May 2008). "Wnt signaling and stem cell control". Cell Research. 18 (5): 523–7. doi:10.1038/cr.2008.47. PMID 18392048.
- ^ Bakre MM, Hoi A, Mong JC, Koh YY, Wong KY, Stanton LW (October 2007). "Generation of multipotential mesendodermal progenitors from mouse embryonic stem cells via sustained Wnt pathway activation". The Journal of Biological Chemistry. 282 (43): 31703–12. doi:10.1074/jbc.M704287200. PMID 17711862.
- ^ Woll PS, Morris JK, Painschab MS, Marcus RK, Kohn AD, Biechele TL, Moon RT, Kaufman DS (January 2008). "Wnt signaling promotes hematoendothelial cell development from human embryonic stem cells". Blood. 111 (1): 122–31. doi:10.1182/blood-2007-04-084186. PMC 2200802. PMID 17875805.
- ^ Schneider VA, Mercola M (February 2001). "Wnt antagonism initiates cardiogenesis in Xenopus laevis". Genes & Development. 15 (3): 304–15. doi:10.1101/gad.855601. PMC 312618. PMID 11159911.
- ^ Marvin MJ, Di Rocco G, Gardiner A, Bush SM, Lassar AB (February 2001). "Inhibition of Wnt activity induces heart formation from posterior mesoderm". Genes & Development. 15 (3): 316–27. doi:10.1101/gad.855501. PMC 312622. PMID 11159912.
- ^ Ueno S, Weidinger G, Osugi T, Kohn AD, Golob JL, Pabon L, Reinecke H, Moon RT, Murry CE (June 2007). "Biphasic role for Wnt/beta-catenin signaling in cardiac specification in zebrafish and embryonic stem cells". Proceedings of the National Academy of Sciences of the United States of America. 104 (23): 9685–90. Bibcode:2007PNAS..104.9685U. doi:10.1073/pnas.0702859104. PMC 1876428. PMID 17522258.
- ^ Willems E, Spiering S, Davidovics H, Lanier M, Xia Z, Dawson M, Cashman J, Mercola M (August 2011). "Small-molecule inhibitors of the Wnt pathway potently promote cardiomyocytes from human embryonic stem cell-derived mesoderm". Circulation Research. 109 (4): 360–4. doi:10.1161/CIRCRESAHA.111.249540. PMC 3327303. PMID 21737789.
- ^ Burridge PW, Matsa E, Shukla P, Lin ZC, Churko JM, Ebert AD, Lan F, Diecke S, Huber B, Mordwinkin NM, Plews JR, Abilez OJ, Cui B, Gold JD, Wu JC (August 2014). "Chemically defined generation of human cardiomyocytes". Nature Methods. 11 (8): 855–60. doi:10.1038/nmeth.2999. PMC 4169698. PMID 24930130.
- ^ Kaldis P, Pagano M (December 2009). "Wnt signaling in mitosis". Developmental Cell. 17 (6): 749–50. doi:10.1016/j.devcel.2009.12.001. PMID 20059944.
- ^ Willert K, Jones KA (June 2006). "Wnt signaling: is the party in the nucleus?". Genes & Development. 20 (11): 1394–404. doi:10.1101/gad.1424006. PMID 16751178.
- ^ Hodge, Russ (2016-01-25). "Hacking the programs of cancer stem cells". medicalxpress.com. Medical Express. Retrieved 2016-02-12.
- ^ Schambony A, Wedlich D (2013). Wnt Signaling and Cell Migration. Landes Bioscience. Retrieved 7 May 2013.
{{cite book}}:|website=ignored (help) - ^ Micalizzi DS, Farabaugh SM, Ford HL (June 2010). "Epithelial-mesenchymal transition in cancer: parallels between normal development and tumor progression". Journal of Mammary Gland Biology and Neoplasia. 15 (2): 117–34. doi:10.1007/s10911-010-9178-9. PMC 2886089. PMID 20490631.
- ^ Abiola M, Favier M, Christodoulou-Vafeiadou E, Pichard AL, Martelly I, Guillet-Deniau I (December 2009). "Activation of Wnt/beta-catenin signaling increases insulin sensitivity through a reciprocal regulation of Wnt10b and SREBP-1c in skeletal muscle cells". PLOS ONE. 4 (12): e8509. Bibcode:2009PLoSO...4.8509A. doi:10.1371/journal.pone.0008509. PMC 2794543. PMID 20041157.
- ^ Milosevic, V. et al. Wnt/IL-1β/IL-8 autocrine circuitries control chemoresistance in mesothelioma initiating cells by inducing ABCB5.Int. J. Cancer, https://doi.org/10.1002/ijc.32419
- ^ Howe LR, Brown AM (January 2004). "Wnt signaling and breast cancer". Cancer Biology & Therapy. 3 (1): 36–41. doi:10.4161/cbt.3.1.561. PMID 14739782.
- ^ Taketo MM (April 2004). "Shutting down Wnt signal-activated cancer". Nature Genetics. 36 (4): 320–2. doi:10.1038/ng0404-320. PMID 15054482.
- ^ DiMeo TA, Anderson K, Phadke P, Fan C, Feng C, Perou CM, Naber S, Kuperwasser C (July 2009). "A novel lung metastasis signature links Wnt signaling with cancer cell self-renewal and epithelial-mesenchymal transition in basal-like breast cancer". Cancer Research. 69 (13): 5364–73. doi:10.1158/0008-5472.CAN-08-4135. PMC 2782448. PMID 19549913.
- ^ Howard, J. Harrison; Pollock, Raphael E. (June 2016). "Intra-Abdominal and Abdominal Wall Desmoid Fibromatosis". Oncology and Therapy. 4 (1): 57–72. doi:10.1007/s40487-016-0017-z. ISSN 2366-1070. PMC 5315078. PMID 28261640.
- ^ Anastas JN, Moon RT (January 2013). "WNT signalling pathways as therapeutic targets in cancer". Nature Reviews. Cancer. 13 (1): 11–26. doi:10.1038/nrc3419. PMID 23258168. S2CID 35599667.
- ^ Malladi, Srinivas; Macalinao, Danilo G.; Jin, Xin; He, Lan; Basnet, Harihar; Zou, Yilong; de Stanchina, Elisa; Massagué, Joan (2016-03-24). "Metastatic Latency and Immune Evasion through Autocrine Inhibition of WNT". Cell. 165 (1): 45–60. doi:10.1016/j.cell.2016.02.025. ISSN 1097-4172. PMC 4808520. PMID 27015306.
- ^ Esposito, Mark; Fang, Cao; Cook, Katelyn C.; Park, Nana; Wei, Yong; Spadazzi, Chiara; Bracha, Dan; Gunaratna, Ramesh T.; Laevsky, Gary; DeCoste, Christina J.; Slabodkin, Hannah (March 2021). "TGF-β-induced DACT1 biomolecular condensates repress Wnt signalling to promote bone metastasis". Nature Cell Biology. 23 (3): 257–267. doi:10.1038/s41556-021-00641-w. ISSN 1476-4679. PMC 7970447. PMID 33723425.
- ^ Esposito, Mark; Mondal, Nandini; Greco, Todd M.; Wei, Yong; Spadazzi, Chiara; Lin, Song-Chang; Zheng, Hanqiu; Cheung, Corey; Magnani, John L.; Lin, Sue-Hwa; Cristea, Ileana M. (May 2019). "Bone vascular niche E-selectin induces mesenchymal–epithelial transition and Wnt activation in cancer cells to promote bone metastasis". Nature Cell Biology. 21 (5): 627–639. doi:10.1038/s41556-019-0309-2. ISSN 1476-4679. PMC 6556210. PMID 30988423.
- ^ Welters HJ, Kulkarni RN (December 2008). "Wnt signaling: relevance to beta-cell biology and diabetes". Trends in Endocrinology and Metabolism. 19 (10): 349–55. doi:10.1016/j.tem.2008.08.004. PMID 18926717. S2CID 19299033.
- ^ Yoon JC, Ng A, Kim BH, Bianco A, Xavier RJ, Elledge SJ (July 2010). "Wnt signaling regulates mitochondrial physiology and insulin sensitivity". Genes & Development. 24 (14): 1507–18. doi:10.1101/gad.1924910. PMC 2904941. PMID 20634317.
- ^ Zhai L, Ballinger SW, Messina JL (March 2011). "Role of reactive oxygen species in injury-induced insulin resistance". Molecular Endocrinology. 25 (3): 492–502. doi:10.1210/me.2010-0224. PMC 3045736. PMID 21239612.
- ^ Grant SF, Thorleifsson G, Reynisdottir I, Benediktsson R, Manolescu A, Sainz J, et al. (March 2006). "Variant of transcription factor 7-like 2 (TCF7L2) gene confers risk of type 2 diabetes". Nature Genetics. 38 (3): 320–3. doi:10.1038/ng1732. PMID 16415884. S2CID 28825825.
Further reading
[edit]- Milosevic V, et al. (Январь 2020 г.). «Аутокринная схема Wnt/IL-1β/IL-8 контролирует хеморезистентность в клетках мезотелиомы, индуцируя ABCB5» . Инт. Дж. Рак . 146 (1): 192–207. doi : 10.1002/ijc.32419 . HDL : 2318/1711962 . PMID 31107974 . S2CID 160014053 .
- Dinasarapu AR, Saunders B, Ozerlat I, Azam K, Subramaniam S (июнь 2011 г.). «Страницы молекулы сигнального шлюза-перспектива модели данных» . Биоинформатика . 27 (12): 1736–8. doi : 10.1093/bioinformatics/btr190 . PMC 3106186 . PMID 21505029 .
Внешние ссылки
[ редактировать ]- Wnt+белки в Национальной библиотеке медицинской библиотеки Медицинской библиотеки (сетка)