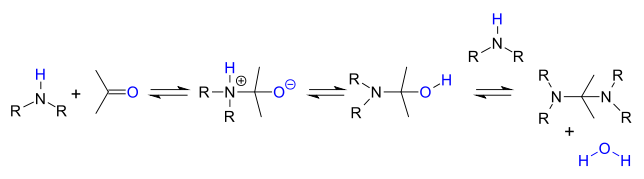Карбонильная конденсация
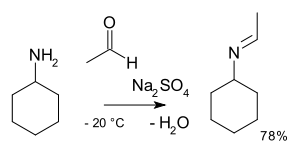
В органической химии алкилимино оксо-бизамещение — это органическая реакция карбонильных -де - соединений с аминами с образованием иминов . [ 2 ] Название реакции основано на Номенклатуре превращений ИЮПАК . Реакция катализируется кислотой , тип реакции представляет собой нуклеофильное присоединение амина к карбонильному соединению с последующим переносом протона от азота к кислороду к стабильному гемиаминалю или карбиноламину. У первичных аминов вода теряется в реакции элиминирования до имина . С ариламинами особенно устойчивые основания Шиффа образуются .
Механизм реакции
[ редактировать ]Стадии реакции являются обратимыми реакциями , и реакция доводится до завершения путем удаления воды, например, с помощью азеотропной перегонки , молекулярных сит или тетрахлорида титана . Первичные амины реагируют через нестабильное полуаминное промежуточное соединение, которое затем отщепляет воду.
Вторичные амины не теряют воду легко, потому что у них нет доступного протона, и вместо этого они часто реагируют дальше с аминалем :
или когда α-карбонильный протон присутствует в енамине :
В кислой среде продукт реакции представляет собой соль иминия за счет потери воды.
Этот тип реакции встречается во многих препаратах гетероциклов , например, в реакции Поварова и синтезе Фридлендера с получением хинолинов .
Внутримолекулярное замещение
[ редактировать ]Соединения, содержащие как первичную, так и вторичную аминную и карбонильную функциональную группу, часто являются лабильными. Настоящее руководство применимо к аминоальдегидам, аминокетонам и аминоэфирам; действительно, молекула не может нести одновременно ( незащищенные ) альдегидные и аминные группы. Аминоацетон , простейший аминокетон, не может быть выделен в жидком или твердом виде. [ 3 ] а 2-аминобензальдегид олигомеризуется в растворе или в расплаве. [ 4 ] α- , формилазиридин обратимо восстановленный с помощью DIBAL из сложного эфира . [ Примечание 1 ] димеризуется в [ Примечание 2 ] оксазолидин : [ 5 ]

Связанные реакции
[ редактировать ]Гидразины и гидроксиламины замещают карбонильные атомы кислорода гораздо легче, чем амины. Их равновесие сильно благоприятствует дегидратированному продукту, и карбонил извлекается с трудом. [ 6 ]
Примечания
[ редактировать ]- ^ При реакции с борогидридом натрия димер преобразует мономер и поэтому должен находиться в равновесии с последним.
- ^ Штамм с высоким содержанием азиридина геометрически ингибирует элиминацию с образованием иона иминия .
Ссылки
[ редактировать ]- ^ Виттиг, Г.; Гессен, А. (1970). «Направленная альдольная конденсация: β-фенилкоричный альдегид». Органические синтезы . 50:66 . дои : 10.15227/orgsyn.050.0066 .
- ^ Марч Джерри; (1985). Реакции, механизмы и структура продвинутой органической химии (3-е изд.). Нью-Йорк: John Wiley & Sons, Inc. ISBN 0-471-85472-7
- ^ Джон Д. Хепворт (1965). «Аминоацетона семикарбазона гидрохлорид». Органические синтезы . 45 : 1. дои : 10.15227/orgsyn.045.0001 .
- ^ Таммел, Рэндольф П. (2001). «2-Аминобензальдегид». Энциклопедия реагентов для органического синтеза . дои : 10.1002/047084289X.ra088 . ISBN 0471936235 .
- ^ Хили, Райан; Юдин, Андрей К. (2006). «Доступные незащищенные аминоальдегиды». Журнал Американского химического общества . 128 (46): 14772–14773. дои : 10.1021/ja065898s . ПМИД 17105264 .
- ^ Гроссман, Роберт Б. (2003). Искусство написания разумных механизмов органических реакций (2-е изд.). Нью-Йорк: Спрингер. п. 61. ИСБН 0-387-95468-6 .