Электрофильное галогенирование
В органической химии электрофильное ароматическое галогенирование является разновидностью электрофильного ароматического замещения . Эта органическая реакция типична для ароматических соединений и является очень полезным методом добавления заместителей к ароматической системе.
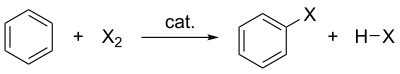
Halogenation of benzene where X is the halogen, catalyst represents the catalyst (if needed) and HX represents the protonated base.
Некоторые типы ароматических соединений, такие как фенол , реагируют без катализатора , но для типичных производных бензола с менее реакционноспособными субстратами кислота Льюиса требуется в качестве катализатора . Типичные катализаторы на основе кислоты Льюиса включают AlCl3 , FeCl 3 , FeBr 3 и ZnCl 2 . Они действуют путем образования высокоэлектрофильного комплекса , который подвергается атаке бензольного кольца.
Механизм реакции
[ редактировать ]Механизм реакции хлорирования бензола такой же, как и бромирования бензола. Бромид железа(III) и хлорид железа(III) инактивируются при реакции с водой, в том числе с влагой воздуха. Поэтому они образуются путем добавления железных опилок к брому или хлору. Вот механизм этой реакции:
Механизм йодирования несколько иной: йод (I 2 ) обрабатывают окислителем, например азотной кислотой, с получением электрофильного йода («I + ", вероятно, IONO 2 ). Другие условия для йодирования включают I 2 , HIO 3 , H 2 SO 4 и N -йодсукцинимид, H 2 SO 4 . [ 1 ] [ 2 ] Эти условия успешны для высокодезактивированных аренов, в том числе нитроароматических соединений.
В серии исследований мощный реагент, полученный с использованием смеси йода и йодата калия, растворенных в концентрированной серной кислоте был использован . Здесь йодирующим агентом является катион трийода I 3 + а основание - HSO 4 − . В этих работах изучены как кинетика реакции, так и препаративные условия йодирования сильно дезактивированных соединений, таких как бензойная кислота и 3-нитробензотрифторид. [ 3 ] [ 4 ]
Хотя электрофильное фторирование возможно с помощью реагентов F 2 /N 2 (10%), XeF 2 или NF, таких как Selectfluor , эти методы используются редко из-за образования изомерных смесей и продуктов полифторирования. [ 5 ] Хотя смеси также образуются в случае других ароматических галогенидов, фторароматические соединения часто чрезвычайно сложно отделить от их нефторированных, полифторированных и/или изомерных аналогов.
Начальная стадия галогенирования ароматических соединений отличается от стадии галогенирования алкенов тем, что алкенам не требуется катализатор для повышения электрофильности галогена. Образование иона арения приводит к временной потере ароматичности , которая имеет более высокую энергию активации по сравнению с образованием иона галония в алкенах. Другими словами, алкены более реакционноспособны и не нуждаются в ослаблении связи Br-Br или Cl-Cl.
Объем
[ редактировать ]Если кольцо содержит сильно активирующий заместитель, такой как –OH, –OR или амины , катализатор не требуется, например, при бромировании п -крезола : [ 6 ]
Однако если использовать катализатор с избытком брома, то образуется трибромид.
Галогенирование фенолов происходит быстрее в полярных растворителях в основной среде из-за диссоциации фенола, при этом ионы феноксида более восприимчивы к электрофильной атаке, поскольку они более богаты электронами.
Хлорирование толуола хлором без катализатора требует также полярного растворителя, такого как уксусная кислота . Селективность от орто до пара низкая: [ 7 ]
При замене растворителя тетрахлорметаном реакции не происходит . Напротив, когда реагентом является 2-фенилэтиламин , можно использовать относительно аполярные растворители с исключительной орторегиоселективностью из -за промежуточного образования хлорамина , обеспечивающего внутримолекулярную реакцию .
Пищевой краситель эритрозин можно синтезировать путем йодирования другого красителя, называемого флуоресцеином :
Эту реакцию запускает бикарбонат натрия . [ 8 ]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Бергстрем, Мария; Суреш, Ганджи; Найду, Велуру Рамеш; Унелиус, К. Рикард (2017). «N-Йодосукцинимид (НИС) при прямом ароматическом йодировании». Европейский журнал органической химии . 2017 (22): 3234–3239. дои : 10.1002/ejoc.201700173 . ISSN 1099-0690 .
- ^ Чайковский В.К.; Филимонов В.Д.; Скороходов В.И.; Огородников, В.Д. (01.09.2007). «Сверхактивность и двойная реакционная способность системы N-йодсукцинимид-H2SO4 при йодировании дезактивированных аренов». Российский журнал органической химии . 43 (9): 1278–1281. дои : 10.1134/S1070428007090035 . ISSN 1608-3393 . S2CID 98269288 .
- ^ «Кинетика ароматического йодирования с помощью катиона трийода», Дж. Ароцкий, AC Darby и JBA Hamilton, J. Chem. Соц. Б , 1968, 739–742.
- ^ «Йодирование и йодсоединения, часть IV», Джуда Ароцкий, А. Карл Дарби и Джон Б.А. Гамильтон, J. Chem. Soc., Перкин Транс. 2, 1973, 595–599.
- ^ Эл, Постиго (5 сентября 2018 г.). Поздняя стадия фторирования биоактивных молекул и биологически значимых субстратов . Амстердам, Нидерланды. ISBN 9780128130391 . OCLC 1052566523 .
{{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка ) - ^ А. Шанкаранараянан; С.Б. Чандалия (2006). «Разработка технологии синтеза 3,4,5-триметокситолуола». Орг. Процесс Рез. Дев. 10 (3): 487–492. дои : 10.1021/op0502248 .
- ^ Дж. Л. О'Коннелл; Дж. С. Симпсон; П.Г. Думанский; Г. В. Симпсон; Си Джей Истон (2006). «Ароматическое хлорирование ω-фенилалкиламинов и ω-фенилалкиламидов в четыреххлористом углероде и α,α,α-трифтортолуоле». Органическая и биомолекулярная химия . 4 (14): 2716–2723. дои : 10.1039/b605010g . ПМИД 16826296 .
- ^ «Синтез триарилметановых и ксантеновых красителей с использованием реакций электрофильного ароматического замещения» Джеймс В. МакКаллах и Келли А. Даггетт Дж. Хим. Образование. 2007 , 84, 1799. Аннотация





