Электрофильное галогенирование
В органической химии электрофильное ароматическое галогенирование является типом электрофильной ароматической замещения . Эта органическая реакция типична для ароматических соединений и очень полезный метод для добавления заместителей в ароматическую систему.
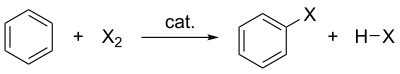
Halogenation of benzene where X is the halogen, catalyst represents the catalyst (if needed) and HX represents the protonated base.
Несколько типов ароматических соединений, таких как фенол , будут реагировать без катализатора , но для типичных бензольных производных с менее реактивными субстратами кислота Льюиса требуется в качестве катализатора . Типичные кислотные катализаторы Льюиса включают Alcl 3 , FECL 3 , февраля 3 и Zncl 2 . Они работают путем формирования высокоэлектрофильного комплекса , который атаковается бензоловым кольцом.
Механизм реакции
[ редактировать ]Механизм реакции хлорирования бензола такой же, как бромирование бензола. Железо (III) бромид и хлорид железа (III) становятся инактивированными, если они реагируют с водой, включая влагу в воздухе. Следовательно, они генерируются путем добавления железных заявок в бром или хлор. Вот механизм этой реакции:
Механизм йодирования немного отличается: йод (I 2 ) обрабатывается окислительным агентом, таким как азотная кислота, для получения электрофильного йода («I + ", вероятно, Iono 2 ). Другие условия для йодирования включают I 2 , Hio 3 , H 2 SO 4 и N -oidosuccinimide, H 2 SO 4 . [ 1 ] [ 2 ] Эти условия являются успешными для сильно деактивированных арен, включая нитроароматики.
В серии исследований мощный реагент, полученный с использованием смеси йода и йодата калия, растворенного в концентрированной серной кислоте использовали . Здесь йодирующий агент - это трийодиновый катион I 3 + и база - HSO 4 − Полем В этих исследованиях была исследована как кинетика реакции, так и препаративные условия для йодирования сильно деактивированных соединений, таких как бензоевая кислота и 3-нитробензотрифлуорид. [ 3 ] [ 4 ]
В то время как электрофильное фторирование возможно с помощью F 2 /N 2 (10%), реагентов XEF 2 или NF, таких как SelectFluor , эти методы редко используются из -за образования изомерных смесей и продуктов полифлюрина. [ 5 ] Хотя смеси также образуются в случае других ароматических галогеников, флуоророматика часто чрезвычайно сложна, чтобы отделиться от их нефлюрированных, полифлюрированных и/или изомерных аналогов.
Начальная стадия галогенирования ароматических соединений отличается от стадии галогенирования алкенов в том, что алкены не требуют катализатора для повышения электрофильности галогена. Образование иона арены приводит к временной потере ароматичности , которая имеет более высокую энергию активации по сравнению с образованием ионов галоний в алкенах. Другими словами, алкены более реактивны и не нуждаются в ослаблении связи Br - Br или Cl -Cl.
Объем
[ редактировать ]Если кольцо содержит сильно активирующий заместитель, такой как –OH, -или амины , катализатор не требуется, например, при бромировании P -CRRESOL : [ 6 ]
Однако, если катализатор используется с избытком брома, то будет сформирован трибромид.
Галогенирование фенолов более быстрое в полярных растворителях в основной среде из-за диссоциации фенола, причем ионы феноксида более восприимчивы к электрофильной атаке, поскольку они более богаты электронами.
Хлорирование толуола с хлором без катализатора требует также полярного растворителя, такой как уксусная кислота . Орто : -пара -селективность низкая [ 7 ]
Никакой реакции не происходит, когда растворитель заменяется тетрахлорметаном . Напротив, когда реагентом является 2-фенилэтиламин , можно использовать относительно положительные растворители с исключительной ортооселективностью из -за промежуточного образования хлорамина , что позволяет внутримолектуальной реакции .
Пищевый краситель эритрозин может быть синтезирован с помощью йодирования другого красителя, называемого флуоресцеином :
Эта реакция обусловлена бикарбонатом натрия . [ 8 ]
Смотрите также
[ редактировать ]Ссылки
[ редактировать ]- ^ Бергстрем, Мария; Суреш, Ганджи; Найду, Велуру Рамеш; Unelius, C. Rikard (2017). «N-odosuccinimide (NIS) в прямом ароматическом йодином». Европейский журнал органической химии . 2017 (22): 3234–3239. doi : 10.1002/ejoc.201700173 . ISSN 1099-0690 .
- ^ Chaikovskii, VK; Филимонов, VD; Скороходов, VI; Ogorodnikov, VD (2007-09-01). «Суперктивность и двойная реакционная способность системы N-йодосукцинимид-H2SO4 в йодировании деактивированных арен» ». Российский журнал органической химии . 43 (9): 1278–1281. doi : 10.1134/s1070428007090035 . ISSN 1608-3393 . S2CID 98269288 .
- ^ «Кинетика ароматического йодирования с помощью катиона трииорина», Дж. Ароцкий, А.К. Дарби и Дж. Хэмильтон, Дж. Хим. Соц B , 1968, 739–742
- ^ «Йодирование и йодо-компоненты, часть IV», Иуда Ароцкий, А. Карл Дарби и Джон Ба Гамильтон, Дж. Хим. Soc., Perkin Trans. 2, 1973, 595–599
- ^ AL, Postigo (5 сентября 2018 г.). Позднее фторирование биологически активных молекул и биологически релевантных субстратов . Амстердам, Нидерланды. ISBN 9780128130391 Полем OCLC 1052566523 .
{{cite book}}: CS1 Maint: местоположение отсутствует издатель ( ссылка ) - ^ А. Санкаранараянан; SB Chandalia (2006). «Разработка процесса синтеза 3,4,5-триметокситолуола». Орг Процесс Res. Девчонка 10 (3): 487–492. doi : 10.1021/op0502248 .
- ^ JL O'Connell; JS Симпсон; PG Dumanski; GW Симпсон; CJ Easton (2006). «Ароматическое хлорирование ω-фенилалкиламинов и ω-фенилалкиламидов в тетрахлориде углерода и α, α, α-трифтортолуолуоне». Органическая и биомолекулярная химия . 4 (14): 2716–2723. doi : 10.1039/b605010g . PMID 16826296 .
- ^ «Синтез окрасов триарилметана и ксантена с использованием электрофильных реакций ароматической замещения» Джеймс В. МакКуллаг и Келли А. Даггетт Дж. Хим. Образовательный 2007 , 84, 1799. Аннотация





