Молнупиравир
 | |
| Клинические данные | |
|---|---|
| Произношение | / ˌ m ɔː l n u ˈ p ɪər ə v ɪər / MAWL -noo- PEER -ə-veer |
| Торговые названия | Лагеврио |
| Другие имена | МК-4482, ЭИДД-2801 |
| AHFS / Drugs.com | Монография |
| Медлайн Плюс | а622027 |
| Данные лицензии |
|
| Беременность категория | |
| Маршруты администрация | Через рот |
| код АТС | |
| Юридический статус | |
| Юридический статус | |
| Идентификаторы | |
| Номер CAS | |
| ПабХим CID | |
| Лекарственный Банк | |
| ХимическийПаук | |
| НЕКОТОРЫЙ | |
| КЕГГ | |
| ЧЭБИ | |
| ЧЕМБЛ | |
| Панель управления CompTox ( EPA ) | |
| Химические и физические данные | |
| Формула | С 13 Н 19 Н 3 О 7 |
| Молярная масса | 329.309 g·mol −1 |
| 3D model ( JSmol ) | |
Молнупиравир , продаваемый под торговой маркой Лагеврио , представляет собой противовирусный препарат , ингибирующий репликацию некоторых РНК-вирусов . [7] Он используется для лечения COVID-19 у лиц, инфицированных SARS-CoV-2 . [7] Его принимают внутрь . [7]
Молнупиравир является пролекарством синтетического нуклеозида производного N. 4 -гидроксицитидин . и оказывает противовирусное действие путем внесения ошибок копирования во время репликации вирусной РНК [13] [14]
Молнупиравир изначально был разработан для лечения гриппа в Университете Эмори университетской инновационной фармацевтической компанией Drug Innovation Ventures at Emory (DRIVE), но, как сообщается, от него отказались из-за опасений мутагенности . [15] [16] Затем его приобрела базирующаяся в Майами компания Ridgeback Biotherapeutics , которая позже стала партнером Merck & Co. для дальнейшей разработки препарата. [17]
Основываясь на положительных результатах плацебо -контролируемых двойных слепых рандомизированных клинических исследований, [18] [19] молнупиравир был одобрен для медицинского применения в Великобритании в ноябре 2021 года. [7] [20] [21] [22] США В декабре 2021 года Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) выдало молнупиравиру разрешение на экстренное применение (EUA) для использования в определенных группах населения, где другие методы лечения невозможны. [10] Разрешение на экстренное использование было одобрено лишь узкими кругами (13-10) из-за вопросов об эффективности и опасений, что мутагенные эффекты молнупиравира могут создать новые варианты, которые уклоняются от иммунитета и продлевают пандемию COVID-19 . [23] [24] [25] В сентябре 2023 года мутагенность молнупиравира была подтверждена в исследовании глобальных изолятов SARS CoV 2 после 2022 года: геномные изменения были более распространены, особенно там, где использовался молнупиравир. [26]
Медицинское использование
В Великобритании молнупиравир показан для лечения легкой и среднетяжелой формы COVID-19 у взрослых с положительным диагностическим тестом на SARS-COV-2 и у которых имеется хотя бы один фактор риска развития тяжелого заболевания. [7]
В США молнупиравир не одобрен, но разрешен в соответствии с EUA для экстренного применения для лечения взрослых с легкой и умеренной формой COVID-19, которые подвержены высокому риску развития тяжелой формы COVID-19, включая госпитализацию или смерть, и для которых альтернативные варианты лечения COVID-19, одобренные или одобренные FDA, недоступны или клинически не приемлемы. [9] [10] [12]
Противопоказания [ править ]
Использование во время беременности не рекомендуется. [4] Нет данных о применении препарата во время беременности для оценки риска неблагоприятных исходов для матери или плода. [4] По данным на животных, препарат может нанести вред плоду. [4]
Побочные эффекты [ править ]
Побочные реакции, наблюдавшиеся в исследовании III фазы MOVe-OUT, включали диарею (2%), тошноту (1%) и головокружение (1%), все из которых были легкими или умеренными. [12]
На этикетке рецепта FDA США содержится предупреждение в рамке . [9]
У крыс после повторного введения наблюдалась токсичность для костей и хрящей. [12]
Передозировка [ править ]
Последствия передозировки неизвестны, лечение состоит из общих поддерживающих мер, таких как мониторинг клинического статуса. [12]
Взаимодействие с лекарствами [ править ]
На основании ограниченных доступных данных взаимодействие с лекарственными средствами отсутствует. [12]
Механизм действия [ править ]
Молнупиравир ингибирует размножение вируса, способствуя широко распространенным мутациям в репликации вирусной РНК с помощью РНК-направленной РНК-полимеразы . [27] Метаболизируется в аналог рибонуклеозида , напоминающий цитидин , β- D - N. 4 -гидроксицитидин- 5'-трифосфат (также называемый EIDD-1931 5'-трифосфат или NHC-TP). [28] [29] [30] Во время репликации фермент вируса включает NHC-TP во вновь созданную РНК вместо использования настоящего цитидина. [30]

Молнупиравир может переключаться между двумя формами ( таутомерами ), одна из которых имитирует цитидин (C), а другая — уридин (U). [31] вируса NHC-TP не распознается как ошибка корректирующими ферментами экзонуклеазой , которые могут заменять мутировавшие нуклеотиды исправленными версиями. [27] Когда вирусная РНК-полимераза пытается скопировать РНК, содержащую молнупиравир, она иногда интерпретирует ее как C, а иногда как U. Это вызывает больше мутаций во всех последующих копиях, чем вирус может выжить, - эффект, называемый катастрофой вирусной ошибки или летальным мутагенезом . [31]
Химия [ править ]
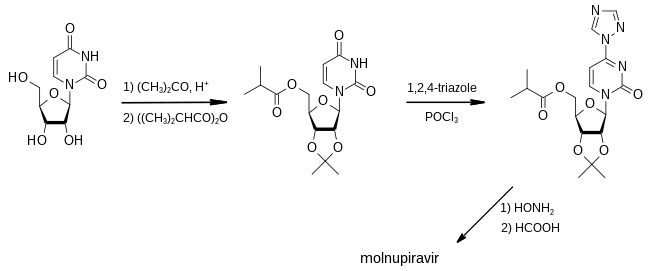
Первый синтез молнупиравира был раскрыт в патенте, поданном Университетом Эмори в 2018 году. [32]
На первом этапе ацетон используется в качестве защитной группы , чтобы сделать две из трех гидроксильных групп уридина нереактивными при обработке ангидридом изомасляной кислоты , который превращает третью гидроксигруппу в ее сложный эфир . Обработка 1,2,4-триазолом и фосфорилхлоридом дает реакционноспособное промежуточное соединение, в котором триазольная часть может быть заменена гидроксиламином . Наконец, удаление защитной группы с помощью муравьиной кислоты превращает материал в молнупиравир. [32] : 93–95
История [ править ]
Молнупиравир был разработан в Университете Эмори его инновационной фармацевтической компанией Drug Innovation Ventures at Emory (DRIVE). [17] В 2014 году DRIVE начал проект скрининга, финансируемый Агентством по уменьшению угроз Министерства обороны , по поиску противовирусного препарата, нацеленного на вирус венесуэльского лошадиного энцефалита (VEEV), что привело к открытию EIDD-1931. [33] [ ненадежный медицинский источник? ] Когда соединение было превращено в пролекарство EIDD-2801 (молнупиравир), оно также проявило активность против других РНК-вирусов, включая грипп , Эбола , чикунгунья и различные коронавирусы . [33]
Международное непатентованное название препарата было вдохновлено названием Тора молота — Мьёльнир . Идея состоит в том, что препарат поразит вирус, как могучий удар бога грома. [30]
В 2019 году Национальный институт аллергии и инфекционных заболеваний (NIAID) одобрил перевод молнупиравира в I фазу клинических исследований гриппа. [33]
В марте 2020 года исследовательская группа приступила к изучению SARS-CoV-2 и успешно применила молнупиравир для лечения клеток человека, инфицированных новым коронавирусом. [33] [ ненадежный медицинский источник? ] Исследование показало, что он активен при пероральном приеме против SARS-CoV-2 у хорьков. [34]
Затем DRIVE передал лицензию на молнупиравир для клинических исследований на людях компании Ridgeback Biotherapeutics из Майами, которая позже стала партнером Merck & Co. для дальнейшей разработки препарата. [33] [17]
Первичные данные, подтверждающие молнупиравира Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA), разрешение на экстренное применение взяты из MOVe-OUT, рандомизированного двойного слепого плацебо-контролируемого клинического исследования по изучению молнупиравира для лечения негоспитализированных участников с легкой и средней степенью тяжести. COVID-19 с высоким риском прогрессирования до тяжелой формы COVID-19 и/или госпитализации. [10] [35] Участниками были взрослые от 18 лет и старше с заранее установленным хроническим заболеванием или с повышенным риском заражения SARS-CoV-2 по другим причинам, которые не получили вакцину от COVID-19. [10] Основным результатом, измеряемым в ходе исследования, был процент людей, которые были госпитализированы или умерли по любой причине в течение 29 дней наблюдения. [10] Из 709 человек, получавших молнупиравир, 6,8% были госпитализированы или умерли в течение этого периода по сравнению с 9,7% из 699 человек, получавших плацебо. [10]
В ноябре 2022 года Британский национальный институт здравоохранения и передового опыта решил, что молнупиравир не следует регулярно использовать для лечения COVID-19, поскольку исследования показали, что он не оказывает существенного влияния на уровень госпитализации или смертности и не является экономически эффективным. [36] Препарат был добавлен в список «нерекомендованных» в проекте руководства по лечению COVID-19 для консультации. [37] [36]
и Общество культура
Экономика [ править ]
В сентябре 2021 года компания Merck подписала добровольное лицензионное соглашение с Патентным пулом лекарственных средств (MPP), которое позволяет MPP сублицензировать молнупиравир и поставлять пероральный препарат от COVID-19 в 105 стран с низким и средним уровнем дохода. Стоимость первоначальной покупки правительства США составила около 712 долларов за курс лечения; Лечение дженериками в развивающихся странах может стоить всего 20 долларов. [38] [39]
Продажи молнупиравира в четвертом квартале 2021 года составили 952 миллиона долларов. [40]
Юридический статус [ править ]
В октябре 2021 года компания Merck подала заявку EUA в FDA, а в ноябре 2021 года Консультативный комитет FDA по противомикробным препаратам (AMDAC) в Центре оценки и исследований лекарств собрался для обсуждения заявки. [41] [42] Комитет с небольшим перевесом проголосовал (13 за и 10 против) за то, чтобы рекомендовать разрешение для взрослых с легким и умеренным заболеванием, которые подвергаются высокому риску развития тяжелой формы COVID-19. [43] Были высказаны опасения по поводу низкой эффективности препарата в предотвращении смертности, которая в последнем испытании составила всего 30%, а также повышенного уровня мутаций, вызываемых препаратом, что теоретически может усугубить пандемию, стимулируя развитие более опасных вариантов. [43] [16] США В декабре 2021 года Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) выдало разрешение на экстренное применение (EUA) молнупиравира для лечения легкой и среднетяжелой формы COVID-19 у взрослых с положительными результатами прямого тестирования на вирус SARS-CoV-2, которые подвергаются высокому риску развития тяжелой формы COVID-19, включая госпитализацию или смерть, и для которых альтернативные варианты лечения COVID-19, одобренные FDA, недоступны или клинически не подходят. [10]
В октябре 2021 года Комитет по лекарственным препаратам для применения человеком Европейского агентства по лекарственным средствам (EMA) начал поочередную проверку молнупиравира. [44] В феврале 2023 года EMA рекомендовало отклонить регистрационное удостоверение молнупиравира. [45] В июне 2023 года компания Merck Sharp & Dohme отозвала заявку на получение регистрационного удостоверения молнупиравира. [46]
В ноябре 2021 года молнупиравир был одобрен в Великобритании Агентством по регулированию лекарственных средств и товаров медицинского назначения (MHRA) для лечения установленных инфекций COVID-19. [7] MHRA выдало условное разрешение на продажу, применимое в Великобритании, и разрешение на экстренное использование в Северной Ирландии. [7] [20] [47] [48]
В ноябре 2021 года Главное управление управления лекарственными средствами Бангладеш (DGDA) разрешило экстренное применение молнупиравира. [49] [50]
В январе 2022 года молнупиравир был одобрен для медицинского применения в Израиле. [51] и в феврале 2022 года в России. [52]
Названия брендов [ править ]
Молнупиравир – международное непатентованное название . [53] [54]
Дженерики доступны под торговыми марками Molulife ( Mankind ), [55] Молена ( Эмкуре ), [56] и Эсплевир ( Промомед ). [52]
здравоохранения общественного Проблемы
На заседании AMDAC в ноябре 2021 года несколько консультантов выразили обеспокоенность тем, что молнупиравир может ускорить появление вызывающих беспокойство вариантов . [57] [58] Другие ученые выразили аналогичные опасения как до, так и после встречи. [59] [25] [60] [24] Эти опасения были подтверждены публикацией в сентябре 2023 года исследования 15 миллионов глобальных последовательностей SARS-CoV-2: после того, как молнупиравир был представлен в 2022 году, геномные изменения стали более распространенными, особенно там, где он использовался. [26]
Исследования [ править ]
Были рассмотрены альтернативные запатентованные пути применения молнупиравира. [61]
Клинические испытания COVID-19 [ править ]
В октябре 2021 г. будут представлены предварительные результаты клинического исследования (MOVe-OUT). [62] [63] [ нужна полная цитата ] указали, что лечение молнупиравиром может снизить риск госпитализации и смерти от COVID-19. [64] [65] Окончательный анализ показал снижение количества госпитализаций и смертей на 30%. [18] [66]
С декабря 2021 года в исследовании PANORAMIC проверяется эффективность молнупиравира. [67] [68] Результаты показали, что при более высоком риске вакцинированные молнупиравиром взрослые не снижают вероятность госпитализации и смерти. Однако это приводит к более быстрому выздоровлению и снижению вирусной нагрузки . [69] [70]
В феврале 2023 года компания Merck сообщила, что исследование III фазы MOVE-AHEAD по оценке безопасности и эффективности Лагеврио по сравнению с плацебо в предотвращении распространения SARS-CoV-2 внутри домохозяйств не достигло основных конечных результатов. Учитывая более чем 1500 участников, у которых не было COVID-19 и которые жили с кем-то, у кого недавно был диагностирован вирус, у пациентов, получавших Лагеврио, вероятность развития COVID через 14 дней была на 23,6% ниже, чем у тех, кто принимал плацебо. [71] [72] [73]
Ссылки [ править ]
- ^ Jump up to: Перейти обратно: а б с «Лагеврио АПМДС» . Управление терапевтических товаров (TGA) . 21 января 2022 года. Архивировано из оригинала 5 февраля 2022 года . Проверено 5 февраля 2022 г.
- ^ «Обновления базы данных о назначении лекарственных средств при беременности» . Управление терапевтических товаров (TGA) . 12 мая 2022 года. Архивировано из оригинала 3 апреля 2022 года . Проверено 13 мая 2022 г.
- ^ «Список всех лекарств с предупреждениями о черном ящике, полученный FDA (используйте ссылки «Загрузить полные результаты» и «Просмотреть запрос»).» . nctr-crs.fda.gov . FDA . Проверено 22 октября 2023 г.
- ^ Jump up to: Перейти обратно: а б с д «TGA eBS — Информационная лицензия на продукцию и потребительские лекарства» . Архивировано из оригинала 5 февраля 2022 года . Проверено 5 февраля 2022 г.
- ^ «АусПАР: Молнупиравир» . Управление терапевтических товаров (TGA) . 8 февраля 2022 года. Архивировано из оригинала 24 марта 2022 года . Проверено 23 марта 2022 г.
- ^ Анвиса (31 марта 2023 г.). "НДК № 784 - Перечни наркотических средств, психотропных веществ, прекурсоров и других веществ, находящихся под особым контролем" [Постановление Коллегии № 784 - Перечни наркотических средств, психотропных веществ, прекурсоров и других веществ, находящихся под специальным контролем]. Официальный вестник Союза (на бразильском португальском языке) (опубликовано 4 апреля 2023 г.). Архивировано из оригинала 3 августа 2023 года . Проверено 16 августа 2023 г.
- ^ Jump up to: Перейти обратно: а б с д и ж г час «Краткая информация о характеристиках продукции Lagevrio» . Агентство по регулированию лекарственных средств и товаров медицинского назначения (MHRA) . 4 ноября 2021 г. Архивировано из оригинала 4 ноября 2021 г. Проверено 4 ноября 2021 г.
- ^ «Одобрение регулирующих органов Лагеврио (молнупиравир)» . Агентство по регулированию лекарственных средств и товаров медицинского назначения (MHRA) . 4 ноября 2021 г. Архивировано из оригинала 4 ноября 2021 г. Проверено 4 ноября 2021 г.
- ^ Jump up to: Перейти обратно: а б с «Молнупиравир капсула» . ДейлиМед . Архивировано из оригинала 14 января 2024 года . Проверено 3 октября 2023 г.
- ^ Jump up to: Перейти обратно: а б с д и ж г час «Обновление о коронавирусе (COVID-19): FDA разрешает дополнительные пероральные противовирусные препараты для лечения COVID-19 у некоторых взрослых» . США Управление по контролю за продуктами и лекарствами (FDA) (пресс-релиз). 23 декабря 2021 года. Архивировано из оригинала 23 декабря 2021 года . Проверено 23 декабря 2021 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе . - ^ О'Шонесси, Дж. А. (22 марта 2022 г.). «Разрешение на экстренное использование 108» . Письмо компании Merck Sharp & Dohme Corp. Управлению по контролю за продуктами и лекарствами США (FDA).
- ^ Jump up to: Перейти обратно: а б с д и ж «Информационный бюллетень для медицинских работников: Разрешение на экстренное применение молнупиравира» (PDF) . США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) . Merck & Co., Inc. 23 октября 2023 г. Архивировано из оригинала 14 января 2024 г. Проверено 14 января 2024 г.
- ^ Тутс М., Юн Дж.Дж., Кокс Р.М., Харт М., Стичер З.М., Махсус Н. и др. (октябрь 2019 г.). «Характеристика эффективного перорального препарата против гриппа с высоким барьером резистентности у хорьков и эпителия дыхательных путей человека» . Наука трансляционной медицины . 11 (515): eaax5866. doi : 10.1126/scitranslmed.aax5866 . ПМК 6848974 . ПМИД 31645453 .
- ^ Тутс М., Юн Джей-Джей, Харт М., Натчус М.Г., Пейнтер Г.Р., Племпер Р.К. (апрель 2020 г.). «Парадигмы количественной эффективности кандидатного клинического препарата против гриппа EIDD-2801 на модели хорька» . Трансляционные исследования . 218 : 16–28. дои : 10.1016/j.trsl.2019.12.002 . ПМЦ 7568909 . ПМИД 31945316 .
- ^ Коэн Б., Пиллер С. (май 2020 г.). «Электронные письма предлагают изучить обвинения осведомителей в кумовстве, стоящих за потенциальным препаратом от COVID-19» . Наука . дои : 10.1126/science.abc7055 .
- ^ Jump up to: Перейти обратно: а б Калли М. (январь 2022 г.). «История о двух противовирусных мишенях и препаратах против COVID-19, которые их связывают» . Обзоры природы. Открытие наркотиков . 21 (1): 3–5. дои : 10.1038/d41573-021-00202-8 . ПМИД 34857884 . S2CID 244851870 .
- ^ Jump up to: Перейти обратно: а б с Алессия Дж (29 сентября 2021 г.). «Ежедневная таблетка для лечения COVID может появиться всего через несколько месяцев» . Новости АВС . Новости здоровья Кайзера. Архивировано из оригинала 29 сентября 2021 года . Проверено 29 сентября 2021 г.
- ^ Jump up to: Перейти обратно: а б Джейк Берналь А., Гомеш да Силва М.М., Мусунгаи Д.Б., Ковальчук Е., Гонсалес А., Делос Рейес В. и др. (декабрь 2021 г.). «Молнупиравир для перорального лечения COVID-19 у негоспитализированных пациентов» . Медицинский журнал Новой Англии . 386 (6): 509–520. дои : 10.1056/NEJMoa2116044 . ПМЦ 8693688 . ПМИД 34914868 .
- ^ Сингх А.К., Сингх А., Сингх Р., Мисра А. (ноябрь 2021 г.). «Молнупиравир при COVID-19: систематический обзор литературы» . Диабет и метаболический синдром . 15 (6): 102329. doi : 10.1016/j.dsx.2021.102329 . ПМЦ 8556684 . ПМИД 34742052 .
- ^ Jump up to: Перейти обратно: а б «Первый пероральный противовирусный препарат для лечения COVID-19, Лагеврио (молнупиравир), одобренный MHRA» (пресс-релиз). Агентство по регулированию лекарственных средств и товаров медицинского назначения (MHRA). 4 ноября 2021 года. Архивировано из оригинала 5 января 2022 года . Проверено 4 ноября 2021 г.
- ^ «Молнупиравир компании Merck и Ridgeback, пероральный противовирусный препарат от COVID-19, получает первую в мире авторизацию» . Merck & Co. (Пресс-релиз). 4 ноября 2021 г. Архивировано из оригинала 4 ноября 2021 г. Проверено 4 ноября 2021 г.
- ^ Роббинс Р., Хан А.Дж., Специя М (4 ноября 2021 г.). «Британия становится первой, кто разрешил противовирусную таблетку от Covid-19» . Нью-Йорк Таймс . Архивировано из оригинала 28 ноября 2021 года . Проверено 27 ноября 2021 г.
- ^ Кимбалл С. (30 ноября 2021 г.). «Консультативная группа FDA однозначно одобряет таблетки Merck для перорального лечения Covid, несмотря на меньшее количество вопросов об эффективности и безопасности» . CNBC . Архивировано из оригинала 1 января 2022 года . Проверено 1 января 2022 г.
- ^ Jump up to: Перейти обратно: а б Лин М.З. (24 декабря 2021 г.). «Новый препарат для лечения коронавируса может создать питательную среду для мутантных вирусов» . Вашингтон Пост . Архивировано из оригинала 30 декабря 2021 года . Проверено 1 января 2022 г.
- ^ Jump up to: Перейти обратно: а б Служба РФ (ноябрь 2021 г.). «Известный вирусолог предупреждает, что таблетка от COVID-19 может привести к появлению опасных мутантов. Другие не видят повода для тревоги» . Наука . дои : 10.1126/science.acx9591 .
- ^ Jump up to: Перейти обратно: а б Сандерсон Т., Хиснер Р., Донован-Банфилд И., Хартман Х., Лохен А., Пикок Т.П. и др. (сентябрь 2023 г.). «Мутационная сигнатура, связанная с молнупиравиром, в глобальных геномах SARS-CoV-2» . Природа . 623 (7987): 594–600. Бибкод : 2023Natur.623..594S . дои : 10.1038/s41586-023-06649-6 . ПМЦ 10651478 . ПМИД 37748513 . S2CID 262748823 .
- ^ Jump up to: Перейти обратно: а б Лоу Д. (13 октября 2021 г.). «Мутации молнупиравира» . Наука (блог). Архивировано из оригинала 21 декабря 2021 года . Проверено 13 октября 2021 г.
- ^ Художник В.П., Холман В., Буш Дж.А., Алмазеди Ф., Малик Х., Эраут Н.К. и др. (март 2021 г.). «Безопасность, переносимость и фармакокинетика молнупиравира для человека, нового перорального противовирусного средства широкого спектра действия, активного против SARS-CoV-2» . Антимикробные средства и химиотерапия . 65 (5). дои : 10.1128/AAC.02428-20 . ПМК 8092915 . ПМИД 33649113 .
- ^ Амара А., Пенчала С.Д., Эльза Л., Хейл С., Фитцджеральд Р., Уокер Л. и др. (сентябрь 2021 г.). «Разработка и валидация нового метода ЖХ-МС/МС для одновременного количественного определения молнупиравира и его метаболита β-d-N4-гидроксицитидина в плазме и слюне человека» . Журнал фармацевтического и биомедицинского анализа . 206 : 114356. дои : 10.1016/j.jpba.2021.114356 . ПМЦ 7611757 . ПМИД 34509661 . S2CID 237493842 .
- ^ Jump up to: Перейти обратно: а б с Крот Б (октябрь 2021 г.). «Познакомьтесь с молнупиравиром, таблеткой Merck, вдохновленной Тором, которая побеждает COVID» . Арс Техника . Архивировано из оригинала 2 октября 2021 года . Проверено 2 октября 2021 г.
- ^ Jump up to: Перейти обратно: а б с Мэлоун Б., Кэмпбелл Э.А. (сентябрь 2021 г.). «Молнупиравир: кодирование катастрофы» . Структурная и молекулярная биология природы . 28 (9): 706–708. дои : 10.1038/s41594-021-00657-8 . ПМИД 34518697 . S2CID 237507937 .
- ^ Jump up to: Перейти обратно: а б Заявка в США 20200276219 , Painter GR, Bluemling GR, Natchus MG, Guthrie D, «N4-гидроксицитидин и производные и связанное с ним противовирусное применение», опубликована 03 сентября 2020 г., передана Университету Эмори. Архивировано 5 октября 2021 г. в Wayback Machine.
- ^ Jump up to: Перейти обратно: а б с д и Хэлфорд Б. «Новый противовирусный препарат нацелен на борьбу с COVID-19» . Новости химии и техники . Архивировано из оригинала 2 августа 2020 года . Проверено 2 октября 2021 г.
- ^ Кокс Р.М., Вольф Дж.Д., Племпер Р.К. (январь 2021 г.). «Терапевтически вводимый аналог рибонуклеозида MK-4482/EIDD-2801 блокирует передачу SARS-CoV-2 у хорьков» . Природная микробиология . 6 (1): 11–18. дои : 10.1038/s41564-020-00835-2 . ПМЦ 7755744 . ПМИД 33273742 .
- ^ Научный обзор CDER в поддержку EUA (PDF) (Отчет). Центр оценки и исследования лекарственных средств . Архивировано из оригинала 16 февраля 2022 года . Проверено 16 февраля 2022 г.
- ^ Jump up to: Перейти обратно: а б «В проекте руководства NICE рекомендует три метода лечения COVID-19» . Национальный институт здравоохранения и передового опыта (NICE) . 16 ноября 2022 г. Проверено 13 февраля 2023 г.
- ^ Доннелли Л. (11 февраля 2023 г.). «Почти 1 миллиард фунтов стерлингов потрачено на препарат против Covid, но это не имеет никакого существенного значения » . «Дейли телеграф» . Проверено 13 февраля 2023 г.
- ^ «Патентный пул лекарственных средств (MPP) и компания Merck заключают лицензионное соглашение на молнупиравир, исследуемый пероральный противовирусный препарат от COVID-19, для расширения широкого доступа в странах с низким и средним уровнем дохода» . Merck & Co. (Пресс-релиз). Архивировано из оригинала 27 октября 2021 года . Проверено 28 октября 2021 г.
- ^ «Merck поделится формулой своей таблетки от Covid с бедными странами» . Нью-Йорк Таймс . 27 октября 2021 г. Архивировано из оригинала 27 ноября 2021 г. Проверено 27 ноября 2021 г.
- ^ Эрман М (3 февраля 2022 г.). «Merck прогнозирует рост продаж в 2022 году почти на 20%, в основном по молнупиравиру» . Рейтер . Проверено 29 октября 2022 г.
- ^ «Merck и Ridgeback объявляют о подаче в FDA США заявки на разрешение на экстренное использование молнупиравира, исследуемого перорального противовирусного препарата, для лечения легкой и умеренной степени тяжести COVID-19 у взрослых из группы риска» . Merck & Co. (Пресс-релиз). Архивировано из оригинала 17 октября 2021 года . Проверено 17 октября 2021 г.
- ^ «FDA проведет заседание консультативного комитета для обсуждения заявки Merck и Ridgeback EUA на пероральное лечение COVID-19» . США Управление по контролю за продуктами и лекарствами (FDA) (пресс-релиз). 18 октября 2021 года. Архивировано из оригинала 18 октября 2021 года . Проверено 19 октября 2021 г.
- ^ Jump up to: Перейти обратно: а б Хенсли С (30 ноября 2021 г.). «Комиссия FDA неоднозначно поддержала препарат Merck от COVID» . ЭНЕРГЕТИЧЕСКИЙ ЯДЕРНЫЙ РЕАКТОР . Архивировано из оригинала 4 января 2022 года . Проверено 3 декабря 2021 г.
- ^ «COVID-19: EMA начинает обзор молнупиравира» . Европейское агентство лекарственных средств (EMA) . 25 октября 2021 года. Архивировано из оригинала 4 ноября 2021 года . Проверено 6 ноября 2021 г.
- ^ «Отказ в выдаче регистрационного удостоверения на Лагеврио (молнупиравир)» (PDF) . Архивировано (PDF) из оригинала 14 января 2024 года . Проверено 14 января 2024 г.
- ^ «Лагеврио ЭПАР» . Европейское агентство лекарственных средств (EMA) . 21 июня 2023 года. Архивировано из оригинала 14 января 2024 года . Проверено 14 января 2024 г.
- ^ Рид Дж. (4 ноября 2021 г.). «Первая таблетка для лечения Covid получила одобрение в Великобритании» . Новости BBC онлайн . Архивировано из оригинала 4 ноября 2021 года . Проверено 4 ноября 2021 г.
- ^ Уиппл Т. (4 ноября 2021 г.). «Великобритания первой одобрила противовирусную таблетку от Covid, которая меняет правила игры» . Таймс . Архивировано из оригинала 4 ноября 2021 года . Проверено 5 ноября 2021 г.
- ^ «Поральные лекарства от Covid-19 теперь доступны в Бангладеш» . Бизнес-стандарт . 9 ноября 2021 года. Архивировано из оригинала 10 ноября 2021 года . Проверено 10 ноября 2021 г.
- ^ «Таблетка Эскаифа от Covid выходит на рынок» . Дейли Стар . 10 ноября 2021 года. Архивировано из оригинала 9 ноября 2021 года . Проверено 10 ноября 2021 г.
- ^ «Противовирусный препарат Лагеврио (Молнупиравир) для лечения COVID-19 одобрен» . Архивировано из оригинала 4 июля 2022 года . Проверено 30 июня 2022 г.
- ^ Jump up to: Перейти обратно: а б Prokhorchuk S (4 February 2022). «Промомед» зарегистрировал пероральный препарат MSD для терапии COVID-19 [Промомед зарегистрировал пероральный препарат MSD для терапии COVID-19]. Вадемекум (на русском языке). Архивировано из оригинала 14 января 2024 года . Проверено 22 ноября 2023 г.
- ^ Всемирная организация здравоохранения (2021 г.). «Международные непатентованные наименования фармацевтических субстанций (МНН): рекомендуемое МНН: список 85». Информация ВОЗ о лекарствах . 35 (1). hdl : 10665/340684 .
- ^ Всемирная организация здравоохранения (2022 г.). «Международные непатентованные наименования фармацевтических субстанций (МНН): рекомендуемое МНН: список 87». Информация ВОЗ о лекарствах . 36 (1). hdl : 10665/352794 .
- ^ «Человечество и BDR Pharma объединяют усилия, чтобы выпустить таблетку Molulife против COVID-19» . Экономические времена . 29 декабря 2021 года. Архивировано из оригинала 14 января 2024 года . Проверено 23 ноября 2023 г.
- ^ Приян V (3 января 2022 г.). «Сводка новостей компании о коронавирусе – Emcure Pharma выпустит на рынок молнупиравир в Индии – Ascletis расширяет производство пероральных таблеток ритонавира» . Фармацевтические технологии . Архивировано из оригинала 14 января 2024 года . Проверено 23 ноября 2023 г.
- ^ Кимбалл С. (30 ноября 2021 г.). «Консультативная группа FDA однозначно одобряет таблетки Merck для перорального лечения Covid, несмотря на меньшее количество вопросов об эффективности и безопасности» . CNBC . Архивировано из оригинала 1 января 2022 года . Проверено 4 января 2022 г.
- ^ Уокер М. (30 ноября 2021 г.). «Комиссия FDA узко поддерживает таблетки от COVID от Merck» . МедПейдж сегодня . Архивировано из оригинала 4 января 2022 года . Проверено 4 января 2022 г.
- ^ Нельсон К.В., Отто С.П. (29 ноября 2021 г.). «Мутагенные противовирусные препараты: эволюционный риск низких доз» . Вирусологический . Архивировано из оригинала 1 января 2022 года . Проверено 4 января 2022 г.
- ^ Ловетт С. (11 декабря 2021 г.). «Осторожность ученых в отношении использования новых противовирусных таблеток у людей с ослабленным иммунитетом» . Независимый . Архивировано из оригинала 4 января 2022 года . Проверено 4 января 2022 г.
- ^ Врус О (1986). «[Сравнительное исследование стабильности после фиксации переломов диафиза бедренной кости. Экспериментальное исследование на трупных костях]». Wiener Klinische Wochenschrift. Приложение (на немецком языке). 169 : 3–16. ПМИД 3464133 .
- ^ «Merck и Ridgeback Biotherapeutics предоставляют обновленную информацию о ходе программы клинических разработок молнупиравира, исследуемого перорального терапевтического препарата для лечения легкой и среднетяжелой формы COVID-19» . Merck & Co. (Пресс-релиз). 15 апреля 2021 года. Архивировано из оригинала 28 ноября 2021 года . Проверено 28 ноября 2021 г.
- ^ Номер клинического исследования NCT04575597 «Эффективность и безопасность молнупиравира (MK-4482) у негоспитализированных взрослых участников с COVID-19 (MK-4482-002)» на сайте ClinicalTrials.gov.
- ^ «Исследуемый пероральный противовирусный препарат молнупиравир компании Merck и Ridgeback снизил риск госпитализации или смерти примерно на 50 процентов по сравнению с плацебо для пациентов с легкой или умеренной формой COVID-19 в положительном промежуточном анализе исследования фазы 3» . Merck & Co. (Пресс-релиз). 1 октября 2021 года. Архивировано из оригинала 1 октября 2021 года . Проверено 28 ноября 2021 г.
- ^ Герпер М. (1 октября 2021 г.). «Противовирусная таблетка Merck сокращает госпитализацию пациентов с Covid, что может изменить правила лечения» . Стат . Архивировано из оригинала 1 октября 2021 года . Проверено 2 октября 2021 г.
- ^ Мишра М., Эрман М. (26 ноября 2021 г.). «По данным нового анализа, таблетка Merck от COVID-19 значительно менее эффективна» . Рейтер . Архивировано из оригинала 1 декабря 2021 года . Проверено 2 декабря 2021 г.
- ^ «NIHR финансирует общественные испытания противовирусных препаратов COVID-19» . Национальный институт исследований в области здравоохранения и ухода (NIHR) . Архивировано из оригинала 16 марта 2022 года . Проверено 16 марта 2022 г.
- ^ «Тысячам людей нужно было попробовать новое противовирусное лечение Covid» . Новости Би-би-си . 25 января 2022 года. Архивировано из оригинала 16 марта 2022 года . Проверено 16 марта 2022 г.
- ^ Батлер CC, Хоббс Ф.Д., Гбиниджи О.А., Рахман Н.М., Хейворд Г., Ричардс Д.Б. и др. (декабрь 2022 г.). «Молнупиравир в сочетании с обычным уходом по сравнению с обычным уходом в качестве раннего лечения для взрослых с COVID-19 с повышенным риском неблагоприятных исходов (PANORAMIC): открытое, адаптивное к платформе рандомизированное контролируемое исследование» . Ланцет . 401 (10373): 281–293. дои : 10.1016/S0140-6736(22)02597-1 . ПМЦ 9779781 . ПМИД 36566761 .
- ^ «Таблетки от Covid не снижают риск госпитализации или смерти, показало британское исследование» . Хранитель . 22 декабря 2022 года. Архивировано из оригинала 23 декабря 2022 года . Проверено 29 декабря 2022 г.
- ^ «Многоцентровое, рандомизированное, двойное слепое, плацебо-контролируемое исследование фазы 3 для оценки эффективности и безопасности MK-4482 для профилактики COVID-19 (лабораторно подтвержденная инфекция SARS-CoV-2 с симптомами) у взрослых, проживающих в С человеком, больным COVID-19» . Clinicaltrials.gov . 5 декабря 2022 года. Архивировано из оригинала 19 октября 2021 года . Проверено 22 февраля 2023 г.
- ^ «Merck предоставляет обновленную информацию о фазе 3 исследования MOVe-AHEAD по оценке лагеврио (молнупиравира) для постконтактной профилактики COVID-19» . Merck & Co. (Пресс-релиз). Архивировано из оригинала 14 января 2024 года . Проверено 22 февраля 2023 г.
- ^ «Таблетка Лагеврио от COVID от компании Merck не соответствует результатам исследования воздействия COVID в домашних условиях» . Жесткая Фарма . 21 февраля 2023 года. Архивировано из оригинала 14 января 2024 года . Проверено 22 февраля 2023 г.
Дальнейшее чтение [ править ]
- Торлунд К., Шелдрик К., Мейеровиц-Кац Г., Сингх С., Хилл А. (март 2022 г.). «Статистический смысл клинического исследования молнупиравира MOVE-OUT» . Am J Trop Med Hyg . 106 (5): 1301–1304. дои : 10.4269/ajtmh.21-1339 . ПМЦ 9128711 . ПМИД 35276667 . S2CID 247406958 .