Разработка лекарств от COVID-19
| Часть серии о |
| COVID-19 пандемия |
|---|
 |
|
|
|
Разработка лекарств от COVID-19 — это исследовательский процесс по разработке профилактических терапевтических рецептурных препаратов , которые облегчат тяжесть коронавирусной болезни 2019 года (COVID-19). С начала 2020 по 2021 год несколько сотен фармацевтических компаний , биотехнологических фирм, университетских исследовательских групп и организаций здравоохранения разрабатывали кандидатов на терапию для лечения заболевания COVID-19 на различных стадиях доклинических или клинических исследований (всего 506 кандидатов в апреле 2021 года), из них 419 потенциальных кандидатов. Препараты против COVID-19, находящиеся на стадии клинических испытаний , по состоянию на апрель 2021 г. [ 1 ]
Еще в марте 2020 года Всемирная организация здравоохранения (ВОЗ) [ 2 ] Европейское агентство лекарственных средств (EMA), [ 3 ] США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA), [ 4 ] и китайское правительство и производители лекарств [ 5 ] [ 6 ] координировали свои действия с академическими и отраслевыми исследователями, чтобы ускорить разработку вакцин, противовирусных препаратов и средств постинфекционной терапии. [ 7 ] [ 8 ] [ 9 ] [ 10 ] Международная платформа регистрации клинических исследований ВОЗ зафиксировала 536 клинических исследований по разработке постинфекционной терапии инфекций COVID-19. [ 11 ] [ 12 ] с многочисленными признанными противовирусными соединениями для лечения других инфекций, находящихся в стадии клинических исследований, которые будут перепрофилированы . [ 7 ] [ 13 ] [ 14 ] [ 15 ]
В марте 2020 года ВОЗ инициировала « Испытание SOLIDARITY » в 10 странах, в котором приняли участие тысячи людей, инфицированных COVID-19, для оценки эффективности лечения четырех существующих противовирусных соединений с наиболее многообещающей эффективностью. [ 2 ] [ 16 ] В апреле 2020 года был организован динамический систематический обзор для отслеживания хода зарегистрированных клинических испытаний вакцины против COVID-19 и потенциальных терапевтических препаратов. [ 12 ]
Разработка лекарств — это многоэтапный процесс, обычно требующий более пяти лет для обеспечения безопасности и эффективности нового соединения. [ 17 ] Несколько национальных регулирующих органов, таких как EMA и FDA, утвердили процедуры ускорения клинических испытаний. [ 4 ] [ 18 ] К июню 2021 года десятки потенциальных постинфекционных методов лечения находились на заключительной стадии испытаний на людях — клинических испытаниях фазы III–IV . [ 19 ]
Фон
Разработка лекарств – это процесс вывода новой вакцины против инфекционных заболеваний или терапевтического препарата на рынок было идентифицировано ведущее соединение после того, как в процессе открытия лекарства . [ 17 ] Он включает в себя лабораторные исследования на микроорганизмах и животных, подачу заявки на получение регулирующего статуса, например, через FDA, для нового исследуемого препарата с целью инициирования клинических испытаний на людях, а также может включать этап получения разрешения регулирующих органов вместе с заявкой на новое лекарство для его вывода на рынок. . [ 20 ] [ 21 ] Весь процесс – от концепции до доклинических испытаний в лаборатории до разработки клинических испытаний, включая испытания фазы I–III – до одобрения вакцины или лекарства обычно занимает более десяти лет. [ 17 ] [ 20 ] [ 21 ]
Термин «доклинические исследования» определяется лабораторными исследованиями in vitro и in vivo , что указывает на начальный этап разработки профилактической вакцины, противовирусных или других постинфекционных методов лечения. [ 7 ] такие как эксперименты по определению эффективных доз и токсичности на животных, прежде чем соединение-кандидат будет подвергнуто оценке безопасности и эффективности на людях. [ 22 ] Завершение доклинической стадии разработки лекарства, а затем его тестирование на безопасность и эффективность на достаточном количестве людей, инфицированных COVID-19 (от сотен до тысяч в разных странах), — это процесс, который, вероятно, потребует 1–2 года для COVID-19. терапии, согласно нескольким отчетам в начале 2020 года. [ 9 ] [ 23 ] [ 24 ] [ 25 ] Несмотря на эти усилия, вероятность успеха кандидатов в лекарства для получения окончательного одобрения регулирующих органов на протяжении всего процесса разработки лекарств для лечения инфекционных заболеваний составляет всего 19%. [ 26 ]
В исследованиях фазы I в первую очередь проверяют безопасность и предварительное дозирование на нескольких десятках здоровых субъектов, в то время как в исследованиях фазы II – после успеха в фазе I – оценивают терапевтическую эффективность против заболевания COVID-19 при возрастающих уровнях доз (эффективность основана на биомаркерах ), при этом тщательно оценка возможных побочных эффектов терапии-кандидата (или комбинированной терапии), как правило, у сотен людей. Обычный дизайн исследований фазы II возможных препаратов против COVID-19 является рандомизированным , плацебо -контролируемым, слепым и проводится в нескольких центрах, при этом определяются более точные и эффективные дозы и осуществляется мониторинг побочных эффектов. [ 27 ]
Вероятность успеха испытаний фазы II для перехода в фазу III (для всех заболеваний) составляет около 31%, а конкретно для инфекционных заболеваний — около 43%. [ 26 ] В зависимости от продолжительности (дольше дороже) – обычно от нескольких месяцев до двух лет. [ 27 ] – исследование фазы II средней продолжительности стоит 57 миллионов долларов США (в долларах 2013 года, включая расходы на доклинические исследования и фазу I). [ 28 ] Успешное завершение исследования фазы II не является надежным прогнозом того, что лекарство-кандидат будет успешным в исследованиях фазы III. [ 29 ]
В испытаниях III фазы COVID-19 участвуют от сотен до тысяч госпитализированных участников, в которых проверяется эффективность лечения с целью уменьшения последствий заболевания, одновременно отслеживая побочные эффекты при применении оптимальной дозы, как, например, в многонациональных исследованиях Solidarity и Discovery. [ 2 ] [ 17 ] [ 30 ]
Кандидаты
Этот раздел необходимо обновить . ( февраль 2021 г. ) |
Согласно одному источнику (по состоянию на август 2020 г.), различные категории доклинических или ранних клинических исследований по разработке кандидатов на лечение COVID-19 включали: [ 19 ]
- антитела (81 кандидат)
- противовирусные препараты (31 кандидат)
- клеточные соединения (34 кандидата)
- Соединения на основе РНК (6 кандидатов)
- сканирование соединений для перепрофилирования (18 кандидатов)
- различные другие категории терапии, такие как противовоспалительные, противомалярийные , интерфероновые , белковые, антибиотики и соединения, модулирующие рецепторы . [ 19 ]
В основных исследованиях фазы III оценивают, обладает ли лекарственный препарат-кандидат эффективностью конкретно против заболевания, и – в случае людей, госпитализированных с тяжелыми инфекциями COVID-19 – проверяют уровень эффективной дозы перепрофилированного или нового лекарственного препарата-кандидата для улучшения заболевания (в первую очередь пневмония) от инфекции COVID-19. [ 2 ] [ 11 ] [ 32 ] Для уже одобренного препарата (например, гидроксихлорохина от малярии) испытания фазы III–IV определяют на сотнях и тысячах людей, инфицированных COVID-19, возможность расширенного использования уже одобренного препарата для лечения инфекции COVID-19. [ 32 ] По состоянию на август 2020 года более 500 потенциальных терапевтических средств находились в доклинической стадии или на стадии разработки фаз I–IV, а в течение 2020 года было объявлено о новых исследованиях фаз II–III для сотен потенциальных терапевтических средств. [ 19 ]
Многочисленные препараты-кандидаты, изучаемые в качестве «вспомогательного» лечения для облегчения дискомфорта во время болезни, такие как НПВП или бронходилататоры , не включены в таблицу ниже. Другие, находящиеся на ранней стадии исследований фазы II, или многочисленные кандидаты на лечение в исследованиях фазы I, [ 19 ] также исключены. Кандидаты на лекарства, участвующие в испытаниях фазы I–II, имеют низкий уровень успеха (менее 12%), чтобы пройти все фазы испытаний и получить окончательное одобрение. [ 20 ] [ 29 ] После достижения фазы III испытаний кандидаты на лечение заболеваний, связанных с инфекцией COVID-19 – инфекционных и респираторных заболеваний – имеют показатель успеха около 72%. [ 26 ]
| Кандидат на наркотики | Описание | Разрешение на существующее заболевание | Спонсор(ы) испытания | Местоположение(а) | Ожидаемые результаты | Примечания, ссылки |
|---|---|---|---|---|---|---|
| Ремдесивир | противовирусное средство ; аналог аденозинового нуклеотида, ингибирующий синтез РНК у коронавирусов | исследовательский [ 33 ] | Галаад , ВОЗ, INSERM , NIAID | Первоначально Китай, Япония; расширен на международном уровне в рамках испытаний Global Solidarity и Discovery, а также испытания NIAID ACTT в США. | Середина 2020 г. (китайские, японские испытания) | [ 19 ] [ 34 ] [ 35 ] выборочно предоставляется компанией Gilead для экстренного доступа в связи с COVID-19; [ 36 ] [ 37 ] как многообещающие, так и отрицательные эффекты были зарегистрированы в апреле 2020 года. [ 38 ] [ 39 ] [ 40 ] |
| Гидроксихлорохин или хлорохин | противопаразитарное и противоревматическое ; дженерик от многих производителей | малярия , ревматоидный артрит, волчанка (международное) [ 41 ] [ 42 ] | Я понял, КТО, INSERM | Несколько сайтов в Китае; глобальные испытания солидарности и открытий | Июнь 2020 г. (прекращено ВОЗ) | множественные побочные эффекты ; возможные неблагоприятные лекарств, отпускаемых по рецепту взаимодействия ; [ 41 ] [ 42 ] в июне прекращено участие в исследовании ВОЗ «Солидарность» и исследовании «Восстановление в Великобритании» как «не имеющее клинической пользы у госпитализированных пациентов с COVID-19»; [ 43 ] [ 44 ] испытания [ 19 ] [ 34 ] |
| Фавипиравир | противовирусное средство от гриппа | грипп (Китай) [ 45 ] | Фуджифильм | Китай | апрель 2020 г. | [ 19 ] [ 8 ] [ 46 ] |
| Лопинавир/ритонавир без или с интерфероном бета-1а | противовирусное, иммуносупрессия | исследовательская комбинация; лопинавир/ритонавир одобрен для лечения ВИЧ [ 47 ] | CEPI, ВОЗ, Правительство Великобритании, Univ. Оксфордского университета, INSERM | Испытания глобальной солидарности и открытий, несколько стран | середина 2020 года | [ 19 ] [ 34 ] |
| Эгоистичный | человеческое моноклональное антитело против рецептора интерлейкина-6 | ревматоидный артрит (США, Европа) [ 48 ] | Регенерон - Санофи | Несколько стран | Весна 2020 г. | [ 19 ] [ 49 ] |
| ASC-09 + ритонавир | противовирусное средство | комбинация не одобрена; ритонавир одобрен для лечения ВИЧ [ 47 ] | Асклетис Фарма | Несколько сайтов в Китае | Весна 2020 г. | [ 19 ] [ 50 ] |
| Тоцилизумаб | человеческое моноклональное антитело против рецептора интерлейкина-6 | иммуносупрессия, ревматоидный артрит (США, Европа) [ 51 ] | Genentech - Хоффманн-Ла Рош | Несколько стран | середина 2020 года | [ 19 ] [ 52 ] В конце июля компания Roche объявила, что ее исследование III фазы тоцилизумаба для лечения пневмонии у госпитализированных людей с инфекцией COVID-19 оказалось неэффективным. [ 53 ] |
| Это книга | гуманизированное моноклональное антитело для облегчения пневмонии | новый кандидат на наркотики | Хьюманиген, Инк. | Несколько сайтов в США | сентябрь 2020 г. | [ 19 ] [ 54 ] |
| Дапаглифлозин | ингибитор натрий-глюкозного котранспортера 2 | для гипогликемии средство [ 55 ] | Среднеамериканский институт сердца Святого Луки, AstraZeneca | Несколько стран | декабрь 2020 г. | [ 19 ] [ 56 ] |
| CD24Fc | противовирусный иммуномодулятор против воспалительной реакции | новый кандидат на наркотики | Онкоиммун, Инк. | Несколько сайтов в США | 2021 | [ 19 ] [ 57 ] |
| Апабеталон | селективный ингибитор БЭТ | исследовательский | Ресверлогикс Корп | Соединенные Штаты | 22 марта 2022 г. | [ 19 ] [ 58 ] |
Перепрофилированные кандидаты на лекарства
Изменение позиционирования лекарств (также называемое перепрофилированием лекарств) – исследование существующих лекарств для новых терапевтических целей – является одним из направлений научных исследований, проводимых для разработки безопасных и эффективных методов лечения COVID-19. [ 15 ] [ 59 ] Несколько существующих противовирусных препаратов, ранее разработанных или используемых для лечения тяжелого острого респираторного синдрома (ТОРС), ближневосточного респираторного синдрома (БВРС), ВИЧ/СПИДа и малярии , исследуются в качестве лечения COVID-19, а некоторые из них переходят к клиническим испытаниям. . [ 13 ]
Во время пандемии COVID-19 перепрофилирование лекарств — это процесс клинических исследований , направленный на быструю проверку и определение безопасности и эффективности существующих лекарств, уже одобренных для лечения других заболеваний и предназначенных для использования у людей с инфекцией COVID-19. [ 13 ] [ 15 ] [ 60 ] В обычном процессе разработки лекарств [ 17 ] Для подтверждения повторного использования препарата для лечения нового заболевания потребуются многие годы клинических исследований, включая ключевые клинические испытания фазы III , препарата-кандидата, чтобы гарантировать его безопасность и эффективность специально для лечения инфекции COVID-19. [ 13 ] [ 60 ] В условиях растущей пандемии COVID-19 в марте 2020 года был ускорен процесс перепрофилирования лекарств для лечения людей, госпитализированных с COVID-19. [ 2 ] [ 13 ] [ 15 ]
Клинические испытания с использованием перепрофилированных, в целом безопасных существующих лекарств для госпитализированных людей с COVID-19 могут занять меньше времени и иметь более низкие общие затраты для получения конечных результатов, подтверждающих безопасность (отсутствие серьезных побочных эффектов ) и постинфекционную эффективность, а также могут быстро получить доступ к существующим запасам лекарств. цепи для производства и распространения по всему миру. [ 2 ] [ 13 ] [ 61 ] В рамках международных усилий по использованию этих преимуществ ВОЗ начала в середине марта 2020 года ускоренные международные испытания II–III фазы четырех многообещающих вариантов лечения – исследование SOLIDARITY. [ 2 ] [ 62 ] [ 63 ] – при этом множество других препаратов, имеющих потенциал для повторного использования в различных стратегиях лечения заболеваний, таких как, среди прочего, противовоспалительная терапия, кортикостероидная терапия, антитела, иммунная терапия и терапия факторами роста , проходят испытания фазы II или III в течение 2020 года. [ 19 ] [ 13 ] [ 60 ] [ 64 ]
В марте 2020 года Центры США по контролю и профилактике заболеваний (CDC) выпустили рекомендации для врачей относительно ремдесивира для людей, госпитализированных с пневмонией, вызванной COVID-19: «Хотя клинические испытания имеют решающее значение для установления безопасности и эффективности этого препарата, врачи без доступа к клиническим испытаниям может запросить ремдесивир для щадящего использования через производителя для пациентов с клинической пневмонией». [ 37 ]
Новые препараты на основе антител
Плазма выздоравливающих

Пассивная иммунизация или выздоравливающей плазмой гипериммунной сывороткой была предложена в качестве потенциального лечения COVID-19. По состоянию на май 2021 года имеются убедительные доказательства того, что лечение выздоравливающей плазмой не связано с клиническим улучшением у людей с умеренным или тяжелым заболеванием и не снижает риск смерти. [ 65 ] Потенциал побочных эффектов, связанных с лечением плазмой выздоравливающих, неизвестен. [ 65 ]
В Соединенных Штатах FDA выдало временное разрешение на использование плазмы выздоравливающих (плазмы крови людей, выздоровевших от COVID-19, которая, таким образом, содержит антитела против SARS-CoV-2) в качестве экспериментального лечения в случаях, когда жизнь человека может быть нарушена. находится под серьезной или немедленной угрозой. [ 66 ] По состоянию на май 2021 года в рецензируемых медицинских журналах было опубликовано как минимум 12 рандомизированных контролируемых исследований эффективности лечения выздоравливающих плазмой. [ 65 ] Кроме того, по состоянию на май 2021 года 100 дополнительных исследований находились в стадии «продолжения», а 33 исследования были признаны «конкурирующими», но еще не опубликованы. [ 65 ]
Аргентина, Бразилия, Коста-Рика и Мексика продолжили разработку антисывороток . [ 67 ] В середине 2020 года Бразилия начала разработку лошадиной гипериммунной сыворотки, полученной путем инокуляции лошадям рекомбинантного шиповидного белка SARS-CoV-2 . Консорциум Instituto Vital Brazil, UFRJ , Фонда Освальдо Круза и Института исследований и образования Д'Ор в Рио-де-Жанейро начал доклинические испытания в мае 2020 года. [ 68 ] а Институт Бутантана в Сан-Паулу завершил испытания на животных в сентябре. [ 67 ] В декабре 2020 года Аргентина предоставила экстренное разрешение на CoviFab, разработанный на местном уровне состав лошадиной гипериммунной сыворотки, для использования в случаях умеренной и тяжелой формы COVID-19 на основании первоначальных результатов одного исследования фазы 2/3, которые предполагали снижение смертности. , госпитализация в отделение интенсивной терапии и требования к искусственной вентиляции легких у пациентов, получивших сыворотку. [ 69 ] [ 70 ] Это подверглось резкой критике со стороны Аргентинского общества интенсивной терапии, которое заявило, что исследование не смогло достичь своих первичных или вторичных конечных точек и не продемонстрировало каких-либо статистически значимых различий между группами сыворотки и плацебо. [ 70 ]
Бамланивимаб/этезевимаб
Бамланивимаб/этезевимаб представляет собой комбинацию двух моноклональных антител , бамланивимаба и этесевимаба , которые вводятся вместе посредством внутривенной инфузии для лечения COVID-19 . [ 71 ] [ 72 ] [ 73 ] [ 74 ] Оба типа антител нацелены на поверхностный белок-шип SARS -CoV-2 . [ 75 ] [ 76 ]
Совместное применение бамланивимаба и этесевимаба разрешено в США для лечения легкой и среднетяжелой формы COVID-19 у людей в возрасте двенадцати лет и старше с массой тела не менее 40 кг (88 фунтов) с положительными результатами прямого ОРВИ-19. тестирование на вирус CoV-2 и те, кто подвержен высокому риску развития тяжелой формы COVID-19, включая госпитализацию или смерть. [ 77 ] [ 78 ] При совместном применении они также разрешены к использованию после контакта с вирусом SARS-CoV-2 для постконтактной профилактики (ПКП) COVID-19 и не разрешены для доконтактной профилактики с целью предотвращения заражения COVID-19 до контакта. к вирусу SARS-CoV-2. [ 77 ] [ 78 ]
США В январе 2022 года Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) пересмотрело разрешения на лечение двумя моноклональными антителами – бамланивимаб/этезевимаб (при совместном применении) и казиривимаб/имдевимаб – чтобы ограничить их использование только в тех случаях, когда реципиенты, скорее всего, были инфицированы вирусом. или подвергнуться воздействию варианта, восприимчивого к этим методам лечения. [ 79 ] Поскольку данные показывают, что эти методы лечения вряд ли будут активны против варианта омикрона , который очень часто циркулирует на территории Соединенных Штатов, в настоящее время эти методы лечения не разрешены к использованию ни в каких штатах, территориях и юрисдикциях США. [ 79 ]Бебтеловимаб
Бебтеловимаб — это моноклональное антитело, разработанное компаниями AbCellera и Eli Lilly для лечения COVID-19 . [ 80 ] [ 81 ] [ 82 ] [ 83 ]
Возможные побочные эффекты включают зуд, сыпь, инфузионные реакции, тошноту и рвоту. [ 80 ]
Бебтеловимаб действует путем связывания с белком-шипом вируса, вызывающего COVID-19, подобно другим моноклональным антителам, которые были разрешены для лечения людей из группы высокого риска с легкой и умеренной формой COVID-19 и показали свою эффективность в снижении риска заражения. госпитализация или смерть. [ 80 ] Бебтеловимаб представляет собой нейтрализующее человеческое моноклональное антитело иммуноглобулина G1 (IgG1), выделенное от пациента, выздоровевшего от коронавирусной болезни 2019 (COVID-19), направленное против белка-шипа (S) тяжелого острого респираторного синдрома коронавируса-2 (SARS-2). CoV-2), который потенциально может быть использован для иммунизации против COVID-19. [ 84 ]
По состоянию на ноябрь 2022 г. [update]Бебтеловимаб не разрешен для экстренного применения в США, поскольку не ожидается, что он нейтрализует субварианты Омикрона BQ.1 и BQ.1.1. [ 85 ]Казиривимаб/имдевимаб
Касиривимаб/имдевимаб , продаваемые, среди прочего, под торговой маркой REGEN‑COV, [ 86 ] [ 87 ] представляет собой комбинированный препарат, используемый для лечения и профилактики COVID‑19 . [ 87 ] Он состоит из двух человеческих моноклональных антител , казиривимаба и имдевимаба, которые необходимо смешать и вводить в виде инфузии или подкожной инъекции. [ 88 ] [ 86 ] [ 87 ] Комбинация двух антител предназначена для предотвращения мутационного ухода . [ 89 ] Он также доступен в виде совместного продукта. [ 88 ] Его разработала американская биотехнологическая компания Regeneron Pharmaceuticals . [ 90 ] [ 91 ]
Наиболее распространенные побочные эффекты включают аллергические реакции, в том числе реакции, связанные с инфузией, реакции в месте инъекции, [ 87 ] кратковременные боли, слабость и другие. [ 92 ]
Комбинация одобрена под торговой маркой Ronapreve для медицинского применения в Японии, Великобритании, Европейском Союзе и Австралии. [ 93 ] [ 94 ] [ 87 ] [ 95 ] [ 96 ] [ 97 ]
США В январе 2022 года Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) пересмотрело разрешения на лечение двумя моноклональными антителами – бамланивимаб/этезевимаб (при совместном применении) и казиривимаб/имдевимаб – чтобы ограничить их использование только в тех случаях, когда реципиенты, скорее всего, были инфицированы вирусом. или подвергнуться воздействию варианта, чувствительного к этому лечению, поскольку данные показывают, что эти методы лечения вряд ли будут активны против варианта омикрон . [ 98 ]Пемивибарт
Пемивибарт , продаваемый под торговой маркой Пемгарда, представляет собой препарат на основе моноклональных антител , разрешенный для доконтактной профилактики (предотвращения) COVID-19 . [ 99 ]
США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) выдало разрешение на экстренное применение пемивибарта в марте 2024 года. [ 99 ] [ 100 ]Регданвимаб
Регданвимаб , продаваемый под торговой маркой Регкирона, представляет собой человеческое моноклональное антитело, используемое для лечения COVID-19 . [ 101 ] Антитело направлено против белка-шипа SARS -CoV-2 . Он разработан компанией Celltrion . [ 102 ] [ 103 ] Лекарство вводят инфузионно (капельно) в вену. [ 101 ] [ 104 ]
Наиболее распространенные побочные эффекты включают реакции, связанные с инфузией, включая аллергические реакции и анафилаксию. [ 101 ]
Регданвимаб был одобрен для медицинского применения в Европейском Союзе в ноябре 2021 года. [ 101 ] [ 105 ]Сотровимаб

Сотровимаб , продаваемый под торговой маркой Ксевуди, представляет собой человеческое нейтрализующее моноклональное антитело , обладающее активностью против коронавируса 2 тяжелого острого респираторного синдрома, известного как SARS-CoV-2 . [ 106 ] [ 107 ] [ 108 ] Он был разработан компаниями GlaxoSmithKline и Vir Biotechnology, Inc. [ 107 ] [ 109 ] Сотровимаб предназначен для прикрепления к белку-шипу SARS-CoV-2. [ 107 ] [ 108 ] [ 110 ]
Наиболее распространенные побочные эффекты включают реакции гиперчувствительности (аллергические) и реакции, связанные с инфузией. [ 106 ]
Хотя сотровимаб использовался во всем мире против SARS-CoV-2, в том числе в США, в соответствии с разрешением FDA на экстренное использование (EUA), FDA отменило EUA в апреле 2022 года из-за отсутствия эффективности против варианта Omicron . [ 111 ]Тиксагевимаб/цилгавимаб
Тиксагевимаб/цилгавимаб , продаваемый под торговой маркой Evusheld, представляет собой комбинацию двух человеческих моноклональных антител , тикагевимаба (AZD8895) и цилгавимаба (AZD1061), нацеленных на поверхностный шиповидный белок SARS-CoV-2. [ 112 ] [ 113 ] используется для профилактики COVID-19 . [ 114 ] Его разрабатывает британско-шведская транснациональная фармацевтическая и биотехнологическая компания AstraZeneca . [ 115 ] [ 116 ] Он упаковывается в одну упаковку и вводится в виде двух отдельных последовательных внутримышечных инъекций (одна инъекция на моноклональное антитело, вводимая непосредственно друг за другом). [ 117 ]
Вилобелимаб
Вилобелимаб , продаваемый под торговой маркой Gohibic, представляет собой исследуемый препарат , используемый для лечения COVID-19 . [ 118 ] Это химерное -антитело человека и мыши IgG4 каппа , которое нацелено на человеческий C5a в плазме. [ 119 ]
Наиболее частые побочные реакции включают пневмонию, сепсис, делирий, легочную эмболию, гипертензию, пневмоторакс, тромбоз глубоких вен, простой герпес, энтерококковую инфекцию, бронхолегочный аспергиллез, повышение активности печеночных ферментов, инфекцию мочевыводящих путей, гипоксию, тромбоцитопению, пневмомедиастинум, инфекции дыхательных путей, наджелудочковая тахикардия, запор и сыпь. [ 118 ]
Вилобелимаб представляет собой рекомбинантное химерное моноклональное антитело IgG4, которое специфически связывается с растворимым продуктом расщепления человеческого комплемента C5a после отщепления от C5, чтобы блокировать его взаимодействие с рецептором C5a, оба из которых являются компонентами системы комплемента, которые, как считается, способствуют воспалению и ухудшению течения COVID. -19. [ 120 ] Вилобелимаб получил разрешение на экстренное применение США (EUA) от Управления по контролю за продуктами и лекарствами (FDA) в апреле 2023 года. [ 118 ] [ 120 ] [ 119 ] [ 121 ] [ 122 ]Новые ингибиторы репликации вируса
Молнупиравир

Молнупиравир , продаваемый под торговой маркой Лагеврио, представляет собой противовирусный препарат , ингибирующий репликацию некоторых РНК-вирусов . [ 123 ] Он используется для лечения COVID-19 у лиц, инфицированных SARS-CoV-2 . [ 123 ] Его принимают внутрь . [ 123 ]
Молнупиравир является пролекарством синтетического нуклеозида производного N. 4 -гидроксицитидин . и оказывает противовирусное действие путем внесения ошибок копирования во время репликации вирусной РНК [ 124 ] [ 125 ]
Молнупиравир изначально был разработан для лечения гриппа в Университете Эмори университетской инновационной фармацевтической компанией Drug Innovation Ventures at Emory (DRIVE), но, как сообщается, от него отказались из-за опасений мутагенности . [ 126 ] [ 127 ] Затем его приобрела базирующаяся в Майами компания Ridgeback Biotherapeutics , которая позже стала партнером Merck & Co. для дальнейшей разработки препарата. [ 128 ]
Основываясь на положительных результатах плацебо -контролируемых двойных слепых рандомизированных клинических исследований, [ 129 ] [ 130 ] молнупиравир был одобрен для медицинского применения в Великобритании в ноябре 2021 года. [ 123 ] [ 131 ] [ 132 ] [ 133 ] США В декабре 2021 года Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) выдало молнупиравиру разрешение на экстренное применение (EUA) для использования в определенных группах населения, где другие методы лечения невозможны. [ 134 ] Разрешение на экстренное применение было одобрено лишь узкими кругами лиц (13–10) из-за вопросов об эффективности и опасений, что мутагенные эффекты молнупиравира могут создать новые варианты, которые уклоняются от иммунитета и продлевают пандемию COVID-19 . [ 135 ] [ 136 ] [ 137 ] В сентябре 2023 года мутагенность молнупиравира была подтверждена в исследовании глобальных изолятов SARS CoV 2 после 2022 года: геномные изменения были более распространены, особенно там, где использовался молнупиравир. [ 138 ]Новые ингибиторы протеазы
Энситрелвир

Энситрелвир , продаваемый под торговой маркой Xocova, представляет собой противовирусный препарат, используемый для лечения COVID-19 . [ 139 ] [ 140 ] [ 141 ] [ 142 ] Он был разработан компанией Shionogi в сотрудничестве с Университетом Хоккайдо и действует как перорально активный ингибитор 3C-подобной протеазы . [ 143 ] [ 144 ] Его принимают внутрь. [ 145 ] [ 146 ] [ 147 ]
Наиболее частые нежелательные явления включают преходящее снижение уровня липопротеинов высокой плотности и повышение уровня триглицеридов в крови . [ 145 ]Нирмарелвир/ритонавир
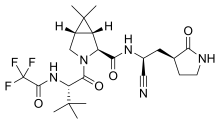
Нирмарелвир/ритонавир , продаваемый под торговой маркой Паксловид, представляет собой упакованный в одну упаковку препарат, используемый для лечения COVID-19 . [ 148 ] [ 149 ] [ 150 ] [ 151 ] Он содержит противовирусные препараты нирмарелвир и ритонавир и был разработан компанией Pfizer . [ 148 ] [ 150 ] Нирмарелвир ингибирует основную протеазу SARS-CoV-2 , а ритонавир является сильным ингибитором CYP3A , замедляя метаболизм нирмарелвира и, следовательно, усиливая его эффект. [ 150 ] [ 152 ] Его принимают внутрь . [ 150 ]
У непривитых людей из группы высокого риска с COVID-19 нирмарелвир/ритонавир может снизить риск госпитализации или смерти на 88%, если принимать их в течение пяти дней после появления симптомов. [ 153 ] У людей, принимающих нирмарелвир/ритонавир, тест на COVID-19 также дает отрицательный результат примерно на два с половиной дня раньше, чем у людей, которые этого не делают. [ 154 ] Побочные эффекты нирмарелвира/ритонавира включают изменения вкусовых ощущений ( дисгевзия ), диарею , высокое кровяное давление ( гипертония ) и мышечные боли ( миалгия ). [ 150 ]
США В декабре 2021 года Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) выдало разрешение на экстренное применение нирмателвира/ритонавира (EUA) для лечения COVID-19. [ 155 ] [ 156 ] Позже в том же месяце он был одобрен в Великобритании. [ 157 ] а в Европейском Союзе и Канаде — в январе 2022 года. [ 158 ] [ 159 ] [ 160 ] В мае 2023 года он был одобрен в США для лечения легкой и среднетяжелой формы COVID-19 у взрослых, которые подвержены высокому риску развития тяжелой формы COVID-19, включая госпитализацию или смерть. [ 161 ] [ 151 ] FDA считает эту комбинацию первым в своем классе лекарством . [ 162 ]Другой
сабизубулин

| |
| Имена | |
|---|---|
| Название ИЮПАК
[2-( 1H -Индол-3-ил)-1H - имидазол-5-ил]-(3,4,5-триметоксифенил)метанон
| |
| Другие имена | |
| Идентификаторы | |
3D model ( JSmol )
|
|
| ХЭМБЛ | |
| ХимическийПаук | |
| КЕГГ | |
ПабХим CID
|
|
| НЕКОТОРЫЙ | |
| Характеристики | |
| С 21 Н 19 Н 3 О 4 | |
| Молярная масса | 377.400 g·mol −1 |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |
Планирование и координация
Этот раздел необходимо обновить . ( июнь 2021 г. ) |
Раннее планирование
В 2018–2020 годах новые инициативы по стимулированию разработки вакцин и противовирусных препаратов включали партнерство между правительственными организациями и промышленностью, такие как Европейская инициатива по инновационным лекарственным средствам , [ 169 ] США» Инициатива «Критический путь по стимулированию инноваций в разработке лекарств, [ 170 ] и присвоение статуса «Прорывная терапия» для ускорения разработки и нормативной проверки перспективных лекарств-кандидатов. [ 171 ] Для ускорения совершенствования диагностики для выявления инфекции COVID-19 сформирован глобальный трекер диагностического конвейера. [ 172 ]
По данным системы отслеживания прогресса клинических испытаний потенциальных терапевтических препаратов для лечения инфекций COVID-19, в марте 2020 года были завершены 29 исследований эффективности II–IV фаз, а результаты запланированы на апрель в больницах Китая, где произошла первая вспышка COVID-19. 19 в конце 2019 года. [ 19 ] В семи исследованиях оценивались перепрофилированные препараты, уже одобренные для лечения малярии , в том числе четыре исследования по гидроксихлорохину или хлорохинфосфату. [ 19 ] Большую часть китайских исследований составляют перепрофилированные противовирусные препараты: к концу апреля должны быть опубликованы девять исследований III фазы ремдесивира в нескольких странах. [ 19 ] Другими потенциальными терапевтическими кандидатами в рамках основных клинических исследований, завершающихся в марте-апреле, являются, среди прочего, вазодилататоры , кортикостероиды , иммунная терапия , липоевая кислота , бевацизумаб и рекомбинантный ангиотензинпревращающий фермент 2 .
Коалиция клинических исследований COVID-19 ставит перед собой цели: 1) способствовать быстрому рассмотрению предложений о клинических исследованиях комитетами по этике и национальными регулирующими органами, 2) ускорить процесс утверждения потенциальных терапевтических соединений, 3) обеспечить стандартизированный и быстрый анализ возникающей эффективности и данные о безопасности и 4) способствовать обмену результатами клинических испытаний до их публикации. [ 11 ] По состоянию на апрель проводился динамический обзор клинических разработок кандидатов на вакцину и лекарства от COVID-19. [ 12 ]
К марту 2020 года Международная коалиция за инновации в области обеспечения готовности к эпидемиям (CEPI) обязалась инвестировать в исследования в размере 100 миллионов долларов США в нескольких странах. [ 173 ] и выступил с срочным призывом собрать и быстро инвестировать 2 миллиарда долларов на разработку вакцины. [ 174 ] В марте под руководством Фонда Билла и Мелинды Гейтс совместно с партнерами, инвестировавшими 125 миллионов долларов США и координируя свою деятельность со Всемирной организацией здравоохранения, стартовал Акселератор терапии COVID-19, который помогает исследователям в области разработки лекарств быстро выявлять, оценивать, разрабатывать и расширять потенциальные методы лечения. [ 175 ] Коалиция клинических исследований COVID-19 создана для координации и ускорения получения результатов международных клинических испытаний наиболее перспективных постинфекционных методов лечения. [ 11 ] В начале 2020 года многочисленные признанные противовирусные соединения для лечения других инфекций были перепрофилированы или разработаны в рамках новых клинических исследований, направленных на облегчение заболевания, вызванного COVID-19. [ 7 ] [ 13 ] [ 19 ]
В марте 2020 года Коалиция за инновации в области готовности к эпидемиям (CEPI) инициировала создание международного фонда разработки вакцин против COVID-19 с целью собрать 2 миллиарда долларов США на исследования и разработки вакцин. [ 176 ] и обязался инвестировать 100 миллионов долларов США в разработку вакцины в нескольких странах. [ 173 ] Правительство Канады объявило о выделении 275 миллионов канадских долларов на финансирование 96 исследовательских проектов по медицинским контрмерам против COVID-19, включая многочисленные кандидаты на вакцины в канадских университетах. [ 177 ] [ 178 ] с планами создать «банк вакцин» новых вакцин для внедрения в случае возникновения новой вспышки COVID-19. [ 178 ] [ 179 ] В апреле Фонд Билла и Мелинды Гейтс инвестировал 150 миллионов долларов США в разработку вакцин, средств диагностики и лечения COVID-19. [ 180 ]
Компьютерные исследования
Этот раздел необходимо обновить . ( ноябрь 2020 г. ) |
В марте 2020 года Министерство энергетики США , Национальный научный фонд , НАСА , промышленность и девять университетов объединили ресурсы для доступа к суперкомпьютерам IBM в сочетании с ресурсами облачных вычислений Hewlett Packard Enterprise , Amazon , Microsoft и Google для разработки лекарств. . [ 181 ] [ 182 ] Консорциум высокопроизводительных вычислений для борьбы с COVID-19 также стремится прогнозировать распространение болезней, моделировать возможные вакцины и проверять тысячи химических соединений для разработки вакцины или лечения COVID-19. [ 181 ] [ 182 ] К маю 2020 года Консорциум израсходовал 437 петафлопс вычислительной мощности. [ 183 ]
Институт цифровой трансформации C3.ai, дополнительный консорциум Microsoft, шести университетов (включая Массачусетский технологический институт , член первого консорциума) и Национального центра суперкомпьютерных приложений в Иллинойсе, работающих под эгидой C3.ai. , компания-разработчик программного обеспечения для искусственного интеллекта, объединяет ресурсы суперкомпьютеров для открытия лекарств, разработки медицинских протоколов и улучшения стратегии общественного здравоохранения, а также предоставляет крупные гранты исследователям, которые к Мэй предложили использовать ИИ для выполнения подобные задачи. [ 184 ] [ 185 ]
В марте 2020 года распределенных вычислений проект Folding@home запустил программу помощи разработчикам лекарств, первоначально моделируя белковые мишени SARS-CoV-2 и родственного вируса SARS-CoV, который был изучен ранее. [ 186 ] [ 187 ] [ 188 ] [ 189 ] [ 190 ] [ 191 ]
проект распределенных вычислений Rosetta@home В марте к усилиям также присоединился . В проекте используются компьютеры добровольцев для моделирования белков вируса SARS-CoV-2, чтобы обнаружить возможные мишени для лекарств или создать новые белки для нейтрализации вируса. Исследователи сообщили, что с помощью Rosetta@home им удалось «точно предсказать структуру атомного масштаба важного белка коронавируса за несколько недель до того, как ее можно будет измерить в лаборатории». [ 192 ]
В мае 2020 года было запущено партнерство OpenPandemics – COVID-19 между Scripps Research и IBM World Community Grid . Партнерство представляет собой проект распределенных вычислений, который «будет автоматически запускать моделируемый эксперимент в фоновом режиме [подключенных домашних компьютеров], который поможет спрогнозировать эффективность конкретного химического соединения в качестве возможного лечения COVID-19». [ 193 ]
Международная солидарность и испытания открытий
В марте Всемирная организация здравоохранения (ВОЗ) запустила скоординированное «Испытание солидарности» в 10 странах на пяти континентах , чтобы быстро оценить на тысячах инфицированных Covid-19 людей потенциальную эффективность существующих противовирусных и противовоспалительных средств, еще не оцененных специально для лечения. COVID-19 болезнь. [ 2 ] [ 16 ] К концу апреля в исследовании приняли участие больницы более чем 100 стран. [ 194 ]
Индивидуальные или комбинированные препараты, подвергающиеся первоначальному изучению: 1) лопинавир - ритонавир в сочетании, 2) лопинавир-ритонавир в сочетании с интерфероном-бета , 3) ремдесивир или 4) (гидрокси) хлорохин в отдельных исследованиях и в больницах по всему миру. [ 2 ] [ 16 ] исследования После опубликованного в The Lancet проблем безопасности гидроксихлорохина ВОЗ приостановила его использование в исследовании Solidarity в мае 2020 года. [ 195 ] [ 196 ] восстановил его после отзыва исследования, [ 197 ] затем отказалась от дальнейшего использования препарата для лечения COVID-19, когда анализ в июне показал, что он не принес никакой пользы. [ 43 ]
Учитывая, что около 15% людей, инфицированных COVID-19, страдают тяжелым заболеванием, а больницы во время пандемии перегружены, ВОЗ признала срочную клиническую необходимость протестировать и перепрофилировать эти препараты в качестве средств, уже одобренных для лечения других заболеваний и признанных безопасными. [ 2 ] Проект «Солидарность» предназначен для быстрого получения информации по ключевым клиническим вопросам: [ 2 ] [ 198 ]
- Снижает ли какой-либо препарат смертность?
- Сокращают ли какие-либо препараты время госпитализации пациента?
- Влияет ли лечение на необходимость искусственной вентиляции легких или содержания людей с пневмонией, вызванной COVID-19, в отделении интенсивной терапии ?
- Могут ли такие препараты использоваться для минимизации заболеваемости инфекцией COVID-19 у медицинского персонала и людей с высоким риском развития тяжелого заболевания?
Регистрация людей с инфекцией COVID-19 упрощается за счет использования ввода данных, включая информированное согласие , на веб-сайте ВОЗ. После того, как сотрудники исследования определят лекарства, доступные в больнице, веб-сайт ВОЗ рандомизирует госпитализированных субъектов на один из исследуемых препаратов или на больничный стандарт лечения COVID-19. Врач, проводящий исследование, записывает и предоставляет последующую информацию о состоянии субъекта и лечении, завершая ввод данных через веб-сайт ВОЗ «Солидарность». Дизайн исследования «Солидарность» не является двойным слепым , что обычно является стандартом для высококачественных клинических исследований, но ВОЗ требовалась скорость и качество для проведения исследования во многих больницах и странах. [ 2 ] Глобальный совет по мониторингу безопасности, состоящий из врачей ВОЗ, изучает промежуточные результаты , чтобы помочь принять решения о безопасности и эффективности исследуемых препаратов, а также изменить дизайн исследования или рекомендовать эффективную терапию. [ 2 ] [ 198 ] Аналогичное онлайн-исследование «Солидарности» под названием «Discovery» было инициировано в марте в семи странах компанией INSERM ( Париж, Франция ). [ 2 ] [ 34 ]
Исследование «Солидарность» направлено на обеспечение координации между сотнями больниц в разных странах, в том числе со слаборазвитой инфраструктурой для клинических испытаний, но его необходимо провести быстро. По словам Джона-Арне Рёттингена , исполнительного директора Исследовательского совета Норвегии и председателя международного руководящего комитета исследования «Солидарность », исследование будет считаться эффективным, если будет установлено, что методы лечения «сократят долю пациентов, нуждающихся в аппаратах искусственной вентиляции легких, скажем, на 20 %, это может оказать огромное влияние на наши национальные системы здравоохранения». [ 30 ]
В марте финансирование испытания «Солидарность» достигло 108 миллионов долларов США от 203 000 частных лиц, организаций и правительств, при этом 45 стран участвовали в финансировании или управлении испытанием. [ 195 ]
Дизайн текущего клинического исследования может быть изменен как «адаптивный дизайн», если накопление данных в исследовании позволит на ранней стадии получить представление о положительной или отрицательной эффективности лечения. [ 199 ] [ 200 ] В глобальных исследованиях Solidarity и European Discovery с участием госпитализированных людей с тяжелой инфекцией COVID-19 применяется адаптивный дизайн для быстрого изменения параметров исследования по мере появления результатов четырех экспериментальных терапевтических стратегий. [ 11 ] [ 34 ] [ 201 ] Адаптивный дизайн в рамках текущих клинических исследований фазы II–III потенциальных терапевтических средств может сократить продолжительность испытаний и использовать меньшее количество участников, возможно, ускоряя принятие решений о досрочном прекращении или успехе, а также координируя изменения в дизайне конкретного исследования в его международных точках. [ 29 ] [ 200 ] [ 202 ]
Исследование адаптивного лечения COVID-19
США Национальный институт аллергии и инфекционных заболеваний (NIAID) инициировал международное исследование фазы III с адаптивным дизайном (называемое «ACTT»), в котором примут участие до 800 госпитализированных людей с COVID-19 в 100 учреждениях в нескольких странах. Начиная с использования ремдесивира в качестве основного лечения в течение 29 дней, в определении его адаптивного протокола испытания говорится, что «будет проводиться временный мониторинг для введения новых препаратов и возможность раннего прекращения лечения из-за бесполезности, эффективности или безопасности. эффективен, то это лечение может стать контрольной группой для сравнения с новым экспериментальным лечением(ями)». [ 38 ]
Операция «Варп Скорость»

Операция Warp Speed (OWS) — государственно-частное партнерство, инициированное правительством США с целью облегчить и ускорить разработку, производство и распространение против COVID-19 . вакцин , терапевтических и диагностических средств [ 203 ] [ 204 ] Первый новостной репортаж об операции Warp Speed вышел 29 апреля 2020 года. [ 205 ] [ 206 ] [ 207 ] и программа была официально анонсирована 15 мая 2020 года. [ 203 ] Его возглавлял Монсеф Слауи с мая 2020 года по январь 2021 года и Дэвид А. Кесслер с января по февраль 2021 года. [ 208 ] В конце февраля 2021 года операция Warp Speed была передана в обязанности Группы реагирования Белого дома на COVID-19 . [ 209 ]
Программа способствовала массовому производству нескольких вакцин и различных типов вакцинных технологий на основе предварительных данных, что позволило обеспечить более быстрое распространение, если клинические испытания подтвердят, что одна из вакцин безопасна и эффективна. [ нужна ссылка ] План предполагал, что некоторые из этих вакцин не окажутся безопасными или эффективными, что сделает программу более дорогостоящей, чем разработка обычных вакцин, но потенциально приведет к появлению жизнеспособной вакцины на несколько месяцев раньше обычных сроков. [ 210 ]
Операция Warp Speed, первоначально финансируемая примерно на 10 миллиардов долларов из Закона CARES (помощь, облегчение и экономическая безопасность в связи с коронавирусом), принятого Конгрессом США 27 марта 2020 года. [ 203 ] представляла собой межведомственную программу, включающую компоненты Министерства здравоохранения и социальных служб , в том числе Центры по контролю и профилактике заболеваний , Управление по контролю за продуктами и лекарствами , Национальные институты здравоохранения (NIH) и Управление перспективных биомедицинских исследований и разработок (BARDA). ; Министерство обороны ; частные фирмы; и другие федеральные агентства, включая Министерство сельского хозяйства , Министерство энергетики и Министерство по делам ветеранов . [ 203 ]ВОССТАНОВЛЕНИЕ
крупномасштабное рандомизированное контролируемое исследование под названием RECOVERY Trial В марте 2020 года в Великобритании было проведено для проверки возможных методов лечения COVID-19. Он находится в ведении Департамента общественного здравоохранения и медицины Наффилда Оксфордского университета и тестирует пять перепрофилированных лекарств, а также плазму выздоравливающих . К июню 2020 года в исследовании приняли участие более 11 500 участников с положительным результатом на COVID-19 в Великобритании. [ 44 ] [ 211 ] [ 212 ]
В апреле британское исследование RECOVERY (рандомизированная оценка терапии COVID-19) было запущено первоначально в 132 больницах по всей Великобритании. [ 213 ] по состоянию на середину апреля оно расширяется и становится одним из крупнейших в мире клинических исследований COVID-19, в котором приняли участие 5400 инфицированных людей, находящихся на лечении в 165 больницах Великобритании. [ 214 ] В исследовании изучаются различные потенциальные методы лечения тяжелой инфекции COVID-19: лопинавир/ритонавир, низкие дозы дексаметазона (противовоспалительный стероид ), гидроксихлорохин и азитромицин (распространенный антибиотик ). [ 211 ] В июне исследование, в котором применялся гидроксихлорохин, было прекращено, поскольку анализы показали, что он не приносит пользы. [ 44 ]
16 июня исследовательская группа опубликовала заявление о том, что дексаметазон снижает смертность у пациентов, получающих респираторную поддержку. [ 215 ] В контролируемом исследовании около 2000 пациентов больницы получали дексаметазон, и их сравнивали с более чем 4000, которые не получали этот препарат. Для пациентов, подключенных к аппаратам искусственной вентиляции легких, это снизило риск смерти с 40% до 28% (1 из 8). Для пациентов, нуждающихся в кислороде, риск смерти снижается с 25% до 20% (1 из 5). [ 216 ]
К концу июня 2020 года в ходе исследования были опубликованы результаты исследования гидроксихлорохина и дексаметазона . [ 44 ] [ 217 ] Он также объявил результаты по лопинавиру/ритонавиру , которые были опубликованы в октябре 2020 года. Группы лопинавир-ритонавир и гидроксихлорохин были закрыты для новых участников после того, как была доказана их неэффективность. [ 44 ] [ 218 ] [ 219 ] Дексаметазон был закрыт для новых заявок для взрослых после положительных результатов, а к ноябрю 2020 года был открыт для заявок для детей.
ПАНОРАМНОЕ испытание
, стартовавшее в декабре 2021 года, Исследование PANORAMIC проверит эффективность молнупиравира и нирмарелвира/ритонавира в предотвращении госпитализации и ускорении выздоровления людей старше 50 лет и лиц, находящихся в группе повышенного риска из-за сопутствующих заболеваний. [ 220 ] [ 221 ] PANORAMIC спонсируется Оксфордским университетом и финансируется Национальным институтом медицинских исследований (NIHR). [ 220 ] По состоянию на март 2022 года в нем приняли участие более 16 000 человек, что делает это крупнейшее исследование противовирусных препаратов от COVID-19. [ 222 ]
См. также
Ссылки
- ^ «Отслеживание вакцины и терапии COVID-19» . БиоРендер. 5 апреля 2021 года. Архивировано из оригинала 3 октября 2020 года . Проверено 21 июня 2021 г.
- ^ Jump up to: а б с д и ж г час я дж к л м н Купфершмидт К., Коэн Дж. (22 марта 2020 г.). «ВОЗ запускает глобальное мегаиспытание четырех наиболее перспективных методов лечения коронавируса» . Научный журнал . дои : 10.1126/science.abb8497 . S2CID 216325781 . Архивировано из оригинала 14 сентября 2020 года . Проверено 27 марта 2020 г.
- ^ «Первый нормативный семинар по COVID-19 способствует глобальному сотрудничеству в разработке вакцин» . Европейское агентство лекарственных средств. 18 марта 2020 г. Архивировано из оригинала 20 марта 2020 г. . Проверено 21 марта 2020 г.
- ^ Jump up to: а б «Обновление о коронавирусе (COVID-19): FDA продолжает способствовать разработке методов лечения» (пресс-релиз). США Управление по контролю за продуктами и лекарствами (FDA). 19 марта 2020 года. Архивировано из оригинала 20 марта 2020 года . Проверено 21 марта 2020 г.
- ^ «Китай одобрил первый противовирусный препарат против коронавируса Covid-19» . Арена клинических испытаний. 18 февраля 2020 года. Архивировано из оригинала 21 марта 2020 года . Проверено 21 марта 2020 г.
- ^ «Китайская вакцина одобрена для испытаний на людях в эпицентре вируса» . Новости Блумберга . 19 марта 2020 года. Архивировано из оригинала 21 марта 2020 года . Проверено 21 марта 2020 г.
- ^ Jump up to: а б с д Дхама К., Шарун К., Тивари Р., Дадар М., Малик Ю.С., Сингх К.П. и др. (июнь 2020 г.). «COVID-19, новая коронавирусная инфекция: достижения и перспективы в разработке вакцин, иммунотерапии и терапевтических средств» . Человеческие вакцины и иммунотерапия . 16 (6): 1232–1238. дои : 10.1080/21645515.2020.1735227 . ПМЦ 7103671 . ПМИД 32186952 .
- ^ Jump up to: а б Чжан Л., Лю Ю (май 2020 г.). «Потенциальные меры борьбы с новым коронавирусом в Китае: систематический обзор» . Журнал медицинской вирусологии . 92 (5): 479–490. дои : 10.1002/jmv.25707 . ПМК 7166986 . ПМИД 32052466 .
- ^ Jump up to: а б Фокс М (19 марта 2020 г.). «Производители лекарств спешат разработать иммунную терапию для Covid-19. Будут ли они готовы вовремя?» . Стат . Архивировано из оригинала 22 марта 2020 года . Проверено 21 марта 2020 г.
- ^ Чан М (19 марта 2020 г.). «Китайским военным ученым поручено выиграть глобальную гонку по разработке вакцины от коронавируса» . Южно-Китайская Морнинг Пост . Архивировано из оригинала 22 марта 2020 года . Проверено 22 марта 2020 г.
- ^ Jump up to: а б с д и Коалиция клинических исследований COVID-19 (апрель 2020 г.). «Глобальная коалиция по ускорению клинических исследований COVID-19 в условиях ограниченных ресурсов» . Ланцет . 395 (10233): 1322–1325. дои : 10.1016/s0140-6736(20)30798-4 . ПМЦ 7270833 . ПМИД 32247324 .
- ^ Jump up to: а б с Магуайр Б.Дж., Герен П.Дж. (2 апреля 2020 г.). «Живой протокол систематического обзора регистрации клинических исследований COVID-19» . Добро пожаловать, Открытое исследование . 5 : 60. doi : 10.12688/wellcomeopenres.15821.1 . ПМК 7141164 . ПМИД 32292826 .
- ^ Jump up to: а б с д и ж г час Ли Джи, Де Клерк Э (март 2020 г.). «Варианты лечения нового коронавируса 2019 года (2019-nCoV)» . Обзоры природы. Открытие наркотиков . 19 (3): 149–150. дои : 10.1038/d41573-020-00016-0 . ПМИД 32127666 .
- ^ Донг Л., Ху С., Гао Дж. (29 февраля 2020 г.). «Открытие лекарств для лечения коронавирусной болезни 2019 (COVID-19)» . Открытия лекарств и терапия . 14 (1): 58–60. дои : 10.5582/ддт.2020.01012 . ПМИД 32147628 . Архивировано из оригинала 20 марта 2020 года . Проверено 21 марта 2020 г.
- ^ Jump up to: а б с д Харрисон С. (апрель 2020 г.). «Коронавирус ускоряет перепрофилирование лекарств». Природная биотехнология . 38 (4): 379–381. дои : 10.1038/d41587-020-00003-1 . ПМИД 32205870 . S2CID 213394680 .
- ^ Jump up to: а б с Ченг М.П., Ли Т.К., Тан Д.Х., Мурти С. (апрель 2020 г.). «Получение данных рандомизированных исследований для оптимизации лечения во время пандемии COVID-19» . CMAJ . 192 (15): Е405–Е407. дои : 10.1503/cmaj.200438 . ПМЦ 7162442 . ПМИД 32336678 .
- ^ Jump up to: а б с д и «Процесс разработки лекарств» . США Управление по контролю за продуктами и лекарствами (FDA). 4 января 2018 г. Архивировано из оригинала 22 февраля 2020 г. . Проверено 21 марта 2020 г.
- ^ «Призыв объединить исследовательские ресурсы в крупных многоцентровых клинических исследованиях с участием нескольких групп для получения убедительных доказательств эффективности лечения COVID-19» . Европейское агентство лекарственных средств. 19 марта 2020 года. Архивировано из оригинала 21 марта 2020 года . Проверено 21 марта 2020 г.
- ^ Jump up to: а б с д и ж г час я дж к л м н тот п д р с т в «Отслеживание вакцин и методов лечения COVID-19 (выберите вкладку «Вакцины или методы лечения», примените фильтры для просмотра выбранных данных)» . Институт Милкена. 21 июня 2021 года. Архивировано из оригинала 24 июня 2021 года . Проверено 11 июня 2021 г.
- ^ Jump up to: а б с Стровел Дж., Ситтампалам С., Куссенс Н.П., Хьюз М., Инглезе Дж., Курц А. и др. (1 июля 2016 г.). «Руководство по раннему открытию и разработке лекарств: для академических исследователей, сотрудников и начинающих компаний» . Руководство по проведению анализа . Eli Lilly & Company и Национальный центр развития трансляционных наук. ПМИД 22553881 . Архивировано из оригинала 19 апреля 2020 года . Проверено 21 марта 2020 г.
- ^ Jump up to: а б Тейлор Д. (2015). «Фармацевтическая промышленность и будущее разработки лекарств». Проблемы экологической науки и техники . Королевское химическое общество: 1–33. дои : 10.1039/9781782622345-00001 . ISBN 978-1-78262-189-8 .
- ^ «Шаг 2: Доклинические исследования» . США Управление по контролю за продуктами и лекарствами (FDA). 4 января 2018 г. Архивировано из оригинала 16 сентября 2020 г. Проверено 23 марта 2020 г.
- ^ Гренфелл Р., Дрю Т. (14 февраля 2020 г.). «Вот почему ВОЗ заявляет, что до создания вакцины от коронавируса осталось 18 месяцев» . Разговор . Архивировано из оригинала 5 декабря 2020 года . Проверено 11 ноября 2020 г.
- ^ Престон Э (19 марта 2020 г.). «Почему создание вакцины от коронавируса займет так много времени?» . Бостон Глобус . Архивировано из оригинала 28 июля 2020 года . Проверено 21 марта 2020 г.
- ^ Ворота Б (февраль 2020 г.). «Реакция на Covid-19 – пандемия, которая случается раз в столетие?» . Медицинский журнал Новой Англии . 382 (18): 1677–1679. дои : 10.1056/nejmp2003762 . ПМИД 32109012 .
- ^ Jump up to: а б с «Успехи клинических разработок: 2006–2015 гг.» (PDF) . Анализ БИО-индустрии. Июнь 2016 г. Архивировано (PDF) из оригинала 1 июля 2016 г. Проверено 21 марта 2020 г.
- ^ Jump up to: а б «Процесс разработки лекарств: Клинические исследования» . США Управление по контролю за продуктами и лекарствами (FDA). 4 января 2018 г. Архивировано из оригинала 20 июня 2020 г. Проверено 28 апреля 2020 г.
- ^ ДиМаси Дж.А., Грабовски Х.Г., Хансен Р.В. (май 2016 г.). «Инновации в фармацевтической промышленности: новые оценки затрат на НИОКР» . Журнал экономики здравоохранения . 47 : 20–33. дои : 10.1016/j.jhealeco.2016.01.012 . hdl : 10161/12742 . ПМИД 26928437 . Архивировано (PDF) из оригинала 14 мая 2020 года . Проверено 24 марта 2020 г.
- ^ Jump up to: а б с Ван Норман, Джорджия (июнь 2019 г.). «Испытания фазы II в области разработки лекарств и адаптивного дизайна исследований» . JACC. Основы трансляционной науки . 4 (3): 428–437. дои : 10.1016/j.jacbts.2019.02.005 . ПМК 6609997 . ПМИД 31312766 .
- ^ Jump up to: а б Маллард А. (апрель 2020 г.). «Затопленный потоком: трубопровод лекарств от COVID-19» . Ланцет . 395 (10232): 1245–1246. дои : 10.1016/S0140-6736(20)30894-1 . ПМЦ 7162641 . ПМИД 32305088 .
- ^ Jump up to: а б Торлунд К., Дрон Л., Пак Дж., Сюй Дж., Форрест Дж.И., Миллс Э.Дж. (июнь 2020 г.). «Информационная панель клинических испытаний COVID-19 в режиме реального времени» . «Ланцет». Цифровое здоровье . 2 (6): е286–е287. дои : 10.1016/S2589-7500(20)30086-8 . ПМЦ 7195288 . ПМИД 32363333 .
- ^ Jump up to: а б «Каковы этапы клинических испытаний?» . Американское онкологическое общество. 2020. Архивировано из оригинала 6 июня 2020 года . Проверено 4 апреля 2020 г.
- ^ «Статус одобрения Ремдесивира» . Наркотики.com. 24 марта 2020 г. Архивировано из оригинала 19 сентября 2020 г. . Проверено 6 апреля 2020 г.
- ^ Jump up to: а б с д и «Запуск европейского клинического исследования против COVID-19» . ВСТАВКА. 22 марта 2020 г. Архивировано из оригинала 22 мая 2020 г. . Проверено 5 апреля 2020 г.
Сильная сторона этого испытания — его «адаптивный» характер. Это означает, что от неэффективных экспериментальных методов лечения можно очень быстро отказаться и заменить их другими молекулами, появившимися в результате исследовательских усилий. Таким образом, мы сможем вносить изменения в режиме реального времени, в соответствии с самыми последними научными данными, чтобы найти лучшее лечение для наших пациентов.
- ^ Пальяруло Н. (5 марта 2020 г.). «Более пристальный взгляд на лекарство от Эболы, которое стало главной надеждой на лечение коронавируса» . Биофарма Дайв. Архивировано из оригинала 31 октября 2021 года . Проверено 19 марта 2020 г.
На данный момент есть только один препарат, который, по нашему мнению, может иметь реальную эффективность. И это ремдесивир», — сказал Брюс Эйлуорд, старший советник и международный руководитель совместной миссии Всемирной организации здравоохранения в Китае.
- ^ «Экстренный доступ к ремдесивиру вне клинических испытаний» . Галаад Наук. 1 апреля 2020 года. Архивировано из оригинала 7 апреля 2020 года . Проверено 7 апреля 2020 г.
- ^ Jump up to: а б «Информация для врачей о вариантах лечения пациентов с COVID-19» . Центры США по контролю и профилактике заболеваний. 21 марта 2020 года. Архивировано из оригинала 8 апреля 2020 года . Проверено 22 марта 2020 г.
- ^ Jump up to: а б Номер клинического исследования NCT04280705 «Испытание адаптивного лечения COVID-19 (ACTT)» на сайте ClinicalTrials.gov.
- ^ «Клинические испытания Национального института здравоохранения показывают, что ремдесивир ускоряет выздоровление при запущенной стадии COVID-19» (пресс-релиз). Национальный институт аллергии и инфекционных заболеваний США. 29 апреля 2020 года. Архивировано из оригинала 30 апреля 2020 года . Проверено 29 апреля 2020 г.
- ^ Ван Ю, Чжан Д, Ду Г, Ду Р, Чжао Дж, Цзинь Ю и др. (май 2020 г.). «Ремдесивир у взрослых с тяжелой формой COVID-19: рандомизированное двойное слепое плацебо-контролируемое многоцентровое исследование» . Ланцет . 395 (10236): 1569–1578. дои : 10.1016/S0140-6736(20)31022-9 . ПМК 7190303 . ПМИД 32423584 .
- ^ Jump up to: а б «Гидроксихлорохина сульфат» . Наркотики.com. 31 марта 2020 г. Архивировано из оригинала 20 марта 2020 г. Проверено 5 апреля 2020 г.
- ^ Jump up to: а б «Хлорохина фосфат» . Наркотики.com. 31 марта 2020 года. Архивировано из оригинала 8 декабря 2015 года . Проверено 5 апреля 2020 г.
- ^ Jump up to: а б Мюлиер Т (17 июня 2020 г.). «Испытания гидроксихлорохина, спонсируемые ВОЗ, прекращены в отношении COVID-19» . Блумберг . Архивировано из оригинала 11 октября 2020 года . Проверено 17 июня 2020 г.
- ^ Jump up to: а б с д и «Нет клинической пользы от использования гидроксихлорохина у госпитализированных пациентов с COVID-19» . Испытание Recovery, Департамент здравоохранения Наффилда, Оксфордский университет, Великобритания. 5 июня 2020 года. Архивировано из оригинала 8 октября 2020 года . Проверено 7 июня 2020 г.
- ^ «Fujifilm объявляет о начале III фазы клинических испытаний противовирусного препарата против гриппа Авиган (фавипиравир) при лечении COVID-19 в Японии и обязуется увеличить производство» . Drugs.com через Fujifilm Toyama Chemical Co., Ltd. 31 марта 2020 г. Архивировано из оригинала 28 июля 2020 г. . Проверено 6 апреля 2020 г.
- ^ Григорий А. (18 марта 2020 г.). «Коронавирус: японский противовирусный препарат эффективен при лечении пациентов, - заявил китайский чиновник» . Независимый . Архивировано из оригинала 9 октября 2020 года . Проверено 19 марта 2020 г.
- ^ Jump up to: а б «Ритонавир» . Наркотики.com. 2020. Архивировано из оригинала 28 июля 2020 года . Проверено 6 апреля 2020 г.
- ^ «Кевзара» . Наркотики.com. 7 марта 2019 г. Архивировано из оригинала 28 июля 2020 г. Проверено 6 апреля 2020 г.
- ^ Стейнс Р. (31 марта 2020 г.). «Sanofi начинает исследование Кевзары против осложнений COVID-19» . ФармаФорум. Архивировано из оригинала 17 августа 2020 года . Проверено 6 апреля 2020 г.
- ^ МакГрат Дж. (2 апреля 2020 г.). «Все вакцины и методы лечения COVID-19 в настоящее время проходят клинические испытания» . Цифровые тенденции. Архивировано из оригинала 8 октября 2020 года . Проверено 6 апреля 2020 г.
- ^ «Тоцилизумаб» . Наркотики.com. 7 июня 2019 года. Архивировано из оригинала 8 сентября 2020 года . Проверено 6 апреля 2020 г.
- ^ Слейтер Х (26 марта 2020 г.). «FDA одобрило клиническое исследование III фазы тоцилизумаба при пневмонии, вызванной COVID-19» . Раковая сеть, MJH Life Sciences. Архивировано из оригинала 17 июня 2020 года . Проверено 28 марта 2020 г.
- ^ «Компания Roche предоставляет обновленную информацию о III фазе исследования COVACTA препарата Актемра/РоАктемра у госпитализированных пациентов с тяжелой пневмонией, связанной с COVID-19» . Хоффманн-Ла Рош. 29 июля 2020 года. Архивировано из оригинала 9 января 2021 года . Проверено 18 августа 2020 г.
- ^ Номер клинического исследования NCT04351152 «Исследование фазы 3 по оценке эффективности и безопасности лензилумаба у госпитализированных пациентов с пневмонией, вызванной COVID-19» на сайте ClinicalTrials.gov.
- ^ «Дапаглифлозин: Информация о препарате MedlinePlus» . medlineplus.gov . 20 апреля 2020 года. Архивировано из оригинала 28 июля 2020 года . Проверено 27 апреля 2020 г.
- ^ Номер клинического исследования NCT04350593 «Дапаглифлозин при дыхательной недостаточности у пациентов с COVID-19 (DARE-19)» на сайте ClinicalTrials.gov.
- ^ Номер клинического исследования NCT04317040 «CD24Fc как непротивовирусный иммуномодулятор при лечении COVID-19 (SAC-COVID)» на сайте ClinicalTrials.gov.
- ^ «Открытое исследование апабеталона при инфекции Covid» . Национальная медицинская библиотека НИЗ . 20 мая 2021 г. Архивировано из оригинала 24 мая 2021 г. Проверено 24 мая 2021 г.
- ^ «Перепрофилирование лекарств» . Национальный центр развития трансляционных наук (NCATS). 7 ноября 2017 года. Архивировано из оригинала 4 октября 2020 года . Проверено 26 марта 2020 г. .
- ^ Jump up to: а б с Крузе Р.Л. (31 января 2020 г.). «Терапевтические стратегии в случае вспышки нового коронавируса, возникшего в Ухане, Китай» . F1000Исследования . 9:72 . doi : 10.12688/f1000research.22211.1 . ПМК 7029759 . ПМИД 32117569 .
- ^ Митжа О, Клотет Б (март 2020 г.). «Использование противовирусных препаратов для снижения передачи COVID-19» . «Ланцет». Глобальное здоровье . 8 (5). Эльзевир Б.В.: e639–e640. дои : 10.1016/s2214-109x(20)30114-5 . ПМК 7104000 . ПМИД 32199468 .
- ^ «Глава здравоохранения ООН объявляет о глобальном «испытании солидарности», чтобы дать толчок поиску лечения COVID-19» . Организация Объединенных Наций – Новости . Всемирная организация здравоохранения. 18 марта 2020 г. Архивировано из оригинала 23 марта 2020 г. . Проверено 29 марта 2020 г.
- ^ Купфершмидт К., Коэн Дж. (март 2020 г.). «Гонка за поиском методов лечения COVID-19 ускоряется» . Наука . 367 (6485): 1412–1413. Бибкод : 2020Sci...367.1412K . дои : 10.1126/science.367.6485.1412 . ПМИД 32217705 .
- ^ «Разработка лекарств от COVID-19: ландшафтный анализ терапевтических средств (таблица)» (PDF) . ООН, Всемирная организация здравоохранения. 21 марта 2020 г. Архивировано (PDF) из оригинала 10 сентября 2020 г. . Проверено 29 марта 2020 г.
- ^ Jump up to: а б с д Пьехотта В., Янницци С., Чай К.Л., Валк С.Дж., Кимбер С., Дорандо Е. и др. (20 мая 2021 г.). «Плазма выздоравливающих или гипериммунный иммуноглобулин для людей с COVID-19: живой систематический обзор» . Кокрановская база данных систематических обзоров . 2021 (5): CD013600. дои : 10.1002/14651858.CD013600.pub4 . ISSN 1469-493X . ПМЦ 8135693 . ПМИД 34013969 .
- ^ «FDA теперь разрешает лечение опасных для жизни случаев COVID-19 с использованием крови выздоровевших пациентов» . ТехКранч . 24 марта 2020 года. Архивировано из оригинала 11 октября 2020 года . Проверено 9 апреля 2020 г.
- ^ Jump up to: а б Фиораванти С (14 декабря 2020 г.). « Бутантан разрабатывает сыворотку против коронавируса». Журнал Pesquisa Fapesp (на португальском языке). Архивировано из оригинала 20 января 2021 года . Проверено 20 января 2021 г.
- ^ Моннерат А (4 января 2021 г.). « Vital Brazil разрабатывает сыворотку против COVID-19, но препарат еще предстоит испытать на людях». Штат Сан-Паулу (на португальском языке). Архивировано из оригинала 17 января 2021 года . Проверено 20 января 2021 г.
- ^ «Аргентина одобряет использование лошадиной сыворотки, которая снижает смертность от COVID-19 на 45%» [Аргентина одобряет использование лошадиной сыворотки, которая снижает смертность от COVID-19 на 45%] (на испанском языке). Немецкая волна. 11 января 2021 года. Архивировано из оригинала 25 января. Получено 20 января.
- ^ Jump up to: а б «Коронавирус: терапевты «решительно» отвергли использование лошадиной сыворотки у тяжелых пациентов » Кларин (на испанском языке). 17 января 2021 года. Архивировано из оригинала 17 января 2021 года . Проверено 20 января 2021 г.
- ^ «FDA разрешает использовать моноклональные антитела для лечения COVID-19» . США Управление по контролю за продуктами и лекарствами (FDA) (пресс-релиз). 10 февраля 2021 г. Проверено 9 февраля 2021 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе .
- ^ «Бамланивимаб компании Lilly (LY-CoV555), вводимый вместе с этесевимабом (LY-CoV016), получил разрешение FDA на экстренное применение при COVID-19» (пресс-релиз). Эли Лилли и компания. 9 февраля 2021 г. Проверено 9 февраля 2021 г. - через PR Newswire.
- ^ «Новые данные показывают, что лечение нейтрализующими антителами Lilly бамланивимабом (LY-CoV555) и этесевимабом (LY-CoV016) вместе снизило риск госпитализаций и смертности от COVID-19 на 70 процентов» (пресс-релиз). Эли Лилли и компания. 26 января 2021 г. Проверено 9 февраля 2021 г. - через PR Newswire.
- ^ Hurt AC, Уитли AK (апрель 2021 г.). «Терапевтические нейтрализующие антитела для лечения COVID-19» . Вирусы . 13 (4): 628. дои : 10.3390/v13040628 . ПМК 8067572 . ПМИД 33916927 .
- ^ «этезевимаб» . Руководство IUPHAR/BPS по фармакологии . Проверено 10 февраля 2021 г.
- ^ «Компания Lilly объявляет о соглашении с правительством США на поставку 300 000 флаконов исследовательского нейтрализующего антитела бамланивимаба (LY-CoV555) в целях борьбы с COVID-19» . Эли Лилли и компания (пресс-релиз). 28 октября 2020 г.
- ^ Jump up to: а б «FDA разрешает бамланивимаб и этесевимаб для лечения COVID-19» . США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) . 16 сентября 2021 г. Проверено 16 сентября 2021 г.
- ^ Jump up to: а б «Разрешение на экстренное использование 094» (PDF) . США Управление по контролю за продуктами и лекарствами (FDA). 16 сентября 2021 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе .
- ^ Jump up to: а б «Обновление о коронавирусе (COVID-19): FDA ограничивает использование некоторых моноклональных антител для лечения COVID-19 из-за варианта Омикрон» (пресс-релиз). США Управление по контролю за продуктами и лекарствами (FDA). 24 января 2022 г. Проверено 24 января 2022 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе .
- ^ Jump up to: а б с «FDA разрешает использовать новое моноклональное антитело для лечения COVID-19, сохраняющее активность против варианта Омикрона» (пресс-релиз). США Управление по контролю за продуктами и лекарствами (FDA). 11 февраля 2022 года. Архивировано из оригинала 12 февраля 2022 года . Проверено 12 февраля 2022 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе .
- ^ «Бебтеловимаб компании Lilly получает разрешение на экстренное использование для лечения легкой и среднетяжелой формы COVID-19» (пресс-релиз). Эли Лилли и компания. 11 февраля 2022 года. Архивировано из оригинала 11 февраля 2022 года . Проверено 12 февраля 2022 г. - через PR Newswire.
- ^ «Обнаруженное AbCellera антитело, бебтеловимаб, получило разрешение FDA США на экстренное использование для лечения легкой и среднетяжелой формы COVID-19» (пресс-релиз). Абселлера. 11 февраля 2022 года. Архивировано из оригинала 11 февраля 2022 года . Проверено 12 февраля 2022 г.
- ^ Суран М (март 2022 г.). «Федеральное правительство закупает тысячи доз бебтеловимаба». ДЖАМА . 327 (12): 1117. doi : 10.1001/jama.2022.3520 . ПМИД 35315904 . S2CID 247599102 .
- ^ «Бебтеловимаб (Код С182122)» . Национальный институт рака. Архивировано из оригинала 13 февраля 2022 года . Проверено 12 февраля 2022 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе .
- ^ «FDA объявляет, что бебтеловимаб в настоящее время не зарегистрирован в США» . Управление по контролю за продуктами и лекарствами США . 30 ноября 2022 г. Проверено 1 декабря 2022 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе .
- ^ Jump up to: а б «Касиривимаб для инъекций, раствор, концентрат Имдевимаб для инъекций, раствор, концентрат REGEN-COV – набор казиривимаб и имдевимаб» . ДейлиМед . Архивировано из оригинала 4 января 2021 года . Проверено 18 марта 2021 г.
- ^ Jump up to: а б с д и «Ронапреве ЭПАР» . Европейское агентство по лекарственным средствам . 10 ноября 2021 года. Архивировано из оригинала 13 ноября 2021 года . Проверено 12 ноября 2021 г. Текст скопирован из источника, права на который принадлежат Европейскому агентству по лекарственным средствам. Воспроизведение разрешено при условии указания источника.
- ^ Jump up to: а б «Информационный бюллетень для разрешения на экстренное использование (EUA) казиривимаба и имдевимаба поставщиками медицинских услуг» (PDF) . США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) . Июнь 2021 г. Архивировано из оригинала 2 ноября 2021 г. Проверено 19 марта 2021 г.
- ^ Баум А., Фултон Б.О., Влога Е., Копин Р., Паскаль К.Е., Руссо В. и др. (август 2020 г.). «Коктейль антител к белку-шипу SARS-CoV-2 предотвращает быстрое ускользание мутаций, наблюдаемое для отдельных антител» . Наука . 369 (6506): 1014–1018. Бибкод : 2020Sci...369.1014B . дои : 10.1126/science.abd0831 . ПМЦ 7299283 . ПМИД 32540904 .
- ^ Келланд К. (14 сентября 2020 г.). «Препарат на основе антител Regeneron добавлен в исследование лечения COVID в Великобритании» . Рейтер . Архивировано из оригинала 11 января 2021 года . Проверено 14 сентября 2020 г.
- ^ «Усилия Regeneron по реагированию на COVID-19» . Регенерон Фармасьютикалс . Архивировано из оригинала 3 декабря 2020 года . Проверено 14 сентября 2020 г.
- ^ Помощник секретаря по связям с общественностью (ASPA) (7 января 2021 г.). «Моноклональные антитела для пациентов с высоким риском заражения COVID-19» . CombatCOVID.hhs.gov . Архивировано из оригинала 27 декабря 2021 года . Проверено 29 декабря 2021 г.
- ^ «Ронапреве» . Управление терапевтических товаров (TGA) . 18 октября 2021 года. Архивировано из оригинала 23 октября 2021 года . Проверено 22 октября 2021 г.
- ^ «Краткий обзор характеристик продукта Ronapreve» . Агентство по регулированию лекарственных средств и товаров медицинского назначения (MHRA). 20 августа 2021 года. Архивировано из оригинала 30 августа 2021 года . Проверено 29 августа 2021 г.
- ^ «Япония становится первой страной, которая одобрила Ронапреве (касиривимаб и имдевимаб) для лечения легкой и среднетяжелой формы COVID-19» . Рош (Пресс-релиз). 20 июля 2021 года. Архивировано из оригинала 24 июля 2021 года . Проверено 29 августа 2021 г.
- ^ «Регуляторное одобрение Ronapreve» . Агентство по регулированию лекарственных средств и товаров медицинского назначения (MHRA). 20 августа 2021 года. Архивировано из оригинала 30 августа 2021 года . Проверено 29 августа 2021 г.
- ^ «Первое лечение моноклональными антителами от COVID-19, одобренное для использования в Великобритании» (пресс-релиз). Агентство по регулированию лекарственных средств и товаров медицинского назначения (MHRA). 20 августа 2021 года. Архивировано из оригинала 30 августа 2021 года . Проверено 29 августа 2021 г.
- ^ «Обновление о коронавирусе (COVID-19): FDA ограничивает использование некоторых моноклональных антител для лечения COVID-19 из-за варианта Омикрон» (пресс-релиз). США Управление по контролю за продуктами и лекарствами (FDA). 24 января 2022 года. Архивировано из оригинала 26 января 2022 года . Проверено 24 января 2022 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе .
- ^ Jump up to: а б «Сводка новостей FDA: 22 марта 2024 г.» . США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) . 22 марта 2024 года. Архивировано из оригинала 23 марта 2024 года . Проверено 23 марта 2024 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе .
- ^ «Invivyd объявляет о разрешении FDA на экстренное использование пемгарды (ранее VYD222) для доконтактной профилактики (PrEP) COVID-19» (пресс-релиз). Инвивид. 22 марта 2024 года. Архивировано из оригинала 23 марта 2024 года . Проверено 23 марта 2024 г. - через GlobeNewswire.
- ^ Jump up to: а б с д «Регкирона ЭПАР» . Европейское агентство по лекарственным средствам . 10 ноября 2021 года. Архивировано из оригинала 12 ноября 2021 года . Проверено 12 ноября 2021 г. Текст скопирован из источника, права на который принадлежат Европейскому агентству по лекарственным средствам. Воспроизведение разрешено при условии указания источника.
- ^ «Celltrion разрабатывает индивидуальный коктейль из нейтрализующих антител с CT-P59 для борьбы с распространением варианта COVID-19, используя свою платформу разработки антител» (пресс-релиз). Целтрион. 11 февраля 2021 года. Архивировано из оригинала 19 октября 2021 года . Проверено 4 марта 2021 г. - через Business Wire.
- ^ «Celltrion Group объявляет о положительных результатах глобального клинического исследования фазы II/III кандидата на лечение COVID-19 CT-P59» (пресс-релиз). Целтрион. 13 января 2021 года. Архивировано из оригинала 19 октября 2021 года . Проверено 4 марта 2021 г. - через Business Wire.
- ^ «EMA выпускает рекомендации по использованию регданвимаба для лечения COVID-19» . Европейское агентство по лекарственным средствам . 26 марта 2021 года. Архивировано из оригинала 15 ноября 2021 года . Проверено 15 октября 2021 г.
- ^ «Регкирона» . Союзный реестр лекарственных средств . 12 ноября 2021 года. Архивировано из оригинала 24 апреля 2022 года . Проверено 24 апреля 2022 г.
- ^ Jump up to: а б «Ксевуди ЭПАР» . Европейское агентство лекарственных средств (EMA) . 15 декабря 2021 года. Архивировано из оригинала 18 декабря 2021 года . Проверено 17 декабря 2021 г. Текст скопирован из источника, права на который принадлежат Европейскому агентству по лекарственным средствам. Воспроизведение разрешено при условии указания источника.
- ^ Jump up to: а б с «EMA начинает обзор сотровимаба (ВИР-7831) для лечения COVID-19» . Европейское агентство лекарственных средств (EMA) (пресс-релиз). 7 мая 2021 г. Архивировано из оригинала 3 августа 2021 г. Проверено 21 мая 2021 г. Текст скопирован из источника, права на который принадлежат Европейскому агентству по лекарственным средствам. Воспроизведение разрешено при условии указания источника.
- ^ Jump up to: а б «EMA выпускает рекомендации по использованию сотровимаба (ВИР-7831) для лечения COVID-19» . Европейское агентство лекарственных средств (EMA) (пресс-релиз). 21 мая 2021 года. Архивировано из оригинала 29 июля 2021 года . Проверено 21 мая 2021 г. Текст скопирован из источника, права на который принадлежат Европейскому агентству по лекарственным средствам. Воспроизведение разрешено при условии указания источника.
- ^ «GSK и Vir Biotechnology объявляют о начале скользящего обзора EMA препарата VIR-7831 (сотровимаб) для раннего лечения COVID-19» . GlaxoSmithKline (пресс-релиз). 7 мая 2021 г. Архивировано из оригинала 22 мая 2021 г. Проверено 21 мая 2021 г.
- ^ «EMA начинает рассмотрение VIR-7831 для лечения пациентов с COVID-19» . Европейское агентство лекарственных средств (EMA) (пресс-релиз). 15 апреля 2021 года. Архивировано из оригинала 22 мая 2021 года . Проверено 21 мая 2021 г.
- ^ «Сводка новостей FDA: 5 апреля 2022 г.» . Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (пресс-релиз). 5 апреля 2022 года. Архивировано из оригинала 8 апреля 2022 года . Проверено 8 апреля 2022 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе .
- ^ «Цилгавимаб» . Руководство IUPHAR/BPS по фармакологии . ЮФАР . 27 декабря 2021 года. Архивировано из оригинала 27 декабря 2021 года . Проверено 27 декабря 2021 г.
- ^ «Тиксагевимаб» . Руководство IUPHAR/BPS по фармакологии . ЮФАР . 27 декабря 2021 года. Архивировано из оригинала 27 декабря 2021 года . Проверено 27 декабря 2021 г.
- ^ Абрамович М., Зуккотти Г., Пфломм Дж.М., ред. (январь 2022 г.). «Тиксагевимаб и Силгавимаб (Эвушельд) для доконтактной профилактики COVID- 1 ДЖАМА 327 (4): 384–385. дои : 10.1001/public.2021.24931 . ПМИД 35076671 .
- ^ Рэй С. (21 августа 2021 г.). «Терапия антителами против Covid-19 компании AstraZeneca эффективна для предотвращения симптомов среди групп высокого риска, результаты испытаний» . Форбс . ISSN 0015-6914 . Архивировано из оригинала 21 августа 2021 года . Проверено 18 января 2022 г.
- ^ Горяинов А.О. (20 августа 2021 г.). «AstraZeneca заявляет, что исследование фазы 3 антитела AZD7442 достигло основной конечной точки в предотвращении Covid-19» . МаркетВотч . Архивировано из оригинала 21 августа 2021 года . Проверено 18 января 2022 г.
- ^ «Обновление о коронавирусе (COVID-19): FDA разрешает новые моноклональные антитела длительного действия для доконтактной профилактики COVID-19 у определенных лиц» . США Управление по контролю за продуктами и лекарствами (FDA) (пресс-релиз). 8 декабря 2021 года. Архивировано из оригинала 28 апреля 2022 года . Проверено 9 декабря 2021 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе .
- ^ Jump up to: а б с «FDA разрешает инъекции Гобика (вилобелимаба) для лечения COVID-19» . США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) . 4 апреля 2023 г. Проверено 4 апреля 2023 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе .
- ^ Jump up to: а б https://www.fda.gov/media/166824/download
- ^ Jump up to: а б https://www.fda.gov/media/166823/download
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе .
- ^ https://www.fda.gov/media/166826/download.
- ^ «InflaRx получает разрешение FDA на экстренное использование Гобика (вилобелимаба) для лечения пациентов с COVID-19 в критическом состоянии» (пресс-релиз). InflaRx NV, 4 апреля 2023 г. Проверено 4 апреля 2023 г. - через GlobeNewswire.
- ^ Jump up to: а б с д «Краткая информация о характеристиках продукции Lagevrio» . Агентство по регулированию лекарственных средств и товаров медицинского назначения (MHRA) . 4 ноября 2021 г. Архивировано из оригинала 4 ноября 2021 г. Проверено 4 ноября 2021 г.
- ^ Тутс М., Юн Дж.Дж., Кокс Р.М., Харт М., Стичер З.М., Махсус Н. и др. (октябрь 2019 г.). «Характеристика эффективного перорального препарата против гриппа с высоким барьером резистентности у хорьков и эпителия дыхательных путей человека» . Наука трансляционной медицины . 11 (515): eaax5866. doi : 10.1126/scitranslmed.aax5866 . ПМК 6848974 . ПМИД 31645453 .
- ^ Тутс М., Юн Джей Джей, Харт М., Натчус М.Г., Пейнтер Г.Р., Племпер Р.К. (апрель 2020 г.). «Парадигмы количественной эффективности кандидатного клинического препарата против гриппа EIDD-2801 на модели хорька» . Трансляционные исследования . 218 : 16–28. дои : 10.1016/j.trsl.2019.12.002 . ПМЦ 7568909 . ПМИД 31945316 .
- ^ Коэн Б., Пиллер С. (май 2020 г.). «Электронные письма предлагают изучить обвинения осведомителей в кумовстве, стоящих за потенциальным препаратом от COVID-19» . Наука . дои : 10.1126/science.abc7055 .
- ^ Калли М. (январь 2022 г.). «История о двух противовирусных мишенях и препаратах против COVID-19, которые их связывают» . Обзоры природы. Открытие наркотиков . 21 (1): 3–5. дои : 10.1038/d41573-021-00202-8 . ПМИД 34857884 . S2CID 244851870 .
- ^ Алессия Дж (29 сентября 2021 г.). «Ежедневная таблетка для лечения COVID может появиться всего через несколько месяцев» . Новости АВС . Новости здоровья Кайзера. Архивировано из оригинала 29 сентября 2021 года . Проверено 29 сентября 2021 г.
- ^ Джейк Берналь А., Гомеш да Силва М.М., Мусунгаи Д.Б., Ковальчук Е., Гонсалес А., Делос Рейес В. и др. (декабрь 2021 г.). «Молнупиравир для перорального лечения COVID-19 у негоспитализированных пациентов » Медицинский журнал Новой Англии . 386 (6): 509–520. дои : 10.1056/NEJMoa2116044 . ПМЦ 8693688 . ПМИД 34914868 .
- ^ Сингх А.К., Сингх А., Сингх Р., Мисра А. (ноябрь 2021 г.). «Молнупиравир при COVID-19: систематический обзор литературы» . Диабет и метаболический синдром . 15 (6): 102329. doi : 10.1016/j.dsx.2021.102329 . ПМЦ 8556684 . ПМИД 34742052 .
- ^ «Первый пероральный противовирусный препарат для лечения COVID-19, Лагеврио (молнупиравир), одобренный MHRA» (пресс-релиз). Агентство по регулированию лекарственных средств и товаров медицинского назначения (MHRA). 4 ноября 2021 года. Архивировано из оригинала 5 января 2022 года . Проверено 4 ноября 2021 г.
- ^ «Молнупиравир компании Merck и Ridgeback, пероральный противовирусный препарат от COVID-19, получает первую в мире авторизацию» . Merck & Co. (Пресс-релиз). 4 ноября 2021 г. Архивировано из оригинала 4 ноября 2021 г. Проверено 4 ноября 2021 г.
- ^ Роббинс Р., Хан А.Дж., Специя М (4 ноября 2021 г.). «Британия становится первой, кто разрешил противовирусную таблетку от Covid-19» . Нью-Йорк Таймс . Архивировано из оригинала 28 ноября 2021 года . Проверено 27 ноября 2021 г.
- ^ «Обновление о коронавирусе (COVID-19): FDA разрешает дополнительные пероральные противовирусные препараты для лечения COVID-19 у некоторых взрослых» . США Управление по контролю за продуктами и лекарствами (FDA) (пресс-релиз). 23 декабря 2021 года. Архивировано из оригинала 23 декабря 2021 года . Проверено 23 декабря 2021 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе .
- ^ Кимбалл С. (30 ноября 2021 г.). «Консультативная группа FDA однозначно одобряет таблетки Merck для перорального лечения Covid, несмотря на меньшее количество вопросов об эффективности и безопасности» . CNBC . Архивировано из оригинала 1 января 2022 года . Проверено 1 января 2022 г.
- ^ Лин М.З. (24 декабря 2021 г.). «Новый препарат для лечения коронавируса может создать питательную среду для мутантных вирусов» . Вашингтон Пост . Архивировано из оригинала 30 декабря 2021 года . Проверено 1 января 2022 г.
- ^ Служба РФ (ноябрь 2021 г.). «Известный вирусолог предупреждает, что таблетка от COVID-19 может привести к появлению опасных мутантов. Другие не видят повода для тревоги» . Наука . дои : 10.1126/science.acx9591 .
- ^ Сандерсон Т., Хиснер Р., Донован-Банфилд И., Хартман Х., Лохен А., Пикок Т.П. и др. (сентябрь 2023 г.). «Мутационная сигнатура, связанная с молнупиравиром, в глобальных геномах SARS-CoV-2» . Природа . 623 (7987): 594–600. Бибкод : 2023Natur.623..594S . дои : 10.1038/s41586-023-06649-6 . ПМЦ 10651478 . ПМИД 37748513 . S2CID 262748823 .
- ^ Маккарти MW (декабрь 2022 г.). «Энситрелвир как потенциальное средство лечения COVID-19». Эксперт Опин Фармакотер . 23 (18): 1995–1998. дои : 10.1080/14656566.2022.2146493 . ПМИД 36350029 . S2CID 253418404 .
- ^ Фудзикава М. (22 ноября 2022 г.). «Япония одобрила первую отечественную противовирусную таблетку от Covid-19» . Уолл Стрит Джорнал . Проверено 28 ноября 2022 г.
- ^ «Противовирусный препарат Shionogi от Covid получил первое одобрение в новой системе экстренного одобрения в Японии» . Новости конечных точек . 22 ноября 2022 г. Проверено 28 ноября 2022 г.
- ^ «Xocova: новая мощная японская таблетка для лечения коронавируса» . БиоФарма Медиа . Февраль 2022.
- ^ Уно Ю., Уэхара С., Накахара К., Нобори Х., Ямацу Ю., Ямамото С. и др. (май 2022 г.). «Открытие S-217622, нековалентного перорального ингибитора протеазы SARS-CoV-2 3CL, клинического кандидата для лечения COVID-19 » Журнал медицинской химии . 65 (9): 6499–6512. doi : 10.1021/acs.jmedchem.2c00117 . ПМЦ 8982737 . ПМИД 35352927 .
- ^ «Shionogi представляет положительные результаты Ph II/III для противовирусного препарата S-217622 от COVID-19» . thepharmaletter.com . 31 января 2022 г.
- ^ Jump up to: а б «Таблетки Xocova (энситрелвир, фумаровая кислота) 125 мг одобрены в Японии для лечения инфекции SARS-CoV-2 в рамках системы одобрения чрезвычайных регулирующих органов» . Сионоги (Пресс-релиз). 22 ноября 2022 г. Проверено 28 ноября 2022 г.
- ^ «Новая таблетка от COVID от Сионоги, по-видимому, облегчает симптомы омикрона» . Никкей Азия . 21 декабря 2021 г.
- ^ Ураки Р., Кисо М., Иида С., Имаи М., Такашита Э., Курода М. и др. (Исследовательская группа IASO) (май 2022 г.). «Характеристика и противовирусная чувствительность SARS-CoV-2 Omicron/BA.2» . Природа . 607 (7917): 119–127. Бибкод : 2022Natur.607..119U . дои : 10.1038/s41586-022-04856-1 . ПМК 10579982 . ПМИД 35576972 . S2CID 248833104 .
- ^ Траст Б, Траст Б (февраль 2023 г.). «Эффективность и безопасность нирмателвира/ритонавира (Паксловида) при COVID-19: быстрый обзор и метаанализ » Журнал медицинской вирусологии . 95 (2):e28441. дои : 10.1002/jmv.28441 . ПМЦ 9880713 . ПМИД 36576379 .
- ^ «Паксловид» . Портал вакцин и методов лечения COVID-19 . 17 января 2022 года. Архивировано из оригинала 22 апреля 2022 года . Проверено 25 апреля 2022 г.
- ^ Новые разрешения на лекарственную терапию, 2023 г. (PDF) . США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) (отчет). Январь 2024 года. Архивировано из оригинала 10 января 2024 года . Проверено 9 января 2024 г.
- ^ «Название вещества: Сабизабулин» . ХимИДплюс . Проверено 1 мая 2022 г.
- ^ «Сабизубулин при COVID-19» . Правда Инк . 14 января 2022 г. Проверено 1 мая 2022 г.
- ^ «VERU-111 в лечении инфекции SARS-Cov-2 путем оценки его влияния на долю пациентов, умерших в ходе исследования» . ClinicalTrials.gov (пресс-релиз). 13 апреля 2021 г. Проверено 1 мая 2022 г.
- ^ Ли СМ, Лу Ю, Чен Дж., Костелло Т.А., Нараянан Р., Далтон М.Н. и др. (4 июля 2012 г.). «Биодоступные пероральные антагонисты тубулина при раке, резистентном к паклитакселу» . Фармацевтические исследования . 29 (11): 3053–3063. дои : 10.1007/s11095-012-0814-5 . ISSN 0724-8741 . ПМЦ 3646298 . ПМИД 22760659 .
- ^ Марковски М.С., Тутроне Р., Печонка С., Барнетт К.Г., Гетценберг Р.Х., Родригес Д. и др. (апрель 2022 г.). «Исследование фазы 1b/2 сабизабулина, нового перорального разрушителя цитоскелета, у мужчин с метастатическим устойчивым к кастрации раком простаты с прогрессированием под действием агента, нацеленного на андрогенные рецепторы» . Клинические исследования рака . 28 (13): ОФ1–ОФ7. дои : 10.1158/1078-0432.CCR-22-0162 . ПМЦ 9774054 . ПМИД 35416959 . S2CID 248128050 .
- ^ rme (13 апреля 2022 г.). «COVID-19: противораковый препарат сабизубулин вдвое снижает смертность от серьезных заболеваний» . aerzteblatt.de . Проверено 14 апреля 2022 г.
- ^ «Об инициативе инновационных лекарственных средств» . Европейская инициатива инновационных лекарственных средств. 2020. Архивировано из оригинала 2 сентября 2020 года . Проверено 24 января 2020 г.
- ^ «Инициатива критического пути» . США Управление по контролю за продуктами и лекарствами (FDA). 23 апреля 2018 г. Архивировано из оригинала 17 сентября 2020 г. Проверено 24 января 2020 г.
- ^ «Прорывная терапия» . США Управление по контролю за продуктами и лекарствами (FDA). 4 января 2018 г. Архивировано из оригинала 25 сентября 2020 г. Проверено 24 января 2020 г.
- ^ «Диагностический трубопровод SARS-CoV-2» . Фонд инновационной новой диагностики. 2020. Архивировано из оригинала 16 сентября 2020 года . Проверено 4 апреля 2020 г.
- ^ Jump up to: а б Келланд К. (10 марта 2020 г.). «Группа реагирования на эпидемию увеличивает финансирование вакцины против коронавируса до 23,7 миллиона долларов» . Рейтер . Архивировано из оригинала 18 августа 2020 года . Проверено 21 марта 2020 г.
- ^ «Реакция CEPI на COVID-19» . Коалиция за инновации в области готовности к эпидемиям, Осло, Норвегия. 1 марта 2020 г. Архивировано из оригинала 25 марта 2020 г. . Проверено 25 марта 2020 г.
- ^ «Ускоритель терапии COVID-19: Фонд Билла и Мелинды Гейтс, Wellcome и Mastercard запускают инициативу для ускорения разработки и доступа к методам лечения COVID-19» . Фонд Билла и Мелинды Гейтс. 10 марта 2020 года. Архивировано из оригинала 6 октября 2020 года . Проверено 4 апреля 2020 г.
- ^ «CEPI приветствует финансирование правительства Великобритании и подчеркивает необходимость в 2 миллиардах долларов для разработки вакцины против COVID-19» . Коалиция за инновации в области готовности к эпидемиям, Осло, Норвегия. 6 марта 2020 г. Архивировано из оригинала 22 марта 2020 г. . Проверено 23 марта 2020 г.
- ^ «Правительство Канады финансирует 49 дополнительных исследовательских проектов по COVID-19 – Подробная информация о профинансированных проектах» . Правительство Канады. 23 марта 2020 г. Архивировано из оригинала 22 марта 2020 г. . Проверено 23 марта 2020 г.
- ^ Jump up to: а б Абеди М (23 марта 2020 г.). «Канада потратит 192 миллиона долларов на разработку вакцины против COVID-19» . Глобальные новости . Архивировано из оригинала 9 апреля 2020 года . Проверено 24 марта 2020 г.
- ^ О'Брайен С. (31 марта 2020 г.). «Наблюдение за вакцинами: такие усилия предпринимаются во всем мире» . Новости КТВ . Архивировано из оригинала 24 сентября 2020 года . Проверено 1 апреля 2020 г.
- ^ «Фонд Гейтса расширяет свою приверженность реагированию на COVID-19 и призывает к международному сотрудничеству» . Фонд Билла и Мелинды Гейтс. 15 апреля 2020 года. Архивировано из оригинала 14 сентября 2020 года . Проверено 27 апреля 2020 г.
- ^ Jump up to: а б Шенкленд С. (23 марта 2020 г.). «Шестнадцать суперкомпьютеров занимаются лечением коронавируса в США» . CNET . ВиакомСБС. Архивировано из оригинала 20 сентября 2020 года . Проверено 27 апреля 2020 г.
- ^ Jump up to: а б «Консорциум высокопроизводительных вычислений COVID-19» . Консорциум высокопроизводительных вычислений COVID-19. 2020. Архивировано из оригинала 23 сентября 2020 года . Проверено 27 апреля 2020 г.
- ^ Виггерс К. (28 мая 2020 г.). «Консорциум HPC-COVID-19 выделяет 437 петафлопс вычислительной мощности на исследования вирусов» . ВенчурБит . Архивировано из оригинала 26 марта 2022 года . Проверено 1 апреля 2022 г.
- ^ «C3.ai, Microsoft и ведущие университеты создают Институт цифровой трансформации C3.ai» . C3.ai. 26 марта 2020 г. Архивировано из оригинала 14 августа 2020 г. . Проверено 27 апреля 2020 г.
- ^ Broad W (26 марта 2020 г.). «ИИ против коронавируса» . Нью-Йорк Таймс . Архивировано из оригинала 31 августа 2020 года . Проверено 27 апреля 2020 г.
- ^ Броехейсен Н. (3 марта 2020 г.). «Помогите вылечить коронавирус, используя оставшуюся вычислительную мощность вашего компьютера» . Аппаратное обеспечение Тома . Архивировано из оригинала 21 августа 2020 года . Проверено 12 марта 2020 г.
- ^ Боуман Дж. (27 февраля 2020 г.). «Folding@home начинает борьбу с COVID-19/2019-nCoV» . Складной@дома . Архивировано из оригинала 15 марта 2020 года . Проверено 12 марта 2020 г.
- ^ «Folding@home превращает свою огромную краудсорсинговую компьютерную сеть в борьбу с COVID-19» . 16 марта 2020 г. Архивировано из оригинала 8 сентября 2020 г. . Проверено 27 апреля 2020 г.
- ^ Мастерсон В. (22 декабря 2020 г.). «Ваш компьютер может помочь ученым найти лекарство от COVID-19. Вот как» . Всемирный экономический форум . Архивировано из оригинала 5 ноября 2021 года . Проверено 1 апреля 2022 г.
- ^ «Вместе мы сила» . СКЛАДНОЙ ДОМА . Архивировано из оригинала 23 марта 2022 года . Проверено 1 апреля 2022 г.
- ^ фон Делфт Ф., Кальмиано М., Чодера Дж., Гриффен Е., Ли А., Лондон Н. и др. (июнь 2021 г.). «Абсолютное открытие открытого лекарства от COVID» . Природа . 594 (7863): 330–332. Бибкод : 2021Природа.594..330В . дои : 10.1038/d41586-021-01571-1 . ПМИД 34127864 . S2CID 235438395 .
- ^ «Rosetta@home объединяет легион компьютеров против коронавируса» . HPCwire . 24 марта 2020 года. Архивировано из оригинала 9 апреля 2020 года . Проверено 4 ноября 2020 г. .
- ^ «Открытые пандемии – COVID-19» . ИБМ. 2020. Архивировано из оригинала 17 августа 2020 года . Проверено 18 мая 2020 г.
- ^ « Клиническое исследование «Солидарность» по лечению COVID-19» . Всемирная организация здравоохранения. 27 апреля 2020 года. Архивировано из оригинала 12 октября 2020 года . Проверено 1 мая 2020 г.
- ^ Jump up to: а б «Вступительное слово Генерального директора ВОЗ на брифинге для СМИ, посвященном COVID-19» . Всемирная организация здравоохранения. 25 мая 2020 г. Архивировано из оригинала 10 октября 2020 г. . Проверено 27 мая 2020 г.
- ^ Ченг М., Китен Дж. (25 мая 2020 г.). «ВОЗ приостановила испытания гидроксихлорохина на коронавирус из соображений безопасности» . Глобальные новости . Ассошиэйтед Пресс. Архивировано из оригинала 19 сентября 2020 года . Проверено 27 мая 2020 г.
- ^ Абантика Г, Маскареньяш А (4 июня 2020 г.). «ВОЗ возобновляет испытание HCQ после того, как журнал Lancet выразил обеспокоенность по поводу бумаги, которая его испортила» . indianexpress.com . Индийский экспресс . Архивировано из оригинала 29 июля 2020 года . Проверено 16 июня 2020 г.
При обращении к нам Сумья Сваминатан, главный научный сотрудник ВОЗ, рассказал The Indian Express: «Наша комиссия по мониторингу безопасности данных рассмотрела данные о смертности в «Солидарности»… У них не было опасений, связанных со смертностью между HCQ и стандартами медицинской помощи. Поэтому мы решили возобновить судебное разбирательство.
- ^ Jump up to: а б Брансвелл Х (18 марта 2020 г.). «ВОЗ запустит многонациональное исследование, чтобы дать толчок поиску лекарств от коронавируса» . СТАТ. Архивировано из оригинала 11 октября 2020 года . Проверено 28 марта 2020 г.
- ^ «Адаптивные конструкции для клинических испытаний лекарств и биологических препаратов: руководство для промышленности» (PDF) . США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) . 1 ноября 2019 года. Архивировано из оригинала 13 декабря 2019 года . Проверено 3 апреля 2020 г. .
- ^ Jump up to: а б Паллманн П., Беддинг А.В., Чхудари-Оскуей Б., Димайро М., Флайт Л., Хэмпсон Л.В. и др. (февраль 2018 г.). «Адаптивные конструкции в клинических исследованиях: зачем их использовать, как их запускать и сообщать о них» . БМК Медицина . 16 (1): 29. дои : 10.1186/s12916-018-1017-7 . ПМК 5830330 . ПМИД 29490655 .
- ^ Коток А (19 марта 2020 г.). «ВОЗ начинает испытания терапии Covid-19» . Новости технологий: наука и предпринимательство . Архивировано из оригинала 9 августа 2020 года . Проверено 7 апреля 2020 г.
- ^ Сато А., Шимура М., Гошо М. (апрель 2018 г.). «Практические характеристики адаптивного дизайна в клинических исследованиях фазы 2 и 3» . Журнал клинической фармации и терапии . 43 (2): 170–180. дои : 10.1111/jcpt.12617 . ПМИД 28850685 . S2CID 3704071 .
- ^ Jump up to: а б с д «Администрация Трампа объявляет структуру и руководство для операции Warp Speed » . Министерство здравоохранения и социальных служб США . 15 мая 2020 г. Архивировано из оригинала 16 декабря 2020 г. . Проверено 15 мая 2020 г.
Среди других целей операции Warp Speed – обеспечить американцев значительным количеством безопасной и эффективной вакцины к январю 2021 года.
- ^ «Информационный бюллетень: объяснение операции Warp Speed» . Министерство здравоохранения и социальных служб США. 10 ноября 2020 года. Архивировано из оригинала 19 декабря 2020 года . Проверено 24 ноября 2020 г.
- ^ Джейкобс Дж., Армстронг Д. (29 апреля 2020 г.). «Операция Трампа «Варп-Скорость» направлена на ускоренное создание вакцины от коронавируса» . Новости Блумберга . Архивировано из оригинала 17 декабря 2020 года . Проверено 15 мая 2020 г.
- ^ Коэн Дж. (12 мая 2020 г.). «Представляем «Варп-скорость», первый шаг Белого дома в Америке по созданию вакцины от коронавируса» . Наука . дои : 10.1126/science.abc7056 . S2CID 219432336 . Архивировано из оригинала 29 ноября 2020 года . Проверено 16 мая 2020 г.
- ^ Сангер Д.Э. (29 апреля 2020 г.). «Трамп стремится ускорить создание вакцины, несмотря на опасения по поводу безопасности» . Нью-Йорк Таймс . Архивировано из оригинала 9 декабря 2020 года . Проверено 15 мая 2020 г.
- ^ Каплан С. (15 января 2021 г.). «Байден выбирает бывшего руководителя FDA, чтобы возглавить федеральные усилия по разработке вакцин» . Нью-Йорк Таймс . Архивировано из оригинала 15 января 2021 года . Проверено 15 января 2021 г.
- ^ Зрайк К. (24 февраля 2021 г.). «Познакомьтесь с ключевыми членами команды Байдена по реагированию на Covid-19» . Нью-Йорк Таймс . ISSN 0362-4331 . Проверено 7 марта 2021 г.
- ^ Джейкобс Дж., Армстронг Д. (29 апреля 2020 г.). «Операция Трампа «Варп-скорость» направлена на ускорение разработки вакцины от коронавируса» . Новости Блумберга . Архивировано из оригинала 17 декабря 2020 года . Проверено 15 мая 2020 г.
- ^ Jump up to: а б «Испытание ВОССТАНОВЛЕНИЯ» . Департамент здравоохранения Наффилда. 3 апреля 2020 г. Архивировано из оригинала 12 октября 2020 г. . Проверено 18 апреля 2020 г.
- ^ Уолш Ф (20 июня 2020 г.). «Наконец-то хорошие новости о коронавирусе» . Новости Би-би-си . Архивировано из оригинала 31 октября 2020 года . Проверено 20 июня 2020 г.
- ^ «Испытание RECOVERY началось по всей Великобритании» . Департамент здравоохранения Наффилда. 3 апреля 2020 г. Архивировано из оригинала 12 октября 2020 г. . Проверено 18 апреля 2020 г.
- ^ Бозли С. (17 апреля 2020 г.). «Коронавирус: крупнейшее в мире испытание препарата для лечения Covid-19 начинается в Великобритании» . Хранитель . ISSN 0261-3077 . Архивировано из оригинала 9 октября 2020 года . Проверено 18 апреля 2020 г.
- ^ «Недорогой дексаметазон снижает смертность до одной трети у госпитализированных пациентов с тяжелыми респираторными осложнениями, вызванными COVID-19» (PDF) . 16 июня 2020 г. Архивировано (PDF) из оригинала 10 августа 2020 г. . Проверено 21 июня 2020 г.
- ^ Робертс М. (16 июня 2020 г.). «Коронавирус: дексаметазон оказался первым лекарством, спасающим жизни» . Новости BBC онлайн . Архивировано из оригинала 12 октября 2020 года . Проверено 21 июня 2020 г.
- ^ «Дексаметазон снижает смертность госпитализированных пациентов с тяжелыми респираторными осложнениями COVID-19» . Оксфордский университет . 16 июня 2020 года. Архивировано из оригинала 16 июня 2020 года . Проверено 16 июня 2020 г.
- ^ «Никакой клинической пользы от применения лопинавир-ритонавира у госпитализированных пациентов с COVID-19, изученных в программе RECOVERY» (PDF) . Судебный процесс по ВОССТАНОВЛЕНИЮ: Заявление главных следователей. 29 июня 2020 г. Архивировано (PDF) из оригинала 6 октября 2020 г. . Проверено 30 июня 2020 г.
- ^ Хорби П.В., Мафэм М., Белл Дж.Л., Линселл Л., Стэплин Н., Эмберсон Дж. и др. (Совместная группа RECOVERY) (октябрь 2020 г.). «Лопинавир-ритонавир у пациентов, поступивших в больницу с COVID-19 (ВОССТАНОВЛЕНИЕ): рандомизированное контролируемое открытое платформенное исследование» . Ланцет . 396 (10259): 1345–1352. дои : 10.1016/S0140-6736(20)32013-4 . ПМЦ 7535623 . ПМИД 33031764 . S2CID 222135901 .
- ^ Jump up to: а б «NIHR финансирует общественные испытания противовирусных препаратов COVID-19» . www.nihr.ac.uk. Архивировано из оригинала 16 марта 2022 года . Проверено 16 марта 2022 г.
- ^ «Тысячам людей нужно было попробовать новое противовирусное лечение Covid» . Новости Би-би-си . 25 января 2022 года. Архивировано из оригинала 16 марта 2022 года . Проверено 16 марта 2022 г.
- ^ Пинчинг Джей (22 февраля 2022 г.). «ПАНОРАМНЫЙ обзор крупнейшего в мире исследования COVID» . ФармаТаймс . Архивировано из оригинала 18 марта 2022 года . Проверено 16 марта 2022 г.
Дальнейшее чтение
- Каплон Х, Райхерт Дж. М. (2021). «Антитела, за которыми стоит следить в 2021 году» . МАБ . 13 (1): 1860476. дои : 10.1080/19420862.2020.1860476 . ПМЦ 7833761 . ПМИД 33459118 .
- МакКрири Э.К., Пог Дж.М. (апрель 2020 г.). «Лечение коронавирусной болезни 2019: обзор ранних и новых вариантов» . Открытый форум Инфекционные болезни . 7 (4): ofaa105. дои : 10.1093/офид/офаа105 . ПМЦ 7144823 . ПМИД 32284951 .
- Туккори М., Ферраро С., Конвертино И., Каппелло Е., Вальдисерра Г., Бландицци С. и др. (2020). «Моноклональные антитела, нейтрализующие SARS-CoV-2: клиническая разработка» . МАБ . 12 (1): 1854149. дои : 10.1080/19420862.2020.1854149 . ПМЦ 7755170 . ПМИД 33319649 .
- Ян Л., Лю В., Юй Х, Ву М., Райхерт Дж. М., Хо М. (июль 2020 г.). «Отслеживание терапевтических антител к COVID-19: глобальная онлайн-база данных по терапевтическим препаратам на основе антител для профилактики и лечения COVID-19» . Антиб Тер . 3 (3): 205–12. дои : 10.1093/abt/tbaa020 . ПМЦ 7454247 . ПМИД 33215063 .
Внешние ссылки
- План НИОКР и COVID-19 , Всемирная организация здравоохранения
- Коронавирусы Национального института аллергии и инфекционных заболеваний США.
- Трекер терапии COVID-19 Общество специалистов по нормативно-правовому регулированию
- «Лечение COVID-19: исследования и разработки» . Европейское агентство лекарственных средств (EMA). 18 февраля 2021 года. Архивировано из оригинала 23 октября 2021 года . Проверено 16 июня 2021 г.
