Временный потенциальный канал рецептора
| Ионный канал переходного рецепторного потенциала (TRP) | |||
|---|---|---|---|
| Идентификаторы | |||
| Символ | ГТО | ||
| Пфам | PF06011 | ||
| ИнтерПро | ИПР013555 | ||
| Суперсемейство OPM | 8 | ||
| белок OPM | 3j5p | ||
| Мембраном | 605 | ||
| |||
Каналы транзиторного рецепторного потенциала ( TRP-каналы ) представляют собой группу ионных каналов, расположенных в основном на плазматической мембране многих типов клеток животных. Большинство из них сгруппированы в две большие группы: группа 1 включает TRPC («C» для канонического), TRPV («V» для ваниллоида ), TRPVL («VL» для ваниллоидоподобного), TRPM («M» для меластатина). , TRPS («S» для соромеластатина), TRPN («N» для механорецепторного потенциала C) и TRPA («A» для анкирина). Группа 2 состоит из ТРПП («П» для поликистоза) и ТРМЛ («МЛ» для муколипина). [1] [2] Существуют и другие, менее четко классифицированные каналы TRP, включая дрожжевые каналы и ряд каналов группы 1 и группы 2, присутствующих у неживотных. [2] [3] [4] Многие из этих каналов передают различные ощущения, такие как боль, температура, различные вкусовые ощущения, давление и зрение. Считается, что в организме некоторые каналы TRP ведут себя как микроскопические термометры и используются животными для определения тепла или холода. [5] Некоторые каналы TRP активируются молекулами, содержащимися в специях, таких как чеснок ( аллицин ), перец чили ( капсаицин ), васаби ( аллилизотиоцианат ); другие активируются ментолом , камфорой , мятой и охлаждающими веществами; третьи активируются молекулами, содержащимися в каннабисе (например, ТГК , КБД и КБН ) или стевии . Некоторые действуют как датчики осмотического давления, объема, растяжения и вибрации. Большинство каналов активируются или ингибируются сигнальными липидами и вносят вклад в семейство липид-управляемых ионных каналов . [6] [7]
Эти ионные каналы обладают относительно неселективной проницаемостью для катионов , включая натрий , кальций и магний .
с так называемым «переходным рецепторным потенциалом» Каналы TRP были первоначально обнаружены в так называемом мутантном ( trp -мутантном) штамме плодовой мушки Drosophila , отсюда и их название (см. Историю дрозофилы каналов TRP ниже). Позже каналы TRP были обнаружены у позвоночных, где они повсеместно экспрессируются во многих типах клеток и тканях. Большинство каналов TRP состоят из 6 трансмембранных спиралей с внутриклеточными N- и C-концами . Каналы TRP млекопитающих активируются и регулируются множеством стимулов и выражены по всему телу.
Семьи
[ редактировать ]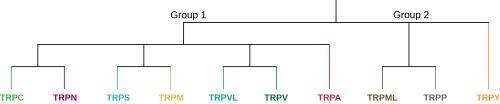
В суперсемействе TRP животных в настоящее время существует 9 предполагаемых семейств, разделенных на две группы, каждая из которых содержит несколько подсемейств. [2] Первая группа состоит из TRPC, TRPV, TRPVL, TRPA, TRPM, TRPS и TRPN, а вторая группа содержит TRPP и TRPML. Существует еще одно семейство, обозначенное TRPY, которое не всегда включается ни в одну из этих групп. Все эти подсемейства сходны в том, что они представляют собой молекулярно-чувствительные неселективные катионные каналы, имеющие шесть трансмембранных сегментов, однако каждое подсемейство уникально и имеет мало структурной гомологии друг с другом. Эта уникальность приводит к различным функциям сенсорного восприятия и регуляции, которые каналы TRP выполняют по всему телу. Первая и вторая группы различаются тем, что и TRPP, и TRPML второй группы имеют гораздо более длинную внеклеточную петлю между трансмембранными сегментами S1 и S2. Другая отличительная характеристика заключается в том, что все подсемейства первой группы содержат либо N-концевую внутриклеточную повторяющуюся последовательность анкирина, либо С-концевую последовательность домена TRP, либо и то, и другое, тогда как оба подсемейства второй группы не имеют ни того, ни другого. [8] Ниже приведены члены подсемейств и краткое описание каждого:
ФАРШИРОВАННЫЕ
[ редактировать ]| Семья | Подсемейство | Известные таксоны [9] [10] [11] |
|---|---|---|
| ФАРШИРОВАННЫЕ | ТРПА1 | Позвоночные животные , членистоногие и моллюски |
| TRPA-подобный | Хоанофлагелляты , книдарии , нематоды , членистоногие (только ракообразные и многоножки), моллюски и иглокожие. | |
| ТППА5 | Членистоногие (только ракообразные и насекомые) | |
| безболезненный | ||
| пирексия | ||
| водяная ведьма | ||
| HsTRPA | Специфично для перепончатокрылых насекомых. |
TRPA, что означает «анкирин», назван в честь большого количества повторов анкирина, обнаруженных вблизи N-конца. [12] TRPA в основном обнаруживается в афферентных ноцицептивных нервных волокнах и связан с усилением болевых сигналов, а также с гиперчувствительностью к холодовой боли. Было показано, что эти каналы являются одновременно механическими рецепторами боли и хемосенсорами, активируемыми различными химическими веществами, включая изотиоцианаты (едкие химические вещества в таких веществах, как горчичное масло и васаби), каннабиноиды, общие и местные анальгетики и коричный альдегид. [13]
Хотя TRPA1 экспрессируется у самых разных животных, за пределами позвоночных существует множество других каналов TRPA. TRPA5, безболезненный, пирексия и водяная ведьма представляют собой отдельные филогенетические ветви внутри клады TRPA, и доказано, что они экспрессируются только у ракообразных и насекомых. [8] в то время как HsTRPA возник как специфическое для Hymenoptera дублирование водяной ведьмы. [14] Подобно TRPA1 и другим каналам TRP, они функционируют как ионные каналы в ряде сенсорных систем. TRPA- или TRPA1-подобные каналы также существуют у многих видов как филогенетически отдельная клада, но они менее изучены. [10]
ТРПК
[ редактировать ]| Семья | Подсемейство | Известные таксоны [11] [15] [16] |
|---|---|---|
| ТРПК | ТРПК1 | Позвоночные животные |
| ТРПК2 | ||
| ТРПК3 | ||
| ТРПК4 | ||
| ТРПК5 | ||
| ТРПК6 | ||
| ТРПК7 | ||
| ГТО | Членистоногие | |
| ТРПгамма | ||
| ТРПЛ | ||
| Неизвестный | Хоанофлагелляты, книдарии, ксенацеломорфы , лофотрохозойи и нематоды. |
TRPC, C означает «канонический», назван так потому, что он наиболее тесно связан с TRP дрозофилы, тезкой каналов TRP. Филогения каналов TRPC детально не выяснена, но они присутствуют во всех таксонах животных. На самом деле у людей экспрессируется только шесть каналов TRPC, поскольку обнаружено, что TRPC2 экспрессируется исключительно у мышей и считается псевдогеном у людей ; Частично это связано с ролью TRPC2 в обнаружении феромонов, способность которых у мышей повышена по сравнению с людьми. Мутации в каналах TRPC связаны с респираторными заболеваниями наряду с фокальным сегментарным гломерулосклерозом почек. [13] Все каналы TRPC активируются либо фосфолипазой C (PLC), либо диацилглицерином (DAG).
ТРПМЛ
[ редактировать ]| Семья | Подсемейство | Известные таксоны [11] [17] |
|---|---|---|
| ТРПМЛ | Неизвестный | Книдарии, базальные позвоночные, оболочники , головохордовые , полухордовые , иглокожие, членистоногие и нематоды. |
| ТРМЛ1 | Специфично для челюстных позвоночных. | |
| ТРМЛ2 | ||
| ТРМЛ3 |
TRPML, ML от «муколипин», получил свое название от муколипидоза IV , связанного с нарушением развития нервной системы . Муколипидоз IV был впервые обнаружен в 1974 году Э. Р. Берманом, который заметил аномалии в глазах младенца. [18] Эти аномалии вскоре стали ассоциироваться с мутациями гена MCOLN1, который кодирует ионный канал TRPML1. TRPML до сих пор недостаточно охарактеризован. Три известные копии позвоночных ограничены челюстными позвоночными, за некоторыми исключениями (например, Xenopus тропический ). [17]
ТРПМ
[ редактировать ]| Семья | Подсемейство | Известные таксоны |
|---|---|---|
| ТРПМ | Альфа/α (включая TRPM1, 3, 6 и 7) | Все хоанофлагелляты и эуметазоа (кроме тихоходок ). |
| Бета/β (включая TRPM2, 4, 5 и 8) |
TRPM, М для «меластатина», был обнаружен во время сравнительного генетического анализа доброкачественных невусов и злокачественных невусов (меланомы). [12] Мутации в каналах TRPM были связаны с гипомагниемией и вторичной гипокальциемией. Каналы TRPM также стали известны своими механизмами холодного зондирования, как в случае с TRPM8. [13] Сравнительные исследования показали, что функциональные домены и критические аминокислоты каналов TRPM высоко консервативны у разных видов. [19] [10] [20]
Филогенетика показала, что каналы TRPM разделены на две основные клады: αTRPM и βTRPM. [10] [16] αTRPM включают, среди прочего, TRPM1, TRPM3 позвоночных и «ханзимы» TRPM6 и TRPM7, а также единственный канал TRPM насекомых. βTRPM включают, помимо прочего, TRPM2, TRPM4, TRPM5 и TRPM8 позвоночных (сенсор холода и ментола). Описаны еще две основные клады: TRPMc, которая присутствует только у различных членистоногих, [16] и базальная клада, [11] [10] которое с тех пор было предложено выделить в отдельное семейство каналов TRP (TRPS). [16]
ТРПН
[ редактировать ]| Семья | Подсемейство | Известные таксоны [21] [11] |
|---|---|---|
| ТРПН | ТРПН/номпК | Плакозойные, книдарии, нематоды, членистоногие, моллюски, кольчатые черви и позвоночные (исключая амниоты) |
TRPN был первоначально описан у Drosophila melanogaster и Caenorhabditis elegans как nompC, механически управляемый ионный канал. [22] [21] Известно, что только один TRPN, N, что означает «отсутствие механорецепторного потенциала C» или «nompC», широко экспрессируется у животных (хотя у некоторых книдарий их больше) и, в частности, является только псевдогеном у амниотных позвоночных . [21] [11] Несмотря на то, что TRPA назван в честь анкириновых повторов, считается, что каналы TRPN содержат больше всех каналов TRP, обычно около 28, которые высоко консервативны среди таксонов. [21] С момента своего открытия Drosophila nompC участвует в механочувствительности (включая механическую стимуляцию кутикулы и обнаружение звука) и холодовой ноцицепции . [23]
ТРПП
[ редактировать ]| Семья | Подсемейство [11] [24] [25] [2] | Известные таксоны [26] [25] |
|---|---|---|
| ТРПП | PKD1-подобный | Животные (кроме членистоногих) |
| PKD2-подобный | Животные | |
| Бривидос | Насекомые |
TRPP , P от «полицистин», назван в честь поликистозной болезни почек , связанной с этими каналами. [12] Эти каналы также называются ионными каналами ПКД (поликистозная болезнь почек).
PKD2-подобные гены (примеры включают TRPP2 , TRPP3 и TRPP5 ) кодируют канонические каналы TRP. PKD1-подобные гены кодируют гораздо более крупные белки с 11 трансмембранными сегментами, которые не обладают всеми особенностями других каналов TRP. Однако 6 трансмембранных сегментов PKD1-подобных белков имеют значительную гомологию последовательностей с каналами TRP, что указывает на то, что они, возможно, просто сильно отличались от других близкородственных белков. [26]
У насекомых есть третье подсемейство TRPP, называемое brividos, которое участвует в ощущении холода. [25] [2]
ТРПС
[ редактировать ]TRPS, S от Soromelastatin, был назван так как он образует сестринскую группу TRPM. TRPS широко присутствует у животных, но особенно отсутствует у позвоночных и насекомых (среди прочих). [16] Функционально TRPS еще недостаточно хорошо описан, хотя известно, что TRPS C. elegans , известный как CED-11, представляет собой кальциевый канал, который участвует в апоптозе . [27]
ТРПВ
[ редактировать ]| Семья | Подсемейство | Известные таксоны [11] [28] |
|---|---|---|
| ТРПВ | Наньчун | Плакозойные , книдарии, нематоды, кольчатые черви, моллюски и членистоногие (возможно, исключая паукообразных ) |
| Неактивный | ||
| ТРПВ1 | Специфично для позвоночных | |
| ТРПВ2 | ||
| ТРПВ3 | ||
| ТРПВ4 | ||
| ТРПВ5 | ||
| ТРПВ6 |
TRPV, V означает «ваниллоид», первоначально был обнаружен у Caenorhabditis elegans и назван в честь ваниллоидных химических веществ, которые активируют некоторые из этих каналов. [24] [29] Эти каналы прославились благодаря своей связи с такими молекулами, как капсаицин (агонист TRPV1). [13] Помимо шести известных паралогов позвоночных, за пределами детеростомов известны две основные клады: nanchung и Iav. Механистические исследования этих последних клад в основном ограничивались Drosophila , но филогенетический анализ выявил в них ряд других генов Placozoa, Annelida, Cnidaria, Mollusca и других членистоногих. [11] [30] [31] Каналы TRPV также были описаны у простейших. [11]
ТРПВЛ
[ редактировать ]Было предложено, что TRPVL является сестринской кладой TRPV и ограничена книдариями Nematostella vectensis и Hydra magnipapillata , а также кольчатыми червями Capitella teleta . [11] Об этих каналах мало что известно.
ТРПИ
[ редактировать ]TRPY, Y от «дрожжи», высоко локализован в дрожжевой вакуоли, которая является функциональным эквивалентом лизосомы в клетке млекопитающих, и действует как механосенсор вакуольного осмотического давления. Методы патч-клампа и гиперосмотическая стимуляция продемонстрировали, что TRPY играет роль во внутриклеточном высвобождении кальция. [32] Филогенетический анализ показал, что TRPY1 не входит в состав первой и второй групп TRP других многоклеточных животных и, как предполагается, развился после расхождения многоклеточных животных и грибов. [8] Другие указали, что TRPY более тесно связан с TRPP. [33]
Структура
[ редактировать ]Каналы TRP состоят из 6 трансмембранных спиралей (S1-S6) с внутриклеточными N- и C-концами . Каналы TRP млекопитающих активируются и регулируются широким спектром стимулов, включая множество посттранскрипционных механизмов, таких как фосфорилирование , связывание рецептора G-белка , лиганд-гейтирование и убиквитинирование . Рецепторы обнаружены почти во всех типах клеток и в основном локализованы в мембранах клеток и органелл, модулируя вход ионов.
Большинство каналов TRP образуют гомо- или гетеротетрамеры, когда они полностью функциональны. Фильтр ионной селективности, пора, образован сложной комбинацией p-петлей тетрамерного белка, которые расположены во внеклеточном домене между трансмембранными сегментами S5 и S6. Как и большинство катионных каналов, каналы TRP имеют отрицательно заряженные остатки внутри пор, которые привлекают положительно заряженные ионы. [34]
Группа 1 Характеристики
[ редактировать ]Каждый канал в этой группе структурно уникален, что увеличивает разнообразие функций, которыми обладают каналы TRP, однако есть некоторые общие черты, отличающие эту группу от других. Начиная с внутриклеточного N-конца, существуют повторы анкриина различной длины (за исключением TRPM), которые способствуют закреплению на мембране и другим белковым взаимодействиям. Вскоре после S6 на С-конце находится высококонсервативный домен TRP (за исключением TRPA), который участвует в стробирующей модуляции и мультимеризации каналов. В этой группе также наблюдались другие С-концевые модификации, такие как домены альфа-киназы в TRPM7 и M8. [8] [13] [12]
Группа 2 Характеристики
[ редактировать ]Наиболее отличительной чертой второй группы является длинный внеклеточный промежуток между трансмембранными сегментами S1 и S2. У членов второй группы также отсутствуют повторы анкриина и домен TRP. Однако было показано, что они имеют удерживающие последовательности эндоплазматического ретикулума (ЭР) ближе к С-концу, что иллюстрирует возможные взаимодействия с ЭР. [8] [13] [12]
Функция
[ редактировать ]Каналы TRP модулируют движущие силы входа ионов и Ca 2+ и мг 2+ транспортные машины в плазматической мембране, где их большинство. TRPs имеют важные взаимодействия с другими белками и часто образуют сигнальные комплексы, точные пути которых неизвестны. [35] TRP-каналы были первоначально обнаружены у trp -мутантного штамма плодовой мухи Drosophila. [36] которые демонстрировали временное повышение потенциала в ответ на световые стимулы и были так называемыми каналами транзиторного рецепторного потенциала . [37] Каналы TRPML функционируют как каналы высвобождения внутриклеточного кальция и, таким образом, играют важную роль в регуляции органелл. [35] Важно отметить, что многие из этих каналов передают различные ощущения, такие как ощущения боли, температуры, различные виды вкуса, давления и зрения. Считается, что в организме некоторые каналы TRP ведут себя как микроскопические термометры и используются животными для определения тепла или холода. TRPs действуют как датчики осмотического давления , объема , растяжения и вибрации . Было замечено, что TRP играют сложную многомерную роль в сенсорной передаче сигналов. Многие TRP функционируют как каналы внутриклеточного высвобождения кальция.
Болевые и температурные ощущения
[ редактировать ]Ионные каналы TRP преобразуют энергию в потенциалы действия в соматосенсорных ноцицепторах. [38] Каналы Thermo-TRP имеют С-концевой домен, отвечающий за термочувствительность , и имеют специфическую взаимозаменяемую область, которая позволяет им воспринимать температурные стимулы, связанные с регуляторными процессами лигандов. [39] Хотя большинство каналов TRP модулируются изменениями температуры, некоторые из них играют решающую роль в ощущении температуры. Существует как минимум 6 различных каналов Thermo-TRP, каждый из которых играет свою роль. Например, TRPM8 связан с механизмами восприятия холода, TRPV1 и TRPM3 способствуют ощущениям тепла и воспаления, а TRPA1 облегчает работу многих сигнальных путей, таких как сенсорная трансдукция, ноцицепция , воспаление и окислительный стресс . [38]
Вкус
[ редактировать ]TRPM5 участвует в передаче сигналов о сладком , горьком вкусе и вкусе умами путем модуляции сигнального пути в клетках вкусовых рецепторов II типа . [40] TRPM5 активируется сладкими гликозидами, содержащимися в растении стевия .
Несколько других каналов TRP играют значительную роль в хемочувствительности через сенсорные нервные окончания во рту, независимые от вкусовых рецепторов. TRPA1 реагирует на горчичное масло ( аллилизотиоцианат ), васаби и корицу, TRPA1 и TRPV1 реагирует на чеснок ( аллицин ), TRPV1 реагирует на перец чили ( капсаицин ), TRPM8 активируется ментолом , камфорой , мятой и охлаждающими веществами; TRPV2 активируется молекулами ( THC , CBD и CBN ), содержащимися в марихуане.
TRP-подобные каналы в зрении насекомых
[ редактировать ]
trp - мутантные плодовые мухи, у которых отсутствует функциональная копия гена trp, характеризуются временной реакцией на свет, в отличие от мух дикого типа, которые демонстрируют устойчивую активность фоторецепторных клеток в ответ на свет. [36] Отдалённо родственная изоформа канала TRP, TRP-подобный канал (TRPL), позже была идентифицирована в фоторецепторах дрозофилы , где она экспрессируется примерно в 10–20 раз более низких уровнях, чем белок TRP. Впоследствии была выделена муха-мутант trpl . Помимо структурных различий, каналы TRP и TRPL различаются катионной проницаемостью и фармакологическими свойствами.
Каналы TRP/TRPL несут исключительную ответственность за деполяризацию плазматической мембраны фоторецепторов насекомых в ответ на свет. Когда эти каналы открываются, они позволяют натрию и кальцию проникать в клетку по градиенту концентрации, что деполяризует мембрану. Вариации интенсивности света влияют на общее количество открытых каналов TRP/TRPL и, следовательно, на степень деполяризации мембраны. Эти градуированные напряжения распространяются на синапсы сетчатки второго порядка фоторецепторов с нейронами и далее в мозг.
Важно отметить, что механизм фоторецепции насекомых резко отличается от такового у млекопитающих. Возбуждение родопсина в фоторецепторах млекопитающих приводит к гиперполяризации рецепторной мембраны, а не к деполяризации, как в глазу насекомого. У дрозофилы и, предположительно, у других насекомых сигнальный каскад, опосредованный фосфолипазой C (PLC), связывает фотовозбуждение родопсина с открытием каналов TRP/TRPL. Хотя многочисленные активаторы этих каналов, такие как фосфатидилинозитол-4,5-бисфосфат (PIP 2 ) и полиненасыщенные жирные кислоты (PUFAs), были известны в течение многих лет, ключевой фактор, опосредующий химическое соединение между PLC и каналами TRP/TRPL, до недавнего времени оставался загадкой. Было обнаружено, что расщепление липидного продукта каскада PLC, диацилглицерина (DAG), под действием фермента диацилглицеринлипазы приводит к образованию ПНЖК, которые могут активировать каналы TRP, тем самым инициируя деполяризацию мембраны в ответ на свет. [41] Этот механизм активации каналов TRP может хорошо сохраняться среди других типов клеток, где эти каналы выполняют различные функции.
Клиническое значение
[ редактировать ]Мутации в TRP связаны с нейродегенеративными заболеваниями, скелетной дисплазией , заболеваниями почек, [35] и может играть важную роль в развитии рака. TRP могут стать важными терапевтическими целями. Роль TRPV1, TRPV2, TRPV3 и TRPM8 как терморецепторов, а также роль TRPV4 и TRPA1 как механорецепторов имеет значительное клиническое значение; Уменьшение хронической боли может быть возможным путем воздействия на ионные каналы, участвующие в термических, химических и механических ощущениях, чтобы снизить их чувствительность к раздражителям. [42] Например, использование агонистов TRPV1 потенциально может ингибировать ноцицепцию TRPV1, особенно в ткани поджелудочной железы, где TRPV1 высоко экспрессируется. [43] Агонист TRPV1 капсаицин, обнаруженный в перце чили, показан для облегчения нейропатической боли. [35] Агонисты TRPV1 ингибируют ноцицепцию TRPV1.
Роль в раке
[ редактировать ]Изменение экспрессии белков TRP часто приводит к онкогенезу , как сообщалось для TRPV1, TRPV6, TRPC1, TRPC6, TRPM4, TRPM5 и TRPM8. [43] TRPV1 и TRPV2 вовлечены в развитие рака молочной железы. Экспрессия TRPV1 в агрегатах, обнаруженных в эндоплазматическом ретикулуме или аппарате Гольджи и/или окружающих эти структуры у пациентов с раком молочной железы, приводит к худшей выживаемости. [44]
Семейство ионных каналов TRPM особенно связано с раком простаты, где TRPM2 (и его длинная некодирующая РНК TRPM2-AS ), TRPM4 и TRPM8 сверхэкспрессируются при раке простаты, что связано с более агрессивными исходами. [45] Было показано, что TRPM3 способствует росту и аутофагии при светлоклеточной почечно-клеточной карциноме. [46] TRPM4 сверхэкспрессируется при диффузной крупноклеточной В-клеточной лимфоме, что связано с более низкой выживаемостью. [47] в то время как TRPM5 обладает онкогенными свойствами при меланоме . [48]
Каналы TRP занимают центральное место в модуляции резистентности к химиотерапии при раке молочной железы. [49] Некоторые каналы TRP, такие как TRPA1 и TRPC5, тесно связаны с лекарственной устойчивостью во время лечения рака; TRPC5-опосредованный высокий уровень кальция 2+ приток активирует фактор транскрипции NFATC3 (ядерный фактор активированных Т-клеток, цитоплазматический 3), который запускает транскрипцию p-гликопротеина (p-gp). Сверхэкспрессия p-gp широко признана основным фактором химиорезистентности раковых клеток, поскольку он действует как активный эффлюксный насос, который может удалять различные чужеродные вещества, включая химиотерапевтические агенты, изнутри клетки. [49]

- Сверхэкспрессия TRPC5 активирует фактор транскрипции NFATC3 Ca. 2+ сигнальный путь, приводящий к сверхэкспрессии p-gp. Более того, сверхэкспрессированный p-gp выводит химиотерапевтические препараты, такие как доксорубицин, вызывая химиорезистентность.
- Химиорезистентные клетки рака молочной железы, сверхэкспрессирующие единицы канала передачи TRPC5, к химиочувствительным клеткам-реципиентам через внеклеточные везикулы (EV), что приводит к развитию TRPC5-опосредованной химиорезистентности в этих клетках. [49]
Напротив, было продемонстрировано, что другие каналы TRP, такие как TRPV1 и TRPV2, усиливают противоопухолевые эффекты некоторых химиотерапевтических агентов, а TRPV2 является потенциальным биомаркером и терапевтической мишенью при тройном негативном раке молочной железы. [49]
Роль в воспалительных реакциях
[ редактировать ]В дополнение к путям, опосредованным TLR4 , некоторые члены семейства ионных каналов временного рецепторного потенциала распознают LPS . LPS-опосредованная активация TRPA1 была показана на мышах [50] и Drosophila melanogaster . мухи [51] В более высоких концентрациях ЛПС активирует и других членов семейства сенсорных каналов TRP, таких как TRPV1, TRPM3 и в некоторой степени TRPM8. [52] ЛПС распознается TRPV4 на эпителиальных клетках. Активация TRPV4 с помощью ЛПС была необходима и достаточна для индукции продукции оксида азота с бактерицидным эффектом. [53]
История дрозофилы каналов TRP
[ редактировать ]Первоначальный TRP-мутант у дрозофилы был впервые описан Козенсом и Мэннингом в 1969 году как «мутантный штамм D. melanogaster , который, хотя и ведет себя фототаксически положительно в Т-образном лабиринте при слабом окружающем освещении, имеет нарушения зрения и ведет себя как слепой». . Он также показал аномальную электроретинограммы реакцию фоторецепторов на свет, которая была преходящей, а не постоянной, как у «дикого типа». [36] Впоследствии его исследовал Барух Минке, постдоктор из группы Уильяма Пака, и назвал его TRP в соответствии с его поведением в ERG. [54] Идентичность мутировавшего белка была неизвестна до тех пор, пока он не был клонирован Крейгом Монтеллом, научным сотрудником исследовательской группы Джеральда Рубина, в 1989 году, который отметил его предсказанную структурную связь с известными в то время каналами. [37] и Роджер Харди и Барух Минке, которые в 1992 году представили доказательства того, что это ионный канал, который открывается в ответ на световую стимуляцию. [55] Канал TRPL был клонирован и охарактеризован в 1992 году исследовательской группой Леонарда Келли. [56] В 2013 году Монтелл и его исследовательская группа обнаружили, что катионный канал TRPL (TRP-подобный) является прямой мишенью для вкусовых веществ в нейронах вкусовых рецепторов и может быть обратимо подавлен. [57]
См. также
[ редактировать ]- Эндоканнабиноидная система
- База данных белков, взаимодействующих с каналами временных рецепторов (2010)
Ссылки
[ редактировать ]- ^ Ислам М.С., изд. (январь 2011 г.). Потенциальные каналы временных рецепторов . Достижения экспериментальной медицины и биологии. Том. 704. Берлин: Шпрингер. п. 700. ИСБН 978-94-007-0264-6 .
- ^ Перейти обратно: а б с д и Химмель, Нью-Джерси, Кокс, Д.Н. (август 2020 г.). «Потенциальные каналы временных рецепторов: современные взгляды на эволюцию, структуру, функции и номенклатуру» . Слушания. Биологические науки . 287 (1933): 20201309. doi : 10.1098/rspb.2020.1309 . ПМЦ 7482286 . ПМИД 32842926 .
- ^ Ариас-Даррас Л., Кабесас Д., Коленсо К.К., Алегрия-Аркос М., Браво-Морага Ф., Варас-Конча I и др. (январь 2015 г.). «Ионный канал временного рецепторного потенциала у Chlamydomonas имеет общие ключевые характеристики с TRP-каналами, связанными с сенсорной трансдукцией, у млекопитающих» . Растительная клетка . 27 (1): 177–88. дои : 10.1105/tpc.114.131862 . ПМЦ 4330573 . ПМИД 25595824 .
- ^ Линдстрем Дж.Б., Пирс Н.Т., Латц М.И. (октябрь 2017 г.). «Роль каналов TRP в механотрансдукции динофлагеллят». Биологический вестник . 233 (2): 151–167. дои : 10.1086/695421 . ПМИД 29373067 . S2CID 3388001 .
- ^ Вриенс Дж., Нилиус Б., Воетс Т. (сентябрь 2014 г.). «Периферическая термочувствительность у млекопитающих» . Обзоры природы. Нейронаука . 15 (9): 573–89. дои : 10.1038/nrn3784 . ПМИД 25053448 . S2CID 27149948 .
- ^ Робинсон К.В., Рохакс Т., Хансен С.Б. (сентябрь 2019 г.). «Инструменты для понимания наномасштабной липидной регуляции ионных каналов» . Тенденции биохимических наук . 44 (9): 795–806. дои : 10.1016/j.tibs.2019.04.001 . ПМК 6729126 . ПМИД 31060927 .
- ^ Хансен С.Б. (май 2015 г.). «Липидный агонизм: парадигма PIP2 лиганд-управляемых ионных каналов» . Biochimica et Biophysical Acta (BBA) - Молекулярная и клеточная биология липидов . 1851 (5): 620–8. дои : 10.1016/j.bbalip.2015.01.011 . ПМК 4540326 . ПМИД 25633344 .
- ^ Перейти обратно: а б с д и Кадоваки Т. (октябрь 2015 г.). «Эволюционная динамика каналов TRP многоклеточных». Архив Пфлюгерса . 467 (10): 2043–53. дои : 10.1007/s00424-015-1705-5 . ПМИД 25823501 . S2CID 9190224 .
- ^ Канг К., Пулвер С.Р., Панзано В.К., Чанг Э.К., Гриффит Л.К., Теобальд Д.Л., Гаррити П.А. (март 2010 г.). «Анализ TRPA1 дрозофилы показывает древнее происхождение химической ноцицепции человека» . Природа . 464 (7288): 597–600. Бибкод : 2010Natur.464..597K . дои : 10.1038/nature08848 . ПМЦ 2845738 . ПМИД 20237474 .
- ^ Перейти обратно: а б с д и Химмель, Нью-Джерси, Летчер Дж. М., Сакурай А., Грей Т. Р., Бенсон М. Н., Кокс Д. Н. (ноябрь 2019 г.). « Чувствительность дрозофилы к ментолу и докембрийское происхождение временной хемочувствительности, зависимой от потенциала рецептора» . Философские труды Лондонского королевского общества. Серия Б, Биологические науки . 374 (1785): 20190369. doi : 10.1098/rstb.2019.0369 . ПМК 6790378 . ПМИД 31544603 .
- ^ Перейти обратно: а б с д и ж г час я дж к Пэн Г., Ши Икс, Кадоваки Т. (март 2015 г.). «Эволюция каналов TRP, выведенная на основе их классификации у различных видов животных». Молекулярная филогенетика и эволюция . 84 : 145–57. Бибкод : 2015МОЛПЭ..84..145П . дои : 10.1016/j.ympev.2014.06.016 . ПМИД 24981559 .
- ^ Перейти обратно: а б с д и Моран М.М., МакАлександер М.А., Биро Т., Салласи А. (август 2011 г.). «Переходные рецепторные потенциальные каналы как терапевтические мишени». Обзоры природы. Открытие наркотиков . 10 (8): 601–20. дои : 10.1038/nrd3456 . ПМИД 21804597 . S2CID 8809131 .
- ^ Перейти обратно: а б с д и ж Салласи А (9 апреля 2015 г.). Каналы TRP как терапевтические цели: от фундаментальной науки до клинического применения . Салласи, Арпад, 1958-, Макалександер, М. Аллен. Амстердам [Нидерланды]. ISBN 9780124200791 . OCLC 912315205 .
{{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка ) - ^ Коно К., Сокабе Т., Томинага М., Кадоваки Т. (сентябрь 2010 г.). «Термический/химический датчик медоносной пчелы, AmHsTRPA, выявляет неофункционализацию и потерю генов временных рецепторных потенциальных каналов» . Журнал неврологии . 30 (37): 12219–29. doi : 10.1523/JNEUROSCI.2001-10.2010 . ПМЦ 6633439 . ПМИД 20844118 .
- ^ Френч А.С., Мейснер С., Лю Х., Векстрем М., Торккели П.Х. (2015). «Анализ транскриптома и РНК-интерференция фототрансдукции таракана указывают на три опсина и предполагают важную роль каналов TRPL» . Границы в физиологии . 6 : 207. doi : 10.3389/fphys.2015.00207 . ПМК 4513288 . ПМИД 26257659 .
- ^ Перейти обратно: а б с д и Химмель, Нью-Джерси, Грей, Т.Р., Кокс, Д.Н. (июль 2020 г.). «Филогенетика идентифицирует две клады TRPM эвметазойцев и восьмое семейство TRP, TRP соромеластатин (TRPS)» . Молекулярная биология и эволюция . 37 (7): 2034–2044. дои : 10.1093/molbev/msaa065 . ПМК 7306681 . ПМИД 32159767 .
- ^ Перейти обратно: а б Гарсиа-Аньоверос Дж., Виватпанит Т. (2014). «TRPML2 и эволюция муколипина». Катионные каналы переходного рецепторного потенциала млекопитающих (TRP) . Справочник по экспериментальной фармакологии. Том. 222. стр. 647–58. дои : 10.1007/978-3-642-54215-2_25 . ISBN 978-3-642-54214-5 . ПМИД 24756724 .
- ^ Берман Э.Р., Ливни Н., Шапира Э., Мерин С., Левий И.С. (апрель 1974 г.). «Врожденное помутнение роговицы с аномальными системными запасающими тельцами: новый вариант муколипидоза». Журнал педиатрии . 84 (4): 519–26. дои : 10.1016/s0022-3476(74)80671-2 . ПМИД 4365943 .
- ^ Медерос-и-Шницлер М., Веринг Дж., Гудерманн Т., Чубанов В. (май 2008 г.). «Эволюционные детерминанты различной кальциевой селективности каналов TRPM» . Журнал ФАСЭБ . 22 (5): 1540–51. дои : 10.1096/fj.07-9694com . ПМИД 18073331 . S2CID 25474094 .
- ^ Иорданов И., Тот Б., Соллоши А., Чанади Л. (апрель 2019 г.). «Ферментативная активность и стабильность селективного фильтра древних каналов TRPM2 были одновременно потеряны у ранних позвоночных» . электронная жизнь . 8 . doi : 10.7554/eLife.44556 . ПМК 6461439 . ПМИД 30938679 .
- ^ Перейти обратно: а б с д Шулер А., Шмитц Г., Рефт А., Озбек С., Турм У., Борнберг-Бауэр Э. (июнь 2015 г.). «Взлет и падение TRP-N, древнего семейства механизированных ионных каналов в Metazoa» . Геномная биология и эволюция . 7 (6): 1713–27. дои : 10.1093/gbe/evv091 . ПМК 4494053 . ПМИД 26100409 .
- ^ Уокер Р.Г., Уиллингем А.Т., Цукер К.С. (март 2000 г.). «Канал механосенсорной трансдукции дрозофилы». Наука . 287 (5461): 2229–34. Бибкод : 2000Sci...287.2229W . дои : 10.1126/science.287.5461.2229 . ПМИД 10744543 .
- ^ Химмель Н., Патель А., Кокс Д. (март 2017 г.). «Ноцицепция беспозвоночных». Оксфордская исследовательская энциклопедия нейробиологии . doi : 10.1093/acrefore/9780190264086.013.166 . ISBN 9780190264086 .
- ^ Перейти обратно: а б Монтелл С. (июль 2001 г.). «Физиология, филогения и функции суперсемейства катионных каналов TRP». СТКЭ науки . 2001 (90): re1. дои : 10.1126/stke.2001.90.re1 . ПМИД 11752662 . S2CID 37074808 .
- ^ Перейти обратно: а б с Галлио М., Офстад Т.А., Макферсон Л.Дж., Ван Дж.В., Цукер К.С. (февраль 2011 г.). «Кодирование температуры в мозгу дрозофилы» . Клетка . 144 (4): 614–24. дои : 10.1016/j.cell.2011.01.028 . ПМЦ 3336488 . ПМИД 21335241 .
- ^ Перейти обратно: а б Безарес-Кальдерон Л.А., Бергер Дж., Ясек С., Верасто С., Мендес С., Гуманн М. и др. (декабрь 2018 г.). «Нейронная схема гидродинамической реакции испуга, опосредованной полицистином, для избегания хищников» . электронная жизнь . 7 . дои : 10.7554/eLife.36262 . ПМК 6294549 . ПМИД 30547885 .
- ^ Дрисколл К., Стэнфилд GM, Дросте Р., Хорвиц HR (август 2017 г.). «Предположительный канал TRP CED-11 способствует уменьшению объема клеток и облегчает деградацию апоптотических клеток у Caenorhabditis elegans » . Труды Национальной академии наук Соединенных Штатов Америки . 114 (33): 8806–8811. Бибкод : 2017PNAS..114.8806D . дои : 10.1073/pnas.1705084114 . ПМЦ 5565440 . ПМИД 28760991 .
- ^ Каттанео А.М., Бенгтссон Дж.М., Монтанье Н., Жакин-Жоли Э., Рота-Стабелли О., Сальванин У. и др. (2016). «TRPA5, канал TRP насекомых подсемейства анкиринов, экспрессируется в антеннах Cydia pomonella (Lepidoptera: Tortricidae) в множественных вариантах сплайсинга» . Журнал науки о насекомых . 16 (1): 83. дои : 10.1093/jisesa/iew072 . ПМК 5026476 . ПМИД 27638948 .
- ^ Колберт Х.А., Смит Т.Л., Баргманн К.И. (ноябрь 1997 г.). «OSM-9, новый белок со структурным сходством с каналами, необходим для обоняния, механочувствительности и обонятельной адаптации у Caenorhabditis elegans» . Журнал неврологии . 17 (21): 8259–69. doi : 10.1523/JNEUROSCI.17-21-08259.1997 . ПМК 6573730 . ПМИД 9334401 .
- ^ Гонг З., Сон В., Чунг Ю.Д., Ким Дж., Шин Д.В., МакКлунг К.А. и др. (октябрь 2004 г.). «Две взаимозависимые субъединицы канала TRPV, неактивный и Наньчунг, опосредуют слух у дрозофилы» . Журнал неврологии . 24 (41): 9059–66. doi : 10.1523/JNEUROSCI.1645-04.2004 . ПМК 6730075 . ПМИД 15483124 .
- ^ Ким Дж., Чунг Ю.Д., Пак Д.Ю., Чой С., Шин Д.В., Со Х. и др. (июль 2003 г.). «Ионный канал семейства TRPV, необходимый для слуха у дрозофилы». Природа . 424 (6944): 81–4. Бибкод : 2003Natur.424...81K . дои : 10.1038/nature01733 . ПМИД 12819662 . S2CID 4426696 .
- ^ Донг XP, Ван X, Сюй Х (апрель 2010 г.). «TRP-каналы внутриклеточных мембран» . Журнал нейрохимии . 113 (2): 313–28. дои : 10.1111/j.1471-4159.2010.06626.x . ПМЦ 2905631 . ПМИД 20132470 .
- ^ Паловчак Э., Делемотт Л., Кляйн М.Л., Карневале В. (июль 2015 г.). «Сравнительный анализ последовательностей предполагает консервативный механизм стробирования для каналов TRP» . Журнал общей физиологии . 146 (1): 37–50. дои : 10.1085/jgp.201411329 . ПМК 4485022 . ПМИД 26078053 .
- ^ Хилле Б (2001). Ионные каналы возбудимых мембран (3-е изд.). Сандерленд, Массачусетс: Синауэр. ISBN 978-0878933211 . OCLC 46858498 .
- ^ Перейти обратно: а б с д Уинстон К.Р., Лутц В. (март 1988 г.). «Линейный ускоритель как нейрохирургический инструмент стереотаксической радиохирургии». Нейрохирургия . 22 (3): 454–64. дои : 10.1097/00006123-198803000-00002 . ПМИД 3129667 .
- ^ Перейти обратно: а б с Диджей Косенс, Мэннинг А. (октябрь 1969 г.). «Аномальная электроретинограмма мутанта дрозофилы». Природа . 224 (5216): 285–7. Бибкод : 1969Natur.224..285C . дои : 10.1038/224285a0 . ПМИД 5344615 . S2CID 4200329 .
- ^ Перейти обратно: а б Монтелл С., Рубин ГМ (апрель 1989 г.). «Молекулярная характеристика локуса trp дрозофилы: предполагаемый интегральный мембранный белок, необходимый для фототрансдукции». Нейрон . 2 (4): 1313–23. дои : 10.1016/0896-6273(89)90069-x . ПМИД 2516726 . S2CID 8908180 .
- ^ Перейти обратно: а б Экклс Р. (1989). «Физиология носа и заболевания при астме». Агенты и действия. Дополнения . 28 : 249–61. ПМИД 2683630 .
- ^ Браучи С., Орта Г., Салазар М., Розенманн Э., Латорре Р. (май 2006 г.). «Рецептор холода, чувствительный к горячему: С-концевой домен определяет термочувствительность в потенциальных каналах переходного рецептора» . Журнал неврологии . 26 (18): 4835–40. doi : 10.1523/JNEUROSCI.5080-05.2006 . ПМК 6674176 . ПМИД 16672657 .
- ^ Филиппаерт К., Пиронет А., Месуере М., Сонес В., Вермейрен Л., Керселерс С. и др. (март 2017 г.). «Стевиолгликозиды улучшают функцию бета-клеток поджелудочной железы и вкусовые ощущения за счет усиления активности канала TRPM5» . Природные коммуникации . 8 : 14733. Бибкод : 2017NatCo...814733P . дои : 10.1038/ncomms14733 . ПМК 5380970 . ПМИД 28361903 .
- ^ Люнг Х.Т., Ценг-Кранк Дж., Ким Э., Махапатра С., Шино С., Чжоу Ю. и др. (июнь 2008 г.). «Активность DAG-липазы необходима для регуляции каналов TRP в фоторецепторах дрозофилы» . Нейрон . 58 (6): 884–96. дои : 10.1016/j.neuron.2008.05.001 . ПМЦ 2459341 . ПМИД 18579079 .
- ^ Левин Дж. Д., Алессандри-Хабер Н. (август 2007 г.). «Каналы ГТО: мишени для облегчения боли» . Biochimica et Biophysica Acta (BBA) - Молекулярные основы болезней . 1772 (8): 989–1003. дои : 10.1016/j.bbadis.2007.01.008 . ПМИД 17321113 .
- ^ Перейти обратно: а б Преварская Н., Чжан Л., Барритт Дж. (август 2007 г.). «Каналы TRP при раке» . Biochimica et Biophysica Acta (BBA) - Молекулярные основы болезней . 1772 (8): 937–46. дои : 10.1016/j.bbadis.2007.05.006 . ПМИД 17616360 .
- ^ Лосано С., Кордова С., Маршан И., Суньига Р., Охова П., Рамирес-Баррантес Р. и др. (15 октября 2018 г.). «Внутриклеточный агрегированный TRPV1 связан с более низкой выживаемостью у пациентов с раком молочной железы» . Рак молочной железы: цели и терапия . 10 : 161–168. дои : 10.2147/BCTT.S170208 . ПМК 6197232 . ПМИД 30410392 .
- ^ Вонг К.К., Банхам А.Х., Яакоб Н.С., Нур Хусна С.М. (февраль 2019 г.). «Онкогенная роль ионных каналов TRPM при раке» . Журнал клеточной физиологии . 234 (9): 14556–14573. дои : 10.1002/jcp.28168 . ПМИД 30710353 . S2CID 73432591 .
- ^ Холл Д.П., Кост Н.Г., Хегде С., Келлнер Е., Михайлова О., Страттон Ю. и др. (ноябрь 2014 г.). «TRPM3 и миР-204 создают регуляторную цепь, которая контролирует онкогенную аутофагию при светлоклеточной почечно-клеточной карциноме» . Раковая клетка . 26 (5): 738–53. дои : 10.1016/j.ccell.2014.09.015 . ПМК 4269832 . ПМИД 25517751 .
- ^ Лоо С.К., Чнг Э.С., Мд Саллех М.С., Банхам А.Х., Педерсен Л.М., Мёллер М.Б. и др. (июль 2017 г.). «Экспрессия TRPM4 связана с активированным подтипом B-клеток и плохой выживаемостью при диффузной крупноклеточной B-клеточной лимфоме» . Гистопатология . 71 (1): 98–111. дои : 10.1111/его.13204 . ПМИД 28248435 . S2CID 4767956 .
- ^ Палмер Р.К., Атвал К., Бакадж И., Карлуччи-Дербишир С., Бубер М.Т., Серн Р. и др. (декабрь 2010 г.). «Оксид трифенилфосфина является мощным и селективным ингибитором временного рецепторного потенциала ионного канала меластатина-5». Технологии анализа и разработки лекарств . 8 (6): 703–13. дои : 10.1089/adt.2010.0334 . ПМИД 21158685 .
- ^ Перейти обратно: а б с д Сусси, М; Хассельсвейлер, А; Гкика, Д. (12 сентября 2023 г.). «Каналы TRP: забытые виновники устойчивости рака молочной железы к химиотерапии?» . Мембраны . 13 (9): 788. doi : 10.3390/membranes13090788 . ПМЦ 10536409 . ПМИД 37755210 .
 В эту статью включен текст, доступный по лицензии CC BY 4.0 .
В эту статью включен текст, доступный по лицензии CC BY 4.0 . - ^ Месегер В., Альпизар Ю.А., Луис Э., Таджада С., Денлингер Б., Фахардо О. и др. (20 января 2014 г.). «Каналы TRPA1 опосредуют острое нейрогенное воспаление и боль, вызванную бактериальными эндотоксинами» . Природные коммуникации . 5 : 3125. Бибкод : 2014NatCo...5.3125M . дои : 10.1038/ncomms4125 . ПМЦ 3905718 . ПМИД 24445575 .
- ^ Солдано А., Альпизар Ю.А., Боонен Б., Франко Л., Лопес-Рекена А., Лю Г. и др. (июнь 2016 г.). «Вкусоопосредованное избегание бактериальных липополисахаридов посредством активации TRPA1 у дрозофилы» . электронная жизнь 5 . дои : 10.7554/eLife.13133 . ПМЦ 4907694 . ПМИД 27296646 .
- ^ Боонен Б., Альпизар Я.А., Санчес А., Лопес-Рекена А., Воэтс Т., Талавера К. (июль 2018 г.). «Дифференциальное воздействие липополисахарида на сенсорные каналы TRP мыши» . Клеточный кальций . 73 : 72–81. дои : 10.1016/j.ceca.2018.04.004 . ПМИД 29689522 . S2CID 13681499 .
- ^ Альпизар Ю.А., Боонен Б., Санчес А., Юнг С., Лопес-Рекена А., Наерт Р. и др. (октябрь 2017 г.). «Активация TRPV4 запускает защитные реакции на бактериальные липополисахариды в эпителиальных клетках дыхательных путей» . Природные коммуникации . 8 (1): 1059. Бибкод : 2017NatCo...8.1059A . дои : 10.1038/s41467-017-01201-3 . ПМК 5651912 . ПМИД 29057902 .
- ^ Минке Б., Ву С., Пак В.Л. (ноябрь 1975 г.). «Индукция напряжения шума фоторецепторов в темноте у мутанта дрозофилы». Природа . 258 (5530): 84–7. Бибкод : 1975Natur.258...84M . дои : 10.1038/258084a0 . ПМИД 810728 . S2CID 4206531 .
- ^ Харди Р.К., Минке Б. (апрель 1992 г.). «Ген trp необходим для активируемого светом Ca2+-канала в фоторецепторах дрозофилы». Нейрон . 8 (4): 643–51. дои : 10.1016/0896-6273(92)90086-S . ПМИД 1314617 . S2CID 34820827 .
- ^ Филлипс А.М., Булл А., Келли Л.Е. (апрель 1992 г.). «Идентификация гена дрозофилы, кодирующего кальмодулинсвязывающий белок, гомологичный гену фототрансдукции trp». Нейрон . 8 (4): 631–42. дои : 10.1016/0896-6273(92)90085-R . ПМИД 1314616 . S2CID 21130927 .
- ^ Чжан, Яли В.; Рагуванши, Ракеш П.; Шен, Вэй Л.; Монтелл, Крейг (октябрь 2013 г.). «Десенситизация вкуса, вызванная пищевым опытом, модулируемая каналом TRPL дрозофилы» . Природная неврология . 16 (10): 1468–1476. дои : 10.1038/nn.3513 . ISSN 1546-1726 . ПМЦ 3785572 . ПМИД 24013593 .
Внешние ссылки
[ редактировать ]- Переходные + Рецепторные + Потенциальные + Каналы в Национальной медицинской библиотеке США по медицинским предметным рубрикам (MeSH)
- «Потенциальные каналы временных рецепторов» . База данных IUPHAR по рецепторам и ионным каналам . Международный союз фундаментальной и клинической фармакологии.
- Клэпхэм Д.Э., ДеКэн П., Карвачо И., Чаудхури Д., Доернер Дж.Ф., Джулиус Д. и др. «Каналы транзиторного рецепторного потенциала» . Руководство IUPHAR/BPS по фармакологии.
- «База данных ТРИП» . созданная вручную база данных межбелковых взаимодействий для каналов TRP млекопитающих .