Алкан

В органической химии алкан , или парафин (историческое тривиальное название которое также имеет другие значения ), является ациклическим насыщенным углеводородом . Другими словами, алкан состоит из водорода и углерода атомов , расположенных в структуре деревьев в которой все углерод -углеродные связи одиноки , . [ 1 ] Алканы имеют общую химическую формулу C N H 2 N +2 . Алканы в диапазоне сложности от самых простых случаев метана ( CH 4 ), где n = 1 (иногда называемая родительской молекулой), до произвольно больших и сложных молекул, таких как пентакантант ( C 50 H 102 ) октан, изомер тетрадекана ) или 6-этил-2-метил-5- (1- метилэтил ( C 14 H 30 ).
Международный союз чистой и прикладной химии (IUPAC) определяет алканы как «ациклические разветвленные или неразветвленные углеводороды, имеющие общую формулу C n h 2 n +2 следовательно, полностью состоящий из атомов водорода и . насыщенных , и , атомов углерода Имея отличную общую формулу (например, циклоалканы C N H 2 N ).
В алкане каждый атом углерода - SP 3 -Гибридизируется с 4 -сигма -связями (C -C или C -H ), и каждый атом водорода соединен с одним из атомов углерода (в связи C -H). Самая длинная серия связанных атомов углерода в молекуле известна как его углеродный скелет или костяка углерода. Количество атомов углерода может рассматриваться как размер алкане.
Одной из групп более высоких алканов являются воски , твердые вещества при стандартной температуре окружающей среды и давлении (SATP), для которых количество атомов углерода в основной цепи углерода больше, чем около 17. С их повторяющимися - CH 2 единицы, алканы представляют собой гомологичную серию в которых элементы различаются по молекулярной массе на несколько кратных ед . органических соединений , 14,03 Атомы водорода массы ~ 1,01 ед. Каждый).
Метан продуцируется метаногенными бактериями , а некоторые длинноцепочечные алканы функционируют как феромоны у определенных видов животных или в качестве защитных восков у растений и грибов. Тем не менее, большинство алканов не имеют большой биологической активности . Их можно рассматривать как молекулярные деревья, на которых можно повесить более активные/реактивные функциональные группы биологических молекул.
Алканы имеют два основных коммерческих источника: нефть (сырая нефть) и природный газ .
Алкильная . группа-это алкановый молекулярный фрагмент, который несет одну открытую валентность для связи Как правило, они сокращаются с символом для любой органической группы , R, хотя ALK иногда используется для специфически символизирования алкильной группы (в отличие от алкенильной группы или арильной группы).
Структура и классификация
[ редактировать ]Обычно расстояние отдельной связи CC составляет 1,53 Ångströms (1,53 × 10 −10 М). [ 2 ] Насыщенные углеводороды могут быть линейными, разветвленными или циклическими . Третья группа иногда называют циклоалканами . [ 1 ] Очень сложные структуры возможны путем объединения линейных ветвей, циклических алканов.
Изомерия
[ редактировать ]
Алканы с более чем тремя атомами углерода могут быть расположены различными способами, образуя структурные изомеры . Самый простой изомер алкана - это тот, в котором атомы углерода расположены в одной цепи без ветвей. Этот изомер иногда называют N -изомер ( N для «нормального», хотя он не обязательно является наиболее распространенным). Однако цепь атомов углерода также может быть разветвлена в одной или нескольких точках. Количество возможных изомеров быстро увеличивается с количеством атомов углерода. Например, для ациклических алканов: [ 3 ]
- C 1 : метатан только
- C 2 : этан только
- C 3 : пропан только
- C 4 : 2 Изомеры: Бутан и Изобутан
- C 5 : 3 Изомеры: пентатан , изопентан и неопентан
- C 6 : 5 Изомеры: гексан , 2-метилпентан , 3-метилпентан , 2,2-диметилбутан и 2,3-диметилбутан
- C 7 : 9 Изомеры: гептан , 2-метилгексан , 3-метилгексан , 2,2-диметилпентан , 2,3-диметилпентан , 2,4-диметилпентан , 3,3-диметилпентатан , 3-этилпентан , 2,2,3- триметилбутан
- C 8 : 18 Изомеры: октатан , 2-метилгептан , 3-метилгептан , 4-метилгептан , 2,2-диметилгексан , 2,3-диметилгексан , 2,4-диметилгексан , 2,5-диметилгексан , 3,3-диметилгексан , 3,4-диметилгексан , 3-этилгексан , 2,2,3-триметилпентатан , 2,2,4-триметилпентатан , 2,3,3,3-триметилпентатан , 2,3,4-триметилпентатан , 3-этил-2-метилпентан , 3-этил-3-метилпентан , 2, 2, 2,3,3-тетраметилбутан
- C 9 : 35 Изомеры
- C 10 : 75 Изомеры
- C 12 : 355 изомеров
- C 32 : 27,711,253,769 изомеров
- C 60 : 22,158,734 535,770,411 074 184 изомеров, многие из которых не являются стабильными
Разветвленные алканы могут быть хиральными . Например, 3-метилгексан и его более высокие гомологи являются хиральными из-за их стереогенного центра при атоме углерода № 3. Приведенный выше список включает только различия в связности, а не стереохимию. В дополнение к алкане изомеры, цепь атомов углерода может образовывать одно или несколько колец. Такие соединения называются циклоалканами и также исключаются из приведенного выше списка, поскольку изменение количества колец изменяет молекулярную формулу . Например, циклобутан и метилциклопропан являются изомерами друг друга (C 4 H 8 ), но не являются изомерами бутана (C 4 H 10 ).
Разветвленные алканы более термодинамически стабильны, чем их линейные (или менее разветвленные) изомеры. Например, высокоразвитый 2,2,3,3 -тетраметилбутан составляет примерно 1,9 ккал/моль более стабильный, чем его линейный изомер, N -октан. [ 4 ]
Номенклатура
[ редактировать ]Номенклатура IUPAC (систематический способ именования соединений) для алканов основана на идентификации углеводородных цепей. Неразветвленные, насыщенные углеводородные цепи систематически называются греческим численным префиксом, обозначающим количество углеродов и суффикса «-ена». [ 5 ]
В 1866 году август Вильгельм фон Хофманн предложил систематизировать номенклатуру, используя всю последовательность гласных A, E, I, O и U для создания суффиксов -Ane, -ene, -ine (или -yne), -он, -ne, для Углеводороды , C N H 2 N +2 , C N H 2 N C N H 2 N −2 , C N H 2 N -4 , C N H 2 N N −6 . [ 6 ] В современной номенклатуре первые три специально назвали углеводороды с одиночными, двойными и тройными связями; [ 7 ] в то время как «-он» теперь представляет кетон .
Линейные алканы
[ редактировать ]Алканы прямой цепи иногда обозначаются префиксом «n-» или « n- » (для «нормального»), где существует нелинейный изомер . Хотя это не является строго необходимым и не является частью системы именования IUPAC, использование по-прежнему распространено в тех случаях, когда кто-то хочет подчеркнуть или различать изомеры с прямой цепью и разветвленной цепью, например, « n -бутан », а не Проще говоря, «бутан», чтобы отличить его от изобутана . Альтернативными названиями для этой группы, используемых в нефтяной промышленности, являются линейные парафины или n -параффины .
Первые восемь членов серии (с точки зрения количества атомов углерода) названы следующим образом:
- метан
- CH 4 - один углерод и 4 водород
- этан
- C 2 H 6 - два углерода и 6 водород
- пропан
- C 3 H 8 - три углерода и 8 водород
- бутан
- C 4 H 10 - четыре углерода и 10 водород
- Пентатан
- C 5 H 12 - пять углерод и 12 водород
- гексан
- C 6 H 14 - шесть углерода и 14 водород
- гептан
- C 7 H 16 - семь углеродов и 16 водород
- октатан
- C 8 H 18 - восемь углеродов и 18 водород
Первые четыре названия были получены из метанола , эфира , пропионовой кислоты и массовой кислоты . Алканы с пятью или более атомами углерода названы путем добавления суффикса -эн к соответствующему численному префиксу множителя [ 8 ] с Elision любого терминала гласного ( -a или -o ) из основного численного термина. Следовательно, пентатан , C 5 H 12 ; Гексан , C 6 H 14 ; Гептан , C 7 H 16 ; Октан , C 8 H 18 ; и т.д. Цифровой префикс обычно греческий; Тем не менее, алканы с подсчетом атома углерода, заканчивающимся в девяти, , используйте латинский префикс . например
Разветвленные алканы
[ редактировать ]
Простые разветвленные алканы часто имеют общее название, используя префикс, чтобы отличить их от линейных алканов, например, n -пентан , изопентан и неопентан .
Конвенции именования IUPAC могут быть использованы для производства систематического имени.
Ключевые шаги в названии более сложных разветвленных алканов заключаются в следующем: [ 9 ]
- Определите самую длинную непрерывную цепь атомов углерода
- Назовите эту самую длинную корневую цепь, используя стандартные правила именования
- Назовите каждую боковую цепь, изменяя суффикс имени алкане с «-Ane» на «-ил»
- Числа самая длинная непрерывная цепь, чтобы дать самые низкие цифры для боковых цепей [ 10 ]
- Номер и назовите боковые цепи перед названием корневой цепи
- Если есть несколько боковых цепей одного и того же типа, используйте префиксы, такие как «di-» и «tri-», чтобы указать это как таковой, и числа каждый.
- Добавить имена боковых цепей в алфавитном порядке (игнорирование префиксов «Ди-» и т. Д.
| Общее название | n -pentane | изопентан | неопентан |
|---|---|---|---|
| Имя IUPAC | Пентатан | 2-метилбутан | 2,2-диметилп'пане |
| Структура |  |

|
Насыщенные циклические углеводороды
[ редактировать ]Несмотря на то, что они технически отличаются от алканов, этот класс углеводородов называется некоторыми как «циклические алканы». Как следует из их описания, они содержат одно или несколько колец.
Простые циклоалканы имеют префикс «цикло-», чтобы отличить их от алканов. Циклоалканы названы в соответствии с их ациклическими аналогами в отношении количества атомов углерода в их магистралях, например, циклопентан (C 5 H 10 ) - это циклоалкан с 5 атомами углерода, как пентатан (C 5 H 12 ), но они соединены. в пятичленном кольце. Аналогичным образом, пропан и циклопропан , бутан и циклобутан и т. Д.
Заменившие циклоалканы названы аналогично замещенным алканам - указано кольцо циклоалкана, а заместители в соответствии с их позицией на кольце, причем нумерация, определенная правилами приоритета Cahn -Engold -Prolog . [ 8 ]
Тривиальные/общие названия
[ редактировать ]Тривиальное (не систематическое ) название для алканов- «парафины». Вместе алканы известны как «парафиновый сериал». Тривиальные названия для соединений обычно являются историческими артефактами. Они были придуманы до разработки систематических имен и были сохранены из -за знакомого использования в промышленности. Циклоалканы также называют нафтенесами. [ 11 ] [ 12 ]
Алканы с разветвленной цепью называются изопарафинами . «Параффин» является общим термином и часто не различает чистые соединения и смеси изомеров , то есть соединения одной и той же химической формулы , например, пентана и изопентана .
- В IUPAC
Следующие тривиальные названия сохраняются в системе IUPAC:
- Неайпак
Некоторые тривиальные названия не iupac иногда используются:
- Цетан, для гексадекана
- Cerane, для гексакозана [ 13 ]
Физические свойства
[ редактировать ]Все алканы бесцветны. [ 14 ] [ 15 ] Алканы с самой низкой молекулярной массой представляют собой газы, а в промежуточной молекулярной массе - это жидкости, а самыми тяжелыми являются восковые твердые вещества. [ 16 ] [ 17 ]
Таблица алканов
[ редактировать ]| Алкан | Формула | Точка кипения [ Примечание 1 ] [° C] |
Точка плавления [ Примечание 1 ] [° C] |
Плотность [ Примечание 1 ] [кг/м 3 ] (и 20 ° C) |
Изомеры [ Примечание 2 ] |
|---|---|---|---|---|---|
| Метан | Ch 4 | −162 | −182 | 0,656 (газ) | 1 |
| Этан | C 2 H 6 | −89 | −183 | 1.26 (газ) | 1 |
| Пропан | C 3 H 8 | −42 | −188 | 2.01 (газ) | 1 |
| Бутан | C 4 H 10 | 0 | −138 | 2.48 (газ) | 2 |
| Пентатан | C 5 H 12 | 36 | −130 | 626 (жидкость) | 3 |
| Гексан | C 6 H 14 | 69 | −95 | 659 (жидкость) | 5 |
| Гептан | C 7 H 16 | 98 | −91 | 684 (жидкость) | 9 |
| Октатан | C 8 H 18 | 126 | −57 | 703 (жидкость) | 18 |
| Неэн | C 9 H 20 | 151 | −54 | 718 (жидкость) | 35 |
| Деканский | C 10 H 22 | 174 | −30 | 730 (жидкость) | 75 |
| Унх | C 11 H 24 | 196 | −26 | 740 (жидкость) | 159 |
| Додекан | C 12 H 26 | 216 | −10 | 749 (жидкость) | 355 |
| Тридекейн | C 13 H 28 | 235 | −5.4 | 756 (жидкость) | 802 |
| Тетрадекан | C 14 H 30 | 253 | 5.9 | 763 (жидкость) | 1858 |
| Пентадекан | C 15 H 32 | 270 | 10 | 769 (жидкость) | 4347 |
| Гексадекейн | C 4:34 вечера | 287 | 18 | 773 (жидкость) | 10,359 |
| Heptadecane | C 17 H 36 | 303 | 22 | 777 (твердый) | 24,894 |
| Октадекан | C 18 H 38 | 317 | 28 | 781 (твердый) | 60,523 |
| Девять | C 19 H 40 | 330 | 32 | 785 (твердый) | 148,284 |
| Икозан | C 20 H 42 | 343 | 37 | 789 (твердый) | 366,319 |
| Триаконтант | C 30 H 62 | 450 | 66 | 810 (твердый) | 4,111,846,763 |
| Тетракантан | C 40 H 82 | 525 | 82 | 817 (твердый) | 62,481,801,147,341 |
| Пентакантант | C 50 H 102 | 575 | 91 | 824 (твердый) | 1,117,743,651,746,953,270 |
| Гексакантант | C 60 H 122 | 625 | 100 | 829 (твердый) | 2.21587345357704×10 22 |
| Heptacontane | C 70 H 142 | 653 | 109 | 869 (твердый) | 4.71484798515330×10 26 |
| |||||
Точка кипения
[ редактировать ]
Алканы испытывают межмолекулярные силы Ван -дер -Ваальс . Совокупные эффекты этих межмолекулярных сил приводят к более высоким точкам кипения алканов. [ 18 ]
Два фактора влияют на силу сил Ван -дер -Ваальса:
- Количество электронов, окружающих молекулу , которая увеличивается с молекулярной массой Алкана
- площадь поверхности молекулы
В стандартных условиях от 4 до C 4 H 10 алканов являются газообразными; От C 5 H 12 до C 17 H 36 они являются жидкостями; и после C 18 H 38 они - твердые вещества. Поскольку точка кипения алканов в основном определяется весом, не должно быть сюрпризом, что точка кипения имеет почти линейную связь с размером ( молекулярная масса ) молекулы. Как правило, температура кипения увеличивается на 20–30 ° C для каждого углерода, добавленного в цепь; Это правило относится к другим гомологичным сериям. [ 18 ]
Алкан с прямой цепью будет иметь точку кипения выше, чем алкан с разветвленной цепью из-за большей площади поверхности в контакте и, следовательно, больших сил Ван-дер-ваальса, между соседними молекулами. Например, сравните изобутан (2-метилпропан) и N-бутан (бутан), которые кипят при -12 и 0 ° C, а также 2,2-диметилбутан и 2,3-диметилбутан, которые кипят при 50 и 58 ° C, соответственно Полем [ 18 ]
С другой стороны, циклоалканы имеют тенденцию иметь более высокие точки кипения, чем их линейные аналоги из -за заблокированных конформаций молекул, которые дают плоскость межмолекулярного контакта.
Точки плавления
[ редактировать ]Точки плавления алканов следуют аналогичной тенденции к точкам кипения по той же причине, что и изложено выше. То есть (при равных), чем больше молекула, чем выше температура плавления. Существует одна значительная разница между точками кипения и точками плавления. Твердые вещества имеют более жесткую и фиксированную структуру, чем жидкости. Эта жесткая структура требует энергии для разрушения. Таким образом, для лучшего собрания твердых конструкций потребуется больше энергии для разрыва. Для алканов это можно увидеть на графике выше (т.е. синяя линия). Алканы с нечетными номерами имеют более низкую тенденцию в точках плавления, чем ровные алканы. Это связано с тем, что равномерные алканы хорошо содержатся в твердой фазе, образуя хорошо организованную структуру, которая требует больше энергии для разрыва. Алканы с нечетными номерами упаковываются менее хорошо, и поэтому «более разумная» солидная упаковочная конструкция требует меньше энергии для разрыва. [ 19 ] Для визуализации кристаллических структур видят. [ 20 ]
Точки плавления алканов с разветвленной цепью могут быть либо выше, либо ниже, чем у соответствующих алканов прямой цепи, опять же, в зависимости от способности рассматриваемого алкана хорошо упаковывать в твердую фазу.
Проводимость и растворимость
[ редактировать ]Алканы никоим образом не проводят электричество, и они не поляризованы электрическим полем . По этой причине они не образуют водородные связи и нерастворимы в полярных растворителях, таких как вода. Поскольку водородные связи между отдельными молекулами воды выровнены от алканской молекулы, сосуществование алкана и воды приводит к увеличению молекулярного порядка (снижение энтропии ). Поскольку не существует существенной связи между молекулами воды и алкановыми молекулами, второй закон термодинамики предполагает, что это снижение энтропии следует минимизировать путем минимизации контакта между алканом и водой: алканы, как говорят, являются гидрофобными, поскольку они нерастворимы в воде.
Их растворимость в неполярных растворителях относительно высока, свойство, которое называется липофильностью . Алканы, например, недоступны во всех пропорциях между собой.
Плотность алканов обычно увеличивается с количеством атомов углерода, но остается меньше, чем у воды. Следовательно, алканы образуют верхний слой в смеси алкан -воды. [ 21 ]
Молекулярная геометрия
[ редактировать ]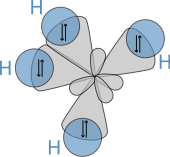
Молекулярная структура алканов напрямую влияет на их физические и химические характеристики. Это получено из конфигурации электронов углерода валентные , которая имеет четыре электроны . Атомы углерода в алканах описаны как SP 3 гибриды; То есть, к хорошему приближению, валентные электроны находятся на орбиталях, направленных на углах тетрахедрона, которые получены из комбинации орбитальных 2S и трех 2p орбиталей. Геометрически, угол между связями cos −1 (− 1/3 . ) ≈ 109,47 ° Это точнее для случая метана, в то время как более крупные алканы, содержащие комбинацию связей C - H и C - C, обычно имеют связи, которые находятся в пределах нескольких градусов от этого идеализированного значения.
Длина связей и углы связи
[ редактировать ]
Алкан имеет только отдельные связи C - H и C - C. Первый результат перекрытия SP 3 орбиталь углерода с орбиталом 1s водорода; последний из -за перекрытия двух SP 3 орбитали на соседних атомах углерода. Длина связи составляет 1,09 × 10 −10 м для связи C - H и 1,54 × 10 −10 м для связи C - C.
Пространственное расположение связей аналогично сфере четырех SP 3 Орбитали - они расположены тетраэдрически, с углом 109,47 ° между ними. Структурные формулы, которые представляют связи как под прямым углом друг с другом, хотя и общие, так и полезные, не точно изображают геометрию.
Конформация
[ редактировать ]

Пространственное расположение связей CC и CH описывается углами кручения молекулы, известно как его конформация . В этане , простейшем случае для изучения конформации алканов, существует почти свободное вращение о одноуглеродной единой связи. Две ограничивающие конформации важны: затмеваемая конформация и ошеломленная конформация . Потрясающая конформация составляет 12,6 кДж/моль (3,0 ккал/моль) ниже по энергии (более стабильная), чем затмеваемая конформация (наименьшая стабильная). В высоко разветвленных алканах угол связи может отличаться от оптимального значения (109,5 °) до размещения громоздких групп. Такие искажения вводят натяжение в молекуле, известное как стерическое препятствие или штамм. Штамм существенно повышает реактивность. [ 22 ]
Спектроскопические свойства
[ редактировать ]Спектроскопические сигнатуры для алканов доступны с помощью основных методов характеристики. [ 23 ]
Инфракрасная спектроскопия
[ редактировать ]Режим растяжения СН обеспечивает сильное поглощение между 2850 и 2960 см. −1 и более слабые полосы для режима растяжения CC поглощаются от 800 до 1300 см. −1 Полем Режимы изгиба углерода -гидрогена зависят от природы группы: метильные группы показывают полосы при 1450 см. −1 и 1375 см −1 , в то время как метиленовые группы показывают полосы на 1465 см −1 и 1450 см −1 . [ 24 ] Углеродные цепи с более чем четырьмя атомами углерода показывают слабое поглощение примерно на 725 см. −1 .
ЯМР -спектроскопия
[ редактировать ]Протонные резонансы алканов обычно обнаруживаются при Δ H = 0,5–1,5. Резонансы углерода-13 зависят от количества атомов водорода, прикрепленных к углероду: Δ C = 8–30 (первичный, метил, –CH 3 ), 15–55 (вторичный, метилен, –CH 2- ), 20–60 (Третичная, метина, C - H) и четвертичная. Резонанс углерода-13 атомов четвертичного углерода характерно из-за отсутствия эффекта преобразователя ядер и длительного времени релаксации , и его можно пропустить в слабых образцах или образцах, которые не работали в течение достаточно долгого времени.
Масс -спектрометрия
[ редактировать ]Поскольку алканы имеют высокие энергии ионизации , их электронные масс -спектры показывают слабые токи для их молекулярных ионов. Схема фрагментации может быть трудно интерпретировать, но в случае алканов разветвленной цепи углеродная цепь предпочтительно расщепляется на третичные или четвертичные углероды из -за относительной стабильности полученных свободных радикалов . Масс-спектры для алканов прямой цепи иллюстрируются тем, что для додекана : фрагмент, возникающий в результате потери одной метильной группы ( M -15), отсутствует, фрагменты более интенсивны, чем молекулярный ион и распределены по интервалу 14 массы. Единицы, соответствующие потерю CH 2 групп. [ 25 ]
Химические свойства
[ редактировать ]Алканы только слабо реагируют с большинством химических соединений. Они реагируют только с самыми сильными из электрофильных реагентов в силу своих сильных связей C - H (~ 100 ккал/моль) и связей C - C (~ 90 ккал/моль). Они также относительно нереактивны в отношении свободных радикалов. Эта инертность является источником термина парафины (со значением здесь «не хватает сродства»). В сырой нефти молекулы алкана оставались химически неизменными в течение миллионов лет.
Кислото-базовое поведение
[ редактировать ]По оценкам, константа диспсоциации кислоты (P k a ) всех алканов варьируется от 50 до 70, в зависимости от метода экстраполяции, следовательно, они являются чрезвычайно слабыми кислотами, которые практически инертны для оснований (см.: Углеродные кислоты ). Они также являются чрезвычайно слабыми основаниями, не подвергаясь наблюдаемой протонировании в чистой серной кислоте ( H 0 ~ -12), хотя известно, что супецидры , по крайней мере, миллионы раз сильнее, протонируют их, чтобы получить гиперкоординатные ионы алкания (см.: Метановый ион ). Полем Таким образом, смесь сурьмы пентафторида (SBF 5 ) и фторульфоновой кислоты (HSO 3 F), называемой магической кислотой , может протонировать алканы. [ 26 ]
Реакции с кислородом (реакция сжигания)
[ редактировать ]Все алканы реагируют с кислородом в реакции сжигания , хотя их становится все труднее зажигать по мере увеличения количества атомов углерода. Общее уравнение для полного сгорания:
- C n h 2 n +2 + ( 3 / 2 n + 1/2 2 ) O 2 → ( N + 1) H O + N CO 2
- или c n h 2 n +2 + ( 3 N + 1/2 ) O 2 → ( N + 1) H 2 O + N CO 2
При отсутствии достаточного количества кислорода окись углерода или даже сажи можно образовать , как показано ниже:
Например, метан :
- 2 CH 4 + 3 O 2 → 4 H 2 O + 2 CO
- CH 4 + O 2 → 2 H 2 O + C
См. Алкане тепло в таблице формирования для подробных данных. Стандартное изменение энтальпии сгорания , Δ c h ⊖ , для алканов увеличивается примерно на 650 кДж/моль на группу 2 . Алканы с разветвленной цепью имеют более низкие значения Δ C H ⊖ чем прямые алканы того же количества атомов углерода, и поэтому можно рассматривать как несколько более стабильные.
Биодеградация
[ редактировать ]Некоторые организмы способны металлизировать алканы. [ 27 ] [ 28 ] Метановые монооксигеназы преобразуют метатан в метанол . Для более высоких алканов цитохром P450 превращают алканы в спирты, которые затем подвержены деградации.
Свободные радикальные реакции
[ редактировать ]Свободные радикалы , молекулы с непарными электронами, играют большую роль в большинстве реакций алканов. Реакции галогеникации свободного радикала происходят с галогенами, что приводит к производству галоалканов . Атомы водорода алкана постепенно заменяются атомами галогена. Реакция алканов и фтора очень экзотермична и может привести к взрыву. [ 29 ] Эти реакции являются важным промышленным путем к галогенированным углеводородам. Есть три шага:
- Инициирование галогенные радикалы образуются при гомолизе . Обычно требуется энергия в форме тепла или света.
- Затем происходит цепная реакция или распространение - галогенный радикал реферат водород из алкана с получением алкильного радикала. Это реагирует дальше.
- Заканчивание цепью , где радикалы рекомбинируют.
Эксперименты показали, что все галогенирование продуцирует смесь всех возможных изомеров, что указывает на то, что все атомы водорода подвержены реакции. Производимая смесь, однако, не является статистической: вторичные и третичные атомы водорода преимущественно заменены из-за большей стабильности вторичных и третичных свободных радикалов. Пример можно увидеть в монобромировании пропана: [ 18 ]

В реакции тростника и диоксид серы хлор переворачивают углеводороды в сульфонилхлориды под воздействием света .
В некоторых условиях алканы будут подвергаться нитрованию .
Ch активация
[ редактировать ]Некоторые комплексы переходных металлов способствуют нерадикальным реакциям с алканами, что приводит к реакциям активации связи SO C-H . [ 30 ]
Трещины
[ редактировать ]Трещивание разбивает большие молекулы на более мелкие. Эта реакция требует тепла и катализаторов. Процесс теплового растрескивания следует за гомолитическим механизмом с образованием свободных радикалов . Процесс каталитического растрескивания включает в себя присутствие кислотных катализаторов (обычно твердые кислоты, такие как кремнезема и цеолиты ), которые способствуют гетеролитическому (асимметричным) разрушению связей, дающих пары ионов противоположных зарядов, обычно карбокация . Локализованные углероды свободных радикалов и катионов очень нестабильны и подвергаются процессам перестройки цепи, рассеяния C- C в положении бета (т.е., растрескивание) и внутри- и межмолекулярного переноса водорода или переноса гидрида . В обоих типах процессов соответствующие реактивные интермедиаты (радикалы, ионы) постоянно регенерируются, и, таким образом, они продолжаются с помощью механизма самопроизводительной цепи. Цепь реакций в конечном итоге прекращается радикальной или ионной рекомбинацией. [ Цитация необходима ]
Изомеризация и Реформация
[ редактировать ]Драган и его коллега первыми сообщили об изомеризации в алканах. [ 31 ] Изомеризация и реформация-это процессы, в которых алканы прямой цепи нагреваются в присутствии платинового катализатора. При изомеризации алканы становятся изомерами с разветвленной цепью. Другими словами, он не теряет углеродов или гидрогидов, сохраняя одинаковую молекулярную массу. [ 31 ] В Реформации алканы становятся циклоалканами или ароматическими углеводородами , испуская водород в качестве побочного продукта. Оба этих процесса повышают октановое число вещества. Бутан является наиболее распространенным алканом, который подвергается процессу изомеризации, поскольку он делает много разветвленных алканов с высокими октановыми числами. [ 31 ]
Другие реакции
[ редактировать ]В паровом реформировании алканы реагируют с парами в присутствии никелевого катализатора с получением водорода и окиси углерода.
Возникновение
[ редактировать ]Появление алканов во вселенной
[ редактировать ]

Алканы образуют небольшую часть атмосферных планет , таких как Юпитер (0,1% метан, 2 ч / млн этан), Сатурн (0,2% метан, 5 ч / млн этан), Уран (1,99% метан, 2,5 ч / млн . 1,5% метан, 1,5 ч / млн этан). Титан (1,6% метана), спутник Сатурна, был исследован Huygens зондом , который указывал на то, что атмосфера Титана периодически дождь жидкого метана на поверхность луны. [ 32 ] Также на Титане миссия Кассини отображала сезонные метановые/этановые озера возле полярных регионов Титана. Метан и этан также были обнаружены в хвосте кометы Hyakutake . Химический анализ показал, что численность этана и метана были примерно равны, что, как полагают, подразумевает, что его льты образуются в межзвездном пространстве, вдали от солнца, что испарило бы эти летучие молекулы. [ 33 ] Алканы также были обнаружены в метеоритах , таких как углеродистые хондриты .
Появление алканов на земле
[ редактировать ]Следы метана газа (около 0,0002% или 1745 м.д.) встречаются в атмосфере Земли, продуцируемой главным образом метаногенными микроорганизмами, такими как архаи в кишечнике жвачных животных. [ 34 ]
Наиболее важными коммерческими источниками для алканов являются природный газ и нефть . [ 18 ] Природный газ содержит в основном метатан и этан, с некоторым пропаном и бутаном : нефть представляет собой смесь жидких алканов и других углеводородов . Эти углеводороды были образованы, когда морские животные и растения (зоопланктон и фитопланктон) умерли и погрузились в дно древнего моря и были покрыты отложениями в аноксической среде и преобразованы в течение многих миллионов лет при высоких температурах и высоком давлении в их нынешнюю форму. Природный газ привел таким образом, например, из следующей реакции:
- C 6 H 12 O 6 → 3 CH 4 + 3 CO 2
Эти углеводородные отложения, собранные в пористых породах, захваченных под непроницаемыми породами крышки, составляют коммерческие нефтяные месторождения . Они сформировались в течение миллионов лет, и после того, как исчерпаны, нельзя легко заменить. Истощение этих запасов углеводородов является основой для того, что известно как энергетический кризис .
Алканы имеют низкую растворимость в воде, поэтому содержание в океанах незначительно; Однако при высоких давлениях и низких температурах (например, на дне океанов), метан может совместно кристаллизоваться с водой, образуя твердый клатрат метана (гидрат метана). Хотя это не может быть коммерчески эксплуатироваться в настоящее время, количество горючей энергии известных полей метановых клатрат превышает содержание энергии во всех местах природного газа и нефти. Следовательно, метатан, извлеченный из клатрата метана, является кандидатом на будущее топливо.
Биологическое явление
[ редактировать ]
Помимо нефти и природного газа, алканы существуют в природе только в качестве метана, который вырабатывается некоторыми архей в результате процесса метаногенеза . Эти организмы обнаружены в кишечнике термитов [ 35 ] и коровы. [ 36 ] Метан углекислого производится из газа или других органических соединений. Энергия выделяется окислением водорода :
- CO 2 + 4 H 2 → CH 4 + 2 H 2 O
Вероятно, что наши текущие отложения природного газа были сформированы аналогичным образом. [ 37 ]
RCH2\sCH3}} (R = alkyl)
Другим путем в алканы является гидрогенолиз , который влечет за собой расщепление связей C-гетероатома с использованием водорода. В промышленности основными субстратами являются органонитрогеновые и органосульфурные примеси, то есть гетероатомы являются N, а S. Специфические процессы называются гидроденитрификацией и гидродсульфуризация :
- R 3 N + 3 H 2 → 3 RH + H 3 N
- R 2 S + 2 H 2 → 2 RH + H 2 S
Гидрогенолиз может быть применен для преобразования практически любой функциональной группы в углеводороды. Субстраты включают галоалканы, спирты, альдегиды, кетоны, карбоновые кислоты и т. Д. Это может быть осуществлено с помощью гидрида лития алюминия , восстановления Клемменсона и других специализированных маршрутов.
Уголь
[ редактировать ]Уголь является более традиционным предшественником алканов. Широкий спектр технологий интенсивно практиковался на протяжении веков. [ 38 ] Просто нагревание угля дает алканы, оставляя после себя колу . Соответствующие технологии включают процесс Бергиуса и угольную жидкость . Частичное сжигание угля и связанные с ними твердые органические соединения генерирует угарный газ , который может быть гидрогенизирован с использованием процесса Fischer -Tropsch . Эта технология позволяет синтезировать жидкие углеводороды, включая алканы. Этот метод используется для получения заменителей для нефтяных дистиллятов .
Лабораторная подготовка
[ редактировать ]Редко есть какой -либо интерес к синтезу алканов, поскольку они обычно являются коммерчески доступными и менее ценными, чем практически любой предшественник. Самым известным методом гидрирование алкенов является . Многие связи CX могут быть преобразованы в связи с CH, используя гидрид лития алюминия , восстановление клемменсона и другие специализированные маршруты. [ 39 ] Гидролиз реагентов алкил Гринья и алкил -лития дает алканы. [ 40 ]
Приложения
[ редактировать ]Топливо
[ редактировать ]Доминирующее использование алканов является как топливо. Пропан и бутан , легко выселенные газы, обычно известны как жидкий нефтяной газ (СПГ). [ 41 ] От пентана до октана алканы - это очень нестабильные жидкости. Они используются в качестве топлива в двигателях внутреннего сгорания , поскольку они легко испаряются при входе в камеру сгорания без формирования капель, что может повредить однородности сгорания. Алканы разветвленной цепи являются предпочтительными, поскольку они гораздо менее склонны к преждевременному зажиганию, что вызывает стук , чем их гомологи прямой цепи. Эта склонность к преждевременному зажиганию измеряется октановым рейтингом топлива, где 2,2,4-триметилпентатан ( изооктан ) имеет произвольное значение 100, а гептан имеет ноль. Помимо их использования в качестве топлива, средние алканы также являются хорошими растворителями для неполярных веществ. Алканы от nonane до, например, гексадекан (алкан с шестнадцатью атомами углерода) представляют собой жидкости с более высокой вязкостью , все меньше и менее подходящими для использования в бензине. Вместо этого они образуют основную часть дизельного топлива и авиационного топлива . Дизельное топливо характеризуется их цетановым номером , кетан является старым именем для шестигранного. Тем не менее, более высокие точки плавления этих алканов могут вызывать проблемы при низких температурах и в полярных областях, где топливо становится слишком толстым, чтобы правильно течь.
Предшественники химикатов
[ редактировать ]В процессе растрескивания алканы могут быть преобразованы в алкены . Простые алкени являются предшественниками полимеров, таких как полиэтилен и полипропилен . Когда растрескивание добирается до крайностей, алканы могут быть преобразованы в углеродный черный , который является значительным компонентом шин.
Хлорирование метана дает хлорметаны, которые используются в качестве растворителей и строительных блоков для сложных соединений. Аналогичным образом обработка метана серной дает углеродный дисульфид . Еще другие химические вещества получают реакцией с триоксидом серы и оксидом азота
Другой
[ редактировать ]Некоторые легкие углеводороды используются в качестве аэрозольных спреев .
Алканы из гексадекана вверх образуют наиболее важные компоненты мазута и смазочного масла . В последней функции они работают в то же время, что и антикоррозивные агенты, поскольку их гидрофобная природа означает, что вода не может достичь металлической поверхности. Многие твердые алканы находят использование в качестве парафинового воска , например, в свечах . Однако это не следует путать с истинным воском , который состоит в основном из сложных эфиров .
Алканы с длиной цепи приблизительно 35 или более атомов углерода обнаруживаются в битуме , например, в дорожном поверхности. Тем не менее, более высокие алканы имеют небольшую ценность и обычно разделяются на более низкие алканы путем растрескивания .
Опасности
[ редактировать ]Алканы очень воспламеняются, но у них низкая токсичность. Метан "токсикологически практически инертный". Алканы могут быть асфиксиантами и наркотиком. [ 38 ]
Смотрите также
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а беременный IUPAC , сборник химической терминологии , 2 -е изд. («Золотая книга») (1997). Онлайн -исправленная версия: (2006–) « Алканы ». два : 10.1351/goldbook.a00222
- ^ Смит, Майкл Б.; Март, Джерри (2007). Усовершенствованная органическая химия: реакции, механизмы и структура (6 -е изд.). Нью-Йорк: Wiley-Interscience. п. 23. ISBN 978-0-471-72091-1 .
- ^ Онлайн-энциклопедия целочисленных последовательностей (последовательность A000602 в OEI ). Число n-узловых квартических деревьев; Количество алконов с n-углеродами C (n) H (2n+2) игнорирование стереоизомеров
- ^ Алабугин, Игорь В. (2016). Стереоэлектронные эффекты: мост между структурой и реакционной способностью . Уайли. ISBN 978-1-118-90637-8 Полем OCLC 957525299 .
- ^ IUPAC, Комиссия по номенклатуре органической химии (1993). "R-2.2.1: углеводороды" . Руководство по номенклатуре IUPAC органических соединений (рекомендации 1993) . Blackwell Scientific. ISBN 978-0-632-03488-8 Полем Получено 12 февраля 2007 года .
- ^ "Алкане номенклатура" . Архивировано из оригинала 2 февраля 2012 года.
- ^ Таким образом, окончание «-diene» применяется в некоторых случаях, когда у фон Хофманна был "-ine"
- ^ Jump up to: а беременный Реуш, Уильям. «Номенклатура - алканы» . Виртуальный учебник по органической химии . Архивировано из оригинала 21 мая 2016 года . Получено 5 апреля 2007 года .
- ^ Реуш, Уильям. «Примеры правил IUPAC на практике» . Виртуальный учебник по органической химии . Архивировано из оригинала 21 мая 2016 года . Получено 5 апреля 2007 года .
- ^ "Правила IUPAC" . www.chem.uiuc.edu . Получено 13 августа 2018 года .
- ^ «Определение циклоалканов» . www.merriam-webster.com . Получено 26 июня 2021 года .
- ^ «Определение нафтена» . www.merriam-webster.com . Получено 26 июня 2021 года .
- ^ Маккей, Дональд (14 марта 2006 г.). Справочник по физическим химическим свойствам и судьбе окружающей среды для органических химикатов . CRC Press. п. 206. ISBN 1-4200-4439-7 .
- ^ «Фармацевтическая химия» (PDF) . Архивировано из оригинала (PDF) 29 октября 2013 года . Получено 17 февраля 2014 года .
- ^ «13. углеводороды | Учебники» . Учебник.s-Anand.net. Архивировано из оригинала 8 мая 2011 года . Получено 3 октября 2014 года .
- ^ «Галерея молекул - алканы» . www.angelo.edu . Получено 6 декабря 2021 года .
- ^ Аллаби, Майкл, изд. (1988). «Алканы (парафины)». Иллюстрированный словарь науки, Андромеда . Windmill Books (Andromeda International).
- ^ Jump up to: а беременный в дюймовый и RT Моррисон; Р.Н. Бойд (1992). Органическая химия (6 -е изд.). Прентис Холл. ISBN 978-0-13-643669-0 .
- ^ Боиз, Роланд; Вайс, Ган-Кристоф; Bläser, Dieter (1 апреля 1999 г.). -аналканах с короткой цепью «Чередование точки плавления в N : однокристаллический рентгеновский анализ пропана при 30 К и N -бутана до N -ненана при 90 K». Angewandte Chemie International Edition . 38 (7): 988–992. doi : 10.1002/(SICI) 1521-3773 (19990401) 38: 7 <988 :: Aid-Anie988> 3.0.co; 2-0 . ISSN 1433-7851 .
- ^ «Твердый метатан» . Визуализация молекул и кристаллических структур .
- ^ Ouellette, Robert J.; Роун, Дж. Дэвид (1 января 2015 г.). «Алканы и циклоалканы» . Принципы органической химии . Elsevier. С. 65–94. doi : 10.1016/b978-0-12-802444-7.00003-3 . ISBN 978-0-12-802444-7 .
- ^ Смит, Майкл Б.; Март, Джерри (2007), Advanced Organic Chemistry: реакции, механизмы и структура (6-е изд.), Нью-Йорк: Wiley-Interscience, p. 195, ISBN 978-0-471-72091-1
- ^ Сильверштейн, Роберт М.; Вебстер, Фрэнсис Х.; Kiemle, David J.; Брайс, Дэвид Л. (2016). Спектрометрическая идентификация органических соединений (8 -е изд.). Уайли. ISBN 978-0-470-61637-6 .
- ^ «Додекан: ИК -спектр» . NIST Chemistry Webbook . SRD 69.
- ^ "Додекан" . NIST Chemistry Webbook . SRD 69.
- ^ Ола, Джорджия ; Schlosberg, RH (1968). «Химия в суперкислотах. I. Обмен водорода и поликонденсация метана и алканов в FSO H - SBF 5 (« Волшебная кислота »). 3 + и связанные с ним ионы углеводородов. Высокая химическая реакционная способность «парафинов» в реакциях ионных растворов ». Журнал Американского химического общества . 90 (10): 2726–7. DOI : 10.1021/ja01012a066 .
- ^ Джи, Юруи; Мао, Гуаннан; Ван, Йингинг; Бартлам, Марк (2013). «Структурное понимание механизмов биодеградации разнообразия и биодеградации N-алкане» . Границы в микробиологии . 4 : 58. doi : 10.3389/fmicb.2013.00058 . PMC 3604635 . PMID 23519435 .
- ^ Дашти, Нарджес; Али, Недаа; Элияс, Мохамед; Ханафер, Маджида; Сорхох, Назер А.; Радван, Самир С. (март 2015 г.). «Большинство углеводородокластических бактерий в общей среде являются диазотрофными, что подчеркивает их ценность в биоремедиации углеводородов загрязняющих веществ» . Микробы и среды . 30 (1): 70–75. doi : 10.1264/jsme2.me14090 . ISSN 1342-6311 . PMC 4356466 . PMID 25740314 .
- ^ Зигемунд, Гюнтер; Schwertfeger, Werner; Feiring, Эндрю; Умный, Брюс; Бер, Фред; Фогель, Херорд; МакКусик, Блейн. «Фториновые соединения, органические». Энциклопедия промышленной химии Уллмана . Вейнхайм: Wiley-VCH. Doi : 10.1002/14356007.a11_349 . ISBN 978-3527306732 .
- ^ Ю, Исаак Ф.; Уилсон, Джейк У.; Хартвиг, Джон Ф. (2023). «Катализируемое переходным металлом силилирование и борилирование связей C-H для синтеза и функционализации сложных молекул». Химические обзоры . 123 (19): 11619–63. doi : 10.1021/acs.chemrev.3c00207 . PMID 37751601 . S2CID 263150991 .
- ^ Jump up to: а беременный в Асингер, Фридрих (1967). Парафины; Химия и технология . Pergamon Press. OCLC 556032 .
- ^ Лакдавалла, Эмили. "Титан: Аризона в ледяной коробке?" Полем Архивировано из оригинала 6 апреля 2008 года . Получено 21 января 2004 года .
- ^ Mumma, MJ; Disanti, MA; Dello Russo, N.; Фоменкова, М.; Magee-Sauer, K.; Камински, CD; DX, Xie (1996). «Обнаружение обильного этана и метана, наряду с окисью углерода и водой, в комете C/1996 B2 Hyakutake: доказательства межзвездного происхождения». Наука . 272 (5266): 1310–4. Bibcode : 1996sci ... 272.1310M . doi : 10.1126/science.272.5266.1310 . PMID 8650540 . S2CID 27362518 .
- ^ Янссен, Ph; Кирс, М. (2008). «Структура архейного сообщества рубца» . Appl Environ Microbiol . 74 (12): 3619–25. Bibcode : 2008apenm..74.3619j . doi : 10.1128/aem.02812-07 . PMC 2446570 . PMID 18424540 .
- ^ Бучковский, Грегорз; Bertelsmeier, Cleo (15 января 2017 г.). «Инвазивные термиты в меняющемся климате: глобальная перспектива» . Экология и эволюция . 7 (3): 974–985. Bibcode : 2017ecoev ... 7..974b . doi : 10.1002/ECE3.2674 . PMC 5288252 . PMID 28168033 .
- ^ Блиц, Мэтт. «Действительно ли коровьи пердуны способствуют глобальному потеплению?» Полем Сегодня ofoundout.com . Получено 11 апреля 2018 года - через Gizmodo.
- ^ "Природный газ" . Библиотека ресурсов . Национальное географическое общество . Получено 11 апреля 2018 года .
- ^ Jump up to: а беременный Шмидт, Роланд; Грисбаум, Карл; Бер, Арно; Биденкапп, Дитер; Фогес, Хайнц-Вернер; Гарбе, Доротея; Патц, христианин; Коллин, Герд; Майер, Дитер; Хёк, Хартмут. «Углеводороды». Энциклопедия промышленной химии Уллмана . Вейнхайм: Wiley-VCH. Doi : 10.1002/14356007.a13_227.pub3 . ISBN 978-3527306732 .
- ^ Смит, Майкл Б.; Март, Джерри (2007), Advanced Organic Chemistry: реакции, механизмы и структура (6-е изд.), Нью-Йорк: Wiley-Interscience, p. 1790, ISBN 978-0-471-72091-1
- ^ Порядок, CR (1931). "In-Pentane". Органические синтезаторы . 11 : 84. doi : 10.1527/Organs.011.0084 .
- ^ «Использование пропана в качестве топлива» (PDF) . Архивировано из оригинала (PDF) 12 октября 2013 года . Получено 27 ноября 2012 года .
Дальнейшее чтение
[ редактировать ]- Виртуальный учебник по органической химии
- Визуализация кристаллических структур алканов до неана
- Редвуд, Бовертон (1911). . Encyclopædia Britannica . Тол. 20 (11 -е изд.). С. 752–756.

