мРНК-вакцина

мРНК - вакцина — это тип вакцины используется копия молекулы, называемой информационной РНК (мРНК). , в которой для создания иммунного ответа [ 1 ] Вакцина доставляет молекулы мРНК, кодирующей антиген, в иммунные клетки , которые используют созданную мРНК в качестве основы для создания чужеродного белка , который обычно вырабатывается патогеном ( например, вирусом ) или раковой клеткой . Эти белковые молекулы стимулируют адаптивный иммунный ответ , который учит организм идентифицировать и уничтожать соответствующий патоген или раковые клетки. [ 1 ] мРНК доставляется посредством совместной композиции РНК, инкапсулированной в липидные наночастицы , которые защищают цепи РНК и способствуют их абсорбции в клетки. [ 2 ] [ 3 ]
Реактогенность , склонность вакцины вызывать побочные реакции, аналогична таковой у обычных вакцин, не содержащих РНК. [ 4 ] У людей, склонных к аутоиммунному ответу , может возникнуть побочная реакция на вакцины с информационной РНК. [ 4 ] Преимуществами мРНК-вакцин перед традиционными вакцинами являются простота разработки, скорость и меньшая стоимость производства, индукция как клеточного , так и гуморального иммунитета , а также отсутствие взаимодействия с геномной ДНК . [ 5 ] [ 6 ] Хотя некоторые вакцины с информационной РНК, такие как вакцина Pfizer-BioNTech против COVID-19 , имеют тот недостаток, что их необходимо хранить в ультрахолоде . перед распространением [ 1 ] другие мРНК-вакцины, такие как вакцина Moderna , не предъявляют таких требований. [ 7 ]
В РНК-терапии вакцины с информационной РНК вызвали значительный интерес в качестве вакцин против COVID-19 . [ 1 ] В декабре 2020 года компании Pfizer-BioNTech и Moderna получили разрешение на использование своих вакцин против COVID-19 на основе мРНК. 2 декабря Агентство по регулированию лекарственных средств и товаров медицинского назначения Великобритании (MHRA) стало первым регулирующим органом в области лекарственных средств , утвердившим мРНК-вакцину, разрешив широкое использование вакцины Pfizer-BioNTech. [ 8 ] [ 9 ] [ 10 ] 11 декабря Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) выдало разрешение на экстренное использование вакцины Pfizer-BioNTech. [ 11 ] [ 12 ] а неделю спустя аналогичным образом санкционировали вакцину Moderna. [ 13 ] [ 14 ] В 2023 году Нобелевская премия по физиологии и медицине была присуждена Каталин Карико и Дрю Вайсману за открытия, касающиеся модифицированных нуклеозидов , которые позволили разработать эффективные мРНК-вакцины против COVID-19. [ 15 ] [ 16 ] [ 17 ]
История
Ранние исследования
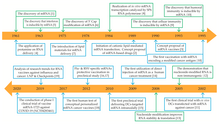
Первая успешная трансфекция разработанной мРНК, упакованной в липосомальную наночастицу, в клетку была опубликована в 1989 году. [ 18 ] [ 19 ] «Голую» (или незащищенную) мРНК лабораторного производства вводили год спустя в мышцу мышей. [ 3 ] [ 20 ] Эти исследования стали первым доказательством того, что транскрибируемая in vitro мРНК с выбранным геном способна доставлять генетическую информацию для производства желаемого белка в ткани живых клеток. [ 3 ] и привело к предложению концепции вакцин с информационной РНК. [ 21 ] [ 22 ] [ 23 ]
В 1993 году было показано , что инкапсулированная в липосомы мРНК, кодирующая вирусный антиген, стимулирует Т-клетки у мышей. [ 24 ] [ 25 ] В следующем году была разработана самоамплифицирующаяся мРНК, включающая как вирусный антиген, так и ген, кодирующий репликазу . [ 24 ] [ 26 ] Метод был использован на мышах для индукции как гуморального , так и клеточного иммунного ответа против вирусного патогена. [ 24 ] В следующем году было показано, что мРНК, кодирующая опухолевый антиген, вызывает аналогичный иммунный ответ против раковых клеток у мышей. [ 27 ] [ 28 ]
Разработка
Первое клиническое испытание на людях с использованием ex vivo, дендритных клеток трансфицированных мРНК, кодирующей опухолевые антигены ( терапевтическая раковая мРНК-вакцина ), было начато в 2001 году. [ 29 ] [ 30 ] Четыре года спустя было сообщено об успешном использовании модифицированных нуклеозидов в качестве метода транспортировки мРНК внутри клеток без срабатывания защитной системы организма. [ 29 ] [ 31 ] Результаты клинических испытаний мРНК-вакцины, непосредственно вводимой в организм против раковых клеток, были опубликованы в 2008 году. [ 32 ] [ 33 ]
BioNTech в 2008 году и Moderna в 2010 году были основаны для разработки биотехнологий мРНК. [ 34 ] [ 35 ] В это время американское исследовательское агентство DARPA запустило программу биотехнологических исследований ADEPT с целью разработки новых технологий для вооруженных сил США . [ 36 ] [ 37 ] Агентство осознало потенциал технологии нуклеиновых кислот для защиты от пандемий и начало инвестировать в эту область. [ 36 ] Гранты DARPA рассматривались как вотум доверия, который, в свою очередь, побудил другие правительственные учреждения и частных инвесторов инвестировать в технологию мРНК. [ 37 ] DARPA тогда предоставило компании Moderna грант в размере 25 миллионов долларов. [ 38 ]
Первые клинические испытания на людях мРНК-вакцины против инфекционного агента ( бешенства ) начались в 2013 году. [ 39 ] [ 40 ] В течение следующих нескольких лет были начаты клинические испытания мРНК-вакцин против ряда других вирусов. МРНК-вакцины для использования человеком были изучены на предмет инфекционных агентов, таких как грипп , [ 41 ] Вирус Зика , цитомегаловирус и вирус Чикунгунья . [ 42 ] [ 43 ]
Ускорение
Пандемия COVID-19 и секвенирование вызывающего его вируса SARS-CoV-2 в начале 2020 года привели к быстрой разработке первых одобренных мРНК-вакцин. [ 44 ] [ 45 ] BioNTech и Moderna в декабре того же года получили одобрение на свои вакцины против COVID-19 на основе мРНК . 2 декабря, через семь дней после последнего восьминедельного испытания, Агентство по регулированию лекарственных средств и товаров медицинского назначения Великобритании (MHRA) стало первым в истории глобальным регулятором лекарственных средств , одобрившим мРНК-вакцину, выдав экстренное разрешение на вакцину BNT162b2 от COVID-19 от Pfizer-BioNTech. вакцина для широкого применения. [ 8 ] [ 9 ] [ 46 ] 11 декабря FDA выдало разрешение на экстренное использование вакцины Pfizer-BioNTech против COVID-19, а неделей позже аналогичное одобрение для вакцины Moderna против COVID-19 . [ 47 ]
Другие мРНК-вакцины продолжают разрабатываться с момента утверждения первых мРНК-вакцин. Moderna объявила о разработке мРНК-вакцин от 15 заболеваний: вирус Чикунгунья , COVID-19, геморрагическая лихорадка Крым-Конго , денге , болезнь, вызванная вирусом Эбола , ВИЧ , малярия , болезнь, вызванная вирусом Марбург , лихорадка Ласса , коронавирус ближневосточного респираторного синдрома (MERS-CoV). ) , Нипах и генипавирусные заболевания, Лихорадка Рифт-Валли , Тяжелая лихорадка с синдромом тромбоцитопении , Туберкулез и Зика . [ 48 ] [ 49 ]
Компания Moderna также разрабатывает мРНК- вакцину против рака против меланомы мРНК-4157/V940 . [ 50 ] [ 51 ] [ 52 ]
Механизм

Цель вакцины — стимулировать адаптивную иммунную систему к созданию антител , которые точно нацелены на этот конкретный патоген . Маркеры патогена, на которые нацелены антитела, называются антигенами . [ 53 ]
Традиционные вакцины стимулируют выработку антител путем инъекции либо антигенов , либо аттенуированного (ослабленного) вируса, либо инактивированного (мертвого) вируса, либо рекомбинантного вирусного вектора антигеном , кодирующего антиген (безвредный вирус-носитель с трансгенным в организм ). Эти антигены и вирусы готовятся и выращиваются вне организма. [ 54 ] [ 55 ]
Напротив, мРНК-вакцины вызывают кратковременный эффект. [ 56 ] синтетически созданный фрагмент последовательности РНК вируса в организм прививаемого человека. Эти фрагменты мРНК поглощаются дендритными клетками посредством фагоцитоза . [ 57 ] Дендритные клетки используют свои внутренние механизмы ( рибосомы ) для чтения мРНК и производства вирусных антигенов, которые кодирует мРНК. [ 4 ] Организм разрушает фрагменты мРНК в течение нескольких дней после введения. [ 58 ] Хотя неиммунные клетки потенциально также могут поглощать мРНК вакцины, продуцировать антигены и отображать антигены на своей поверхности, дендритные клетки поглощают глобулы мРНК гораздо легче. [ 59 ] Фрагменты мРНК транслируются в цитоплазме и не влияют на геномную ДНК организма, расположенную отдельно в ядре клетки . [ 1 ] [ 60 ]
Как только вирусные антигены продуцируются клеткой-хозяином, происходят нормальные процессы адаптивной иммунной системы. Антигены расщепляются протеасомами . класса I и класса II Молекулы MHC затем прикрепляются к антигену и транспортируют его к клеточной мембране, «активируя» дендритную клетку. [ 60 ] После активации дендритные клетки мигрируют в лимфатические узлы , где они представляют антиген Т- клеткам и В- . [ 61 ] Это запускает выработку антител, специально нацеленных на антиген, что в конечном итоге приводит к развитию иммунитета . [ 53 ]
мРНК

Центральным компонентом мРНК-вакцины является ее конструкция мРНК. [ 62 ] мРНК in vitro Транскрибируемая создается из сконструированной плазмидной ДНК, которая имеет промотор РНК-полимеразы и последовательность, соответствующую конструкции мРНК. Объединив фага Т7 РНК-полимеразу и плазмидную ДНК, мРНК можно транскрибировать в лаборатории. Эффективность вакцины зависит от стабильности и структуры разработанной мРНК. [ 4 ]
мРНК Транскрибируемая in vitro имеет те же структурные компоненты, что и природная мРНК в эукариотических клетках . Он имеет 5'-кэп , 5'-нетранслируемую область (UTR) и 3'-UTR , открытую рамку считывания (ORF), которая кодирует соответствующий антиген, и 3'-поли(А) хвост . Модифицируя эти различные компоненты синтетической мРНК, можно повысить стабильность и трансляционную способность мРНК и, в свою очередь, повысить эффективность вакцины. [ 62 ]
мРНК можно улучшить с помощью синтетических аналогов 5'-кэпа, которые повышают стабильность и усиливают трансляцию белка. Аналогичным образом, регуляторные элементы в 5'-нетранслируемой области и 3'-нетранслируемой области могут быть изменены, а длина поли(А)-хвоста оптимизирована для стабилизации мРНК и увеличения продукции белка. мРНК Нуклеотиды можно модифицировать, чтобы уменьшить активацию врожденного иммунитета мРНК и увеличить период полураспада в клетке-хозяине. Последовательность нуклеиновой кислоты и использование кодонов влияют на трансляцию белка. Обогащение последовательности содержанием гуанина-цитозина улучшает стабильность и период полураспада мРНК и, в свою очередь, продукцию белка. Замена редких кодонов синонимичными кодонами, часто используемыми клеткой-хозяином, также увеличивает выработку белка. [ 4 ]
Доставка

Чтобы вакцина была успешной, в цитоплазму клетки-хозяина должно попасть достаточное количество мРНК , чтобы стимулировать выработку специфических антигенов. Однако проникновение молекул мРНК сталкивается с рядом трудностей. Молекулы мРНК не только слишком велики, чтобы проникнуть через клеточную мембрану путем простой диффузии , но они также отрицательно заряжены, как и клеточная мембрана, что вызывает взаимное электростатическое отталкивание . Кроме того, мРНК легко разрушается РНКазами кожи и крови. [ 60 ]
Для преодоления этих препятствий при доставке были разработаны различные методы. Метод доставки вакцины можно в общих чертах классифицировать по тому, происходит ли перенос мРНК в клетки внутри ( in vivo ) или снаружи ( ex vivo ) организма. [ 60 ] [ 3 ]
Экс виво
Дендритные клетки отображают антигены на своей поверхности , что приводит к взаимодействию с Т-клетками и инициированию иммунного ответа. Дендритные клетки можно собрать у пациентов и запрограммировать с помощью желаемой мРНК, а затем ввести обратно пациентам для создания иммунного ответа. [ 63 ]
Самый простой способ поглощения молекул мРНК дендритными клетками ex vivo - это эндоцитоз , довольно неэффективный путь в лабораторных условиях, который можно значительно улучшить с помощью электропорации . [ 60 ]
В естественных условиях
С момента открытия того, что прямое введение транскрибируемой in vitro мРНК приводит к экспрессии антигенов в организме, in vivo . были исследованы подходы [ 20 ] Они предлагают некоторые преимущества перед методами ex vivo , в частности, позволяют избежать затрат на сбор и адаптацию дендритных клеток у пациентов, а также за счет имитации обычной инфекции. [ 60 ]
Различные пути инъекции , например, в кожу , кровь или мышцы , приводят к разным уровням поглощения мРНК, что делает выбор пути введения критическим аспектом доставки in vivo . Одно исследование при сравнении различных путей показало, что инъекция в лимфатические узлы приводит к наибольшему ответу Т-клеток. [ 64 ]
Инъекция голой мРНК
Голая инъекция мРНК означает, что доставка вакцины осуществляется только в буферном растворе . [ 65 ] Этот способ поглощения мРНК известен с 1990-х годов. [ 20 ] В первых мировых клинических исследованиях для вакцинации использовались внутрикожные инъекции обнаженной мРНК. [ 66 ] [ 67 ] Для доставки голой мРНК использовались различные методы, такие как подкожные, внутривенные и внутриопухолевые инъекции. Хотя доставка «голой» мРНК вызывает иммунный ответ, эффект относительно слабый, и после инъекции мРНК часто быстро разрушается. [ 60 ]
Полимерные и пептидные векторы
Катионные полимеры можно смешивать с мРНК для создания защитных покрытий, называемых полиплексами . Они защищают рекомбинантную мРНК от рибонуклеаз и способствуют ее проникновению в клетки. Протамин представляет собой природный катионный пептид , который использовался для инкапсуляции мРНК при вакцинации. [ 68 ] [ нужен неосновной источник ] [ 69 ]
Вектор липидных наночастиц

Впервые FDA одобрило использование липидных наночастиц в качестве системы доставки лекарств в 2018 году, когда агентство одобрило первый siRNA препарат Onpattro . [ 70 ] Инкапсулирование молекулы мРНК в липидные наночастицы стало решающим прорывом в производстве жизнеспособных мРНК-вакцин, разрешив ряд ключевых технических барьеров при доставке молекулы мРНК в клетку-хозяина. [ 70 ] [ 71 ] Исследования по использованию липидов для доставки миРНК в клетки стали основой для аналогичных исследований по использованию липидов для доставки мРНК. [ 72 ] Однако пришлось изобрести новые липиды для инкапсуляции нитей мРНК, которые намного длиннее, чем нити миРНК. [ 72 ]
По сути, липид обеспечивает уровень защиты от деградации, обеспечивая более надежный результат трансляции. Кроме того, настройка внешнего слоя липида позволяет нацеливаться на нужные типы клеток посредством взаимодействия лигандов . Однако многие исследования также подчеркнули сложность изучения этого типа доставки, продемонстрировав несоответствие между in vivo и in vitro с точки зрения клеточного поступления. применением наночастиц [ 73 ] Наночастицы можно вводить в организм и транспортировать несколькими путями, например, внутривенно или через лимфатическую систему . [ 70 ]
Одна из проблем, связанных с липидными наночастицами, заключается в том, что некоторые из прорывов, ведущих к практическому использованию этой технологии, связаны с использованием микрофлюидики . Микрофлюидные реакционные камеры трудно масштабировать, поскольку весь смысл микрофлюидики заключается в использовании микромасштабного поведения жидкостей. Единственный способ обойти это препятствие — параллельная работа большого количества микрофлюидных реакционных камер. Это новая задача, требующая специально изготовленного оборудования. [ 74 ] [ 75 ] Для мРНК-вакцин против COVID-19 это было основным узким местом производства. Pfizer использовала такой параллельный подход для решения проблемы масштабирования. Убедившись, что смесители с ударной струей невозможно масштабировать напрямую, [ 76 ] Компания Pfizer изготовила около 100 маленьких миксеров (каждый размером с монету в полдоллара США ), соединила их вместе с насосами и фильтрами «лабиринтом труб». [ 77 ] [ 78 ] и установил компьютерную систему для регулирования потока и давления в смесителях. [ 76 ]
Другой проблемой, связанной с широкомасштабным использованием этого метода доставки, является доступность новых липидов, используемых для создания липидных наночастиц, особенно ионизируемых катионных липидов. До 2020 года такие липиды производились в небольших количествах, измеряемых в граммах или килограммах, и использовались для медицинских исследований, а также в ряде лекарств для лечения редких заболеваний. Когда в 2020 году безопасность и эффективность мРНК-вакцин стала очевидна, немногие компании, способные производить необходимые липиды, столкнулись с проблемой увеличения производства для удовлетворения заказов на несколько тонн липидов. [ 75 ] [ 79 ]
Вирусный вектор
В дополнение к невирусным методам доставки РНК-вирусы были созданы для достижения аналогичных иммунологических ответов. Типичные РНК-вирусы, используемые в качестве векторов, включают ретровирусы , лентивирусы , альфавирусы и рабдовирусы , каждый из которых может различаться по структуре и функциям. [ 80 ] В клинических исследованиях такие вирусы использовались при лечении ряда заболеваний на модельных животных, таких как мыши , курицы и приматы . [ 81 ] [ 82 ] [ 83 ]
Преимущества
Традиционные вакцины
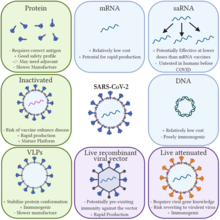
мРНК-вакцины обладают особыми преимуществами по сравнению с традиционными вакцинами . [ 4 ] [ 5 ] Поскольку мРНК-вакцины не состоят из активного патогена (или даже инактивированного патогена), они неинфекционны. Напротив, традиционные вакцины требуют производства патогенов, что, если производить его в больших объемах, может увеличить риски локализованных вспышек вируса на производственном объекте. [ 5 ] Еще одним биологическим преимуществом мРНК-вакцин является то, что, поскольку антигены производятся внутри клетки, они стимулируют клеточный иммунитет , а также гуморальный иммунитет . [ 6 ] [ 84 ]
Преимущество мРНК-вакцин в производстве состоит в том, что их можно быстро разработать. Компания Moderna разработала вакцину мРНК-1273 от COVID-19 за 2 дня. [ 85 ] Их также можно производить быстрее, дешевле и более стандартизированным способом (с меньшим количеством ошибок в производстве), что может улучшить реагирование на серьезные вспышки. [ 4 ] [ 5 ]
Первоначально для массового производства вакцины Pfizer-BioNTech требовалось 110 дней (до того, как Pfizer начала оптимизировать производственный процесс до 60 дней), что было значительно быстрее, чем традиционные вакцины против гриппа и полиомиелита. [ 77 ] ДНК-РНК В рамках этого более длительного периода фактическое время производства составляет всего около 22 дней: две недели для молекулярного клонирования ДНК-плазмид и очистки ДНК, четыре дня для транскрипции и очистки мРНК и четыре дня для инкапсуляции мРНК в липид. наночастицы с последующим заполнением и отделкой . [ 86 ] Большая часть времени, необходимого для каждого производственного цикла, отводится строгому контролю качества на каждом этапе. [ 77 ]
ДНК-вакцины
Помимо преимуществ теоретических ДНК-вакцин перед традиционными вакцинами , мРНК-вакцины также имеют дополнительные преимущества перед ДНК-вакцинами. мРНК ядро транслируется и в цитозоле , поэтому нет необходимости для РНК проникать в клетки риск интеграции в геном хозяина. предотвращается [ 3 ] Модифицированные нуклеозиды (например, псевдоуридины , 2'-O-метилированные нуклеозиды) могут быть включены в мРНК для подавления стимуляции иммунного ответа , чтобы избежать немедленной деградации и обеспечить более стойкий эффект за счет повышенной способности трансляции. [ 31 ] [ 87 ] [ 88 ] Открытая рамка считывания (ORF) и нетранслируемые области (UTR) мРНК могут быть оптимизированы для различных целей (процесс, называемый инженерией последовательности мРНК), например, путем увеличения содержания гуанина-цитозина или выбора конкретных UTR, которые, как известно, увеличивают трансляцию. [ 57 ] Дополнительная кодировка ORF для механизма репликации может быть добавлена для усиления трансляции антигена и, следовательно, иммунного ответа, уменьшая количество необходимого исходного материала. [ 89 ] [ 90 ]
Недостатки
Хранилище
Поскольку мРНК хрупка, некоторые вакцины необходимо хранить при очень низких температурах, чтобы избежать разложения и, таким образом, не дать реципиенту эффективного иммунитета. компании Pfizer-BioNTech Вакцину мРНК BNT162b2 следует хранить при температуре от -80 до -60 °C (от -112 до -76 °F). [ 91 ] [ 92 ] Moderna утверждает, что их вакцина мРНК-1273 может храниться при температуре от -25 до -15 °C (от -13 до 5 °F). [ 93 ] что сравнимо с домашней морозильной камерой, [ 92 ] и что он остается стабильным при температуре от 2 до 8 ° C (от 36 до 46 ° F) до 30 дней. [ 93 ] [ 94 ] В ноябре 2020 года журнал Nature сообщил: «Хотя различия в составах ЛНП или вторичных структурах мРНК могут объяснить различия в термостабильности [между Moderna и BioNtech], многие эксперты подозревают, что оба вакцинных продукта в конечном итоге будут иметь одинаковые требования к хранению и сроки годности. в различных температурных условиях». [ 84 ] Изучаются несколько платформ, которые могут обеспечить хранение при более высоких температурах. [ 4 ]
Недавний
До 2020 года ни одна технологическая платформа мРНК (лекарство или вакцина) не была разрешена для использования на людях, поэтому существовал риск неизвестных эффектов. [ 84 ] Пандемия COVID-19 2020 года потребовала более быстрого производства мРНК-вакцин, сделала их привлекательными для национальных организаций здравоохранения и привела к дебатам о типе первоначального разрешения, которое должны получить мРНК-вакцины (включая разрешение на экстренное использование или разрешение на расширенный доступ ) после восьмилетнего периода. недельный период послефинальных испытаний на людях. [ 95 ] [ 96 ]
Побочные эффекты
Реактогенность аналогична реактогенности обычных вакцин, не содержащих РНК. Однако у людей, подверженных аутоиммунному ответу , может возникнуть побочная реакция на мРНК-вакцины. [ 4 ] Нити мРНК в вакцине могут вызвать непреднамеренную иммунную реакцию – это приводит к тому, что организм считает себя больным , и в результате человек чувствует себя так, как будто он болен. Чтобы свести это к минимуму, последовательности мРНК в мРНК-вакцинах имитируют последовательности, продуцируемые клетками-хозяевами. [ 5 ]
Сильные, но временные реактогенные эффекты были зарегистрированы в ходе испытаний новых мРНК-вакцин против COVID-19; большинство людей не будут испытывать серьезных побочных эффектов, включая лихорадку и усталость. Тяжелые побочные эффекты определяются как те, которые препятствуют повседневной деятельности. [ 97 ]
Эффективность
Вакцины мРНК против COVID-19 от Moderna и Pfizer-BioNTech имеют эффективность от 90 до 95 процентов. [ нужна ссылка ] Предыдущие испытания мРНК на других патогенах, кроме COVID-19, не были эффективными, и от них пришлось отказаться на ранних стадиях испытаний. Причина эффективности новых мРНК-вакцин не ясна. [ 98 ]
Врач-ученый Маргарет Лю заявила, что эффективность новых мРНК-вакцин против COVID-19 может быть обусловлена «огромным объемом ресурсов», которые были потрачены на разработку, или что вакцины могут «вызывать неспецифическую воспалительную реакцию на мРНК, которая может усилить его специфический иммунный ответ, учитывая, что модифицированный нуклеозидный метод уменьшил воспаление, но не устранил его полностью», и что «это также может объяснить интенсивные реакции, такие как боли и лихорадка, о которых сообщалось у некоторых реципиентов мРНК SARS-CoV- 2 вакцины». Эти реакции, хотя и были тяжелыми, были временными, и другая точка зрения состоит в том, что они считались реакцией на липидные молекулы доставки лекарств. [ 98 ]
Нерешительность
Существует дезинформация, предполагающая, что мРНК-вакцины могут изменить ДНК в ядре. [ 99 ] мРНК в цитозоле очень быстро разрушается, прежде чем она успевает проникнуть в ядро клетки. Фактически, мРНК-вакцины должны храниться при очень низкой температуре и без РНКаз , чтобы предотвратить деградацию мРНК. Ретровирус может представлять собой одноцепочечную РНК (так же, как многие вакцины против SARS-CoV-2 представляют собой одноцепочечную РНК), которая проникает в ядро клетки и использует обратную транскриптазу для создания ДНК из РНК в ядре клетки. У ретровируса есть механизмы импорта в ядро, но у других мРНК (например, вакцины) эти механизмы отсутствуют. Попав внутрь ядра, создание ДНК из РНК не может произойти без обратной транскриптазы и соответствующих праймеров , которые сопровождают ретровирус, но которые не присутствовали бы для другой экзогенной мРНК (например, вакцины), даже если бы она могла проникнуть в ядро. [ 100 ]
Усиление
В мРНК-вакцинах используются либо неамплицирующие (обычные) мРНК, либо самоамплифицирующиеся мРНК. [ 101 ] В вакцинах Pfizer–BioNTech и Moderna используется неамплицирующая мРНК. Оба типа мРНК продолжают исследоваться в качестве методов создания вакцин против других потенциальных патогенов и рака. [ 32 ]
Неусилительный

В первоначальных мРНК-вакцинах используется неамплицирующая конструкция мРНК. [ 69 ] Неамплифицирующая мРНК имеет только одну открытую рамку считывания , которая кодирует интересующий антиген. [ 101 ] Общее количество мРНК, доступное клетке, равно количеству, доставленному вакциной. Сила дозы ограничена количеством мРНК, которое может быть доставлено вакциной. [ 102 ] Неамплифицирующие вакцины заменяют уридин N1 -метилпсевдуридином в попытке снизить токсичность. [ 103 ]
Самоусиливающийся
Вакцины с самоамплифицирующейся мРНК (саРНК) реплицируют свою мРНК после трансфекции. [ 104 ] Самоамплифицирующаяся мРНК имеет две открытые рамки считывания . Первая рамка, как и обычная мРНК, кодирует интересующий антиген. Вторая рамка кодирует РНК-зависимую РНК-полимеразу (и ее вспомогательные белки), которая реплицирует конструкцию мРНК в клетке. Это позволяет использовать меньшие дозы вакцины. [ 104 ] Механизмы и, следовательно, оценка самоамплификации мРНК могут быть разными, поскольку самоамплифицирующаяся мРНК представляет собой гораздо большую молекулу. [ 3 ]
Исследуемые SaRNA-вакцины включают вакцину против малярии . [ 105 ] В 2021 году компания Gritstone Bio начала первую фазу испытаний вакцины saRNA против COVID-19, используемой в качестве ревакцинации . Вакцина предназначена для воздействия как на шиповидный белок вируса SARS-CoV-2 , так и на вирусные белки, которые могут быть менее склонны к генетическим вариациям, чтобы обеспечить большую защиту от вариантов SARS-CoV-2. [ 106 ] [ 107 ] Вакцины saRNA должны использовать уридин, который необходим для репродукции. [ 103 ]
См. также
- ДНК-вакцина
- Модифицированная нуклеозидами информационная РНК
- РНК-терапия
- Хронология создания человеческих вакцин
Ссылки
- ^ Перейти обратно: а б с д и Пак К.С., Сан Икс, Эйкинс М.Э., Мун Дж.Дж. (декабрь 2020 г.). «Системы доставки невирусной вакцины против COVID-19» . Обзоры расширенной доставки лекарств . 169 : 137–51. дои : 10.1016/j.addr.2020.12.008 . ПМЦ 7744276 . ПМИД 33340620 .
- ^ Ковальски П.С., Рудра А., Мяо Л., Андерсон Д.Г. (апрель 2019 г.). «Доставка посланника: достижения в области технологий терапевтической доставки мРНК» . Мол Тер . 27 (4): 710–28. дои : 10.1016/j.ymthe.2019.02.012 . ПМК 6453548 . ПМИД 30846391 .
- ^ Перейти обратно: а б с д и ж Вербеке Р., Лентакер И., Де Смедт СК, Девитте Х (октябрь 2019 г.). «Три десятилетия разработки вакцины с информационной РНК» . Нано сегодня . 28 : 100766. doi : 10.1016/j.nantod.2019.100766 . hdl : 1854/LU-8628303 . S2CID 202221207 . Архивировано из оригинала 11 января 2021 года . Проверено 8 декабря 2020 г.
- ^ Перейти обратно: а б с д и ж г час я Парди Н., Хоган М.Дж., Портер Ф.В., Вайсман Д. (апрель 2018 г.). «МРНК-вакцины — новая эра в вакцинологии» . Nature Reviews Открытие лекарств . 17 (4): 261–279. дои : 10.1038/nrd.2017.243 . ISSN 1474-1784 . ПМЦ 5906799 . ПМИД 29326426 .
- ^ Перейти обратно: а б с д и Фонд ПХГ (2019). «РНК-вакцины: введение» . Кембриджский университет . Архивировано из оригинала 6 декабря 2018 года . Проверено 18 ноября 2020 г. .
- ^ Перейти обратно: а б Крампс Т., Элдерс К. (2017). «Введение в РНК-вакцины». РНК-вакцины: методы и протоколы . Методы молекулярной биологии. Том. 1499. стр. 1–11. дои : 10.1007/978-1-4939-6481-9_1 . ISBN 978-1-4939-6479-6 . ПМИД 27987140 .
- ^ Кроммелин DJ, Anchordoquy TJ, Волкин Д.Б., Джискут В., Мастробаттиста Э (март 2021 г.). «Решение холодной реальности стабильности мРНК-вакцин» . Журнал фармацевтических наук . 110 (3): 997–1001. дои : 10.1016/j.xphs.2020.12.006 . ISSN 0022-3549 . ПМЦ 7834447 . ПМИД 33321139 .
- ^ Перейти обратно: а б «Великобритания разрешает Pfizer/BioNTech вакцину против COVID-19» (пресс-релиз). Департамент здравоохранения и социальной защиты . 2 декабря 2020 г. Архивировано из оригинала 2 декабря 2020 г. Проверено 2 декабря 2020 г.
- ^ Перейти обратно: а б Бозли С., Холлидей Дж. (2 декабря 2020 г.). «Великобритания одобрила внедрение вакцины Pfizer/BioNTech Covid на следующей неделе» . Хранитель . Архивировано из оригинала 2 декабря 2020 года . Проверено 2 декабря 2020 г.
- ^ «Условия авторизации вакцины Pfizer/BioNTech против COVID-19» (Решение). Агентство по регулированию лекарственных средств и товаров медицинского назначения. 8 декабря 2020 г. Архивировано из оригинала 7 декабря 2020 г. . Проверено 10 декабря 2020 г.
- ^ «FDA принимает ключевые меры в борьбе с COVID-19, выдавая разрешение на экстренное использование первой вакцины против COVID-19» . США Управление по контролю за продуктами и лекарствами (FDA) (пресс-релиз). 11 декабря 2020 года. Архивировано из оригинала 31 января 2021 года . Проверено 6 февраля 2021 г.
- ^ Оливер С.Е., Гаргано Дж.В., Марин М., Уоллес М., Карран К.Г., Чемберленд М. и др. (декабрь 2020 г.). «Временная рекомендация Консультативного комитета по практике иммунизации по использованию вакцины Pfizer-BioNTech против COVID-19 – США, декабрь 2020 г.» (PDF) . MMWR Morb Mortal Wkly Rep . 69 (50): 1922–24. дои : 10.15585/mmwr.mm6950e2 . ПМЦ 7745957 . ПМИД 33332292 . Архивировано (PDF) из оригинала 19 декабря 2020 г. Проверено 7 февраля 2021 г.
- ^ «FDA принимает дополнительные меры в борьбе с COVID-19, выдавая разрешение на экстренное использование второй вакцины против COVID-19» . США Управление по контролю за продуктами и лекарствами (FDA) (пресс-релиз). 18 декабря 2020 года. Архивировано из оригинала 19 декабря 2020 года . Проверено 21 декабря 2020 г. .
- ^ Оливер С.Е., Гаргано Дж.В., Марин М., Уоллес М., Карран К.Г., Чемберленд М. и др. (январь 2021 г.). «Временная рекомендация Консультативного комитета по практике иммунизации по использованию вакцины Moderna против COVID-19 – США, декабрь 2020 г.» (PDF) . MMWR Morb Mortal Wkly Rep . 69 (5152): 1653–56. doi : 10.15585/mmwr.mm695152e1 . ПМК 9191904 . ПМИД 33382675 . S2CID 229945697 . Архивировано (PDF) из оригинала 9 февраля 2021 года . Проверено 7 февраля 2021 г.
- ^ «Нобелевская премия по физиологии и медицине 2023 года» . NobelPrize.org . Проверено 3 октября 2023 г.
- ^ «Венгерские и американские учёные получили Нобелевскую премию за открытие вакцины против COVID-19» . Рейтер . 2 октября 2023 г. Проверено 3 октября 2023 г.
- ^ «Нобелевская премия по физиологии и медицине 2023 года» . NobelPrize.org . Проверено 3 октября 2023 г.
- ^ Сюй С., Ян К., Ли Р., Чжан Л. (сентябрь 2020 г.). «Механизмы эры мРНК-вакцин, лекарственная платформа и клинические перспективы» . Международный журнал молекулярных наук . 21 (18): 6582. doi : 10.3390/ijms21186582 . ПМЦ 7554980 . ПМИД 32916818 .
Инициирование катионной липид-опосредованной трансфекции мРНК; Концептуальное предложение препаратов на основе мРНК
- ^ Мэлоун Р.В. , Фельгнер П.Л. [на немецком языке] , Верма И.М. (август 1989 г.). «Трансфекция РНК, опосредованная катионными липосомами» . Труды Национальной академии наук Соединенных Штатов Америки . 86 (16): 6077–81. Бибкод : 1989PNAS...86.6077M . дои : 10.1073/pnas.86.16.6077 . ПМК 297778 . ПМИД 2762315 .
- ^ Перейти обратно: а б с Вольф Дж.А. , Мэлоун Р.В. , Уильямс П., Чонг В., Аксади Г., Яни А., Фельгнер П.Л. [на немецком языке] (март 1990 г.). «Прямой перенос генов в мышцы мыши in vivo». Наука . 247 (4949, ч. 1): 1465–8. Бибкод : 1990Sci...247.1465W . дои : 10.1126/science.1690918 . ПМИД 1690918 .
- ^ Мэй М (31 мая 2021 г.). «После успехов в борьбе с COVID-19 исследователи стремятся разработать мРНК-вакцины для других заболеваний» . Природа . Архивировано из оригинала 13 октября 2021 года . Проверено 31 июля 2021 г.
Когда широкий спектр вакцин против COVID-19 тестировался в клинических испытаниях, лишь немногие эксперты ожидали, что непроверенная технология мРНК станет звездой. В течение 10 месяцев мРНК-вакцины были первыми одобренными и наиболее эффективными. Хотя это первые мРНК-вакцины, которые были одобрены, история мРНК-вакцин началась более 30 лет назад, и на ее пути было много препятствий. В 1990 году покойный врач-ученый Джон Вольф и его коллеги из Университета Висконсина ввели мРНК мышам, что заставило клетки мышей производить закодированные белки. Во многих отношениях эта работа послужила первым шагом на пути к созданию вакцины из мРНК, но предстояло пройти долгий путь — и для многих приложений его предстоит еще пройти.
- ^ Сюй С., Ян К., Ли Р., Чжан Л. (сентябрь 2020 г.). «Механизмы эры мРНК-вакцин, лекарственная платформа и клинические перспективы» . Международный журнал молекулярных наук . 21 (18): 6582. doi : 10.3390/ijms21186582 . ПМЦ 7554980 . ПМИД 32916818 .
Предложение концепции мРНК-вакцин (1990 г.)
- ^ Патент: WO1990011092. Архивировано 14 октября 2021 г. в Wayback Machine ; Изобретатели: Филип Л. Фельгнер, Джон Ашер Вольф, Гэри Х. Роудс, Роберт Уоллес Мэлоун, Деннис А. Карсон; Правопреемники: Vical Inc., Фонд исследований выпускников штата Висконсин; Название: « Экспрессия экзогенных полинуклеотидных последовательностей у позвоночных. Архивировано 9 декабря 2021 года в Wayback Machine »; (Цитата: «Настоящее изобретение относится к введению обнаженных последовательностей ДНК и РНК позвоночному для достижения контролируемой экспрессии полипептида. Оно полезно в генной терапии, вакцинации и в любой терапевтической ситуации, в которой полипептид следует вводить в клетки vivo"; Пример 8: вакцинация мышей мРНК для продукции белка gpl20 вируса ВИЧ); Дата приоритета: 21 марта 1989 г.; Дата публикации: 4 октября 1990 г.
- ^ Перейти обратно: а б с Пасколо С. (август 2004 г.). «Вакцины на основе мессенджерной РНК». Экспертное мнение о биологической терапии . 4 (8): 1285–94. дои : 10.1517/14712598.4.8.1285 . ПМИД 15268662 . S2CID 19350848 .
- ^ Мартинон Ф., Кришнан С., Ленцен Г., Магне Р., Гомар Э., Гийе Дж.Г. и др. (июль 1993 г.). «Индукция вирусспецифических цитотоксических Т-лимфоцитов in vivo с помощью мРНК, заключённой в липосомах». Европейский журнал иммунологии . 23 (7): 1719–22. дои : 10.1002/eji.1830230749 . ПМИД 8325342 . S2CID 42640967 .
- ^ Чжоу X, Берглунд П., Роудс Г., Паркер С.Е., Джондал М., Лильестрём П. (декабрь 1994 г.). «Самореплицирующаяся РНК вируса леса Семлики как рекомбинантная вакцина». Вакцина . 12 (16): 1510–14. дои : 10.1016/0264-410x(94)90074-4 . ПМИД 7879415 .
- ^ Каллен К.Дж., Тесса А. (январь 2014 г.). «Развитие, которое может перерасти в революцию в медицине: мРНК как основа для новых вакцин и лекарств на основе нуклеотидов» . Терапевтические достижения в области вакцин . 2 (1): 10–31. дои : 10.1177/2051013613508729 . ПМЦ 3991152 . ПМИД 24757523 .
- ^ Конри Р.М., ЛоБульо А.Ф., Райт М., Сумерел Л., Пайк М.Дж., Йоханнинг Ф. и др. (апрель 1995 г.). «Характеристика полинуклеотидного вакцинного вектора с информационной РНК». Исследования рака . 55 (7): 1397–400. ПМИД 7882341 .
- ^ Перейти обратно: а б Сахин У, Карико К, Тюречи О (октябрь 2014 г.). «Терапия на основе мРНК — разработка нового класса лекарств» . Nature Reviews Открытие лекарств . 13 (10): 759–80. дои : 10.1038/nrd4278 . ISSN 1474-1784 . ПМИД 25233993 .
- ^ Хейзер А., Коулман Д., Даннулл Дж., Янси Д., Морис М.А., Лаллас К.Д. и др. (февраль 2002 г.). «Аутологичные дендритные клетки, трансфицированные РНК простата-специфического антигена, стимулируют реакцию CTL против метастатических опухолей простаты» . Журнал клинических исследований . 109 (3): 409–17. дои : 10.1172/JCI14364 . ISSN 0021-9738 . ПМК 150859 . ПМИД 11828001 .
- ^ Перейти обратно: а б Карико К. , Бакштейн М., Ни Х., Вайсман Д. (август 2005 г.). «Подавление распознавания РНК Toll-подобными рецепторами: влияние модификации нуклеозидов и эволюционное происхождение РНК» . Иммунитет . 23 (2): 165–75. doi : 10.1016/j.immuni.2005.06.008 . ПМИД 16111635 .
- ^ Перейти обратно: а б Блэкни А.К., Ип С., Гилл А.Дж. (январь 2021 г.). «Обновленная информация о разработке самоамплифицированной мРНК-вакцины» . Вакцина . 9 (2): 97. doi : 10.3390/vaccines9020097 . ПМЦ 7911542 . ПМИД 33525396 .
- ^ Вейде Б., Карралот Дж.П., Риз А., Шил Б., Эйджентлер Т.К., Хорр И. и др. (февраль – март 2008 г.). «Результаты первого клинического исследования фазы I/II вакцинации с прямой инъекцией мРНК». Журнал иммунотерапии . 31 (2): 180–8. дои : 10.1097/CJI.0b013e31815ce501 . ПМИД 18481387 . S2CID 8233422 .
- ^ «Основатели BioNTech: пара ученых в центре внимания всего мира» . Франция 24 . 13 ноября 2020 года. Архивировано из оригинала 14 февраля 2021 года . Проверено 31 июля 2021 г.
- ^ Гарад Д (10 ноября 2020 г.). «История мРНК: как когда-то отвергнутая идея стала ведущей технологией в гонке вакцин против Covid» . Стат . Архивировано из оригинала 10 ноября 2020 года . Проверено 16 ноября 2020 г.
- ^ Перейти обратно: а б Зонне П (30 июля 2020 г.). «Как секретное агентство Пентагона заложило основу для быстрого лечения коронавируса» . Вашингтон Пост . Архивировано из оригинала 2 августа 2021 года . Проверено 21 июня 2021 г.
- ^ Перейти обратно: а б Усдин С (19 марта 2020 г.). «Авантюры DARPA, возможно, породили наилучшие надежды на остановку COVID-19» . БиоСентьюри . Архивировано из оригинала 18 июня 2021 года . Проверено 19 июня 2021 г.
- ^ «DARPA наградило Moderna Therapeutics грантом на сумму до 25 миллионов долларов на разработку терапии с использованием мессенджерной РНК» (пресс-релиз). 2 октября 2013 г. Архивировано из оригинала 2 июня 2021 г. Проверено 31 мая 2021 г.
- ^ Долгин Э. (сентябрь 2021 г.). «Запутанная история мРНК-вакцин». Природа . 597 (7876): 318–24. Бибкод : 2021Natur.597..318D . дои : 10.1038/d41586-021-02483-w . ISSN 0028-0836 . ПМИД 34522017 . S2CID 237515383 .
- ^ Альберер М., Гнад-Фогт У., Хонг Х.С., Мехр К.Т., Бакерт Л., Финак Г. и др. (сентябрь 2017 г.). «Безопасность и иммуногенность мРНК-вакцины против бешенства у здоровых взрослых: открытое нерандомизированное проспективное первое клиническое исследование фазы 1 на людях». Ланцет . 390 (10101): 1511–20. дои : 10.1016/S0140-6736(17)31665-3 . ПМИД 28754494 . S2CID 7700297 .
- ^ Долгин Э. (ноябрь 2021 г.). «Прививки от гриппа мРНК переходят в испытания». Nature Reviews Открытие лекарств . 20 (11): 801–3. дои : 10.1038/d41573-021-00176-7 . ПМИД 34635829 . S2CID 238637957 .
- ^ Хоу Х, Закс Т, Лангер Р, Донг Й (август 2021 г.). «Липидные наночастицы для доставки мРНК» . Материалы обзоров природы . 6 (12): 1078–94. Бибкод : 2021NatRM...6.1078H . дои : 10.1038/s41578-021-00358-0 . ISSN 2058-8437 . ПМЦ 8353930 . ПМИД 34394960 .
- ^ «COVID-19 и ваше здоровье» . Центры по контролю и профилактике заболеваний . 11 февраля 2020 года. Архивировано из оригинала 3 марта 2021 года . Проверено 26 ноября 2020 г.
- ^ Болл П (январь 2021 г.). «Молниеносный поиск вакцин против COVID — и что это значит для других болезней». Природа . 589 (7840): 16–18. Бибкод : 2021Natur.589...16B . дои : 10.1038/d41586-020-03626-1 . ПМИД 33340018 . S2CID 229324351 .
- ^ Уэрри Э.Дж., Джаффи Э.М., Уоррен Н., Д'Суза Дж., Рибас А. (апрель 2021 г.). «Как мы получили вакцину от COVID-19 менее чем за год?» . Клинические исследования рака . 27 (8): 2136–38. дои : 10.1158/1078-0432.CCR-21-0079 . ISSN 1078-0432 . ПМК 8052930 . ПМИД 33542081 .
- ^ Робертс М. (2 декабря 2020 г.). «Вакцина Covid Pfizer одобрена для использования на следующей неделе в Великобритании» . Новости Би-би-си . Архивировано из оригинала 2 декабря 2020 года . Проверено 2 декабря 2020 г.
- ^ Офис комиссара (18 декабря 2020 г.). «Вакцина Pfizer-BioNTech против COVID-19» . FDA . Архивировано из оригинала 14 января 2021 года . Проверено 21 декабря 2020 г. .
- ^ «Moderna объявляет о своей глобальной стратегии общественного здравоохранения» . investors.modernatx.com . Архивировано из оригинала 16 марта 2022 года . Проверено 15 марта 2022 г.
- ^ Стинхейсен, Джули; Эрман, Майкл (8 марта 2022 г.). «Moderna разрабатывает вакцины против 15 патогенов с будущим пандемическим потенциалом» . Рейтер . Архивировано из оригинала 14 марта 2022 года . Проверено 15 марта 2022 г.
- ^ «Точная медицина встречается с вакцинами против рака» . Природная медицина . 29 (6): 1287. 16 июня 2023 г. doi : 10.1038/s41591-023-02432-2 . ПМИД 37328586 . S2CID 259184146 .
- ^ Бафалукос, Димитриос (2023). «Эволюция и прогресс мРНК-вакцин в лечении меланомы: перспективы на будущее» . Вакцина . 11 (3): 636. doi : 10.3390/vaccines11030636 . ПМЦ 10057252 . ПМИД 36992220 .
- ^ «Британец тестирует первую персонализированную вакцину против меланомы » 25 апреля 2024 г. Проверено 26 апреля 2024 г.
- ^ Перейти обратно: а б Бэтти Си Джей, Хейз М.Т., Бачелдер Э.М., Эйнсли К.М. (декабрь 2020 г.). «Составы вакцин в клинической разработке для профилактики тяжелого острого респираторного синдрома коронавирусной инфекции 2» . Обзоры расширенной доставки лекарств . 169 : 168–89. дои : 10.1016/j.addr.2020.12.006 . ПМЦ 7733686 . ПМИД 33316346 .
- ^ Кириакидис Н.К., Лопес-Кортес А., Гонсалес Е.В., Гримальдос А.Б., Прадо Э.О. (февраль 2021 г.). «Стратегии вакцинации против SARS-CoV-2: всесторонний обзор кандидатов фазы 3» . НПЖ Вакцины . 6 (1): 28. дои : 10.1038/s41541-021-00292-w . ПМК 7900244 . ПМИД 33619260 .
- ^ Булл Джей Джей, Нуйсмер С.Л., Антиа Р. (июль 2019 г.). «Эволюция рекомбинантной векторной вакцины» . PLOS Вычислительная биология . 15 (7): e1006857. Бибкод : 2019PLSCB..15E6857B . дои : 10.1371/journal.pcbi.1006857 . ПМК 6668849 . ПМИД 31323032 .
- ^ Хадж К.А., Уайтхед К.А. (сентябрь 2017 г.). «Инструменты трансляции: невирусные материалы для доставки терапевтической мРНК» . Материалы обзоров природы . 2 (10): 17056. Бибкод : 2017NatRM...217056H . дои : 10.1038/natrevmats.2017.56 .
- ^ Перейти обратно: а б Шлейк Т., Тесс А., Фотин-Млечек М., Каллен К.Дж. (ноябрь 2012 г.). «Разработка технологий мРНК-вакцины» . Биология РНК . 9 (11): 1319–30. дои : 10.4161/rna.22269 . ПМЦ 3597572 . ПМИД 23064118 .
- ^ Ананд П., вице-президент Stahel (май 2021 г.). «Обзор безопасности мРНК-вакцин против Covid-19: обзор» . Безопасность пациентов в хирургии . 15 (1): 20. дои : 10.1186/s13037-021-00291-9 . ПМЦ 8087878 . ПМИД 33933145 .
- ^ Голдман Б (22 декабря 2020 г.). «Как работают новые вакцины против COVID-19?» . Объем . Стэнфордская медицина. Архивировано из оригинала 30 января 2021 года . Проверено 28 января 2021 г.
- ^ Перейти обратно: а б с д и ж г Сюй С., Ян К., Ли Р., Чжан Л. (сентябрь 2020 г.). «Эра мРНК-вакцин — механизмы, лекарственная платформа и клинические перспективы» . Международный журнал молекулярных наук . 21 (18): 6582. doi : 10.3390/ijms21186582 . ПМЦ 7554980 . ПМИД 32916818 .
- ^ Фидлер К., Лаззаро С., Лутц Дж., Раух С., Хайденрайх Р. (2016). «Вакцины против рака МРНК». Современные стратегии генной терапии рака . Последние результаты исследований рака. Том. 209. стр. 61–85. дои : 10.1007/978-3-319-42934-2_5 . ISBN 978-3-319-42932-8 . ПМИД 28101688 .
{{cite book}}:|journal=игнорируется ( помогите ) - ^ Перейти обратно: а б Джексон Н.А., Кестер К.Е., Казимиро Д., Гурунатан С., ДеРоса Ф. (февраль 2020 г.). «Перспективы мРНК-вакцин: биотехнологическая и промышленная перспектива» . НПЖ Вакцины . 5 (1): 11. дои : 10.1038/s41541-020-0159-8 . ISSN 2059-0105 . ПМК 7000814 . ПМИД 32047656 .
- ^ Бентейн Д., Хейрман С., Бонхилл А., Тилеманс К., Брекпот К. (февраль 2015 г.). «Вакцины на основе дендритных клеток на основе мРНК». Экспертная оценка вакцин . 14 (2): 161–76. дои : 10.1586/14760584.2014.957684 . ПМИД 25196947 . S2CID 38292712 .
- ^ Крейтер С., Селми А., Дикен М., Козловски М., Бриттен С.М., Хубер С. и др. (ноябрь 2010 г.). «Интранодальная вакцинация обнаженной РНК, кодирующей антиген, вызывает мощный профилактический и терапевтический противоопухолевый иммунитет» . Исследования рака . 70 (22): 9031–40. дои : 10.1158/0008-5472.can-10-0699 . ПМИД 21045153 .
- ^ «Компоненты вакцины» . Консультативный центр по иммунизации . 22 сентября 2016 г. Архивировано из оригинала 26 января 2021 г. Проверено 20 декабря 2020 г.
- ^ Пробст Дж., Вейде Б., Шеел Б., Пихлер Б.Дж., Хорр И., Раммензее Х.Г., Пасколо С. (август 2007 г.). «Спонтанное клеточное поглощение экзогенной информационной РНК in vivo является специфичным для нуклеиновой кислоты, насыщаемым и ион-зависимым». Генная терапия . 14 (15): 1175–80. дои : 10.1038/sj.gt.3302964 . ПМИД 17476302 . S2CID 27518606 .
- ^ Лоренц С., Фотин-Млечек М., Рот Г., Беккер С., Дам Т.С., Вердурмен В.П. и др. (июль 2011 г.). «Экспрессия белка из экзогенной мРНК: поглощение посредством рецептор-опосредованного эндоцитоза и транспортировка по лизосомальному пути» . Биология РНК . 8 (4): 627–36. дои : 10.4161/rna.8.4.15394 . ПМИД 21654214 .
- ^ Вейде Б., Пасколо С., Шил Б., Дерхованессян Е., Пфлугфельдер А., Эйгентлер Т.К. и др. (июнь 2009 г.). «Прямая инъекция мРНК, защищенной протамином: результаты исследования вакцинации фазы 1/2 у пациентов с метастатической меланомой». Журнал иммунотерапии . 32 (5): 498–507. дои : 10.1097/CJI.0b013e3181a00068 . ПМИД 19609242 . S2CID 3278811 .
- ^ Перейти обратно: а б Ван Ю, Чжан Цзы, Луо Дж, Хань Х, Вэй Ю, Вэй Икс (февраль 2021 г.). «МРНК-вакцина: потенциальная терапевтическая стратегия» . Молекулярный рак . 20 (1): 33. дои : 10.1186/s12943-021-01311-z . ПМЦ 7884263 . ПМИД 33593376 .
- ^ Перейти обратно: а б с Куни Э (1 декабря 2020 г.). «Как нанотехнологии помогают мРНК-вакцинам против Covid-19 работать» . Стат . Архивировано из оригинала 1 декабря 2020 года . Проверено 3 декабря 2020 г.
- ^ Райхмут А.М., Оберли М.А., Якленец А., Лангер Р., Бланкштейн Д. (май 2016 г.). «Доставка мРНК-вакцины с использованием липидных наночастиц» . Терапевтическая доставка . 7 (5): 319–34. дои : 10.4155/tde-2016-0006 . ПМЦ 5439223 . ПМИД 27075952 .
- ^ Перейти обратно: а б Кросс Р (6 марта 2021 г.). «Без этих липидных оболочек не было бы мРНК-вакцин от COVID-19» . Новости химии и техники . Американское химическое общество. Архивировано из оригинала 5 марта 2021 года . Проверено 6 марта 2021 г.
- ^ Пауновска К., Саго С.Д., Монако СМ, Хадсон В.Х., Кастро М.Г., Рудольц Т.Г. и др. (март 2018 г.). «Прямое сравнение доставки нуклеиновых кислот in vitro и in vivo, опосредованной сотнями наночастиц, показывает слабую корреляцию» . Нано-буквы . 18 (3): 2148–57. Бибкод : 2018NanoL..18.2148P . дои : 10.1021/acs.nanolett.8b00432 . ПМК 6054134 . ПМИД 29489381 .
- ^ Лоу Д. (3 февраля 2021 г.). «Мнение: простое объяснение, почему невозможно производить больше вакцин против COVID-19 с помощью «десятков» компаний» . МаркетВотч . Архивировано из оригинала 5 февраля 2021 года . Проверено 5 февраля 2021 г.
- ^ Перейти обратно: а б Король А (23 марта 2021 г.). «Почему производство вакцин против Covid в больших масштабах затруднено» . Химический мир . Королевское химическое общество. Архивировано из оригинала 24 марта 2021 года . Проверено 26 марта 2021 г.
- ^ Перейти обратно: а б Сили А (2 апреля 2021 г.). «Производственный успех: как Pfizer производит миллионы доз вакцины против Covid-19» . CNN . Архивировано из оригинала 1 апреля 2021 года . Проверено 3 апреля 2021 г.
- ^ Перейти обратно: а б с Вайзе Э., Вайнтрауб К. (7 февраля 2021 г.). «Гонка за вакциной: жизненный цикл вакцины против COVID-19: от ДНК до доз» . США сегодня . Ганнетт. Архивировано из оригинала 25 февраля 2021 года . Проверено 24 февраля 2021 г.
- ^ Хопкинс Дж. С., Иствуд Дж., Мориарти Д. (3 марта 2021 г.). «Вакцины мРНК Covid-19 производят быстро, но их трудно масштабировать» . Уолл Стрит Джорнал . Архивировано из оригинала 4 апреля 2021 года . Проверено 3 апреля 2021 г.
- ^ Роуленд С. (18 февраля 2021 г.). «Почему бабушки и дедушки не могут найти вакцины: нехватка нишевых биотехнологических ингредиентов» . Вашингтон Пост . Архивировано из оригинала 26 февраля 2021 года . Проверено 7 марта 2021 г.
- ^ Лундстрем К. (март 2019 г.). «РНК-вирусы как инструменты генной терапии и разработки вакцин» . Гены . 10 (3): 189. doi : 10.3390/genes10030189 . ПМК 6471356 . ПМИД 30832256 .
- ^ Хуанг Т.Т., Параб С., Бернетт Р., Диаго О., Остертаг Д., Хофман Ф.М. и др. (февраль 2015 г.). «Внутривенное введение ретровирусного реплицирующего вектора Toca 511 демонстрирует терапевтическую эффективность на модели ортотопической иммунокомпетентной мышиной глиомы» . Генная терапия человека . 26 (2): 82–93. дои : 10.1089/hum.2014.100 . ПМК 4326030 . ПМИД 25419577 .
- ^ Шульц-Черри С., Дайбинг Дж.К., Дэвис Н.Л., Уильямсон С., Суарес Д.Л., Джонстон Р., Пердью М.Л. (декабрь 2000 г.). «Гемагглютинин вируса гриппа (A/HK/156/97), экспрессируемый системой репликонов альфавируса, защищает цыплят от летальной инфекции вирусами H5N1 гонконгского происхождения» . Вирусология . 278 (1): 55–59. дои : 10.1006/виро.2000.0635 . ПМИД 11112481 .
- ^ Гейсберт Т.В., Фельдманн Х. (ноябрь 2011 г.). «Вакцины на основе рекомбинантного вируса везикулярного стоматита против вирусных инфекций Эбола и Марбург» . Журнал инфекционных болезней . 204 (Приложение 3): S1075–81. дои : 10.1093/infdis/jir349 . ПМК 3218670 . ПМИД 21987744 .
- ^ Перейти обратно: а б с Долгин Э (ноябрь 2020 г.). «Вакцины против COVID-19 готовы к выпуску, но влияние на пандемию неясно». Природная биотехнология . дои : 10.1038/d41587-020-00022-y . ПМИД 33239758 . S2CID 227176634 .
- ^ Нилсон С., Данн А., Бендикс А. (26 ноября 2020 г.). «Инновационная вакцина от коронавируса Moderna была разработана всего за 2 дня» . Бизнес-инсайдер . Архивировано из оригинала 11 января 2021 года . Проверено 28 ноября 2020 г.
- ^ Рабсон М. (27 февраля 2021 г.). «От науки к шприцу: вакцины против COVID-19 — это чудеса науки и цепочек поставок» . Новости КТВ . Белл Медиа. Архивировано из оригинала 27 февраля 2021 года . Проверено 28 февраля 2021 г.
- ^ Карико К., Мурамацу Х., Людвиг Дж., Вайсман Д. (ноябрь 2011 г.). «Создание оптимальной мРНК для терапии: очистка ВЭЖХ устраняет иммунную активацию и улучшает трансляцию нуклеозид-модифицированной мРНК, кодирующей белок» . Исследования нуклеиновых кислот . 39 (21): е142. дои : 10.1093/nar/gkr695 . ПМК 3241667 . ПМИД 21890902 .
- ^ Парди Н., Вайсман Д. (17 декабря 2016 г.). «Нуклеозидмодифицированные мРНК-вакцины для инфекционных заболеваний». РНК-вакцины . Методы молекулярной биологии. Том. 1499. Спрингер, Нью-Йорк. стр. 109–21. дои : 10.1007/978-1-4939-6481-9_6 . ISBN 978-1-4939-6479-6 . ПМИД 27987145 .
- ^ Берглунд П., Смерду С., Флитон М.Н., Тубулекас И., Лильестрем П. (июнь 1998 г.). «Усиление иммунного ответа с помощью суицидальных ДНК-вакцин». Природная биотехнология . 16 (6): 562–65. дои : 10.1038/nbt0698-562 . ПМИД 9624688 . S2CID 38532700 .
- ^ Фогель А.Б., Ламберт Л., Киннер Э., Бусс Д., Эрбар С., Рейтер К.С. и др. (февраль 2018 г.). «Самоамплифицирующиеся РНК-вакцины обеспечивают защиту от гриппа, эквивалентную мРНК-вакцинам, но в гораздо меньших дозах» . Молекулярная терапия . 26 (2): 446–55. дои : 10.1016/j.ymthe.2017.11.017 . ПМК 5835025 . ПМИД 29275847 .
- ^ «Хранение вакцины Pfizer-BioNTech против COVID-19 и безопасное обращение с сухим льдом» . Пфайзер. Архивировано из оригинала 24 января 2021 года . Проверено 17 декабря 2020 г.
- ^ Перейти обратно: а б Симмонс-Даффин С. «Почему вакцину Pfizer против COVID-19 нужно хранить холоднее, чем в Антарктиде?» . NPR.org . Архивировано из оригинала 1 февраля 2021 года . Проверено 18 ноября 2020 г. .
- ^ Перейти обратно: а б «Информационный бюллетень для поставщиков медицинских услуг, вводящих вакцину» (PDF) . ModernaTX, Inc. Архивировано из оригинала 28 января 2021 года . Проверено 21 декабря 2020 г. .
- ^ «Moderna объявляет об увеличении срока хранения своей кандидатной вакцины против COVID-19 при охлаждении» . NPR.org . Архивировано из оригинала 16 ноября 2020 года . Проверено 18 ноября 2020 г. .
- ^ Томас К. (22 октября 2020 г.). «Эксперты говорят FDA, что ему следует собрать больше данных о безопасности вакцин против Covid-19» . Нью-Йорк Таймс . Архивировано из оригинала 26 января 2021 года . Проверено 21 ноября 2020 г.
- ^ Кюхлер Х. (30 сентября 2020 г.). «Руководитель Pfizer предупреждает об опасности ускоренного внедрения вакцин» . Файнэншл Таймс . Архивировано из оригинала 18 ноября 2020 года . Проверено 21 ноября 2020 г.
- ^ Вадман М. (ноябрь 2020 г.). «Общественность должна быть готова к побочным эффектам вакцин». Наука . 370 (6520): 1022. doi : 10.1126/science.370.6520.1022 . ПМИД 33243869 . S2CID 227180967 .
- ^ Перейти обратно: а б Квон Д. (25 ноября 2020 г.). «Перспективы мРНК-вакцин» . Ученый . Архивировано из оригинала 22 января 2021 года . Проверено 27 ноября 2020 г. .
- ^ Кармайкл Ф., Гудман Дж. (2 декабря 2020 г.). «Слухи о вакцинах развенчаны: микрочипы, «измененная ДНК» и многое другое» (Проверка реальности). Би-би-си. Архивировано из оригинала 13 марта 2021 года . Проверено 10 декабря 2020 г.
- ^ Скалка АМ (2014). «Транспозиция ретровирусной ДНК: темы и вариации» . Микробиологический спектр . 2 (5): 1101–23. doi : 10.1128/microbiolspec.MDNA3-0005-2014 . ISBN 9781555819200 . ПМЦ 4383315 . ПМИД 25844274 .
- ^ Перейти обратно: а б Диринг Р.П., Коммаредди С., Улмер Дж.Б., Брито Л.А., Гилл А.Дж. (июнь 2014 г.). «Вакцины на основе нуклеиновой кислоты: перспективы невирусной доставки мРНК-вакцин». Экспертное мнение: Делив лекарств . 11 (6): 885–99. дои : 10.1517/17425247.2014.901308 . ПМИД 24665982 . S2CID 33489182 .
- ^ Верстег Л., Альмутаири М.М., Хотез П.Дж., Поллет Дж. (сентябрь 2019 г.). «Привлечение платформы мРНК-вакцин для борьбы с паразитарными инфекциями» . Вакцина . 7 (4): 122. doi : 10.3390/vaccines7040122 . ПМК 6963228 . ПМИД 31547081 .
- ^ Перейти обратно: а б «Новый урожай мРНК-вакцин против COVID-19 может быть проще хранить и дешевле в использовании» . www.science.org . Архивировано из оригинала 5 апреля 2022 года . Проверено 6 апреля 2022 г.
- ^ Перейти обратно: а б Блум К., ван ден Берг Ф., Арбутнот П. (апрель 2021 г.). «Самоамплифицированные РНК-вакцины против инфекционных заболеваний» . Генная терапия . 28 (3–4): 117–129. дои : 10.1038/s41434-020-00204-y . ПМЦ 7580817 . ПМИД 33093657 .
- ^ Лоу Д. (1 марта 2021 г.). «Кандидат на вакцину от малярии» . Наука трансляционной медицины . Архивировано из оригинала 6 мая 2021 года . Проверено 7 мая 2021 г.
- ^ Кнаптон, Сара (20 сентября 2021 г.). «Первая «устойчивая к варианту» вакцина против Covid начинает испытания в Манчестере. 63-летняя пара пенсионеров Эндрю Кларк и его 64-летняя жена Хелен из Болтона стали первыми, кто получил мРНК-вакцину в понедельник» . «Дейли телеграф» . Архивировано из оригинала 20 сентября 2021 года . Проверено 21 сентября 2021 г.
- ^ «Gritstone объявляет о дозировании первого добровольца в испытании по оценке самоамплифицирующейся мРНК в качестве усилителя вакцины против COVID-19 и усилителя иммуногенности» . Обзор трубопровода . 20 сентября 2021 года. Архивировано из оригинала 22 сентября 2021 года . Проверено 21 сентября 2021 г.
Дальнейшее чтение
- Долгин Э. (сентябрь 2021 г.). «Запутанная история мРНК-вакцин» (PDF) . Природа . 597 (9): 318–24. Бибкод : 2021Natur.597..318D . дои : 10.1038/d41586-021-02483-w . ПМИД 34522017 . S2CID 237515383 .
- Сахин У , Карико К , Тюречи О (октябрь 2014 г.). «Терапия на основе мРНК – разработка нового класса лекарств» . Nat Rev Drug Discov . 13 (10): 759–80. дои : 10.1038/nrd4278 . ПМИД 25233993 .
Внешние ссылки
- «Пять вещей, о которых вам нужно знать: мРНК-вакцины» . Горизонт . Архивировано из оригинала 4 апреля 2020 года . Проверено 17 ноября 2020 г.
- «РНК-вакцины: введение» . Фонд ПХГ . Кембриджский университет .
- «Понимание мРНК вакцин против COVID-19» . Центры по контролю и профилактике заболеваний . 4 января 2022 г.
- Колата, Джина; Мюллер, Бенджамин (15 января 2022 г.). «Остановка прогресса и счастливые случайности: как были созданы мРНК-вакцины» . Нью-Йорк Таймс .
- Лекция 10 Массачусетского технологического института: Кизмекия Корбетт, Вакцины» на YouTube
- xkcd Веб-комикс , объясняющий, как работает вакцина, с использованием «Звездных войн» . персонажей и ситуаций