Современные вакцины против COVID-19
Эта статья нуждается в более надежных медицинских ссылках для проверки или слишком сильно полагается на первоисточники . ( ноябрь 2021 г. ) |  |
 Флаконы вакцины Модерна от COVID-19 | |
| Описание вакцины | |
|---|---|
| Цель | SARS-CoV-2 |
| Тип вакцины | мРНК |
| Клинические данные | |
| Торговые названия | Спикевакс [1] [2] |
| Другие имена | мРНК-1273, CX-024414, мРНК COVID-19, вакцина Moderna, TAK-919, вакцина Moderna от COVID-19, вакцина от COVID-19 Moderna, вакцина от COVID-19 Moderna для внутримышечных инъекций, [3] элазомеран, [4] [5] Вакцина против COVID-19 (мРНК), [6] Дэйвсомеран, [4] imelasomeran, [4] андусомеран, [4] CX-034476, CX-038839 |
| AHFS / Drugs.com | Монография |
| Медлайн Плюс | а621002 |
| Данные лицензии | |
| Беременность категория | |
| Маршруты администрация | Внутримышечный |
| код АТС | |
| Юридический статус | |
| Юридический статус |
|
| Идентификаторы | |
| Номер CAS | |
| ПабХим SID | |
| Лекарственный Банк | |
| НЕКОТОРЫЙ | |
| КЕГГ | |
| ЧЕМБЛ | |
| Часть серии о |
| COVID-19 пандемия |
|---|
 |
|
Вакцина Moderna COVID‑19 , продаваемая под торговой маркой Spikevax , представляет собой вакцину против COVID-19, разработанную американской компанией Moderna США , Национальным институтом аллергии и инфекционных заболеваний (NIAID) и Управлением перспективных биомедицинских исследований и разработок (США). БАРДА). В зависимости от юрисдикции он разрешен к использованию у людей в возрасте шести месяцев, [48] двенадцать лет или восемнадцать лет и старше. Он обеспечивает защиту от COVID-19 , вызванного заражением вирусом SARS-CoV-2 . [42] [2] [22] [14]
Он предназначен для введения в виде двух или трех по 0,5 мл доз внутримышечно , преимущественно в дельтовидную мышцу, с интервалом не менее 28 дней. [33] [49] [50] [51] Всемирная организация здравоохранения рекомендует делать восьминедельный интервал между приемами для оптимизации эффективности. В некоторых регионах одобрены дополнительные ревакцинационные дозы для поддержания иммунитета. Клинические испытания и реальные данные продемонстрировали высокую эффективность вакцины, причем значительная эффективность наблюдалась через две недели после введения второй дозы, обеспечивая 94% защиту от Covid и надежную защиту от тяжелых случаев. Эффективность вакцины распространяется на различные демографические группы, включая возраст, пол и людей с заболеваниями высокого риска.
Это мРНК-вакцина, состоящая из модифицированной нуклеозидами мРНК (модРНК), кодирующей шиповый белок SARS-CoV-2, инкапсулированный в липидные наночастицы . [52] В августе и сентябре 2022 года вводятся бивалентные версии вакцины (Moderna COVID-19 Vaccine, Biвалентная), содержащие элазомеран/элазомеран 0-омикрон (Spikevax Biвалентный ноль/омикрон). [53] были разрешены для использования в качестве ревакцинации лицам в возрасте 18 лет и старше в Соединенном Королевстве, [54] [55] Швейцария, [56] Австралия, [57] Канада, [58] [59] Европейский Союз, [2] и США. [60] [61] [62] [63] [64] [65] Второй компонент версии бивалентной вакцины, используемой в США. [66] основан на варианте Omicron BA.4/BA.5 , [60] тогда как второй компонент версии бивалентной вакцины, используемой в других странах, основан на варианте Омикрон BA.1 . [2] [53] [55] [54] [59] Эффективность вакцины против вариантов была тщательно изучена, что указывает на различную степень защиты. Например, во время преобладания варианта Дельта эффективность против инфекции со временем немного снижалась. Долговечность и непрерывная защита вакцины изучаются, при этом продолжаются исследования, направленные на продолжительность ее эффективности, которая на момент последних обновлений остается частично неопределенной.
Профиль безопасности вакцины благоприятный, с частыми побочными эффектами, включая боль в месте инъекции, усталость и головные боли. Тяжелые реакции, такие как анафилаксия, встречаются крайне редко. опасения по поводу миокардита Были выявлены , но они обычно легкие и поддающиеся лечению. В рецептуре вакцины используется технология мРНК, инкапсулированная в липидные наночастицы для обеспечения клеточного поглощения и реакции иммунной системы.
Медицинское использование
Вакцина Moderna COVID‑19 используется для обеспечения защиты от заражения вирусом SARS‑CoV‑2 в целях профилактики COVID‑19. [42] [2]
Вакцину вводят внутримышечно в дельтовидную мышцу руки. [33] Начальный курс состоит из двух доз. [33] Всемирная организация здравоохранения (ВОЗ) рекомендует интервал между дозами в восемь недель. [67]
В некоторых странах может быть добавлена третья, четвертая или пятая доза. [50] [51] [68]
Эффективность
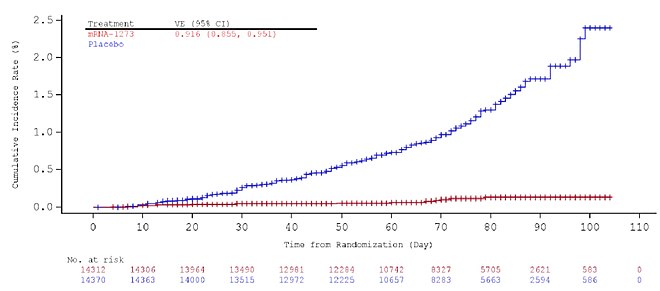
Доказательства эффективности вакцины начинают проявляться примерно через две недели после первой дозы. [69] [70] Высокая эффективность достигается при полной иммунизации через две недели после второй дозы и оценивается в 94,1%: на момент окончания исследования вакцины, повлекшего за собой экстренную авторизацию в США, в группе вакцины было зарегистрировано одиннадцать случаев COVID‑19. (из 15 181 человека) против 185 случаев в группе плацебо (15 170 человек). [69] Более того, в группе вакцинации не было зарегистрировано ни одного случая тяжелого течения COVID-19 по сравнению с одиннадцатью в группе плацебо. [71] Эта эффективность была описана как «удивительная». [72] и «пограничное историческое» [73] для вакцины против респираторного вируса, и ее эффективность аналогична эффективности вакцины Pfizer-BioNTech против COVID-19 . [74] [75]
Оценки эффективности были одинаковыми для всех возрастных, половых, расовых и этнических групп, а также для участников с сопутствующими заболеваниями, связанными с высоким риском тяжелого течения COVID-19. [76] В исследовании принимали участие только лица в возрасте 18 лет и старше. В настоящее время проводятся исследования для оценки эффективности и безопасности у детей в возрасте 0–11 лет (KidCOVE) и 12–17 лет (TeenCOVE). [77]
Дальнейшее исследование, проведенное Центрами по контролю и профилактике заболеваний США (CDC) в период с декабря 2020 года по март 2021 года с участием почти 4 тысяч медицинских работников, лиц, оказывающих первую помощь , и других основных и передовых работников, пришло к выводу, что в реальных условиях мРНК Эффективность вакцины при полной иммунизации (через 14 дней или более после второй дозы) составила 90% против инфекций SARS-CoV-2 , независимо от симптомов, а эффективность вакцины при частичной иммунизации (через 14 дней или более после первой дозы, но до второй дозы) составила 80. %. [78]
Продолжительность защиты, обеспечиваемой вакциной, по состоянию на апрель 2021 г. неизвестна. [update], [52] [79] и проводится двухлетнее последующее исследование для определения продолжительности. [73]
Предварительные результаты исследования фазы III показывают, что эффективность вакцины является продолжительной и остается на уровне 93% через шесть месяцев после второй дозы. [80]
Эффективность
Вакцина обычно считается эффективной, если ее оценка составляет ≥50% с нижней границей 95% доверительного интервала >30% . [81] Обычно ожидается, что эффективность будет постепенно снижаться с течением времени. [82]
В августе 2021 года результаты исследования показали, что эффективность против инфекции снизилась с 91% ( 81 – 96% ) до 66% ( 26–84 стал % ), когда вариант Дельта преобладать в США, что может быть связано с неизмеренными и остаточными искажениями , связанными со снижением эффективности вакцины с течением времени. [83]
| Дозы | Тяжесть заболевания | Дельта [а] | Альфа [б] | Гамма [б] | Бета [б] | Омикрон | Другие, обращавшиеся ранее [б] |
|---|---|---|---|---|---|---|---|
| 1 | Бессимптомный | 62% ( от −10 до 87 % ) | Не сообщается | Не сообщается | Не сообщается | Не сообщается | Не сообщается |
| Симптоматический | 83% ( 65 – 91% ) | 61% ( 56 – 66% ) | 43% ( 22 – 59% ) | Не сообщается | 61% ( 53 – 67% ) | ||
| Госпитализация | 87% ( от −1 до 98 % ) | 59% ( 39 – 73% ) | 56% ( от −9 до 82% ) | Не сообщается | 76% ( 46 – 90% ) | ||
| 2 | Бессимптомный | 54% ( 33 – 68% ) | Не сообщается | Не сообщается | Не сообщается | Не сообщается | Не сообщается |
| Симптоматический | 74% ( 66 – 80% ) | 90% ( 85 – 94% ) | 88% ( 61 – 96% ) | Не сообщается | 93% ( 87 – 96% ) | ||
| Госпитализация | 96% ( 72 – 100% ) | 94% ( 59 – 99% ) | 100% [с] | Не сообщается | 90% ( 80 – 100% ) | ||
Конкретные группы населения
Доступны ограниченные данные о безопасности вакцины Moderna COVID-19 во время беременности. [86] Первоначальное исследование исключало беременных женщин или прекращало их вакцинацию после положительного теста на беременность. [69] Исследования на животных не выявили никаких проблем с безопасностью, и в настоящее время проводятся клинические испытания для оценки безопасности и эффективности вакцин против COVID-19 у беременных женщин. [86] Реальные наблюдения в рамках программы отслеживания CDC v-safe не выявили необычного количества побочных эффектов или представляющих интерес исходов. [87] По результатам предварительного исследования Центры по контролю и профилактике заболеваний США рекомендуют беременным женщинам вакцинироваться вакциной от COVID‑19. [88] [89]
Побочные эффекты

Всемирная организация здравоохранения ) вакцины (ВОЗ) заявила, что «данные о безопасности подтверждают благоприятный профиль безопасности» и что профиль НЯ ( нежелательных явлений «не предполагает каких-либо конкретных проблем с безопасностью». [69] Наиболее частыми нежелательными явлениями были боль в месте инъекции, утомляемость, головная боль, миалгия (мышечная боль) и артралгия (боль в суставах). [69]
Центры США по контролю и профилактике заболеваний (CDC) сообщили о анафилаксии (тяжелой аллергической реакции) в 2,5 случаях на миллион введенных доз и рекомендовали 15-минутный период наблюдения после инъекции. [91] замедленные кожные реакции в местах инъекций, приводящие к появлению сыпи, но они не считаются серьезными или противопоказаниями к последующей вакцинации. В редких случаях также наблюдались [92] Частота возникновения местной неблагоприятной эритемы составляет около 10,8%. В 1,9% случаев покраснение может распространяться до размера 100 мм и более. [41]
В июне 2021 года Центры по контролю и профилактике заболеваний США подтвердили, что миокардит или перикардит возникает примерно у 13 из каждых 1 миллиона молодых людей, в основном мужчин старше 16 лет, получивших вакцину Moderna или Pfizer-BioNTech . [93] [94] Большинство пострадавших быстро выздоравливают при адекватном лечении и отдыхе. [95]
Дополнительные побочные эффекты включают обширный отек вакцинированной конечности. [96]
Фармакология
В технологии Moderna используется модифицированное нуклеозидами соединение информационной РНК (modRNA) под кодовым названием мРНК-1273. В системе доставки лекарственного средства мРНК-1273 используется ПЭГилированного липида система доставки лекарственного средства наночастиц (LNP). [97] клетки Как только соединение попадает внутрь клетки человека, мРНК связывается с эндоплазматическим ретикулумом . МРНК-1273 закодирована, чтобы заставить клетку производить определенный белок, используя обычный производственный процесс клетки. Вакцина кодирует версию белка-шипа с модификацией под названием 2P, в которой белок включает две стабилизирующие мутации, в которых исходные аминокислоты заменены на пролины , разработанные исследователями Техасского университета в Остине и Национального института аллергии. и инфекционных Научно-исследовательский центр вакцин заболеваний . [98] [99] [100] Как только белок вытесняется из клетки, он в конечном итоге обнаруживается иммунной системой, которая начинает вырабатывать эффективные антитела.
Химия
Вакцина содержит следующие ингредиенты: [42] [41]
Активный ингредиент представляет собой последовательность мРНК, содержащую в общей сложности 4101 нуклеотид, которая кодирует полноразмерный гликопротеин спайка (S) SARS-CoV-2. [101] с двумя мутациями (K986P и V987P), предназначенными для стабилизации конформации перед слиянием. Последовательность дополнительно оптимизируется за счет: [102] [103]
- все уридины (U) замещены N1-метилпсевдуридином (U → m1Ψ),
- фланкирован искусственной 5'- нетранслируемой областью (UTR) и 3'-UTR, полученной из гена альфа-глобина человека ( HBA1 ),
- введение двух дополнительных стоп-кодонов ,
- оканчивается 3'-поли(А)-хвостом.
опубликована предполагаемая последовательность вакцины , полученная путем прямого секвенирования остаточного материала вакцины в использованных флаконах. На форуме профессиональных вирусологов [104]
Вакцинную мРНК растворяют в водном буфере, содержащем трометамин , гидрохлорид трометамина , ацетат натрия и сахарозу . [33] мРНК инкапсулирована в липидные наночастицы , которые стабилизируют мРНК и облегчают ее проникновение в клетки. [52] Наночастицы производятся из следующих липидов :
- 1,2-дистеароил-sn-глицеро-3-фосфохолин (DSPC), [33]
- холестерин , [33]
- ПЭГ2000-ДМГ (полиэтиленгликоль (ПЭГ) 2000-димиристоилглицерин (ДМГ)), [33] и
- СМ-102 [33]
Производство


Moderna широко полагается на контрактные производственные организации для расширения процесса производства вакцин. Первый этап процесса — синтез ДНК- плазмид (которые будут использоваться в качестве матрицы для синтеза мРНК) — был выполнен подрядчиком Aldevron из Фарго, Северная Дакота . [105] На оставшуюся часть процесса Moderna заключила контракт с Lonza Group на производство вакцины на предприятиях в Портсмуте, штат Нью-Гэмпшир в США, и в Виспе в Швейцарии, а также закупила необходимые липидные наполнители у CordenPharma. [106] Помимо директоров по маркетингу, Moderna также производит вакцину на собственном производственном предприятии в Норвуде, штат Массачусетс . [107] Еще одна производственная площадка вакцин для рынка за пределами США (с конца 2021 года) находится в Гелине в Нидерландах и производится ее партнером-производителем Lonza . [108] Ранее Lonza производила вакцину только для ЕС, Великобритании и Канады только на своем предприятии в Швейцарии, но в начале 2021 года ей пришлось сократить прогнозируемые поставки в Великобританию и Канаду из-за проблем с производством. [109]
На выполнение задач по наполнению и упаковке флаконов ( fill and Finish ) компания Moderna заключила контракты с Catalent в США и Laboratorios Farmacéuticos Rovi в Испании. [106] В апреле 2021 года Moderna расширила соглашение с Catalent об увеличении объемов производства на заводе последней в Блумингтоне, штат Индиана . Расширение позволит Catalent производить до 400 флаконов в минуту и наполнять дополнительно 80 миллионов флаконов в год. [110] Позже в том же месяце Moderna объявила о своих планах потратить миллиарды долларов на увеличение производства своих вакцин, потенциально утроив выпуск в 2022 году, а также заявив, что в 2021 году будет произведено не менее 800 миллионов доз. Это связано с улучшениями, внесенными компанией в методы производства. [111] [112] [113]
Новости Moderna последовали за предварительными результатами вакцины-кандидата Pfizer - BioNTech , BNT162b2 , причем Moderna демонстрирует аналогичную эффективность, но требует хранения при температуре стандартного медицинского холодильника 2–8 °C (36–46 °F) в течение тридцати дней или -20 °C (-4 °F) на срок до четырех месяцев, тогда как кандидату Pfizer-BioNTech требуется хранение в ультрахолодной морозильной камере при температуре от -80 до -60 °C (от -112 до -76 °F). [114] [115] Страны с низкими доходами обычно располагают мощностями холодовой цепи только для хранения в стандартных холодильниках, а не в ультрахолодных морозильных камерах. [116] [117] В феврале 2021 года ограничения на вакцину Pfizer были смягчены, когда Управление по контролю за продуктами и лекарствами США (FDA) обновило разрешение на экстренное использование (EUA), разрешив транспортировку и хранение неразбавленных замороженных флаконов с вакциной при температуре от -25 до -15. °C (-13 и 5 °F) на срок до двух недель перед использованием. [41] [118] [119] Вакцину Moderna нельзя хранить при температуре ниже -50 °C (-58 °F). [120]
В ноябре 2020 года журнал Nature сообщил, что «хотя возможно, что различия в составах ЛНП или вторичных структурах мРНК могут объяснять различия в термостабильности [между Moderna и BioNtech], многие эксперты подозревают, что оба вакцинных продукта в конечном итоге будут иметь одинаковые требования к хранению и сроки годности. в различных температурных условиях». [121]
История
Оригинальная версия
В январе 2020 года компания Moderna объявила о разработке РНК-вакцины под кодовым названием мРНК-1273, вызывающей иммунитет к SARS-CoV-2. [122] [123] [124]
Компания Moderna получила долларов США 955 миллионов от Управления передовых биомедицинских исследований и разработок (BARDA), подразделения Министерства здравоохранения и социальных служб США . BARDA профинансировала 100% затрат на доведение вакцины до лицензии FDA. [125] [126]
Правительство США выделило 2,5 миллиарда долларов на финансирование вакцины Moderna от COVID-19 (мРНК-1273). [127] Частные доноры также внесли свой вклад в разработку вакцины. Фонд исследований COVID-19 Долли Партон внес 1 миллион долларов. [128]
Клинические исследования фазы I–II
В марте 2020 года фаза США началась I испытаний мРНК-1273 на людях в партнерстве с Национальным институтом аллергии и инфекционных заболеваний . [129] В апреле Управление перспективных биомедицинских исследований и разработок США (BARDA) выделило до 483 миллионов долларов на разработку вакцины Moderna. [130] Планы фазы II исследования дозировки и эффективности, которые начнутся в мае, были одобрены Управлением по контролю за продуктами и лекарствами США (FDA). [131] Moderna подписала партнерство со швейцарским производителем вакцин Lonza Group . [132] поставлять 300 миллионов доз в год. [133]
В мае 2020 года компания Moderna начала фазы клиническое исследование IIa , в котором приняли участие шестьсот взрослых участников для оценки безопасности и различий в реакции антител на две дозы своей вакцины-кандидата, мРНК-1273. Ожидается, что исследование завершится в 2021 году. [134]
В июле 2020 года ученые Moderna опубликовали предварительные результаты I фазы клинического исследования мРНК-1273 с увеличением дозы, показывающие дозозависимую индукцию нейтрализующих антител против S1/S2 уже через 15 дней после инъекции. легкой до умеренной степени тяжести Побочные реакции от , такие как лихорадка , утомляемость, головная боль, мышечная боль и боль в месте инъекции, наблюдались во всех группах дозировки, но были обычными при увеличении дозы. [103] Вакцина в низких дозах была признана безопасной и эффективной для продвижения фазы III клинических испытаний с использованием двух доз по 100 мкг, вводимых с интервалом в 29 дней. [103]
В июле 2020 года компания Moderna объявила в предварительном отчете, что ее кандидат в операцию Warp Speed привел к выработке нейтрализующих антител у здоровых взрослых в ходе I фазы клинических испытаний . [103] [135] «При дозе в 100 микрограммов, которую Moderna проводит в более масштабных исследованиях, у всех 15 пациентов наблюдались побочные эффекты, включая усталость, озноб, головную боль, мышечную боль и боль в месте инъекции». [136] В июле проблемные более высокие дозы были исключены из будущих исследований. [136] [ дублирование? ]
В сентябре 2021 года исследование, профинансированное Национальным институтом аллергии и инфекционных заболеваний, сообщило о сильном иммунном ответе через шесть месяцев даже при низких дозах, что позволяет предположить, что при ограниченном запасе вакцины можно использовать больше доз. Через шесть месяцев после вакцинации низкой дозой у 67% участников все еще были памяти цитотоксические Т-клетки , что позволяет предположить, что иммунная память стабильна. Исследование также показало, что перекрестно-реактивные Т-клетки, приобретенные во время заражения другими коронавирусами, вызывающими простуду, усиливают реакцию на вакцину. [137] [138]
Клинические исследования III фазы
Moderna и Национальный институт аллергии и инфекционных заболеваний начали III фазу исследования в США в июле 2020 года, планируя привлечь и распределить тридцать тысяч добровольцев на две группы: одна группа получит две дозы вакцины мРНК-1273 по 100 мкг. а другой получал плацебо 0,9% хлорида натрия. [139] По состоянию на 7 августа зарегистрировалось более 4500 волонтеров. [ нужна ссылка ]
В сентябре 2020 года Moderna опубликовала подробный план клинического исследования. [140] В сентябре 2020 года генеральный директор Стефан Бансель заявил, что, если испытания пройдут успешно, вакцина может стать доступной для общественности уже в конце марта или начале апреля 2021 года. [141] По состоянию на октябрь 2020 года Moderna завершила набор 30 000 участников, необходимых для III фазы исследования. [142] В ноябре 2020 года Национальные институты здравоохранения США объявили, что общие результаты испытаний были положительными. [143]
С сентября 2020 года компания Moderna использует Roche Diagnostics тест Elecsys Anti-SARS-CoV-2 S компании , одобренный Управлением по контролю за продуктами и лекарствами США (FDA) в соответствии с разрешением на экстренное использование (EUA) в ноябре 2020 года. По данным независимого поставщика клинических анализов в микробиологии, «это облегчит количественное измерение антител к SARS-CoV-2 и поможет установить корреляцию между защитой, вызванной вакциной, и уровнями антител антирецепторсвязывающего домена (RBD)». О партнерстве было объявлено компанией Roche 9 декабря 2020 года. [144]
Обзор промежуточных результатов фазы III клинического исследования мРНК-1273, проведенный FDA в декабре 2020 года, показал, что она безопасна и эффективна против инфекции COVID-19, в результате чего FDA выдало EUA. [145]
результаты фазы клинического исследования III были опубликованы В феврале 2021 года в Медицинском журнале Новой Англии , свидетельствующие о 94% эффективности в предотвращении заражения COVID-19. [52] [115] [146] Побочные эффекты включали гриппоподобные симптомы, такие как боль в месте инъекции, усталость, мышечная боль и головная боль. [115] Клинические испытания продолжаются и завершатся в конце 2022 года. [147]
Беременные и кормящие женщины также были исключены из первоначальных испытаний, проводившихся для получения разрешения на экстренное использование. [148] хотя ожидалось, что испытания на этих популяциях будут проведены в 2021 году. [149]
В марте 2021 года, чтобы увеличить продолжительность вакцинации за пределами взрослых, Moderna начала клинические испытания вакцин на детях в возрасте от 6 месяцев до 11 лет в США и Канаде (KidCove). [150] в дополнение к существующему полномасштабному исследованию среди детей 12–17 лет (TeenCOVE). [151] [65]
Разрешения
| |||
Ускоренный
По состоянию на декабрь 2020 года вакцина Moderna от COVID-19 находилась на стадии оценки на предмет экстренной авторизации или одобрения в нескольких странах, что позволит быстро внедрить вакцину в Великобритании, Европейском Союзе (ЕС), Канаде и США. [152] [153] [154] [155]
одобрило вакцину Moderna против COVID-19 В декабре 2020 года Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) в соответствии с разрешением на экстренное использование (EUA) для людей в возрасте 18 лет и старше. [156] [43] [145] Это первый продукт Moderna, одобренный FDA. [157] [158] В июне 2022 года EUA была расширена и теперь включает людей в возрасте от шести месяцев до шестнадцати лет. [40] В апреле 2023 года разрешение на использование оригинальной моновалентной версии вакцины в США было отозвано. [159] [160] По состоянию на апрель 2023 года в США разрешена только бивалентная версия вакцины (оригинальная и Omicron BA.4/BA.5). [159] [160]
В декабре 2020 года вакцина Moderna от COVID-19 была одобрена Министерством здравоохранения Канады . [161] [23] [4]
В январе 2021 года вакцина Moderna от COVID-19 была разрешена к использованию в Израиле Министерством здравоохранения . [162]
Сингапура разрешило использование вакцины Moderna против COVID-19 В феврале 2021 года Управление медицинских наук . [163]
В апреле 2021 года Всемирная организация здравоохранения (ВОЗ) внесла в список экстренного использования. [164] [165]
Филиппин разрешило вакцину Moderna от COVID-19 для экстренного использования на Филиппинах В мае 2021 года Управление по санитарному надзору за качеством пищевых продуктов и медикаментов . [166]
В 2020 году Moderna стала партнером фармацевтической компании Takeda и Министерства здравоохранения, труда и социального обеспечения Японии (MHLW). [167] [168] Вакцина известна как «COVID-19 Vaccine Moderna Intramuscular Injection». [169] [3] В мае 2021 года в Японии для экстренного применения была разрешена вакцина Moderna для внутримышечных инъекций от COVID-19 (ранее TAK-919). [3]
В июне 2021 года вакцина Moderna от COVID-19 была разрешена к использованию в Индии Генеральным контролером по наркотикам Индии . [170] В тот же день вакцина была также одобрена Министерством здравоохранения Вьетнама для экстренного использования в стране. [171]
В августе 2021 года Национальное агентство по фармацевтическому регулированию Малайзии (NPRA) дало условную регистрацию для экстренного использования вакцины Moderna COVID-19. [172]
Стандартный
В январе 2021 года Комитет по лекарственным препаратам для применения человеком (CHMP) Европейского агентства по лекарственным средствам (EMA) рекомендовал предоставить условное регистрационное удостоверение. [2] [173] и в тот же день рекомендация была принята Европейской комиссией . [44] [45] В июле 2021 года EMA расширило использование вакцины Moderna от COVID-19, включив в нее людей в возрасте от 12 до 17 лет. [174]
В январе 2021 года Swissmedic выдала временное разрешение на мРНК-вакцину Moderna COVID-19 в Швейцарии. [175] [176] [177] [178] [179] [180]
В марте 2021 года Агентство по регулированию лекарственных средств и товаров медицинского назначения (MHRA) выдало условное разрешение на продажу в Соединенном Королевстве. [29] [31] [32]
В августе 2021 года Спикевакс получил предварительное одобрение в Австралии. [13] В сентябре 2021 года разрешение было обновлено и теперь включает людей в возрасте двенадцати лет и старше. [14]
Вакцина Moderna Spikevax против COVID-19 была разрешена в Канаде в сентябре 2021 года для людей в возрасте 12 лет и старше. [22] [4] [181]
Вакцина Moderna Spikevax против COVID-19 была разрешена в США в январе 2022 года для людей в возрасте 18 лет и старше. [1] [38] [41]
Вакцина Moderna Spikevax Biвалентная Zero/Omicron была одобрена для медицинского применения в Великобритании в августе 2022 года. [54]
В сентябре 2022 года CHMP EMA рекомендовал преобразовать условные регистрационные удостоверения вакцины в стандартные регистрационные удостоверения. [46] Рекомендация распространяется на все существующие и будущие адаптированные вакцины Spikevax, включая недавно одобренную адаптированную бивалентную вакцину Spikevax Original/Omicron BA.1. [46]
Бустеры


В январе 2021 года компания Moderna объявила, что предложит третью дозу своей вакцины людям, которые были вакцинированы дважды в ходе I фазы испытаний. Бустер будет доступен участникам через шесть-двенадцать месяцев после получения второй дозы. Компания заявила, что может также изучить третью прививку участникам исследования фазы III, если этого оправдают данные о персистенции антител. [182] [183] [184] Он также начал тестирование, чтобы выяснить, можно ли использовать третью прививку существующей вакцины для борьбы с вариантами вируса. [185]
В августе 2021 года Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) и Центры по контролю и профилактике заболеваний США (CDC) разрешили использование дополнительной дозы мРНК вакцины для лиц с ослабленным иммунитетом. [50] [51] [186] [187]
В сентябре 2021 года Комитет по лекарственным препаратам для применения человеком (CHMP) Европейского агентства по лекарственным средствам (EMA) начал оценку использования ревакцинационной дозы вакцины Moderna против COVID-19, которую следует вводить по крайней мере через шесть месяцев после второй дозы в люди в возрасте двенадцати лет и старше. [188] [189]
В октябре 2021 года Европейское агентство лекарственных средств (EMA) заявило, что люди с «сильно ослабленной» иммунной системой могут получить дополнительную дозу либо вакцины Pfizer–BioNTech от COVID-19, либо вакцины Moderna от COVID-19, начиная как минимум через 28 дней после их вакцинации. вторая доза. [68]
США В октябре 2021 года Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) и Центры по контролю и профилактике заболеваний (CDC) разрешили использование гомологичных или гетерологичных бустерных доз вакцины. [190] [191] [192] [193] В ноябре 2021 года разрешение было расширено и теперь включает всех взрослых. [192]
Варианты
В январе 2021 года компания Moderna начала разработку новой формы своей вакцины под названием мРНК-1273.351, которую можно было бы использовать в качестве ревакцинации против бета-варианта (линия B.1.351). [194] [185] В феврале 2021 года Moderna объявила, что произвела и отправила достаточное количество мРНК-1273.351 Национальным институтам здравоохранения для проведения фазы I клинических испытаний. [195] Компания Moderna также исследовала мультивалентный бустер мРНК-1273.211, который сочетает в себе смесь мРНК-1273 и мРНК-1273.351 в соотношении 50-50. [196] [197]
Бивалентная версия вакцины, содержащая элазомеран/имелазомеран (Spikevax biвалентный Оригинал/Омикрон). [53] был одобрен для использования в Великобритании и Австралии в августе 2022 года. [54] [55] [198] [17] Он был одобрен для использования в Канаде в сентябре 2022 года. [59] [199] [22]
В октябре 2022 года FDA внесло поправки в разрешение на бивалентную ревакцинацию, чтобы охватить людей в возрасте шести лет и старше. [200] В декабре 2022 года FDA внесло поправки в разрешение на применение двухвалентной ревакцинации, чтобы охватить людей в возрасте шести месяцев и старше. [201]
Моновалентная вакцина XBB.1.5
В сентябре 2023 года FDA одобрило обновленную моновалентную (однокомпонентную) Omicron варианта XBB.1.5 (формула Spikevax 2023-2024) в качестве однократной дозы для лиц в возрасте двенадцати лет и старше; версию вакцины [202] и разрешил использовать формулу вакцины Moderna COVID-19 2023-2024 для экстренного использования лицами в возрасте от 6 месяцев до 11 лет. [37] [203] Обновленная версия была протестирована в небольшом исследовании на людях с участием 101 участника; 50 человек получили моновалентную версию XBB.1.5, тогда как 51 человек получил версию, содержащую XBB.1.5, BA.4 и BA.5. Все участники ранее получили четыре дозы старых составов вакцины Moderna против COVID-19. Было обнаружено, что профиль безопасности разрешенной вакцины XBB.1.5 «соответствует ранее разрешенным вакцинам». [204] [205] Одобрения и экстренные разрешения на бивалентную версию вакцины были отозваны. [37] Министерство здравоохранения Канады одобрило вакцину Moderna Spikevax против COVID-19 (субвариант Omicron XBB.1.5) (андузомеран) в сентябре 2023 года. [4] [22] [206] MHRA одобрило использование вакцины Moderna (Spikevax) XBB.1.5 в сентябре 2023 года. [207] [208]
Общество и культура
было введено около 155 миллионов доз вакцины Moderna против COVID-19, в том числе около 3,1 миллиона доз детям и подросткам (в возрасте до 18 лет) . в ЕС/ ЕЭЗ С момента получения разрешения до 26 июня 2022 года [96]
Названия брендов
мРНК-1273 была кодовым названием во время разработки и тестирования. [52] [158] элазомеран – международное непатентованное наименование (МНН), [10] [209] [210] и Spikevax — это торговая марка . [1] [2]
Давесомеран — это МНН варианта BA.5 в бивалентной версии вакцины. [10] [211] [212] Андусомеран — это МНН варианта вакцины XBB 1.5. [10] [213] [214]
Экономика
В июне 2020 года Сингапур подписал соглашение о предварительной закупке вакцины Moderna, как сообщается, заплатив надбавку к цене, чтобы обеспечить ранние запасы вакцин, хотя правительство отказалось сообщить фактическую цену и количество, сославшись на положения о коммерческой чувствительности и конфиденциальности. [215] [216]
В августе 2020 года правительство США подписало соглашение о закупке 100 миллионов доз ожидаемой вакцины Moderna. [217] Газета Financial Times сообщила, что Moderna планировала установить цену в 50–60 долларов США за курс. [218] В ноябре 2020 года компания Moderna заявила, что будет взимать с правительств, приобретающих ее вакцину, сумму от 25 до 37 долларов США за дозу, в то время как ЕС добивается цены менее 25 долларов США за дозу для 160 миллионов доз, которые он планирует закупить у Moderna. [219] [220]
В 2020 году Moderna заключила соглашения о покупке мРНК-1273 с Европейским Союзом на 160 миллионов доз и с Канадой на 56 миллионов доз. [221] [222] В декабре 2020 года твите в государственного секретаря по бюджету Бельгии сообщалось, что ЕС будет платить 18 долларов США за дозу, а The New York Times сообщила, что США будут платить 15 долларов США за дозу. [223]
Компания Moderna сообщила о выручке долларов США . в размере 200 миллионов от своей вакцины против COVID-19 в 2020 году [224] и 17,7 млрд долларов в 2021 году. [225]
Приостановленные прививки
Обеспокоенные тем, что вакцина может увеличить риск миокардита у молодых людей в возрасте до 30 лет, Финляндия, Швеция, Германия и Франция рекомендовали не использовать вакцинацию Moderna для этой возрастной группы в октябре/ноябре 2021 года. [226] [227] [228] [229] [230]
Споры
этой статьи Разделы «критика» или «противоречие» могут поставить под угрозу ее нейтральность . ( декабрь 2020 г. ) |
В мае 2020 года, опубликовав частичные и не прошедшие рецензирование результаты только для восьми из 45 кандидатов на предварительном этапе I стадии испытаний на людях непосредственно на финансовых рынках, генеральный директор объявил на канале CNBC о немедленном выпуске прав на сумму 1,25 миллиарда долларов для сбора средств для компания при оценке в 30 миллиардов долларов, [231] в то время как Стат сказал: «Эксперты по вакцинам говорят, что Moderna не предоставила данных, критически важных для оценки вакцины против COVID-19». [232]
В июле 2020 года выявились споры между Moderna и государственными учеными по поводу нежелания компании делиться данными клинических испытаний. [233]
Moderna также подверглась критике за то, что ей не удалось привлечь цветных людей к клиническим испытаниям. [234]
В августе 2021 года Министерство здравоохранения и социальных служб США объявило о плане предложить ревакцинацию через восемь месяцев после второй дозы, сославшись на доказательства снижения защиты от легких и среднетяжелых заболеваний и на возможность снижения защиты от тяжелых заболеваний, госпитализации и смерть. [235] Ученые и ВОЗ подтвердили отсутствие доказательств необходимости ревакцинации для здоровых людей и того, что вакцина остается эффективной против тяжелых заболеваний через несколько месяцев после введения. [236] В своем заявлении ВОЗ и SAGE заявили, что, хотя защита от инфекции может быть снижена, защита от тяжелых заболеваний, скорее всего, сохранится благодаря клеточному иммунитету . [237] Исследования оптимального времени для повторной вакцинации все еще продолжаются, и слишком ранняя повторная вакцинация может привести к менее надежной защите. [238]
Дезинформация
Примерно в мае 2021 года на платформах обмена видео были распространены видеоролики, показывающие, как люди приклеивают магниты к рукам после получения вакцины, якобы демонстрируя теорию заговора о том, что вакцины содержат микрочипы , но эти видеоролики были опровергнуты. [239] [240] [241] [242]
В ноябре 2021 года корреспондент консервативного издания Newsmax в Белом доме ложно написал в Твиттере, что вакцина Moderna содержит люциферазу , «чтобы вас можно было отследить». [243] [244]
Патентные споры
Система доставки лекарственных средств на основе ПЭГилированных липидных наночастиц (LNP) мРНК-1273 стала предметом продолжающегося патентного спора с Arbutus Biopharma , у которой Moderna ранее лицензировала технологию LNP. [97] [245] 4 сентября 2020 года Nature Biotechnology сообщила, что Moderna проиграла ключевое дело в продолжающемся деле. [246]
Пояснительные примечания
Ссылки
- ^ Jump up to: а б с д «Вакцина Spikevax-covid-19, мРНК для инъекций, суспензия» . ДейлиМед . 1 января 2022 года. Архивировано из оригинала 18 июня 2022 года . Проверено 17 июня 2022 г.
- ^ Jump up to: а б с д и ж г час «Спикевакс (ранее вакцина против COVID-19 Moderna) EPAR» . Европейское агентство лекарственных средств (EMA) . 4 января 2021 года. Архивировано из оригинала 1 февраля 2022 года . Проверено 31 января 2022 г.
- ^ Jump up to: а б с «Такеда объявляет об одобрении вакцины против COVID-19 компании Moderna в Японии» (пресс-релиз). Такеда. 21 мая 2021 года. Архивировано из оригинала 23 декабря 2021 года . Проверено 29 мая 2021 г.
- ^ «Элазомеран для профилактики COVID-19» . Австралийский врач . 44 (5): 172. Октябрь 2021 г. doi : 10.18773/austprescr.2021.048 . ПМЦ 8542485 . ПМИД 34728884 . Архивировано из оригинала 14 мая 2022 года . Проверено 14 мая 2022 г.
- ^ «Обновления базы данных о назначении лекарственных средств при беременности» . Управление терапевтических товаров (TGA) . 21 декабря 2022 г. Проверено 2 января 2023 г.
- ^ Jump up to: а б «Спайвакс» . Управление терапевтических товаров (TGA). 9 августа 2021 года. Архивировано из оригинала 28 августа 2021 года . Проверено 28 августа 2021 г.
- ^ Jump up to: а б «Информационная лицензия на вакцину Спикевакс (элазомеран) против Covid-19» (PDF) . Управление терапевтических товаров (TGA). 18 августа 2021 года. Архивировано из оригинала 28 августа 2021 года . Проверено 28 августа 2021 г.
- ^ «Обновления базы данных о назначении лекарственных средств при беременности» . Управление терапевтических товаров (TGA) . 12 мая 2022 года. Архивировано из оригинала 3 апреля 2022 года . Проверено 13 мая 2022 г.
- ^ Jump up to: а б с д «Регуляторный статус вакцин против COVID-19» . Управление терапевтических товаров (TGA) . 21 июня 2022 г. Проверено 8 октября 2023 г.
- ^ «Вакцина против COVID-19: Спикевакс (элазомеран)» . Управление терапевтических товаров (TGA) . 21 июня 2022 г. Проверено 9 октября 2023 г.
- ^ «Краткая информация для записи Artg: 370599 Spikevax (элазомеран) Вакцина против Covid-19, 0,2 мг/мл, суспензия для флакона для инъекций» (PDF) . Управление терапевтических товаров (TGA) . Проверено 28 августа 2021 г. [ мертвая ссылка ]
- ^ Jump up to: а б «Вакцина против COVID-19: Спикевакс (элазомеран)» . Управление терапевтических товаров (TGA) . 9 августа 2021 года. Архивировано из оригинала 28 августа 2021 года . Проверено 28 августа 2021 г.
- ^ Jump up to: а б с «Предварительное одобрение TGA вакцины Moderna против COVID-19 для возрастной группы 12–17 лет» . Управление терапевтических товаров (TGA) . 4 сентября 2021 года. Архивировано из оригинала 4 сентября 2021 года . Проверено 4 сентября 2021 г.
- ^ «АусПАР: Элазомеран» . Управление терапевтических товаров (TGA) . 23 февраля 2022 года. Архивировано из оригинала 24 марта 2022 года . Проверено 23 марта 2022 г.
- ^ «AusPAR: Элазомеран (мРНК-1273)» . Управление терапевтических товаров (TGA) . 9 декабря 2021 года. Архивировано из оригинала 24 марта 2022 года . Проверено 24 марта 2022 г.
- ^ Jump up to: а б «Спайвакс Бивалент Оригинал/Омикрон» . Управление терапевтическими товарами . 1 сентября 2022 г.
- ^ «Спайвакс бивалент Ориджинал/Омикрон ВА.4-5» . Управление терапевтических товаров (TGA) . 23 февраля 2023 г. Проверено 8 апреля 2023 г.
- ^ «Терапевтические товары (стандарт по ядам) (вакцина против COVID-19 — Moderna) (элазомеран и имелазомеран) Освобождение от маркировки в 2022 году» . Управление терапевтических товаров (TGA) . 31 августа 2022 г. Проверено 17 сентября 2023 г.
- ^ Росарио М. (26 июня 2023 г.). «Anvisa одобряет бивалентную вакцину Moderna от Covid-19» . О Глобо (на бразильском португальском языке) . Проверено 21 июня 2024 г.
- ^ «Анвиза одобрена для регистрации вакцины Spikevax monoваленте» . Бразильское агентство по регулированию здравоохранения (на бразильском португальском языке). 6 марта 2024 г. Проверено 21 июня 2024 г.
- ^ Jump up to: а б с д и «Современные вакцины Spikevax против COVID-19» . Здоровье Канады . 12 сентября 2023 года. Архивировано из оригинала 15 сентября 2023 года . Проверено 15 сентября 2023 г.
- ^ Jump up to: а б «Современная вакцина против COVID-19 (мРНК-1273 SARS-CoV-2)» . Здоровье Канады . 23 декабря 2020 года. Архивировано из оригинала 23 декабря 2020 года . Проверено 23 декабря 2020 г.
- ^ «Краткое описание нормативного решения — вакцина против COVID-19 Moderna» . Здоровье Канады . 27 августа 2021 года. Архивировано из оригинала 27 августа 2021 года . Проверено 28 августа 2021 г.
- ^ «Монография Spikevax (элазомеровая мРНК-вакцина)» (PDF) . Архивировано из оригинала (PDF) 3 декабря 2021 года.
- ^ «Сводка нормативных решений — Спикевакс» . Здоровье Канады . 13 ноября 2020 года. Архивировано из оригинала 17 сентября 2021 года . Проверено 18 сентября 2021 г.
- ^ «Краткая основа решения (SBD) для Спикевакса» . Здоровье Канады . 23 октября 2014 г. Архивировано из оригинала 29 мая 2022 г. . Проверено 29 мая 2022 г.
- ^ «Краткая основа решения (SBD) для Spikevax XBB.1.5» . Портал лекарств и товаров для здоровья . 1 сентября 2012 года . Проверено 11 декабря 2023 г.
- ^ Jump up to: а б «Краткая информация о характеристиках продукта Spikevax» . Агентство по регулированию лекарственных средств и товаров медицинского назначения (MHRA). 20 августа 2021 года. Архивировано из оригинала 18 февраля 2021 года . Проверено 29 августа 2021 г.
- ^ «Условия регистрации вакцины против COVID-19 Moderna» . Агентство по регулированию лекарственных средств и товаров медицинского назначения (MHRA). 8 января 2021 года. Архивировано из оригинала 18 февраля 2021 года . Проверено 29 августа 2021 г.
- ^ Jump up to: а б «Одобрение регулирующих органов Spikevax (ранее вакцина против COVID-19 Moderna)» . Агентство по регулированию лекарственных средств и товаров медицинского назначения (MHRA). 8 января 2021 года. Архивировано из оригинала 28 августа 2021 года . Проверено 29 августа 2021 г.
- ^ Jump up to: а б «Резюме отчета об общественной оценке Спикевакса» . Агентство по регулированию лекарственных средств и товаров медицинского назначения (MHRA). 19 февраля 2021 года. Архивировано из оригинала 22 апреля 2021 года . Проверено 29 августа 2021 г.
- ^ Jump up to: а б с д и ж г час я «Современный регламент вакцинации против COVID-19 для введения вакцины лицам в возрасте 18 лет и старше» (PDF) . Центры по контролю и профилактике заболеваний (CDC). 11 июля 2022 г. Архивировано (PDF) из оригинала 14 августа 2021 г. . Проверено 14 июля 2022 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе . - ^ «Современный регламент вакцинации против COVID-19 для введения вакцины лицам в возрасте от 12 до 17 лет» (PDF) . Центры по контролю и профилактике заболеваний (CDC). 11 июля 2022 г. Архивировано (PDF) из оригинала 16 июля 2022 г. . Проверено 14 июля 2022 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе . - ^ «Современный регламент вакцинации против COVID-19 для введения вакцины лицам в возрасте от 6 до 11 лет» (PDF) . Центры по контролю и профилактике заболеваний (CDC). 11 июля 2022 г. Архивировано (PDF) из оригинала 16 июля 2022 г. . Проверено 14 июля 2022 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе . - ^ «Современный регламент вакцинации против COVID-19 для введения вакцины лицам в возрасте от 6 месяцев до 5 лет» (PDF) . Центры по контролю и профилактике заболеваний (CDC). 11 июля 2022 г. Архивировано (PDF) из оригинала 16 июля 2022 г. . Проверено 14 июля 2022 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе . - ^ Jump up to: а б с д «FDA принимает меры по обновлению мРНК-вакцин против COVID-19 для лучшей защиты от циркулирующих в настоящее время вариантов» . США Управление по контролю за продуктами и лекарствами (FDA). 11 сентября 2023 г. Проверено 12 сентября 2023 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе . - ^ Jump up to: а б «FDA предпринимает ключевые действия, одобряя вторую вакцину против COVID-19» . США Управление по контролю за продуктами и лекарствами (FDA) (пресс-релиз). 31 января 2022 года. Архивировано из оригинала 31 января 2022 года . Проверено 31 января 2022 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе . - ^ «Спайвакс и вакцина Moderna против COVID-19» . США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) . 17 июня 2022 года. Архивировано из оригинала 18 июня 2022 года . Проверено 18 июня 2022 г.
- ^ Jump up to: а б «Обновление о коронавирусе (COVID-19): FDA разрешает использование вакцин Moderna и Pfizer-BioNTech против COVID-19 для детей в возрасте до 6 месяцев» . США Управление по контролю за продуктами и лекарствами (FDA) (пресс-релиз). 17 июня 2022 года. Архивировано из оригинала 17 июня 2022 года . Проверено 17 июня 2022 г.
- ^ Jump up to: а б с д и «Информационный бюллетень для поставщиков медицинских услуг, вводящих вакцину» (PDF) . США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) . 31 января 2022 года. Архивировано из оригинала 1 февраля 2022 года . Проверено 13 августа 2021 г.
- ^ Jump up to: а б с д «Современная вакцина против COVID-19-cx-024414 инъекционная, суспензия» . ДейлиМед . 17 июня 2022 года. Архивировано из оригинала 18 июня 2022 года . Проверено 17 июня 2022 г.
- ^ Jump up to: а б «Разрешение на экстренное использование современной вакцины против COVID-19» (PDF) . США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) . 17 июня 2022 года. Архивировано из оригинала 14 августа 2021 года . Проверено 17 июня 2022 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе . - ^ Jump up to: а б «Европейская комиссия санкционирует вторую безопасную и эффективную вакцину против COVID-19» . Европейская Комиссия (Пресс-релиз). 6 января 2021 года. Архивировано из оригинала 20 января 2021 года . Проверено 6 января 2021 г.
- ^ Jump up to: а б «Современная вакцина против COVID-19» . Европа . 22 июля 2022 года. Архивировано из оригинала 10 января 2022 года.
- ^ Jump up to: а б с «EMA рекомендует стандартные регистрационные удостоверения для вакцин Comirnaty и Spikevax против COVID-19» . Европейское агентство по лекарственным средствам (пресс-релиз). 16 сентября 2022 года. Архивировано из оригинала 16 сентября 2022 года . Проверено 18 сентября 2022 г. Текст скопирован из источника, права на который принадлежат Европейскому агентству по лекарственным средствам. Воспроизведение разрешено при условии указания источника.
- ^ «Информация о продукте Spikevax» . Союзный реестр лекарственных средств . Проверено 3 марта 2023 г.
- ^ Мандавилли А (19 июня 2022 г.). «CDC рекомендует вакцины против COVID-19 детям до 5 лет» . Нью-Йорк Таймс . Архивировано из оригинала 21 июня 2022 года . Проверено 21 июня 2022 г.
- ^ «Современная вакцина против COVID-19» . Дозирование и применение . Американское общество инфекционистов . 4 января 2021 г. Архивировано из оригинала 20 декабря 2020 г. Проверено 5 января 2021 г.
- ^ Jump up to: а б с «FDA разрешает вводить дополнительную дозу вакцины для некоторых лиц с ослабленным иммунитетом» . США Управление по контролю за продуктами и лекарствами (FDA) (пресс-релиз). 12 августа 2021 года. Архивировано из оригинала 7 декабря 2021 года . Проверено 13 августа 2021 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе . - ^ Jump up to: а б с «Вакцины против COVID-19 для людей с умеренным и тяжелым иммунодефицитом» . Центры США по контролю и профилактике заболеваний (CDC) . 13 августа 2021 года. Архивировано из оригинала 10 декабря 2021 года . Проверено 13 августа 2021 г.
- ^ Jump up to: а б с д и Баден Л.Р., Эль Сахли Х.М., Эссинк Б., Котлофф К., Фрей С., Новак Р. и др. (февраль 2021 г.). «Эффективность и безопасность вакцины мРНК-1273 SARS-CoV-2» . Медицинский журнал Новой Англии . 384 (5): 403–416. дои : 10.1056/NEJMoa2035389 . ПМЦ 7787219 . ПМИД 33378609 .
- ^ Jump up to: а б с «Moderna объявляет о клинических обновлениях бивалентной платформы для бустерной терапии COVID-19» . Модерна (Пресс-релиз). 19 апреля 2022 года. Архивировано из оригинала 6 мая 2022 года . Проверено 7 мая 2022 г.
- ^ Jump up to: а б с д «Первая двухвалентная бустерная вакцина против COVID-19, одобренная регулирующим органом Великобритании по лекарственным средствам» (пресс-релиз). Агентство по регулированию лекарственных средств и товаров медицинского назначения (MHRA). 15 августа 2022 года. Архивировано из оригинала 16 августа 2022 года . Проверено 16 августа 2022 г.
- ^ Jump up to: а б с «Одобрение регулирующих органов бивалентной оригинальной вакцины Spikevax/ревакцинации Omicron» . Агентство по регулированию лекарственных средств и товаров медицинского назначения (MHRA). 15 августа 2022 года. Архивировано из оригинала 16 августа 2022 года . Проверено 16 августа 2022 г.
- ^ «Swissmedic одобрила первую бивалентную бустерную вакцину против COVID-19 в Швейцарии» . Swissmedic (Пресс-релиз). 29 августа 2022 года. Архивировано из оригинала 29 августа 2022 года . Проверено 1 сентября 2022 г.
- ^ «TGA предварительно одобряет бивалентную вакцину Moderna против COVID-19 для использования в качестве ревакцинационной дозы у взрослых» (пресс-релиз). Управление терапевтическими товарами . 30 августа 2022 года. Архивировано из оригинала 1 сентября 2022 года . Проверено 1 сентября 2022 г.
- ^ «Краткое описание нормативного решения — бивалентный спайквакс» . Здоровье Канады . 1 сентября 2022 года. Архивировано из оригинала 1 сентября 2022 года . Проверено 1 сентября 2022 г.
- ^ Jump up to: а б с Буасверт Н. (1 сентября 2022 г.). «Министерство здравоохранения Канады одобрило обновленную вакцину Moderna для варианта Omicron» . Новости ЦБК . Архивировано из оригинала 1 сентября 2022 года . Проверено 1 сентября 2022 г.
- ^ Jump up to: а б «Обновление о коронавирусе (COVID-19): FDA разрешает использовать бивалентные вакцины Moderna, Pfizer-BioNTech против COVID-19 в качестве ревакцинации» (пресс-релиз). США Управление по контролю за продуктами и лекарствами (FDA). 31 августа 2022 года. Архивировано из оригинала 1 сентября 2022 года . Проверено 1 сентября 2022 г.
- ^ «CDC рекомендует первый обновленный бустер против COVID-19» (пресс-релиз). Центры США по контролю и профилактике заболеваний (CDC). 1 сентября 2022 года. Архивировано из оригинала 2 сентября 2022 года . Проверено 1 сентября 2022 г.
- ^ «Отслеживание вакцины против COVID-19: Moderna: мРНК-1273» . Университет Макгилла . Архивировано из оригинала 1 февраля 2022 года.
- ^ «Современная вакцина против COVID-19» . США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) . 7 июля 2021 года. Архивировано из оригинала 23 января 2021 года . Проверено 5 августа 2021 г.
- ^ Стевис-Гриднефф М. (6 января 2021 г.). «Регулятор ЕС по лекарствам одобряет вакцину Moderna» . Нью-Йорк Таймс . Архивировано из оригинала 6 августа 2021 года . Проверено 5 августа 2021 г.
- ^ Jump up to: а б «Moderna сообщает финансовые результаты за второй квартал 2021 финансового года и предоставляет обновленную информацию о бизнесе» . Moderna, Inc. (Пресс-релиз). 5 августа 2021 года. Архивировано из оригинала 6 августа 2021 года . Проверено 5 августа 2021 г.
- ^ «Moderna завершает подачу заявки в Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США на разрешение на экстренное использование двухвалентной бустерной вакцины против COVID-19, нацеленной на Омикрон, мРНК-1273.222» . Moderna, Inc., 23 августа 2022 г. Проверено 25 сентября 2022 г.
- ^ «Вакцина Moderna от COVID-19 (мРНК-1273): что вам нужно знать» . Всемирная организация здравоохранения (ВОЗ). 18 августа 2022 года. Архивировано из оригинала 2 сентября 2022 года . Проверено 1 сентября 2022 г.
- ^ Jump up to: а б «Комирнаты и Спикевакс: рекомендации EMA по дополнительным дозам бустеров» . Европейское агентство лекарственных средств (EMA) (пресс-релиз). 4 октября 2021 г. Архивировано из оригинала 11 декабря 2021 г. Проверено 4 октября 2021 г.
- ^ Jump up to: а б с д и Справочный документ по вакцине мРНК-1273 (Moderna) против COVID-19 (Отчет). Всемирная организация здравоохранения (ВОЗ). Февраль 2021 г. HDL : 10665/339218 . ВОЗ/2019-nCoV/vaccines/SAGE_recommendation/mRNA-1273/background/2021.1. Архивировано из оригинала 13 июня 2021 года . Проверено 2 мая 2021 г.
- ^ «Справочный документ по вакцине мРНК-1273 (Moderna) против COVID-19» . Всемирная организация здравоохранения (ВОЗ). 3 февраля 2021 года. Архивировано из оригинала 26 января 2022 года . Проверено 25 января 2022 г.
- ^ «Заседание Консультативного комитета по вакцинам и сопутствующим биологическим продуктам» (PDF) . США Управление по контролю за продуктами и лекарствами (FDA). 17 декабря 2020 года. Архивировано из оригинала 1 января 2022 года . Проверено 23 декабря 2020 г.
- ^ Брансвелл Х. (2 февраля 2021 г.). «Сравнение вакцин против Covid-19, разработанных компаниями Pfizer, Moderna и Johnson & Johnson» . Архивировано из оригинала 1 февраля 2022 года . Проверено 28 марта 2021 г.
- ^ Jump up to: а б Кунцманн К. (31 декабря 2020 г.). «Современная вакцина демонстрирует значительную эффективность профилактики COVID-19 по данным фазы 3» . Заражение в прямом эфире . Архивировано из оригинала 1 февраля 2022 года.
- ^ Мишра С.К., Трипати Т. (февраль 2021 г.). «Обзор пандемии COVID-19 за год: где мы сейчас находимся?» . Акта Тропика . 214 : 105778. doi : 10.1016/j.actatropica.2020.105778 . ПМЦ 7695590 . ПМИД 33253656 .
- ^ Мео С.А., Бухари И.А., Акрам Дж., Мео А.С., Клонофф, округ Колумбия (февраль 2021 г.). «Вакцины против COVID-19: сравнение биологических, фармакологических характеристик и побочных эффектов вакцин Pfizer/BioNTech и Moderna» . Европейский обзор медицинских и фармакологических наук . 25 (3): 1663–1669. дои : 10.26355/eurrev_202102_24877 . ПМИД 33629336 .
- ^ «Информационный документ для спонсора VRBPAC мРНК-1273» (PDF) . Модерна. 17 декабря 2020 года. Архивировано из оригинала 13 мая 2021 года . Проверено 1 января 2021 г.
- ^ Дженко Дж. (16 марта 2021 г.). «Современное тестирование вакцины против COVID-19 на детях до 12 лет» . Новости ААП . Архивировано из оригинала 3 ноября 2021 года . Проверено 10 апреля 2021 г.
- ^ Томпсон М.Г., Берджесс Дж.Л., Нэйлуэй А.Л., Тайнер Х.Л., Юн С.К., Мис Дж. и др. (апрель 2021 г.). «Промежуточные оценки эффективности вакцин BNT162b2 и мРНК-1273 против COVID-19 в предотвращении заражения SARS-CoV-2 среди медицинского персонала, лиц, оказывающих первую помощь, и других основных и передовых работников - восемь мест в США, декабрь 2020 г. – март 2021 г.» ( PDF) . ММВР. Еженедельный отчет о заболеваемости и смертности . 70 (13): 495–500. дои : 10.15585/mmwr.mm7013e3 . ПМЦ 8022879 . ПМИД 33793460 . Архивировано (PDF) из оригинала 28 августа 2021 года . Проверено 29 марта 2021 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе . - ^ Дориа-Роуз Н., Сутар М.С., Маковски М., О'Коннелл С., МакДермотт А.Б., Флах Б. и др. (июнь 2021 г.). «Сохранение антител через 6 месяцев после второй дозы вакцины мРНК-1273 от Covid-19» . N Engl J Med . 384 (23): 2259–2261. дои : 10.1056/NEJMc2103916 . ПМЦ 8524784 . ПМИД 33822494 .
- ^ «Moderna утверждает, что вакцина от Covid рассчитана на срок не менее шести месяцев» . Франция 24 . Агентство Франс-Пресс. 5 августа 2021 года. Архивировано из оригинала 11 августа 2021 года . Проверено 11 августа 2021 г.
- ^ Краузе П., Флеминг Т.Р., Лонгини И., Энао-Рестрепо А.М., Пето Р. (сентябрь 2020 г.). «Испытания вакцины против COVID-19 должны обеспечить достойную эффективность» . Ланцет . 396 (10253): 741–743. дои : 10.1016/S0140-6736(20)31821-3 . ПМЦ 7832749 . ПМИД 32861315 .
ВОЗ рекомендует, чтобы успешные вакцины демонстрировали предполагаемое снижение риска как минимум на половину с достаточной точностью, чтобы сделать вывод о том, что истинная эффективность вакцины превышает 30%. Это означает, что 95% ДИ для результата исследования должен исключать эффективность менее 30%. Текущие рекомендации Управления по контролю за продуктами и лекарствами США включают этот нижний предел в 30% в качестве критерия для лицензирования вакцины.
- ^ Хури Д.С., Кромер Д., Рейнальди А., Шлаб Т.Е., Уитли А.К., Джуно Дж.А. и др. (май 2021 г.). «Уровни нейтрализующих антител позволяют с высокой степенью прогнозировать иммунную защиту от симптоматической инфекции SARS-CoV-2» . Природная медицина . 27 (7): 1205–1211. дои : 10.1038/s41591-021-01377-8 . ISSN 1546-170Х . ПМИД 34002089 . S2CID 234769053 .
- ^ Фаулкс А., Гаглани М., Грувер К., Тиз М.С., Тайнер Х., Эллингсон К. (27 августа 2021 г.). «Эффективность вакцин против COVID-19 в предотвращении заражения SARS-CoV-2 среди рабочих на переднем крае до и во время преобладания варианта B.1.617.2 (Дельта) — восемь регионов США, декабрь 2020 г. – август 2021 г.» (PDF) . ММВР. Еженедельный отчет о заболеваемости и смертности . 70 (34): 1167–9. дои : 10.15585/mmwr.mm7034e4 . ПМЦ 8389394 . ПМИД 34437521 . Архивировано (PDF) из оригинала 5 февраля 2022 года . Проверено 15 сентября 2021 г.
- ^ Тан П., Хасан М.Р., Чемайтелли Х., Ясин Х.М., Бенслиман Ф.М., Аль Хатиб Х.А. и др. (2 ноября 2021 г.). «Эффективность вакцины BNT162b2 и мРНК-1273 против COVID-19 против дельта-варианта SARS-CoV-2 в Катаре» . Природная медицина . 27 (12): 2136–2143. дои : 10.1038/s41591-021-01583-4 . hdl : 10576/24856 . ISSN 1546-170Х . ПМИД 34728831 . S2CID 241108406 .
Таблицы 3 и 5
- ^ Чунг Х., Хе С., Насрин С., Сундарам М.Э., Бьюкен С.А., Уилсон С.Е. и др. (август 2021 г.). «Эффективность вакцин BNT162b2 и мРНК-1273 covid-19 против симптоматической инфекции SARS-CoV-2 и тяжелых исходов covid-19 в Онтарио, Канада: исследование с отрицательным результатом теста» . БМЖ . 374 : н1943. дои : 10.1136/bmj.n1943 . ПМЦ 8377789 . ПМИД 34417165 .
Таблицы 6 и 7
- ^ Jump up to: а б «Рекомендации по вакцинации беременных и кормящих грудью» . Центры США по контролю и профилактике заболеваний (CDC). 18 марта 2021 года. Архивировано из оригинала 5 января 2022 года . Проверено 24 апреля 2021 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе . - ^ Симабукуро Т (1 марта 2021 г.). «Обновление безопасности вакцин против COVID-19» (PDF) . Центры США по контролю и профилактике заболеваний . Архивировано (PDF) из оригинала 7 июня 2021 года . Проверено 30 марта 2021 г.
- ^ Смит К. (24 апреля 2021 г.). «Новое руководство CDC рекомендует беременным сделать вакцину от COVID-19» . Новости CBS. Архивировано из оригинала 24 апреля 2021 года . Проверено 24 апреля 2021 г.
- ^ Симабукуро Т.Т., Ким С.Ю., Майерс Т.Р., Моро П.Л., Одуебо Т., Панагиотакопулос Л. и др. (июнь 2021 г.). «Предварительные данные о безопасности вакцины мРНК Covid-19 у беременных» . Медицинский журнал Новой Англии . 384 (24): 2273–2282. дои : 10.1056/NEJMoa2104983 . ПМЦ 8117969 . ПМИД 33882218 .
- ^ Вайзе Э (7 апреля 2021 г.). «Пальцы ног от COVID-19, рука Moderna, сыпь по всему телу: вакцины могут вызывать кожные реакции, но не опасны, говорится в исследовании» . США сегодня . Архивировано из оригинала 1 февраля 2022 года.
- ^ Группа реагирования CDC на COVID-19 (январь 2021 г.). «Аллергические реакции, включая анафилаксию, после получения первой дозы вакцины Moderna против COVID-19 — США, 21 декабря 2020 г. – 10 января 2021 г.» (PDF) . ММВР. Еженедельный отчет о заболеваемости и смертности . 70 (4): 125–129. doi : 10.15585/mmwr.mm7004e1 . ПМЦ 7842812 . ПМИД 33507892 . Архивировано (PDF) из оригинала 1 сентября 2021 года . Проверено 25 апреля 2021 г.
{{cite journal}}: CS1 maint: числовые имена: список авторов ( ссылка ) В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе . - ^ Блюменталь К.Г., Фриман Э.Э., Сафф Р.Р., Робинсон Л.Б., Вольфсон А.Р., Форман Р.К. и др. (апрель 2021 г.). «Отсроченные крупные местные реакции на вакцину мРНК-1273 против SARS-CoV-2» . Медицинский журнал Новой Англии . 384 (13): 1273–1277. дои : 10.1056/NEJMc2102131 . ПМЦ 7944952 . ПМИД 33657292 .
- ^ «Клинические аспекты: миокардит после введения мРНК вакцины против COVID-19» . Центры США по контролю и профилактике заболеваний (CDC) . 3 июня 2022 года. Архивировано из оригинала 27 июня 2021 года . Проверено 27 июня 2021 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе . - ^ Остер М.Э., Шей Д.К., Су Дж.Р., Джи Дж., Крич С.Б., Бродер К.Р. и др. (январь 2022 г.). «Случаи миокардита, зарегистрированные после вакцинации против COVID-19 на основе мРНК в США с декабря 2020 года по август 2021 года» . ДЖАМА . 327 (4): 331–340. дои : 10.1001/jama.2021.24110 . ПМЦ 8790664 . ПМИД 35076665 .
- ^ Национальный центр иммунизации и респираторных заболеваний (23 июня 2021 г.). «Миокардит и перикардит после вакцинации мРНК от COVID-19» . Центры по контролю и профилактике заболеваний. Архивировано из оригинала 3 июля 2021 года . Проверено 2 июля 2021 г.
- ^ Jump up to: а б «Обновленная информация о безопасности вакцин против COVID-19» (PDF) . Европейское агентство по лекарственным средствам . 3 августа 2022 г. Архивировано (PDF) из оригинала 3 августа 2022 г. . Проверено 3 августа 2022 г. Текст скопирован из источника, права на который принадлежат Европейскому агентству по лекарственным средствам. Воспроизведение разрешено при условии указания источника.
- ^ Jump up to: а б Автор: DR, Powell MB (14 сентября 2020 г.). «Патентные проблемы подчеркивают риски, связанные с вакциной Moderna против COVID-19» . Нью-Йоркский юридический журнал . Архивировано из оригинала 15 октября 2020 года . Проверено 1 декабря 2020 г.
- ^ Кросс Р (29 сентября 2020 г.). «Маленькая поправка к вакцинам против COVID-19» . Новости химии и техники . 98 (38). Архивировано из оригинала 16 февраля 2021 года . Проверено 30 сентября 2020 г.
- ^ Джонсон CY (6 декабря 2020 г.). «Азартная игра окупается «впечатляющим успехом»: как ведущие вакцины против коронавируса добрались до финиша» . Вашингтон Пост . Архивировано из оригинала 6 марта 2021 года . Проверено 9 декабря 2020 г.
- ^ Крамер Дж. (31 декабря 2020 г.). «Они потратили 12 лет на решение головоломки. В результате были созданы первые вакцины от COVID-19» . Нэшнл Географик . Архивировано из оригинала 28 февраля 2021 года . Проверено 8 марта 2021 г.
- ^ «Идентификатор Генбанка MN908947.3» . Национальный центр биотехнологической информации . 18 марта 2020 года. Архивировано из оригинала 11 января 2022 года . Проверено 11 июля 2021 г.
- ^ Всемирная организация здравоохранения (июнь 2021 г.). «Предлагаемые международные непатентованные наименования МНН: Список 125 COVID-19 (специальное издание)» . Информация ВОЗ о лекарствах . 35 (2): 578–9. hdl : 10665/343367 .
- ^ Jump up to: а б с д Джексон Л.А., Андерсон Э.Дж., Руфаэль Н.Г., Робертс П.С., Махен М., Колер Р.Н. и др. (ноябрь 2020 г.). «МРНК-вакцина против SARS-CoV-2 – предварительный отчет» . Медицинский журнал Новой Англии . 383 (20): 1920–1931. дои : 10.1056/NEJMoa2022483 . ПМЦ 7377258 . ПМИД 32663912 .
- ^ Чон Д.Е., Маккой М., Артилес К., Илбай О., Файр А., Надо К. и др. (23 марта 2021 г.). «Сборки предполагаемых последовательностей мРНК, кодирующих спайки SARS-CoV2, для вакцин BNT-162b2 и мРНК-1273» . Вирусологический.org . Архивировано из оригинала 1 февраля 2022 года.
- ^ Спрингер П. (24 мая 2021 г.). «Фирма Fargo производит ключевой ингредиент для миллионов доз вакцины против COVID-19» . Гранд Форкс Геральд . Архивировано из оригинала 22 августа 2021 года . Проверено 25 мая 2021 г.
- ^ Jump up to: а б Маллин Р. (25 ноября 2020 г.). «Pfizer, Moderna готовы к производству вакцин» . Новости химии и техники . Американское химическое общество. Архивировано из оригинала 11 декабря 2020 года . Проверено 21 декабря 2020 г. .
- ^ Кот J (4 мая 2021 г.). «Moderna увеличит размер предприятия в Массачусетсе более чем вдвое, превратит производство и лабораторные помещения в промышленный технологический центр» . МассЛайв . Архивировано из оригинала 25 июля 2021 года . Проверено 28 мая 2021 г.
- ^ «Lonza и Moderna объявляют о дальнейшем сотрудничестве в производстве лекарственных средств для вакцины против COVID-19 Moderna в Нидерландах» . www.lonza.com . 2 июня 2021 г. Проверено 25 декабря 2022 г.
- ^ «Moderna удвоит производство вакцин в ЕС, открыв новое предприятие в Нидерландах» . Политик . 2 июня 2021 г. Проверено 25 декабря 2022 г.
- ^ Хопкинс Дж.С. (6 апреля 2021 г.). «Темпы производства современной вакцины против Covid-19 в компании Catalent, работающей по контракту, будут увеличиваться» . Уолл Стрит Джорнал . Архивировано из оригинала 13 апреля 2021 года . Проверено 13 апреля 2021 г.
- ^ Лофтус П (21 марта 2021 г.). «Производство вакцины против Covid-19 в США стремительно набирает обороты» . Уолл Стрит Джорнал . Архивировано из оригинала 28 апреля 2021 года . Проверено 29 апреля 2021 г.
- ^ Уильямс Дж. (29 апреля 2021 г.). «Современное удвоение производства вакцины против COVID-19» . Холм . Архивировано из оригинала 29 апреля 2021 года . Проверено 29 апреля 2021 г.
- ^ Лофтус П (29 апреля 2021 г.). «Moderna увеличит производство вакцины против Covid-19, чтобы удовлетворить растущий мировой спрос» . Уолл Стрит Джорнал . Архивировано из оригинала 29 апреля 2021 года . Проверено 29 апреля 2021 г.
- ^ «Хранение вакцины Pfizer-BioNTech против COVID-19 и безопасное обращение с сухим льдом» . Пфайзер. Архивировано из оригинала 1 февраля 2022 года . Проверено 17 декабря 2020 г.
- ^ Jump up to: а б с Лавлейс-младший Б., Хиггинс-Данн Н. (16 ноября 2020 г.). «Moderna заявляет, что предварительные данные испытаний показывают, что ее вакцина от коронавируса эффективна более чем на 94%, акции растут» . CNBC . Архивировано из оригинала 16 ноября 2020 года . Проверено 17 ноября 2020 г. .
- ^ МакГрегор Дж. (5 декабря 2020 г.). «Как китайский COVID-19 может заполнить пробелы, оставленные Pfizer, Moderna, AstraZeneca» . Удача . Архивировано из оригинала 12 декабря 2020 года . Проверено 5 декабря 2020 г.
- ^ «О вакцине Pfizer не может быть и речи, поскольку в Индонезии не хватает холодильников: глава государственной фармацевтической компании» . Джакарта Глобус . 22 ноября 2020 г. Архивировано из оригинала 7 декабря 2020 г. . Проверено 5 декабря 2020 г.
- ^ «Обновление о коронавирусе (COVID-19): FDA обеспечивает более гибкие условия хранения и транспортировки вакцины Pfizer-BioNTech против COVID-19» . США Управление по контролю за продуктами и лекарствами (FDA) (пресс-релиз). 25 февраля 2021 года. Архивировано из оригинала 25 февраля 2021 года . Проверено 25 февраля 2021 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе . - ^ «Pfizer и BioNTech предоставляют в FDA США данные о стабильности вакцины против COVID-19 при стандартной температуре замораживания» . Pfizer (пресс-релиз). 19 февраля 2021 года. Архивировано из оригинала 26 апреля 2021 года . Проверено 19 февраля 2021 г.
- ^ «Хранение и обработка» . Модерна. 11 августа 2021 года. Архивировано из оригинала 10 января 2022 года . Проверено 11 августа 2021 г.
- ^ Долгин Э (ноябрь 2020 г.). «Вакцины против COVID-19 готовы к выпуску, но влияние на пандемию неясно». Природная биотехнология . дои : 10.1038/d41587-020-00022-y . ПМИД 33239758 . S2CID 227176634 .
- ^ Стинхейсен Дж., Келланд К. (24 января 2020 г.). «Имея в руках генетический код уханьского вируса, ученые начинают работу над вакциной» . Рейтер . Архивировано из оригинала 25 января 2020 года . Проверено 26 января 2020 г. .
- ^ Кэри К. (26 февраля 2020 г.). «По мере распространения вируса растет число биофармацевтических препаратов, нацеленных на COVID-19» . Биомир. Архивировано из оригинала 27 февраля 2020 года . Проверено 1 марта 2020 г.
- ^ Эверетт Дж. (27 февраля 2020 г.). «Эти пять разработчиков лекарств на этой неделе прыгнули в надежде, что смогут обеспечить лечение коронавируса» . Инсайдер рынка. Архивировано из оригинала 16 ноября 2020 года . Проверено 1 марта 2020 г.
- ^ «Moderna объявляет о расширении соглашения BARDA для поддержки более широкой программы фазы 3 по разработке вакцины (мРНК-1273) против COVID-19» . Модерна. 26 июля 2020 года. Архивировано из оригинала 25 апреля 2021 года . Проверено 25 апреля 2021 г.
- ^ Кластер А (24 ноября 2020 г.). «Проверка фактов: вакцина Moderna финансируется за счет государственных расходов при значительных частных пожертвованиях» . США сегодня . Архивировано из оригинала 25 апреля 2021 года . Проверено 25 апреля 2021 г.
- ^ Грейди Д. (16 ноября 2020 г.). «Первые данные показывают, что вакцина от коронавируса Moderna эффективна на 94,5%» . Нью-Йорк Таймс . Архивировано из оригинала 24 февраля 2021 года . Проверено 25 апреля 2021 г.
- ^ «Долли Партон для меня большая честь и гордость помочь в борьбе с Covid-19» . Новости Би-би-си . 18 ноября 2020 года. Архивировано из оригинала 19 августа 2021 года . Проверено 14 августа 2021 г.
- ^ «Начинаются клинические испытания NIH экспериментальной вакцины от COVID-19» . Национальные институты здравоохранения (NIH) . 16 марта 2020 г. Архивировано из оригинала 19 марта 2020 г. . Проверено 18 марта 2020 г.
- ^ Кузня Р., Полглас К., Меццофиоре Дж. (1 мая 2020 г.). «В поисках вакцины США делают «большую ставку» на компании с непроверенными технологиями» . CNN . Архивировано из оригинала 13 мая 2020 года . Проверено 2 мая 2020 г.
- ^ Киоун А (7 мая 2020 г.). «Moderna переходит ко второй фазе испытаний кандидатной вакцины против COVID-19» . Биокосмос. Архивировано из оригинала 16 ноября 2020 года . Проверено 9 мая 2020 г.
- ^ Бланкеншип К. (1 мая 2020 г.). «Moderna стремится производить миллиард прививок от COVID-19 в год благодаря производственному сотрудничеству с Lonza» . Жесткая Фарма . Архивировано из оригинала 16 ноября 2020 года.
- ^ «Швейцарская фабрика спешит подготовить вакцину Moderna Covid-19» . SWI swissinfo.ch . 7 октября 2020 г. Архивировано из оригинала 16 ноября 2020 г. Проверено 7 октября 2020 г.
- ^ Номер клинического исследования NCT04405076 «Исследование подтверждения дозы для оценки безопасности, реактогенности и иммуногенности мРНК-1273 вакцины против COVID-19 у взрослых в возрасте 18 лет и старше» на сайте ClinicalTrials.gov.
- ^ Ли Ю (14 июля 2020 г.). «Фьючерсы на индекс Dow подскочили более чем на 200 пунктов после того, как компания Moderna заявила, что ее вакцина вырабатывает антитела к коронавирусу» . CNBC . Архивировано из оригинала 16 ноября 2020 года . Проверено 15 июля 2020 г.
- ^ Jump up to: а б Херпер М., Гард Д. (14 июля 2020 г.). «Первые данные о вакцине Moderna Covid-19 показывают, что она стимулирует иммунный ответ» . Стат . Архивировано из оригинала 14 июля 2020 года . Проверено 15 июля 2020 г.
- ^ Матеус Дж., Дэн Дж.М., Чжан З., Модербахер Ч.Р., Ламмерс М., Гудвин Б. и др. (2021). «Низкие дозы мРНК-1273 вакцины против COVID-19 создают устойчивую память, усиленную перекрестно-реактивными Т-клетками» . Наука . 374 (6566): eabj9853. дои : 10.1126/science.abj9853 . ПМЦ 8542617 . ПМИД 34519540 .
- ^ Брайант Э. (5 октября 2021 г.). «Современная вакцина против COVID-19 формирует долговременную иммунную память» . Вопросы исследований НИЗ . Национальные институты здравоохранения. Архивировано из оригинала 10 ноября 2021 года . Проверено 10 ноября 2021 г.
- ^ Палка Дж. (27 июля 2020 г.). «Кандидат на вакцину против COVID-19 готовится к широкомасштабным испытаниям в США» NPR . Архивировано из оригинала 11 октября 2020 года . Проверено 27 июля 2020 г.
- ^ Пальяруло Н, изд. (17 сентября 2020 г.). «Модерна, стремясь к прозрачности, раскрывает подробный план испытаний вакцины от коронавируса» . Биофарма Дайв . Архивировано из оригинала 16 ноября 2020 года . Проверено 18 сентября 2020 г.
- ^ Маскареньяш Л. (1 октября 2020 г.). «Руководитель Moderna говорит, что вакцина от Covid-19 может стать широко доступной к концу марта» . CNN . Архивировано из оригинала 16 ноября 2020 года . Проверено 2 октября 2020 г. .
- ^ Коэн Э (22 октября 2020 г.). «Первое крупномасштабное испытание вакцины против Covid-19 в США достигло цели в 30 000 участников» . CNN . Архивировано из оригинала 16 ноября 2020 года . Проверено 23 октября 2020 г.
- ^ «Многообещающие промежуточные результаты клинических испытаний вакцины против COVID-19 NIH-Moderna» . Национальные институты здравоохранения (NIH) . 15 ноября 2020 года. Архивировано из оригинала 4 января 2021 года . Проверено 19 декабря 2020 г.
- ^ «Современное использование теста на антитела компании Roche во время испытаний вакцин» . www.rapidmicrobiology.com . 10 декабря 2020 года. Архивировано из оригинала 10 января 2022 года . Проверено 13 декабря 2020 г.
- ^ Jump up to: а б «Заявление Национального института здравоохранения и BARDA о разрешении FDA на экстренное использование вакцины Moderna против COVID-19» . Национальные институты здравоохранения . 18 декабря 2020 года. Архивировано из оригинала 19 марта 2021 года . Проверено 19 декабря 2020 г.
- ^ Циммер С (20 ноября 2020 г.). «Две компании заявляют, что их вакцины эффективны на 95%. Что это значит? Можно предположить, что 95 из каждых 100 вакцинированных человек будут защищены от Covid-19. Но математика работает не так» . Нью-Йорк Таймс . Архивировано из оригинала 22 ноября 2020 года . Проверено 21 ноября 2020 г.
- ^ Номер клинического исследования NCT04470427 «Исследование по оценке эффективности, безопасности и иммуногенности вакцины мРНК-1273 у взрослых в возрасте 18 лет и старше для предотвращения COVID-19» на сайте ClinicalTrials.gov.
- ^ Лутра С. (23 ноября 2020 г.). «Беременные женщины не участвовали в многообещающих испытаниях вакцины против COVID-19» . США сегодня . Архивировано из оригинала 10 января 2022 года.
- ^ Крубинер С., Фаден Р.Р., Каррон Р.А. (9 декабря 2020 г.). «FDA: Оставьте дверь открытой для вакцинации против Covid-19 беременных и кормящих работников здравоохранения» . СТАТ . Архивировано из оригинала 10 января 2022 года.
- ^ Лофтус П (16 марта 2021 г.). «Moderna тестирует свою вакцину от Covid-19 на маленьких детях» . Уолл Стрит Джорнал . Архивировано из оригинала 16 марта 2021 года . Проверено 16 марта 2021 г.
- ^ «Современное тестирование вакцины против COVID-19 на детях до 12 лет» . Американская академия педиатрии. 16 марта 2021 года. Архивировано из оригинала 3 ноября 2021 года . Проверено 10 апреля 2021 г.
- ^ Коэн Э (30 ноября 2020 г.). «Moderna подает заявку на получение разрешения FDA на свою вакцину против Covid-19» . CNN . Архивировано из оригинала 3 декабря 2020 года . Проверено 4 декабря 2020 г.
- ^ Бургер Л (1 декабря 2020 г.). «Спринт по вакцине против COVID-19: Pfizer-BioNTech и Moderna запросили экстренное одобрение ЕС» . Рейтер . Архивировано из оригинала 3 декабря 2020 года . Проверено 4 декабря 2020 г.
- ^ Кюхлер Х. (30 ноября 2020 г.). «Канада может быть одной из первых, кто разрешит использование вакцины против COVID-19 компании Moderna» . Финансовая почта . Архивировано из оригинала 4 декабря 2020 года . Проверено 4 декабря 2020 г.
- ^ Парсонс Л. (28 октября 2020 г.). «Великобританское MHRA начинает проверку вакцины Moderna против COVID-19» . ФармаТаймс. Архивировано из оригинала 30 ноября 2020 года . Проверено 4 декабря 2020 г.
- ^ «FDA принимает дополнительные меры в борьбе с COVID-19, выдавая разрешение на экстренное использование второй вакцины против COVID-19» . США Управление по контролю за продуктами и лекарствами (FDA) (пресс-релиз). 18 декабря 2020 года. Архивировано из оригинала 17 марта 2021 года . Проверено 18 декабря 2020 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе . - ^ Ли Джей (16 декабря 2020 г.). «Moderna близка к получению первого в истории разрешения FDA на свою вакцину против COVID-19» . МаркетВотч . Архивировано из оригинала 16 апреля 2021 года . Проверено 19 декабря 2020 г.
- ^ Jump up to: а б Оливер С.Е., Гаргано Дж.В., Марин М., Уоллес М., Карран К.Г., Чемберленд М. и др. (январь 2021 г.). «Временная рекомендация Консультативного комитета по практике иммунизации по использованию вакцины Moderna против COVID-19 — США, декабрь 2020 г.» (PDF) . ММВР. Еженедельный отчет о заболеваемости и смертности . 69 (5152): 1653–6. doi : 10.15585/mmwr.mm695152e1 . ISSN 0149-2195 . ПМК 9191904 . ПМИД 33382675 . S2CID 229945697 . Архивировано (PDF) из оригинала 9 февраля 2021 года . Проверено 21 декабря 2020 г. .
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе . - ^ Jump up to: а б «Современные вакцины против COVID-19» . Управление по контролю за продуктами и лекарствами США . 20 апреля 2023 г. Проверено 23 апреля 2023 г.
- ^ Jump up to: а б «Обновление о коронавирусе (COVID-19): FDA разрешает внести изменения, упрощающие использование вакцин против COVID-19 с бивалентной мРНК» . Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (пресс-релиз). 18 апреля 2023 г. Проверено 23 апреля 2023 г.
- ^ «Краткое описание нормативного решения – вакцина Moderna против COVID-19» . Здоровье Канады . 23 декабря 2020 года. Архивировано из оригинала 15 января 2021 года . Проверено 23 декабря 2020 г.
- ^ «Израиль разрешает использование вакцины против COVID-19 компании Moderna» . Yahoo! Новости . 4 января 2021 года. Архивировано из оригинала 5 января 2021 года . Проверено 5 января 2021 г.
- ^ «Сингапур становится первым в Азии, кто одобрил вакцину Moderna от COVID-19» . Рейтер . 3 февраля 2021 года. Архивировано из оригинала 10 января 2022 года . Проверено 3 февраля 2021 г.
- ^ «ВОЗ вносит вакцину Moderna в список экстренного использования» . Всемирная организация здравоохранения (ВОЗ) (пресс-релиз). 30 апреля 2021 года. Архивировано из оригинала 6 мая 2021 года . Проверено 29 мая 2021 г.
- ^ «ВОЗ вносит в список вакцину против COVID Moderna для экстренного использования» . Филиппинский Daily Inquirer. Агентство Франс-Пресс. 1 мая 2021 года. Архивировано из оригинала 1 мая 2021 года . Проверено 1 мая 2021 г.
- ^ Лопес V (5 мая 2021 г.). «Филиппины предоставляют EUA вакцину от COVID-19 компании Moderna» . Новости GMA онлайн . Архивировано из оригинала 5 мая 2021 года . Проверено 5 мая 2021 г.
- ^ «Японская компания Takeda импортирует 50 миллионов доз вакцины против COVID-19 компании Moderna, что повышает прогноз прибыли» . Рейтер . 29 октября 2020 года. Архивировано из оригинала 9 июля 2021 года . Проверено 2 июля 2021 г.
- ^ Бальфур Х. (2 ноября 2020 г.). «Такеда поставит в Японию вакцину против COVID-19 компании Moderna» . Европейский фармацевтический обзор . Архивировано из оригинала 10 января 2022 года.
- ^ «Начало японского клинического исследования TAK-919, кандидатной вакцины Moderna против COVID-19» (пресс-релиз). Такеда. 21 января 2021 года. Архивировано из оригинала 25 февраля 2021 года . Проверено 11 марта 2021 г.
- ^ Каул Р. (29 июня 2021 г.). «Вакцина Moderna от Covid одобрена для использования в Индии» . Индостан Таймс . Архивировано из оригинала 20 октября 2021 года . Проверено 29 июня 2021 г.
- ^ Нга Л (29 июня 2021 г.). «Вьетнам одобрил вакцину Moderna Covid для экстренного использования» . ВнЭкспресс. Архивировано из оригинала 1 июля 2021 года . Проверено 1 июля 2021 г.
- ^ «NPRA одобрила вакцину Moderna Covid-19» . КодBlue. 5 августа 2021 года. Архивировано из оригинала 7 августа 2021 года . Проверено 8 августа 2021 г.
- ^ «EMA рекомендует вакцину против COVID-19 Moderna для авторизации в ЕС» (пресс-релиз). Европейское агентство лекарственных средств (EMA). 6 января 2021 года. Архивировано из оригинала 17 марта 2021 года . Проверено 6 января 2021 г.
- ^ «Вакцина против COVID-19 Spikevax одобрена для детей в возрасте от 12 до 17 лет в ЕС» . Европейское агентство лекарственных средств (EMA) (пресс-релиз). 23 июля 2021 года. Архивировано из оригинала 26 ноября 2021 года . Проверено 10 ноября 2021 г.
- ^ Миллер Дж. (12 января 2021 г.). «Швейцарский регулятор по лекарственным средствам одобрил вакцину против COVID-19 компании Moderna» . Рейтер . Архивировано из оригинала 12 января 2021 года . Проверено 17 января 2021 г.
- ^ «Swissmedic выдает разрешение на вакцину против COVID-19 от Moderna» . Swissmedic (Пресс-релиз). 12 января 2020 года. Архивировано из оригинала 11 февраля 2021 года . Проверено 12 января 2020 г.
- ^ «Swissmedic одобряет продление показаний к вакцине Spikevax для детей в возрасте от 12 до 17 лет» . Swissmedic (Пресс-релиз). 11 июня 2021 года. Архивировано из оригинала 18 июня 2022 года . Проверено 5 июля 2022 г.
- ^ «Современная вакцина против COVID-19, разрешенная в Швейцарии для детей в возрасте от 6 до 11 лет» . Swissmedic (Пресс-релиз). 13 мая 2022 года. Архивировано из оригинала 16 июня 2022 года . Проверено 5 июля 2022 г.
- ^ «Вакцины против COVID-19 от Moderna и Pfizer/BioNTech: Swissmedic одобряет третью вакцинацию для определенных групп населения» . Swissmedic (Пресс-релиз). 26 октября 2021 года. Архивировано из оригинала 30 мая 2022 года . Проверено 5 июля 2022 г.
- ^ «Swissmedic одобрила бустерную дозу вакцины Moderna от COVID-19 для взрослых в возрасте от 18 лет и старше» . Swissmedic (Пресс-релиз). 26 октября 2021 года. Архивировано из оригинала 30 мая 2022 года . Проверено 5 июля 2022 г.
- ^ Казалетто Л (16 сентября 2021 г.). «Вакцины Pfizer и Moderna получили полное одобрение Министерства здравоохранения Канады; измените название» . Городские новости . Архивировано из оригинала 10 января 2022 года . Проверено 17 сентября 2021 г.
- ^ Макдоннелл Ньето дель Рио Джи (15 января 2021 г.). «Covid-19: более двух миллионов человек во всем мире умерли от вируса» . Нью-Йорк Таймс . Архивировано из оригинала 18 января 2021 года . Проверено 18 января 2021 г.
- ^ Тиррелл М. (14 января 2021 г.). «Moderna надеется протестировать прививки от Covid-19 через год после первоначальной вакцинации» . CNBC . Архивировано из оригинала 10 января 2022 года . Проверено 18 января 2021 г.
- ^ Лофтус П. «Moderna исследует, добавляет ли третья доза вакцины против Covid-19 дополнительную защиту» . Уолл Стрит Джорнал . Архивировано из оригинала 15 января 2021 года . Проверено 18 января 2021 г.
- ^ Jump up to: а б Грейди Д., Мандавилли А., Томас К. (25 января 2021 г.). «Эффективна ли вакцина Covid-19 против нового южноафриканского варианта?» . Нью-Йорк Таймс . Архивировано из оригинала 10 января 2022 года . Проверено 25 января 2021 г.
- ^ "Коронавирус заболевание 2019" . Центры по контролю и профилактике заболеваний (пресс-релиз). 10 января 2022 года. Архивировано из оригинала 4 февраля 2022 года . Проверено 4 февраля 2022 г.
- ^ «Обновление о коронавирусе (COVID-19): FDA сокращает интервал для бустерной дозы вакцины Moderna против COVID-19 до пяти месяцев» . США Управление по контролю за продуктами и лекарствами (FDA) (пресс-релиз). 7 января 2022 года. Архивировано из оригинала 4 февраля 2022 года . Проверено 4 февраля 2022 г.
- ^ «EMA оценивает данные о ревакцинации вакцины против COVID-19 Спикевакс» . Европейское агентство лекарственных средств (EMA) (пресс-релиз). 27 сентября 2021 года. Архивировано из оригинала 27 сентября 2021 года . Проверено 27 сентября 2021 г. Текст скопирован из источника, права на который принадлежат Европейскому агентству по лекарственным средствам. Воспроизведение разрешено при условии указания источника.
- ^ «ECDC и EMA подчеркивают необходимость дополнительных бустерных доз вакцины против COVID-19» . Европейское агентство лекарственных средств (EMA) (пресс-релиз). 2 сентября 2021 г. Архивировано из оригинала 28 сентября 2021 г. Проверено 27 сентября 2021 г.
- ^ «FDA принимает дополнительные меры по использованию бустерной дозы вакцин против COVID-19» . США Управление по контролю за продуктами и лекарствами (FDA) (пресс-релиз). 21 октября 2021 года. Архивировано из оригинала 7 декабря 2021 года . Проверено 22 октября 2021 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе . - ^ «CDC расширяет право на повторные прививки от COVID-19» . Центры США по контролю и профилактике заболеваний (CDC) . 21 октября 2021 года. Архивировано из оригинала 7 декабря 2021 года . Проверено 22 октября 2021 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе . - ^ Jump up to: а б «FDA расширяет право на бустеры вакцины против COVID-19» . США Управление по контролю за продуктами и лекарствами (FDA) (пресс-релиз). 19 ноября 2021 года. Архивировано из оригинала 19 ноября 2021 года . Проверено 19 ноября 2021 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе . - ^ «FDA сокращает интервал для бустерной дозы вакцины Moderna против COVID-19 до пяти месяцев» . США Управление по контролю за продуктами и лекарствами (FDA) (пресс-релиз). 7 января 2022 года. Архивировано из оригинала 7 января 2022 года . Проверено 7 января 2022 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе . - ^ «Современное обновление вакцины против COVID-19» . Moderna, Inc. 25 января 2021 г. Архивировано из оригинала (PDF) 29 июня 2021 г. . Проверено 26 января 2021 г.
- ^ «Moderna объявляет, что отправила в НИЗ для клинического исследования вариант-специфическую вакцину-кандидат, мРНК-1273.351» . Moderna Inc. (Пресс-релиз). 24 февраля 2021 года. Архивировано из оригинала 24 февраля 2021 года . Проверено 24 февраля 2021 г.
- ^ «Исследование по оценке иммуногенности и безопасности вакцины мРНК-1273.211 для вариантов COVID-19» . ClinicalTrials.gov . 15 июня 2021 года. Архивировано из оригинала 6 августа 2021 года . Проверено 5 августа 2021 г.
- ^ «Moderna объявляет о положительных первичных данных о ревакцинации против вызывающих беспокойство вариантов SARS-CoV-2» . Moderna, Inc. (Пресс-релиз). 5 мая 2021 года. Архивировано из оригинала 2 декабря 2021 года . Проверено 22 августа 2021 г.
- ^ «Вакцина против COVID-19: Спикевакс бивалентный оригинал/Омикрон (элазомеран/имелазомеран)» . Управление терапевтическими товарами . 23 сентября 2022 г.
- ^ «Спайвакс бивалент» . Здоровье Канады . 1 сентября 2022 г. Проверено 30 октября 2022 г.
- ^ «Обновление о коронавирусе (COVID-19): FDA разрешает использовать бивалентные вакцины Moderna и Pfizer-BioNTech против COVID-19 в качестве ревакцинационной дозы в более молодых возрастных группах» . Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (пресс-релиз). 12 октября 2022 г. Проверено 13 октября 2022 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе . - ^ «Обновление о коронавирусе (COVID-19): FDA разрешает обновленные (двухвалентные) вакцины против COVID-19 для детей в возрасте до 6 месяцев» . Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (пресс-релиз). 8 декабря 2022 г. Проверено 25 января 2023 г.
- ^ «Спайвакс» . США Управление по контролю за продуктами и лекарствами (FDA). 11 сентября 2023 г. Проверено 12 сентября 2023 г.
- ^ «Современная вакцина против COVID-19» . США Управление по контролю за продуктами и лекарствами (FDA). 11 сентября 2023 г. Проверено 12 сентября 2023 г.
- ^ Придди Ф (12 сентября 2023 г.). «Безопасность и иммуногенность вакцины Moderna против COVID-19 (формула 2023–2024 гг.) — моновалентная вакцина, вариант XBB.1.5» (PDF) . Центры по контролю и профилактике заболеваний . Архивировано (PDF) из оригинала 15 сентября 2023 года . Проверено 15 сентября 2023 г.
- ^ Винтер Д.Э., Ло М. (14 сентября 2023 г.). «Заявление главного хирурга Флориды о том, что обновленные вакцины против COVID не прошли клинических испытаний, в том числе на людях, вводит в заблуждение» . ПРОВЕРЯТЬ . Архивировано из оригинала 15 сентября 2023 года . Проверено 15 сентября 2023 г.
- ^ Джадд А. (12 сентября 2023 г.). «Приготовьтесь к масштабной кампании по вакцинации от COVID и гриппа, - заявляет правительство Британской Колумбии» . Глобальные новости . Архивировано из оригинала 13 сентября 2023 года . Проверено 15 сентября 2023 г.
- ^ «Одобрение регулирующих органов адаптированной вакцины Spikevax (ранее Covid-19 Vaccine Moderna) XBB.1.5» . Агентство по регулированию лекарственных средств и товаров медицинского назначения (MHRA) . 15 сентября 2023 г. Проверено 7 октября 2023 г.
- ^ «MHRA одобряет адаптированную вакцину против COVID-19 компании Moderna (Spikevax), нацеленную на Omicron XBB.1.5» . Агентство по регулированию лекарственных средств и товаров медицинского назначения (MHRA) . 15 сентября 2023 г. Проверено 7 октября 2023 г.
- ^ «TGA выдает предварительное заключение по вакцине Moderna Covid-19, Элазомеран» . Управление терапевтических товаров (TGA) (пресс-релиз). 24 июня 2021 года. Архивировано из оригинала 27 июня 2021 года . Проверено 29 июня 2021 г.
- ^ Всемирная организация здравоохранения (2021 г.). «Международные непатентованные наименования фармацевтических субстанций (МНН): рекомендуемое МНН: список 86». Информация ВОЗ о лекарствах . 35 (3). hdl : 10665/346562 .
- ^ «ЮНИ-TYF7YW7ENF» . точностьFDA . Проверено 6 октября 2023 г.
- ^ Всемирная организация здравоохранения (2022 г.). «Международные непатентованные наименования фармацевтических субстанций (МНН): рекомендуемое МНН: список 88». Информация ВОЗ о лекарствах . 36 (3). hdl : 10665/363551 .
- ^ «УНИИ-4F9QRS7ZV2» . точностьFDA . Проверено 6 октября 2023 г.
- ^ «Предлагаемый перечень МНН 129» . Всемирная организация здравоохранения (ВОЗ) . 1 января 1900 года . Проверено 6 октября 2023 г.
- ^ «Обеспечение доступа Сингапура к вакцинам против COVID-19» . www.gov.sg. Правительство Сингапура. 14 декабря 2020 года. Архивировано из оригинала 29 января 2021 года . Проверено 1 февраля 2021 г.
- ^ Халик С. (1 февраля 2021 г.). «Как Сингапур выбирал вакцины против Covid-19» . «Стрейтс Таймс» . Архивировано из оригинала 31 января 2021 года . Проверено 1 февраля 2021 г.
- ^ «Трамп сообщил, что США подписывают соглашение с Moderna на поставку 100 млн доз вакцины-кандидата от COVID-19» . Яху . Рейтер. 11 августа 2020 г. Архивировано из оригинала 16 ноября 2020 г. . Проверено 12 августа 2020 г.
- ^ «Moderna стремится установить цену на вакцину от коронавируса в 50–60 долларов за курс: FT» . Рейтер . 28 июля 2020 года. Архивировано из оригинала 25 июля 2021 года . Проверено 20 марта 2021 г.
- ^ «Дональд Трамп, похоже, признает, что Covid в США «одичал» . Хранитель . 22 ноября 2020 г. Архивировано из оригинала 22 ноября 2020 г. . Проверено 22 ноября 2020 г.
Компания Moderna сообщила немецкому еженедельнику Welt am Sonntag, что будет взимать с правительств от 25 до 37 долларов за дозу вакцины-кандидата от Covid, в зависимости от заказанного количества.
- ^ Гуарасио Ф (24 ноября 2020 г.). «ЕС обеспечивает 160 миллионов доз вакцины Moderna против COVID-19» . Рейтер . Архивировано из оригинала 24 ноября 2020 года . Проверено 25 ноября 2020 г.
- ^ «Коронавирус: Комиссия утверждает контракт с Moderna для обеспечения доступа к потенциальной вакцине» . Европейская комиссия. 25 ноября 2020 года. Архивировано из оригинала 10 января 2022 года . Проверено 4 декабря 2020 г.
- ^ «Новые соглашения по обеспечению дополнительных кандидатов на вакцину от COVID-19» . Канцелярия премьер-министра правительства Канады. 25 сентября 2020 года. Архивировано из оригинала 10 января 2022 года . Проверено 4 декабря 2020 г.
- ^ Стевис-Гриднефф М., Сангер-Кац М., Вейланд Н. (18 декабря 2020 г.). «Европейский чиновник раскрывает секрет: США платят больше за вакцины от коронавируса» . Нью-Йорк Таймс . Архивировано из оригинала 28 марта 2021 года . Проверено 19 декабря 2020 г.
- ^ «Годовой отчет за финансовый год, закончившийся 31 декабря 2020 г.; подача документов в SEC 10-K» (PDF) . Moderna Inc., 16 февраля 2021 г. Архивировано (PDF) из оригинала 8 декабря 2021 г. . Проверено 3 мая 2022 г.
- ^ «Годовой отчет за финансовый год, закончившийся 31 декабря 2021 г.; подача документов 10-K SEC» (PDF) . Moderna Inc., 25 февраля 2022 г. Архивировано (PDF) из оригинала 7 марта 2022 г. . Проверено 3 мая 2022 г.
- ^ «Нет, Германия не прекратила использование вакцин против COVID-19» . АП Новости . 14 сентября 2022 г. Проверено 3 октября 2022 г.
- ^ Харт Р. (10 ноября 2021 г.). «Германия и Франция ограничивают использование вакцины Moderna от Covid для лиц моложе 30 лет из-за редкого сердечного риска, несмотря на рост числа случаев» . Форбс . Проверено 3 октября 2022 г.
- ^ Тенн С (6 октября 2021 г.). «Вакцина Moderna приостановлена для молодых людей в двух европейских странах» . Ученый . Проверено 3 октября 2022 г.
- ^ «Франция не рекомендует использовать Moderna для людей младше 30 лет из-за редкого сердечного риска» . Франция 24 . 9 ноября 2021 г. Проверено 3 октября 2022 г.
- ^ Тейлор С. (8 октября 2021 г.). «Скандинавские страны ограничивают использование вакцины Moderna от Covid. Вот почему» . CNBC . Проверено 2 октября 2022 г.
- ^ Хильцик М. (19 мая 2020 г.). «Колонка: Результаты вакцинации компании Moderna способствовали увеличению количества ее акций – и это вряд ли совпадение» . Лос-Анджелес Таймс . Архивировано из оригинала 16 ноября 2020 года . Проверено 19 мая 2020 г.
- ^ Брансвелл Х. (19 мая 2020 г.). «Эксперты по вакцинам говорят, что Moderna не предоставила данных, критически важных для оценки вакцины против Covid-19» . Стат . Архивировано из оригинала 16 ноября 2020 года . Проверено 19 мая 2020 г.
- ^ Тейлор М., Респаут Р. (7 июля 2020 г.). «Эксклюзив: Moderna спорит с американскими учёными по поводу испытаний вакцины против COVID-19» . Рейтер . Архивировано из оригинала 16 ноября 2020 года . Проверено 10 июля 2020 г.
- ^ «Современные подрядчики по испытаниям вакцин не могут привлечь достаточное количество цветных людей, что приводит к замедлению темпов роста» . Новости Эн-Би-Си . Рейтер . 6 октября 2020 г. Архивировано из оригинала 19 ноября 2020 г. . Проверено 17 ноября 2020 г. .
- ^ «Совместное заявление экспертов здравоохранения и медицины HHS о прививках от COVID-19» (пресс-релиз). Министерство здравоохранения и социальных служб США. 18 августа 2021 года. Архивировано из оригинала 7 декабря 2021 года . Проверено 21 августа 2021 г.
- ^ «ВОЗ права, призывая к временной остановке бустеров вакцины против COVID» . Природа (Редакционная статья). 596 (7872): 317. 17 августа 2021 г. Бибкод : 2021Natur.596..317. . дои : 10.1038/d41586-021-02219-w . ПМИД 34404945 . S2CID 237199262 . Архивировано из оригинала 21 октября 2021 года . Проверено 21 августа 2021 г.
- ^ «Промежуточное заявление о бустерных дозах вакцины против COVID-19» (пресс-релиз). Всемирная организация здравоохранения. 10 августа 2021 года. Архивировано из оригинала 27 ноября 2021 года . Проверено 26 августа 2021 г.
- ^ Крамер Дж. (18 августа 2021 г.). «США планируют разрешить ревакцинацию, но многие уже получили третью дозу» . Нэшнл Географик . Архивировано из оригинала 10 октября 2021 года . Проверено 21 августа 2021 г.
Получение ревакцинации слишком рано после первичной прививки может не научить иммунную систему организма создавать более надежную защиту.
- ^ Ли Джей (14 мая 2021 г.). «Показывают ли видео магниты, прилипающие к рукам людей после вакцинации от COVID-19?» . Snopes.com . Архивировано из оригинала 9 ноября 2021 года . Проверено 7 июня 2021 г.
- ^ Фичера А (14 мая 2021 г.). «Магнитные видеоролики дополняют фиктивную претензию о вакцинных микрочипах» . FactCheck.org . Центр государственной политики Анненберга. Архивировано из оригинала 17 мая 2021 года . Проверено 7 июня 2021 г.
- ^ «Мифы и факты о вакцине против COVID-19» (PDF) . Департамент общественного здравоохранения округа Лос-Анджелес. 15 декабря 2021 г. Архивировано (PDF) из оригинала 25 августа 2021 г. . Проверено 27 августа 2021 г.
- ^ «Факты о вакцине против COVID-19» . Центры по контролю и профилактике заболеваний . 18 августа 2021 года. Архивировано из оригинала 11 декабря 2021 года . Проверено 27 августа 2021 г.
- ^ Эвон Д. (2 ноября 2021 г.). « Люцифераза не является ингредиентом вакцин против COVID-19» . Snopes.com . Архивировано из оригинала 10 января 2022 года.
- ^ «Проверка фактов: вакцина Moderna против COVID-19 не содержит люциферина или люциферазы» . Рейтер. 6 мая 2021 года. Архивировано из оригинала 3 ноября 2021 года . Проверено 2 ноября 2021 г.
- ^ Варди Н (29 июня 2020 г.). «Таинственная система доставки вакцины от коронавируса Moderna» . Форбс . Архивировано из оригинала 6 января 2021 года . Проверено 1 декабря 2020 г.
- ^ «Moderna проигрывает ключевой патентный спор» . Природная биотехнология . 38 (9): 1009. Сентябрь 2020 г. doi : 10.1038/s41587-020-0674-1 . ПМИД 32887970 . S2CID 221504018 .
Дальнейшее чтение
- Корум Дж., Циммер С. (7 мая 2021 г.). «Как действует вакцина Moderna» . Нью-Йорк Таймс .
- Модерна (17 декабря 2020 г.). «Информационный документ для спонсора VRBPAC мРНК-1273» (PDF) . США Управление по контролю за продуктами и лекарствами .
- Комитет по лекарственным препаратам для использования человеком (CHMP) (11 марта 2021 г.). «Отчет об оценке: вакцина против COVID-19 Moderna» (PDF) . Европейское агентство по лекарственным средствам . Архивировано (PDF) из оригинала 20 января 2021 года.
- «Протокол клинического исследования мРНК-1273-P301» (PDF) . Модерна . 20 августа 2020 г. Архивировано из оригинала (PDF) 17 сентября 2020 г.
- Дикерман Б.А., Герловин Х., Маденси А.Л., Курганский К.Э., Феролито Б.Р., Фигероа Муньис М.Дж. и др. (январь 2022 г.). «Сравнительная эффективность вакцин BNT162b2 и мРНК-1273 у ветеранов США» . Медицинский журнал Новой Англии . 386 (2): 105–115. дои : 10.1056/nejmoa2115463 . ПМЦ 8693691 . ПМИД 34942066 .
- Всемирная организация здравоохранения (2021 г.). Справочный документ по вакцине мРНК-1273 (Moderna) против COVID-19: справочный документ к Временным рекомендациям ВОЗ по использованию вакцины мРНК-1273 (Moderna), 3 февраля 2021 г. (Отчет). Всемирная организация здравоохранения (ВОЗ). hdl : 10665/339218 . ВОЗ/2019-nCoV/vaccines/SAGE_recommendation/mRNA-1273/background/2021.1.