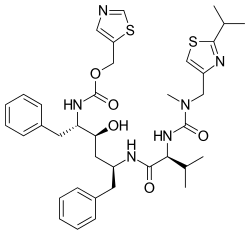
Нирмарелвир/ритонавир
 | |
 | |
| Сочетание | |
|---|---|
| Нирмарелвир | Противовирусный препарат |
| Ритонавир | ингибитор CYP3A ; Противовирусный препарат |
| Клинические данные | |
| Торговые названия | Паксловид |
| AHFS / Drugs.com | Монография |
| Медлайн Плюс | а622005 |
| Данные лицензии | |
| Беременность категория | |
| Маршруты администрация | Через рот |
| код АТС | |
| Юридический статус | |
| Юридический статус | |
| Идентификаторы | |
| КЕГГ | |
| ЧЭБИ | |
Нирмарелвир/ритонавир , продаваемый под торговой маркой Паксловид , представляет собой упакованный в упаковку препарат, используемый для лечения COVID-19 . [8] [11] [10] [17] Он содержит противовирусные препараты нирмарелвир и ритонавир и был разработан компанией Pfizer . [8] [10] Нирмарелвир ингибирует основную протеазу SARS-CoV-2 , тогда как ритонавир является сильным ингибитором CYP3A , замедляя метаболизм нирмарелвира и, следовательно, усиливая его эффект. [10] [18] Его принимают внутрь . [10]
У непривитых людей из группы высокого риска с COVID-19 нирмарелвир/ритонавир может снизить риск госпитализации или смерти на 88%, если принимать их в течение пяти дней после появления симптомов. [19] Люди, которые принимают нирмарелвир/ритонавир, также получают отрицательный результат на COVID-19 примерно на два с половиной дня раньше, чем люди, которые этого не делают. [20] Побочные эффекты нирмарелвира/ритонавира включают изменения вкусовых ощущений ( дисгевзия ), диарею , высокое кровяное давление ( гипертония ) и мышечные боли ( миалгия ). [10]
США В декабре 2021 года Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) выдало разрешение на экстренное применение нирмателвира/ритонавира (EUA) для лечения COVID-19. [13] [21] Позже в том же месяце он был одобрен в Великобритании. [22] а в Европейском Союзе и Канаде — в январе 2022 года. [15] [23] [24] В мае 2023 года он был одобрен в США для лечения легкой и среднетяжелой формы COVID-19 у взрослых, которые подвержены высокому риску развития тяжелой формы COVID-19, включая госпитализацию или смерть. [14] [17] FDA считает эту комбинацию первым в своем классе лекарством . [25]
Медицинское использование
[ редактировать ]В США нирмарелвир/ритонавир показан для лечения легкой и среднетяжелой формы COVID-19 у взрослых, которые подвергаются высокому риску развития тяжелой формы COVID-19, включая госпитализацию или смерть. [10] [14] Сюда входят люди старше 50 лет, люди с диабетом, раком, ишемической болезнью сердца, хроническими заболеваниями легких, беременные или принимающие иммунодепрессанты. [26]
Упакованные в одну упаковку лекарства не разрешены и не рекомендуются для доконтактной или постконтактной профилактики COVID-19. [12] [14] [27]
В Европейском Союзе упакованный препарат показан для лечения COVID-19 у взрослых, которым не требуется дополнительный кислород и которые подвергаются повышенному риску развития тяжелой формы COVID-19. [15]
При введении в течение пяти дней с момента появления симптомов при подтвержденной инфекции COVID-19 эффективность упакованного препарата против госпитализации или смерти у невакцинированных взрослых из группы высокого риска по состоянию на 2022 год составляла около % (95% ДИ , 75–94 88 ). % )). [13] [19]
Беременность
[ редактировать ]Предложение об использовании упакованных в упаковку лекарств во время беременности у людей, которые могут забеременеть и не используют противозачаточные средства, а также у людей, кормящих грудью, требует дальнейшего изучения. [28] Учитывая риск заболеваемости, госпитализации и смертности, связанный с тяжелым течением заболевания COVID-19 у женщин и плодов, нирмарелвир/ритонавир после тщательного рассмотрения может стать важным вариантом снижения рисков, связанных с острой инфекцией COVID-19, у пациентов из группы риска и невакцинированных пациентов. преимуществ и рисков для каждого пациента. [28] Имеются ограниченные данные о применении нирмарелвира во время беременности, связанные с риском врожденных дефектов, самопроизвольных абортов (выкидышей) или неблагоприятных исходов. [29] Данных о присутствии нирмарелвира в грудном молоке или о его влиянии на выработку молока или на ребенка нет. [30] У потомства кормящих крыс наблюдалось временное снижение массы тела. [13] Другие наблюдательные исследования также продемонстрировали безопасность ритонавира во время беременности. [31]
Противопоказания
[ редактировать ]Препарат противопоказан лицам с гиперчувствительностью к любому из двух основных компонентов, а также лицам с тяжелым нарушением функции почек или печени. [13] Совместное применение с некоторыми лекарственными средствами может иметь серьезные, иногда фатальные последствия. [32]
Побочные эффекты
[ редактировать ]Нирмарелвир/ритонавир имеют высокий потенциал потенциально серьезных лекарственных взаимодействий из-за сильного CYP3A ингибирования ритонавиром. [10] [18] Этикетка FDA США, информационный бюллетень FDA и EUA FDA содержат предупреждение в рамке об ингибировании CYP3A. [10] [14]
Побочные эффекты совместного приема препарата, независимо от причин, наблюдавшиеся в исследовании II-III фазы EPIC-HR, включали дисгевзию (6% против <1% для плацебо ), диарею (3% против 2% для плацебо), диарею (3% против 2% для плацебо), гипертония (1% против <1% для плацебо) и миалгия (1% против <1% для плацебо). [10] [13] [33] В клинических исследованиях 2% людей прекратили лечение из-за побочных эффектов нирмарелвира/ритонавира, тогда как в группе плацебо это сделали 4%. [10] Нирмарелвир/ритонавир находится на стадии исследования, поэтому его побочные эффекты еще не полностью оценены и, возможно, не полностью известны. [18]
Другие побочные эффекты нирмарелвира/ритонавира могут включать реакции гиперчувствительности , токсичность для печени и развитие лекарственной устойчивости ВИЧ у людей с неконтролируемой или недиагностированной ВИЧ-инфекцией . [10] [18] Реакции гиперчувствительности (аллергические реакции) могут проявляться в виде кожной сыпи , крапивницы , затрудненного глотания , затрудненного дыхания , ангионевротического отека и/или анафилаксии . [10] [18] Токсичность печени может проявляться повышением уровня трансаминаз и клиническим гепатитом , включая такие симптомы, как потеря аппетита , желтуха (пожелтение кожи и белков глаз), темная моча , бледный стул , зуд кожи и боли в животе . [10] [18]
Взаимодействия
[ редактировать ]Противопоказано одновременное применение нирмарелвира/ритонавира с некоторыми лекарственными средствами, в том числе препаратами, зависящими от CYP3A при выведении, повышенная концентрация которых приводит к серьезным реакциям, или препаратами с мощными индукторами CYP3A , для которых может возникнуть снижение концентрации в крови двух основных компонентов. среди прочего, в потере эффективности против вируса и возможной резистентности. [10] Совместный прием также влияет на концентрацию нескольких препаратов, что иногда требует изменения дозы или тщательного контроля. [13] [33] Многие из этих препаратов широко назначают людям с высоким риском заражения COVID-19. [34] С продлением действия разрешения на экстренную помощь в августе 2022 года FDA обновило контрольный список, который поможет оценить потенциальное взаимодействие лекарств и другие факторы, влияющие на состояние пациента, перед назначением Паксловида, включая более 120 препаратов, которые противопоказаны, которых следует избегать или воздерживаться от применения или которые требуют дозы. корректировки или специальный мониторинг. [35] [13]
Нирмарелвир/ритонавир безопасно использовать в сочетании с безрецептурными обезболивающими и жаропонижающими препаратами, такими как парацетамол (ацетаминофен) и ибупрофен . [36]
Фармакология
[ редактировать ]Нирмарелвир отвечает за противовирусную активность против SARS-CoV-2 , тогда как ритонавир действует путем ингибирования метаболизма нирмарелвира в печени, усиливая его активность. [10] [18]
Фармакодинамика
[ редактировать ]Нирмарелвир — основная протеаза SARS-CoV-2 (M про , 3CL про протеазы nsp5) , ингибитор , тогда как ритонавир является протеазы ВИЧ-1 ингибитором и сильным CYP3A ингибитором . [10] [18] Нирмарелвир является основным активным веществом в составе, тогда как ритонавир, который ингибирует протеазу ВИЧ-1 , является сильным ингибитором CYP3A : он ингибирует метаболизм нирмарелвира в печени и тем самым усиливает или усиливает его активность. [10] [18] Ритонавир не активен в отношении SARS-CoV-2 и не способствует его противовирусной активности. [18] [10] Нирмарелвир/ритонавир действует против COVID-19, предотвращая репликацию SARS-CoV-2, для которой необходима основная протеаза SARS-CoV-2. [10] [18]
Фармакокинетика
[ редактировать ]Поглощение
[ редактировать ]Время достижения максимальной концентрации нирмарелвира в сочетании с ритонавиром составляет 3,00 часа (диапазон 1,02–6,00 часов), тогда как для ритонавира — 3,98 часа. [10] Пиковые концентрации нирмарелвира в сочетании с ритонавиром после однократного приема (300 мг нирмарелвира и 100 мг ритонавира) у здоровых людей составляют 2,21 мкг/мл, тогда как общая экспозиция составляет 23,01 мкг•ч/мл. [10] Прием нирмарелвира/ритонавира с пищей с высоким содержанием жиров умеренно увеличивает воздействие нирмарелвира (пиковые концентрации увеличиваются на 15%, а общее воздействие увеличивается на 1,6%) по сравнению с их приемом натощак. [10]
Распределение
[ редактировать ]Объем распределения (V z /F) нирмателвира в сочетании с ритонавиром составляет 104,7 л, а ритонавира — 112,4 л. [10] Соотношение крови и плазмы нирмарелвира в сочетании с ритонавиром составляет 0,60, тогда как соотношение эритроцитов и плазмы ритонавира составляет 0,14. [10] Связывание с белками плазмы нирмарелвира в сочетании с ритонавиром составляет 69%, а ритонавира — от 98 до 99%. [10]
Метаболизм
[ редактировать ]Нирмарелвир в основном является субстратом CYP3A метаболизма с точки зрения его . [10] Но когда его сочетают с ритонавиром, сильным ингибитором CYP3A4, метаболизм ниматрелвира минимален, и вместо этого его выведение основном через почки происходит в . [10] Ритонавир выводится главным образом путем метаболизма в печени , при этом CYP3A4 основным ферментом является CYP2D6 . , а второстепенным — [10]
Устранение
[ редактировать ]Нирмарелвир в сочетании с ритонавиром выводится 35,3% с калом и 49,6% с мочой , тогда как ритонавир выводится 86,4% с калом и 11,3% с мочой. [10]
Пероральный клиренс (CL/F) нирмарелвира в сочетании с ритонавиром составляет 8,99, а ритонавира — 13,92. [10] Период полувыведения нирмарелвира в сочетании с ритонавиром составляет (среднее ± стандартное отклонение) 6,05 ± 1,79 часа, а ритонавира — 6,15 часа. [10] Период полувыведения ниматрелвира в сочетании с ритонавиром делает препарат пригодным для введения каждые 12 часов. [10] [18]
Конкретные группы населения
[ редактировать ]Фармакокинетика нирмарелвира/ритонавира в зависимости от возраста и пола не оценивалась. [10] Воздействие нирмарелвира/ритонавира было численно ниже у японцев, чем у жителей Запада, но не в клинически значимой степени. [10] Пиковые концентрации, общая экспозиция, время достижения пиковых концентраций и период полувыведения нирмарелвира в сочетании с ритонавиром увеличиваются в зависимости от тяжести у людей с почечной недостаточностью . [10] но не увеличивается у людей с умеренной печеночной недостаточностью . [10] Комбинация не изучалась у людей с тяжелой печеночной недостаточностью. [10]
Исследовать
[ редактировать ]Исследования показывают, что нирмателвир/ритонавир могут минимизировать риск длительного течения COVID . [26]
Отскок
[ редактировать ]Дополнительный анализ исходных данных клинического исследования EPIC-HR ( вариант Дельта ) показал, что около 2% групп лечения и плацебо испытали симптоматический рецидив после пятидневного лечения, то есть они снова почувствовали себя плохо и снова дали положительный результат (антиген тест и ПЦР-тест) после отрицательного результата теста. [37] Точная причина неизвестна, но есть предположение, что это связано с резервуарами в тканях, до которых не доходит лекарство, или с повторным заражением. В мае 2022 года компания Pfizer предложила повторить лечение, но FDA заявило, что доказательств пользы нет. [38] [39]
В июне 2022 года в отчете о случае десяти человек с рецидивом COVID-19 в США было обнаружено, что вирусная нагрузка во время рецидива была сопоставима с уровнями во время первоначального заражения и достаточно высока, чтобы вызвать вторичную передачу. [40] Президент Джо Байден , первая леди Джилл Байден , Энтони Фаучи , [38] Питер Хотез и Рошель Валенски [41] известно, что они испытали отскок. По состоянию на июнь 2022 года компания Pfizer изучала это явление в рамках нового исследования под названием EPIC-SR (стандартный риск), пока вариант омикрона . циркулировал [40] И EPIC-HR, и EPIC-SR представляли собой рандомизированные контролируемые исследования, которые предоставили информацию о рецидиве COVID-19. [14] Данные этих исследований показали, что восстановление выделения SARS-CoV-2 (РНК или вируса) или симптомов COVID-19 наблюдалось у части участников и происходило как у участников, получавших нирмарелвир/ритонавир, так и у участников, принимавших плацебо. [14] По состоянию на 2023 год FDA на основании имеющихся у них данных обнаружило отсутствие четкой связи между лечением нирмарелвиром/ритонавиром и рецидивом COVID-19. [14]
Сопротивление
[ редактировать ]По состоянию на июль 2022 года устойчивого к нирмарелвиру/ритонавиру. в клиническом контексте не наблюдалось ни одного случая SARS-CoV-2, [42] Разработка устойчивой к нирмарелвиру химеры вируса везикулярного стоматита (ВВС) в лабораторных условиях была опубликована без официальной экспертной оценки в июле 2022 года. [43] было продемонстрировано несколько путей развития устойчивости к нирмарелвиру/ритонавиру По состоянию на ноябрь 2022 года in vitro . [44]
История
[ редактировать ]Нирмарелвир принадлежит к семейству 3C-подобных ингибиторов протеазы, разработанных в конце 2010-х годов против кошачьего коронавируса , тогда как ритонавир — антиретровирусный препарат, разработанный в 1980-х годах и используемый с 1990-х годов для ингибирования фермента, метаболизирующего другие ингибиторы протеазы.
Основные данные, подтверждающие нирмарелвира/ритонавира Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA), выдачу разрешения на экстренное применение были получены из исследования EPIC-HR, рандомизированного двойного слепого плацебо-контролируемого клинического исследования по изучению нирмарелвира/ритонавира для лечения неинфекционных заболеваний. госпитализированных взрослых с симптомами инфекции с лабораторно подтвержденным диагнозом инфекции SARS-CoV-2. [10] [12] [45] Участники были в возрасте 18 лет и старше с заранее установленным фактором риска развития тяжелого заболевания или были в возрасте 60 лет и старше независимо от заранее определенных хронических заболеваний. [12] Ни один из участников не получил вакцину от COVID-19 и не был ранее инфицирован COVID-19. [12] Основным результатом, измеряемым в ходе исследования, была доля людей, которые были госпитализированы из-за COVID-19 или умерли по любой причине в течение 28 дней наблюдения. [12] EPIC-HR стартовал в июле 2021 года и завершился в декабре 2021 года. [46] Нирмарелвир/ритонавир значительно снизил долю людей с госпитализацией или смертью по любой причине, связанной с COVID-19, на 88% по сравнению с плацебо среди участников, получавших лечение в течение пяти дней после появления симптомов и не получавших терапевтическое лечение моноклональными антителами против COVID-19. [12] В декабре 2021 года компания Pfizer также объявила, что исследование фазы II/III нирмарелвира/ритонавира показало снижение риска госпитализации или смерти. [47]
В августе 2021 года компания Pfizer начала II/III исследование нирмарелвира/ритонавира при лечении COVID-19 у лиц со стандартным риском заражения COVID-19, известным как EPIC-SR. [48] [49] Промежуточные результаты этого исследования были объявлены в декабре 2021 года, а окончательные результаты были опубликованы в июне 2022 года. [48] Компания Pfizer прекратила участие в исследовании, указав причину в очень низком уровне госпитализации и смертности в этой группе населения. [50] EPIC-SR было еще одним клиническим исследованием, в котором были включены вакцинированные участники, по крайней мере, с одним фактором риска развития тяжелой формы COVID-19. [14] Хотя это и не является статистически значимым, среди этих вакцинированных участников наблюдалось снижение риска госпитализации или смерти по любой причине, связанной с COVID-19. [14]
(FDA) выдало разрешение на экстренное применение США В декабре 2021 года Управление по санитарному надзору за качеством пищевых продуктов и медикаментов нирмарелвира/ритонавира для лечения COVID-19. [13] Соединенного Королевства В декабре 2021 года Агентство по регулированию лекарственных средств и товаров медицинского назначения (MHRA) одобрило использование нирмарелвира в сочетании с ритонавиром у взрослых с легкой и умеренной инфекцией и с высоким риском обострения заболевания. [51] [22]
В апреле 2022 года было объявлено, что в исследовании PANORAMIC начнется проверка эффективности нирмарелвира/ритонавира для лечения инфекций COVID-19. [52]
Нирмарелвир/ритонавир оценивался при лечении COVID-19 у лиц со стандартным риском в исследовании EPIC-SR. [48] [50] Это исследование не достигло своей основной цели — сократить время до устойчивого облегчения симптомов COVID-19 (лечение: 13 дней (95% ДИ 12–15 дней); плацебо: 13 дней (95% ДИ 11–14 дней)). [48] [50] Также не было обнаружено статистически значимого снижения риска госпитализации или смерти (лечение: 5/576 [0,9%]; плацебо: 10/569 [1,8%]; p > 0,05). [48] [50] Аналогичным образом, результаты не были статистически значимыми для снижения уровня госпитализации в подгруппе вакцинированных взрослых с хотя бы одним фактором риска тяжелого течения COVID-19 (лечение: 3/361 [0,8%]; плацебо: 7/360 [1,9%]; 57 % снижения – ОР 0,43, 95% ДИ 0,11–1,64). [48] [50] Тем не менее, исследование выявило статистически значимое снижение числа посещений врача, связанных с COVID-19, на 62 %, что аналогично снижению на 67 % по данным исследования EPIC-HR среди лиц из группы высокого риска. [48] [50] Регистрация в EPIC-SR была прекращена из-за низкого уровня госпитализации и смертности в этой группе населения. [48] [50]
В мае 2023 года нирмарелвир/ритонавир получил одобрение FDA для лечения легкой и среднетяжелой формы COVID-19 у взрослых, которые подвержены высокому риску развития тяжелой формы COVID-19, включая госпитализацию или смерть. [14] В ноябре 2023 года FDA пересмотрело EUA для нирмарелвира/ритонавира, чтобы разрешить нирмарелвир/ритонавир, маркированные EUA или NDA, для лечения легкой и среднетяжелой формы COVID-19 у людей в возрасте двенадцати лет и старше с массой тела не менее 40 килограммов. (88 фунтов), которые подвергаются высокому риску развития тяжелой формы COVID-19, включая госпитализацию. [17] В марте 2024 года FDA пересмотрело EUA для нирмарелвира/ритонавира, отменив разрешение на нирмарелвир/ритонавир с маркировкой EUA. [53] [17]
Общество и культура
[ редактировать ]
Юридический статус
[ редактировать ]Канада
[ редактировать ]Министерство здравоохранения Канады одобрило использование упакованного лекарства в январе 2022 года. [7] [23] [54] [55] [56]
Китай
[ редактировать ]В феврале 2022 года Китай одобрил препарат для лечения взрослых с легкой и умеренной формой COVID-19, у которых высок риск развития тяжелого заболевания. [57]
Евросоюз
[ редактировать ]Европейское агентство лекарственных средств (EMA) одобрило упакованный препарат для лечения COVID-19 в ЕС в январе 2022 года. [15] [16]
Израиль
[ редактировать ]Министерство здравоохранения Израиля одобрило использование упакованного лекарства в декабре 2021 года. [58]
Сингапур
[ редактировать ]Сингапура Управление медицинских наук одобрило использование упакованного лекарства для лечения взрослых в феврале 2022 года. [59]
Южная Корея
[ редактировать ]Южная Корея одобрила использование упакованного лекарства в декабре 2021 года. [60]
Великобритания
[ редактировать ]Великобритания одобрила использование упакованного лекарства в декабре 2021 года. [8] [9] [61]
Соединенные Штаты
[ редактировать ]В ноябре 2021 года компания Pfizer подала заявку в Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) на получение разрешения на экстренное использование упакованного лекарства. [62] [63] [64] Разрешение было выдано в декабре 2021 года для людей в возрасте 12 лет и старше, инфицированных COVID-19 и находящихся в группе риска. [12] [17] [65]
В январе 2024 года FDA пересмотрело разрешение на экстренное использование (EUA) и заявило, что нирмарелвир/ритонавир, произведенные и маркированные в соответствии с EUA, которые в настоящее время распределяются в США, останутся разрешенными к использованию до наступления указанной даты или продленного срока годности или до наступления более ранней из указанных дат. Март 2024. [53] В марте 2024 года FDA пересмотрело разрешение на экстренное применение и больше не распространяется на нирмарелвир/ритонавир, маркированные EUA. [17] [53] По состоянию на март 2024 года разрешение FDA на экстренное использование нирмарелвира/ритонавира продолжает разрешать его для лечения людей в возрасте 12 лет и старше с весом не менее 40 кг (88 фунтов), которые подвергаются высокому риску развития тяжелой формы COVID-19. , включая госпитализацию или смерть. [53] [17] Разрешение на экстренное использование также по-прежнему разрешает назначение нирмарелвира/ритонавира фармацевтом, имеющим государственную лицензию, для лечения легкой и среднетяжелой формы COVID-19 людям в возрасте 12 лет и старше с массой тела не менее 40 кг (88 фунтов), которые входят в группу высокого риска заболевания. прогрессирование до тяжелой формы COVID-19, включая госпитализацию или смерть, в соответствии с одобренной FDA информацией о назначении или утвержденной маркировкой, в зависимости от обстоятельств, и при соблюдении определенных условий, подробно описанных в разрешении и официальном информационном бюллетене для поставщиков медицинских услуг. [17] [53] [66]
Производство
[ редактировать ]Pfizer выбрала свой крупнейший завод по производству пероральных таблеток во Фрайбурге в качестве стартового предприятия для производства упакованных лекарств. [67] Нирмарелвир, новая часть упакованного лекарства, была впервые разработана в США и первоначально производилась в небольших количествах в Гротоне, штат Коннектикут , для поддержки клинических испытаний. [68] но предприятие во Фрайбурге отвечало за выяснение того, как массово производить расфасованные лекарства в промышленных масштабах. [67] Pfizer выбрала еще один завод в Асколи-Пичено , Италия, для оказания помощи заводу во Фрайбурге в упаковке таблеток в блистерные упаковки . [69]
Экономика
[ редактировать ]В декабре 2021 года правительство Германии заказало один миллион доз, но к августу 2022 года оптовики доставили в аптеки лишь около 43 000 доз. В Германии нирмарелвир/ритонавир продается только по рецепту врачей, и немецкие врачи неохотно его прописывают. Таким образом, министр здравоохранения Карл Лаутербах решил, что врачи общей практики могут иметь в своей практике пять курсов нирмарелвира/ритонавира и выдавать их непосредственно пациентам, что рецепт будет оплачиваться в размере 15 евро и что каждый дом престарелых должен назначить специалиста по вакцинации, а также специалист по нирмарелвиру/ритонавиру. По состоянию на август 2022 года рекомендации по лечению, которым следуют немецкие семейные врачи, не обновлялись с февраля 2022 года и рекомендовали нирмарелвир/ритонавир только невакцинированным пациентам риска, то есть лишь нескольким людям. [70]
По состоянию на апрель 2022 года в США заказано в общей сложности 20 миллионов курсов нирмарелвира/ритонавира. [71] По состоянию на июль 2022 года Министерство здравоохранения и социальных служб США открыло не менее 2200 пунктов, где люди могут получить нирмарелвир/ритонавир сразу после положительного результата теста на вирус, включая аптеки, общественные медицинские центры и учреждения долгосрочного ухода. [65] В июле 2022 года FDA разрешило фармацевтам, имеющим государственную лицензию, назначать его людям с COVID-19 с высоким риском развития тяжелого заболевания. [72]
В течение 2022 года только 10–12% взрослых амбулаторных пациентов в США, имеющих право на участие в программе, получали нирмарелвир/ритонавир. [26] Предполагается, что причинами являются опасения по поводу «рецидива, незнания лечения и его стоимости», а также «непонимания относительно того, кто подвергается высокому риску тяжелого заболевания». [26] Несмотря на прейскурантную цену Pfizer в 1390 долларов США за пять дней в США, лечение было и будет бесплатным до конца 2024 года для бенефициаров Medicare или Medicaid, а также застрахованных лиц, покрывающих расходы из собственного кармана. [26] [73]
Названия брендов
[ редактировать ]Нирмарелвир/ритонавир продается под торговой маркой Паксловид. [10] Примовир и Паксиста — это дженерики, производимые и распространяемые в Индии. [74] [75]
Сравнение с ивермектином
[ редактировать ]В 2021 году было ошибочно заявлено, что нирмарелвир/ритонавир представляет собой переупакованную версию противопаразитарного препарата ивермектина или что нирмарелвир/ритонавир аналогичны ивермектину, поскольку оба являются ингибиторами протеазы. [76] [77] Ивермектин оказался ошибочным [78] пропагандируется как терапевтическое средство против COVID-19. Подобные заявления, иногда под прозвищем «Пфайзермектин», [79] возникают из-за поверхностного сходства механизма действия препаратов. [76] и утверждение о том, что Pfizer скрывает информацию о преимуществах ивермектина. [77]
Ссылки
[ редактировать ]- ^ «Паксловид АПМДС» . Управление терапевтических товаров (TGA) . 21 января 2022 года. Архивировано из оригинала 5 февраля 2022 года . Проверено 5 февраля 2022 г.
- ^ Перейти обратно: а б «TGA eBS — Информационная лицензия на продукцию и потребительские лекарства» . Архивировано из оригинала 5 февраля 2022 года . Проверено 5 февраля 2022 г.
- ^ «Список всех лекарств с предупреждениями о черном ящике, полученный FDA (используйте ссылки «Загрузить полные результаты» и «Просмотреть запрос»)» . nctr-crs.fda.gov . FDA . Проверено 22 октября 2023 г.
- ^ «Монография продукта: Паксловид» (PDF) . Архивировано (PDF) из оригинала 7 января 2024 года.
- ^ «Краткая основа решения (SBD) для Паксловида» . Здоровье Канады . 23 октября 2014 г. Архивировано из оригинала 12 июня 2022 г. Проверено 29 мая 2022 г.
- ^ Перейти обратно: а б «Паксловид» . Здоровье Канады . 17 января 2022 года. Архивировано из оригинала 18 января 2022 года . Проверено 18 января 2022 г.
- ^ Перейти обратно: а б с д «Краткая характеристика продукта Паксловид» . Агентство по регулированию лекарственных средств и товаров медицинского назначения (MHRA) . 31 декабря 2021 года. Архивировано из оригинала 31 декабря 2021 года . Проверено 31 декабря 2021 г.
- ^ Перейти обратно: а б «Одобрение регулирующих органов Паксловида» . Агентство по регулированию лекарственных средств и товаров медицинского назначения (MHRA) . 31 декабря 2021 года. Архивировано из оригинала 11 января 2022 года . Проверено 31 декабря 2021 г.
- ^ Перейти обратно: а б с д и ж г час я дж к л м н тот п д р с т в v В х и С аа аб и объявление но из в ах есть также и аль являюсь а «Паксловид-нирмарелвир и набор ритонавира» . ДейлиМед . 18 октября 2023 года. Архивировано из оригинала 26 февраля 2024 года . Проверено 6 января 2024 г.
- ^ Перейти обратно: а б «Паксловид-нирмарелвир и набор ритонавира» . ДейлиМед . Архивировано из оригинала 31 декабря 2021 года . Проверено 30 декабря 2021 г.
- ^ Перейти обратно: а б с д и ж г час «FDA разрешает первый пероральный противовирусный препарат для лечения COVID-19» (пресс-релиз). США Управление по контролю за продуктами и лекарствами (FDA). 22 декабря 2021 года. Архивировано из оригинала 27 декабря 2021 года . Проверено 22 декабря 2021 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе . - ^ Перейти обратно: а б с д и ж г час я Информационный бюллетень для медицинских работников: Разрешение на экстренное использование Паксловида (PDF) (Технический отчет). Пфайзер . 22 декабря 2021 г. ЛАБ-1492-0.8. Архивировано из оригинала 23 декабря 2021 года.
- ^ Перейти обратно: а б с д и ж г час я дж к «FDA одобрило первый пероральный противовирусный препарат для лечения COVID-19 у взрослых» . США Управление по контролю за продуктами и лекарствами (FDA) (пресс-релиз). 26 мая 2023 года. Архивировано из оригинала 28 июля 2023 года . Проверено 26 мая 2023 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе . - ^ Перейти обратно: а б с д «Пахловид ЭПАР» . Европейское агентство лекарственных средств (EMA) . 24 января 2022 года. Архивировано из оригинала 11 мая 2022 года . Проверено 3 февраля 2022 г. Текст скопирован из источника, права на который принадлежат Европейскому агентству по лекарственным средствам. Воспроизведение разрешено при условии указания источника.
- ^ Перейти обратно: а б «Паксловид ПИ» . Союзный реестр лекарственных средств . 28 января 2022 года. Архивировано из оригинала 16 мая 2022 года . Проверено 24 апреля 2022 г.
- ^ Перейти обратно: а б с д и ж г час «Часто задаваемые вопросы о разрешении на экстренное использование Паксловида для лечения COVID-19» (PDF) . США Управление по контролю за продуктами и лекарствами (FDA). 1 ноября 2023 года. Архивировано из оригинала 7 января 2024 года . Проверено 6 января 2024 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе . - ^ Перейти обратно: а б с д и ж г час я дж к л Акиносоглу К., Схинас Г., Гогос С. (ноябрь 2022 г.). «Пероральное противовирусное лечение COVID-19: комплексный обзор нирмарелвира/ритонавира» . Вирусы . 14 (11): 2540. дои : 10.3390/v14112540 . ПМК 9696049 . ПМИД 36423149 .
- ^ Перейти обратно: а б Хаммонд Дж., Лейстер-Теббе Х., Гарднер А., Абреу П., Бао В., Вайсмандл В. и др. (апрель 2022 г.). «Оральный нирмателвир для негоспитализированных взрослых с Covid-19 из группы высокого риска» . Медицинский журнал Новой Англии . 386 (15): 1397–1408. дои : 10.1056/NEJMoa2118542 . ПМЦ 8908851 . ПМИД 35172054 .
- ^ Амани Б, Амани Б (февраль 2023 г.). «Эффективность и безопасность нирмарелвира/ритонавира (Паксловида) при COVID-19: быстрый обзор и метаанализ» . Журнал медицинской вирусологии . 95 (2): e28441. дои : 10.1002/jmv.28441 . ПМЦ 9880713 . ПМИД 36576379 .
- ^ «Pfizer получила разрешение FDA США на экстренное использование нового перорального противовирусного препарата при COVID-19» (пресс-релиз). Пфайзер . 22 декабря 2021 года. Архивировано из оригинала 22 декабря 2021 года . Проверено 22 декабря 2021 г. - через Business Wire.
- ^ Перейти обратно: а б «Поральный противовирусный препарат от COVID-19, Паксловид, одобрен регулирующим органом Великобритании» (пресс-релиз). Агентство по регулированию лекарственных средств и товаров медицинского назначения. 31 декабря 2021 года. Архивировано из оригинала 11 января 2022 года . Проверено 5 января 2022 г.
- ^ Перейти обратно: а б «Министерство здравоохранения Канады разрешает применять Паксловид пациентам с легкой и умеренной формой COVID-19 с высоким риском развития серьезного заболевания» . Министерство здравоохранения Канады (пресс-релиз). 17 января 2022 года. Архивировано из оригинала 29 апреля 2022 года . Проверено 24 апреля 2022 г.
- ^ «Паксловид» . Портал вакцин и методов лечения COVID-19 . 17 января 2022 года. Архивировано из оригинала 22 апреля 2022 года . Проверено 25 апреля 2022 г.
- ^ Новые разрешения на лекарственную терапию, 2023 г. (PDF) . США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) (отчет). Январь 2024 года. Архивировано из оригинала 10 января 2024 года . Проверено 9 января 2024 г.
- ^ Перейти обратно: а б с д и Рубин Р. (январь 2024 г.). «Паксловид эффективен, но используется недостаточно. Вот что говорят последние исследования о отскоке и многом другом». ДЖАМА . 331 (7): 548–551. дои : 10.1001/jama.2023.28254 . ПМИД 38294771 .
- ^ Рейс С., Метцендорф М.И., Куэн Р., Попп М., Гадьор И., Кранк П. и др. (ноябрь 2023 г.). «Нирматрелвир в сочетании с ритонавиром для профилактики и лечения COVID-19» . Кокрановская база данных систематических обзоров . 2023 (11): CD015395. дои : 10.1002/14651858.CD015395.pub3 . ПМЦ 10688265 . ПМИД 38032024 .
- ^ Перейти обратно: а б Чурасиа П., Маринганти Б.С., Эдвардс-Флиннер М., Гангу К., Бобба А., Шейх А.Б. и др. (январь 2023 г.). «Применение Паксловида (нирмарелвира и ритонавира) у беременных и кормящих женщин: текущие данные и практические рекомендации – обзорный обзор» . Вакцина . 11 (1): 107. doi : 10.3390/vaccines11010107 . ПМЦ 9866309 . ПМИД 36679952 .
- ^ Лоза А., Фариас Р., Гэвин Н., Вагнер Р., Хаммер Э., Шилдс А. (сентябрь 2022 г.). «Краткосрочные результаты беременности после лечения коронавирусной болезни легкой и средней степени тяжести 2019 (COVID-19) нирматрелвиром-ритонавиром» . Акушерство и гинекология . 140 (3): 447–449. дои : 10.1097/AOG.0000000000004900 . ПМЦ 9377369 . ПМИД 36356238 .
- ^ «Беременность, кормление грудью и фертильность на фоне приема Паксловида» . Национальная служба здравоохранения . 11 мая 2022 года. Архивировано из оригинала 12 ноября 2023 года . Проверено 16 ноября 2023 г.
- ^ Пэсли М.В., Мартинес М., Гермес А., д'Амико Р., Нилиус А. (2013). «Безопасность и эффективность лопинавира/ритонавира во время беременности: систематический обзор». Обзоры по СПИДу . 15 (1): 38–48. ПМИД 23449228 .
- ^ «Нирматрелвир (Паксловид), усиленный ритонавиром» . Национальные институты здравоохранения . 24 февраля 2022 года. Архивировано из оригинала 23 апреля 2022 года . Проверено 25 апреля 2022 г.
- ^ Перейти обратно: а б «EMA выпускает рекомендации по использованию Паксловида (PF-07321332 и ритонавира) для лечения COVID-19: параллельно начинается скользящий обзор» (пресс-релиз). Европейское агентство лекарственных средств (EMA). 16 декабря 2021 г. Архивировано из оригинала 11 января 2022 г. Текст был скопирован из этого источника, авторские права на который принадлежат Европейскому медицинскому агентству. Воспроизведение разрешено при условии указания источника.
- ^ «Противовирусные таблетки Pfizer могут быть опасны вместе с другими лекарствами» . Новости АВС . 26 декабря 2021 года. Архивировано из оригинала 3 февраля 2022 года . Проверено 4 февраля 2022 г.
- ^ «Контрольный список пациентов для проверки соответствия требованиям к препарату Паксловид и инструмент взаимодействия с лекарственными средствами» . США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) . 26 августа 2022 года. Архивировано из оригинала 10 октября 2022 года . Проверено 10 октября 2022 г.
- ^ «Следует ли мне принимать Паксловид после положительного теста на COVID-19?» . наркотики.com . 13 ноября 2022 года. Архивировано из оригинала 7 декабря 2022 года . Проверено 7 декабря 2022 г.
- ^ Андерсон А.С., Каубель П., Руснак Дж.М. (сентябрь 2022 г.). «Нирматрелвир-ритонавир и восстановление вирусной нагрузки при Covid-19» . Медицинский журнал Новой Англии . 387 (11): 1047–1049. дои : 10.1056/NEJMc2205944 . ПМЦ 9513855 . ПМИД 36069818 .
- ^ Перейти обратно: а б «Pfizer заявляет, что пациенты, у которых случился рецидив после приема таблеток от Covid, могут повторить лечение» . Блумберг . 3 мая 2022 года. Архивировано из оригинала 14 мая 2022 года . Проверено 21 мая 2022 г.
- ^ «Обновления FDA о Паксловиде для поставщиков медицинских услуг» . США Управление по контролю за продуктами и лекарствами (FDA). 4 мая 2022 года. Архивировано из оригинала 20 мая 2022 года . Проверено 21 мая 2022 г.
- ^ Перейти обратно: а б Рубин Р. (июнь 2022 г.). «От позитива к негативу и снова к позитиву: загадка того, почему COVID-19 возобновляется у некоторых пациентов, принимающих Паксловид» . ДЖАМА . 327 (24): 2380–2382. дои : 10.1001/jama.2022.9925 . ПМИД 35675094 . S2CID 249465757 .
- ^ «Директор CDC Рошель Валенски снова получила положительный результат на Covid после приема противовирусной таблетки Паксловид» . НБК . 31 октября 2022 года. Архивировано из оригинала 1 ноября 2022 года . Проверено 1 ноября 2022 г.
- ^ Лоу Д. (11 июля 2022 г.). «Сопротивление Паксловида: теперь это просто вопрос времени?» . В Трубопроводе . Архивировано из оригинала 10 октября 2022 года . Проверено 10 октября 2022 г.
- ^ Хейльманн Э., Костакурта Ф., Волланд А., фон Лаер Д. (4 июля 2022 г.). «Мутации 3CLpro SARS-CoV-2 придают устойчивость к Паксловиду (нирмарелвир/ритонавир) в системе, основанной на VSV, без усиления функции» . дои : 10.1101/2022.07.02.495455 . S2CID 250353628 . Архивировано из оригинала 9 ноября 2023 года . Проверено 8 ноября 2023 г.
- ^ Икетани С., Мори Х., Калбертсон Б., Хонг С.Дж., Дуан Ю., Лак М.И. и др. (ноябрь 2022 г.). «Множественные пути устойчивости SARS-CoV-2 к нирмарелвиру» . Природа . 613 (7944): 558–564. дои : 10.1038/s41586-022-05514-2 . ПМЦ 9849135 . ПМИД 36351451 . S2CID 253445215 .
- ^ Научный обзор CDER в поддержку EUA (PDF) (Отчет). США Управление по контролю за продуктами и лекарствами (FDA). Архивировано из оригинала 17 января 2022 года . Проверено 16 февраля 2022 г.
- ^ Номер клинического исследования NCT04960202 для «EPIC-HR: Исследование перорального применения PF-07321332/ритонавира по сравнению с плацебо у негоспитализированных взрослых с высоким риском заражения COVID-19» на сайте ClinicalTrials.gov.
- ^ «Pfizer объявляет дополнительные результаты исследования фазы 2/3, подтверждающие надежную эффективность нового кандидата на пероральное противовирусное лечение COVID-19 в снижении риска госпитализации или смерти» (пресс-релиз). Пфайзер . 14 декабря 2021 года. Архивировано из оригинала 26 декабря 2021 года . Проверено 25 декабря 2021 г. - через Business Wire.
- ^ Перейти обратно: а б с д и ж г час Ли Т.К., Пог Дж.М., МакКрири Э.К., Моррис А.М. (ноябрь 2022 г.). «Какое место в терапии нирмарелвира/ритонавира?». BMJ Evid, основанная медицина . 28 (5): 287–290. doi : 10.1136/bmjebm-2022-112064 . ПМИД 36384743 . S2CID 253579652 .
- ^ «Pfizer начинает дозирование противовирусного препарата для лечения Covid-19 в рамках фазы II/III» . Арена клинических испытаний . 2 сентября 2021 г. Архивировано из оригинала 5 ноября 2021 г. Проверено 5 января 2022 г.
- ^ Перейти обратно: а б с д и ж г «Pfizer сообщает дополнительные данные о Паксловиде, подтверждающие предстоящую подачу заявки на новый препарат в FDA США» . Нью-Йорк. 14 июня 2022 года. Архивировано из оригинала 24 июня 2022 года . Проверено 24 июня 2022 г.
- ^ Арипака П. (31 декабря 2021 г.). «Великобритания одобряет противовирусную таблетку от COVID-19 от Pfizer» . Рейтер . Архивировано из оригинала 31 декабря 2021 года . Проверено 31 декабря 2021 г.
- ^ Робинсон Дж. (апрель 2022 г.). «В исследовании PANORAMIC примут участие еще 17 500 пациентов, поскольку исследователи добавляют второй противовирусный препарат от COVID-19» . Фармацевтический журнал . дои : 10.1211/PJ.2022.1.138635 . Архивировано из оригинала 25 апреля 2022 года . Проверено 26 апреля 2022 г.
- ^ Перейти обратно: а б с д и «FDA пересматривает разрешительное письмо для разрешения на экстренное использование Паксловида» . США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) . 13 марта 2024 года. Архивировано из оригинала 27 мая 2024 года . Проверено 29 июня 2024 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе . - ^ «Паксловид (нирмарелвир/ритонавир)» . Здоровье Канады . 1 сентября 2012 года. Архивировано из оригинала 25 февраля 2024 года . Проверено 30 июня 2024 г.
- ^ «Паксловид, пероральная таблетка от COVID-19 от Pfizer, одобрена в Канаде» . Глобальные новости . Архивировано из оригинала 18 января 2022 года . Проверено 18 января 2022 г.
- ^ Недели C (17 января 2022 г.). «Министерство здравоохранения Канады одобрило противовирусную таблетку Pfizer против COVID-19 Паксловид» . Глобус и почта . Архивировано из оригинала 18 января 2022 года . Проверено 18 января 2022 г.
- ^ «Китай условно одобряет таблетку для лечения Covid от Pfizer Paxlovid» . Хранитель . Рейтер . 12 февраля 2022 года. Архивировано из оригинала 13 февраля 2022 года . Проверено 13 февраля 2022 г.
- ^ «Использование противовирусного препарата Pfizer для лечения COVID-19 одобрено» . Министерство здравоохранения (Пресс-релиз). Архивировано из оригинала 28 декабря 2021 года . Проверено 28 декабря 2021 г.
- ^ Челван, вице-президент (3 февраля 2022 г.). «Сингапур одобрил таблетку Паксловид от Pfizer для лечения COVID-19 у взрослых пациентов» . ЦНА . Архивировано из оригинала 17 февраля 2022 года . Проверено 3 февраля 2022 г.
- ^ «Южная Корея разрешает экстренное использование пероральных препаратов Pfizer для лечения коронавируса» . Рейтер . 27 декабря 2021 года. Архивировано из оригинала 11 января 2022 года . Проверено 28 декабря 2021 г.
- ^ «Паксловид 150 мг/100 мг таблетки, покрытые пленочной оболочкой» . (эмс) . 16 января 2024 года. Архивировано из оригинала 27 февраля 2024 года . Проверено 30 июня 2024 г.
- ^ «Pfizer запрашивает разрешение на экстренное использование нового кандидатного перорального противовирусного препарата от COVID-19» (пресс-релиз). Пфайзер . 16 ноября 2021 года. Архивировано из оригинала 16 ноября 2021 года . Проверено 17 ноября 2021 г. - через Business Wire.
- ^ Кимбалл С. (16 ноября 2021 г.). «Pfizer подает заявку FDA на экстренное одобрение таблетки для лечения Covid» . CNBC . Архивировано из оригинала 16 ноября 2021 года . Проверено 17 ноября 2021 г.
- ^ Роббинс Р. (5 ноября 2021 г.). «Pfizer заявляет, что ее противовирусная таблетка очень эффективна при лечении Covid» . Нью-Йорк Таймс . ISSN 0362-4331 . Архивировано из оригинала 8 ноября 2021 года . Проверено 9 ноября 2021 г.
- ^ Перейти обратно: а б Кимбалл С. (3 мая 2022 г.). «С конца февраля количество рецептов на Паксловид для лечения Covid в США выросло в десять раз, - сообщает Pfizer» . CNBC . Архивировано из оригинала 3 мая 2022 года . Проверено 3 мая 2022 г.
- ^ «Разрешение на экстренное использование 105» (PDF) . США Управление по контролю за продуктами и лекарствами (FDA). 13 марта 2024 года. Архивировано из оригинала 22 апреля 2022 года . Проверено 30 июня 2024 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе . - ^ Перейти обратно: а б Шмидт Б. (1 декабря 2021 г.). «Новое лекарство от короны от Pfizer производится во Фрайбурге» [лекарство от короны от Pfizer производится во Фрайбурге]. Badische Zeitung (на немецком языке). Архивировано из оригинала 15 января 2022 года . Проверено 15 января 2022 г.
- ^ Зеленый R (23 декабря 2021 г.). «Ученые Pfizer в Гротоне сыграли решающую роль в разработке новой таблетки от COVID-19» . Хартфорд Курант . Архивировано из оригинала 15 января 2022 года . Проверено 15 января 2022 г.
- ^ Пачи М (17 декабря 2021 г.). «Covid, в Асколи, единственный завод в Италии, который будет производить противовирусный препарат. Pfizer думает о сотне сотрудников» [Covid, в Асколи, единственный завод в Италии, который будет производить противовирусный препарат. Pfizer думает нанять сотню]. Corriere Adriatico (на итальянском языке). Архивировано из оригинала 15 января 2022 года . Проверено 15 января 2022 г.
- ^ Хакенброх V (25 августа 2022 г.). «Скандал с Паксловидом: почему немецкие врачи отказывают такому количеству пациентов в убийце вируса?» . Зеркало (на немецком языке). ISSN 2195-1349 . Архивировано из оригинала 10 октября 2022 года . Проверено 10 октября 2022 г.
- ^ «Информационный бюллетень: Администрация Байдена расширяет доступ к лечению COVID-19 и повышает осведомленность пациентов и поставщиков услуг» . Белый дом (Пресс-релиз). 26 апреля 2022 года. Архивировано из оригинала 6 июля 2022 года . Проверено 7 июля 2022 г.
- ^ Стивенсон Дж. (июль 2022 г.). «FDA разрешает фармацевтам назначать пероральные противовирусные препараты для лечения COVID-19» . Форум здоровья JAMA . 3 (7): e222968. doi : 10.1001/jamahealthforum.2022.2968 . ПМИД 36219005 . S2CID 250704928 .
- ^ «HHS и Pfizer достигли соглашения о расширении доступа пациентов к Паксловиду» . США Министерство здравоохранения и социальных служб (HHS) (пресс-релиз). 13 октября 2023 г. Проверено 30 июня 2024 г.
- ^ Сингх АГ. «Индийские дженерики становятся спасением в пострадавшем от Covid-19 Китае» . ОРФ . Архивировано из оригинала 21 января 2023 года . Проверено 30 декабря 2022 г.
- ^ «Китайцы обращаются к черному рынку дженериков индийских лекарств от Covid-19» . Южно-Китайская Морнинг Пост . 26 декабря 2022 года. Архивировано из оригинала 29 декабря 2022 года . Проверено 30 декабря 2022 г.
- ^ Перейти обратно: а б фон Чефалвай С (27 ноября 2021 г.). «Почему Паксловид — это не Пфизермектин» . Крис фон Чефальвай: Биты и ошибки . дои : 10.59350/576dr-vbd49 . Архивировано из оригинала 9 января 2022 года . Проверено 9 января 2022 г.
- ^ Перейти обратно: а б Горский Д. (15 ноября 2021 г.). «Новый препарат-ингибитор протеазы COVID-19 от Pfizer — это не просто «переупакованный ивермектин» » . Научная медицина . Архивировано из оригинала 20 декабря 2021 года . Проверено 5 января 2022 г.
- ^ «Ивермектин: как ложная наука создала «чудодейственное» лекарство от Covid» . Новости Би-би-си . 6 октября 2021 года. Архивировано из оригинала 8 января 2022 года . Проверено 8 ноября 2022 г.
- ^ Блум Дж. (2 декабря 2021 г.). «Чем Паксловид от Pfizer отличается от ивермектина?» . Американский совет по науке и здоровью. Архивировано из оригинала 15 декабря 2021 года . Проверено 12 декабря 2021 г.
Внешние ссылки
[ редактировать ]- Хэлфорд Б. (январь 2022 г.). «Как ученые Pfizer превратили старый препарат в противовирусное средство от COVID-19» . Новости химии и техники . Том. 100, нет. 3.
- Регаладо А (февраль 2022 г.). «Как компания Pfizer создала эффективную таблетку от коронавируса» . Обзор технологий Массачусетского технологического института .