Бэйлис -Хиллман Реакция
| (Морита -) Реакция Бэйлис -Хиллман | |
|---|---|
| Назван в честь | Кен-Ичи Морита Энтони Б. Байлис Мелвилл Э. Д. Хиллман |
| Тип реакции | Реакция связи |
| Идентификаторы | |
| Органическая химическая портал | Бэйлис-Хиллман-Реакция |
| RSC Ontology Id | Rxno: 0000076 |
В органической химии реакция Baylis -Hillman , Morita-Baylis-Hillman или MBH представляет собой реакцию формирования углерода-углерода между активированным алкеном и углеродным электрофилом в присутствии нуклеофильного катализатора , такого как третичный амин или фосфин . Продукт плотно функционируется , соединяя алкен в α-позиции к сниженной форме электрофила (например, в случае альдегида , аллильного спирта ). [ 1 ] [ 2 ]
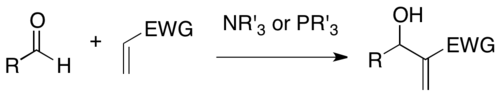
Реакция названа в честь Энтони Б. Бэйлиса и Мелвилла Э. Д. Хиллмана, двух химиков, которые разработали реакцию в целане ; и К. Морита, который опубликовал ранее [ 3 ] на том же.
Реакция MBH предлагает несколько преимуществ в органическом синтезе :
- Он сочетает в себе легко подготовленные начальные материалы с высокой экономикой атомов .
- Это требует только мягких условий и не требует никаких переходных металлов .
- Асимметричный синтез возможен из прочеральных электрофилов.
- Плотная функционализация продукта обеспечивает многие дальнейшие преобразования .
Его недостаток заключается в том, что реакция чрезвычайно медленная.
Общие реагенты
[ редактировать ]Наиболее часто используемым катализатором реакции является третичный амин- дабко (триэтилендиамин) ; Другие известные катализаторы включают 4-диметиламинопиридин , DBU (диазабициклунцен) и различные фосфины .
Механизм реакции
[ редактировать ]По состоянию на 2012 год [update], определенные вопросы о механизме реакции MBH остаются открытыми.
Хилл и Исааки провели первые кинетические эксперименты в 1990-х годах, обнаружив, что скорость реакции между акрилонитрилом и ацетальдегидом была первым порядком в каждом реагенте и в катализаторе Dabco. Акрилонитрил α- дейтерированный не проявлял кинетического изотопного эффекта , но продукт, по-видимому, катализировал его собственное поколение . [ 4 ]
В модели Хоффманн предложил семь лет назад, [ 5 ] Реакция начинается с 1,4-изменения каталитического амина к активированному алкене. Полученный Zwitterionic AzaNolate к подвергается добавлению альдола альдегиду. Внутримолекулярное сдвиг протона затем генерирует конечный аддукт MBH, который устраняет катализатор.

Если бы модель Хоффмана была правильной, то добавление Aldol было бы ограничивающим скоростью этап , который согласуется с отсутствующим кинетическим изотопным эффектом. [ 4 ] Тем не менее, механизм Хоффмана рационализирует ни автокатализ продукта, ни (в реакции арил -альдегидов с акрилатами ) значительную генерацию побочного продукта диоксанона .
В более поздних работах McQuade et al. И Aggarwal et al. Пересели механизм MBH, сосредоточившись на протоне-переносе и автокатализе. [ 6 ] [ 7 ] Согласно МакКуде, реакция между метилакрилатом и п-нитробензальдегидом является вторым порядком относительно альдегида. Более того, он показал значительный кинетический изотопный эффект для α-гидрогена акрилата (5,2 в ДМСО , но ≥2 во всех растворителях), что подразумевает, что абстракция протона является стадией определения скорости.
Чтобы учесть этот повторный анализ, МакКуде предложил изменить предложение Хоффмана, так что после первого добавления Альдола второй Альдол добавляет образуя гемиацетальный алкоксид. Затем, определяющая скорость переноса протона, выпускает аддукт через шестичленное переходное состояние , которое дополнительно реагирует на производство продукта MBH c или диоксанон-побочный продукт . A
В дальнейшей модификации Аггарвал отметил, что метанол ингибирует автокатализ в реакции MBH. Таким образом, он предположил, что на ранних стадиях реакции действует механизм, эквивалентный предложению МакКуде, но после 20% конверсии реакция с алкогольным растворителем может заменить второе добавление Альдола. В поддержку этого утверждения Аггарвал и Харви смоделировали два пути, используя расчеты функциональной теории плотности и показали, что профиль вычисленной энергии соответствует экспериментальным кинетическим изотопным эффектам и наблюдаемой скорости реакции. [ 8 ] Кроме того, они показали, что общий энтальпический барьер катализируемого алкоголем пути немного меньше, чем у неалкогольного пути, катализируемого пути, рационализируя, что по мере того, как концентрация алкоголя (продукт MBH) увеличивает катализируемый алкоголем путь.

В то время как исследования МакКуде и Аггарваля уделяли много внимания, однозначное доказательство роли промежуточного A A оставалось неуловимым по состоянию на 2012 год. [update]Полем Поскольку A может быть сформирован путем отдельного добавления B к альдегиду, любой изолированный A и C может быть результатом побочных реакций , а не самого MBH. Также не было убедительного объяснения, пока не было представлено для первоначальных данных первого порядка Хилла и Исаака.
Модификация Аггарвала имеет свои противоречия. Если это правильно, то этап определения скорости изменяется от переноса протона в добавление Aldol в течение реакции [ 7 ] - Но последующие вычислительные исследования пришли к выводу, что перенос протона по -прежнему имеет самый высокий барьер даже поздно в процессе реакции. С другой стороны, Coelho и Eberlin et al. Получили данные электрораспыления , масс -спектроскопии которые являются структурными доказательствами для двух разных форм стадии переноса протона реакции. [ 9 ]
Объем и ограничения
[ редактировать ]
Реакция MBH чрезвычайно общая. В большинстве случаев электрофил представляет собой альдегид, кетон (но см. Ниже) или имин (в последнее время реакция Аза -Байлис -Хиллман ); Но отчеты указывают на то, что аллил галогениды , алкилгалогениды и эпоксиды также возможны. [ 10 ] [ 11 ] [ 12 ] Использование Аллена вместо простого алкена в качестве предшественника дает промежуточное соединение, которое может реагировать на γ -углерод, а не на α. [ 13 ]
В то же время, может быть сложно разработать подходящие условия реакции. Реакция медленная (время двухнедельных или дольше не является редкостью, даже с 25-100 моль % катализатором), особенно с (в виде алкена) β-замещенных активированных олефинов, сульфонов или винилсульфоксидов виниловых ; или (в качестве электрофила) затруднены алифатические альдегиды или богатые электронами бензальдегиды . Кетоны, как правило, недостаточно реагируют в обычных условиях, чтобы принять участие в синтетически полезном способе. [ 14 ] Например, реакция между стерически затрудненным T -бутилакрилатом умеренному и бензальдегидом с каталитическим Dabco в отсутствие растворителя требовала 4 недели, чтобы привести к преобразованию в конечный продукт.

В апротонных растворителях скорость реакции даже медленнее, хотя восстановление возможна с протекными добавками (например, спиртами и карбоновыми кислотами). [ 15 ]
При таких низких показателях активность субстратов может вызвать конкурирующие боковые реакции: акролеины также олигомеризации и Allenoates Cycloadd. Электрофилы аллиля-халида и алкил-эпоксид также часто оказываются неуправляемыми. [ нужно разъяснения ] [ Цитация необходима ] Реакция MBH арил-винилового кетона с альдегидом не является прямой (но см . Реакцию Sila-MBH ), поскольку реактивный арилвинилкетон легко подвергается добавлению Майкла к другой молекуле арил-винилактона, который затем добавляет к альдегиду с образованием добавления двойного-mBH. [ 16 ]

Из -за очень негативного объема активации, вялые реакции Байлиса -Хиллман, включая кетонические, могут быть реализованы путем проведения реакции под высоким давлением (до 20 кбар). [ 14 ]
Варианты
[ редактировать ]Их-мбх реакция
[ редактировать ]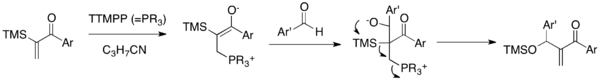
В реакции SILA-MBH α-силилированные виниларилкетоны пара к альдегидам в присутствии каталитического TTMPP , большого реагента фосфина триарила . [ 17 ] Цвиттерионный эннелят, полученный при добавлении нуклеофильного катализатора в enone, добавляет к альдегидскому карбонилу для генерации алкоксида. Этот алкоксид подвергается последующему 1,3- брукскому перестройке и элиминационной каскаде, чтобы позволить себе силокси-метиленонный enone и высвободить катализатор.
Реакция Раухут-Курье
[ редактировать ]
Реакция Раухут-Курриер представляет собой винилогенный аналог реакции MBH, в которой электрофил является акцептором Майкла , а не альдегидом или имином. Межмолекулярные реакции Rauhut-Currier, как правило, демонстрируют плохую хемоцелективность , потому что реакция объединяет два активированных алкена, но были использованы внутримолекулярные реакции раухут-турнира. Например, циклизация α, β-без насыщенных альдегидов может быть выполнена в присутствии пролина и уксусной кислоты, предоставляя энантиоэгнированные продукты. [ 18 ]
Тандемные стратегии
[ редактировать ]Как упоминалось выше, медленная скорость реакции MBH часто позволяет побочным реакциям на ее активированных субстратах. В тандемных стратегиях реакции это добродетель, поскольку он позволяет синтезам с высокой экономикой атомов. Например, в трехкомпонентной связке альдегидов, аминов и активированных алкенов альдегид реагирует с амином с образованием имином до образования аза -МБХ, как в реакции арил -альдегид, дифенилфосфинамид , , и метил -винил, in, in, in, in, in, in, in, in, in, in, in, in -in, in, in, in, in, in, in -in, in -in -in -in -tyn -tyn -tyn -ty -tynphosphesphesphisphessy, и метиловое моглоеновое моглоловое емывоееновое ,вое ,емыеное , емыеное ,емыеное ,емыеное , вое , вое, иеловое .жиленое . и триэтиламин : [ 19 ]

Аналогичным образом, активированные ацетилен могут подвергаться конъюгатному добавлению и оставаться активированным алкеном для реакции MBH, как в следующей энантиоселективной реакции циклизации , в которой фенолярный нуклеофил добавляет к функционализированному Enyne перед AZA -MBH -кольцом, катализированным основом хирального амина. [ 20 ]

Асимметричный синтез
[ редактировать ]Хиральные вспомогательные
[ редактировать ]Sultam Oppolzer можно использовать в качестве хирального вспомогательного для асимметричной реакции MBH. Когда акрилат, заменяемый султамом противника, реагировал различными альдегидами в присутствии катализатора Dabco, оптически чистых 1,3-диоксан-4-от были предоставлены с расщеплением вспомогательного выхода 67-98%,> 99% EE). Циклические продукты могут быть преобразованы в желаемые продукты MBH с использованием кампхольфоновой кислоты и метанола. [ 21 ]
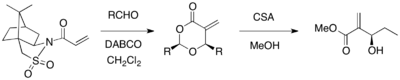
Связанным вспомогательным гидразидом является хиральный акрилоилгидразид , который реагирует диастереоселективно с альдегидами. [ 22 ] Оба диастереомера могут быть получены с различным выбором растворителей (DMSO против смешанного THF и H 2 O), что позволяет предположить, что конформация структуры перехода зависит от растворителя.
Хирал Аллена и Имины также могут быть использованы для асимметричной реакции аза -МБХ, катализируемой Dabco. [ 23 ] Оптически активная 10-фенилсульфульфонилизоборрнила BUTA-2,3-диеноат реагирует с арилом имином с получением α-алениламина диастереоселективным образом (выход 37-57%).

Хирал Льюис-Базический катализатор
[ редактировать ]В некоторых энантиоселективных реакциях MBH используются хиральные аминные катализаторы. Например, β-ICD , производное алкалоид Cinchona, известно среди катализаторов на основе рамки хинидина и катализировала энантиоселективную реакцию MBH с 1,1,1,3,3,3, -гексафторуоизопропильным акрилатом в качестве активированного алкенового: алкен: алкен: алкен: Активированный алкен: -гексафлуороизопропильный акрилат в качестве активированного алкенового: алкен:-гексафлуоизопропил акрилат в качестве активированного алкена: -гексафлуороизопропильного акрилата. [ 24 ]
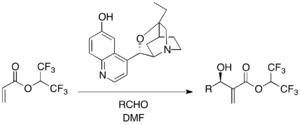
Было показано, что фенольный кислород β-ICD важен в реакции, подразумевая, что β-ICD действует как бронстедская кислота, а не просто нуклеофил.
Циклопентенон и различные ароматические и алифатические альдегиды подвергаются асимметричной реакции с использованием плоского хирального катализатора DMAP FU в изопропаноле (выход 54-96%, 53-98% EE). В этом случае йодид магния в качестве кислотного кокатализатора Льюиса был необходим для ускорения реакции. [ 25 ]

П -хиральные фосфины были исследованы. [ 26 ]
Простые диамины также могут использоваться в качестве катализаторов MBH. Было обнаружено, что метилвинил кетон и различные замещенные бензальдегиды подвергаются асимметричной реакции MBH. Хиральный пирролидиновый катализатор был эффективен для орто- и паразамещенных электронов бензальдегидов (выход 75-99%, 8-73% ЭЭ). [ 27 ]

Катализаторы хирального фосфина MBH часто содержат бронстеды кислотных фрагментов в их костях. Например, хиральные фосфины, содержащие основание Льюиса, бронстедскую кислоту, и активированное кислотой основание бронстеда, были разработаны для асимметричной реакции AZA -MBH (выход 86-96%, 79-92% EE). Предполагалось, что кислота и базовые фрагменты бронстеда участвуют в стабилизации Zwitterionic видов стереоселективным образом. [ 28 ]

Хиральный фосфиновый катализатор, полученный из биноля, также эффективен для асимметричной реакции аза-МБХ N-тозиловых иминов с активированными алкенами, такими как метилвиниловый кетон и фенилкрилат. [ 29 ]
Кроме того, отчетливый класс молекул хирального фосфийнккварамида может эффективно катализировать внутримолекулярную асимметричную реакцию MBH. ω-формалоны реагировали на то, что они дают энантиоэнергированные циклические продукты при температуре окружающей среды (выход 64-98%, 88-93% EE). [ 30 ]

Кирал Кластный катализатор Льюиса
[ редактировать ]Киральные кислотных катализаторов Льюиса были даны интересы, так как они могли бы активировать группу с электронно-гигиенными, энантиоселекционирование. Было показано, что хиральные катионные оксаборолидиниевые катализаторы эффективны при трехкомпонентном соединении α, β-ацетиленовых сложных эфиров, альдегидов и йодида триметилсилила (50-99% урожайности, 62-94% EE). Оба энантиомерных продукта могут быть получены с использованием различных энантиомеров катализатора. [ 31 ]

Комплекс металлической соли и хирального лиганда также является жизнеспособной стратегией. LA (OTF) 3 и, полученные из камфоры, хиральные лиганды могут вызывать энантиоселективность в реакции MBH, катализируемой DABCO, получения различных альдегидов и акрилатов (25-97%, 6-95% ЭЭ). Для этих случаев мультивантные лиганды обычно использовались для хелата с металлом, который активирует как Zwitterionic Enolate, так и альдегид. [ 32 ]

LA (O-IPR) 3 и бинол, полученная из лиганда, в сочетании с каталитической Dabco также работают для асимметричной реакции AZA-MBH различных N-дифенилфосфиноил иминов и метилакрилата. Арил, гетероарил и алкениловые имины были подходящими для хорошего урожайности и энантиоселективности. [ 33 ]
Хиральные палладиевые (II) Комплексы клещей функционируют как кислота Льюиса в энантиоселективной катализируемой аза-мбх реакции акрилонитрила и различных тозиловых иминов для обеспечения функционализированных α-метилена-β-аминонитрилов (75-98%, 76-98% EE). Ацетат серебра необходим для активации докатализатора бромида палладиевого бромида в каталитическом цикле. [ 34 ]
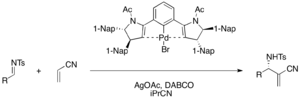
Хирал Бронстедский кислотный кокатализатор
[ редактировать ]Разнообразные хиральные катализаторы Thiurea проходят исследование асимметричных реакций MBH. Катализаторы хиральной тиомочевины и бис (тиореа) могут быть эффективными в реакциях, катализируемых Dabco MBH и AZA-MBH. [ 35 ] [ 36 ] Например, катализатор Thiurea в Якобсене выполняет энантиоселективную реакцию AZA-MBH (доход 25-49%, 87-99% EE).
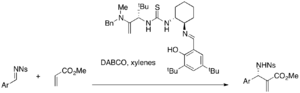
В то время как простая тиомочевина требует нуклеофильного катализатора в сочетании, бифункциональные катализаторы, такие как фосфин-тиорус, могут использоваться отдельно для асимметричных реакций MBH. Например, различные акрилаты и ароматические альдегиды реагируют в присутствии этих катализаторов, чтобы позволить себе либо энантиомерные аддукты MBH (выход 32-96%, 9-77% EE). [ 37 ]

Реакция MBH может включать производное пролина в качестве кокатализатора. Было предложено, что нуклеофильный катализатор имидазола и эффект пролина реакция через промежуточный иминий. [ 38 ] С (S) -пролиновыми и Dabco, α-амидо сульфонами и α, β-безсыщенными альдегидами подвергаются высокоэнантиоселективной реакции AZA-MBH (46-87% выход, E/Z 10: 1-19: 1, 82-99% EE). [ 39 ]

Применение в органическом синтезе
[ редактировать ]Аддукты Baylis -Hillman и их производные были широко использованы для генерации гетероциклов и других циклических рамок. [ 40 ]
Реакции MBH широко используются в органическом синтезе. Например, эта реакция была использована для построения ключевых циклических промежуточных соединений для синтезов салиноспорамида А., Diversonol и Anatoxin-A. [ 41 ] [ 42 ] [ 43 ]



Дальнейшее чтение
[ редактировать ]Было написано много обзоров, в том числе:
- Deevi Basavaiah, Anumolu Jaganmohan Rao и Tummanapalli Satyanarayana (2003), «Последние достижения в реакции и приложениях Baylis -Hillman». Химический Преподобный , 103 (3), стр. 811–892. два : 10.1021/cr010043d
- G. Masson, C. Housseman и J. Zhu (2007), «Энантиоселективная реакция Морита -Байлис -Хиллман и ее аналог AZA». Angewandte Chemie International Edition , 46: 4614–4628. два : 10.1002/anie.200604366
- Valerie Declerck, Джин Мартинес и Фредерик Ламати (2009), « Аза -бейлис -гиллман» Chem. Rev. , 109 (1), с. 1–48. два : 10.1021/cr068057c
- Deevi Basavaiah, Bhavanam Sekhara Reddy и Satpal Singh Badsara (2010), «Недавние вклад от реакции Baylis-Hillman на органическую химию». Химические обзоры 110 (9), стр. 5447-5674. два : 10.1021/cr900291g
- Бейс . Соц Провинция два : 10.1039/c1cs15174f
Ссылки
[ редактировать ]- ^ Бэйлис, Аб; Hillman, Med German Patent 2155113, 1972 .
- ^ Ciganek, E. Org. Реагировать. 1997 , 51 , Два : 10.1002/0471264180.or051.02
- ^ K. Morita, Z. Suzuki и H. Hirose, Bull. Химический Соц Jpn., 1968 , 41, 2815.
- ^ Jump up to: а беременный J. Phys Орг Химический 1990, 3, 285.
- ^ Angew. Химический Инт. Редакция Энтузиазм 1983, 22, 795.
- ^ Органические буквы, 2005, 7, 1, 147-150.
- ^ Jump up to: а беременный Angew. Химический Инт. Редакция 2005, 44, 1706-1708.
- ^ J. Am. Chem. Soc. 2007, 129, 15513.
- ^ J. Org. Chem., 2009, 74(8), 3031-3037
- ^ Тетраэдр Летт. 2001, 42, 85.
- ^ Org. Легкий. 2010, 12, 2418.
- ^ Chem. Commun. 2006, 2977.
- ^ J. Am. Chem. Soc. 2009, 131, 4196.
- ^ Jump up to: а беременный Basavaiah, Rao & Satyanarayana 2003 .
- ^ Форт, Ив; Берт, Мари Кристин; Caubere, Paul (1992). «Механизм и приложения« Бэйлис - реакция Хиллмана »и приложения повторно». Тетраэдр . 48 (31): 6371–6384. doi : 10.1016/s0040-4020 (01) 88227-2 .
- ^ «Энантиоселективные реакции аза -мориты -байлиса -Хиллман акрилонитрила, катализируемых комплексами клещей палладий (II), имеющими C 2 -симметричные хиральные бис (имидазолин) лиганды» Hyodo, K.; Накамура, с.; Шибата, Н. Ангев. Химический Инт. Редакция 2012, 51, 10337. Два : 10.1002/anie.201204891
- ^ Трофимов, Александр; Gevorgyan, Vladimir (2009). «Sila-Morita-Baylis-Hillman Реакция арилвинилкетонов: преодоление проблемы димеризации». Органические буквы . 11 (1): 253–255. doi : 10.1021/ol8026522 .
- ^ Marqués-López, Евгения; Эррера, Ракель П.; Отметки, тимьян; Джейкобс, Вибке С.; Кеннинг, Даниэль; De Figueiredo, Renata M.; Кристманн, Матиас (2009). «Внутренние внутримолекулярные реакции раухут-тепло посредством активации диенамина». Органические буквы . 11 (18): 4116–4119. Doi : 10.1021/ol901614t . HDL : 10261/113980 .
- ^ Ши, мин; Zhao, Gui-Ling (2002). «Аза-байлис-гиллман реакции арилальдегидов и дифенилфосфинамида с метилвиниловым ктоном в присутствии тикля 4 , PPH 3 и ET 3 N». Тетраэдр буквы . 43 (50): 9171–9174. doi : 10.1016/s0040-4039 (02) 02263-3 .
- ^ Немецкий, Джозеф; Нуньес, Альберто; Март, закон; Марк, Ванеса; Альварад, Quauhtémoc; Руано, Хосе Луис Гарсия (2010). «Симметричный ситез 4-амино-4H-хроменов путем организации Oxael/Aza-Baylis/Aza-Baylis-Hillman-это реакция. Химический Евро. Дж 16 (31): 9453–9456 doi : 10.1002/ chem.201001293
- ^ J. Am. Chem. Soc. 1997, 119, 4317-4318
- ^ Org. Легкий. 2000, 2, 6, 729-731
- ^ Евро. J. Org. Химический 2010, 3249-3256
- ^ J. Am. Chem. Soc. 1999, 121, 10219-10220
- ^ Chem. Commun. 2010, 46, 2644-2646
- ^ Xiao, Y.; Солнце, Z.; Го, Х.; Квон, О. (2014). «Хиральные фосфины в нуклеофильном органокатализе» . Бейльштейн Журнал органической химии . 10 : 2089–2121. doi : 10.3762/bjoc.10.218 . PMC 4168899 . PMID 25246969 .
- ^ J. Tetrahedron: Asymmetry, 2010, 1511.
- ^ Adv. Синтезатор Катал. 2009, 351, 331
- ^ Chem. Commun. 2003, 1310
- ^ Chem. Commun. 2011, 47, 1012
- ^ Angew. Химический Инт. Редакция 2009, 48, 4398
- ^ J. Org. Chem. 2003, 68, 915-919
- ^ J. Am. Chem. Soc. 2010, 132, 11988
- ^ Angew. Химический Инт. Редакция 2012, 51, 10337-10341
- ^ Adv. Синтезатор Катал. 2005, 347, 1701-1708
- ^ Тетраэдр Летт. 2011, 52, 6234
- ^ Tetrahedron 2009, 65, 8185
- ^ Chem. Eur, J. 2009, 15, 1734
- ^ J. Adv. Синтезатор Катал. 2011, 353, 1096
- ^ Tetrahedron, 2008, 64 (20), 4511-4574.
- ^ J. Am. Chem. Soc. 2004, 126, 6230-6231.
- ^ Angew. Химический Инт. Редакция 2006, 45, 307–309.
- ^ Chem. Commun. 2008, 3432.