Современные вакцины против COVID-19
Эта статья нуждается в более надежных медицинских ссылках для проверки или слишком сильно полагается на первоисточники . ( ноябрь 2021 г. ) |  |
 Флаконы вакцины Модерна от COVID-19 | |
| Описание вакцины | |
|---|---|
| Цель | SARS-CoV-2 |
| Vaccine type | mRNA |
| Clinical data | |
| Trade names | Spikevax[1][2] |
| Other names | mRNA-1273, CX-024414, COVID-19 mRNA Vaccine Moderna, TAK-919, Moderna COVID‑19 Vaccine, COVID‑19 Vaccine Moderna, COVID-19 Vaccine Moderna Intramuscular Injection,[3] elasomeran,[4][5] COVID-19 Vaccine (mRNA),[6] davesomeran,[4] imelasomeran,[4] andusomeran,[4] CX-034476, CX-038839 |
| AHFS/Drugs.com | Monograph |
| MedlinePlus | a621002 |
| License data | |
| Pregnancy category | |
| Routes of administration | Intramuscular |
| ATC code | |
| Legal status | |
| Legal status |
|
| Identifiers | |
| CAS Number | |
| PubChem SID | |
| DrugBank | |
| UNII | |
| KEGG | |
| ChEMBL | |
| Part of a series on the |
| COVID-19 pandemic |
|---|
 |
|
|
|
Вакцина Moderna COVID‑19 , продаваемая под торговой маркой Spikevax , представляет собой вакцину против COVID-19, разработанную американской компанией Moderna США , Национальным институтом аллергии и инфекционных заболеваний (NIAID) и Управлением перспективных биомедицинских исследований и разработок (США). БАРДА). В зависимости от юрисдикции он разрешен к использованию у людей в возрасте шести месяцев, [ 48 ] двенадцать лет или восемнадцать лет и старше. Он обеспечивает защиту от COVID-19 , вызванного заражением вирусом SARS-CoV-2 . [ 42 ] [ 2 ] [ 22 ] [ 14 ]
Он предназначен для введения в виде двух или трех по 0,5 мл доз внутримышечно , преимущественно в дельтовидную мышцу, с интервалом не менее 28 дней. [ 33 ] [ 49 ] [ 50 ] [ 51 ] Всемирная организация здравоохранения рекомендует делать восьминедельный интервал между приемами для оптимизации эффективности. В некоторых регионах одобрены дополнительные ревакцинационные дозы для поддержания иммунитета. Клинические испытания и реальные данные продемонстрировали высокую эффективность вакцины, причем значительная эффективность наблюдалась через две недели после введения второй дозы, обеспечивая 94% защиту от Covid и надежную защиту от тяжелых случаев. Эффективность вакцины распространяется на различные демографические группы, включая возраст, пол и людей с заболеваниями высокого риска.
It is an mRNA vaccine composed of nucleoside-modified mRNA (modRNA) encoding a spike protein of SARS-CoV-2, which is encapsulated in lipid nanoparticles.[52] In August and September 2022, bivalent versions of the vaccine (Moderna COVID-19 Vaccine, Bivalent) containing elasomeran/elasomeran 0-omicron (Spikevax Bivalent Zero/Omicron)[53] were authorized for use as booster doses in individuals aged 18 or older in the United Kingdom,[54][55] Switzerland,[56] Australia,[57] Canada,[58][59] the European Union,[2] and the United States.[60][61][62][63][64][65] The second component of the version of the bivalent vaccine used in the United States[66] is based on the Omicron BA.4/BA.5 variant,[60] while the second component of the bivalent vaccine version used in other countries is based on the Omicron BA.1 variant.[2][53][55][54][59] The vaccine's effectiveness against variants has been extensively studied, indicating varying degrees of protection. For instance, during the prevalence of the Delta variant, effectiveness against infection slightly decreased over time. The vaccine's longevity and continuous protection are under study, with ongoing research focusing on its duration of effectiveness, which remains partially undetermined as of the latest updates.
The safety profile of the vaccine is favorable, with common side effects including injection site pain, fatigue, and headaches. Severe reactions like anaphylaxis are exceedingly rare. Concerns regarding myocarditis, have been identified but are typically mild and manageable. The vaccine's formulation utilizes mRNA technology, encapsulated within lipid nanoparticles to ensure cellular uptake and immune system response.
Medical uses
The Moderna COVID‑19 vaccine is used to provide protection against infection by the SARS‑CoV‑2 virus in order to prevent COVID‑19.[42][2]
The vaccine is given by intramuscular injection into the deltoid muscle of the arm.[33] The initial course consists of two doses.[33] The World Health Organization (WHO) recommends an interval of eight weeks between doses.[67]
A third, fourth, or fifth dose can be added in some countries.[50][51][68]
Efficacy
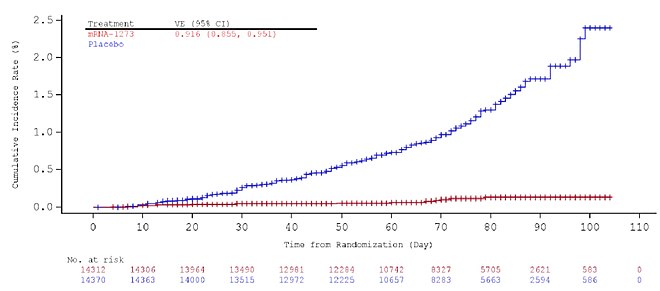
Evidence of vaccine efficacy starts about two weeks after the first dose.[69][70] High efficacy is achieved with full immunization, two weeks after the second dose, and was evaluated at 94.1%: at the end of the vaccine study that led to emergency authorization in the US, there were eleven cases of COVID‑19 in the vaccine group (out of 15,181 people) versus 185 cases in the placebo group (15,170 people).[69] Moreover, there were zero cases of severe COVID‑19 in the vaccine group, versus eleven in the placebo group.[71] This efficacy has been described as "astonishing"[72] and "borderline historic"[73] for a respiratory virus vaccine, and it is similar to the efficacy of the Pfizer–BioNTech COVID-19 vaccine.[74][75]
Efficacy estimates were similar across age groups, sexes, racial and ethnic groups, and participants with medical comorbidities associated with high risk of severe COVID‑19.[76] Only individuals aged 18 or older were studied. Studies are underway to gauge efficacy and safety in children aged 0–11 (KidCOVE) and 12–17 (TeenCOVE).[77]
A further study conducted by the US Centers for Disease Control and Prevention (CDC) between December 2020, and March 2021, on nearly 4 thousand health care personnel, first responders, and other essential and frontline workers concluded that under real-world conditions, mRNA vaccine effectiveness of full immunization (14 days or more after second dose) was 90% against SARS-CoV-2 infections, regardless of symptoms, and vaccine effectiveness of partial immunization (14 days or more after first dose but before second dose) was 80%.[78]
The duration of protection provided by the vaccine is unknown as of April 2021[update],[52][79] and a two-year followup study is underway to determine the duration.[73]
Preliminary results from a phase III trial indicate that vaccine efficacy is durable, remaining at 93% six months after the second dose.[80]
Effectiveness
A vaccine is generally considered effective if the estimate is ≥50% with a >30% lower limit of the 95% confidence interval.[81] Effectiveness is generally expected to slowly decrease over time.[82]
In August 2021, results from a study suggested that the effectiveness against infection decreased from 91% (81–96%) to 66% (26–84%) when the Delta variant became predominant in the US, which may be due to unmeasured and residual confounding related to a decline in vaccine effectiveness over time.[83]
| Doses | Severity of illness | Delta[a] | Alpha[b] | Gamma[b] | Beta[b] | Omicron | Others circulating previously[b] |
|---|---|---|---|---|---|---|---|
| 1 | Asymptomatic | 62% (−10 to 87%) | Not reported | Not reported | Not reported | Not reported | Not reported |
| Symptomatic | 83% (65–91%) | 61% (56–66%) | 43% (22–59%) | Not reported | 61% (53–67%) | ||
| Hospitalization | 87% (−1 to 98%) | 59% (39–73%) | 56% (−9 to 82%) | Not reported | 76% (46–90%) | ||
| 2 | Asymptomatic | 54% (33–68%) | Not reported | Not reported | Not reported | Not reported | Not reported |
| Symptomatic | 74% (66–80%) | 90% (85–94%) | 88% (61–96%) | Not reported | 93% (87–96%) | ||
| Hospitalization | 96% (72–100%) | 94% (59–99%) | 100%[c] | Not reported | 90% (80–100%) | ||
Specific populations
Limited data are available on the safety of the Moderna COVID‑19 vaccine during pregnancy.[86] The initial study excluded pregnant women or discontinued them from vaccination upon a positive pregnancy test.[69] Studies in animals found no safety concerns and clinical trials are underway to evaluate the safety and efficacy of COVID‑19 vaccines in pregnant women.[86] Real-world observations through the CDC v-safe tracking program have not uncovered unusual numbers of adverse events or outcomes of interest.[87] Based on the results of a preliminary study, the US CDC recommends that pregnant women get vaccinated with the COVID‑19 vaccine.[88][89]
Adverse effects

The World Health Organization (WHO) stated that "the safety data supported a favorable safety profile" and that the vaccine's AE (adverse event) profile "did not suggest any specific safety concerns".[69] The most common adverse events were pain at the injection site, fatigue, headache, myalgia (muscle pain), and arthralgia (joint pain).[69]
The US Centers for Disease Control and Prevention (CDC) has reported anaphylaxis (a severe allergic reaction) in 2.5 cases per million doses administered and has recommended a 15-minute observation period after injection.[91] Delayed cutaneous reactions at injection sites resulting in rash-like erythemas have also been observed in rare cases but are not considered serious or contraindications to subsequent vaccination.[92] The incidence rate for local adverse erythema is about 10.8%. In 1.9% of cases, redness may extend to a size of 100 mm or greater.[41]
In June 2021, the US CDC confirmed that myocarditis or pericarditis occurs in about 13 of every 1 million young people, mostly male and over the age of 16, who received the Moderna or the Pfizer–BioNTech vaccine.[93][94] Most affected individuals recover quickly with adequate treatment and rest.[95]
Additional side effects include extensive swelling of the vaccinated limb.[96]
Pharmacology
Moderna's technology uses a nucleoside-modified messenger RNA (modRNA) compound codenamed mRNA-1273. The mRNA-1273 drug delivery system uses a PEGylated lipid nanoparticle drug delivery (LNP) system.[97] Once the compound is inside a human cell, the mRNA links up with the cell's endoplasmic reticulum. The mRNA-1273 is encoded to trigger the cell into making a specific protein using the cell's normal manufacturing process. The vaccine encodes a version of the spike protein with a modification called 2P, in which the protein includes two stabilizing mutations in which the original amino acids are replaced with prolines, developed by researchers at the University of Texas at Austin and the National Institute of Allergy and Infectious Diseases' Vaccine Research Center.[98][99][100] Once the protein is expelled from the cell, it is eventually detected by the immune system, which begins generating efficacious antibodies.
Chemistry
The vaccine contains the following ingredients:[42][41]
The active ingredient is an mRNA sequence containing a total of 4101 nucleotides that encodes the full-length SARS-CoV-2 spike (S) glycoprotein,[101] with two mutations (K986P and V987P) designed to stabilize the pre-fusion conformation. The sequence is further optimized by:[102][103]
- all uridines (U) substituted with N1-methylpseudouridine (U → m1Ψ),
- flanked by an artificial 5' untranslated region (UTR) and a 3' UTR derived from the human alpha globin gene (HBA1),
- introduction of two additional stop codons,
- terminated by a 3' poly(A) tail.
A putative sequence of the vaccine has been published on a forum for professional virologists, obtained by direct sequencing of residual vaccine material in used vials.[104]
The vaccine mRNA is dissolved in an aqueous buffer containing tromethamine, tromethamine hydrochloride, sodium acetate, and sucrose.[33] The mRNA is encapsulated in lipid nanoparticles that stabilize the mRNA and facilitate its entry into cells.[52] The nanoparticles are manufactured from the following lipids:
- 1,2-distearoyl-sn-glycero-3-phosphocholine (DSPC),[33]
- cholesterol,[33]
- PEG2000-DMG (polyethylene glycol (PEG) 2000-dimyristoyl glycerol (DMG)),[33] and
- SM-102[33]
Manufacturing


Moderna is relying extensively on contract manufacturing organizations to scale up its vaccine manufacturing process. The first step of the process—synthesis of DNA plasmids (to be used as a template for synthesis of mRNA)—has been handled by a contractor called Aldevron based in Fargo, North Dakota.[105] For the remainder of the process, Moderna contracted with Lonza Group to manufacture the vaccine at facilities in Portsmouth, New Hampshire in the United States, and in Visp in Switzerland, and purchased the necessary lipid excipients from CordenPharma.[106] Besides CMOs, Moderna also manufactures the vaccine at its own production facility in Norwood, Massachusetts.[107] Another manufacturing site for the vaccines for the market outside the U.S. (since the end of 2021) is in Geleen in the Netherlands, produced by its manufacturing partner Lonza.[108] Earlier, Lonza did produce the vaccine for the EU, U.K. and Canada at its site in Switzerland only, but had to cut projected deliveries to the U.K. and Canada earlier in 2021 due to production issues.[109]
For the tasks of filling and packaging vials (fill and finish), Moderna entered into contracts with Catalent in the United States and Laboratorios Farmacéuticos Rovi in Spain.[106] In April 2021, Moderna expanded its agreement with Catalent to increase manufacturing output at the latter's plant in Bloomington, Indiana. The expansion will allow Catalent to manufacture up to 400 vials per minute and fill an additional 80 million vials per year.[110] Later that month, Moderna announced its plans to spend billions of dollars to boost production of its vaccines, potentially tripling the output in 2022, claiming as well that it would make no less than 800 million doses in 2021. The increase in production is in part attributed to improvements made by the company in manufacturing methods.[111][112][113]
The Moderna news followed preliminary results from the Pfizer-BioNTech vaccine candidate, BNT162b2, with Moderna demonstrating similar efficacy, but requiring storage at the temperature of a standard medical refrigerator of 2–8 °C (36–46 °F) for up to thirty days or −20 °C (−4 °F) for up to four months, whereas the Pfizer-BioNTech candidate requires ultracold freezer storage between −80 and −60 °C (−112 and −76 °F).[114][115] Low-income countries usually have cold chain capacity for only standard refrigerator storage, not ultracold freezer storage.[116][117] In February 2021, the restrictions on the Pfizer vaccine were relaxed when the US Food and Drug Administration (FDA) updated the emergency use authorization (EUA) to permit undiluted frozen vials of the vaccine to be transported and stored at between −25 and −15 °C (−13 and 5 °F) for up to two weeks before use.[41][118][119] The Moderna vaccine should not be stored at a temperature below −50 °C (−58 °F).[120]
In November 2020, Nature reported that "While it's possible that differences in LNP formulations or mRNA secondary structures could account for the thermostability differences [between Moderna and BioNtech], many experts suspect both vaccine products will ultimately prove to have similar storage requirements and shelf lives under various temperature conditions."[121]
History
Original version
In January 2020, Moderna announced development of an RNA vaccine, codenamed mRNA-1273, to induce immunity to SARS-CoV-2.[122][123][124]
Moderna received US$955 million from the Biomedical Advanced Research and Development Authority (BARDA), an office of the US Department of Health and Human Services. BARDA funded 100% of the cost of bringing the vaccine to FDA licensure.[125][126]
The United States government provided $2.5 billion in total funding for the Moderna COVID‑19 vaccine (mRNA-1273).[127] Private donors also made contributions to the vaccine's development. The Dolly Parton COVID-19 Research Fund contributed $1 million.[128]
Phase I–II clinical trials
In March 2020, the phase I human trial of mRNA-1273 began in partnership with the US National Institute of Allergy and Infectious Diseases.[129] In April, the US Biomedical Advanced Research and Development Authority (BARDA) allocated up to $483 million for Moderna's vaccine development.[130] Plans for a phase II dosing and efficacy trial to begin in May were approved by the US Food and Drug Administration (FDA).[131] Moderna signed a partnership with Swiss vaccine manufacturer Lonza Group,[132] to supply 300 million doses per annum.[133]
In May 2020, Moderna began a phase IIa clinical trial recruiting six hundred adult participants to assess safety and differences in antibody response to two doses of its candidate vaccine, mRNA-1273, a study expected to complete in 2021.[134]
In July 2020, Moderna scientists published preliminary results of the phase I dose escalation clinical trial of mRNA-1273, showing dose-dependent induction of neutralizing antibodies against S1/S2 as early as 15 days post-injection. Mild to moderate adverse reactions, such as fever, fatigue, headache, muscle ache, and pain at the injection site were observed in all dose groups, but were common with increased dosage.[103] The vaccine in low doses was deemed safe and effective in order to advance a phase III clinical trial using two 100-μg doses administered 29 days apart.[103]
In July 2020, Moderna announced in a preliminary report that its Operation Warp Speed candidate had led to production of neutralizing antibodies in healthy adults in phase I clinical testing.[103][135] "At the 100-microgram dose, the one Moderna is advancing into larger trials, all 15 patients experienced side effects, including fatigue, chills, headache, muscle pain, and pain at the site of injection."[136] The troublesome higher doses were discarded in July from future studies.[136][duplication?]
In September 2021, a study funded by the National Institute of Allergy and Infectious Diseases reported a strong immune response after six months, even at low doses, suggesting that more doses could be deployed from a limited vaccine supply. Six months after low-dose vaccination, 67% of participants still had memory cytotoxic T cells, suggesting that immune memory is stable. The study also found that cross-reactive T cells acquired during infection with other coronaviruses that cause the common cold increased the response to the vaccine.[137][138]
Phase III clinical trials
Moderna and the National Institute of Allergy and Infectious Diseases began a phase III trial in the US in July 2020, with a plan to enroll and assign thirty-thousand volunteers to two groups – one group receiving two 100-μg doses of mRNA-1273 vaccine and the other receiving a placebo of 0.9% sodium chloride.[139] As of 7 August, more than 4,500 volunteers had enrolled.[citation needed]
In September 2020, Moderna published the detailed study plan for the clinical trial.[140] In September 2020, CEO Stéphane Bancel said that, if the trial is successful, the vaccine might be available to the public as early as late March or early April 2021.[141] As of October 2020, Moderna had completed the enrollment of 30,000 participants needed for its phase III trial.[142] The US National Institutes of Health announced in November 2020, that overall trial results were positive.[143]
Since September 2020, Moderna has used Roche Diagnostics' Elecsys Anti-SARS-CoV-2 S test, authorized by the US Food and Drug Administration (FDA) under an emergency use authorization (EUA) in November 2020. According to an independent supplier of clinical assays in microbiology, "this will facilitate the quantitative measurement of SARS-CoV-2 antibodies and help to establish a correlation between vaccine-induced protection and levels of anti-receptor binding domain (RBD) antibodies." The partnership was announced by Roche on 9 December 2020.[144]
A review by the FDA in December 2020, of interim results of the phase III clinical trial on mRNA-1273 showed it to be safe and effective against COVID‑19 infection resulting in the issuance of an EUA by the FDA.[145]
In February 2021, results from phase III clinical trial were published in the New England Journal of Medicine, indicating 94% efficacy in preventing COVID‑19 infection.[52][115][146] Side effects included flu-like symptoms, such as pain at the injection site, fatigue, muscle pain, and headache.[115] The clinical trial is ongoing and is set to conclude in late 2022.[147]
Pregnant and breastfeeding women were also excluded from the initial trials used to obtain the emergency use authorization,[148] though trials in those populations were expected to be performed in 2021.[149]
In March 2021, in order to increase the span of vaccination beyond adults, Moderna started the clinical trials of vaccines on children age 6-months to 11-years-old in the US and in Canada (KidCove),[150] in addition to the existing and fully-enrolled study on 12-17 year-olds (TeenCOVE).[151][65]
Authorizations
| |||
Expedited
As of December 2020, the Moderna COVID‑19 vaccine was under evaluation for emergency authorization or approval by multiple countries which would enable rapid rollout of the vaccine in the United Kingdom, the European Union (EU), Canada, and the United States.[152][153][154][155]
In December 2020, the Moderna COVID‑19 vaccine was authorized by the US Food and Drug Administration (FDA) under an emergency use authorization (EUA) for people aged 18 years of age and older.[156][43][145] This is the first product from Moderna that has been authorized by the FDA.[157][158] In June 2022, the EUA was expanded to include people aged six months through sixteen years of age.[40] In April 2023, the authorization for the original, monovalent, version of the vaccine in the US was withdrawn.[159][160] As of April 2023, only the bivalent (Original and Omicron BA.4/BA.5) version of the vaccine is authorized in the US.[159][160]
In December 2020, the Moderna COVID‑19 vaccine was authorized by Health Canada.[161][23][4]
In January 2021, the Moderna COVID‑19 vaccine was authorized for use in Israel by its Ministry of Health.[162]
In February 2021, the Moderna COVID‑19 vaccine was authorized for use in Singapore by its Health Sciences Authority.[163]
In April 2021, the World Health Organization (WHO) granted emergency use listing.[164][165]
In May 2021, the Moderna COVID‑19 vaccine was authorized for emergency use in the Philippines by the Philippines Food and Drug Administration.[166]
In 2020, Moderna partnered with Takeda Pharmaceutical Company, and the Japan Ministry of Health, Labour and Welfare (MHLW).[167][168] The vaccine is known as "COVID-19 Vaccine Moderna Intramuscular Injection".[169][3] In May 2021, COVID‑19 Vaccine Moderna Intramuscular Injection (formerly TAK-919) was authorized for emergency use in Japan.[3]
In June 2021, the Moderna COVID‑19 vaccine was authorized for use in India by the Drugs Controller General of India.[170] The same day, the vaccine was also approved by the Ministry of Health of Vietnam for emergency use in the country.[171]
In August 2021, Malaysia's National Pharmaceutical Regulatory Agency (NPRA) gave conditional registration for emergency use of the Moderna COVID‑19 vaccine.[172]
Standard
In January 2021, the Committee for Medicinal Products for Human Use (CHMP) of the European Medicines Agency (EMA) recommended granting conditional marketing authorization[2][173] and the recommendation was accepted by the European Commission the same day.[44][45] In July 2021, the EMA extended the use of the COVID‑19 Vaccine Moderna to include people aged 12 to 17.[174]
In January 2021, Swissmedic granted temporary authorization for the Moderna COVID-19 mRNA Vaccine in Switzerland.[175][176][177][178][179][180]
In March 2021, the Medicines and Healthcare products Regulatory Agency (MHRA) granted conditional marketing authorization in the United Kingdom.[29][31][32]
In August 2021, Spikevax was granted provisional approval in Australia.[13] The approval was updated in September 2021, to include people aged twelve and older.[14]
The Moderna Spikevax COVID-19 vaccine was authorized in Canada in September 2021, for people aged 12 and older.[22][4][181]
The Moderna Spikevax COVID-19 vaccine was authorized in the US in January 2022, for people aged 18 and older.[1][38][41]
The Moderna Spikevax Bivalent Zero/Omicron vaccine was approved for medical use in the United Kingdom in August 2022.[54]
In September 2022, the CHMP of the EMA recommended converting the conditional marketing authorizations of the vaccine into standard marketing authorizations.[46] The recommendation covers all existing and upcoming adapted Spikevax vaccines, including the recently approved adapted Spikevax bivalent Original/Omicron BA.1.[46]
Boosters


In January 2021, Moderna announced that it would offer a third dose of its vaccine to people who were vaccinated twice in its phase I trial. The booster would be made available to participants six to twelve months after they got their second dose. The company said it may also study a third shot in participants from its phase III trial, if antibody persistence data warranted it.[182][183][184] It also started testing to see if a third shot of the existing vaccine could be used to fend off the virus variants.[185]
In August 2021, the US Food and Drug Administration (FDA) and the US Centers for Disease Control and Prevention (CDC) authorized the use of an additional mRNA vaccine dose for immunocompromised individuals.[50][51][186][187]
In September 2021, the Committee for Medicinal Products for Human Use (CHMP) of the European Medicines Agency (EMA) started evaluating the use of a booster dose of the Moderna COVID-19 vaccine to be given at least six months after the second dose in people aged twelve years and older.[188][189]
In October 2021, the European Medicines Agency (EMA) stated that people with "severely weakened" immune systems can receive an extra dose of either the Pfizer–BioNTech COVID-19 vaccine or the Moderna COVID-19 vaccine starting at least 28 days after their second dose.[68]
In October 2021, the US Food and Drug Administration (FDA) and the Centers for Disease Control and Prevention (CDC) authorized the use of either homologous or heterologous vaccine booster doses.[190][191][192][193] The authorization was expanded to include all adults in November 2021.[192]
Variants
In January 2021, Moderna started development of a new form of its vaccine, called mRNA-1273.351, that could be used as a booster shot against the Beta variant (lineage B.1.351).[194][185] In February 2021, Moderna announced that it had manufactured and shipped sufficient amounts of mRNA-1273.351 to the National Institutes of Health to run phase I clinical trials.[195] Moderna also investigated a multivalent booster, mRNA-1273.211, which combines a 50-50 mix of mRNA-1273 and mRNA-1273.351.[196][197]
A bivalent version of the vaccine containing elasomeran/imelasomeran (Spikevax bivalent Original/Omicron)[53] was approved for use in the United Kingdom and in Australia in August 2022.[54][55][198][17] It was approved for use in Canada in September 2022.[59][199][22]
In October 2022, the FDA amended the authorization for the bivalent booster to cover people aged six years of age and older.[200] In December 2022, the FDA amended the authorization for the bivalent booster to cover people aged six months and older.[201]
XBB.1.5 monovalent vaccine
In September 2023, the FDA approved an updated a monovalent (single) component Omicron variant XBB.1.5 version of the vaccine (Spikevax 2023-2024 formula) as a single dose for individuals aged twelve years of age and older;[202] and authorized the Moderna COVID-19 Vaccine 2023-2024 formula under emergency use for individuals aged 6 months through 11 years of age.[37][203] The updated version was tested in a small human trial of 101 participants; 50 received the monovalent XBB.1.5 version, compared to 51 who received a version containing XBB.1.5, BA.4 and BA.5. All participants had previously received four doses of older formulations of the Moderna COVID-19 vaccine. The safety profile of the authorized XBB.1.5 was found to be "consistent with previously authorized vaccines."[204][205] The approvals and emergency authorizations for the bivalent version of the vaccine were revoked.[37] Health Canada authorized the Moderna Spikevax COVID-19 vaccine (Omicron XBB.1.5 subvariant) (andusomeran) in September 2023.[4][22][206] The MHRA approved the use of the Moderna (Spikevax) XBB.1.5 vaccine in September 2023.[207][208]
Society and culture
About 155 million doses of the Moderna COVID-19 vaccine, including about 3.1 million doses in children and adolescents (below 18 years of age) were administered in the EU/EEA from authorization to 26 June 2022.[96]
Brand names
mRNA-1273 was the code name during development and testing,[52][158] elasomeran is the international nonproprietary name (INN),[10][209][210] and Spikevax is the brand name.[1][2]
Davesomeran is the INN for the BA.5 variant in the bivalent version of the vaccine.[10][211][212] Andusomeran is the INN for the XBB 1.5 variant version of the vaccine.[10][213][214]
Economics
In June 2020, Singapore signed a pre-purchase agreement for Moderna, reportedly paying a price premium in order to secure early stock of vaccines, although the government declined to provide the actual price and quantity, citing commercial sensitivities and confidentiality clauses.[215][216]
В августе 2020 года правительство США подписало соглашение о закупке 100 миллионов доз ожидаемой вакцины Moderna. [ 217 ] Газета Financial Times сообщила, что Moderna планировала установить цену в 50–60 долларов США за курс. [ 218 ] В ноябре 2020 года компания Moderna заявила, что будет взимать с правительств, приобретающих ее вакцину, сумму от 25 до 37 долларов США за дозу, в то время как ЕС добивается цены менее 25 долларов США за дозу для 160 миллионов доз, которые он планирует закупить у Moderna. [ 219 ] [ 220 ]
В 2020 году Moderna заключила соглашения о покупке мРНК-1273 с Европейским Союзом на 160 миллионов доз и с Канадой на 56 миллионов доз. [ 221 ] [ 222 ] В декабре 2020 года твите в государственного секретаря по бюджету Бельгии сообщалось, что ЕС будет платить 18 долларов США за дозу, а The New York Times сообщила, что США будут платить 15 долларов США за дозу. [ 223 ]
Компания Moderna сообщила о выручке долларов США . в размере 200 миллионов от своей вакцины против COVID-19 в 2020 году [ 224 ] и 17,7 млрд долларов в 2021 году. [ 225 ]
Приостановленные прививки
Обеспокоенные тем, что вакцина может увеличить риск миокардита у молодых людей в возрасте до 30 лет, Финляндия, Швеция, Германия и Франция рекомендовали не использовать вакцинацию Moderna для этой возрастной группы в октябре/ноябре 2021 года. [ 226 ] [ 227 ] [ 228 ] [ 229 ] [ 230 ]
Споры
этой статьи Разделы «критика» или «противоречие» могут поставить под угрозу ее нейтральность . ( декабрь 2020 г. ) |
В мае 2020 года, опубликовав частичные и не прошедшие рецензирование результаты только для восьми из 45 кандидатов на предварительном этапе I стадии испытаний на людях непосредственно на финансовых рынках, генеральный директор объявил на канале CNBC о немедленном выпуске прав на сумму 1,25 миллиарда долларов для сбора средств для компания при оценке в 30 миллиардов долларов, [ 231 ] в то время как Стат сказал: «Эксперты по вакцинам говорят, что Moderna не предоставила данных, критически важных для оценки вакцины против COVID-19». [ 232 ]
В июле 2020 года выявились споры между Moderna и государственными учеными по поводу нежелания компании делиться данными клинических испытаний. [ 233 ]
Moderna также подверглась критике за то, что ей не удалось привлечь цветных людей к клиническим испытаниям. [ 234 ]
В августе 2021 года Министерство здравоохранения и социальных служб США объявило о плане предложить ревакцинацию через восемь месяцев после второй дозы, сославшись на доказательства снижения защиты от легких и среднетяжелых заболеваний, а также на возможность снижения защиты от тяжелых заболеваний, госпитализации и смерть. [ 235 ] Ученые и ВОЗ подтвердили отсутствие доказательств необходимости ревакцинации для здоровых людей и того, что вакцина остается эффективной против тяжелых заболеваний через несколько месяцев после введения. [ 236 ] В своем заявлении ВОЗ и SAGE заявили, что, хотя защита от инфекции может быть снижена, защита от тяжелых заболеваний, скорее всего, сохранится благодаря клеточному иммунитету . [ 237 ] Исследования оптимального времени для бустеров все еще продолжаются, и слишком ранняя бустерная вакцинация может привести к менее надежной защите. [ 238 ]
Дезинформация
Примерно в мае 2021 года на платформах обмена видео были распространены видеоролики, показывающие, как люди приклеивают магниты к рукам после получения вакцины, якобы демонстрируя теорию заговора о том, что вакцины содержат микрочипы , но эти видеоролики были опровергнуты. [ 239 ] [ 240 ] [ 241 ] [ 242 ]
В ноябре 2021 года корреспондент консервативного издания Newsmax в Белом доме ложно написал в Твиттере, что вакцина Moderna содержит люциферазу , «чтобы вас можно было отследить». [ 243 ] [ 244 ]
Патентные споры
Система доставки лекарственных средств на основе ПЭГилированных липидных наночастиц (LNP) мРНК-1273 стала предметом продолжающегося патентного спора с Arbutus Biopharma , у которой Moderna ранее лицензировала технологию LNP. [ 97 ] [ 245 ] 4 сентября 2020 года Nature Biotechnology сообщила, что Moderna проиграла ключевое дело в продолжающемся деле. [ 246 ]
Пояснительные примечания
Ссылки
- ^ Jump up to: а б с д «Вакцина Spikevax-covid-19, мРНК для инъекций, суспензия» . ДейлиМед . 1 января 2022 года. Архивировано из оригинала 18 июня 2022 года . Проверено 17 июня 2022 г.
- ^ Jump up to: а б с д и ж г час «Спикевакс (ранее вакцина против COVID-19 Moderna) EPAR» . Европейское агентство лекарственных средств (EMA) . 4 января 2021 года. Архивировано из оригинала 1 февраля 2022 года . Проверено 31 января 2022 г.
- ^ Jump up to: а б с «Такеда объявляет об одобрении вакцины против COVID-19 компании Moderna в Японии» (пресс-релиз). Такеда. 21 мая 2021 года. Архивировано из оригинала 23 декабря 2021 года . Проверено 29 мая 2021 г.
- ^ «Элазомеран для профилактики COVID-19» . Австралийский врач . 44 (5): 172. Октябрь 2021 г. doi : 10.18773/austprescr.2021.048 . ПМЦ 8542485 . ПМИД 34728884 . Архивировано из оригинала 14 мая 2022 года . Проверено 14 мая 2022 г.
- ^ «Обновления базы данных о назначении лекарственных средств при беременности» . Управление терапевтических товаров (TGA) . 21 декабря 2022 г. Проверено 2 января 2023 г.
- ^ Jump up to: а б «Спайвакс» . Управление терапевтических товаров (TGA). 9 августа 2021 года. Архивировано из оригинала 28 августа 2021 года . Проверено 28 августа 2021 г.
- ^ Jump up to: а б «Информационная лицензия на вакцину Спикевакс (элазомеран) против Covid-19» (PDF) . Управление терапевтических товаров (TGA). 18 августа 2021 года. Архивировано из оригинала 28 августа 2021 года . Проверено 28 августа 2021 г.
- ^ «Обновления базы данных о назначении лекарственных средств при беременности» . Управление терапевтических товаров (TGA) . 12 мая 2022 года. Архивировано из оригинала 3 апреля 2022 года . Проверено 13 мая 2022 г.
- ^ Jump up to: а б с д «Регуляторный статус вакцин против COVID-19» . Управление терапевтических товаров (TGA) . 21 июня 2022 г. Проверено 8 октября 2023 г.
- ^ «Вакцина против COVID-19: Спикевакс (элазомеран)» . Управление терапевтических товаров (TGA) . 21 июня 2022 г. Проверено 9 октября 2023 г.
- ^ «Краткая информация для записи Artg: 370599 Spikevax (элазомеран) Вакцина против Covid-19, 0,2 мг/мл, суспензия для флакона для инъекций» (PDF) . Управление терапевтических товаров (TGA) . Проверено 28 августа 2021 г. [ мертвая ссылка ]
- ^ Jump up to: а б «Вакцина против COVID-19: Спикевакс (элазомеран)» . Управление терапевтических товаров (TGA) . 9 августа 2021 года. Архивировано из оригинала 28 августа 2021 года . Проверено 28 августа 2021 г.
- ^ Jump up to: а б с «Предварительное одобрение TGA вакцины Moderna против COVID-19 для возрастной группы 12–17 лет» . Управление терапевтических товаров (TGA) . 4 сентября 2021 года. Архивировано из оригинала 4 сентября 2021 года . Проверено 4 сентября 2021 г.
- ^ «АусПАР: Элазомеран» . Управление терапевтических товаров (TGA) . 23 февраля 2022 года. Архивировано из оригинала 24 марта 2022 года . Проверено 23 марта 2022 г.
- ^ «AusPAR: Элазомеран (мРНК-1273)» . Управление терапевтических товаров (TGA) . 9 декабря 2021 года. Архивировано из оригинала 24 марта 2022 года . Проверено 24 марта 2022 г.
- ^ Jump up to: а б «Спайвакс Бивалент Оригинал/Омикрон» . Управление терапевтическими товарами . 1 сентября 2022 г.
- ^ «Спайвакс бивалент Ориджинал/Омикрон ВА.4-5» . Управление терапевтических товаров (TGA) . 23 февраля 2023 г. Проверено 8 апреля 2023 г.
- ^ «Терапевтические товары (стандарт по ядам) (вакцина против COVID-19 — Moderna) (элазомеран и имелазомеран) Освобождение от маркировки в 2022 году» . Управление терапевтических товаров (TGA) . 31 августа 2022 г. Проверено 17 сентября 2023 г.
- ^ Росарио М. (26 июня 2023 г.). «Anvisa одобряет бивалентную вакцину Moderna от Covid-19» . О Глобо (на бразильском португальском языке) . Проверено 21 июня 2024 г.
- ^ «Анвиса одобрила регистрацию моновалентной вакцины Спикевакс» . Бразильское агентство по регулированию здравоохранения (на бразильском португальском языке). 6 марта 2024 г. . Проверено 21 июня 2024 г.
- ^ Jump up to: а б с д и «Современные вакцины Spikevax против COVID-19» . Здоровье Канады . 12 сентября 2023 года. Архивировано из оригинала 15 сентября 2023 года . Проверено 15 сентября 2023 г.
- ^ Jump up to: а б «Современная вакцина против COVID-19 (мРНК-1273 SARS-CoV-2)» . Здоровье Канады . 23 декабря 2020 года. Архивировано из оригинала 23 декабря 2020 года . Проверено 23 декабря 2020 г.
- ^ «Краткое описание нормативного решения — вакцина против COVID-19 Moderna» . Здоровье Канады . 27 августа 2021 года. Архивировано из оригинала 27 августа 2021 года . Проверено 28 августа 2021 г.
- ^ «Монография Spikevax (элазомеровая мРНК-вакцина)» (PDF) . Архивировано из оригинала (PDF) 3 декабря 2021 года.
- ^ «Сводка нормативных решений — Спикевакс» . Здоровье Канады . 13 ноября 2020 года. Архивировано из оригинала 17 сентября 2021 года . Проверено 18 сентября 2021 г.
- ^ «Краткая основа решения (SBD) для Спикевакса» . Здоровье Канады . 23 октября 2014 г. Архивировано из оригинала 29 мая 2022 г. . Проверено 29 мая 2022 г.
- ^ «Краткая основа решения (SBD) для Spikevax XBB.1.5» . Портал лекарств и товаров для здоровья . 1 сентября 2012 года . Проверено 11 декабря 2023 г.
- ^ Jump up to: а б «Краткая информация о характеристиках продукта Spikevax» . Агентство по регулированию лекарственных средств и товаров медицинского назначения (MHRA). 20 августа 2021 года. Архивировано из оригинала 18 февраля 2021 года . Проверено 29 августа 2021 г.
- ^ «Условия регистрации вакцины против COVID-19 Moderna» . Агентство по регулированию лекарственных средств и товаров медицинского назначения (MHRA). 8 января 2021 года. Архивировано из оригинала 18 февраля 2021 года . Проверено 29 августа 2021 г.
- ^ Jump up to: а б «Одобрение регулирующих органов Spikevax (ранее вакцина против COVID-19 Moderna)» . Агентство по регулированию лекарственных средств и товаров медицинского назначения (MHRA). 8 января 2021 года. Архивировано из оригинала 28 августа 2021 года . Проверено 29 августа 2021 г.
- ^ Jump up to: а б «Краткое содержание отчета об общественной оценке Спикевакса» . Агентство по регулированию лекарственных средств и товаров медицинского назначения (MHRA). 19 февраля 2021 года. Архивировано из оригинала 22 апреля 2021 года . Проверено 29 августа 2021 г.
- ^ Jump up to: а б с д и ж г час я «Современный регламент вакцинации против COVID-19 для введения вакцины лицам в возрасте 18 лет и старше» (PDF) . Центры по контролю и профилактике заболеваний (CDC). 11 июля 2022 г. Архивировано (PDF) из оригинала 14 августа 2021 г. . Проверено 14 июля 2022 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе .
- ^ «Современный регламент вакцинации против COVID-19 для введения вакцины лицам в возрасте от 12 до 17 лет» (PDF) . Центры по контролю и профилактике заболеваний (CDC). 11 июля 2022 года. Архивировано (PDF) из оригинала 16 июля 2022 года . Проверено 14 июля 2022 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе .
- ^ «Современный регламент вакцинации против COVID-19 для введения вакцины лицам в возрасте от 6 до 11 лет» (PDF) . Центры по контролю и профилактике заболеваний (CDC). 11 июля 2022 года. Архивировано (PDF) из оригинала 16 июля 2022 года . Проверено 14 июля 2022 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе .
- ^ «Современный регламент вакцинации против COVID-19 для введения вакцины лицам в возрасте от 6 месяцев до 5 лет» (PDF) . Центры по контролю и профилактике заболеваний (CDC). 11 июля 2022 года. Архивировано (PDF) из оригинала 16 июля 2022 года . Проверено 14 июля 2022 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе .
- ^ Jump up to: а б с д «FDA принимает меры по обновлению мРНК-вакцин против COVID-19 для лучшей защиты от циркулирующих в настоящее время вариантов» . США Управление по контролю за продуктами и лекарствами (FDA). 11 сентября 2023 г. Проверено 12 сентября 2023 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе .
- ^ Jump up to: а б «FDA предпринимает ключевые действия, одобряя вторую вакцину против COVID-19» . США Управление по контролю за продуктами и лекарствами (FDA) (пресс-релиз). 31 января 2022 года. Архивировано из оригинала 31 января 2022 года . Проверено 31 января 2022 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе .
- ^ «Спайвакс и вакцина Moderna против COVID-19» . США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) . 17 июня 2022 года. Архивировано из оригинала 18 июня 2022 года . Проверено 18 июня 2022 г.
- ^ Jump up to: а б «Обновление о коронавирусе (COVID-19): FDA разрешает использование вакцин Moderna и Pfizer-BioNTech против COVID-19 для детей в возрасте до 6 месяцев» . США Управление по контролю за продуктами и лекарствами (FDA) (пресс-релиз). 17 июня 2022 года. Архивировано из оригинала 17 июня 2022 года . Проверено 17 июня 2022 г.
- ^ Jump up to: а б с д и «Информационный бюллетень для поставщиков медицинских услуг, вводящих вакцину» (PDF) . США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) . 31 января 2022 года. Архивировано из оригинала 1 февраля 2022 года . Проверено 13 августа 2021 г.
- ^ Jump up to: а б с д «Современная вакцина против COVID-19-cx-024414 инъекционная, суспензия» . ДейлиМед . 17 июня 2022 года. Архивировано из оригинала 18 июня 2022 года . Проверено 17 июня 2022 г.
- ^ Jump up to: а б «Разрешение на экстренное использование современной вакцины против COVID-19» (PDF) . США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) . 17 июня 2022 года. Архивировано из оригинала 14 августа 2021 года . Проверено 17 июня 2022 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе .
- ^ Jump up to: а б «Европейская комиссия санкционирует вторую безопасную и эффективную вакцину против COVID-19» . Европейская Комиссия (Пресс-релиз). 6 января 2021 года. Архивировано из оригинала 20 января 2021 года . Проверено 6 января 2021 г.
- ^ Jump up to: а б «Современная вакцина против COVID-19» . Европа . 22 июля 2022 года. Архивировано из оригинала 10 января 2022 года.
- ^ Jump up to: а б с «EMA рекомендует стандартные регистрационные удостоверения для вакцин Comirnaty и Spikevax против COVID-19» . Европейское агентство по лекарственным средствам (пресс-релиз). 16 сентября 2022 года. Архивировано из оригинала 16 сентября 2022 года . Проверено 18 сентября 2022 г. Текст скопирован из источника, права на который принадлежат Европейскому агентству по лекарственным средствам. Воспроизведение разрешено при условии указания источника.
- ^ «Информация о продукте Spikevax» . Союзный реестр лекарственных средств . Проверено 3 марта 2023 г.
- ^ Мандавилли А (19 июня 2022 г.). «CDC рекомендует вакцины против COVID-19 детям до 5 лет» . Нью-Йорк Таймс . Архивировано из оригинала 21 июня 2022 года . Проверено 21 июня 2022 г.
- ^ «Современная вакцина против COVID-19» . Дозирование и применение . Американское общество инфекционистов . 4 января 2021 г. Архивировано из оригинала 20 декабря 2020 г. Проверено 5 января 2021 г.
- ^ Jump up to: а б с «FDA разрешает вводить дополнительную дозу вакцины для некоторых лиц с ослабленным иммунитетом» . США Управление по контролю за продуктами и лекарствами (FDA) (пресс-релиз). 12 августа 2021 года. Архивировано из оригинала 7 декабря 2021 года . Проверено 13 августа 2021 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе .
- ^ Jump up to: а б с «Вакцины против COVID-19 для людей с умеренным и тяжелым иммунодефицитом» . Центры США по контролю и профилактике заболеваний (CDC) . 13 августа 2021 года. Архивировано из оригинала 10 декабря 2021 года . Проверено 13 августа 2021 г.
- ^ Jump up to: а б с д и Баден Л.Р., Эль Сахли Х.М., Эссинк Б., Котлофф К., Фрей С., Новак Р. и др. (февраль 2021 г.). «Эффективность и безопасность вакцины мРНК-1273 SARS-CoV-2» . Медицинский журнал Новой Англии . 384 (5): 403–416. дои : 10.1056/NEJMoa2035389 . ПМЦ 7787219 . ПМИД 33378609 .
- ^ Jump up to: а б с «Moderna объявляет о клинических обновлениях бивалентной платформы для бустерной терапии COVID-19» . Модерна (Пресс-релиз). 19 апреля 2022 года. Архивировано из оригинала 6 мая 2022 года . Проверено 7 мая 2022 г.
- ^ Jump up to: а б с д «Первая двухвалентная бустерная вакцина против COVID-19, одобренная регулирующим органом Великобритании по лекарственным средствам» (пресс-релиз). Агентство по регулированию лекарственных средств и товаров медицинского назначения (MHRA). 15 августа 2022 года. Архивировано из оригинала 16 августа 2022 года . Проверено 16 августа 2022 г.
- ^ Jump up to: а б с «Одобрение регулирующих органов бивалентной оригинальной вакцины Spikevax/ревакцинации Omicron» . Агентство по регулированию лекарственных средств и товаров медицинского назначения (MHRA). 15 августа 2022 года. Архивировано из оригинала 16 августа 2022 года . Проверено 16 августа 2022 г.
- ^ «Swissmedic одобрила первую бивалентную бустерную вакцину против COVID-19 в Швейцарии» . Swissmedic (Пресс-релиз). 29 августа 2022 года. Архивировано из оригинала 29 августа 2022 года . Проверено 1 сентября 2022 г.
- ^ «TGA предварительно одобряет бивалентную вакцину Moderna против COVID-19 для использования в качестве ревакцинации у взрослых» (пресс-релиз). Управление терапевтическими товарами . 30 августа 2022 года. Архивировано из оригинала 1 сентября 2022 года . Проверено 1 сентября 2022 г.
- ^ «Краткое описание нормативного решения — бивалентный спайквакс» . Здоровье Канады . 1 сентября 2022 года. Архивировано из оригинала 1 сентября 2022 года . Проверено 1 сентября 2022 г.
- ^ Jump up to: а б с Буасверт Н. (1 сентября 2022 г.). «Министерство здравоохранения Канады одобрило обновленную вакцину Moderna для варианта Omicron» . Новости ЦБК . Архивировано из оригинала 1 сентября 2022 года . Проверено 1 сентября 2022 г.
- ^ Jump up to: а б «Обновление о коронавирусе (COVID-19): FDA разрешает использовать бивалентные вакцины Moderna, Pfizer-BioNTech против COVID-19 в качестве ревакцинации» (пресс-релиз). США Управление по контролю за продуктами и лекарствами (FDA). 31 августа 2022 года. Архивировано из оригинала 1 сентября 2022 года . Проверено 1 сентября 2022 г.
- ^ «CDC рекомендует первый обновленный бустер против COVID-19» (пресс-релиз). Центры США по контролю и профилактике заболеваний (CDC). 1 сентября 2022 года. Архивировано из оригинала 2 сентября 2022 года . Проверено 1 сентября 2022 г.
- ^ «Отслеживание вакцины против COVID-19: Moderna: мРНК-1273» . Университет Макгилла . Архивировано из оригинала 1 февраля 2022 года.
- ^ «Современная вакцина против COVID-19» . США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) . 7 июля 2021 года. Архивировано из оригинала 23 января 2021 года . Проверено 5 августа 2021 г.
- ^ Стевис-Гриднефф М. (6 января 2021 г.). «Регулятор ЕС по лекарствам одобряет вакцину Moderna» . Нью-Йорк Таймс . Архивировано из оригинала 6 августа 2021 года . Проверено 5 августа 2021 г.
- ^ Jump up to: а б «Moderna сообщает финансовые результаты за второй квартал 2021 финансового года и предоставляет обновленную информацию о бизнесе» . Moderna, Inc. (Пресс-релиз). 5 августа 2021 года. Архивировано из оригинала 6 августа 2021 года . Проверено 5 августа 2021 г.
- ^ «Moderna завершает подачу заявки в Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США на разрешение на экстренное использование двухвалентной бустерной вакцины против COVID-19, нацеленной на Омикрон, мРНК-1273.222» . Moderna, Inc., 23 августа 2022 г. Проверено 25 сентября 2022 г.
- ^ «Вакцина Moderna от COVID-19 (мРНК-1273): что вам нужно знать» . Всемирная организация здравоохранения (ВОЗ). 18 августа 2022 года. Архивировано из оригинала 2 сентября 2022 года . Проверено 1 сентября 2022 г.
- ^ Jump up to: а б «Комирнаты и Спикевакс: рекомендации EMA по дополнительным дозам бустеров» . Европейское агентство лекарственных средств (EMA) (пресс-релиз). 4 октября 2021 года. Архивировано из оригинала 11 декабря 2021 года . Проверено 4 октября 2021 г.
- ^ Jump up to: а б с д и Справочный документ по вакцине мРНК-1273 (Moderna) против COVID-19 (Отчет). Всемирная организация здравоохранения (ВОЗ). Февраль 2021 г. HDL : 10665/339218 . ВОЗ/2019-nCoV/vaccines/SAGE_recommendation/mRNA-1273/background/2021.1. Архивировано из оригинала 13 июня 2021 года . Проверено 2 мая 2021 г.
- ^ «Справочный документ по вакцине мРНК-1273 (Moderna) против COVID-19» . Всемирная организация здравоохранения (ВОЗ). 3 февраля 2021 года. Архивировано из оригинала 26 января 2022 года . Проверено 25 января 2022 г.
- ^ «Заседание Консультативного комитета по вакцинам и сопутствующим биологическим продуктам» (PDF) . США Управление по контролю за продуктами и лекарствами (FDA). 17 декабря 2020 года. Архивировано из оригинала 1 января 2022 года . Проверено 23 декабря 2020 г.
- ^ Брансвелл Х. (2 февраля 2021 г.). «Сравнение вакцин против Covid-19, разработанных компаниями Pfizer, Moderna и Johnson & Johnson» . Архивировано из оригинала 1 февраля 2022 года . Проверено 28 марта 2021 г.
- ^ Jump up to: а б Кунцманн К. (31 декабря 2020 г.). «Современная вакцина демонстрирует значительную эффективность профилактики COVID-19 по данным фазы 3» . Заражение в прямом эфире . Архивировано из оригинала 1 февраля 2022 года.
- ^ Мишра С.К., Трипати Т. (февраль 2021 г.). «Обзор пандемии COVID-19 за год: где мы сейчас находимся?» . Акта Тропика . 214 : 105778. doi : 10.1016/j.actatropica.2020.105778 . ПМЦ 7695590 . ПМИД 33253656 .
- ^ Мео С.А., Бухари И.А., Акрам Дж., Мео А.С., Клонофф, округ Колумбия (февраль 2021 г.). «Вакцины против COVID-19: сравнение биологических, фармакологических характеристик и побочных эффектов вакцин Pfizer/BioNTech и Moderna» . Европейский обзор медицинских и фармакологических наук . 25 (3): 1663–1669. дои : 10.26355/eurrev_202102_24877 . ПМИД 33629336 .
- ^ «Информационный документ для спонсора VRBPAC мРНК-1273» (PDF) . Модерна. 17 декабря 2020 года. Архивировано из оригинала 13 мая 2021 года . Проверено 1 января 2021 г.
- ^ Дженко Дж. (16 марта 2021 г.). «Современное тестирование вакцины против COVID-19 на детях до 12 лет» . Новости ААП . Архивировано из оригинала 3 ноября 2021 года . Проверено 10 апреля 2021 г.
- ^ Томпсон М.Г., Берджесс Дж.Л., Нэйлуэй А.Л., Тайнер Х.Л., Юн С.К., Мис Дж. и др. (апрель 2021 г.). «Промежуточные оценки эффективности вакцин BNT162b2 и мРНК-1273 против COVID-19 в предотвращении заражения SARS-CoV-2 среди медицинского персонала, лиц, оказывающих первую помощь, и других основных и передовых работников - восемь мест в США, декабрь 2020 г. – март 2021 г.» ( PDF) . ММВР. Еженедельный отчет о заболеваемости и смертности . 70 (13): 495–500. дои : 10.15585/mmwr.mm7013e3 . ПМЦ 8022879 . ПМИД 33793460 . Архивировано (PDF) из оригинала 28 августа 2021 года . Проверено 29 марта 2021 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе .
- ^ Дориа-Роуз Н., Сутар М.С., Маковски М., О'Коннелл С., МакДермотт А.Б., Флах Б. и др. (июнь 2021 г.). «Стойкость антител через 6 месяцев после второй дозы вакцины мРНК-1273 от Covid-19» . N Engl J Med . 384 (23): 2259–2261. дои : 10.1056/NEJMc2103916 . ПМЦ 8524784 . ПМИД 33822494 .
- ^ «Moderna утверждает, что вакцина от Covid рассчитана на срок не менее шести месяцев» . Франция 24 . Агентство Франс-Пресс. 5 августа 2021 года. Архивировано из оригинала 11 августа 2021 года . Проверено 11 августа 2021 г.
- ^ Краузе П., Флеминг Т.Р., Лонгини И., Энао-Рестрепо А.М., Пето Р. (сентябрь 2020 г.). «Испытания вакцины против COVID-19 должны обеспечить достойную эффективность» . Ланцет . 396 (10253): 741–743. дои : 10.1016/S0140-6736(20)31821-3 . ПМЦ 7832749 . ПМИД 32861315 .
ВОЗ рекомендует, чтобы успешные вакцины демонстрировали предполагаемое снижение риска как минимум на половину с достаточной точностью, чтобы сделать вывод о том, что истинная эффективность вакцины превышает 30%. Это означает, что 95% ДИ для результата исследования должен исключать эффективность менее 30%. Текущие рекомендации Управления по контролю за продуктами и лекарствами США включают этот нижний предел в 30% в качестве критерия для лицензирования вакцины.
- ^ Хури Д.С., Кромер Д., Рейнальди А., Шлаб Т.Е., Уитли А.К., Джуно Дж.А. и др. (май 2021 г.). «Уровни нейтрализующих антител позволяют с высокой степенью прогнозировать иммунную защиту от симптоматической инфекции SARS-CoV-2» . Природная медицина . 27 (7): 1205–1211. дои : 10.1038/s41591-021-01377-8 . ISSN 1546-170Х . ПМИД 34002089 . S2CID 234769053 .
- ^ Фаулкс А., Гаглани М., Грувер К., Тиз М.С., Тайнер Х., Эллингсон К. (27 августа 2021 г.). «Эффективность вакцин против COVID-19 в предотвращении заражения SARS-CoV-2 среди рабочих на переднем крае до и во время преобладания варианта B.1.617.2 (Дельта) — восемь регионов США, декабрь 2020 г. – август 2021 г.» (PDF) . ММВР. Еженедельный отчет о заболеваемости и смертности . 70 (34): 1167–9. дои : 10.15585/mmwr.mm7034e4 . ПМЦ 8389394 . ПМИД 34437521 . Архивировано (PDF) из оригинала 5 февраля 2022 года . Проверено 15 сентября 2021 г.
- ^ Тан П., Хасан М.Р., Чемайтелли Х., Ясин Х.М., Бенслиман Ф.М., Аль Хатиб Х.А. и др. (2 ноября 2021 г.). «Эффективность вакцины BNT162b2 и мРНК-1273 против COVID-19 против дельта-варианта SARS-CoV-2 в Катаре» . Природная медицина . 27 (12): 2136–2143. дои : 10.1038/s41591-021-01583-4 . hdl : 10576/24856 . ISSN 1546-170Х . ПМИД 34728831 . S2CID 241108406 .
Таблицы 3 и 5
- ^ Чунг Х., Хе С., Насрин С., Сундарам М.Э., Бьюкен С.А., Уилсон С.Е. и др. (август 2021 г.). «Эффективность вакцин BNT162b2 и мРНК-1273 covid-19 против симптоматической инфекции SARS-CoV-2 и тяжелых исходов covid-19 в Онтарио, Канада: исследование с отрицательным результатом теста» . БМЖ . 374 : н1943. дои : 10.1136/bmj.n1943 . ПМЦ 8377789 . ПМИД 34417165 .
Таблицы 6 и 7
- ^ Jump up to: а б «Рекомендации по вакцинации беременных и кормящих грудью» . Центры США по контролю и профилактике заболеваний (CDC). 18 марта 2021 года. Архивировано из оригинала 5 января 2022 года . Проверено 24 апреля 2021 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе .
- ^ Симабукуро Т (1 марта 2021 г.). «Обновление безопасности вакцин против COVID-19» (PDF) . Центры США по контролю и профилактике заболеваний . Архивировано (PDF) из оригинала 7 июня 2021 года . Проверено 30 марта 2021 г.
- ^ Смит К. (24 апреля 2021 г.). «Новое руководство CDC рекомендует беременным сделать вакцину от COVID-19» . Новости CBS. Архивировано из оригинала 24 апреля 2021 года . Проверено 24 апреля 2021 г.
- ^ Симабукуро Т.Т., Ким С.Ю., Майерс Т.Р., Моро П.Л., Одуебо Т., Панагиотакопулос Л. и др. (июнь 2021 г.). «Предварительные данные о безопасности вакцины мРНК Covid-19 у беременных» . Медицинский журнал Новой Англии . 384 (24): 2273–2282. дои : 10.1056/NEJMoa2104983 . ПМЦ 8117969 . ПМИД 33882218 .
- ^ Вайзе Э (7 апреля 2021 г.). «Пальцы ног от COVID-19, рука Moderna, сыпь по всему телу: вакцины могут вызывать кожные реакции, но не опасны, говорится в исследовании» . США сегодня . Архивировано из оригинала 1 февраля 2022 года.
- ^ Группа реагирования CDC на COVID-19 (январь 2021 г.). «Аллергические реакции, включая анафилаксию, после получения первой дозы вакцины Moderna против COVID-19 — США, 21 декабря 2020 г. – 10 января 2021 г.» (PDF) . ММВР. Еженедельный отчет о заболеваемости и смертности . 70 (4): 125–129. doi : 10.15585/mmwr.mm7004e1 . ПМЦ 7842812 . ПМИД 33507892 . Архивировано (PDF) из оригинала 1 сентября 2021 года . Проверено 25 апреля 2021 г.
{{cite journal}}: CS1 maint: числовые имена: список авторов ( ссылка ) В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе .
- ^ Блюменталь К.Г., Фриман Э.Э., Сафф Р.Р., Робинсон Л.Б., Вольфсон А.Р., Форман Р.К. и др. (апрель 2021 г.). «Отсроченные крупные местные реакции на вакцину мРНК-1273 против SARS-CoV-2» . Медицинский журнал Новой Англии . 384 (13): 1273–1277. дои : 10.1056/NEJMc2102131 . ПМЦ 7944952 . ПМИД 33657292 .
- ^ «Клинические аспекты: миокардит после введения мРНК вакцины против COVID-19» . Центры США по контролю и профилактике заболеваний (CDC) . 3 июня 2022 года. Архивировано из оригинала 27 июня 2021 года . Проверено 27 июня 2021 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе .
- ^ Остер М.Э., Шей Д.К., Су Дж.Р., Джи Дж., Крич С.Б., Бродер К.Р. и др. (январь 2022 г.). «Случаи миокардита, зарегистрированные после вакцинации против COVID-19 на основе мРНК, в США с декабря 2020 года по август 2021 года» . ДЖАМА . 327 (4): 331–340. дои : 10.1001/jama.2021.24110 . ПМЦ 8790664 . ПМИД 35076665 .
- ^ Национальный центр иммунизации и респираторных заболеваний (23 июня 2021 г.). «Миокардит и перикардит после вакцинации мРНК от COVID-19» . Центры по контролю и профилактике заболеваний. Архивировано из оригинала 3 июля 2021 года . Проверено 2 июля 2021 г.
- ^ Jump up to: а б «Обновленная информация о безопасности вакцин против COVID-19» (PDF) . Европейское агентство по лекарственным средствам . 3 августа 2022 г. Архивировано (PDF) из оригинала 3 августа 2022 г. . Проверено 3 августа 2022 г. Текст скопирован из источника, права на который принадлежат Европейскому агентству по лекарственным средствам. Воспроизведение разрешено при условии указания источника.
- ^ Jump up to: а б Автор: DR, Powell MB (14 сентября 2020 г.). «Патентные проблемы подчеркивают риски, связанные с вакциной Moderna против COVID-19» . Нью-Йоркский юридический журнал . Архивировано из оригинала 15 октября 2020 года . Проверено 1 декабря 2020 г.
- ^ Кросс Р (29 сентября 2020 г.). «Маленькая поправка к вакцинам против COVID-19» . Новости химии и техники . 98 (38). Архивировано из оригинала 16 февраля 2021 года . Проверено 30 сентября 2020 г.
- ^ Джонсон CY (6 декабря 2020 г.). «Азартная игра окупается «впечатляющим успехом»: как ведущие вакцины против коронавируса добрались до финиша» . Вашингтон Пост . Архивировано из оригинала 6 марта 2021 года . Проверено 9 декабря 2020 г.
- ^ Крамер Дж. (31 декабря 2020 г.). «Они потратили 12 лет на решение головоломки. В результате были созданы первые вакцины от COVID-19» . Нэшнл Географик . Архивировано из оригинала 28 февраля 2021 года . Проверено 8 марта 2021 г.
- ^ «Идентификатор Генбанка MN908947.3» . Национальный центр биотехнологической информации . 18 марта 2020 года. Архивировано из оригинала 11 января 2022 года . Проверено 11 июля 2021 г.
- ^ Всемирная организация здравоохранения (июнь 2021 г.). «Предлагаемые международные непатентованные наименования МНН: Список 125 COVID-19 (специальное издание)» . Информация ВОЗ о лекарствах . 35 (2): 578–9. hdl : 10665/343367 .
- ^ Jump up to: а б с д Джексон Л.А., Андерсон Э.Дж., Руфаэль Н.Г., Робертс П.С., Махен М., Колер Р.Н. и др. (ноябрь 2020 г.). «МРНК-вакцина против SARS-CoV-2 – предварительный отчет» . Медицинский журнал Новой Англии . 383 (20): 1920–1931. дои : 10.1056/NEJMoa2022483 . ПМЦ 7377258 . ПМИД 32663912 .
- ^ Чон Д.Е., Маккой М., Артилес К., Илбай О., Файр А., Надо К. и др. (23 марта 2021 г.). «Сборки предполагаемых последовательностей мРНК, кодирующих спайки SARS-CoV2, для вакцин BNT-162b2 и мРНК-1273» . Вирусологический.org . Архивировано из оригинала 1 февраля 2022 года.
- ^ Спрингер П. (24 мая 2021 г.). «Фирма Fargo производит ключевой ингредиент для миллионов доз вакцины против COVID-19» . Гранд Форкс Геральд . Архивировано из оригинала 22 августа 2021 года . Проверено 25 мая 2021 г.
- ^ Jump up to: а б Маллин Р. (25 ноября 2020 г.). «Pfizer, Moderna готовы к производству вакцин» . Новости химии и техники . Американское химическое общество. Архивировано из оригинала 11 декабря 2020 года . Проверено 21 декабря 2020 г.
- ^ Кот J (4 мая 2021 г.). «Moderna увеличит размер предприятия в Массачусетсе более чем вдвое, превратит производство и лабораторные помещения в промышленный технологический центр» . МассЛайв . Архивировано из оригинала 25 июля 2021 года . Проверено 28 мая 2021 г.
- ^ «Lonza и Moderna объявляют о дальнейшем сотрудничестве в производстве лекарственных средств для вакцины против COVID-19 Moderna в Нидерландах» . www.lonza.com . 2 июня 2021 г. Проверено 25 декабря 2022 г.
- ^ «Moderna удвоит производство вакцин в ЕС, открыв новое предприятие в Нидерландах» . Политик . 2 июня 2021 г. Проверено 25 декабря 2022 г.
- ^ Хопкинс Дж.С. (6 апреля 2021 г.). «Темпы производства современной вакцины против Covid-19 в компании Catalent, работающей по контракту, будут увеличиваться» . Уолл Стрит Джорнал . Архивировано из оригинала 13 апреля 2021 года . Проверено 13 апреля 2021 г.
- ^ Лофтус П (21 марта 2021 г.). «Производство вакцины против Covid-19 в США стремительно набирает обороты» . Уолл Стрит Джорнал . Архивировано из оригинала 28 апреля 2021 года . Проверено 29 апреля 2021 г.
- ^ Уильямс Дж. (29 апреля 2021 г.). «Современное удвоение производства вакцины против COVID-19» . Холм . Архивировано из оригинала 29 апреля 2021 года . Проверено 29 апреля 2021 г.
- ^ Лофтус П (29 апреля 2021 г.). «Moderna увеличит производство вакцины против Covid-19, чтобы удовлетворить растущий мировой спрос» . Уолл Стрит Джорнал . Архивировано из оригинала 29 апреля 2021 года . Проверено 29 апреля 2021 г.
- ^ «Хранение вакцины Pfizer-BioNTech против COVID-19 и безопасное обращение с сухим льдом» . Пфайзер. Архивировано из оригинала 1 февраля 2022 года . Проверено 17 декабря 2020 г.
- ^ Jump up to: а б с Лавлейс-младший Б., Хиггинс-Данн Н. (16 ноября 2020 г.). «Moderna заявляет, что предварительные данные испытаний показывают, что ее вакцина от коронавируса эффективна более чем на 94%, акции растут» . CNBC . Архивировано из оригинала 16 ноября 2020 года . Проверено 17 ноября 2020 г.
- ^ МакГрегор Дж. (5 декабря 2020 г.). «Как китайский COVID-19 может заполнить пробелы, оставленные Pfizer, Moderna, AstraZeneca» . Удача . Архивировано из оригинала 12 декабря 2020 года . Проверено 5 декабря 2020 г.
- ^ «О вакцине Pfizer не может быть и речи, поскольку в Индонезии не хватает холодильников: глава государственной фармацевтической компании» . Джакарта Глобус . 22 ноября 2020 г. Архивировано из оригинала 7 декабря 2020 г. . Проверено 5 декабря 2020 г.
- ^ «Обновление о коронавирусе (COVID-19): FDA обеспечивает более гибкие условия хранения и транспортировки вакцины Pfizer-BioNTech против COVID-19» . США Управление по контролю за продуктами и лекарствами (FDA) (пресс-релиз). 25 февраля 2021 года. Архивировано из оригинала 25 февраля 2021 года . Проверено 25 февраля 2021 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе .
- ^ «Pfizer и BioNTech предоставляют в FDA США данные о стабильности вакцины против COVID-19 при стандартной температуре заморозки» . Pfizer (пресс-релиз). 19 февраля 2021 года. Архивировано из оригинала 26 апреля 2021 года . Проверено 19 февраля 2021 г.
- ^ «Хранение и обработка» . Модерна. 11 августа 2021 года. Архивировано из оригинала 10 января 2022 года . Проверено 11 августа 2021 г.
- ^ Долгин Э (ноябрь 2020 г.). «Вакцины против COVID-19 готовы к выпуску, но влияние на пандемию неясно». Природная биотехнология . дои : 10.1038/d41587-020-00022-y . ПМИД 33239758 . S2CID 227176634 .
- ^ Стинхейсен Дж., Келланд К. (24 января 2020 г.). «Имея в руках генетический код уханьского вируса, ученые начинают работу над вакциной» . Рейтер . Архивировано из оригинала 25 января 2020 года . Проверено 26 января 2020 г. .
- ^ Кэри К. (26 февраля 2020 г.). «По мере распространения вируса растет число биофармацевтических препаратов, нацеленных на COVID-19» . Биомир. Архивировано из оригинала 27 февраля 2020 года . Проверено 1 марта 2020 г.
- ^ Эверетт Дж. (27 февраля 2020 г.). «Эти пять разработчиков лекарств на этой неделе прыгнули в надежде, что смогут обеспечить лечение коронавируса» . Инсайдер рынка. Архивировано из оригинала 16 ноября 2020 года . Проверено 1 марта 2020 г.
- ^ «Moderna объявляет о расширении соглашения BARDA для поддержки более широкой программы фазы 3 по разработке вакцины (мРНК-1273) против COVID-19» . Модерна. 26 июля 2020 года. Архивировано из оригинала 25 апреля 2021 года . Проверено 25 апреля 2021 г.
- ^ Кластер А (24 ноября 2020 г.). «Проверка фактов: вакцина Moderna финансируется за счет государственных расходов при значительных частных пожертвованиях» . США сегодня . Архивировано из оригинала 25 апреля 2021 года . Проверено 25 апреля 2021 г.
- ^ Грейди Д. (16 ноября 2020 г.). «Первые данные показывают, что вакцина от коронавируса Moderna эффективна на 94,5%» . Нью-Йорк Таймс . Архивировано из оригинала 24 февраля 2021 года . Проверено 25 апреля 2021 г.
- ^ «Долли Партон для меня большая честь и гордость, что она помогла в борьбе с Covid-19» . Новости Би-би-си . 18 ноября 2020 года. Архивировано из оригинала 19 августа 2021 года . Проверено 14 августа 2021 г.
- ^ «Начинаются клинические испытания NIH экспериментальной вакцины от COVID-19» . Национальные институты здравоохранения (NIH) . 16 марта 2020 г. Архивировано из оригинала 19 марта 2020 г. . Проверено 18 марта 2020 г.
- ^ Кузня Р., Полглас К., Меццофиоре Дж. (1 мая 2020 г.). «В поисках вакцины США делают «большую ставку» на компании с непроверенными технологиями» . CNN . Архивировано из оригинала 13 мая 2020 года . Проверено 2 мая 2020 г.
- ^ Киоун А (7 мая 2020 г.). «Moderna переходит ко второй фазе испытаний кандидатной вакцины против COVID-19» . Биокосмос. Архивировано из оригинала 16 ноября 2020 года . Проверено 9 мая 2020 г.
- ^ Бланкеншип К. (1 мая 2020 г.). «Moderna стремится производить миллиард прививок от COVID-19 в год благодаря производственному сотрудничеству с Lonza» . Жесткая Фарма . Архивировано из оригинала 16 ноября 2020 года.
- ^ «Швейцарская фабрика спешит подготовить вакцину Moderna Covid-19» . SWI swissinfo.ch . 7 октября 2020 г. Архивировано из оригинала 16 ноября 2020 г. . Проверено 7 октября 2020 г.
- ^ Номер клинического исследования NCT04405076 «Исследование подтверждения дозы для оценки безопасности, реактогенности и иммуногенности мРНК-1273 вакцины против COVID-19 у взрослых в возрасте 18 лет и старше» на сайте ClinicalTrials.gov.
- ^ Ли Ю (14 июля 2020 г.). «Фьючерсы на индекс Dow подскочили более чем на 200 пунктов после того, как компания Moderna заявила, что ее вакцина вырабатывает антитела к коронавирусу» . CNBC . Архивировано из оригинала 16 ноября 2020 года . Проверено 15 июля 2020 г.
- ^ Jump up to: а б Херпер М., Гард Д. (14 июля 2020 г.). «Первые данные о вакцине Moderna Covid-19 показывают, что она стимулирует иммунный ответ» . Стат . Архивировано из оригинала 14 июля 2020 года . Проверено 15 июля 2020 г.
- ^ Матеус Дж., Дэн Дж.М., Чжан З., Модербахер Ч.Р., Ламмерс М., Гудвин Б. и др. (2021). «Низкие дозы мРНК-1273 вакцины против COVID-19 создают устойчивую память, усиленную перекрестно-реактивными Т-клетками» . Наука . 374 (6566): eabj9853. дои : 10.1126/science.abj9853 . ПМЦ 8542617 . ПМИД 34519540 .
- ^ Брайант Э. (5 октября 2021 г.). «Современная вакцина против COVID-19 формирует долговременную иммунную память» . Вопросы исследований НИЗ . Национальные институты здравоохранения. Архивировано из оригинала 10 ноября 2021 года . Проверено 10 ноября 2021 г.
- ^ Палка Дж. (27 июля 2020 г.). «Кандидат на вакцину против COVID-19 готовится к широкомасштабным испытаниям в США» NPR . Архивировано из оригинала 11 октября 2020 года . Проверено 27 июля 2020 г.
- ^ Пальяруло Н, изд. (17 сентября 2020 г.). «Модерна, стремясь к прозрачности, раскрывает подробный план испытаний вакцины от коронавируса» . Биофарма Дайв . Архивировано из оригинала 16 ноября 2020 года . Проверено 18 сентября 2020 г.
- ^ Маскареньяш Л. (1 октября 2020 г.). «Руководитель Moderna говорит, что вакцина от Covid-19 может стать широко доступной к концу марта» . CNN . Архивировано из оригинала 16 ноября 2020 года . Проверено 2 октября 2020 г. .
- ^ Коэн Э (22 октября 2020 г.). «Первое крупномасштабное испытание вакцины против Covid-19 в США достигло цели в 30 000 участников» . CNN . Архивировано из оригинала 16 ноября 2020 года . Проверено 23 октября 2020 г.
- ^ «Многообещающие промежуточные результаты клинических испытаний вакцины против COVID-19 NIH-Moderna» . Национальные институты здравоохранения (NIH) . 15 ноября 2020 года. Архивировано из оригинала 4 января 2021 года . Проверено 19 декабря 2020 г.
- ^ «Современное использование теста на антитела компании Roche во время испытаний вакцин» . www.rapidmicrobiology.com . 10 декабря 2020 года. Архивировано из оригинала 10 января 2022 года . Проверено 13 декабря 2020 г.
- ^ Jump up to: а б «Заявление Национального института здравоохранения и BARDA о разрешении FDA на экстренное использование вакцины Moderna против COVID-19» . Национальные институты здравоохранения . 18 декабря 2020 года. Архивировано из оригинала 19 марта 2021 года . Проверено 19 декабря 2020 г.
- ^ Циммер С (20 ноября 2020 г.). «Две компании заявляют, что их вакцины эффективны на 95%. Что это значит? Можно предположить, что 95 из каждых 100 вакцинированных человек будут защищены от Covid-19. Но математика работает не так» . Нью-Йорк Таймс . Архивировано из оригинала 22 ноября 2020 года . Проверено 21 ноября 2020 г.
- ^ Номер клинического испытания NCT04470427 «Исследование по оценке эффективности, безопасности и иммуногенности вакцины мРНК-1273 у взрослых в возрасте 18 лет и старше для предотвращения COVID-19» на сайте ClinicalTrials.gov.
- ^ Лутра С. (23 ноября 2020 г.). «Беременные женщины не участвовали в многообещающих испытаниях вакцины против COVID-19» . США сегодня . Архивировано из оригинала 10 января 2022 года.
- ^ Крубинер С., Фаден Р.Р., Каррон Р.А. (9 декабря 2020 г.). «FDA: Оставьте дверь открытой для вакцинации против Covid-19 беременных и кормящих работников здравоохранения» . СТАТ . Архивировано из оригинала 10 января 2022 года.
- ^ Лофтус П (16 марта 2021 г.). «Moderna тестирует свою вакцину от Covid-19 на маленьких детях» . Уолл Стрит Джорнал . Архивировано из оригинала 16 марта 2021 года . Проверено 16 марта 2021 г.
- ^ «Современное тестирование вакцины против COVID-19 на детях до 12 лет» . Американская академия педиатрии. 16 марта 2021 года. Архивировано из оригинала 3 ноября 2021 года . Проверено 10 апреля 2021 г.
- ^ Коэн Э (30 ноября 2020 г.). «Moderna подает заявку на получение разрешения FDA на свою вакцину против Covid-19» . CNN . Архивировано из оригинала 3 декабря 2020 года . Проверено 4 декабря 2020 г.
- ^ Бургер Л (1 декабря 2020 г.). «Спринт по вакцине против COVID-19: Pfizer-BioNTech и Moderna запросили экстренное одобрение ЕС» . Рейтер . Архивировано из оригинала 3 декабря 2020 года . Проверено 4 декабря 2020 г.
- ^ Кюхлер Х. (30 ноября 2020 г.). «Канада может быть одной из первых, кто разрешит использование вакцины против COVID-19 компании Moderna» . Финансовая почта . Архивировано из оригинала 4 декабря 2020 года . Проверено 4 декабря 2020 г.
- ^ Парсонс Л. (28 октября 2020 г.). «Великобританское MHRA начинает проверку вакцины против COVID-19 компании Moderna» . ФармаТаймс. Архивировано из оригинала 30 ноября 2020 года . Проверено 4 декабря 2020 г.
- ^ «FDA принимает дополнительные меры в борьбе с COVID-19, выдавая разрешение на экстренное использование второй вакцины против COVID-19» . США Управление по контролю за продуктами и лекарствами (FDA) (пресс-релиз). 18 декабря 2020 года. Архивировано из оригинала 17 марта 2021 года . Проверено 18 декабря 2020 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе .
- ^ Ли Джей (16 декабря 2020 г.). «Moderna близка к получению первого в истории разрешения FDA на свою вакцину против COVID-19» . МаркетВотч . Архивировано из оригинала 16 апреля 2021 года . Проверено 19 декабря 2020 г.
- ^ Jump up to: а б Оливер С.Е., Гаргано Дж.В., Марин М., Уоллес М., Карран К.Г., Чемберленд М. и др. (январь 2021 г.). «Временная рекомендация Консультативного комитета по практике иммунизации по использованию вакцины Moderna против COVID-19 — США, декабрь 2020 г.» (PDF) . ММВР. Еженедельный отчет о заболеваемости и смертности . 69 (5152): 1653–6. doi : 10.15585/mmwr.mm695152e1 . ISSN 0149-2195 . ПМК 9191904 . ПМИД 33382675 . S2CID 229945697 . Архивировано (PDF) из оригинала 9 февраля 2021 года . Проверено 21 декабря 2020 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе .
- ^ Jump up to: а б «Современные вакцины против COVID-19» . Управление по контролю за продуктами и лекарствами США . 20 апреля 2023 г. Проверено 23 апреля 2023 г.
- ^ Jump up to: а б «Обновление о коронавирусе (COVID-19): FDA разрешает внести изменения, упрощающие использование вакцин против COVID-19 с бивалентной мРНК» . Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (пресс-релиз). 18 апреля 2023 г. Проверено 23 апреля 2023 г.
- ^ «Краткое описание нормативного решения – вакцина Moderna против COVID-19» . Здоровье Канады . 23 декабря 2020 года. Архивировано из оригинала 15 января 2021 года . Проверено 23 декабря 2020 г.
- ^ «Израиль разрешает использование вакцины против COVID-19 компании Moderna» . Yahoo! Новости . 4 января 2021 года. Архивировано из оригинала 5 января 2021 года . Проверено 5 января 2021 г.
- ^ «Сингапур становится первым в Азии, кто одобрил вакцину Moderna от COVID-19» . Рейтер . 3 февраля 2021 года. Архивировано из оригинала 10 января 2022 года . Проверено 3 февраля 2021 г.
- ^ «ВОЗ вносит вакцину Moderna в список экстренного использования» . Всемирная организация здравоохранения (ВОЗ) (пресс-релиз). 30 апреля 2021 года. Архивировано из оригинала 6 мая 2021 года . Проверено 29 мая 2021 г.
- ^ «ВОЗ вносит в список вакцину против COVID Moderna для экстренного использования» . Филиппинский Daily Inquirer. Агентство Франс-Пресс. 1 мая 2021 года. Архивировано из оригинала 1 мая 2021 года . Проверено 1 мая 2021 г.
- ^ Лопес V (5 мая 2021 г.). «Филиппины предоставляют EUA вакцину от COVID-19 компании Moderna» . Новости GMA онлайн . Архивировано из оригинала 5 мая 2021 года . Проверено 5 мая 2021 г.
- ^ «Японская компания Takeda импортирует 50 миллионов доз вакцины против COVID-19 компании Moderna, что повышает прогноз прибыли» . Рейтер . 29 октября 2020 года. Архивировано из оригинала 9 июля 2021 года . Проверено 2 июля 2021 г.
- ^ Бальфур Х. (2 ноября 2020 г.). «Такеда поставит в Японию вакцину против COVID-19 компании Moderna» . Европейский фармацевтический обзор . Архивировано из оригинала 10 января 2022 года.
- ^ «Начало японского клинического исследования TAK-919, кандидатной вакцины Moderna против COVID-19» (пресс-релиз). Такеда. 21 января 2021 года. Архивировано из оригинала 25 февраля 2021 года . Проверено 11 марта 2021 г.
- ^ Каул Р. (29 июня 2021 г.). «Вакцина Moderna от Covid одобрена для использования в Индии» . Индостан Таймс . Архивировано из оригинала 20 октября 2021 года . Проверено 29 июня 2021 г.
- ^ Нга Л (29 июня 2021 г.). «Вьетнам одобрил вакцину Moderna Covid для экстренного использования» . ВнЭкспресс. Архивировано из оригинала 1 июля 2021 года . Проверено 1 июля 2021 г.
- ^ «NPRA одобрила вакцину Moderna Covid-19» . КодBlue. 5 августа 2021 года. Архивировано из оригинала 7 августа 2021 года . Проверено 8 августа 2021 г.
- ^ «EMA рекомендует вакцину против COVID-19 Moderna для авторизации в ЕС» (пресс-релиз). Европейское агентство лекарственных средств (EMA). 6 января 2021 года. Архивировано из оригинала 17 марта 2021 года . Проверено 6 января 2021 г.
- ^ «Вакцина против COVID-19 Spikevax одобрена для детей в возрасте от 12 до 17 лет в ЕС» . Европейское агентство лекарственных средств (EMA) (пресс-релиз). 23 июля 2021 года. Архивировано из оригинала 26 ноября 2021 года . Проверено 10 ноября 2021 г.
- ^ Миллер Дж. (12 января 2021 г.). «Швейцарский регулятор по лекарственным средствам одобрил вакцину против COVID-19 компании Moderna» . Рейтер . Архивировано из оригинала 12 января 2021 года . Проверено 17 января 2021 г.
- ^ «Swissmedic выдает разрешение на вакцину против COVID-19 от Moderna» . Swissmedic (Пресс-релиз). 12 января 2020 года. Архивировано из оригинала 11 февраля 2021 года . Проверено 12 января 2020 г.
- ^ «Swissmedic одобряет продление показаний к вакцине Spikevax для детей в возрасте от 12 до 17 лет» . Swissmedic (Пресс-релиз). 11 июня 2021 года. Архивировано из оригинала 18 июня 2022 года . Проверено 5 июля 2022 г.
- ^ «Современная вакцина против COVID-19, разрешенная в Швейцарии для детей в возрасте от 6 до 11 лет» . Swissmedic (Пресс-релиз). 13 мая 2022 года. Архивировано из оригинала 16 июня 2022 года . Проверено 5 июля 2022 г.
- ^ «Вакцины против COVID-19 от Moderna и Pfizer/BioNTech: Swissmedic одобряет третью вакцинацию для определенных групп населения» . Swissmedic (Пресс-релиз). 26 октября 2021 года. Архивировано из оригинала 30 мая 2022 года . Проверено 5 июля 2022 г.
- ^ «Swissmedic одобрила бустерную дозу вакцины Moderna от COVID-19 для взрослых в возрасте от 18 лет и старше» . Swissmedic (Пресс-релиз). 26 октября 2021 года. Архивировано из оригинала 30 мая 2022 года . Проверено 5 июля 2022 г.
- ^ Казалетто Л (16 сентября 2021 г.). «Вакцины Pfizer и Moderna получили полное одобрение Министерства здравоохранения Канады; измените название» . Городские новости . Архивировано из оригинала 10 января 2022 года . Проверено 17 сентября 2021 г.
- ^ Макдоннелл Ньето дель Рио Джи (15 января 2021 г.). «Covid-19: более двух миллионов человек во всем мире умерли от вируса» . Нью-Йорк Таймс . Архивировано из оригинала 18 января 2021 года . Проверено 18 января 2021 г.
- ^ Тиррелл М. (14 января 2021 г.). «Moderna надеется протестировать прививки от Covid-19 через год после первоначальной вакцинации» . CNBC . Архивировано из оригинала 10 января 2022 года . Проверено 18 января 2021 г.
- ^ Лофтус П. «Moderna исследует, добавляет ли третья доза вакцины против Covid-19 дополнительную защиту» . Уолл Стрит Джорнал . Архивировано из оригинала 15 января 2021 года . Проверено 18 января 2021 г.
- ^ Jump up to: а б Грейди Д., Мандавилли А., Томас К. (25 января 2021 г.). «Эффективна ли вакцина Covid-19 против нового южноафриканского варианта?» . Нью-Йорк Таймс . Архивировано из оригинала 10 января 2022 года . Проверено 25 января 2021 г.
- ^ "Коронавирус заболевание 2019" . Центры по контролю и профилактике заболеваний (пресс-релиз). 10 января 2022 года. Архивировано из оригинала 4 февраля 2022 года . Проверено 4 февраля 2022 г.
- ^ «Обновление о коронавирусе (COVID-19): FDA сокращает интервал для бустерной дозы вакцины Moderna против COVID-19 до пяти месяцев» . США Управление по контролю за продуктами и лекарствами (FDA) (пресс-релиз). 7 января 2022 года. Архивировано из оригинала 4 февраля 2022 года . Проверено 4 февраля 2022 г.
- ^ «EMA оценивает данные о ревакцинации вакцины против COVID-19 Спикевакс» . Европейское агентство лекарственных средств (EMA) (пресс-релиз). 27 сентября 2021 года. Архивировано из оригинала 27 сентября 2021 года . Проверено 27 сентября 2021 г. Текст скопирован из источника, права на который принадлежат Европейскому агентству по лекарственным средствам. Воспроизведение разрешено при условии указания источника.
- ^ «ECDC и EMA подчеркивают необходимость дополнительных бустерных доз вакцины против COVID-19» . Европейское агентство лекарственных средств (EMA) (пресс-релиз). 2 сентября 2021 г. Архивировано из оригинала 28 сентября 2021 г. Проверено 27 сентября 2021 г.
- ^ «FDA принимает дополнительные меры по использованию бустерной дозы вакцин против COVID-19» . США Управление по контролю за продуктами и лекарствами (FDA) (пресс-релиз). 21 октября 2021 года. Архивировано из оригинала 7 декабря 2021 года . Проверено 22 октября 2021 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе .
- ^ «CDC расширяет право на повторные прививки от COVID-19» . Центры США по контролю и профилактике заболеваний (CDC) . 21 октября 2021 года. Архивировано из оригинала 7 декабря 2021 года . Проверено 22 октября 2021 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе .
- ^ Jump up to: а б «FDA расширяет право на бустеры вакцины против COVID-19» . США Управление по контролю за продуктами и лекарствами (FDA) (пресс-релиз). 19 ноября 2021 года. Архивировано из оригинала 19 ноября 2021 года . Проверено 19 ноября 2021 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе .
- ^ «FDA сокращает интервал для бустерной дозы вакцины Moderna против COVID-19 до пяти месяцев» . США Управление по контролю за продуктами и лекарствами (FDA) (пресс-релиз). 7 января 2022 года. Архивировано из оригинала 7 января 2022 года . Проверено 7 января 2022 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе .
- ^ «Современное обновление вакцины против COVID-19» . Moderna, Inc. 25 января 2021 г. Архивировано из оригинала (PDF) 29 июня 2021 г. . Проверено 26 января 2021 г.
- ^ «Moderna объявляет, что отправила в НИЗ для клинического исследования вариант-специфическую вакцину-кандидат, мРНК-1273.351» . Moderna Inc. (Пресс-релиз). 24 февраля 2021 года. Архивировано из оригинала 24 февраля 2021 года . Проверено 24 февраля 2021 г.
- ^ «Исследование по оценке иммуногенности и безопасности вакцины мРНК-1273.211 для вариантов COVID-19» . ClinicalTrials.gov . 15 июня 2021 года. Архивировано из оригинала 6 августа 2021 года . Проверено 5 августа 2021 г.
- ^ «Moderna объявляет о положительных первичных данных о ревакцинации против вызывающих беспокойство вариантов SARS-CoV-2» . Moderna, Inc. (Пресс-релиз). 5 мая 2021 г. Архивировано из оригинала 2 декабря 2021 г. Проверено 22 августа 2021 г.
- ^ «Вакцина против COVID-19: Spikevax Biвалентный оригинал/Омикрон (элазомеран/имелазомеран)» . Управление терапевтическими товарами . 23 сентября 2022 г.
- ^ «Спайвакс бивалент» . Здоровье Канады . 1 сентября 2022 г. Проверено 30 октября 2022 г.
- ^ «Обновление о коронавирусе (COVID-19): FDA разрешает использовать бивалентные вакцины Moderna и Pfizer-BioNTech против COVID-19 в качестве ревакцинационной дозы в более молодых возрастных группах» . Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (пресс-релиз). 12 октября 2022 г. Проверено 13 октября 2022 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе .
- ^ «Обновление о коронавирусе (COVID-19): FDA разрешает обновленные (двухвалентные) вакцины против COVID-19 для детей в возрасте до 6 месяцев» . Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (пресс-релиз). 8 декабря 2022 г. Проверено 25 января 2023 г.
- ^ «Спайвакс» . США Управление по контролю за продуктами и лекарствами (FDA). 11 сентября 2023 г. Проверено 12 сентября 2023 г.
- ^ «Современная вакцина против COVID-19» . США Управление по контролю за продуктами и лекарствами (FDA). 11 сентября 2023 г. Проверено 12 сентября 2023 г.
- ^ Придди Ф (12 сентября 2023 г.). «Безопасность и иммуногенность вакцины Moderna против COVID-19 (формула 2023–2024 гг.) — моновалентная вакцина, вариант XBB.1.5» (PDF) . Центры по контролю и профилактике заболеваний . Архивировано (PDF) из оригинала 15 сентября 2023 года . Проверено 15 сентября 2023 г.
- ^ Винтер Д.Э., Ло М. (14 сентября 2023 г.). «Заявление главного хирурга Флориды о том, что обновленные вакцины против COVID не прошли клинических испытаний, в том числе на людях, вводит в заблуждение» . ПРОВЕРЯТЬ . Архивировано из оригинала 15 сентября 2023 года . Проверено 15 сентября 2023 г.
- ^ Джадд А. (12 сентября 2023 г.). «Приготовьтесь к масштабной кампании по вакцинации от COVID и гриппа, - заявляет правительство Британской Колумбии» . Глобальные новости . Архивировано из оригинала 13 сентября 2023 года . Проверено 15 сентября 2023 г.
- ^ «Одобрение регулирующих органов адаптированной вакцины Spikevax (ранее Covid-19 Vaccine Moderna) XBB.1.5» . Агентство по регулированию лекарственных средств и товаров медицинского назначения (MHRA) . 15 сентября 2023 г. Проверено 7 октября 2023 г.
- ^ «MHRA одобряет адаптированную вакцину против COVID-19 компании Moderna (Spikevax), нацеленную на Omicron XBB.1.5» . Агентство по регулированию лекарственных средств и товаров медицинского назначения (MHRA) . 15 сентября 2023 г. Проверено 7 октября 2023 г.
- ^ «TGA выдает предварительное заключение по вакцине Moderna Covid-19, Элазомеран» . Управление терапевтических товаров (TGA) (пресс-релиз). 24 июня 2021 года. Архивировано из оригинала 27 июня 2021 года . Проверено 29 июня 2021 г.
- ^ Всемирная организация здравоохранения (2021 г.). «Международные непатентованные наименования фармацевтических субстанций (МНН): рекомендуемое МНН: список 86». Информация ВОЗ о лекарствах . 35 (3). hdl : 10665/346562 .
- ^ «ЮНИ-TYF7YW7ENF» . точностьFDA . Проверено 6 октября 2023 г.
- ^ Всемирная организация здравоохранения (2022 г.). «Международные непатентованные наименования фармацевтических субстанций (МНН): рекомендуемое МНН: список 88». Информация ВОЗ о лекарствах . 36 (3). hdl : 10665/363551 .
- ^ «УНИИ-4F9QRS7ZV2» . точностьFDA . Проверено 6 октября 2023 г.
- ^ «Предлагаемый перечень МНН 129» . Всемирная организация здравоохранения (ВОЗ) . 1 января 1900 года . Проверено 6 октября 2023 г.
- ^ «Обеспечение доступа Сингапура к вакцинам против COVID-19» . www.gov.sg. Правительство Сингапура. 14 декабря 2020 года. Архивировано из оригинала 29 января 2021 года . Проверено 1 февраля 2021 г.
- ^ Халик С. (1 февраля 2021 г.). «Как Сингапур выбирал вакцины против Covid-19» . «Стрейтс Таймс» . Архивировано из оригинала 31 января 2021 года . Проверено 1 февраля 2021 г.
- ^ «Трамп сообщил, что США подписывают соглашение с Moderna на поставку 100 млн доз вакцины-кандидата от COVID-19» . Яху . Рейтер. 11 августа 2020 г. Архивировано из оригинала 16 ноября 2020 г. . Проверено 12 августа 2020 г.
- ^ «Moderna стремится установить цену на вакцину от коронавируса в 50–60 долларов за курс: FT» . Рейтер . 28 июля 2020 года. Архивировано из оригинала 25 июля 2021 года . Проверено 20 марта 2021 г.
- ^ «Дональд Трамп, похоже, признает, что Covid в США «одичал» . Хранитель . 22 ноября 2020 г. Архивировано из оригинала 22 ноября 2020 г. . Проверено 22 ноября 2020 г.
Компания Moderna сообщила немецкому еженедельнику Welt am Sonntag, что будет взимать с правительств от 25 до 37 долларов за дозу вакцины-кандидата от Covid, в зависимости от заказанного количества.
- ^ Гуарасио Ф (24 ноября 2020 г.). «ЕС обеспечивает 160 миллионов доз вакцины Moderna против COVID-19» . Рейтер . Архивировано из оригинала 24 ноября 2020 года . Проверено 25 ноября 2020 г.
- ^ «Коронавирус: Комиссия утверждает контракт с Moderna для обеспечения доступа к потенциальной вакцине» . Европейская комиссия. 25 ноября 2020 года. Архивировано из оригинала 10 января 2022 года . Проверено 4 декабря 2020 г.
- ^ «Новые соглашения по обеспечению дополнительных кандидатов на вакцину от COVID-19» . Канцелярия премьер-министра правительства Канады. 25 сентября 2020 года. Архивировано из оригинала 10 января 2022 года . Проверено 4 декабря 2020 г.
- ^ Стевис-Гриднефф М., Сангер-Кац М., Вейланд Н. (18 декабря 2020 г.). «Европейский чиновник раскрывает секрет: США платят больше за вакцины от коронавируса» . Нью-Йорк Таймс . Архивировано из оригинала 28 марта 2021 года . Проверено 19 декабря 2020 г.
- ^ «Годовой отчет за финансовый год, закончившийся 31 декабря 2020 г.; подача документов в SEC 10-K» (PDF) . Moderna Inc., 16 февраля 2021 г. Архивировано (PDF) из оригинала 8 декабря 2021 г. . Проверено 3 мая 2022 г.
- ^ «Годовой отчет за финансовый год, закончившийся 31 декабря 2021 г.; подача документов 10-K SEC» (PDF) . Moderna Inc., 25 февраля 2022 г. Архивировано (PDF) из оригинала 7 марта 2022 г. . Проверено 3 мая 2022 г.
- ^ «Нет, Германия не прекратила использование вакцин против COVID-19» . АП Новости . 14 сентября 2022 г. Проверено 3 октября 2022 г.
- ^ Харт Р. (10 ноября 2021 г.). «Германия и Франция ограничивают использование вакцины Moderna от Covid для лиц моложе 30 лет из-за редкого сердечного риска, несмотря на рост числа случаев» . Форбс . Проверено 3 октября 2022 г.
- ^ Тенн С (6 октября 2021 г.). «Вакцина Moderna приостановлена для молодых людей в двух европейских странах» . Ученый . Проверено 3 октября 2022 г.
- ^ «Франция не рекомендует использовать Moderna для людей младше 30 лет из-за редкого сердечного риска» . Франция 24 . 9 ноября 2021 г. Проверено 3 октября 2022 г.
- ^ Тейлор С. (8 октября 2021 г.). «Скандинавские страны ограничивают использование вакцины Moderna от Covid. Вот почему» . CNBC . Проверено 2 октября 2022 г.
- ^ Хильцик М. (19 мая 2020 г.). «Колонка: Результаты вакцинации компании Moderna увеличили количество ее акций – и это вряд ли совпадение» . Лос-Анджелес Таймс . Архивировано из оригинала 16 ноября 2020 года . Проверено 19 мая 2020 г.
- ^ Брансвелл Х. (19 мая 2020 г.). «Эксперты по вакцинам говорят, что Moderna не предоставила данных, критически важных для оценки вакцины против Covid-19» . Стат . Архивировано из оригинала 16 ноября 2020 года . Проверено 19 мая 2020 г.
- ^ Тейлор М., Респаут Р. (7 июля 2020 г.). «Эксклюзив: Moderna спорит с американскими учёными по поводу испытаний вакцины против COVID-19» . Рейтер . Архивировано из оригинала 16 ноября 2020 года . Проверено 10 июля 2020 г.
- ^ «Современные подрядчики по испытаниям вакцин не могут привлечь достаточное количество цветных людей, что приводит к замедлению темпов роста» . Новости Эн-Би-Си . Рейтер . 6 октября 2020 г. Архивировано из оригинала 19 ноября 2020 г. . Проверено 17 ноября 2020 г.
- ^ «Совместное заявление экспертов здравоохранения и медицины HHS о прививках от COVID-19» (пресс-релиз). Министерство здравоохранения и социальных служб США. 18 августа 2021 года. Архивировано из оригинала 7 декабря 2021 года . Проверено 21 августа 2021 г.
- ^ «ВОЗ права, призывая к временной остановке бустерной вакцины против COVID» . Природа (Редакционная статья). 596 (7872): 317. 17 августа 2021 г. Бибкод : 2021Natur.596..317. . дои : 10.1038/d41586-021-02219-w . ПМИД 34404945 . S2CID 237199262 . Архивировано из оригинала 21 октября 2021 года . Проверено 21 августа 2021 г.
- ^ «Промежуточное заявление о бустерных дозах вакцины против COVID-19» (пресс-релиз). Всемирная организация здравоохранения. 10 августа 2021 года. Архивировано из оригинала 27 ноября 2021 года . Проверено 26 августа 2021 г.
- ^ Крамер Дж. (18 августа 2021 г.). «США планируют разрешить ревакцинацию, но многие уже получили третью дозу» . Нэшнл Географик . Архивировано из оригинала 10 октября 2021 года . Проверено 21 августа 2021 г.
Получение ревакцинации слишком рано после первичной прививки может не научить иммунную систему организма создавать более надежную защиту.
- ^ Ли Дж (14 мая 2021 г.). «Показывают ли видео магниты, прилипающие к рукам людей после вакцинации от COVID-19?» . Snopes.com . Архивировано из оригинала 9 ноября 2021 года . Проверено 7 июня 2021 г.
- ^ Фичера А (14 мая 2021 г.). «Магнитные видеоролики дополняют фиктивную претензию о вакцинных микрочипах» . FactCheck.org . Центр государственной политики Анненберга. Архивировано из оригинала 17 мая 2021 года . Проверено 7 июня 2021 г.
- ^ «Мифы и факты о вакцине против COVID-19» (PDF) . Департамент общественного здравоохранения округа Лос-Анджелес. 15 декабря 2021 г. Архивировано (PDF) из оригинала 25 августа 2021 г. . Проверено 27 августа 2021 г.
- ^ «Факты о вакцине против COVID-19» . Центры по контролю и профилактике заболеваний . 18 августа 2021 года. Архивировано из оригинала 11 декабря 2021 года . Проверено 27 августа 2021 г.
- ^ Эвон Д. (2 ноября 2021 г.). « Люцифераза не является ингредиентом вакцин против COVID-19» . Snopes.com . Архивировано из оригинала 10 января 2022 года.
- ^ «Проверка фактов: вакцина Moderna против COVID-19 не содержит люциферина или люциферазы» . Рейтер. 6 мая 2021 года. Архивировано из оригинала 3 ноября 2021 года . Проверено 2 ноября 2021 г.
- ^ Варди Н (29 июня 2020 г.). «Таинственная система доставки вакцин от коронавируса Moderna» . Форбс . Архивировано из оригинала 6 января 2021 года . Проверено 1 декабря 2020 г.
- ^ «Moderna проигрывает ключевой патентный спор» . Природная биотехнология . 38 (9): 1009. Сентябрь 2020 г. doi : 10.1038/s41587-020-0674-1 . ПМИД 32887970 . S2CID 221504018 .
Дальнейшее чтение
- Корум Дж., Циммер С. (7 мая 2021 г.). «Как действует вакцина Moderna» . Нью-Йорк Таймс .
- Модерна (17 декабря 2020 г.). «Информационный документ для спонсора VRBPAC мРНК-1273» (PDF) . США Управление по контролю за продуктами и лекарствами .
- Комитет по лекарственным препаратам для использования человеком (CHMP) (11 марта 2021 г.). «Отчет об оценке: вакцина против COVID-19 Moderna» (PDF) . Европейское агентство по лекарственным средствам . Архивировано (PDF) из оригинала 20 января 2021 года.
- «Протокол клинического исследования мРНК-1273-P301» (PDF) . Модерна . 20 августа 2020 г. Архивировано из оригинала (PDF) 17 сентября 2020 г.
- Дикерман Б.А., Герловин Х., Маденджи А.Л., Курганский К.Е., Феролито Б.Р., Фигероа Мунис М.Дж. и др. (январь 2022 г.). «Сравнительная эффективность вакцин BNT162b2 и мРНК-1273 у ветеранов США» . Медицинский журнал Новой Англии . 386 (2): 105–115. дои : 10.1056/nejmoa2115463 . ПМЦ 8693691 . ПМИД 34942066 .
- Всемирная организация здравоохранения (2021 г.). Справочный документ по вакцине мРНК-1273 (Moderna) против COVID-19: справочный документ к Временным рекомендациям ВОЗ по использованию вакцины мРНК-1273 (Moderna), 3 февраля 2021 г. (Отчет). Всемирная организация здравоохранения (ВОЗ). hdl : 10665/339218 . ВОЗ/2019-nCoV/vaccines/SAGE_recommendation/mRNA-1273/background/2021.1.