Реакция Дильса -Альдер
| Реакция Дильса -Альдер | |
|---|---|
| Тип реакции | Цикликация |
| Идентификаторы | |
| Органическая химическая портал | Diels-Alder-реакция |
| RSC Ontology Id | RXNO: 0000006 |
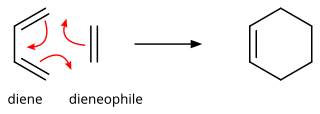
В органической химии реакция Diels -Alder представляет собой химическую реакцию между конъюгированным диеном и замещенным алкеном , обычно называемым диенофилом , образуя замещенное производное циклогекса . Это прототипический пример перициклической реакции с согласованным механизмом . Более конкретно, он классифицируется как термически разрешенная [4 + 2] циклическая обработка с символом Woodward -Hoffmann [ π 4 S + π 2 S ]. Впервые он был описан Отто Диэльсом и Куртом Олдером в 1928 году. За обнаружение этой реакции они были награждены Нобелевской премией по химии в 1950 году. Благодаря одновременному строительству двух новых углерод -углеродных связей реакция Diels -Alder обеспечивает Надежный способ сформировать шестичленные кольца с хорошим контролем над регионо-стереохимическими результатами. [ 1 ] [ 2 ] Следовательно, он послужил мощным и широко применяемым инструментом для введения химической сложности в синтезе натуральных продуктов и новых материалов. [ 3 ] [ 4 ] Основная концепция также была применена к π-системам с участием гетероатомов , таких как карбонилы и имины , которые предоставляют соответствующие гетероциклы ; Этот вариант известен как реакция гетеродиалс-Альдер . Реакция также была обобщена на другие размеры кольца, хотя ни одно из этих обобщений не соответствовало формированию шестичленных колец с точки зрения объема или универсальности. Из -за отрицательных значений Δ H ° и Δ S ° для типичной реакции Diels -Alder микроскопическая обратная обратная реакция реакции Diels -Alder становится благоприятной при высоких температурах, хотя это имеет синтетическое значение только для ограниченного диапазона диль -диль. Аддукты ольхи, как правило, с некоторыми специальными структурными особенностями; Эта обратная реакция известна как реакция ретро-дильс-Альдер . [ 5 ]
Механизм
[ редактировать ]Реакция является примером согласованной перициклической реакции. [ 6 ] Считается, что это происходит через одно циклическое переходное состояние, [ 7 ] без промежуточных соединений, генерируемых в течение реакции. Таким образом, реакция Диэльса -Альдер регулируется соображениями орбитальной симметрии: она классифицируется как циклическое циклу [ π 4 S + π 2 S ], что указывает на то, что она проходит через супрафициальное /супрафициальное взаимодействие системы 4π -электронов (дийенная структура ) с 2π-электронной системой (структура диенофилов) взаимодействие, которое приводит к переходному состоянию без дополнительного энергетического энергетического барьера и позволяет реакции Diels-Alder с относительной легкостью. [ 8 ]
Рассмотрение пограничных молекулярных орбиталей реагентов (FMO) прояснит, почему это так. (Тот же вывод может быть сделан из орбитальной диаграммы корреляции или анализа Dewar-Zimmerman.) Для более распространенной «нормальной» реакции Diels Diels-Alder реакция электронов-более важная из двух взаимодействий Homo/lumo заключается в том, что между электроном-альбома богатого Диена ψ 2 как самая высокая занятая молекулярная орбиталь (HOMO) с электрон дефицитным π* как самая низкая незанятая молекулярная орбиталь (LUMO). Тем не менее, энергетический разрыв Homo -Lumo достаточно близок, чтобы роли можно было изменить, переключая электронные эффекты заместителей на два компонента. В обратной (обратной) реакции электронного положения Diels-Alder заместители электронов на диеном снижают энергию его пустого ψ 3 орбитального и электронного заместителей на диенофиле. Между этими двумя орбиталями становится наиболее энергетически значимым стабилизирующим орбитальным взаимодействием. Независимо от того, какая ситуация относится, Homo и Lumo компонентов находятся в фазе, а взаимодействие связывания, как видно на диаграмме ниже. Поскольку реагенты находятся в их основном состоянии, реакция инициируется термически и не требует активации по свету. [ 8 ]

«Преобладающее мнение» [ 9 ] [ 10 ] [ 11 ] [ 12 ] является то, что большинство реакций Диэльса -Альдер проходят через согласованный механизм; Проблема, однако, была полностью оспорена. Несмотря на то, что подавляющее большинство реакций Диэльса -Альдер демонстрируют стереоспецифическую, син -добавление двух компонентов, дирадикальное промежуточное соединение было постулировано [ 7 ] (и подтверждается вычислительными данными) на том основании, что наблюдаемая стереоспецифичность не исключает двухэтапного добавления, включающего промежуточное соединение, которое ругается на продукт быстрее, чем может вращаться, чтобы обеспечить инверсию стереохимии.
Существует заметное повышение скорости, когда в полярных органических растворителях проводятся определенные реакции Diels -Alder, такие как диметилформамид и этиленгликоль , [ 13 ] и даже в воде. [ 14 ] Реакция циклопентадиена и бутенона , например, в 700 раз быстрее в воде относительно 2,2,4-триметилпентана в качестве растворителя. [ 14 ] Было предложено несколько объяснений этого эффекта, такие как увеличение эффективной концентрации из -за гидрофобной упаковки [ 15 ] или стабилизация водородного связки переходного состояния. [ 16 ]
Геометрия компонентов диена и диенофилов каждая распространяется в стереохимические детали продукта. В частности, для межмолекулярных реакций предпочтительная позиционная и стереохимическая связь заместителей двух компонентов по сравнению друг с другом контролируется электронными эффектами. Тем не менее, для диэль -диал реакций циклического цикла .
Региоселективность
[ редактировать ]Пограничная молекулярная орбитальная теория также была использована для объяснения закономерности региоселективности, наблюдаемых в реакциях Diels -Alder замещенных систем. Расчет энергетических и орбитальных коэффициентов пограничных орбиталей компонентов [ 17 ] Предоставляет картину, которая в хорошем соответствии с более простым анализом резонансных эффектов заместителей, как показано ниже.

В целом, региоселективность, обнаруженная как для нормальной, так и для обратной реакции Diels-Alder как для правила орто-пары , потому что продукт циклогекса имеет заместители в положениях, которые аналогичны положениям орто и пара . Например, в сценарии с нормальным требованием, диен, несущая электронно-представленную группу (EDG) в C1 C2. Сочетание этих двух коэффициентов дает продукт «орто», как видно на случай 1 на рисунке ниже. Диен, заменяемый в C2, как в случае 2 ниже, имеет самый большой коэффициент HOMO в C1, что дает продукт «Para». Аналогичные анализы для соответствующих сценариев обратной задачи дают аналогичные продукты, как видно в случаях 3 и 4. Изучение канонических мезомерных форм выше, легко убедиться, что эти результаты соответствуют ожиданиям, основанным на рассмотрении плотности электронов и плотности и плотности электронов и поляризация.

В целом, в отношении энергетически наиболее хорошо сопоставленной пары гомо-Лумо, максимизация энергии взаимодействия путем формирования связей между центрами с самыми большими пограничными орбитальными коэффициентами позволяет прогнозировать основной региоизомер, который будет возникнуть в результате данной комбинации диенофилов. [ 8 ] В более сложном лечении три типа заместителей ( Z отображение : Homo и Lumo снижение (CF 3 , № 2 , CN, C (O) CH 3 ), x пожертвования : Homo и Lumo повышают (ME, OME, NME 2 ) , C, конъюгирование : Homo повышение и понижение Lumo (pH, винил))), в результате чего в общей сложности 18 возможных комбинаций. Максимизация орбитального взаимодействия правильно предсказывает продукт во всех случаях, для которых доступны экспериментальные данные. Например, в необычных комбинациях с участием x групп как на диене, так и в диенофиле может быть отдан предпочтением шаблона 1,3-субстации, что не объясняется упрощенным аргументом резонансной структуры. [ 18 ] Тем не менее, случаи, когда резонансные аргументы и сопоставление самых больших орбитальных коэффициентов не согласны, редки.
Стереоспецифичность и стереоселективность
[ редактировать ]Реакции Diels -Alder, как согласованные циклические цифры, являются стереоспецифическими . Стереохимическая информация о диене и диенофиле сохраняется в продукте, в качестве добавления SYN по отношению к каждому компоненту. Например, заместители в взаимосвязи цис ( транс , соответственно) на двойной связи диенофила вызывают заместители, которые являются цис ( транс , соответственно) на тех же самых углеродах относительно кольца циклогекса. Аналогичным образом, цис , цис -и транс , транс -дизубсменные диена дают цис -заместители в этих углеродах продукта, тогда как -диспубленные цис диена дают транс заместители: [ 19 ] [ 20 ]


Реакции Diels -Alder, в которых соседние стереоцентеры генерируются на двух концах недавно образованных отдельных связей, подразумевают два разных возможных стереохимических результатов. Это стереоселективная ситуация, основанная на относительной ориентации двух отдельных компонентов, когда они реагируют друг с другом. В контексте реакции Diels-Alder, переходного состояния, в котором наиболее значимое заместитель (электрон-стрижка и/или сопряженная группа) на диенофиле ориентирован на систему диенов и проскальзывает под ней, когда возникает реакция известный как эндо -переходное состояние. В альтернативном переходном состоянии EXO он ориентирован от него. (Существует более общее использование терминов Endo и Exo в стереохимической номенклатуре.)
В тех случаях, когда диенофил имеет единую электронную оболочку / конъюгирующую заместитель или два электрон-гигиенических / сопряженных заместителя CIS друг к другу, результат часто может быть предсказан. В этих сценариях «нормального спроса» Диэльса - Альдер, эндовое переходное состояние, как правило, предпочтительнее, несмотря на то, что часто является более стерически перегруженным. Это предпочтение известно как правило эндо ольхи . Как первоначально заявлено Alder, предпочтительным переходным состоянием является «максимальное накопление двойных связей». Эндо -селективность, как правило, выше для жестких диенофилов, таких как малеиновый ангидрид и бензохинон ; Для других, таких как акрилаты и кротонаты , селективность не очень выражена. [ 21 ]

Наиболее широко принятым объяснением источника этого эффекта является благоприятное взаимодействие между π -системами диенофила и диеном, взаимодействие, описанное как вторичный орбитальный эффект , хотя дипольные и ван -дер -ваальс также могут сыграть часть, а также могут сыграть часть, и и и Растворитель иногда может иметь существенное значение в селективности. [ 6 ] [ 22 ] [ 23 ] Вудворд и Хоффманн впервые предложили вторичное орбитальное перекрытие. [ 24 ] В этом объяснении орбитали, связанные с группой, в сочетании с перекрытием с двумя связками диенофила с внутренними орбиталями диена, ситуация, которая возможна только для эндорового переходного состояния. Хотя первоначальное объяснение только вызвало орбиталь на атоме α в двойную связь диенофила, Салем и Хоук впоследствии предположили, что орбитали на α и β -углеродах участвуют, когда позволяет молекулярная геометрия. [ 25 ]

Часто, как и в случае с сильно замещенными диенами, очень громоздкими диенофилами или обратимыми реакциями (как и в случае с фураном в качестве диена), стерические эффекты могут переопределить нормальную эндоэктивность в пользу изомера EXO .
Диен
[ редактировать ]Диен - компонент реакции Diels-Alder может быть либо открытой цепью, либо циклическим, и он может размещать множество различных типов заместителей. [ 6 ] Однако он должен быть в состоянии существовать в конформации S- цис , поскольку это единственный конформер, который может участвовать в реакции. Хотя Butadienes, как правило, более стабильны в конформации S- транс , для большинства случаев разница в энергии мала (~ 2–5 ккал/моль). [ 26 ]
Оболозный заместитель в положении C2 или C3 может увеличить скорость реакции, дестабилизируя конформацию S- транс и принуждая диен в реактивную конформацию S- цис . 2- ТЕРТ -Бутил-Бута-1,3-Диена в 27 раз больше реактивного, чем простой бутадиен. Например, [ 6 ] [ 27 ] И наоборот, диен, имеющий громоздких заместителей как в C2, так и C3, менее реактивен, поскольку стерические взаимодействия между заместителями дестабилизируют конформацию S- CIS . [ 27 ]
Диены с громоздкими терминальными заместителями (C1 и C4) снижают скорость реакции, предположительно, запуская подход диена и диенофила. [ 28 ]
Особенно реактивным диеном представляет собой 1-метокси-3-триметилсилокси-бута-1,3-диен, иначе известный как диен Данишефский . [ 29 ] Он имеет особую синтетическую полезность в качестве средств оборудования α, β-неподготовленных циклогексеноновых систем путем устранения 1-метокси заместителя после снятия защиты энола силилового эфира. Другие синтетически полезные производные данишефского диена включают 1,3-алкокси-1-триметилсилокси-1,3-бутадиены (Brassard Dienes) [ 30 ] и 1-диалкиламино-3-триметилсилокси-1,3-бутадиены (Равал диен). [ 31 ] Повышенная реакционная способность этих и аналогичных диенов является результатом синергетического вклада донорских групп в C1 и C3, что значительно повысило HOMO выше, чем у сравнимого монозамещенного диена. [ 3 ]

Нестабильные (и, следовательно, очень реактивные) диена могут быть синтетически полезны, например, o - хинодиметаны могут быть получены in situ. Напротив, стабильные диена, такие как нафталин , требуют условий воздействия и/или очень реактивных диенофилов, таких как N -фенилмалеимид . Антрацен , менее ароматный (и, следовательно, более реактивный для синтезов диельса -альтер) в его центральном кольце может образовывать аддукт 9,10 с малеиновым ангидридом при 80 ° C и даже при ацетилене , слабый диенофил, при 250 ° C. [ 32 ]
Диенофил
[ редактировать ]При нормальной реакции диельса-аль-Альдер диенофил имеет группу с электронно-гигиенными в соединении с алкеном; В сценарии обратного требования диенофил конъюгирован с группой доношения электронов. [ 9 ] Диенофилы могут быть выбраны, чтобы содержать «маскированную функциональность». Диенофил подвергается реакции Диэльса -Альдер с диеном, вводящим такую функциональность в молекулу продукта. Серия реакций затем следует, чтобы преобразовать функциональность в желательную группу. Конечный продукт не может быть сделан на одной шаге DA, потому что эквивалентный диенофил либо нереактивно, либо недоступен. Примером такого подхода является использование α-хлороакрилонитрила (CH 2 = CCLCN). При отреагировании с диеном этот диенофил внедрит функцию α-хлорнитрила в молекулу продукта. Это «маскированная функциональность», которая затем может быть гидролизована для образования кетона . α-хлороакрилонитрил диенофил является эквивалентом кетенового диенофила (CH 2 = C = O), который будет производить тот же продукт на одной стадии DA. Проблема заключается в том, что сама кетена не может использоваться в реакциях Diels -Alder, потому что она реагирует с Dienes в нежелательном образом (по [2+2] Cycloaddition), и, следовательно, следует использовать подход «маскированной функциональности». [ 33 ] Другими подобными функциями являются заместители фосфонии (вывод экзоциклических двойных связей после реакции Wittig ), различные сульфоксидные и сульфонилфункциональные функции (оба являются эквивалентами ацетилена) и нитро -группами (кетен -эквиваленты). [ 6 ]
Варианты в классической реакции Diels -Alder
[ редактировать ]Гетеродильс-возраст
[ редактировать ]Реакции Диэльса-Альдер, включающие, по крайней мере, один гетероатом также известны и коллективно называются гетеродиальсовыми реакциями. [ 34 ] карбонильные группы Например, могут успешно реагировать с диенами с получением дигидропиранских колец, реакции, известной как реакция оксодильс-альтернации , и имины могут использоваться как в качестве диенофила, либо в различных сайтах в диене, образуя различные N -Гетероциклические соединения через реакцию аза-диэлс-альтер . Соединения нитрозо (rn = o) могут реагировать с диенами с образованием оксазинов . Хлорсульфонил изоцианат может использоваться в качестве диенофила для приготовления Винса Лактама . [ 6 ] [ 35 ]
Активация кислоты Льюиса
[ редактировать ]Кислоты Льюиса , такие как хлорид цинка , трифторид бора , тетрахлорид олова или хлорид алюминия , могут катализировать реакции Дильс -Альдер путем связывания с диенофилом. Традиционно, повышенная реакционная способность Diels-Alder приписывается способности кислоты Льюиса снижать LUMO активированного диенофила, что приводит к меньшим нормальным электронным потребностям гомо-лумовой энергии и, следовательно, более стабилизирующих орбитальных взаимодействий. [ 36 ] [ 37 ] [ 38 ]
Недавние исследования, однако, показали, что это обоснование реакций, катализируемых кислотами Льюиса, неверно. [ 39 ] [ 40 ] [ 41 ] [ 42 ] Установлено, что кислоты Льюиса ускоряют реакцию Дильса -Альдер, уменьшая дестабилизирующее стерическое отталкивание Паули между взаимодействующим диеном и диенофилом, а не путем снижения энергии LUMO диенофила и, следовательно, усиления нормального орбитального взаимодействия потребности электронов. Кислота Льюиса связывается через донор-акцепторное взаимодействие с диенофилом и с помощью этого механизма поляризуется оккупированная орбитальная плотность вдали от реактивной двойной связи C = C диенофила с кислотой Льюиса. Это уменьшенная занявшая орбитальная плотность на C = C двойной связи диенофила, в свою очередь, будет привлекать менее отталкивающее орбитальное взаимодействие с закрытыми оболочкой с входящим диеном, уменьшая дестабилизирующую стерическую отталкивание Паули и, следовательно, понижает Диэльс-Диелс- Ольхно -реакционная барьер. Кроме того, кислотный катализатор Льюиса также увеличивает асинхронность реакции Дильса-Альдер, делая занятую π-орбиталь, расположенную на двойной связи C = C асимметричной диенофилов. В результате эта усиленная асинхронность приводит к дополнительному снижению дестабилизирующего стерического отталкивания Паули, а также к снижению давления на реагентов для деформации, другими словами, оно снижало дестабилизирующее штамм активации (также известную как энергия искажения). [ 43 ] Этот рабочий каталитический механизм известен как паули, снижающий катализ , [ 44 ] который работает в различных органических реакциях. [ 45 ] [ 46 ] [ 47 ]
Первоначальное обоснование, стоящие за реакциями Diels-Alder, неверно, неверно, неверно, неверно, неверно, [ 39 ] [ 48 ] [ 49 ] [ 50 ] Поскольку помимо снижения энергии Lumo диенофила, кислота Льюиса также снижает энергию гомо диенофила и, следовательно, увеличивает обратную энергию электронного потребления Lumo-Homo. Таким образом, действительно, кислотные катализаторы Льюиса укрепляют нормальное орбитальное взаимодействие в области потребления электронов, снижая LUMO диенофила, но они одновременно ослабляют обратное взаимодействие по потребностям электронов, также снижая энергию гомо диенофила. Эти два противодействующих явления эффективно отменяют друг друга, что приводит к почти неизменным орбитальным взаимодействиям по сравнению с соответствующими некатализированными реакциями Diels-Alder и делая это не активным механизмом, катализируемым кислотой, кислотой, акислойной реакции Lewis.
Асимметричный Дильс -Альдер
[ редактировать ]Было разработано много методов для влияния на стереоселективность реакции Diels -Alder, такую как использование хиральных вспомогательных услуг, катализ хиральных кислот Льюис, кислоты Lewis , [ 51 ] и небольшие катализаторы органических молекул . [ 6 ] Evans 'oxazolidinones , [ 52 ] oxazaborolidines , [ 53 ] [ 54 ] [ 55 ] бис -оксазолин –copper хелаты , [ 56 ] имидазолин катализ, [ 57 ] и существуют многие другие методологии для эффективности реакций диастерео- и энантиоселективных диельс-альтер.
Hexadehydro Diels - Alder
[ редактировать ]В -диельса -альдер реакции гексадегидро используются алкины и диины вместо алкенов и диен, образуя нестабильный промежуточный бензин , который затем может быть пойман в ловушку для формирования ароматического продукта. Эта реакция позволяет образовать сильно функционализированные ароматические кольца за один шаг. [ 58 ] [ 59 ]
Приложения и естественное явление
[ редактировать ]
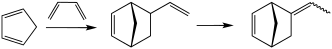
Реакция ретро-дилеров-Альдер используется в промышленном производстве циклопентадиена . Циклопентадиен является предшественником различных норборн , которые являются общими мономерами . Реакция Diels -Alder также используется в производстве витамина B6 .
История
[ редактировать ]
Работа Diels и Alder описана в серии из 28 статей, опубликованных в Юстусе Liebigs Annalen Der Chemie и Berichte der Deutschen Chemischen Gesellschaft с 1928 по 1937 год. Первые 19 статей были написаны Diels and Older, в то время как поздние статьи были авторы. Диэльсом и различными другими соавторами. [ 62 ] [ 63 ]
Приложения в общем синтезе
[ редактировать ]Реакция Дильса -Альдер была одним из стадий в раннем приготовлении стероидов кортизона и холестерина . [ 64 ] Реакция включала добавление бутадиена к хинону.
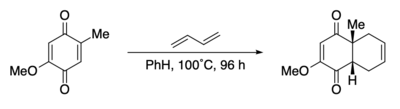
Реакции Diels -Alder были использованы в исходном синтезе простагландинов F2α и E2 . [ 65 ] Реакция Diels -Alder устанавливает относительную стереохимию трех смежных стереоцентров на ядре простагландина. Льюиса активация кислым тетрафлюороборатом Требовалась .

Реакция Диэльса -Альдер была использована в синтезе дизодий префената , [ 66 ] Биосинтетический предшественник аминокислот фенилаланина и тирозина .
Синтез резерпины использует реакцию Diels -Alder, чтобы установить цис -декалиновую структуру колец D и E. [ 67 ]
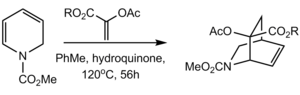
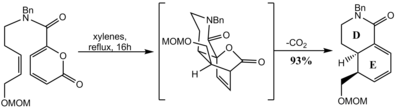
В другом синтезе резерпина цис -просеянные D и E кольца были образованы реакцией Diels -Alder. Внутримолекулярный дильс -Альдер пиранона внизу с последующей экструзией углекислого газа через ретро [4+2] дал бициклический лактам . Эпоксидирование от менее затрудненного α -лика, за которым следует открытие эпоксида в менее затрудненном C18, обеспечивало желаемую стереохимию на этих позициях, в то время как цис -фьюзия была достигнута с гидрированием, в основном исходя из менее затрудненной лица. [ 68 ]
Пиранон также использовался в качестве диенофила в общем синтезе таксола . [ 69 ] Межмолекулярная реакция гидрокси-пирона и α, β-несыщенного эфира, показанного ниже, страдала от плохого урожая и региоселективности; Однако при режиссере фенилбороновой кислотой [ 70 ] Желаемый аддукт может быть получен с выходом 61% после расщепления бороната с неопентиловым гликолем . Стереоспецифичность реакции Diels -Alder в этом случае позволила определить четыре стереоцентра, которые были перенесены на конечный продукт.

Реакция Diels-Alder является ключевым этапом в синтезе (-)-фурахиноцина C. [ 71 ]

Таберсон был подготовлен реакцией Диэльса -Альдер, чтобы установить относительную стереохимию цис -анахимии алкалоидного ядра. Преобразование цис -альдегида в его соответствующий алкен с помощью олефинации с остротой и последующего метатезиса, закрывающего кольцо, с катализатором Schrock дало второе кольцо алкалоидного сердечника. Диен в этом случае заметен как пример 1-амино-3-силоксибутадиена, иначе известного как равал диена. [ 72 ]

(+)-Стерпурен может быть получен с помощью асимметричной реакции DA [ 73 ] Это показала замечательную внутримолекулярную реакцию Diels -Alder of Allene . тиофенильной [2,3] -сигматропная перестройка группы с получением сульфоксида, как показано ниже, происходило энантиоспецифически из-за предопределенной стереохимии проционального спирта. Таким образом, сформированный одиночный изомер Аллен может направить реакцию Диэльса -Альдер, возникающую только на одной поверхности генерируемого «диена».

Тетрациклическое ядро антибиотика (-)-тетрациклина готовили с реакцией Diels-Alder. Термически инициированное, конротационное открытие бензоциклобутен, генерировало о -квинодиметан, который реагировал межмолекулярно с получением скелета тетрациклина. Свободная гидроксильная группа диенофила является неотъемлемой частью успеха реакции, поскольку гидроксиловые варианты не реагировали в нескольких различных условиях реакции. [ 74 ]

Takemura et al. Синтезированный кантаридин в 1980 году реакцией Дильса -Альдер, используя высокое давление. [ 75 ]
Синтетические применения реакции Diels -Alder были подробно рассмотрены. [ 76 ] [ 77 ] [ 78 ] [ 79 ] [ 80 ]
Смотрите также
[ редактировать ]- Bradsher Cycloaddition
- Реакция Вагнер-Джаурегга
- Имин Диэльс -Альдер Реакция
- Аза-диельс-Альдер Реакция
Ссылки
[ редактировать ]- ^ Kloetzel, MC (1948). «Реакция Дильса -Альдер с малеиновым ангидридом». Органические реакции . Тол. 4. С. 1–59. doi : 10.1002/0471264180.or004.01 . ISBN 978-0471264187 .
- ^ Холмс, HL (1948). «Реакция Diels-Alder этилен и ацетиленовые диенофилы». Органические реакции . Тол. 4. С. 60–173. doi : 10.1002/0471264180.or004.02 . ISBN 978-0471264187 .
- ^ Jump up to: а беременный Nicolaou, KC; Снайдер, SA; Montagnon, T.; Vassilikogiannakis, G. (2002). «Реакция Дильса-Альдер в полном синтезе». Angewandte Chemie International Edition . 41 (10): 1668–1698. doi : 10.1002/1521-3773 (20020517) 41:10 <1668 :: Aid-Anie1668> 3.0.co; 2-z . PMID 19750686 .
- ^ Atilla Tasdelen, Mehmet (2011). «Diels - Alder». Нажмите «Реакции: последние приложения в полимерах и материальной науке». Полимерная химия . 2 (10): 2133–2145. doi : 10.1039/c1py00041a .
- ^ Zweifel, GS; Нанц, MH (2007). Современный органический синтез: введение . W. H. Freeman и Co. ISBN 978-0-7167-7266-8 .
- ^ Jump up to: а беременный в дюймовый и фон глин Кэри , часть Б., с. 474–526
- ^ Jump up to: а беременный Dewar, MJ; Оливелла, с.; Стюарт, JJ (1986). «Механизм реакции Дильса-Альдер: реакции бутадиена с этиленом и цианоэтиленом». Журнал Американского химического общества . 108 (19): 5771–5779. doi : 10.1021/ja00279a018 . PMID 22175326 .
- ^ Jump up to: а беременный в Кэри , часть А., с. 836–50
- ^ Jump up to: а беременный Кэри , часть А., с. 839
- ^ Гаевски, JJ; Петерсон, КБ; Кагел, младший (1987). «Изменение структуры переходного состояния в реакции Diels-Alder от вторичного дейтерийного кинетического изотопного эффекта: реакция почти симметричного диена и диенофила почти синхронна». Журнал Американского химического общества . 109 (18): 5545–5546. doi : 10.1021/ja00252a052 .
- ^ Houk, Kn; Лин, YT; Браун, FK (1986). «Свидетельство о согласованном механизме реакции диельса -альтер -бутадиена с этиленом». Журнал Американского химического общества . 108 (3): 554–556. doi : 10.1021/ja00263a059 . PMID 22175504 .
- ^ Гольдштейн, E.; Бено, Б.; Houk, KN (1996). «Прогнозирование теории функционала плотности относительных энергий и изотопных эффектов для согласованных и пошаговых механизмов реакции диельс -альтер от бутадиена и этилена». Журнал Американского химического общества . 118 (25): 6036–6043. doi : 10.1021/ja9601494 .
- ^ Breslow, R.; Го, Т. (1988). «Реакции Diels-Alder в неакезных полярных растворителях. Кинетические эффекты хаотропных и антихаотропных агентов и β-циклодекстрина». Журнал Американского химического общества . 110 (17): 5613–5617. doi : 10.1021/ja00225a003 .
- ^ Jump up to: а беременный Rideout, DC; Бреслоу Р. (1980). «Гидрофобное ускорение реакций Дильса-Альдер». Журнал Американского химического общества . 102 (26): 7816–7817. doi : 10.1021/ja00546a048 .
- ^ Breslow, R.; Риццо, CJ (1991). «Эффекты хаотропной соли в гидрофобно -ускоренной реакции Diels -Alder». Журнал Американского химического общества . 113 (11): 4340–4341. doi : 10.1021/ja00011a052 .
- ^ Blokzijl, Wilfried; Engberts, Jan Bfn (1992). «Влияние начального государства и переходного государства на реакции Diels-Alder в воде и смешанных водных растворителях». Журнал Американского химического общества . 114 (13): 5440–5442. doi : 10.1021/ja00039a074 .
- ^ Эшби, ЕС; Chao, L.-C.; Neumann, HM (1973). «Механизмы органометаллической реакции. XII. Механизм добавления бромида метилмагности к бензонитрилам». Журнал Американского химического общества . 95 (15): 4896–4904. doi : 10.1021/ja00796a022 .
- ^ Флеминг, И. (1990). Пограничные орбитальные и органические химические реакции . Чичестер, Великобритания: Wiley. ISBN 978-0471018193 .
- ^ Кирсс, W.; Mönch, D. (1991). «Поверхность 1.4.4 и 2,2,5 триметилбицикло [3.2.1] катионов Oct-6-OL». Химические отчеты . 124 (1): 237–240. Doi : 10.1002/cber.19911240136 .
- ^ Bérubé, G.; Deslongchamps, P. (1987). «Ациклическая стереоселекция-5,5: синтез оптически активной боковой цепи витамина Е». Бюллетень Франционного химического общества . 1 : 103–115.
- ^ Houk, Kn; Luskus, LJ (1971). «Влияние стерических взаимодействий на эндо -стереоселективность». Журнал Американского химического общества . 93 (18): 4606–4607. doi : 10.1021/ja00747a052 .
- ^ Kobuke, y.; Sugimoto, T.; Furukawa, J.; Фуэно Т. (1972). «Роль привлекательных взаимодействий в эндо -эксоэлектрических стереоселективности реакций Дильса -Альдер». Журнал Американского химического общества . 94 (10): 3633–3635. doi : 10.1021/ja00765a066 .
- ^ Уильямсон, Кл; HSU, Y.-FL (1970). «Стереохимия реакции Дильса-Альдер. II. Кислотный катализ Льюиса изомерии син-анти». Журнал Американского химического общества . 92 (25): 7385–7389. doi : 10.1021/ja00728a022 .
- ^ Вудворд, РБ; Хоффманн Р. (22 октября 2013 г.). Сохранение орбитальной симметрии . Вайнхайм. ISBN 9781483282046 Полем OCLC 915343522 .
{{cite book}}: CS1 Maint: местоположение отсутствует издатель ( ссылка ) - ^ Wannere, Chaitanya S.; Пол, Анкан; Рейнер, Рейнер; Houk, Kn; Шефер, Генри Ф.; Шлейер, Пол фон Рагуэ (2007). «Существование вторичных орбитальных взаимодействий». Журнал вычислительной химии . 28 (1): 344–361. doi : 10.1002/jcc.20532 . ISSN 1096-987X . PMID 17109435 . S2CID 26096085 .
- ^ Кэри , часть А, с. 149
- ^ Jump up to: а беременный Бакер, HJ (1939). «2,3-дитетиобутилбутадиен». Сбор химических работ в Нидерландах . 58 (7): 643–661. Doi : 10.1002/recl .
- ^ Крейг, Д.; Шипман, JJ; Фаулер, РБ (1961). «Скорость реакции малеинового ангидрида с 1,3-диенами, связанными с конформацией диена». Журнал Американского химического общества . 83 (13): 2885–2891. doi : 10.1021/ja01474a023 .
- ^ Danishefsky, S.; Китахара Т. (1974). «Полезный диен для реакции Дильса -Альдер». Журнал Американского химического общества . 96 (25): 7807–7808. doi : 10.1021/ja00832a031 .
- ^ Savard, J.; Brassard, P. (1979). «Региоспецифические синтезы хинонов с использованием винилкетовых ацеталов, полученных из ненасыщенных сложных эфиров». Тетраэдр буквы . 20 (51): 4911–4914. doi : 10.1016/s0040-4039 (01) 86747-2 .
- ^ Козмин, SA; Равал, В.Х. (1997). «Подготовка и реакционная способность Diels-Alder 1-амино-3-силокси-1,3-бутадиены». Журнал органической химии . 62 (16): 5252–5253. doi : 10.1021/jo970438q .
- ^ Маргарета Аврам (1983). Органическая химия с. Издательство Академии Социалистической Республики Румыния
- ^ Ranganathan, S.; Ранганатан, Д.; Мехротра, А.К. (1977). «Кетен -эквиваленты». Синтез . 1977 (5): 289–296. doi : 10.1055/s-1977-24362 . S2CID 260335918 .
- ^ Roush, WR (1991). «Внутримолекулярные реакции Диэльса -Альдер». В Тросте, BM; Флемминг, И. (ред.). Комплексный органический синтез . Тол. 5. С. 513–550. doi : 10.1016/b978-0-08-052349-1.00131-1 . ISBN 978-0-08-052349-1 .
- ^ Грико, Пенсильвания; Ларсен, SD (1990). «Реакции Diels-Alder на основе ионов на основе ионов: N-бензил-2-азанорборен» (PDF) . Органические синтезы . 68 : 206. doi : 10.15227/orgsyn.068.0206 .
- ^ Хук, Кендалл Н. (1 ноября 1975 г.). «Пограничная молекулярная Орбитальная теория реакций циклоадрирования» . Счета химических исследований . 8 (11): 361–369. doi : 10.1021/ar50095a001 . ISSN 0001-4842 .
- ^ Флеминг, Ян (2009). Молекулярные орбитали и органические химические реакции . Чичестер, Западный Суссекс, Великобритания: Wiley. ISBN 9780470746592 .
- ^ Клейден, Джонатан (2012). Органическая химия (2 -е изд.). Оксфорд: издательство Оксфордского университета. ISBN 9780199270293 .
- ^ Jump up to: а беременный Vermeeren, Pascal; Хэмлин, Тревор А.; Фернандес, Израиль; Bickelhaupt, F. Matthias (6 апреля 2020 года). «Как кислоты Льюиса катализируют реакции Дильса -Альдер» . Angewandte Chemie International Edition . 59 (15): 6201–6206. doi : 10.1002/anie.201914582 . PMC 7187354 . PMID 31944503 .
- ^ Vermeeren, Pascal; Хэмлин, Тревор А.; Фернандес, Израиль; Bickelhaupt, F. Matthias (2020). «Происхождение повышения скорости и асинхронности в реакциях Diels -Alder катализировала иминия» . Химическая наука . 11 (31): 8105–8112. doi : 10.1039/d0sc02901g . PMC 8163289 . PMID 34094173 .
- ^ Vermeeren, Pascal; Хэмлин, Тревор А.; Bickelhaupt, F. Matthias; Фернандес, Израиль (17 марта 2021 г.). «Бифункциональная водородная связь, катализируемая донорами, реакции Diels -Alder: происхождение стереоселективности и повышения скорости» . Химия: европейский журнал . 27 (16): 5180–5190. doi : 10.1002/chem.202004496 . PMC 8049058 . PMID 33169912 .
- ^ Vermeeren, Pascal; Тицца, Марко Далла; Dongen, Мишель; Фернандес, Израиль; Bickelhaupt, F. Matthias; Хэмлин, Тревор А. (21 июля 2021 г.). «Реакции Lewis с кислотой, катализируемые Diels -Alder: тенденции реактивности в периодической таблице» . Химия: европейский журнал . 27 (41): 10610–10620. doi : 10.1002/chem.202100522 . PMC 8360170 . PMID 33780068 .
- ^ Vermeeren, Pascal; Хэмлин, Тревор А.; Bickelhaupt, F. Matthias (2021). «Происхождение асинхронности в реакциях Дильса -Альдер» . Физическая химия химическая физика . 23 (36): 20095–20106. Bibcode : 2021pccp ... 2320095V . doi : 10.1039/d1cp02456f . PMC 8457343 . PMID 34499069 .
- ^ Хэмлин, Тревор А.; Bickelhaupt, F. Matthias; Фернандес, Израиль (20 апреля 2021 года). «Концепция снижения отталкивания Паули в катализе» (PDF) . Счета химических исследований . 54 (8): 1972–1981. doi : 10.1021/acs.accounts.1c00016 . HDL : 1871.1/A0090B38-9AB8-4C32-9D9A-B3D5DE4E5ED3 . ISSN 0001-4842 . PMID 33759502 . S2CID 232337915 .
- ^ Vermeeren, Pascal; Бринкхайс, Франсин; Хэмлин, Тревор А.; Bickelhaupt, F. Matthias (апрель 2020 г.). «Как щелочные катионы катализируют ароматические реакции Diels -Alder» . Химия: азиатский журнал . 15 (7): 1167–1174. doi : 10.1002/Asia.202000009 . PMC 7187256 . PMID 32012430 .
- ^ Хансен, Томас; Vermeeren, Pascal; Йошисада, Ryoji; Филиппов, Дмитрий В.; Van der Mary, Gijsbert A.; Код, Jeroen DC; Хэмлин, Тревор А. (19 февраля 2021 г.). «Как кислоты Льюиса катализируют кольцевые открытия оксида циклогекса » Журнал органической химии 86 (4): 3565–3573. Doi : 10.1021/ acs.joc.0c02955 PMC 7901664 33538169PMID
- ^ Tiekink, Eveline H.; Vermeeren, Pascal; Bickelhaupt, F. Matthias; Хэмлин, Тревор А. (7 октября 2021 г.). «Как кислоты Льюиса катализируют реакции ENE». Европейский журнал органической химии . 2021 (37): 5275–5283. doi : 10.1002/ejoc.202101107 . HDL : 2066/241097 . S2CID 239089361 .
- ^ Vermeeren, Pascal; Хэмлин, Тревор А.; Фернандес, Израиль; Bickelhaupt, F. Matthias (2020). «Происхождение повышения скорости и асинхронности в реакциях Diels -Alder катализировала иминия» . Химическая наука . 11 (31): 8105–8112. doi : 10.1039/d0sc02901g . PMC 8163289 . PMID 34094173 .
- ^ Vermeeren, Pascal; Хэмлин, Тревор А.; Bickelhaupt, F. Matthias; Фернандес, Израиль (17 марта 2021 г.). «Бифункциональная водородная связь, катализируемая донорами, реакции Diels -Alder: происхождение стереоселективности и повышения скорости» . Химия: европейский журнал . 27 (16): 5180–5190. doi : 10.1002/chem.202004496 . PMC 8049058 . PMID 33169912 .
- ^ Vermeeren, Pascal; Тицца, Марко Далла; Dongen, Мишель; Фернандес, Израиль; Bickelhaupt, F. Matthias; Хэмлин, Тревор А. (21 июля 2021 г.). «Реакции Lewis с кислотой, катализируемые Diels -Alder: тенденции реактивности в периодической таблице» . Химия: европейский журнал . 27 (41): 10610–10620. doi : 10.1002/chem.202100522 . PMC 8360170 . PMID 33780068 .
- ^ Уайт, Джеймс Д.; Шоу, Субрата (2011). «Цис-2,5-диаминобицикло [2.2.2] октатан, новый каркас для асимметричного катализа через комплексы Салленалала». Орг Летал 13 (9): 2488–91. doi : 10.1021/ol2007378 . PMID 21462988 .
- ^ Эванс, да; Чепмен, KT; Бисаха, Дж. (1988). «Асимметричные реакции циклического цикла диэльса с хиральными α, β-без насыщенными N-ацилоксазолидинонами». Журнал Американского химического общества . 110 (4): 1238–1256. doi : 10.1021/ja00212a037 .
- ^ Кори, EJ; Лох, Т.П. (1991). «Первое применение привлекательных внутримолекулярных взаимодействий к дизайну хиральных катализаторов для высокоэнантиоселективных реакций диельса -альтер». Журнал Американского химического общества . 113 (23): 8966–8967. doi : 10.1021/ja00023a066 .
- ^ Кори, EJ; Shibata, T.; Ли, Т.В. (2002). «Асимметричные реакции Diels-Alder, катализируемые трифлической кислотой, активированной хиральным оксаборолидином». Журнал Американского химического общества . 124 (15): 3808–3809. doi : 10.1021/ja025848x . PMID 11942799 .
- ^ Рю, DH; Кори, EJ (2003). «Трифлимидная активация хирального оксазаборолидина приводит к более общей каталитической системе для энантиоселективного добавления Diels-Alder». Журнал Американского химического общества . 125 (21): 6388–6390. doi : 10.1021/ja035393r . PMID 12785777 .
- ^ Джонсон, JS; Эванс, Д.А. (2000). «Хиральные бис (оксазолиновые) комплексы меди (II): универсальные катализаторы для энантиоселективной циклической обработки, Альдола, Майкла и карбонильных ЭНЕ». Счета химических исследований . 33 (6): 325–335. doi : 10.1021/ar960062n . PMID 10891050 .
- ^ Арендт, Ка; Бортс, CJ; Macmillan, DWC (2000). «Новые стратегии органического катализа: первая высоко энантиоселективная реакция органокаталитических дильс -альтер». Журнал Американского химического общества . 122 (17): 4243–4244. doi : 10.1021/ja000092s .
- ^ Хой, Тр; Baire, B.; Niu, D.; Willoughby, ph; Вудс, BP (2012). «Реакция гексадегидро-диеля-Альдер» . Природа . 490 : 208–212. doi : 10.1038/nature11518 . PMC 3538845 .
- ^ Fluegel, Lucas L.; Хой, Томас Р. (2021). «Реакция гексадегидро-диеля-Альдер: генерация Бензина посредством циклоизомеризации привязанных трин» . Химический Преподобный 121 (4): 2413–2444. doi : 10.1021/acs.chemrev.0c00825 . PMC 8008985 .
- ^ Минами, Ацуши; Oikawa, Hideaki (2016). «Недавние достижения диельса -альдераз, участвующих в биосинтезе природных продуктов» . Журнал антибиотиков . 69 (7): 500–506. doi : 10.1038/ja.2016.67 . PMID 27301662 . S2CID 30482282 .
- ^ Behr, Arno (2000). «Органометаллические соединения и гомогенный катализ». Энциклопедия промышленной химии Уллмана . doi : 10.1002/14356007.a18_215 . ISBN 978-3527306732 .
- ^
- Diels, O.; Олдер, К. (1928). «Синтез в гидроароматическом серии, I. Связь: поиск« ди-эн »углеводородов». Юстус Либигс Анналы химии . 460 : 98–122. Doi : 10.1002/jlac.19284600106 .
- Diels, O.; Олдер, К. (1929). «Синтез в гидроароматическом серии, II. Коммуникация: о кантаридине». Отчеты немецкого химического общества . 62 (3): 554–562. Doi : 10.1002/cber.19290620318 .
- Diels, O.; Олдер, К. (1929). «Синтез в гидроароматических рядах, III. Коммуникация: синтез терпенов, камферов, гидроароматических и гетероциклических систем. Юстус Либигс Анналы химии . 470 : 62-103. Doi : 10.1002/jlac.19294700106 .
- Diels, O.; Олдер, К. (1929). «Синтез в гидроароматических сериях, iv. Коммуникация: о прикреплении живописи кислотно-ангидрида к арилированной порции, триена и фулвен (вместе с Полом Присом)». Отчеты немецкого химического общества . 62 (8): 2081–2087. Doi : 10.1002/cber.19290620829 .
- Diels, O.; Олдер, К. (1929). «Синтез в гидророматической серии V. О Δ4-тетрагидро-фталиновой кислоте (заявление о передаче EH Farmer и FL Warren: свойства конъюгированных двойных связей (VII)». Сообщения Германии химического общества . 62 (8) : 2087–2090. DOI : 10.1002/cber.19290620830 .
- Diels, O.; Олдер, К. (1929). «Синтез в гидроароматических рядах, vi. Communication, Kurt Alder и Gerhard Stein: о частично гидратированном нафто- и антрахиноне с водородом в положении γ или Δ (совместно с Полом Присом и Хансом Винклером)». Отчеты немецкого химического общества . 62 (8): 2337–2372. Doi : 10.1002/cber.19290620872 .
- Diels, O.; Олдер, К. (1930). "Синтез в гидроароматическом серии, vii. Юстус Либигс Анналы химии . 478 : 137–154. Doi : 10.1002/jlac.19304780109 .
- Diels, O.; Олдер, К. (1931). «Синтез в гидроароматических сериях, VIII. Коммуникация: синтез Dien Anthrac. Юстус Либигс Анналы химии . 486 : 191–202. Doi : 10.1002/jlac.19314860110 .
- Diels, O.; Олдер, К. (1931). «Синтез в гидроароматической серии, IX. Коммуникация: синтез Кэмпенилона и Сантен». Юстус Либигс Анналы химии . 486 : 202–210. Doi : 10.1002/jlac.19314860111 .
- Diels, O.; Олдер, К. (1931). «Синтез в гидроароматическом серии, X. Communication:« Dien Syntheses »︁ с Пирролом и его гомологичным». Юстус Либигс Анналы химии . 486 : 211-225. Doi : 10.1002/jlac.19314860112 .
- Diels, O.; Олдер, К. (1931). -гексадиенс и Buttadiens с ацетилендикарбоновой кислотой и его эфирами" « " Синтезирование обслуживания . Синтез в гидроароматическом серии, xi. Centification. ( "︁ des Cyclopentatienens , цикло .19314900109 .
- Diels, O.; Олдер, К. (1931). "Синтез в гидроароматическом серии, xii. Юстус Либигс Анналы химии . 490 : 243–257. Doi : 10.1002/jlac.19314900110 .
- Diels, O.; Олдер, К. (1931). "Синтез в гидроароматическом серии, xiii. Юстус Либигс Анналы химии . 490 : 257–266. Doi : 10.1002/jlac.19314900111 .
- Diels, O.; Олдер, К. (1931). "Синтезы в гидроароматическом серии, XIV. Юстус Либигс Анналы химии . 490 : 267–276. Doi : 10.1002/jlac.19314900112 .
- Diels, O.; Олдер, К. (1931). "Синтез в гидроароматической серии, XV. Юстус Либигс Анналы химии . 490 : 277–294. Doi : 10.1002/jlac.19314900113 .
- Diels, O.; Олдер, К. (1932). "Синтезы в гидроароматическом серии, XVI. Юстус Либигс Анналы химии . 498 : 1–15. Doi : 10.1002/jlac.19324980102 .
- Diels, O.; Олдер, К. (1932). «Синтез в гидроароматических сериях, XVII. Центификация. (« Служба синтеза »︁ азотсодержащий гетероринг. 5. синтезы Диена пиридина, чинолинов, хинальдинов и изохинолинов.)». Юстус Либигс Анналы химии . 498 : 16–49. Doi : 10.1002/jlac.19324980103 .
- Diels, O.; Олдер, К. (1933). «Синтез в гидроароматическом серии, xviii« dien-synthesen »︁ азотсодержащий гетероринг. 6. синтез диена пиридина. Знание чинолка. Юстус Либигс Анналы химии . 505 : 103–150. Doi : 10.1002/jlac.19335050109 .
- Diels, O.; Олдер, К. (1934). «Синтез в гидроароматическом серии, xix». Юстус Либигс Анналы химии . 510 : 87–128. Doi : 10.1002/jlac.19345100106 .
- Diels, O.; Риз, Дж. (1934). «Синтез в гидроароматических сериях, xx. О прикреплении эфиров ацетиленовой дикарбоновой кислоты гидразобензола». Юстус Либигс Анналы химии . 511 : 168–182. Doi : 10.1002/jlac.19345110114 .
- Diels, O.; Мейер, Р. (1934). «Синтез в гидроароматических сериях, XXI». Юстус Либигс Анналы химии . 513 : 129–145. Doi : 10.1002/jlac.19345130108 .
- Diels, O.; Friedrichsen, W. (1934). «Синтез в гидроароматических сериях, XXII. Об аддуктах Anthracen-C4O3, их пригодности для синтезов обязательств и новый принцип синтеза фталевых кислот и дигидро-фталиновых кислот». Юстус Либигс Анналы химии . 513 : 145–155. Doi : 10.1002/jlac.19345130109 .
- Diels, O.; Möller, F. (1935). «Синтез в гидроароматическом серии, XXIII». Юстус Либигс Анналы химии . 516 : 45–61. Doi : 10.1002/jlac.19355160104 .
- Diels, O.; Кеч, Х. (1935). «Синтез в гидроароматическом серии, XXIV« Dien Syntheses »︁ ︁-азотсодержащий гетероринг». Юстус Либигс Анналы химии . 519 : 140–146. Doi : 10.1002/jlac.19355190112 .
- Diels, O.; Риз, Дж. (1935). «Синтез в гидроароматических сериях, XXV через аддукты, изготовленные из эфира ацетиленовой дикарбоновой кислоты и соединений гидразо (2)». Юстус Либигс Анналы химии . 519 : 147–157. Doi : 10.1002/jlac.19355190113 .
- Diels, O.; Harms, J. (1935). «Синтез в гидроароматическом серии, XXVI». Юстус Либигс Анналы химии . 525 : 73–94. Doi : 10.1002/jlac.19365250107 .
- Diels, O.; Schrum, H. (1937). «Синтез в гидроароматическом серии, XXVII». Юстус Либигс Анналы химии . 530 : 68–86. Doi : 10.1002/jlac.19375300106 .
- Diels, O.; Пистор, Х. (1937). «Синтез в гидроароматических сериях, XXVIII». Юстус Либигс Анналы химии . 530 : 87–98. Doi : 10.1002/jlac.19375300107 .
- ^ «Нобелевская премия по химии 1950» . Нобелевский фонд . Получено 19 февраля 2016 года .
- ^ Вудворд, РБ; Сондхеймер, Ф.; Тауб, Д.; Heusler, K.; McLamore, Wm (1952). «Общий синтез стероидов». Журнал Американского химического общества . 74 (17): 4223–4251. doi : 10.1021/ja01137a001 .
- ^ Кори, EJ; Вайншенкер, Нью -Йорк; Schaf, TK; Хубер, В. (1969). «Стереоконтролируемый синтез простагландинов F-2A и E-2 (DL)» Журнал Американского химического общества 91 (20): 5675–7 Doi : 10.1021/ j01048a0 5808505PMID
- ^ Danishefsky, S.; Хирама, М.; Fritch, N.; Clardy, J. (1979). «Синтез дизодий префената и дизодий эпикрафената. Стереохимия префеновой кислоты и наблюдение за катализируемой основой перегруппировки префеновой кислоты в P-гидроксифенилктакно-кислоту». Журнал Американского химического общества . 101 (23): 7013–7018. doi : 10.1021/ja00517a039 .
- ^ Вендер, Пенсильвания; Schaus, JM; Уайт, AW (1980). «Общая методология для синтеза цис-гидровинолина: синтез резерпина». Журнал Американского химического общества . 102 (19): 6157–6159. doi : 10.1021/ja00539a038 .
- ^ Мартин, SF; Rueger, H.; Уильямсон, SA; Grzejszczak, S. (1987). «Общие стратегии синтеза индольных алкалоидов. Общий синтез (±) -резерпина и (±) -α-йогимбин». Журнал Американского химического общества . 109 (20): 6124–6134. doi : 10.1021/ja00254a036 .
- ^ Nicolaou, KC; Ян, Z.; Лю, JJ; Ueno, H.; NanTermet, pg; Парень, RK; Claiborne, cf; Renaud, J.; Куладурос, EA; Paulvannann, K.; Соренсен, EJ (1994). «Общий синтез таксола» Природа 367 (6464): 630–4 Bibcode : 1994natur.367..630n Doi : 10.1038/ 367630A0 PMID 7906395 S2CID 4371975
- ^ Нарасака, К.; Shimada, S.; Осода, К.; Ивасава, Н. (1991). «Фенилбороновая кислота как шаблон в реакции Дильса-Альдер». Синтез . 1991 (12): 1171–1172. doi : 10.1055/s-1991-28413 .
- ^ Смит, А.Б.; Settle, JP; Dormer, PG (1995). Полем общество Американское 117 (43): 10755–10756. doi : 10.1021/ja .
- ^ Козмин, SA; Равал, VH (1998). «Общая стратегия алкалоидов аспидоспермы: эффективный, стереоконтроллированный синтез таберсонина». Журнал Американского химического общества . 120 (51): 13523–13524. doi : 10.1021/ja983198k .
- ^ Гиббс, Ра; Okamura, WH (1988). «Короткий энантиоселективный синтез (+)-стерпурен: полный внутримолекулярный перенос центрального к осевым к центральному хиральным элементам». Журнал Американского химического общества . 110 (12): 4062–4063. doi : 10.1021/ja00220a069 .
- ^ Чарест, мг; Зигель, доктор; Myers, AG (2005). «Синтез (-)-тетрациклин». Журнал Американского химического общества . 127 (23): 8292–3. doi : 10.1021/ja052151d . PMID 15941256 .
- ^ Dauben, WG; Кессель, Кр; Takemura, KH (1980). «Простой, эффективный общий синтез кантаридина через реакцию Diels-Alder высокого давления». Журнал Американского химического общества . 102 (22): 6893–6894. doi : 10.1021/ja00542a060 .
- ^ Холмс, HL (1948). «Реакция Дильса -Альдер этилена и ацетиленовые диенофилы». Органические реакции . Тол. 4. С. 60–173. doi : 10.1002/0471264180.or004.02 . ISBN 978-0471264187 .
- ^ Буц, LW; Rytina, AW (1949). «Кхиноны и другие циклены реакции Дильса -Альдер». Органические реакции . Тол. 5. С. 136–192. doi : 10.1002/0471264180.or005.03 . ISBN 978-0471264187 .
- ^ Kloetzel, MC (1948). «Реакция Дильса -Альдер с малеиновым ангидридом». Органические реакции . Тол. 4. С. 1–59. doi : 10.1002/0471264180.or004.01 . ISBN 978-0471264187 .
- ^ Heintzelman, Gr; Meigh, ir; Хорошо, ты; Weinreb, SW (2005). Imino Dienopelles. Органические реакции Тол. 65. стр. 141–599. doi : 10.1002/ 0471 ISBN 978-0471264187 .
- ^ Сиганек Э. (1984). «Интрамолекулярная реакция Дильса-Альдер». Органические реакции . Тол. 32. С. 1–374. doi : 10.1002/0471264180.or032.01 . ISBN 978-0471264187 .
Библиография
[ редактировать ]- Кэри, Фрэнсис А.; Сандберг, Ричард Дж. (2007). Усовершенствованная органическая химия: часть B: реакции и синтез (5 -е изд.). Нью -Йорк: Спрингер. ISBN 978-0387683546 .
Внешние ссылки
[ редактировать ]- [1] Английский перевод на основополагающую немецкую статью Diels и Alder 1928 года, получившая их Нобелевскую премию. Английский заголовок: «Синтезы гидроароматической серии»; Немецкий заголовок "Синтезен в der hydroaromatischen reihe".