Алкен

В органической химии или содержащий олефин представляет собой углеводород, двухуглеродную двойную алкен связь . [ 1 ] Двойная связь может быть внутренней или в терминальной позиции. Терминальные алкены также известны как α-олефины .
Международный союз чистой и прикладной химии (IUPAC) рекомендует использовать название «Алкен» только для ациклических углеводородов с одной двойной связью; Алкадиен , алкатриен и т. Д. или полиен для ациклических углеводородов с двумя или более двойными связями; Циклоалкен , циклоалкадиен и т. Д. Для циклических ; и «олефин» для общего класса - циклический или ациклический, с одной или несколькими двойными связями. [ 2 ] [ 3 ] [ 4 ]
Ациклические алкены, только с одной двойной связью и никакими другими функциональными группами (также известными как моно-эн ) не образуют серию углеводородов гомологичную с общей формулой C n H 2 N с n - a> 1 естественным числом (которое на две гидрогины меньше, чем соответствующий алкан ). Когда n составляет четыре или более, возможны изомеры , отличающиеся положением и конформацией двойной связи.
Алкены, как правило, являются бесцветными неполярными соединениями, несколько похожими на алканы, но более реактивные. Первыми несколькими членами серии являются газы или жидкости при комнатной температуре. Самый простой алкен, этилен ( C 2 H 4 ) (или «Ethene» в номенклатуре IUPAC ) является органическим соединением, производимым в крупнейшем масштабе в промышленности. [ 5 ]
Ароматические соединения часто рисуются в виде циклических алкенов, однако их структура и свойства достаточно различны, и они не классифицируются как алкены или олефины. [ 3 ] Углеводороды с двумя перекрывающимися двойными связями ( C = c = c ) называются Allenes - самой простой такого соединения сами называется Аллен , и с тремя или более перекрывающимися связями ( C = c = c = c , C = c = c = c = c и т. Д.) называются кумулентами .
Структурный изомеризм
[ редактировать ]Алкены, имеющие четыре или более атомов углерода , могут образовывать разнообразные структурные изомеры . Большинство алкенов также являются изомерами циклоалканов . Ациклические алкеновые структурные изомеры с одной двойной связью следуют: [ 6 ]
- C 2 H 4 : этилен только
- C 3 H 6 : пропилен только
- C 4 H 8 : 3 Изомеры: 1-бутен 2 - бутен ,
- C 5 H 10 : 5 Изомеры: 1-пентен , 2-пентен, 2-метил-1-бутен, 3-метил-1-бутен, 2-метил-2-бутен
- C 6 H 12 : 13 Изомеры: 1-гексен, 2-гексен, 3-гексен, 2-метил-1-пентен, 3-метил-1-пентен, 4-метил-1-пентен, 2-метил-2- Пентен, 3-метил-2-пентен, 4-метил-2-пентен, 2,3-диметил-1-бутен, 3,3-диметил-1-бутен, 2,3-диметил-2-бутен, 2- этил-1-бутен
Многие из этих цис -изомеризм молекул демонстрируют . Также могут быть хиральные атомы углерода, особенно в больших молекулах (из C 5 ). Количество потенциальных изомеров быстро увеличивается с дополнительными атомами углерода.
Структура и связь
[ редактировать ]Связывание
[ редактировать ]
Двойная двойная связь углерода -углерода состоит из сигма -связи и облигации PI . Эта двойная связь сильнее одной ковалентной связи (611 кДж / моль для C = C против 347 кДж / моль для C - C), [ 1 ] но не вдвое сильнее. Двойные связи короче отдельных связей со средней длиной связей 1,33 Å (133 вечера ) против 1,53 Å для типичной отдельной связи CC. [ 7 ]
Каждый атом углерода двойной связи использует три SP 2 Гибридные орбитали для формирования сигма -связей с тремя атомами (другой атом углерода и два атома водорода). Неусибридированные атомные орбитали 2p, которые лежат перпендикулярно плоскости, созданной осей трех SP 2 Гибридные орбитали, объедините, чтобы сформировать связь PI. Эта связь находится за пределами основной оси C - C, с половиной связи на одной стороне молекулы с половиной на другой. При силе 65 ккал/моль связь ПИ значительно слабее, чем сигма -связь.
Вращение в отношении двухуглеродной двойной связи ограничено, потому что оно несет энергетическую стоимость, чтобы сломать выравнивание P -орбиталей на двух атомах углерода. Следовательно, цис или транс -изомеры взаимодействуют настолько медленно, что их можно свободно обрабатывать в условиях окружающей среды без изомеризации. Более сложные алкены могут быть названы с E - Z нотацией для молекул с тремя или четырьмя различными заместителями (боковые группы). Например, из изомеров Бутене две метильные группы ( z ) -but-2 -ene (aka cis -2-butene) появляются на одной и той же стороне двойной связи и в ( e )-но-2 -ene (aka trans -2 -butene) метильные группы появляются на противоположных сторонах. Эти два изомера Бутене обладают различными свойствами.
Форма
[ редактировать ]Как и предсказывается VSEPR модели отталкивания пары электронов , молекулярная геометрия алкенов включает в себя углы связи вокруг каждого атома углерода в двойной связи около 120 °. Угол может варьироваться из -за стерического штамма, введенного в результате несвязанных взаимодействий между функциональными группами, прикрепленными к атомам углерода двойной связи. Например, угол связи C - C - C в пропилене составляет 123,9 °.
Для мостовых алкенов правило Бредта гласит, что двойная связь не может возникать у плацдарма мостовой кольцевой системы, если кольца не достаточно велики. [ 8 ] Следуя за Фосеттом и определением S как общее количество не мостовых атомов в кольцах, [ 9 ] Бициклические системы требуют S ≥ 7 для стабильности [ 8 ] и трициклические системы требуют S ≥ 11. [ 10 ]
Изомерия
[ редактировать ]В органической химии префиксы соединенных цис- и транс-транс используются для описания положений функциональных групп, прикрепленных к атомам углерода, двойной связью. На латыни цис и транс означают «на этой стороне» и »на другой стороне» соответственно. Следовательно, если функциональные группы находятся на одной и той же стороне углеродной цепи, говорят, что связь имеет цис- конфигурацию, в противном случае (т.е. функциональные группы находятся на противоположной стороне углеродной цепи), говорят, что связь имеет Трансформирование .
-
Структура цис-2-бутен
-
Структура транс-2-бутен
-
( ) -On
-
( Z ) -but-2-en
Чтобы быть цис-конфигурации, должна быть углеродная цепь, или, по крайней мере, одна функциональная группа, прикрепленная к каждому углероду, одинакова для обоих. Электронная и Z- Конфигурация может использоваться вместо этого в более общем случае, когда все четыре функциональных группа, прикрепленные к атомам углерода в двойной связи, различны. E- и Z- аббревиатура немецких слов Zusammen (вместе) и Entgegen (напротив). В электронном и Z-изомеризме каждой функциональной группе присваивается приоритет, основанный на правилах приоритета CAHN-ENGOLD-PRELOG . Если две группы с более высоким приоритетом находятся на одной и той же стороне двойной связи, связке назначается z- конфигурация, в противном случае (т.е. две группы с более высоким приоритетом находятся на противоположной стороне двойной связи), связывается e - Конфигурация. Цис -конфигурации не имеют фиксированной связи с E - и z -Configurations.
Физические свойства
[ редактировать ]Многие из физических свойств алкенов и алканов похожи: они бесцветные, неполярные и горючие. Физическое состояние зависит от молекулярной массы : как и соответствующие насыщенные углеводороды, самые простые алкены ( этилен , пропилен и бутене ) - это газы при комнатной температуре. Линейные алкены примерно от пяти до шестнадцати атомов углерода являются жидкостями, а более высокие алкены - это восковые твердые вещества. Точка плавления твердых веществ также увеличивается с увеличением молекулярной массы.
Алкены обычно имеют более сильные запахи, чем их соответствующие алканы. У этилена сладкий и затхлый запах. Известно, что напряженные алкены, в частности, такие как норборненен и транс -циклооктенов, имеют сильные, неприятные запахи, что согласуется с более сильными π -комплексами, которые они образуют с ионами металлов, включая медь. [ 11 ]
Точки кипения и плавления
[ редактировать ]Ниже приведен список точек кипения и плавления различных алкенов с соответствующими аналогами алкане и алкина. [ 12 ] [ 13 ]
| Число углероды |
Алкан | Алкен | Алкин | |
|---|---|---|---|---|
| 2 | Имя | этан | этилен | ацетилен |
| Точка плавления | −183 | −169 | −80.7 | |
| Точка кипения | −89 | −104 | −84.7 | |
| 3 | Имя | пропан | пропилен | проплин |
| Точка плавления | −190 | −185 | −102.7 | |
| Точка кипения | −42 | −47 | −23.2 | |
| 4 | Имя | бутан | 1-то | 1-то |
| Точка плавления | −138 | −185.3 | −125.7 | |
| Точка кипения | −0.5 | −6.2 | 8.0 | |
| 5 | Имя | Пентатан | 1-дюймовый | 1-пенн |
| Точка плавления | −130 | −165.2 | −90.0 | |
| Точка кипения | 36 | 29.9 | 40.1 |
Инфракрасная спектроскопия
[ редактировать ]Растяжение связи C = C даст пик поглощения IR при 1670–1600 см. −1 , в то время как изгиб связи C = C поглощается от 1000 до 650 см −1 Длина волны.
ЯМР -спектроскопия
[ редактировать ]В 1 H ЯМР -спектроскопия, водород, связанный с углеродом, прилегающим к двойным связям, будет давать Δ H 4,5–6,5 ч / млн . Двойная связь также остановит водород, прикрепленный к углеродам, прилегающим к SP 2 углероды, и это генерирует Δ H = 1,6–2. PPM пики. [ 14 ] CIS/Транс-изомеры различимы из-за различного эффекта J-связанного . Цинальные . гидрогены будут иметь константы связи в диапазоне 6–14 Гц , тогда как транс будет иметь константы связи 11–18 Гц [ 15 ]
В их 13 Спектры ЯМР из алкенов, двойные связи также оснащены углеродами, что заставляет их иметь низкий сдвиг поля. C = C Двойные связи обычно имеют химический сдвиг около 100–170 ч / млн. [ 15 ]
Сжигание
[ редактировать ]Как и большинство других углеводородов , Alkenes сгорает, давая углекислый газ и воду.
Сжигание алкенов высвобождает меньше энергии, чем сжигание той же молярности насыщенных с тем же количеством углеродов. Эта тенденция можно ясно увидеть в списке стандартной энтальпии сжигания углеводородов. [ 16 ]
| Число углероды |
Вещество | Тип | Формула | H C. Ø (KJ / Times) |
|---|---|---|---|---|
| 2 | этан | насыщенный | C 2 H 6 | −1559.7 |
| этилен | ненасыщенный | C 2 H 4 | −1410.8 | |
| ацетилен | ненасыщенный | C 2 H 2 | −1300.8 | |
| 3 | пропан | насыщенный | CH 3 CH 2 CH 3 | −2219.2 |
| пропен | ненасыщенный | CH 3 CH = CH 2 | −2058.1 | |
| проплин | ненасыщенный | CH 3 C≡CH | −1938.7 | |
| 4 | бутан | насыщенный | CH 3 CH 2 CH 2 CH 3 | −2876.5 |
| 1-то | ненасыщенный | Ch 2 = ch - ch 2 ch 3 | −2716.8 | |
| 1-то | ненасыщенный | CH®C-CH 2 CH 3 | −2596.6 |
Реакция
[ редактировать ]Алкены являются относительно стабильными соединениями, но являются более реактивными, чем алканы . Большинство реакций алкенов включают в себя дополнения к этой связи PI, образуя новые отдельные связи . Алкены служат сырью для нефтехимической промышленности, потому что они могут участвовать в широком спектре реакций, заметно полимеризация и алкилирование. За исключением этилена, алкены имеют два участка реакционной способности: Pi-связи с углеродом и углеродом и наличие аллиловых CH-центров. Первые доминируют, но аллильные сайты тоже важны.
Дополнение к ненасыщенным связям
[ редактировать ]
Гидрирование включает в себя добавление H 2, что приводит к алкане. Уравнение гидрирования этилена с образованием этана составляет:
- H 2 C = CH 2 + H 2 → H 3 C - CH 3
Реакции гидрирования обычно требуют, чтобы катализаторы увеличивали скорость их реакции . Общее количество гидрогенов, которые могут быть добавлены в ненасыщенный углеводород, зависит от степени ненасыщенности .
Подобно водороду, галогены добавляются в двойные связи.
- H 2 C = CH 2 + BR 2 → H 2 CBR - CH 2 BR
Ионы галония являются промежуточными. Эти реакции не требуют катализаторов.

Тест брома используется для проверки насыщения углеводородов. [ 17 ] Тест брома также может быть использован в качестве показания степени ненасыщенности для ненасыщенных углеводородов. Число брома определяется как грамм брома, способный реагировать с 100 г продукта. [ 18 ] Подобно гидрированию, галогенирование брома также зависит от количества π -связи. Более высокое число брома указывает на более высокую степень ненасыщенности.
Π -связи углеводородов алкенов также подвержены гидратации . Реакция обычно включает сильную кислоту в качестве катализатора . [ 19 ] Первый шаг в гидратации часто включает образование карбоката . Чистым результатом реакции станет алкоголь . Уравнение реакции для гидратации этилена составляет:
- H 2 C = CH 2 + H 2 O → H 3 C-CH 2 OH
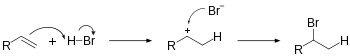
Гидрогалогенирование включает добавление H -X к ненасыщенным углеводородам. Эта реакция приводит к новым связям C - H и C -X σ. Формирование промежуточного карбоката является избирательным и следует правилу Марковникова . Гидрогалогенирование алкена приведет к галоалкану . Уравнение реакции добавления HBR на этилен:
- H 2 C = CH 2 + HBR → H 3 C - ch 2 Br Br
Цикликация
[ редактировать ]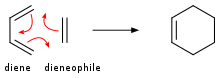
![Генерация синглетного кислорода и его [4+2] -Cycloaddition с циклопентадиеном](http://upload.wikimedia.org/wikipedia/commons/thumb/1/12/4%2B2_cycloaddition_cyclopentadiene_O2.svg/350px-4%2B2_cycloaddition_cyclopentadiene_O2.svg.png)
Алкены добавляют в Диенес, чтобы дать циклогексен . Это преобразование является примером реакции Diels-Alder . Такая реакция продолжается с сохранением стереохимии. Скорости чувствительны к электронно-сбои или электронно-донорным заместителям. При облучке ультрафиолетового света алкенов димеризируется, чтобы дать циклобутаны . [ 20 ] Другим примером является реакция Schenck ENE , в которой кислород синглета реагирует с аллильной структурой, чтобы получить транспонированную пероксид аллил :

Окисление
[ редактировать ]Алкены реагируют с перкарбоновыми кислотами и даже перекисью водорода с учетом эпоксидов :
- RCH = CH 2 + RCO 3 H → RCHOCH 2 + RCO 2 H
Для этилена эпоксидирование проводится на очень крупномасштабной промышленности с использованием кислорода в присутствии катализаторов на основе серебра:
- C 2 H 4 + 1/2 O O 2 C 2 H 4 →
Алкены реагируют с озоном, что приводит к рассеянию двойной связи. Процесс называется озонолизом . Часто процедура реакции включает в себя мягкий редуктант, такой как диметилсульфид ( МСП 2 ):
- Rch = chr ' + o 3 + sme 2 → rcho + r'cho + o = sme 2
- R 2 c = chr ' + o 3 → r 2 CHO + r'cho + o = sme 2
При обработке горячим концентрированным, подкисленным раствором KMNO 4 , Алкены расщепляются для образования кетонов и/или карбоновых кислот . Стехиометрия реакции чувствительна к условиям. Эта реакция и озонолиз могут быть использованы для определения положения двойной связи в неизвестном алкене.
Окисление может быть остановлено на вик -диоле, а не полное расщепление алкена с помощью тетроксида осмия или других окислителей:
Эта реакция называется дигидроксилированием .
При наличии соответствующего фотосенситиза , такого как метиленовый синий и свет, алкены могут подвергаться реакции с реактивными формами кислорода, генерируемыми фотосенситизером, такими как гидроксильные радикалы , синглет -кислород или супероксида ион . Реакции возбужденного сенсибилизатора могут включать электрон или перенос водорода, обычно с восстановительным субстратом (реакция I типа) или взаимодействие с кислородом (реакция типа II). [ 21 ] Эти различные альтернативные процессы и реакции могут контролироваться по выбору специфических условий реакции, что приводит к широкому спектру продуктов. Распространенным примером является [4+2]- циклическая обработка синглетного кислорода с диеном, таким как циклопентадиен, чтобы получить эндопероксид :
Полимеризация
[ редактировать ]Терминальные алкены являются предшественниками полимеров посредством процессов, называемых полимеризацией . Некоторые полимеризации имеют большое экономическое значение, поскольку они генерируют пластмассы полиэтилен и полипропилен . Полимеры из алкена обычно называют полиолефинами, хотя они не содержат олефинов. Полимеризация может продолжаться с помощью разнообразных механизмов. Составленные диена, такие как бута-1,3-диена и изопрен (2-метилбута-1,3-диена), также производят полимеры, одним из примеров является натуральный каучук.
Аллильная замена
[ редактировать ]Присутствие связи C = C π в ненасыщенных углеводородах ослабляет энергию диссоциации аллильных связей C -H. Таким образом, эти группировки восприимчивы к замене свободных радикалов на этих участках CH, а также реакциям добавления на сайте C = C. В присутствии радикальных инициаторов аллиловые связи CH могут быть галогенированы. [ 22 ] Наличие двух связей C = C, фланкирующих один метилен, то есть вдвойне аллиловый, приводит к особенно слабым связям HC-H. Высокая реакционная способность этих ситуаций является основой для определенных реакций свободных радикалов, проявляющейся в химии сушильных масел .
Метатезис
[ редактировать ]Алкены подвергаются метатезису олефина , который расщепляет и меняет заместители алкена. Связанной реакцией является эенолиз : [ 23 ]
Металлическая комплексообразование
[ редактировать ]

Структура бис (циклооктадиен) никель (0) , металлический комплекс
В алкеновых комплексах переходных металлов алкены служат лигандами для металлов. [ 24 ] В этом случае π -электронная плотность пожертвована [ нужно разъяснения ] к металлическим орбиталям. Чем сильнее пожертвование, тем сильнее заднее соединение от металла D Orbital с π* против связывания орбитала алкена. Этот эффект снижает порядок связи алкена и увеличивает длину связи CC . Одним из примеров является сложный PTCL 3 (C 2 H 4 )] − Полем Эти комплексы связаны с механизмами катализируемых металлами реакций ненасыщенных углеводородов. [ 23 ]
Обзор реакции
[ редактировать ]| Имя реакции | Продукт | Комментарий |
|---|---|---|
| Гидрирование | Алканы | добавление водорода |
| Гидроалкенилирование | Алкены | гидрометаляция / вставка / бета-элиминация с помощью металлического катализатора |
| Реакция добавления галогена | 1,2-дихалид | Электрофильное добавление галогенов |
| Гидрогалогенирование ( Марковников ) | Haloalkanes | Добавление гидрогалических кислот |
| анти-Марковникова Гидрогалогенация | Haloalkanes | Свободные радикалы, опосредованное добавлением гидрогальных кислот |
| Гидроаминирование | амины | добавление N - h связывается через C - C Двойная связь |
| Гидроформилирование | альдегиды | Промышленный процесс, добавление CO и H 2 |
| Углевокарбоксилирование и реакция Коха | карбоновая кислота | Промышленный процесс, добавление CO и H 2 o . |
| Углерод | эфир | Промышленный процесс, добавление СО и алкоголя. |
| Алкилирование | эфир | Промышленный процесс: алкеновая алкилирующая карбоновая кислота с силикотунговой кислотой Катализатор. |
| Шарплесс Бишидроксилирование | диол | Окисление, реагент: тетроксид осмия, хиральный лиганд |
| Вудворд цис -гидроксилирование | диол | Окисление, реагенты: йод, ацетат серебра |
| Озонолиз | альдегиды или кетоны | Реагент: озон |
| Олефиновый метатезис | Алкены | Два алкена перестараются, чтобы сформировать два новых алкена |
| Реакция Дильса -Альдер | Циклогексен | Циклетка с диеном |
| Пауссон - реакция Кханда | Циклопентенны | Cycloaddition с алкином и CO |
| Гидробейный - Окидание | спирты | Реагенты: боран, затем пероксид |
| Оксимеркурация по снижению | спирты | Электрофильное добавление ацетата ртути, затем восстановление |
| ПРИНСКАЯ Реакция | 1,3-диол | электрофильное добавление с альдегидом или кетоном |
| Патерно -бючи реакция | Оксаны | Фотохимическая реакция с альдегидом или кетоном |
| Эпоксидирование | эпоксид | электрофильное добавление пероксида |
| Циклопропанация | Циклопропаны | добавление карбенов или карбеноидов |
| Гидроаацилирование | кетоны | Окислительное добавление / редуцирующее элиминацию металлическим катализатором |
| Гидрофоспинация | фосфины |
Синтез
[ редактировать ]Промышленные методы
[ редактировать ]Алкены вырабатываются углеводородным растрескиванием . Сырье в основном представляют собой компоненты конденсата натурального газа (в основном этан и пропан) в США и на Ближнем Востоке и Нафте в Европе и Азии. Алканы разбиваются на части при высоких температурах, часто в присутствии цеолитного катализатора, для получения смесью в основном алифатических алкенов и алканов с более низкой молекулярной массой. Смесь зависит от сырья и температуры и разделена дробной дистилляцией. Это в основном используется для изготовления небольших алкенов (до шести углеродов). [ 25 ]

С этим связано каталитическое дегидрирование , где алкан теряет водород при высоких температурах для получения соответствующего алкена. [ 1 ] Это обратная задача каталитического гидрирования алкенов.

Этот процесс также известен как реформация . Оба процесса являются эндотермическими и направляются к алкене при высоких температурах при энтропии .
Каталитический синтез более высоких α-алкенов (типа RCH = CH 2 ) также может быть достигнут реакцией этилена с помощью органометаллического соединения тритетилалуминия в присутствии никеля , кобальта или платины .
Элиминационные реакции
[ редактировать ]Одним из основных методов синтеза алкена в лаборатории является реакция элиминации алкилгалогенидов, спиртов и подобных соединений. Наиболее распространенным является β-элиминация с помощью механизма E2 или E1. [ 26 ] Коммерчески значимым примером является производство винилового хлорида .
Механизм E2 обеспечивает более надежный метод β-элиминации, чем E1 для большинства алкеновых синтезов. Большинство эфираций E2 начинаются с алкилгалогенида или алкилсульфонатного эфира (например, тозилат или трифлат ). Когда используется алкилгалогенид, реакция называется дегидрогалогенацией . Для несимметричных продуктов более замещенные алкены (с меньшим количеством гидрогенов, прикрепленных к c = c), имеют тенденцию преобладать (см. Правило Зейтева ). Двумя распространенными методами элиминационных реакций являются дегидрогалогенирование алкилгалогенидов и обезвоживание спиртов. Типичный пример показан ниже; Обратите внимание, что, если возможно, H является анти -уходной группой, хотя это приводит к менее стабильному Z -изомер. [ 27 ]

Алкены могут быть синтезированы из спиртов посредством обезвоживания , и в этом случае вода теряется с помощью механизма E1. Например, обезвоживание этанола производит этилен:
- CH 3 CH 2 OH → H 2 C = CH 2 + H 2 O
Алкоголь также может быть преобразован в лучшую уходную группу (например, ксантат ), чтобы позволить более мягкое синэлиминацию , такое как устранение Чугаева и устранение Грико . Связанные реакции включают в себя элиминации с помощью β-халоээтер ( синтез олефина с олефином ) и сложные эфиры ( эфирный пиролиз ). Тиокетон олефинация и фосфитный эфир объединены ( Кори-Винтер ) или тетраодид дифосфора, дезоксигенат гликоль для алкенов.
Алкены могут быть подготовлены косвенно из алкилмина . Амин или аммиак не являются подходящей уходной группой, поэтому амин сначала либо алкилирован (как в элиминации Хофманна ), либо окисляется до оксида амина ( реакция COPE ), чтобы сделать возможным гладкое элиминацию. Реакция COPE -это синэлиминация , которая происходит при или ниже 150 ° C, например: [ 28 ]

Элиминация Хофманна необычна в том смысле, что менее замещенный (не zaitsev ) алкен обычно является основным продуктом.
Алкены генерируются из сульфонов α-гало в реакции Рэмберга-Баккулунда через трехчленное промежуточное соединение кольцевого сульфона.
Синтез из карбонильных соединений
[ редактировать ]Другой важный класс методов синтеза алкена включает в себя строительство новой двухуглеродной двойной связи за счет связывания или конденсации карбонильного соединения (например, альдегид или кетон ) с карбанионом или его эквивалентом. Доиновным является конденсация Альдола . Конденсация Knoevenagel-это связанный класс реакций, которые преобразуют карбонилы в алкена. Более известные методы называются олефинациями . Реакция Wittig является иллюстративной, но известны другие связанные методы, в том числе реакция Хорнера -Вадсворта -Эммонса .
Реакция Wittig включает реакцию альдегида или кетона с реагентом Wittig (или фосфораном) типа pH 3 P = Chr для получения алкена и pH 3 P = O. Реагент Wittig само по себе легко подготовлен из трифенилфосфина и алкилгалогенида. [ 29 ]

С реакцией Виттига связана олефинация Петерсона , которая использует реагенты на основе кремния вместо фосфорана. Эта реакция позволяет выбрать E - или z -продукты. Если E требуется -Продукт, другой альтернативой является джулия олефинация , которая использует карбанион, генерируемый фенилсульфона из . на Олефинация такай основе промежуточного органохрома также обеспечивает электронные продукты. Титановое соединение, реагент Тебба , полезно для синтеза метиленовых соединений; В этом случае даже эфиры и амиды реагируют.
Пара кетонов или альдегидов может быть дезоксигенирована для генерации алкена. Симметричные алкены могут быть подготовлены из одной альдегидской или кетоновой связи с собой, используя восстановление титанового металла ( реакция МакМерри ). Если должны быть связаны разные кетоны, требуется более сложный метод, такой как реакция Бартон -Келлогг .
Один кетон также может быть преобразован в соответствующий алкен через его тозилгидразон с использованием метоксида натрия ( реакция Бамфорд -Ставена ) или алкиллит ( реакция Шапиро ).
Синтез из алкенов
[ редактировать ]Образование более длинных алкенов посредством пошаговой полимеризации более мелких, так как этилен (самый маленький алкен) является одновременно недорогим и легко доступным, причем сотни миллионов тонн производятся ежегодно. Процесс Ziegler -Natta допускает образование очень длинных цепей, например, используемых для полиэтилена . Там, где разыскиваются более короткие цепи, так как они для производства поверхностно -активных веществ процессы, включающие стадию метатезиса олефина , такие как более высокий процесс олефина , тогда важны .
Метатезис олефина также используется в коммерческом смысле для взаимосвязи этилена и 2-бутена с пропиленом. содержащий носодержащий районы и молибдена : в этом процессе: гетерогенный катализ, В этом процессе используется [ 30 ]
- CH 2 = CH 2 + CH 3 CH = CHC 3 → 2 CH 2 = CHCH 3
переходного металла Катализируемое гидровинилирование является еще одним важным процессом синтеза алкена, начиная с самого алкена. [ 31 ] Он включает в себя добавление водорода и виниловой группы (или алкенильной группы) через двойную связь.
От Алкинес
[ редактировать ]Сокращение алкинов является полезным методом стереоселективного синтеза дизамещенных алкенов. Если цис -алкен желателен, то гидрирование в присутствии катализатора Линдлара (гетерогенный катализатор, который состоит из палладия, осажденного на карбонате кальция и обрабатывается различными формами свинца), обычно используется, хотя гидролиз с последующим гидролизом обеспечивает альтернативный подход. Снижение алкина металлом натрия в жидком аммиаке дает транс -ккен. [ 32 ]

Для подготовки многозамещенных алкенов карбометаляция алкинов может привести к большому разнообразию производных алкенов.
Перестройки и связанные с ними реакции
[ редактировать ]Алкены могут быть синтезированы из других алкенов с помощью реакций перестройки . Помимо метатезиса олефина (описано выше ), много перициклических реакций, можно использовать таких как реакция ENE и перестройка COPE .

В реакции Дильса-Альдера готовится производное циклогексена из диена и реактивного или электронного алкена.
Приложение
[ редактировать ]Ненасыщенные углеводороды широко используются для производства пластмасс, лекарств и других полезных материалов.
| Имя | Структура | Использовать |
|---|---|---|
| Этилен |  |
|
| 1,3-бутадиен | 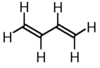 |
|
| винилхлорид |
| |
| Стирол | 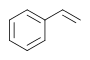 |
|
Естественное явление
[ редактировать ]Алкены распространены по своей природе. Растения являются основным естественным источником алкенов в виде терпенов . [ 33 ] Многие из самых ярких натуральных пигментов - терпены; Например, ликопин (красный в помидорах), каротин (оранжевый у моркови) и ксантофиллы (желтый в яичном желтке). Самый простой из всех алкенов, этилен является сигнальной молекулой , которая влияет на созревание растений.
- Выбранные ненасыщенные соединения в природе
-
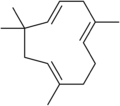
Хумулен , сесквитерпен .
IUPAC NOMENCLATURE
[ редактировать ]Хотя номенклатура не соблюдается широко, согласно IUPAC, алкен представляет собой ациклический углеводород с одной двойной связью между атомами углерода. [ 2 ] Олефины составляют большую коллекцию циклических и ациклических алкенов, а также диен и полиенов. [ 3 ]
Чтобы сформировать корень имен IUPAC для алкенов с прямой цепью, измените -An- infix родителя на -en- . Например, CH 3 -Ch 3 является алканским этаном . Название Ch 2 = CH 2 , следовательно, является Ethene .
Для алкенов с прямой цепью с 4 или более атомами углерода это имя не полностью идентифицирует соединение. Для этих случаев и для разветвленных ациклических алкенов применяются следующие правила:
- Найдите самую длинную углеродную цепь в молекуле. Если эта цепь не содержит двойную связь, назовите соединение в соответствии с правилами именования Алкане. В противном случае:
- Номер углерода в той цепочке, начиная с конца, ближе всего к двойной связи.
- Определите место k двойной связи как количество его первого углерода.
- Назовите боковые группы (кроме водорода) в соответствии с соответствующими правилами.
- Определите положение каждой боковой группы как количество углерода цепи, к которому он прикреплен.
- Напишите положение и название каждой стороны группы.
- Напишите имена Алкане с той же цепью, заменив суффикс «-Ane» на « k -ene».
Положение двойной связи часто вставляется перед именем цепи (например, «2-пентен»), а не перед суффиксом («Pent-2-ene»).
Положения не должны быть указаны, если они уникальны. Обратите внимание, что двойная связь может подразумевать другую нумерацию цепи, чем то, которая используется для соответствующей алкане: (h
3 c)
3 C - Ch
2 - гл
3- «2,2-диметилпентатан», тогда как (h
3 c)
3 C– CH = CH
2- «3,3-диметил 1-пентен».
Более сложные правила применяются для полиенов и циклоалкен . [ 4 ]

CIS - Транс -изомеризм
[ редактировать ]Если двойная связь ациклического моно-рана не является первой связью цепи, название, построенное выше, все еще не полностью идентифицирует соединение из-за цис - транс -изомеризма . Затем необходимо указать, находятся ли две одиночные связи C - C, прилегающие к двойной связи на одной и той же стороне его плоскости или на противоположных сторонах. Для моноалков, конфигурация часто обозначается префиксами CIS - (с латинской »на этой стороне«) или транса - («через», «на другой стороне») перед названием соответственно; как в цис -2 -пентен или транс -2 -бутен.

В целом, CIS - транс изомеризм будет существовать, если каждый из двух углеродов в двойной связи имеет два разных атома или группы. Учет этих случаев, IUPAC рекомендует более общую обозначения E - Z , а не в префиксах CIS и TRANS . Эта нотация рассматривает группу с самым высоким приоритетом CIP в каждом из двух углеродов. Если эти две группы находятся на противоположных сторонах плоскости двойной связи, конфигурация помечена E (из немецкого Entgegen , что означает «противоположный»); Если они находятся на одной стороне, это помечено Z (от немецкого Zusammen , «вместе»). Эта маркировка может преподаваться с помощью мнемонического « z означает» на Ze Zame Zide '». [ 34 ]

Группы, содержащие двойные связи c = c
[ редактировать ]IUPAC распознает два названия для углеводородов, содержащих двухуглеродные двойные связи, виниловую группу и группу аллила . [ 4 ]

Смотрите также
[ редактировать ]Номенклатура ссылки
[ редактировать ]- Правило A-3. Ненасыщенные соединения и одновалентные радикалы Iupac Blue Book .
- Правило A-4. Бивалентные и многовалентные радикалы Iupac Blue Book.
- Правила A-11.3, A-11.4, A-11.5 Ненасыщенные моноциклические углеводороды и заместители IUPAC Blue Book.
- Правило A-23. Гидрогенизированные соединения слитых полициклических углеводородов IUPAC Blue Book.
Ссылки
[ редактировать ]- ^ Подпрыгнуть до: а беременный в Уэйд, Л.Г. (2006). Органическая химия (6 -е изд.). Пирсон Прентис Холл . с. 279 . ISBN 978-1-4058-5345-3 .
- ^ Подпрыгнуть до: а беременный IUPAC , сборник химической терминологии , 2 -е изд. («Золотая книга») (1997). Онлайн -исправленная версия: (2006–) « Алкены ». два : 10.1351/goldbook.a00224
- ^ Подпрыгнуть до: а беременный в IUPAC , сборник химической терминологии , 2 -е изд. («Золотая книга») (1997). Онлайн -исправленная версия: (2006–) " Олефины ". два : 10.1351/goldbook.o04281
- ^ Подпрыгнуть до: а беременный в Мосс, GP; Смит, Пас; Tavernier, D. (1995). «Глоссарий классов названий органических соединений и реактивных промежуточных соединений на основе структуры (рекомендации IUPAC 1995)» . Чистая и прикладная химия . 67 (8–9): 1307–75. doi : 10.1351/pac199567081307 . S2CID 95004254 .
- ^ «Производство: рост - это норма». Химические и инженерные новости . 84 (28): 59–236. 10 июля 2006 г. DOI : 10.1021/cen-v084n034.p059 .
- ^ Слоан, Н. Дж. А. (ред.). «Последовательность A000631 (количество производных этилена с атомами углерода)» . Онлайн -энциклопедия целочисленных последовательностей . Фонд OEIS.
- ^ Смит, Майкл Б.; Март, Джерри (2007), Advanced Organic Chemistry: реакции, механизмы и структура (6-е изд.), Нью-Йорк: Wiley-Interscience, p. 23, ISBN 978-0-471-72091-1
- ^ Подпрыгнуть до: а беременный Бансал, Радж К. (1998). «Правило Бредта» . Механизмы органической реакции (3 -е изд.). McGraw-Hill Education . С. 14–16. ISBN 978-0-07-462083-0 .
- ^ Фосетт, Фрэнк С. (1950). «Правило двойных связей Бредта в структурах атомного мостичного кольца». Химический Rev. 47 (2): 219–274. doi : 10.1021/cr60147a003 . PMID 24538877 .
- ^ «Правило Бредта». Комплексные органические реакции и реагенты . Тол. 116. 2010. С. 525–8. doi : 10.1002/9780470638859.conrr1116 . ISBN 978-0-470-63885-9 .
- ^ Дуан, Сюфанг; Блок, Эрик; Ли, Чжэнь; Коннелли, Тимоти; Чжан, Цзянь; Хуан, Жимин; Su, xubo; Пан, Yi; Wu, Lifang (28 февраля 2012 г.). «Важнейшая роль меди в обнаружении металлических координационных одорантов» . Труды Национальной академии наук Соединенных Штатов Америки . 109 (9): 3492–7. Bibcode : 2012pnas..109.3492d . doi : 10.1073/pnas.1111297109 . PMC 3295281 . PMID 22328155 .
- ^ Нгуен, Трунг; Кларк, Джим (23 апреля 2019 г.). «Физические свойства алкенов» . Химия Либретлекты . Получено 27 мая 2019 года .
- ^ Ophardt, Charles (2003). «Точки кипения и структуры углеводородов» . Виртуальная химическая книга . Получено 27 мая 2019 года .
- ^ Хансон, Джон. «Обзор химических сдвигов в H-ЯМР» . Ups.edu . Получено 5 мая 2019 года .
- ^ Подпрыгнуть до: а беременный «Ядерный магнитный резонанс (ЯМР) алкенов» . Химия Либретлекты . 23 апреля 2019 года . Получено 5 мая 2019 года .
- ^ «Органические соединения: физические и термохимические данные» . ucdsb.on.ca . Получено 5 мая 2019 года .
- ^ Шрайнер, RL; Германн, CKF; Моррилл, ТК; Кертин, Да; Fuson, RC (1997). Систематическая идентификация органических соединений . Уайли. ISBN 0-471-59748-1 .
- ^ «Номер брома» . Hach Company . Получено 5 мая 2019 года .
- ^ Кларк, Джим (ноябрь 2007 г.). «Механизм кислотной катализированной гидратации этеной» . Химиид . Получено 6 мая 2019 года .
- ^ Смит, Майкл Б.; Март, Джерри (2007), Advanced Organic Chemistry: реакции, механизмы и структура (6-е изд.), Нью-Йорк: Wiley-Interscience, ISBN 978-0-471-72091-1
- ^ Baptista, Maurício S.; Курсант, Джин; Машио, Паоло ди; Гогаре, Ашвини А.; Грир, Александр; Хэмблин, Майкл Р.; Лоренте, Каролина; Нуньес, Сильвия Кристина; Рибейро, Марта Симуес; Томас, Андрес Х.; Виньони, Мариана; Йошимура, Таня Матеус (2017). «Тип I и типа II Фотосенсибилизованные реакции окисления: руководящие принципы и механистические пути» . Фотохимия и фотобиология . 93 (4): 912–9. doi : 10.1111/php.12716 . PMC 5500392 . PMID 28084040 .
- ^ Ода, Масаджи; Кавасе, Такеши; Курата, Хироюки (1996). "1,3,5-циктатри" Органические синтезы 73 : 240. DOI : 10.15227/ orgsyn.073.0
- ^ Подпрыгнуть до: а беременный Хартвиг, Джон (2010). Органотрансционная химия металла: от связи к катализу . Нью -Йорк: университетские научные книги. п. 1160. ISBN 978-1-938787-15-7 .
- ^ Торки, Роб (31 марта 2015 г.). «Алкеновые комплексы» . Органометаллический гипертекстовой книжство . Получено 29 мая 2019 года .
- ^ Уэйд, Л.Г. (2006). Органическая химия (6 -е изд.). Пирсон Прентис Холл . с. 309 . ISBN 978-1-4058-5345-3 .
- ^ Saunders, WH (1964). «Реакции элиминации в растворе». В Патае, Саул (ред.). Химия алкенов . Химия функциональных групп Патая. Wiley Interscience. С. 149–201. doi : 10.1002/9780470771044 . ISBN 978-0-470-77104-4 .
- ^ Крэм, диджей; Грин, Фредерик Д.; Depuy, Ch (1956). «Исследования в области стереохимии. XXV. Затмение эффектов в реакции E2». Журнал Американского химического общества . 78 (4): 790–6. doi : 10.1021/ja01585a024 .
- ^ Бах, Rd; Andrzejewski, Denis; Dusold, Laurence R. (1973). «Механизм устранения COPE». J. Org. Химический 38 (9): 1742–3. doi : 10.1021/jo00949a029 .
- ^ Кроуэлл, Томас И. (1964). «Алкенообразующие реакции конденсации». В Патае, Саул (ред.). Химия алкенов . Химия функциональных групп Патая. Wiley Interscience. С. 241–270. doi : 10.1002/9780470771044.CH4 . ISBN 978-0-470-77104-4 .
- ^ Делод, Лайонел; Ноэлс, Альфред Ф. (2005). «Метатезис». Кирк-Отмер Энциклопедия химических технологий . Вейнхайм: Wiley-VCH. с. Metanoel.a01. doi : 10.1002/0471238961.metanoel.a01 . ISBN 978-0-471-23896-6 .
- ^ Фогт Д. (2010). «Катализируемое кобальтом асимметричное гидровинилирование». Angew. Химический Инт. Редакция 49 (40): 7166–8. doi : 10.1002/anie.201003133 . PMID 20672269 .
- ^ Zweifel, George S.; Нанц, Майкл Х. (2007). Современный органический синтез: введение . WH Freeman. с. 366 . ISBN 978-0-7167-7266-8 .
- ^ Нинкуу, Винсент; Чжан, Лин; Ян, Цзянпей; и др. (Июнь 2021 г.). «Биохимия терпенов и последние достижения в области защиты растений» . Международный журнал молекулярных наук . 22 (11): 5710. DOI : 10.3390/IJMS22115710 . PMC 8199371 . PMID 34071919 .
- ^ МакМерри, Джон Э. (2014). Органическая химия с биологическим применением (3 -е изд.). Cengage Learning. п. 189 . ISBN 978-1-285-84291-2 .