Пертузумаб
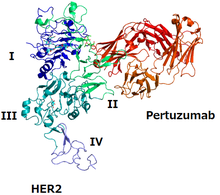 Структура HER2 и пертузумаба | |
| Моноклональное антитело | |
|---|---|
| Тип | Цельное антитело |
| Источник | Гуманизированный (от мыши ) |
| Цель | HER2 |
| Клинические данные | |
| Торговые названия | Жизнь |
| Другие имена | 2С4 |
| Данные лицензии |
|
| Беременность категория |
|
| Маршруты администрация | внутривенный |
| код АТС | |
| Юридический статус | |
| Юридический статус | |
| Идентификаторы | |
| Номер CAS | |
| Лекарственный Банк | |
| ХимическийПаук |
|
| НЕКОТОРЫЙ | |
| КЕГГ | |
| ХЭМБЛ | |
| | |
Пертузумаб , продаваемый под торговой маркой Перьета , представляет собой моноклональное антитело , используемое в сочетании с трастузумабом и доцетакселом для лечения метастатического HER2 -положительного рака молочной железы; его также использовали в той же комбинации, что и неоадъювант, при раннем HER2-положительном раке молочной железы. [ 4 ]
Побочные эффекты у более чем половины людей, принимающих его, включают диарею, выпадение волос и потерю нейтрофилов ; более 10% испытывают потерю эритроцитов , гиперчувствительность или аллергическую реакцию, инфузионные реакции, снижение аппетита, бессонницу, искажения вкусовых ощущений, воспаление рта или губ, запор, сыпь, заболевание ногтей и мышечные боли. [ 3 ] Женщинам, которые беременны или планируют забеременеть, не следует принимать его, он не изучался на людях с определенными заболеваниями сердца, поэтому у таких людей его следует применять с осторожностью, а также не следует применять с антрациклинами . [ 3 ] Неизвестно, взаимодействует ли пертузумаб с доксорубицином . [ 3 ]
Это первый в своем классе препарат, называемый « ингибитором димеризации HER » — он ингибирует димеризацию HER2 с другими рецепторами HER, что не позволяет им передавать сигналы способами, способствующими росту и пролиферации клеток. [ 6 ]
Он был открыт и разработан компанией Genentech и впервые одобрен в 2012 году. [ 7 ] [ 8 ]
Медицинское использование
[ редактировать ]Пертузумаб вводят внутривенно в сочетании с трастузумабом и доцетакселом в качестве терапии первой линии при HER2-положительном метастатическом раке молочной железы. [ 4 ] [ 3 ] Он также используется в той же комбинации, что и неоадъювант (назначается для уменьшения размера опухоли перед операцией или облучением) при HER2-положительном раннем раке молочной железы; по состоянию на 2016 год не было доказано, что такое использование увеличивает выживаемость. [ 4 ]
По состоянию на 2016 год [update]Пертузумаб не изучался у людей со значением фракции выброса левого желудочка ≤ 50% от нормы, с застойной сердечной недостаточностью в анамнезе или состояниями, которые могут ухудшить функцию левого желудочка, такими как неконтролируемая гипертензия, недавние сердечные приступы или серьезная сердечная аритмия. [ 3 ] Следует с осторожностью применять сочетание пертузумаба с антрациклином . [ 3 ] Также нет данных о безопасности применения пертузумаба в сочетании с доксорубицином . [ 3 ]
Женщинам детородного возраста во время приема пертузумаба следует использовать средства контрацепции; он может повредить плод у беременных женщин и может выделяться с грудным молоком. [ 3 ]
Побочные эффекты
[ редактировать ]В клинических исследованиях комбинированной терапии тремя препаратами при метастатическом раке молочной железы побочные эффекты, возникшие у более чем половины людей, принимавших ее, включали диарею, выпадение волос и потерю нейтрофилов ; более 10% людей испытали потерю нейтрофилов с лихорадкой и потерю лейкоцитов . [ 3 ] После отмены доцетаксела у некоторых людей наиболее частыми побочными эффектами были диарея (28,1%), инфекции верхних дыхательных путей (18,3%), сыпь (18,3%), головная боль (17,0%), утомляемость (13,4%), отек носа. проходах и горле (часто из-за простуды) (17,0%), слабость (13,4%), зуд (13,7%), боль в суставах (11,4%), тошнота (12,7%), боль в конечностях (13,4%) , боль в спине (12,1%) и кашель (12,1%). [ 3 ]
В клинических исследованиях неоадъювантного применения комбинации более чем у 50% людей наблюдалось выпадение волос и потеря нейтрофилов . [ 3 ]
При обоих применениях более 10% людей дополнительно испытывали: потерю эритроцитов , гиперчувствительность или аллергическую реакцию, инфузионные реакции, снижение аппетита, бессонницу, искажения вкусовых ощущений, воспаление рта или губ, запор, сыпь, заболевания ногтей и мышечные боли. [ 3 ]
Фармакология
[ редактировать ]Метаболизм пертузумаба непосредственно не изучался; в общем, антитела выводятся главным образом путем катаболизма . Средний клиренс пертузумаба составлял 0,235 л/день, а средний период полувыведения — 18 дней. [ 3 ]
Механизм действия
[ редактировать ]HER2 представляет собой внеклеточный рецептор ( рецепторную тирозинкиназу ), который при активации запускает передачу сигнала по нескольким путям , которые стимулируют пролиферацию и рост клеток; в случае чрезмерной экспрессии это может вызвать неконтролируемый рост. HER2-положительный рак молочной железы вызван амплификацией гена ERBB2, которая приводит к сверхэкспрессии HER2 примерно в 15-30% опухолей молочной железы. [ 9 ]
Как и многие рецепторы, HER2 для функционирования обычно объединяет другой белок (процесс, называемый димеризацией ); он может связываться со вторым рецептором HER2 (действуя как гомодимер ) и может гетеродимеризоваться с другим рецептором семейства HER . Наиболее мощным димером для активации сигнальных путей является HER2/HER3. [ 6 ]
Эпитопом . пертузумаба является домен HER2, где он связывается с HER3, а пертузумаб предотвращает образование димера HER2/HER3, что блокирует передачу сигнала этим димером [ 6 ] [ 10 ] Трастузумаб — еще одно моноклональное антитело против HER2; его эпитопом является домен, в котором HER2 связывается с другим белком HER2. [ 6 ] Два моноклональных антитела вместе препятствуют функционированию HER2. [ 6 ]
Химия и производство
[ редактировать ]Пертузумаб представляет собой иммуноглобулин G1 с вариабельной областью против человеческого белка HER2, моноклональной тяжелой цепи 2C4 человека и мыши, дисульфид связанной с моноклональной κ-цепью 2C4 человека и мыши. [ 11 ]
Он производится рекомбинантно в CHO . клетках [ 4 ]
История
[ редактировать ]Моноклональное антитело 2C4, по-видимому, впервые было опубликовано в 1990 году учеными из Genentech. [ 12 ] в том же году F. Hoffmann-La Roche AG приобрела контрольный пакет акций Genentech. [ 13 ]
К 2003 году компания Genentech поняла, что 2C4 предотвращает димеризацию HER2 с другими рецепторами HER, и начала испытания фазы I, нацеленные на широкий спектр видов рака, а не только на те, которые сверхэкспрессируют HER2. Это был первый известный ингибитор димеризации HER. [ 14 ]
В 2005 году Genentech представила плохие результаты II фазы испытаний пертузумаба в качестве монотерапии при раке простаты, молочной железы и яичников и заявила, что намерена продолжать разработку его в сочетании с другими препаратами для лечения рака яичников. [ 15 ] [ 16 ]
В 2007 году Genentech отказалась от торговой марки Omnitarg. [ 17 ] [ 18 ]
В марте 2009 года компания Roche приобрела Genentech. [ 19 ] [ 20 ]
В 2012 году были опубликованы результаты исследования CLEOPATRA, рандомизированного плацебо-контролируемого исследования III фазы по применению пертузумаба в комбинации с трастузумабом и доцетакселом при HER2-положительном метастатическом раке молочной железы. [ 21 ] Позже в том же году пертузумаб получил одобрение FDA США для лечения HER2-положительного метастатического рака молочной железы. [ 8 ] Результаты исследования фазы II неоадъювантной терапии NeoSphere, опубликованные в 2012 г. [ 22 ] и результаты исследования сердечной безопасности фазы II в той же популяции Tryphaena, опубликованные в 2013 году. [ 23 ] FDA одобрило неоадъювантное показание в 2013 году. [ 24 ]
Пертузумаб был одобрен для медицинского применения в Европейском Союзе в 2013 году. [ 3 ] [ 5 ]
Общество и культура
[ редактировать ]Экономика
[ редактировать ]По состоянию на 2016 год [update]В США каждый цикл комбинации трех препаратов, проводимый каждые три недели, стоит около 8500 долларов США , не считая затрат на вспомогательное лечение. [ 25 ]
В Великобритании оценка NICE , проведенная в 2015 году, сделала предварительный вывод о том, что комбинация препаратов не является экономически эффективной, и NICE отклонил препарат в неоадъювантной терапии в мае 2016 года, главным образом потому, что было неизвестно, обеспечивает ли комбинация препаратов улучшение выживаемости. [ 26 ] [ 27 ] [ 28 ] Впоследствии это решение было отменено шесть месяцев спустя, и пертузумаб стал первым новым препаратом от рака молочной железы, одобренным NICE для регулярного финансирования Национальной службы здравоохранения почти за десять лет. после того, как компания Roche пообещала предоставить препарат Национальной службе здравоохранения с нераскрытой скидкой для пациентов, проходящих неоадъювантную терапию, и разделить долгосрочные финансовые риски. [ 29 ]
Ссылки
[ редактировать ]- ^ Jump up to: а б «АВСТРАЛИЙСКАЯ ИНФОРМАЦИЯ О ПРОДУКТЕ – Перьета® (пертузумаб)» . Проверено 12 июля 2024 г.
- ^ «Список всех лекарств с предупреждениями о черном ящике, полученный FDA (используйте ссылки «Загрузить полные результаты» и «Просмотреть запрос»).» . nctr-crs.fda.gov . FDA . Проверено 22 октября 2023 г.
- ^ Jump up to: а б с д и ж г час я дж к л м н тот «Перьета 420 мг Концентрат для приготовления раствора для инфузий — краткая характеристика продукта (SmPC)» . (эмс) . 2 июля 2021 года. Архивировано из оригинала 3 января 2022 года . Проверено 3 января 2022 г.
- ^ Jump up to: а б с д и «Перьета-пертузумаб для инъекций, раствор, концентрат» . ДейлиМед . Архивировано из оригинала 25 марта 2021 года . Проверено 3 января 2022 г.
- ^ Jump up to: а б «Перьета ЭПАР» . Европейское агентство лекарственных средств (EMA) . 17 сентября 2018 г. Архивировано из оригинала 16 сентября 2021 г. . Проверено 3 января 2022 г.
- ^ Jump up to: а б с д и Харбек Н., Бекманн М.В., Роди А., Шневайс А., Мюллер В., Фем Т. и др. (март 2013 г.). «Ингибитор димеризации HER2 пертузумаб — механизм действия и клинические данные при раке молочной железы» . Уход за грудью . 8 (1): 49–55. дои : 10.1159/000346837 . ПМЦ 3971793 . ПМИД 24715843 .
- ^ «Пакет одобрения препарата: Перьета (пертузумаб) для инъекций, NDA № 125409» . США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) . 3 августа 2012 года. Архивировано из оригинала 3 января 2022 года . Проверено 3 января 2022 г.
- ^ Jump up to: а б «FDA одобряет препарат Перьета для лечения поздней стадии рака молочной железы» . США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) . 8 июня 2012 года. Архивировано из оригинала 1 ноября 2012 года . Проверено 3 января 2022 г.
- ^ Митри З., Константин Т., О'Риган Р. (2012). «Рецептор HER2 при раке молочной железы: патофизиология, клиническое использование и новые достижения в терапии» . Исследования и практика химиотерапии . 2012 : 743193. doi : 10.1155/2012/743193 . ПМЦ 3539433 . ПМИД 23320171 .
- ^ Бадаче А., Хайнс Н.Е. (апрель 2004 г.). «Новое терапевтическое антитело маскирует ErbB2 от своих партнеров» . Раковая клетка . 5 (4): 299–301. дои : 10.1016/s1535-6108(04)00088-1 . ПМИД 15093533 .
- ^ «Предлагаемый МНН: Список 89» (PDF) . Информация ВОЗ о лекарствах . 17 (3). 2003. Архивировано (PDF) из оригинала 9 августа 2020 года . Проверено 5 октября 2020 г.
- ^ Фендли Б.М., Вингет М., Худзиак Р.М., Липари М.Т., Нэпьер М.А., Ульрих А. (март 1990 г.). «Характеристика мышиных моноклональных антител, реагирующих либо на рецептор эпидермального фактора роста человека, либо на продукт гена HER2/neu» (PDF) . Исследования рака . 50 (5): 1550–1558. ПМИД 1689212 . Архивировано (PDF) из оригинала 29 сентября 2019 года . Проверено 2 ноября 2016 г. . , упомянутый в Молина М.А., Кодони-Серват Дж., Албанелл Дж., Рохо Ф., Аррибас Дж., Базельга Дж. (июнь 2001 г.). «Трастузумаб (герцептин), гуманизированное моноклональное антитело против рецептора Her2, ингибирует базальное и активированное расщепление эктодомена Her2 в клетках рака молочной железы» (PDF) . Исследования рака . 61 (12): 4744–4749. ПМИД 11406546 . Архивировано (PDF) из оригинала 29 сентября 2019 года . Проверено 2 ноября 2016 г. .
- ^ Фишер Л.М. (1 октября 2000 г.). «Genentech: Выживший, выставляющий напоказ свои вещи» . Нью-Йорк Таймс . Архивировано из оригинала 20 декабря 2016 года . Проверено 19 февраля 2017 г.
- ^ Албанелл Дж., Кодони Дж., Ровира А., Мелладо Б., Гаскон П. (2003). «Механизм действия моноклональных антител против Her2: научная информация о трастузумабе и 2c4». Новые тенденции в области рака в 21 веке . Достижения экспериментальной медицины и биологии. Том. 532. стр. 253–68. дои : 10.1007/978-1-4615-0081-0_21 . ISBN 978-0-306-47762-1 . ПМИД 12908564 .
- ^ «Пресс-релиз: данные клинической программы Омнитарг, представленные на собрании Американского общества клинической онкологии» . Генентек. 15 мая 2005 г. Архивировано из оригинала 6 апреля 2017 г. . Проверено 2 ноября 2016 г. .
- ^ «Омнитарг компании Genentech терпит неудачу на этапе II» . Фарма Таймс . 16 мая 2005 г. Архивировано из оригинала 24 февраля 2021 г. . Проверено 2 ноября 2016 г. .
- ^ «Исправление: письмо редакции» . Новости онкологии рака : 3 февраля 2012 г. Архивировано из оригинала 4 ноября 2016 г. Проверено 2 ноября 2016 г. .
- ^ «Пресс-релиз: Рош в первом полугодии 2007 года» . Рош. 19 июля 2007 г. Архивировано из оригинала 4 ноября 2016 г. . Проверено 2 ноября 2016 г. .
- ^ Морс А (10 мая 2006 г.). «Чугай делится хорошими оценками перспектив разработки лекарства от рака» . Уолл Стрит Джорнал . Архивировано из оригинала 20 октября 2021 года . Проверено 26 сентября 2008 г.
- ^ «Roche делает предложение на сумму 43,7 миллиарда долларов за Genentech» . Новости генной инженерии и биотехнологии . 21 июля 2008 г. Архивировано из оригинала 3 февраля 2009 г. Проверено 26 сентября 2008 г.
- ^ Базельга Дж., Кортес Дж., Ким С.Б., Им С.А., Хегг Р., Им Ю.Х. и др. (январь 2012 г.). «Пертузумаб плюс трастузумаб плюс доцетаксел при метастатическом раке молочной железы» . Медицинский журнал Новой Англии . 366 (2): 109–119. дои : 10.1056/nejmoa1113216 . ПМК 5705202 . ПМИД 22149875 .
- ^ Джанни Л., Пиенковски Т., Им Ю.Х., Роман Л., Ценг Л.М., Лю М.К. и др. (январь 2012 г.). «Эффективность и безопасность неоадъювантного пертузумаба и трастузумаба у женщин с местнораспространенным, воспалительным или ранним HER2-положительным раком молочной железы (NeoSphere): рандомизированное многоцентровое открытое исследование фазы 2». «Ланцет». Онкология . 13 (1): 25–32. дои : 10.1016/s1470-2045(11)70336-9 . ПМИД 22153890 . цитируется в Мейтс М., Флетчер Г.Г., Фридман О.К., Эйзен А., Ганди С., Трюдо М.Е., Дент С.Ф. (март 2015 г.). «Системная таргетная терапия Her2-положительного раннего рака молочной железы у женщин: систематический обзор доказательств для руководства по системной терапии Cancer Care Ontario 2014 года» . Современная онкология . 22 (Приложение 1): S114–S122. дои : 10.3747/co.22.2322 . ПМЦ 4381787 . ПМИД 25848335 .
- ^ Шневайс А., Чиа С., Хикиш Т., Харви В., Эниу А., Хегг Р. и др. (сентябрь 2013 г.). «Пертузумаб плюс трастузумаб в сочетании со стандартными неоадъювантными антрациклинсодержащими и безантрациклиновыми схемами химиотерапии у пациентов с HER2-положительным ранним раком молочной железы: рандомизированное исследование сердечной безопасности II фазы (TRYPHAENA)» . Анналы онкологии . 24 (9): 2278–2284. дои : 10.1093/annonc/mdt182 . ПМИД 23704196 .
- ^ «FDA одобрило препарат Перьета для неоадъювантного лечения рака молочной железы» . США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) (пресс-релиз). 30 сентября 2013 г. Архивировано из оригинала 10 октября 2013 г. . Проверено 3 января 2022 г.
- ^ Дурки Б.И., Цянь Ю., Поллом Э.Л., Кинг М.Т., Дадли С.А., Шаффер Дж.Л. и др. (март 2016 г.). «Экономическая эффективность пертузумаба при метастатическом раке молочной железы, положительном по рецептору 2 эпидермального фактора роста человека» . Журнал клинической онкологии . 34 (9): 902–909. дои : 10.1200/jco.2015.62.9105 . ПМК 5070553 . ПМИД 26351332 .
- ^ Флиман Н., Багуст А., Бил С., Дван К., Диксон Р., Праудлав С., Дандар Ю. (январь 2015 г.). «Пертузумаб в сочетании с трастузумабом и доцетакселом для лечения HER2-положительного метастатического или местно-рецидивирующего неоперабельного рака молочной железы». Фармакоэкономика . 33 (1): 13–23. дои : 10.1007/s40273-014-0206-2 . ПМИД 25138171 . S2CID 8470253 .
- ^ «Рак молочной железы (HER2-положительный, метастатический) - пертузумаб (с трастузумабом и доцетакселом) [ID523]» . ХОРОШИЙ. 1 сентября 2016 года. Архивировано из оригинала 4 ноября 2016 года . Проверено 2 ноября 2016 г. .
- ^ Макки С. (20 мая 2016 г.). «NICE отвергает препарат компании Roche от рака молочной железы Perjeta» . Фарма Таймс . Архивировано из оригинала 3 марта 2021 года . Проверено 2 ноября 2016 г. .
- ^ Йип А (22 ноября 2016 г.). «NICE: одобрение препарата Перьета компании Roche для лечения HER2-положительного рака молочной железы» . Фармалайв . Архивировано из оригинала 7 апреля 2017 года . Проверено 7 апреля 2017 г.
Дальнейшее чтение
[ редактировать ]- Дин Л. (2015). «Терапия пертузумабом и генотип ERBB2 (HER2)» . В Пратт В.М., МакЛеод Х.Л., Рубинштейн В.С. и др. (ред.). Краткое изложение медицинской генетики . Национальный центр биотехнологической информации (NCBI). ПМИД 28520364 . Идентификатор книжной полки: NBK315949.