Рецептор NMDA

N глутаматным -метил -d -аспартатный рецептор (также известный как рецептор NMDA или NMDAR ), является рецептором и преимущественно CA 2+ Ионный канал найден в нейронах . [ 3 ] [ 4 ] Рецептор NMDA является одним из трех типов ионотропных глутаматных рецепторов , а другие - рецепторы AMPA и каината . В зависимости от состава субъединиц, его лигандами являются глутамат и глицин (или D -серин ). Однако связывание лигандов обычно недостаточно для открытия канала, так как он может быть заблокирован MG 2+ ионы, которые удаляются только тогда, когда нейрон достаточно деполяризован. Таким образом, канал действует как «детектор совпадения», и только после того, как оба этих условия выполняются, канал открывается и позволяет положительно заряженным ионам (катионов) проходить через клеточную мембрану . [ 5 ] Считается, что рецептор NMDA очень важен для контроля синаптической пластичности и опосредования функций обучения и памяти . [ 6 ]
Рецептор NMDA является ионотропным , что означает, что это белок, который позволяет проходить ионы через клеточную мембрану. [ 7 ] Рецептор NMDA назван так, потому что агонистская молекула N -метил -D -аспартата (NMDA) избирательно связывается с ней, а не с другими рецепторами глутамата . Активация рецепторов NMDA приводит к открытию ионного канала, который является неселективным для катионов , с комбинированным потенциалом изменения около 0 мВ. В то время как открытие и закрытие ионного канала в первую очередь управляется связыванием лиганда, ток поток через ионный канал зависит от напряжения. Специально расположен на рецепторе, внеклеточный магний (мг 2+ ) и цинк (Zn 2+ ) Ионы могут связывать и предотвратить протекать другие катионы через открытый ионный канал. Зависимый от напряжения поток преимущественно кальция (CA 2+ ), sodium (Na + ) и калий (k + ) ионы в и из клетки становятся возможными благодаря деполяризации клетки, которая вытесняет и отталкивает Mg 2+ и Zn 2+ Ионы из пор. [ 8 ] [ 9 ] [ 10 ] [ 11 ] Что 2+ Поток через рецепторы NMDA, в частности, считается критическим по синаптической пластичности, клеточному механизму обучения и памяти из -за белков, которые связываются и активируются CA 2+ ионы
Активность рецептора NMDA блокируется многими психоактивными препаратами, такими как фенциклидин (PCP), алкоголь ( этанол ) и декстрометорфан (DXM). Анестетические анальгетические и также эффекты лекарств кетамина и оксида азота частично связаны с их воздействием на блокирование активности рецептора NMDA. Напротив, чрезмерная активация NMDAR агонистами NMDA увеличивает цитозольные концентрации кальция и цинка , что значительно способствует нейронной гибели , что, как известно, предотвращается каннабиноидами , опосредованным активацией рецептора 1 , CB который приводит к белку HINT1 к противодействию Токсические эффекты NMDAR-опосредованного производства NO и высвобождения цинка. [ 12 ] As well as preventing methamphetamine -induced neurotoxicity via inhibition of nitric oxide synthase (nNOS) expression and astrocyte activation, it is seen to reduce methamphetamine induced brain damage through CB1-dependent and independent mechanisms, respectively, and inhibition of methamphetamine induced astrogliosis is likely to возникает через механизм CB 2 рецепторный для ТГК . [ 13 ] С 1989 года меморандум был признан неконкурентоспособным антагонистом рецептора NMDA, входя в канал рецептора после того, как он был активирован и тем самым блокирует поток ионов. [ 14 ] [ 15 ] [ 16 ]
Переоценка рецептора, вызывая чрезмерный приток СА 2+ может привести к экситотоксичности , которая подразумевается, чтобы участвовать в некоторых нейродегенеративных расстройствах. Поэтому блокировка рецепторов NMDA может быть полезной при лечении таких заболеваний. [ 16 ] [ 17 ] [ 18 ] [ 19 ] Однако гипофункция рецепторов NMDA (из -за дефицита глутатиона или других причин) может участвовать в нарушении синаптической пластичности [ 20 ] и может иметь другие негативные последствия. Основная проблема с использованием антагонистов рецептора NMDA для нейропротекции заключается в том, что физиологическое действие рецептора NMDA необходимы для нормальной нейрональной функции. Чтобы быть клинически полезными, антагонисты NMDA должны блокировать чрезмерную активацию, не мешая нормальным функциям. Мемантин обладает этой собственностью. [ 21 ]
История
[ редактировать ]За открытием рецепторов NMDA последовало синтез и исследование N -метил -d -аспарагиновой кислоты (NMDA) в 1960 -х годах Джеффа Уоткинса и его коллег. В начале 1980 -х годов было показано, что рецепторы NMDA участвуют в нескольких центральных синаптических путях. [ 22 ] [ 23 ] Селективность субъединицы рецептора была обнаружена в начале 1990 -х годов, что привело к распознаванию нового класса соединений, которые избирательно ингибируют субъединицу NR2B . Эти результаты привели к активной кампании в фармацевтической промышленности. [ 11 ] Исходя из этого, считалось, что рецепторы NMDA были связаны с различными неврологическими расстройствами , такими как эпилепсия , Паркинсон , Альцгеймер , Хантингтон и другие расстройства CNS. [8]
In 2002, it was discovered by Hilmar Bading and co-workers that the cellular consequences of NMDA receptor stimulation depend on the receptor's location on the neuronal cell surface.[24][25] Synaptic NMDA receptors promote gene expression, plasticity-related events, and acquired neuroprotection. Extrasynaptic NMDA receptors promote death signaling; they cause transcriptional shut-off, mitochondrial dysfunction, and structural disintegration.[24][25] This pathological triad of extrasynaptic NMDA receptor signaling represents a common conversion point in the etiology of several acute and chronic neurodegenerative conditions.[26] The molecular basis for toxic extrasynaptic NMDA receptor signaling was uncovered by Hilmar Bading and co-workers in 2020.[27] Extrasynaptic NMDA receptors form a death signaling complex with TRPM4. NMDAR/TRPM4 interaction interface inhibitors (also known as interface inhibitors) disrupt the NMDAR/TRPM4 complex and detoxify extrasynaptic NMDA receptors.[27]
A fortuitous finding was made in 1968 when a woman was taking amantadine as flu medicine and experienced remarkable remission of her Parkinson's symptoms. This finding, reported by Scawab et al., was the beginning of medicinal chemistry of adamantane derivatives in the context of diseases affecting the CNS.[28] Before this finding, memantine, another adamantane derivative, had been synthesized by Eli Lilly and Company in 1963. The purpose was to develop a hypoglycemic drug, but it showed no such efficacy. It was not until 1972 that a possible therapeutic importance of memantine for treating neurodegenerative disorders was discovered. From 1989 memantine has been recognized to be an uncompetitive antagonist of the NMDA receptor.[15]
Structure
[edit]
Functional NMDA receptors are heterotetramers comprising different combinations of the GluN1, GluN2 (A-D), and GluN3 (A-B) subunits derived from distinct gene families (Grin1-Grin3). All NMDARs contain two of the obligatory GluN1 subunits, which when assembled with GluN2 subunits of the same type, give rise to canonical diheteromeric (d-) NMDARs (e.g., GluN1-2A-1-2A). Triheteromeric NMDARs, by contrast, contain three different types of subunits (e.g., GluN1-2A-1-2B), and include receptors that are composed of one or more subunits from each of the three gene families, designated t-NMDARs (e.g., GluN1-2A-3A-2A).[29] There is one GluN1, four GluN2, and two GluN3 subunit encoding genes, and each gene may produce more than one splice variant.
- GluN1 – GRIN1
- GluN2
- GluN3
Gating
[edit]
The NMDA receptor is a glutamate and ion channel protein receptor that is activated when glycine and glutamate bind to it.[5] The receptor is a highly complex and dynamic heteromeric protein that interacts with a multitude of intracellular proteins via three distinct subunits, namely GluN1, GluN2, and GluN3. The GluN1 subunit, which is encoded by the GRIN1 gene, exhibits eight distinct isoforms owing to alternative splicing. On the other hand, the GluN2 subunit, of which there are four different types (A-D), as well as the GluN3 subunit, of which there are two types (A and B), are each encoded by six separate genes. This intricate molecular structure and genetic diversity enable the receptor to carry out a wide range of physiological functions within the nervous system.[30][31] All the subunits share a common membrane topology that is dominated by a large extracellular N-terminus, a membrane region comprising three transmembrane segments, a re-entrant pore loop, an extracellular loop between the transmembrane segments that are structurally not well known, and an intracellular C-terminus, which are different in size depending on the subunit and provide multiple sites of interaction with many intracellular proteins.[30][32] Figure 1 shows a basic structure of GluN1/GluN2 subunits that forms the binding site for memantine, Mg2+ and ketamine.

Mg2+ blocks the NMDA receptor channel in a voltage-dependent manner. The channels are also highly permeable to Ca2+. Activation of the receptor depends on glutamate binding, D-serine or glycine binding at its GluN1-linked binding site and AMPA receptor-mediated depolarization of the postsynaptic membrane, which relieves the voltage-dependent channel block by Mg2+. Activation and opening of the receptor channel thus allows the flow of K+, Na+ and Ca2+ ions, and the influx of Ca2+ triggers intracellular signaling pathways.[14][33] Allosteric receptor binding sites for zinc, proteins and the polyamines spermidine and spermine are also modulators for the NMDA receptor channels.[34]
The GluN2B subunit has been involved in modulating activity such as learning, memory, processing and feeding behaviors, as well as being implicated in number of human derangements. The basic structure and functions associated with the NMDA receptor can be attributed to the GluN2B subunit. For example, the glutamate binding site and the control of the Mg2+ block are formed by the GluN2B subunit. The high affinity sites for glycine antagonist are also exclusively displayed by the GluN1/GluN2B receptor.[31]
GluN1/GluN2B transmembrane segments are considered to be the part of the receptor that forms the binding pockets for uncompetitive NMDA receptor antagonists, but the transmembrane segments structures are not fully known as stated above. It is claimed that three binding sites within the receptor, A644 on the GluNB subunit and A645 and N616 on the GluN1 subunit, are important for binding of memantine and related compounds as seen in figure 2.[32]
The NMDA receptor forms a heterotetramer between two GluN1 and two GluN2 subunits (the subunits were previously denoted as GluN1 and GluN2), two obligatory GluN1 subunits and two regionally localized GluN2 subunits. A related gene family of GluN3 A and B subunits have an inhibitory effect on receptor activity. Multiple receptor isoforms with distinct brain distributions and functional properties arise by selective splicing of the GluN1 transcripts and differential expression of the GluN2 subunits.
Each receptor subunit has modular design and each structural module, also represents a functional unit:
- The extracellular domain contains two globular structures: a modulatory domain and a ligand-binding domain. GluN1 subunits bind the co-agonist glycine and GluN2 subunits bind the neurotransmitter glutamate.[1][2]
- The agonist-binding module links to a membrane domain, which consists of three transmembrane segments and a re-entrant loop reminiscent of the selectivity filter of potassium channels.
- The membrane domain contributes residues to the channel pore and is responsible for the receptor's high-unitary conductance, high-calcium permeability, and voltage-dependent magnesium block.
- Each subunit has an extensive cytoplasmic domain, which contain residues that can be directly modified by a series of protein kinases and protein phosphatases, as well as residues that interact with a large number of structural, adaptor, and scaffolding proteins.
The glycine-binding modules of the GluN1 and GluN3 subunits and the glutamate-binding module of the GluN2A subunit have been expressed as soluble proteins, and their three-dimensional structure has been solved at atomic resolution by x-ray crystallography. This has revealed a common fold with amino acid-binding bacterial proteins and with the glutamate-binding module of AMPA-receptors and kainate-receptors.
Mechanism of action
[edit]NMDA receptors are a crucial part of the development of the central nervous system. The processes of learning, memory, and neuroplasticity rely on the mechanism of NMDA receptors. NMDA receptors are glutamate-gated cation channels that allow for an increase of calcium permeability. Channel activation of NMDA receptors is a result of the binding of two co agonists, glycine and glutamate.
Overactivation of NMDA receptors, causing excessive influx of Ca2+ can lead to excitotoxicity. Excitotoxicity is implied to be involved in some neurodegenerative disorders such as Alzheimer's disease, Parkinson's disease and Huntington's disease.[16][17][18][19] Blocking of NMDA receptors could therefore, in theory, be useful in treating such diseases.[16][17][18] It is, however, important to preserve physiological NMDA receptor activity while trying to block its excessive, excitotoxic activity. This can possibly be achieved by uncompetitive antagonists, blocking the receptors ion channel when excessively open.[18]
Uncompetitive NMDA receptor antagonists, or channel blockers, enter the channel of the NMDA receptor after it has been activated and thereby block the flow of ions.[14][16] MK-801, ketamine, amantadine and memantine are examples of such antagonists,[14] see figure 1. The off-rate of an antagonist from the receptors channel is an important factor as too slow off-rate can interfere with normal function of the receptor and too fast off-rate may give ineffective blockade of an excessively open receptor.[18]
Memantine is an example of an uncompetitive channel blocker of the NMDA receptor, with a relatively rapid off-rate and low affinity. At physiological pH its amine group is positively charged and its receptor antagonism is voltage-dependent.[18] It thereby mimics the physiological function of Mg2+ as channel blocker.[15] Memantine only blocks NMDA receptor associated channels during prolonged activation of the receptor, as it occurs under excitotoxic conditions, by replacing magnesium at the binding site. During normal receptor activity the channels only stay open for several milliseconds and under those circumstances memantine is unable to bind within the channels and therefore does not interfere with normal synaptic activity.[21]
Variants
[edit]GluN1
[edit]There are eight variants of the GluN1 subunit produced by alternative splicing of GRIN1:[35]
- GluN1-1a, GluN1-1b; GluN1-1a is the most abundantly expressed form.
- GluN1-2a, GluN1-2b;
- GluN1-3a, GluN1-3b;
- GluN1-4a, GluN1-4b;
GluN2
[edit]
While a single GluN2 subunit is found in invertebrate organisms, four distinct isoforms of the GluN2 subunit are expressed in vertebrates and are referred to with the nomenclature GluN2A through GluN2D (encoded by GRIN2A, GRIN2B, GRIN2C, GRIN2D). Strong evidence shows that the genes encoding the GluN2 subunits in vertebrates have undergone at least two rounds of gene duplication.[36] They contain the binding-site for glutamate. More importantly, each GluN2 subunit has a different intracellular C-terminal domain that can interact with different sets of signaling molecules.[37] Unlike GluN1 subunits, GluN2 subunits are expressed differentially across various cell types and developmental timepoints and control the electrophysiological properties of the NMDA receptor. In classic circuits, GluN2B is mainly present in immature neurons and in extrasynaptic locations such as growth cones,[38] and contains the binding-site for the selective inhibitor ifenprodil.[39] However, in pyramidal cell synapses in the newly evolved primate dorsolateral prefrontal cortex, GluN2B are exclusively within the postsynaptic density, and mediate higher cognitive operations such as working memory.[40] This is consistent with the expansion in GluN2B actions and expression across the cortical hierarchy in monkeys [41] and humans [42] and across primate cortex evolution.[43]
GluN2B to GluN2A switch
[edit]
While GluN2B is predominant in the early postnatal brain, the number of GluN2A subunits increases during early development; eventually, GluN2A subunits become more numerous than GluN2B. This is called the GluN2B-GluN2A developmental switch, and is notable because of the different kinetics each GluN2 subunit contributes to receptor function.[45] For instance, greater ratios of the GluN2B subunit leads to NMDA receptors which remain open longer compared to those with more GluN2A.[46] This may in part account for greater memory abilities in the immediate postnatal period compared to late in life, which is the principle behind genetically altered 'doogie mice'. The detailed time course of this switch in the human cerebellum has been estimated using expression microarray and RNA seq and is shown in the figure on the right.
There are three hypothetical models to describe this switch mechanism:
- Increase in synaptic GluN2A along with decrease in GluN2B
- Extrasynaptic displacement of GluN2B away from the synapse with increase in GluN2A
- Increase of GluN2A diluting the number of GluN2B without the decrease of the latter.
The GluN2B and GluN2A subunits also have differential roles in mediating excitotoxic neuronal death.[47] The developmental switch in subunit composition is thought to explain the developmental changes in NMDA neurotoxicity.[48] Homozygous disruption of the gene for GluN2B in mice causes perinatal lethality, whereas disruption of the GluN2A gene produces viable mice, although with impaired hippocampal plasticity.[49] One study suggests that reelin may play a role in the NMDA receptor maturation by increasing the GluN2B subunit mobility.[50]
GluN2B to GluN2C switch
[edit]Granule cell precursors (GCPs) of the cerebellum, after undergoing symmetric cell division[51] in the external granule-cell layer (EGL), migrate into the internal granule-cell layer (IGL) where they down-regulate GluN2B and activate GluN2C, a process that is independent of neuregulin beta signaling through ErbB2 and ErbB4 receptors.[52]
Role in excitotoxicity
[edit]NMDA receptors have been implicated by a number of studies to be strongly involved with excitotoxicity.[53][54][55] Because NMDA receptors play an important role in the health and function of neurons, there has been much discussion on how these receptors can affect both cell survival and cell death.[56] Recent evidence supports the hypothesis that overstimulation of extrasynaptic NMDA receptors has more to do with excitotoxicity than stimulation of their synaptic counterparts.[53][24] In addition, while stimulation of extrasynaptic NMDA receptors appear to contribute to cell death, there is evidence to suggest that stimulation of synaptic NMDA receptors contributes to the health and longevity of the cell. There is ample evidence to support the dual nature of NMDA receptors based on location, and the hypothesis explaining the two differing mechanisms is known as the "localization hypothesis".[53][56]
Differing cascade pathways
[edit]In order to support the localization hypothesis, it would be necessary to show differing cellular signaling pathways are activated by NMDA receptors based on its location within the cell membrane.[53] Experiments have been designed to stimulate either synaptic or non-synaptic NMDA receptors exclusively. These types of experiments have shown that different pathways are being activated or regulated depending on the location of the signal origin.[57] Many of these pathways use the same protein signals, but are regulated oppositely by NMDARs depending on its location. For example, synaptic NMDA excitation caused a decrease in the intracellular concentration of p38 mitogen-activated protein kinase (p38MAPK). Extrasynaptic stimulation NMDARs regulated p38MAPK in the opposite fashion, causing an increase in intracellular concentration.[58][59] Experiments of this type have since been repeated with the results indicating these differences stretch across many pathways linked to cell survival and excitotoxicity.[53]
Two specific proteins have been identified as a major pathway responsible for these different cellular responses ERK1/2, and Jacob.[53] ERK1/2 is responsible for phosphorylation of Jacob when excited by synaptic NMDARs. This information is then transported to the nucleus. Phosphorylation of Jacob does not take place with extrasynaptic NMDA stimulation. This allows the transcription factors in the nucleus to respond differently based in the phosphorylation state of Jacob.[60]
Neural plasticity
[edit]NMDA receptors (NMDARs) critically influence the induction of synaptic plasticity. NMDARs trigger both long-term potentiation (LTP) and long-term depression (LTD) via fast synaptic transmission.[61] Experimental data suggest that extrasynaptic NMDA receptors inhibit LTP while producing LTD.[62] Inhibition of LTP can be prevented with the introduction of a NMDA antagonist.[53] A theta burst stimulation that usually induces LTP with synaptic NMDARs, when applied selectively to extrasynaptic NMDARs produces a LTD.[63] Experimentation also indicates that extrasynaptic activity is not required for the formation of LTP. In addition, both synaptic and extrasynaptic activity are involved in expressing a full LTD.[64]
Role of differing subunits
[edit]Another factor that seems to affect NMDAR induced toxicity is the observed variation in subunit makeup. NMDA receptors are heterotetramers with two GluN1 subunits and two variable subunits.[53][65] Two of these variable subunits, GluN2A and GluN2B, have been shown to preferentially lead to cell survival and cell death cascades respectively. Although both subunits are found in synaptic and extrasynaptic NMDARs there is some evidence to suggest that the GluN2B subunit occurs more frequently in extrasynaptic receptors. This observation could help explain the dualistic role that NMDA receptors play in excitotoxicity.[66][67] t-NMDA receptors have been implicated in excitotoxicity-mediated death of neurons in temporal lobe epilepsy.[68]
Despite the compelling evidence and the relative simplicity of these two theories working in tandem, there is still disagreement about the significance of these claims. Some problems in proving these theories arise with the difficulty of using pharmacological means to determine the subtypes of specific NMDARs.[53][69] In addition, the theory of subunit variation does not explain how this effect might predominate, as it is widely held that the most common tetramer, made from two GluN1 subunits and one of each subunit GluN2A and GluN2B, makes up a high percentage of the NMDARs.[53] The subunit composition of t-NMDA receptors has recently been visualized in brain tissue.[70]
Excitotoxicity in a clinical setting
[edit]Excitotoxicity has been thought to play a role in the degenerative properties of neurodegenerative conditions since the late 1950s.[71] NMDA receptors seem to play an important role in many of these degenerative diseases affecting the brain. Most notably, excitotoxic events involving NMDA receptors have been linked to Alzheimer's disease and Huntington's disease, as well as with other medical conditions such as strokes and epilepsy.[53][72] Treating these conditions with one of the many known NMDA receptor antagonists, however, leads to a variety of unwanted side effects, some of which can be severe. These side effects are, in part, observed because the NMDA receptors do not just signal for cell death but also play an important role in its vitality.[56] Treatment for these conditions might be found in blocking NMDA receptors not found at the synapse.[53][25] One class of excitotoxicity in disease includes gain-of-function mutations in GRIN2B and GRIN1 associated with cortical malformations, such as polymicrogyria.[73] D-serine, an antagonist/inverse co-agonist of t-NMDA receptors, which is made in the brain, has been shown to mitigate neuron loss in an animal model of temporal lobe epilepsy.[68]
Ligands
[edit]Agonists
[edit]
Activation of NMDA receptors requires binding of glutamate or aspartate (aspartate does not stimulate the receptors as strongly).[74] In addition, NMDARs also require the binding of the co-agonist glycine for the efficient opening of the ion channel, which is a part of this receptor.
D-Serine has also been found to co-agonize the NMDA receptor with even greater potency than glycine.[75] It is produced by serine racemase, and is enriched in the same areas as NMDA receptors. Removal of D-serine can block NMDA-mediated excitatory neurotransmission in many areas. Recently, it has been shown that D-serine can be released both by neurons and astrocytes to regulate NMDA receptors. Note that D-serine has also been shown to work as an antagonist / inverse co-agonist for t-NMDA receptors.[76][68]
NMDA receptor (NMDAR)-mediated currents are directly related to membrane depolarization. NMDA agonists therefore exhibit fast Mg2+ unbinding kinetics, increasing channel open probability with depolarization. This property is fundamental to the role of the NMDA receptor in memory and learning, and it has been suggested that this channel is a biochemical substrate of Hebbian learning, where it can act as a coincidence detector for membrane depolarization and synaptic transmission.
Examples
[edit]Some known NMDA receptor agonists include:
- Amino acids and amino acid derivatives
- Aspartic acid (aspartate) (D-aspartic acid, L-aspartic acid) – endogenous glutamate site agonist. The word N-methyl-D-aspartate (NMDA) is partially derived from D-aspartate.
- Glutamic acid (glutamate) – endogenous glutamate site agonist
- Tetrazolylglycine – synthetic glutamate site agonist
- Homocysteic acid – endogenous glutamate site agonist
- Ibotenic acid – naturally occurring glutamate site agonist found in Amanita muscaria
- Quinolinic acid (quinolinate) – endogenous glutamate site agonist
- Glycine – endogenous glycine site agonist
- Positive allosteric modulators
- Cerebrosterol – endogenous weak positive allosteric modulator
- Cholesterol – endogenous weak positive allosteric modulator
- Dehydroepiandrosterone (DHEA) – endogenous weak positive allosteric modulator
- Dehydroepiandrosterone sulfate (DHEA-S) – endogenous weak positive allosteric modulator
- Nebostinel (neboglamine) – synthetic positive allosteric modulator of the glycine site
- Pregnenolone sulfate – endogenous weak positive allosteric modulator
- Polyamines
- Spermidine – endogenous polyamine site agonist
- Spermine – endogenous polyamine site agonist
Neramexane
[edit]
An example of memantine derivative is neramexane which was discovered by studying number of aminoalkyl cyclohexanes, with memantine as the template, as NMDA receptor antagonists. Neramexane binds to the same site as memantine within the NMDA receptor associated channel and with comparable affinity. It does also show very similar bioavailability and blocking kinetics in vivo as memantine. Neramexane went to clinical trials for four indications, including Alzheimer's disease.[28]
Partial agonists
[edit]
N-Methyl-D-aspartic acid (NMDA), which the NMDA receptor was named after, is a partial agonist of the active or glutamate recognition site.
3,5-Dibromo-L-phenylalanine, a naturally occurring halogenated derivative of L-phenylalanine, is a weak partial NMDA receptor agonist acting on the glycine site.[77] 3,5-Dibromo-L-phenylalanine has been proposed a novel therapeutic drug candidate for treatment of neuropsychiatric disorders and diseases such as schizophrenia,[78] and neurological disorders such as ischemic stroke and epileptic seizures.[79]
Other partial agonists of the NMDA receptor acting on novel sites such as rapastinel (GLYX-13) and apimostinel (NRX-1074) are now viewed for the development of new drugs with antidepressant and analgesic effects without obvious psychotomimetic activities.[80]
Examples
[edit]- Aminocyclopropanecarboxylic acid (ACC) – synthetic glycine site partial agonist
- Cycloserine (D-cycloserine) – naturally occurring glycine site partial agonist found in Streptomyces orchidaceus
- HA-966 – synthetic glycine site weak partial agonist
- Homoquinolinic acid – synthetic glutamate site partial agonist
- N-Methyl-D-aspartic acid (NMDA) – synthetic glutamate site partial agonist
Positive allosteric modulators include:
- Zelquistinel (AGN-241751) - synthetic novel site partial agonist
- Apimostinel (NRX-1074) – synthetic novel site partial agonist
- Rapastinel (GLYX-13) – synthetic novel site partial agonist[81]
Antagonists
[edit]
Antagonists of the NMDA receptor are used as anesthetics for animals and sometimes humans, and are often used as recreational drugs due to their hallucinogenic properties, in addition to their unique effects at elevated dosages such as dissociation. When certain NMDA receptor antagonists are given to rodents in large doses, they can cause a form of brain damage called Olney's lesions. NMDA receptor antagonists that have been shown to induce Olney's lesions include ketamine, phencyclidine, and dextrorphan (a metabolite of dextromethorphan), as well as some NMDA receptor antagonists used only in research environments. So far, the published research on Olney's lesions is inconclusive in its occurrence upon human or monkey brain tissues with respect to an increase in the presence of NMDA receptor antagonists.[82]
Большинство антагонистов NMDAR являются неконкурентоспособными или неконкурентоспособными блокаторами канала пор или являются антагонистами ко-регуляторного участка глицина, а не антагонистам активного/глутаматного сайта.
Примеры
[ редактировать ]Общие агенты, в которых антагонизм рецептора NMDA является основным или основным механизмом действия:
- 4-хлоркинуренин (AV-101)-антагонист сайта глицина; пролекарство 7-хлоркинуреневой кислоты [ 83 ] [ 84 ]
- 7-хлоркинуреневая кислота -антагонист сайта глицина
- Антагонист Agmatine - эндогенный полиаминовый сайт [ 85 ] [ 86 ]
- Argiotoxin-636 -природно, встречающийся дизоцилпин или связанный антагонист сайта, обнаруженные в Argiope ядовании
- AP5 - антагонист сайта глутамата
- AP7 - антагонист сайта глутамата
- CGP-37849 -антагонист сайта глутамата
- D -сэрин -антагонист рецептора T -NMDA / обратный коагонг [ 76 ] [ 68 ]
- Делукемин (NPS-1506)-антагонист дизоцилпина или родственного сайта; получен из аргутоксина-636 [ 87 ] [ 88 ]
- Dexstromethorphan (DXM) - антагонист сайта дизоцилпина; Пролекарство Декстрорфана
- Dextrorphan (DXO) - антагонист сайта дизоцилпина
- Дексанабинол -антагонист сайта, связанный с дизоцилпином, антагонист сайта [ 89 ] [ 90 ] [ 91 ]
- Диэтиловый эфир - неизвестный антагонист сайта
- Дифенидин - антагонист сайта дизоцилпина
- Дизоцилпин (MK-801)-антагонист сайта дизоцилпина
- Элипродил - антагонист сайта ifenprodil
- Эскетамина - антагонист сайта дизоцилпина
- Hodgcinsine - неопределенный антагонист сайта
- IfenProdil - антагонист сайта ifenprodil [ 92 ]
- Кайтоцефалин - природно, встречающийся антагонист сайта глутамата, обнаруженный в Eupenicillium shearii
- Кетамин - антагонист сайта дизоцилпина
- Кинуренновая кислота - антагонист сайта эндогенного глицина
- Lanicemine -антагонист сайта дизоцилпина с низким затрочением
- LY-235959 -антагонист сайта глутамата
- Мемантин -антагонист сайта дизоцильпина с низким заложением
- Метоккситамин - антагонист сайта дизоцилпина
- Midafotel - глютаматный антагонист сайта
- Оксид азота (N 2 O) - неопределенный антагонист сайта
- PEAQX - Глутаматный антагонист сайта
- Perzinfotel - антагонист сайта глутамата
- Финценклидин (PCP) - антагонист сайта дизоцилпина
- Фенилаланин - природный аминокислотный антагонист глицина, глициновый антагонист [ 93 ] [ 94 ]
- Психотридин - неопределенный антагонист сайта
- Эльпотел - глютаматный антагонист сайта
- дизоцилпина Антагонист сайта
- TraxoProdil - антагонист сайта ifenprodil
- Ксенон - неизвестный антагонист сайта
Некоторые общие агенты, в которых слабый антагонизм рецептора NMDA является вторичным или дополнительным действием, включают:
- Амантадин - антивирусное и антипаркинсоническое препарат; Антагонист сайта дизоцилпина с низким содержанием развлечений [ 95 ]
- Атосмоксетин - ингибитор обратного захвата норэпинефрина, используемый для лечения дефицита, [ 96 ]
- Декстропропсифен - опиоидный анальгетик
- Этанол ( алкоголь ) - эйфхориант , седативный и анксиолитический , используемый развлекательно; Неизвестный антагонист сайта
- Гуафенезин - отхарк
- Хуперзин А - ингибитор ацетилхолинэстеразы и потенциальный антидигенции, встречающийся в природе агент
- Ибогаин - природный галлюциноген и антиаддиктивное средство
- Кетобемидон - опиоидный анальгетик
- Метадон - опиоидный анальгетик
- Миноциклин - антибиотик [ 97 ]
- Трамадол - атипичный опиоидный анальгетик и серотонин
Нитролемантин
[ редактировать ]Рецептор NMDA регулируется с помощью нитрозилирования , а аминоадамантана может использоваться в качестве целевого шаттла, чтобы привлечь оксид азота (NO) вблизи сайта в рецепторе NMDA, где он может нитрозилат и регулировать проводимость ионного канала. [ 28 ] Нет донора, который можно использовать для снижения активности рецептора NMDA, является алкил -нитрат нитроглицерин. В отличие от многих других доноров, алкил -нитраты не имеют потенциального не связанного нейротоксического эффекта. Алкил -нитраты жертвуют NO в форме нитро -группы, как видно на рисунке 7, -NO 2 -, который является безопасным донором, который избегает нейротоксичности. Группа NITRO должна быть нацелена на рецептор NMDA, в противном случае могут возникнуть другие эффекты NO, такие как дилатация кровеносных сосудов и последующая гипотония . [ 98 ] Нитролемантин является производным мемантина второго поколения, он снижает экситотоксичность, опосредованную переоценкой глутаматергической системы за счет блокирования рецептора NMDA без жертва безопасности. Временные исследования на животных моделях показывают, что нитромеманты более эффективны, чем мемантин в качестве нейропротекторов, как in vitro , так и in vivo. Мемантин и новые производные могут стать очень важным оружием в борьбе с повреждением нейронов. [ 18 ]

Негативные аллостерические модуляторы включают:
- 25-гидроксихолестерин -эндогенный слабый негативный аллостерический модулятор
- Конантокины - природные негативные аллостерические модуляторы полиаминового участка, обнаруженные в Conus Geographus [ 99 ]
Модуляторы
[ редактировать ]Примеры
[ редактировать ]Рецептор NMDA модулируется рядом эндогенных и экзогенных соединений: [ 100 ]
- Было показано, что аминогликозиды оказывают аналогичный эффект полиаминов, и это может объяснить их нейротоксический эффект.
- CDK5 регулирует количество рецепторов NMDA -содержащих NR2B на синаптической мембране, что влияет на синаптическую пластичность . [ 101 ] [ 102 ]
- Полиамины напрямую не активируют рецепторы NMDA, а вместо этого действуют, чтобы потенцировать или ингибировать глутамат-опосредованные ответы.
- REELIN модулирует функцию NMDA через киназы семейства SRC и DAB1 . [ 103 ] Значительно усиление LTP в гиппокампе .
- SRC -киназа усиливает токи рецептора NMDA. [ 104 ]
- НА + К. + и ca 2+ Не только проходят через канал рецептора NMDA, но и модулируют активность рецепторов NMDA. [ 105 ]
- Zn 2+ и с 2+ Как правило, блокируют активность тока NMDA неконкурентным и независимым от напряжения образом. Однако цинк может потенцировать или ингибировать ток в зависимости от нейронной активности. [ 106 ]
- Пб 2+ [ 107 ] является мощным антагонистом NMDAR. Пресинаптический дефицит, вызванный PB 2+ Воздействие во время синаптогенеза опосредовано нарушением NMDAR-зависимой передачи сигналов BDNF.
- Белки основного комплекса гистосовместимости класса I являются эндогенными негативными регуляторами NMDAR-опосредованных токов у взрослого гиппокампа, [ 108 ] и необходимы для соответствующих изменений, вызванных NMDAR, в отношении AMPAR торговли [ 108 ] и NMDAR-зависимая синаптическая пластичность , обучение и память . [ 109 ] [ 110 ]
- Активность рецепторов NMDA также поразительно чувствительна к изменениям pH и частично ингибируется концентрацией Ambient H + в физиологических условиях. [ 111 ] Уровень торможения с h + значительно снижается в рецепторах, содержащих подтип NR1A, который содержит положительно заряженный вставка экзона 5. Влияние этой вставки может быть имитировано положительно заряженными полиаминами и аминогликозидами, объясняя их способ действия.
- Функция рецептора NMDA также строго регулируется химическим восстановлением и окислением посредством так называемого «окислительно-восстановительного модуляторного сайта». [ 112 ] Через этот сайт редактивные средства резко повышают активность канала NMDA, тогда как окислители либо обращают эффекты редуктантов, либо подавляют нативные ответы. Обычно считается, что рецепторы NMDA модулируются эндогенными окислительно -восстановительными агентами, такими как глутатион , липоевая кислота и незаменимый питательный пирроловин хинон [ Цитация необходима ] .
Разработка антагонистов рецепторов NMDA
[ редактировать ]Основная проблема с развитием антагонистов NMDA для нейропротекции заключается в том, что физиологическая активность рецептора NMDA необходима для нормальной функции нейронов. Полная блокада всей активности рецептора NMDA приводит к побочным эффектам, таким как галлюцинации , возбуждение и анестезия . Чтобы быть клинически актуальным, антагонист рецептора NMDA должен ограничить свое действие, чтобы блокировать чрезмерную активацию, не ограничивая нормальную функцию рецептора. [ 21 ]
Конкурентные антагонисты рецепторов NMDA
[ редактировать ]Конкурентные антагонисты NMDA -рецептора, которые были разработаны в первую очередь, не являются хорошим вариантом, поскольку они конкурируют и связываются с одним и тем же сайтом (субъединицей NR2) на рецепторе как агонист, глутамат и, следовательно, также блокируют нормальную функцию. [ 21 ] [ 113 ] Они будут блокировать здоровые области мозга до того, как оказывать влияние на патологические районы, потому что здоровые области содержат более низкие уровни агонистов , чем патологические области. Эти антагонисты могут быть вытеснены из рецептора с помощью высокой концентрации глутамата, которая может существовать при экситотоксических обстоятельствах. [ 16 ]
Неконкурентные антагонисты рецепторов NMDA
[ редактировать ]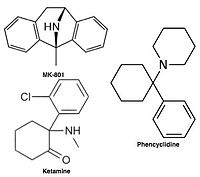
Неконкурентоспособные антагонисты рецепторов NMDA блокируются внутри ионного канала в MG 2+ сайт (область пор) и предотвращение чрезмерного притока CA 2+ Полем Неконкурентный антагонизм относится к типу блока, который увеличенная концентрация глутамата не может преодолеть, и зависит от предварительной активации рецептора агонистом, то есть он входит в канал только тогда, когда он открывается агонистом. [ 21 ] [ 114 ]
Мемантин и связанные с ними соединения
[ редактировать ]
Из -за этих неблагоприятных побочных эффектов блокаторов с высокой аффинной, поиск клинически успешных антагонистов рецепторов NMDA для нейродегенеративных заболеваний продолжался и был сосредоточен на развитии блокаторов с низким сродством. Однако сродство не могло быть слишком низким, а время задержки не слишком короткое (как видно с MG 2+ ) где деполяризация мембраны снимает блок. Таким образом, это открытие было развитием неконкурентоспособного антагониста с более длительным временем жилья, чем MG 2+ В канале, но короче, чем MK-801. Таким образом, полученный препарат только заблокировал бы чрезмерно открытые каналы, связанные с рецептором NMDA, но не нормальную нейротрансмиссию. [ 21 ] [ 114 ] Мемантин - это препарат. Это производная амантадина, который был сначала противоинфуэнзовым агентом, но позже был обнаружен случайным образом обладать эффективностью при болезни Паркинсона. Химические структуры мемантина и амантадина можно увидеть на рисунке 5. Сначала считалось, что соединение является дофаминергическим или антихолинергическим , но позже было обнаружено, что является антагонистом рецептора NMDA. [ 15 ] [ 21 ]
Мемантин является первым препаратом, одобренным для лечения тяжелой и более развитой болезни Альцгеймера , которая, например, антихолинергические препараты не очень полезны. [ 114 ] Это помогает восстановить синаптическую функцию и таким образом улучшает нарушение памяти и обучения. [ 19 ] В 2015 году мемантин также находится в испытаниях по терапевтическому значению при дополнительных неврологических расстройствах. [ 98 ]
Многие производные мемантина второго поколения были в разработке, что может показать еще лучшие нейропротекторные эффекты, где основная мысль состоит в том, чтобы использовать другие безопасные, но эффективные модулирующие сайты на рецепторе NMDA в дополнение к связанным ионному каналу. [ 98 ]
Структурные отношения активности (SAR)
[ редактировать ]
Мемантин (1-амино-3,5-диметиладамантант) представляет собой производное аминоалкилциклогексана и атипичное лекарственное соединение с неплостной трехмерной трициклической структурой. На рисунке 8 показан SAR для производного аминоалкильного циклогексана. Мемантин имеет несколько важных особенностей в своей структуре для ее эффективности:
- Трехководное сооружение с амином плацдарма, -nh 2
- Группа -nh 2 протонируется при физиологическом pH тела для нести положительного заряда, -nh 3+
- Две метильные (CH 3 ) боковые группы, которые служат для продления времени задержки и повышения стабильности, а также аффинность к каналу рецептора NMDA по сравнению с амантадина (1-адамантанамина). [ 18 ] [ 114 ]
Несмотря на небольшую структурную разницу между мемантином и амантадином, два адамантановых производных, аффинность к сайту связывания субъединицы NR1/NR2B намного больше для мемантина. В патча-зажима измерениях в Мемантин имеет IC 50 (2,3+0,3) мкМ, в то время как амантадин имеет IC 50 (71,0+11,1) мкм. [ 28 ] Сайт связывания с самой высокой аффинностью называется доминантным сайтом связывания. Он включает связь между аминной группой мемантина и связывающим карманом NR1-N161 субъединицы NR1/NR2B. Метиловые боковые группы играют важную роль в повышении сродства к открытым каналам рецептора NMDA и созданию его гораздо лучшим нейропротекторным препаратом, чем амантадин. Считается, что карманы связывания для метильных групп находятся в NR1-A645 и NR2B-A644 NR1/NR2B. [ 32 ] Связывающие карманы показаны на рисунке 2. Мемантин связывается в или рядом с MG 2+ сайт внутри канала NMDA, связанного с рецептором. Группа -NH 2 на мемантине, которая протонируется при физиологическом рН тела, представляет область, которая связывается в или рядом с MG 2+ сайт. [ 18 ] Показано, что добавление двух метильных групп в -н в структуру Мемантина снижает аффинность, давая значение IC 50 (28,4+1,4) мкм. [ 28 ]
Производное второго поколения Мемантина; нитролемантин
[ редактировать ]Несколько производных нитролемантина, производного мемантина второго поколения, были синтезированы для выполнения подробной структурной взаимосвязи активности (SAR) этих новых лекарств. Один класс, содержащий группу Nitro (№ 2 ), напротив амина с плацдармом (NH 2 ), показал многообещающий результат. Nitromemantine использует сайт связывания мемантина на рецепторе NMDA для нацеливания группы NO x (x = 1 или 2) для взаимодействия с S-нитрозилированием/окислительно-восстановительным сайтом, внешним по отношению к сайту связывания мемантина. Удлинение боковых цепей мемантина компенсирует худшее сродство лекарств в канале, связанное с добавлением -он 2 группы [ 115 ]
Терапевтическое применение
[ редактировать ]Подразумевается, что экситотоксичность участвует в некоторых нейродегенеративных расстройствах, таких как болезнь Альцгеймера, болезнь Паркинсона, болезнь Хантингтона и амиотрофический боковой склероз . [ 16 ] [ 17 ] [ 18 ] [ 19 ] Поэтому блокировка рецепторов NMDA может быть полезной при лечении таких заболеваний. [ 16 ] [ 17 ] [ 18 ] Однако важно сохранить физиологическую активность рецептора NMDA, пытаясь блокировать ее чрезмерную экситотоксическую активность. Это может быть достигнуто неконкурентоспособными антагонистами, блокируя ионный канал рецептора при чрезмерном открытии [ 18 ]
Мемантин является примером неконкурентоспособного антагониста рецептора NMDA, который одобрил показатель нейродегенеративного заболевания болезни Альцгеймера. В 2015 году мемантин все еще находится в клинических испытаниях для дополнительных неврологических заболеваний. [ 32 ] [ 98 ]
Рецепторная модуляция
[ редактировать ]Рецептор NMDA является неспецифическим катионным каналом, который может позволить прохождение CA 2+ и с + в клетку и k + из камеры. Возбуждающий постсинаптический потенциал (EPSP), продуцируемый активацией рецептора NMDA, увеличивает концентрацию CA 2+ в ячейке. Ca 2+ может, в свою очередь, функционировать как второй мессенджер в различных сигнальных путях . Тем не менее, катионный канал рецептора NMDA блокируется MG 2+ При отдыхе мембраны потенциал. [ 116 ] Магний разблокирован не мгновенный; Чтобы разблокировать все доступные каналы, постсинаптическая ячейка должна быть деполяризована в течение достаточно длительного периода времени (в масштабе миллисекунды). [ 117 ]
Следовательно, рецептор NMDA функционирует как « детектор молекулярного совпадения ». Его ионный канал открывается только при соблюдении следующих двух условий: глутамат связан с рецептором, а постсинаптическая клетка деполяризована (которая удаляет Mg 2+ блокируя канал). Это свойство рецептора NMDA объясняет многие аспекты долгосрочного потенцирования (LTP) и синаптической пластичности . [ 118 ]
В потенциале покойного мембраны открывается пор рецептор NMDA, что позволяет притоить связывание ионов внешнего магния для предотвращения дальнейшего ионного проникновения. [ 119 ] Внешние ионы магния находятся в миллимолярном диапазоне, в то время как внутриклеточные ионы магния находятся в микромолярном диапазоне, что приводит к отрицательному мембранному потенциалу. Рецепторы NMDA модулируются рядом эндогенных и экзогенных соединений и играют ключевую роль в широком диапазоне физиологических (например, памяти ) и патологических процессов (например, экситотоксичность ). Магний работает над тем, чтобы усилить NMDA-индуцированные ответы при положительных мембранных потенциалах при блокировании канала NMDA. Использование кальция, калия и натрия используется для модуляции активности NMDAR, проходящих через мембрану NMDA. Изменения в ч + Концентрация может частично ингибировать активность рецепторов NMDA в различных физиологических условиях.
Клиническое значение
[ редактировать ]антагонисты NMDAR, такие как кетамин , эскетмина , тилет , фенциклидин , оксид азота и ксенон используются В качестве общих анестетиков . Эти и подобные препараты, такие как декстрометорфан и метоксетамин, также вызывают диссоциативные , галлюциногенные и эйфхориантные эффекты и используются в качестве рекреационных препаратов .
NMDAR-нацеленные соединения, в том числе кетамин, эскетмина (JNJ-54135419), Rapastinel (Glyx-13), апимостинел (NRX-1074), Zelquistinel (AGN-241751), 4-хлоркинуренин (AV-101) и RISLENAZ (Cerc -CERNAZ (Cerc-Cerc. 301, MK-0657), находятся в стадии разработки для лечения расстройств настроения , включая серьезные депрессивные расстройства и устойчивую к лечению депрессию . [ 83 ] [ 84 ] [ 120 ] Кроме того, кетамин уже используется для этой цели в качестве не по назначению терапии в некоторых клиниках. [ 121 ] [ 122 ]
Исследования показывают, что тианептин продуцирует антидепрессантные эффекты посредством косвенного изменения и ингибирования активности глутаматного рецептора и высвобождения BDNF , в свою очередь, влияя на нервную пластичность . [ 123 ] [ 124 ] [ 125 ] [ 126 ] [ 127 ] Тианептин также действует на рецепторы NMDA и AMPA . [ 123 ] [ 127 ] На животных моделях тианептин ингибирует вызванные патологическим стрессом изменения глутаматергической нейротрансмиссии в миндалине и гиппокампе.
Мемантин , антагонист NMDAR с низким уровнем улавливания, одобрен в Соединенных Штатах и Европе для лечения болезни Альцгеймера от средней до тяжелой степени, [ 128 ] и теперь получил ограниченную рекомендацию от Великобритании Национального института здравоохранения и совершенства ухода за пациентами, которые терпят неудачу в других вариантах лечения. [ 129 ]
Кохлеарные NMDARS являются целью интенсивных исследований, чтобы найти фармакологические решения для лечения шума в ушах . NMDARS связаны с редким аутоиммунным заболеванием, энцефалитом рецептора анти-NMDA (также известный как энцефалит NMDAR [ 130 ] ), это обычно происходит из-за перекрестной реактивности антител, продуцируемых иммунной системой против эктопических тканей головного мозга, таких как те, которые обнаружены при тератоме . Они известны как антитела против глутамат .
По сравнению с дофаминергическими стимуляторами, такими как метамфетамин , антагонист NMDAR фенкоклидин может вызывать более широкий диапазон симптомов, которые напоминают шизофрению у здоровых добровольцев, в том, что привело к гипотезе глутамата шизофрении . [ 131 ] Эксперименты, в которых грызуны обрабатываются антагонистом рецептора NMDA, являются сегодня наиболее распространенной моделью, когда речь идет о тестировании новой терапии шизофренией или изучению точного механизма лекарств, уже одобренных для лечения шизофренией.
Антагонисты NMDAR, например , элипродил , бензинел , лицестинел и эльтотел, были тщательно исследованы на для лечения экситотоксичностью, , опосредованной нейротоксичности в таких ситуациях, как , но, но седация, но, но седация ишемическая инсульт и травматическая травма головного мозга , но повреждение головного мозга , но не было , но не было некачественных в клинических испытаниях, используемых в небольших дозах, чтобы избежать седации, но, но, но седация, но, но седация, но, но седация, но, но седация . Антагонисты NMDAR могут блокировать распространение деполяризации у животных и у пациентов с травмой головного мозга. [ 132 ] Это использование еще не было проверено в клинических испытаниях.
Смотрите также
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а беременный Laube B, Hirai H, Sturgess M, Betz H, Kuhse J (март 1997 г.). «Молекулярные детерминанты дискриминации агонистов с помощью субъединиц рецептора NMDA: анализ сайта связывания глутамата на субъединице NR2B» . Нейрон . 18 (3): 493–503. doi : 10.1016/s0896-6273 (00) 81249-0 . PMID 9115742 .
Поскольку считается, что две молекулы глутамата и глицина требуются для активации канала (3, 6), это подразумевает, что рецептор NMDA должен состоять как минимум из четырех субъединиц.
- ^ Jump up to: а беременный Anson LC, Chen PE, Wyllie DJ, Colquhoun D, Schoepfer R (январь 1998 г.). «Идентификация аминокислотных остатков субъединицы NR2A, которые контролируют потенцию глутамата в рекомбинантных рецепторах NR1/NR2A NMDA» . Журнал нейробиологии . 18 (2): 581–589. doi : 10.1523/jneurosci.18-02-00581.1998 . PMC 6792534 . PMID 9425000 .
- ^ Krlicky, v.; Corinek, M.; Smejkalova, T.; Балик, А.; Красова, Б.; Kaniakova, M.; Лихнеро, К.; Cerny, J.; Krusek, J.; Dittert, я.; Хорак, М.; Zhlický, L. (2014). «Структура, функция и фармакология каналов рецептора NMDA» . Физиологические исследования . 63 (Suppl 1): S191–203. Doi : 10.33549/physiolres.932678 . ISSN 1802-9973 . PMID 24564659 .
- ^ Джуветт, Бенджамин Э.; Thapa, Bicky (2024), «Физиология, рецептор NMDA» , Statpearls , остров сокровищ (FL): Patpearls Publishing, PMID 30137779 , получен 2024-03-04
- ^ Jump up to: а беременный Furukawa H, Singh SK, Mancusso R, Gouaux E (ноябрь 2005 г.). «Расположение и функция субъединицы в рецепторах NMDA». Природа . 438 (7065): 185–192. Bibcode : 2005natur.438..185f . doi : 10.1038/nature04089 . PMID 16281028 . S2CID 4400777 .
- ^ Li F, Tsien JZ (июль 2009 г.). «Память и рецепторы NMDA» . Новая Англия Журнал медицины . 361 (3): 302–303. doi : 10.1056/nejmcibr0902052 . PMC 3703758 . PMID 19605837 .
- ^ Мориёши К., Масу М., Исии Т., Шигемото Р., Мизуно Н., Наканиши С (ноябрь 1991). «Молекулярное клонирование и характеристика рецептора NMDA крысы». Природа . 354 (6348): 31–37. Bibcode : 1991natur.354 ... 31m . doi : 10.1038/354031A0 . PMID 1834949 . S2CID 4368947 .
- ^ Jump up to: а беременный Dingledine R, Borges K, Bowie D, Traynelis SF (март 1999 г.). «Ионные каналы рецептора глутамата» . Фармакологические обзоры . 51 (1): 7–61. PMID 10049997 .
- ^ Лю Y, Чжан Дж (октябрь 2000 г.). «Недавнее развитие рецепторов NMDA». Китайский медицинский журнал . 113 (10): 948–956. PMID 11775847 .
- ^ Cull-Candy S, Brickley S, Farrant M (июнь 2001 г.). «Субъединицы рецептора NMDA: разнообразие, развитие и болезнь». Современное мнение о нейробиологии . 11 (3): 327–335. doi : 10.1016/s0959-4388 (00) 00215-4 . PMID 11399431 . S2CID 11929361 .
- ^ Jump up to: а беременный Паолетти П., Нейтон Дж (февраль 2007 г.). «Субъединицы рецептора NMDA: функция и фармакология» (PDF) . Современное мнение о фармакологии . 7 (1): 39–47. doi : 10.1016/j.coph.2006.08.011 . PMID 17088105 .
- ^ Sánchez-Blázquez P, Rodríguez-Muñoz M, Vicente-Sánchez A, Garzón J (ноябрь 2013 г.). «Каннабиноидные рецепторы соединяют рецепторы NMDA, чтобы уменьшить выработку NO и мобилизацию цинка, вызванного глутаматом» . Антиоксиданты и окислительно -восстановительная передача сигналов . 19 (15): 1766–1782. doi : 10.1089/ars.2012.5100 . PMC 3837442 . PMID 23600761 .
- ^ Castelli Mp, Madeddu C, Casti A, Casu A, Casti P, Scherma M, et al. (2014-05-20). «Δ9-тетрагидроканнабинол предотвращает индуцированную метамфетамином нейротоксичность» . Plos один . 9 (5): E98079. BIBCODE : 2014PLOSO ... 998079C . doi : 10.1371/journal.pone.0098079 . PMC 4028295 . PMID 24844285 .
- ^ Jump up to: а беременный в дюймовый Johnson JW, Kotermanski SE (февраль 2006 г.). «Механизм действия мемантина». Современное мнение о фармакологии . 6 (1): 61–67. doi : 10.1016/j.coph.2005.09.007 . PMID 16368266 .
- ^ Jump up to: а беременный в дюймовый Домингес Е., Чин Тай, Чен К.П., Ву Тай (декабрь 2011 г.). «Лечение болезни Альцгеймера от средней до тяжелой болезни: сосредоточиться на мемантине» . Тайваньский журнал акушерства и гинекологии . 50 (4): 415–423. doi : 10.1016/j.tjog.2011.10.004 . PMID 22212311 .
- ^ Jump up to: а беременный в дюймовый и фон глин час Chen HS, Lipton SA (июнь 2006 г.). «Химическая биология клинически переносимых антагонистов рецепторов NMDA» . Журнал нейрохимии . 97 (6): 1611–1626. doi : 10.1111/j.1471-4159.2006.03991.x . PMID 16805772 . S2CID 18376541 .
- ^ Jump up to: а беременный в дюймовый и Кемп Дж., Маккернан Р.М. (ноябрь 2002 г.). «Пути рецепторов NMDA в качестве лекарственных целей». Nature Neuroscience . 5 (11): 1039–1042. doi : 10.1038/nn936 . PMID 12403981 . S2CID 41383776 .
- ^ Jump up to: а беременный в дюймовый и фон глин час я Дж k л Липтон С.А. (февраль 2006 г.). «Сдвиг парадигмы в нейропротекции с помощью блокады рецептора NMDA: мемантин и за его пределами». Природные обзоры. Открытие наркотиков . 5 (2): 160–170. doi : 10.1038/nrd1958 . PMID 16424917 . S2CID 21379258 .
- ^ Jump up to: а беременный в дюймовый Koch HJ, Szecsey A, Haen E (1 января 2004 г.). «NMDA-Антагонизм (Мемантин): альтернативный фармакологический терапевтический принцип при болезни Альцгеймера и сосудистой деменции». Текущий фармацевтический дизайн . 10 (3): 253–259. doi : 10.2174/1381612043386392 . PMID 14754385 .
- ^ Steullet P, Neijt HC, Cuénod M, Do KQ (февраль 2006 г.). «Нарушение синаптической пластичности и гипофункция рецепторов NMDA, вызванных дефицитом глутатиона: отношение к шизофрении». Нейробиология . 137 (3): 807–819. doi : 10.1016/j.neuroscience.2005.10.014 . PMID 16330153 . S2CID 1417873 .
- ^ Jump up to: а беременный в дюймовый и фон глин Липтон С.А. (январь 2004 г.). «Неудачи и успехи антагонистов рецепторов NMDA: молекулярная основа для использования блокаторов с открытым каналом, таких как мемантин, при лечении острых и хронических неврологических оскорблений» . Нейрорус . 1 (1): 101–110. doi : 10.1602/neuroRx.1.1.101 . PMC 534915 . PMID 15717010 .
- ^ Yamakura T, Shimoji K (октябрь 1999 г.). «Субъединичная и специфичная для участка фармакология канала рецептора NMDA». Прогресс в нейробиологии . 59 (3): 279–298. doi : 10.1016/s0301-0082 (99) 00007-6 . PMID 10465381 . S2CID 24726102 .
- ^ Уоткинс Дж.С., Джейн де (январь 2006 г.). «История глутамата» . Британский журнал фармакологии . 147 (S1): S100 - S108. doi : 10.1038/sj.bjp.0706444 . PMC 1760733 . PMID 16402093 .
- ^ Jump up to: а беременный в Hardingham GE, Fukunaga Y, Bading H (май 2002). «Экстрасинаптические NMDARS выступают против синаптических NMDAR, запуская отключение CREB и пути гибели клеток». Nature Neuroscience . 5 (5): 405–414. doi : 10.1038/nn835 . PMID 11953750 . S2CID 659716 .
- ^ Jump up to: а беременный в Hardingham GE, Bading H (октябрь 2010 г.). «Синаптическая и экстрасинаптическая передача сигналов рецептора NMDA: последствия для нейродегенеративных расстройств» . Природные обзоры. Нейробиология . 11 (10): 682–696. doi : 10.1038/nrn2911 . PMC 2948541 . PMID 20842175 .
- ^ Bading H (март 2017 г.). «Терапевтическое нацеливание патологической триады экстрасинаптической передачи сигналов рецептора NMDA в нейродегенерациях» . Журнал экспериментальной медицины . 214 (3): 569–578. doi : 10.1084/jem.20161673 . PMC 5339681 . PMID 28209726 .
- ^ Jump up to: а беременный Ян Дж., Бенгтсон К.П., Бутхал Б., Хагенстон А.М., Бадинг Х (октябрь 2020 г.). «Связывание рецепторов NMDA и руководства TRPM4 обнаружение нетрадиционных нейропротекторов». Наука . 370 (6513): EAAY3302. doi : 10.1126/science.aay3302 . PMID 33033186 . S2CID 222210921 .
- ^ Jump up to: а беременный в дюймовый и Wanka L, Iqbal K, Schreiner PR (май 2013). «Липофильная пуля достигает целей: лекарственная химия производных адамантана» . Химические обзоры . 113 (5): 3516–3604. doi : 10.1021/cr100264t . PMC 3650105 . PMID 23432396 .
- ^ Beesley S, Kumar SS (ноябрь 2023 г.). «Рецептор TN-метил-D-аспартата: обоснование D-серина считается его обратным коагогом» . Нейрофармакология . 238 : 109654. DOI : 10.1016/j.neuropharm.2023.109654 . PMID 37437688 .
- ^ Jump up to: а беременный Лофтис Дж. М., Яновский А (январь 2003 г.). «Субъединица NR2B N-метил-D-аспартата NR2B: локализация, функциональные свойства, регуляция и клинические последствия». Фармакология и терапия . 97 (1): 55–85. doi : 10.1016/s0163-7258 (02) 00302-9 . PMID 12493535 .
- ^ Jump up to: а беременный Кристиансен Л.В., Уэрта I, Бенейто М., Мидор-Вудруфф Дж.Х. (февраль 2007 г.). «NMDA -рецепторы и шизофрения». Современное мнение о фармакологии . 7 (1): 48–55. doi : 10.1016/j.coph.2006.08.013 . PMID 17097347 .
- ^ Jump up to: а беременный в дюймовый Limapichat W, Yu WY, Branigan E, Lester HA, Dougherty DA (февраль 2013 г.). «Ключевые взаимодействия для мемантина в рецепторе NMDA» . ACS Химическая нейробиология . 4 (2): 255–260. doi : 10.1021/cn300180a . PMC 3751542 . PMID 23421676 .
- ^ Махер Т.Дж. (2013). «Глава 16: анестезиозные агенты: общие и местные анестетики». (PDF) . В Лемке Тл, Уильямс Д.А. (ред.). Принципы Фойи по лекарственной химии . Филадельфия: Липпинкотт Уильямс и Уилкинс. ISBN 978-1-60913-345-0 .
- ^ Danysz W, Parsons CG (сентябрь 2003 г.). «Антагонист -антагонист рецептора NMDA в качестве симптоматологического и нейропротективного лечения болезни Альцгеймера: доклинические данные». Международный журнал гериатрической психиатрии . 18 (Suppl 1): S23 - S32. doi : 10.1002/gps.938 . PMID 12973747 . S2CID 14852616 .
- ^ Стивенсон Ф.А. (ноябрь 2006 г.). «Структура и торговля рецепторами NMDA и GABAA». Биохимическое общество транзакций . 34 (Pt 5): 877–881. doi : 10.1042/bst0340877 . PMID 17052219 . S2CID 24875113 .
- ^ Teng H, Cai W, Zhou L, Zhang J, Liu Q, Wang Y, et al. (Октябрь 2010). «Эволюционная режим и функциональная дивергенция генов 2 -го рецептора позвоночных NMDA субъединицы 2» . Plos один . 5 (10): E13342. BIBCODE : 2010PLOSO ... 513342T . doi : 10.1371/journal.pone.0013342 . PMC 2954789 . PMID 20976280 .
- ^ Райан Т.Дж., Грант С.Г. (октябрь 2009 г.). «Происхождение и эволюция синапсов». Природные обзоры. Нейробиология . 10 (10): 701–712. doi : 10.1038/nrn2717 . PMID 19738623 . S2CID 5164419 .
- ^ Georgiv D, Taniura H, Kambe Y, Takarada T, Yoneda Y (август 2008 г.). «Критическое значение полиаминового сайта в рецепторах NMDA для роста нейритов и фасцикуляции на ранних стадиях дифференцировки нейронов P19». Экспериментальные исследования клеток . 314 (14): 2603–2617. doi : 10.1016/j.yexcr.2008.06.009 . PMID 18586028 .
- ^ Bunk EC, König HG, Prehn JH, Kirby BP (июнь 2014 г.). «Влияние антагониста субъединицы NR2B N-метил-D-аспартата NR2B на пролиферацию клеток-предшественников в гиппокампе» . Журнал исследований нейробиологии . 92 (6): 679–691. doi : 10.1002/jnr.23347 . PMID 24464409 . S2CID 18582691 .
- ^ Ван М., Ян Й., Ван С.Дж., Гамо Н.Дж., Джин Лей, Мазер Дж.А. и др. (Февраль 2013 г.). «Рецепторы NMDA сохраняют постоянную нейрональную стрельбу во время рабочей памяти в дорсолатеральной префронтальной коре» . Нейрон . 77 (4): 736–749. doi : 10.1016/j.neuron.2012.12.032 . PMC 35844418 . PMID 23439125 .
- ^ Yang St, Wang M, Paspalas CD, Crimins JL, Altman Mt, Mazer JA, Arnsten AF (апрель 2018 г.). «Основные различия в синаптической передаче сигналов между первичной визуальной и дорсолатеральной префронтальной корой» . Кора головного мозга . 28 (4): 1458–1471. doi : 10.1093/cercor/bhx357 . PMC 6041807 . PMID 29351585 .
- ^ Берт Дж. Б., Демирташ М., Экнер В.Дж., Навейр Н.М., Джи Дж.Л., Мартин В.Дж. и др. (Сентябрь 2018 г.). «Иерархия транскриптомной специализации в человеческой коре, захваченной структурной топографией нейровизуализации» . Nature Neuroscience . 21 (9): 1251–1259. doi : 10.1038/s41593-018-0195-0 . PMC 6119093 . PMID 30082915 .
- ^ Muntané G, Horvath Je, Hof PR, Ely JJ, Hopkins WD, Raghanti MA, et al. (Июнь 2015 г.). «Анализ экспрессии синаптических генов в неокортексе приматов выявляет эволюционные изменения в глутаматергической нейротрансмиссии» . Кора головного мозга . 25 (6): 1596–1607. doi : 10.1093/cercor/bht354 . PMC 4428301 . PMID 24408959 .
- ^ Bar-Shira O, Maor R, Chechik G (декабрь 2015 г.). «Переключение экспрессии генов рецепторных субъединиц в развитии человеческого мозга» . PLOS Computational Biology . 11 (12): E1004559. Bibcode : 2015plscb..11e4559b . doi : 10.1371/journal.pcbi.1004559 . PMC 4670163 . PMID 26636753 .
- ^ Лю XB, Мюррей К.Д., Джонс Эг (октябрь 2004 г.). «Переключение субъединиц NMDA рецептора 2A и 2B в таламических и корковых синапсах во время раннего постнатального развития» . Журнал нейробиологии . 24 (40): 8885–8895. doi : 10.1523/jneurosci.2476-04.2004 . PMC 6729956 . PMID 15470155 .
- ^ Tsien JZ (апрель 2000 г.). «Построение более легкой мыши». Scientific American . 282 (4): 62–68. Bibcode : 2000sciam.282d..62t . doi : 10.1038/Scientificamerican0400-62 . PMID 10789248 .
- ^ Liu Y, Wong TP, Aarts M, Rooyakkers A, Liu L, Lai TW, et al. (Март 2007 г.). «Субъединицы рецептора NMDA играют дифференциальную роль в опосредовании экситотоксической гибели нейронов как in vitro, так и in vivo» . Журнал нейробиологии . 27 (11): 2846–2857. doi : 10.1523/jneurosci.0116-07.2007 . PMC 6672582 . PMID 17360906 .
- ^ Чжоу М, Бодри М (март 2006 г.). «Изменения в развитии в нейротоксичности NMDA отражают изменения развития в субъединичном составе рецепторов NMDA» . Журнал нейробиологии . 26 (11): 2956–2963. doi : 10.1523/jneurosci.4299-05.2006 . PMC 6673978 . PMID 16540573 .
- ^ Rosa R, Burnashev N, Rozov A, Al. (Январь 1998). Важность внутриклюлярности . Смеситель 92 (2): 279–2 doi : s 10.1016 / PMID 9458051 . 9791935S2CID
- ^ Groc L, Choquet D, Stephenson FA, Verrier D, Manzoni OJ, Chavis P (сентябрь 2007 г.). «Транспортировка поверхности рецептора NMDA и состав синаптической субъединицы регулируются развитием белка внеклеточного матрикса» . Журнал нейробиологии . 27 (38): 10165–10175. doi : 10.1523/jneurosci.1772-07.2007 . PMC 6672660 . PMID 17881522 .
- ^ Espinosa JS, Luo L (март 2008 г.). «Время нейрогенеза и дифференцировки: понимание количественного клонального анализа клеток мозжечка гранулы» . Журнал нейробиологии . 28 (10): 2301–2312. doi : 10.1523/jneurosci.5157-07.2008 . PMC 2586640 . PMID 18322077 .
- ^ Gajendran N, Kapfhammer JP, Lain E, Canepari M, Vogt K, Wisden W, Brenner HR (февраль 2009 г.). «Передача сигналов neuregulin является неопределенной для экспрессии NMDA- и GABA (A) -рецептор в мозжечке in vivo» . Журнал нейробиологии . 29 (8): 2404–2413. doi : 10.1523/jneurosci.4303-08.2009 . PMC 6666233 . PMID 19244516 .
- ^ Jump up to: а беременный в дюймовый и фон глин час я Дж k л Депутат Парсонса, Рэймонд Л.А. (апрель 2014 г.). «Вовлечение экстрасинаптического рецептора NMDA при расстройствах центральной нервной системы» . Нейрон . 82 (2): 279–293. doi : 10.1016/j.neuron.2014.03.030 . PMID 24742457 .
- ^ Choi DW, Koh JY, Peters S (январь 1988 г.). «Фармакология нейротоксичности глутамата в культуре кортикальных клеток: ослабление антагонистами NMDA» . Журнал нейробиологии . 8 (1): 185–196. doi : 10.1523/jneurosci.08-01-00185.1988 . PMC 6569373 . PMID 2892896 .
- ^ Henchcliffe C (2007). Справочник по клинической неврологии . Нью -Йорк, штат Нью -Йорк, США: Медицинский колледж Корнелльского университета Вейлла, факультет неврологии и неврологии. С. 553–569.
- ^ Jump up to: а беременный в Hardingham GE, Bading H (февраль 2003 г.). «Инь и ян сигнализации рецептора NMDA». Тенденции в нейронауках . 26 (2): 81–89. doi : 10.1016/s0166-2236 (02) 00040-1 . PMID 12536131 . S2CID 26207057 .
- ^ Xia P, Chen HS, Zhang D, Lipton SA (август 2010 г.). «Мемантин преимущественно блокирует экстрасинаптические над синаптическими токами рецепторов NMDA в аутапах гиппокампа» . Журнал нейробиологии . 30 (33): 11246–11250. doi : 10.1523/jneurosci.2488-10.2010 . PMC 2932667 . PMID 20720132 .
- ^ Wang Y, Briz V, Chishti A, Bi X, Baudry M (ноябрь 2013). «Отдельные роли для μ-кальпаины и M-кальпаина в синаптической NMDAR-опосредованной нейропротекции и экстразинаптической NMDAR-опосредованной нейродегенерации» . Журнал нейробиологии . 33 (48): 18880–18892. doi : 10.1523/jneurosci.3293-13.2013 . PMC 3841454 . PMID 24285894 .
- ^ Xu J, Kurup P, Zhang Y, Goebel-Goody SM, Wu PH, Hawasli AH, et al. (Июль 2009 г.). «Экстрасинаптические рецепторы NMDA постепенно парутся к экситотоксичности посредством кальпаин-опосредованного расщепления шага» . Журнал нейробиологии . 29 (29): 9330–9343. doi : 10.1523/jneurosci.2212-09.2009 . PMC 2737362 . PMID 19625523 .
- ^ Карпова А., Михайлова М., Бера С., Бар Дж., Редди П.П., Бехниш Т. и др. (Февраль 2013 г.). «Кодирование и преобразование синаптического или экстрасинаптического происхождения сигналов рецептора NMDA в ядро» . Клетка . 152 (5): 1119–1133. doi : 10.1016/j.cell.2013.02.002 . PMID 23452857 .
- ^ Охота Д.Л., Кастильо П.Е. (июнь 2012 г.). «Синаптическая пластичность рецепторов NMDA: механизмы и функциональные последствия» . Современное мнение о нейробиологии . 22 (3): 496–508. doi : 10.1016/j.conb.2012.01.007 . PMC 3482462 . PMID 22325859 .
- ^ Li S, Jin M, Koeglsperger T, Shepardson NE, Shankar GM, Selkoe DJ (май 2011 г.). «Растворимые олигомеры Aβ ингибируют долгосрочное потенцирование посредством механизма, включающего чрезмерную активацию экстрасинаптических NR2B-рецепторов NMDA» . Журнал нейробиологии . 31 (18): 6627–6638. doi : 10.1523/jneurosci.0203-11.2011 . PMC 3100898 . PMID 21543591 .
- ^ Лю Д.Д., Ян Q, Ли Сент (апрель 2013 г.). «Активация экстрасинаптических рецепторов NMDA индуцирует LTD в нейронах CA1 гиппокампа крысы». Бюллетень исследования мозга . 93 : 10–16. doi : 10.1016/j.brainresbull.2012.12.003 . PMID 23270879 . S2CID 7836184 .
- ^ Папуин Т., Ладепече Л., Руэль Дж., Сакчи С., Лабаск М., Ханини М. и др. (Август 2012 г.). «Синаптические и экстрасинаптические рецепторы NMDA управляются различными эндогенными соагонами» . Клетка . 150 (3): 633–646. doi : 10.1016/j.cell.2012.06.029 . HDL : 11383/1788727 . PMID 22863013 .
- ^ Sanz-Clemente A, Nicoll RA, Roche KW (февраль 2013 г.). «Разнообразие в составе рецепторов NMDA: многие регуляторы, много последствий» . Нейробиолог . 19 (1): 62–75. doi : 10.1177/10738584411435129 . PMC 3567917 . PMID 22343826 .
- ^ Petralia RS, Wang YX, Hua F, Yi Z, Zhou A, Ge L, et al. (Апрель 2010). «Организация рецепторов NMDA в экстрасинаптических местах» . Нейробиология . 167 (1): 68–87. doi : 10.1016/j.neuroscience.2010.01.022 . PMC 2840201 . PMID 20096331 .
- ^ Lai TW, Shyu WC, Wang YT (май 2011 г.). «Пути инсульта вмешательства: рецепторы NMDA и за его пределами». Тенденции в молекулярной медицине . 17 (5): 266–275. doi : 10.1016/j.molmed.2010.12.008 . PMID 21310659 .
- ^ Jump up to: а беременный в дюймовый Beesley S, Sullenberger T, Crotty K, Ailani R, D'orio C, Evans K, et al. (Октябрь 2020 г.). «D-сэрин смягчает потерю клеток, связанную с эпилепсией височной доли» . Природная связь . 11 (1): 4966. Bibcode : 2020natco..11.4966b . doi : 10.1038/s41467-020-18757-2 . PMC 7532172 . PMID 33009404 .
- ^ Fourie C, Li D, Montgomery JM (февраль 2014 г.). «Якорный белок SAP97 влияет на торговлю и локализацией множественных мембранных каналов» . Biochimica et Biophysica Acta (BBA) - Biomembranes . 1838 (2): 589–594. doi : 10.1016/j.bbamem.2013.03.015 . PMID 23535319 .
- ^ Beesley S, Gunjan A, Kumar SS (2023). «Визуализация тригетеромерного состава субъединицы субъединицы N-метил-D-аспартата» . Границы в синаптической нейробиологии . 15 : 1156777. DOI : 10.3389/fnsyn.2023.1156777 . PMC 10244591 . PMID 37292368 .
- ^ Лукас DR, Newhouse JP (август 1957 г.). «Токсическое влияние L-глутамата натрия на внутренние слои сетчатки». АМА Архив офтальмологии . 58 (2): 193–201. doi : 10.1001/archopht.1957.00940010205006 . PMID 13443577 .
- ^ Милнервуд AJ, Gladding CM, Pouladi MA, Kaufman AM, Hines RM, Boyd JD, et al. (Январь 2010). «Раннее увеличение передачи сигналов и экспрессии рецептора NMDA способствует появлению фенотипа у мышей болезни Хантингтона» . Нейрон . 65 (2): 178–190. doi : 10.1016/j.neuron.2010.01.008 . PMID 20152125 . S2CID 12987037 .
- ^ Смит Р.С., Уолш Калифорния (февраль 2020 г.). «Ионно -канал функционирует в раннем развитии мозга» . Тенденции в нейронауках . 43 (2): 103–114. doi : 10.1016/j.tins.2019.12.004 . PMC 7092371 . PMID 31959360 .
- ^ Chen PE, Geballe MT, Stansfeld PJ, Johnston AR, Yuan H, Jacob AL, et al. (Май 2005 г.). «Структурные особенности сайта связывания глутамата в рекомбинантных рецепторах NR1/NR2A N-метил-D-аспартата, определяемых с помощью сайт-направленного мутагенеза и молекулярного моделирования». Молекулярная фармакология . 67 (5): 1470–1484. doi : 10.1124/моль.104.008185 . PMID 15703381 . S2CID 13505187 .
- ^ Wolosker H (октябрь 2006 г.). «Регуляция D-серин активности рецептора NMDA». Science's Stke . 2006 (356): PE41. doi : 10.1126/stke.3562006pe41 . PMID 17033043 . S2CID 39125762 .
- ^ Jump up to: а беременный Beesley S, Kumar SS (ноябрь 2023 г.). «Рецептор TN-метил-D-аспартата: обоснование D-серина считается его обратным коагогом» . Нейрофармакология . 238 : 109654. DOI : 10.1016/j.neuropharm.2023.109654 . PMID 37437688 .
- ^ Yarotskyy V, Glushakov AV, Sumners C, Gravenstein N, Dennis DM, Seubert CN, Martynyuk AE (май 2005). «Дифференциальная модуляция глутаматергической передачи 3,5-дибром-L-фенилаланином». Молекулярная фармакология . 67 (5): 1648–1654. doi : 10.1124/моль.104.005983 . PMID 15687225 . S2CID 11672391 .
- ^ Martynyuk AE, Seubert CN, Yarotskyy V, Glushakov AV, Gravenstein N, Sumners C, Dennis DM (ноябрь 2006 г.). «Галогенированные производные ароматических аминокислот демонстрируют сбалансированные антиглутаматергические действия: потенциальные применения для лечения неврологических и психоневрологических расстройств». Недавние патенты на обнаружение лекарств CNS . 1 (3): 261–270. doi : 10.2174/157488906778773706 . PMID 18221208 .
- ^ Cao W, Shah HP, Glushakov AV, Mecca AP, Shi P, Sumners C, et al. (Декабрь 2009 г.). «Эффективность 3,5-дибром-L-фениланина в моделях инсульта крыс, судорог и дефицита сенсомоторного стробирования » Британский журнал фармакологии 158 (8): 2005–2 Doi : 10.1111/ j.1476-5381.2009.00498.x 2807662PMC 20050189PMID
- ^ J. Moskal, D. Leander, R. Burch (2010). Разблокирование терапевтического потенциала рецептора NMDA. Новости о обнаружении и развитии наркотиков . Получено 19 декабря 2013 года.
- ^ Donello JE, Banerjee P, Li YX, Guo YX, Yoshitake T, Zhang XL, et al. (Март 2019). «Положительная модуляция N-метил-D-аспартата с помощью рапастинеля способствует быстрому и устойчивому антидепрессантным эффектам» . Международный журнал нейропсихофармакологии . 22 (3): 247–259. doi : 10.1093/ijnp/pyy101 . PMC 6403082 . PMID 30544218 .
- ^ Андерсон С. (2003-06-01). «Плохие новости не в: взгляду на диссоциативное повреждение мозга и когнитивные нарушения» . EROWID DXM хранилища: здоровье . Получено 2008-12-17 .
- ^ Jump up to: а беременный Полет MH (декабрь 2013 г.). «Пробные часы: повышение фазы II для антидепрессантов, нацеленных на глутамат» . Природные обзоры. Открытие наркотиков . 12 (12): 897. doi : 10.1038/nrd4178 . PMID 24287771 . S2CID 33113283 .
- ^ Jump up to: а беременный Vécsei L, Szalárdy L, Fülöp F, Dodi J (январь 2013 г.). «Кинуренины в ЦНС: последние достижения и новые вопросы». Природные обзоры. Открытие наркотиков . 12 (1): 64–82. doi : 10.1038/nrd3793 . PMID 23237916 . S2CID 31914015 .
- ^ Reis DJ, Regunathan S (май 2000). "Является ли агматин новым нейротрансмиттером в мозге?" Полем Тенденции в фармакологических науках . 21 (5): 187–193. doi : 10.1016/s0165-6147 (00) 01460-7 . PMID 10785653 .
- ^ Гибсон Д.А., Харрис Б.Р., Роджерс Д.Т., Литтлтон Дж. М. (октябрь 2002 г.). «Исследования связывания радиолиганда показывают, что агматин является более селективным антагонистом для полиаминового сайта на рецепторе NMDA, чем Arcaine или ifenprodil». Исследование мозга . 952 (1): 71–77. doi : 10.1016/s0006-8993 (02) 03198-0 . PMID 12363406 . S2CID 38065910 .
- ^ Мюллер А.Л., Артман Л.Д., Баландрин М.Ф., Брэди Э., Чиен Й., Делмар Э.Г. и др. (2000). «NPS 1506, антагонист неконкурентоспособного неконкурентоспособности NMDA -рецептора NMDA: доклинический краткий и клинический опыт». Аминокислоты . 19 (1): 177–179. doi : 10.1007/s007260070047 . PMID 11026487 . S2CID 2899648 .
- ^ Monge-Fuentes V, Gomes FM, Campos GA, Silva J, Biolchi AM, Dos Anjos LC, et al. (2015). «Нейроактивные соединения, полученные из ядов членистоногих в качестве новых терапевтических платформ для лечения неврологических расстройств» . Журнал ядовитых животных и токсинов, включая тропические заболевания . 21 : 31. doi : 10.1186/s40409-015-0031-x . PMC 4529710 . PMID 26257776 .
- ^ Поп E (сентябрь 2000 г.). «Непсихотропные синтетические каннабиноиды». Текущий фармацевтический дизайн . 6 (13): 1347–1360. doi : 10.2174/1381612003399446 . PMID 10903397 .
- ^ Feigenbaum JJ, Bergmann F, Richmond SA, Mechoulam R, Nadler V, Kloog Y, Sokolovsky M (декабрь 1989 г.). «Непсихотропный каннабиноид действует как функциональный N-метил-D-аспартатный блокатор рецепторов» . Труды Национальной академии наук Соединенных Штатов Америки . 86 (23): 9584–9587. Bibcode : 1989pnas ... 86.9584f . doi : 10.1073/pnas.86.23.9584 . PMC 298542 . PMID 2556719 .
- ^ Nadler V, Mechoulam R, Sokolovsky M (сентябрь 1993 г.). «Блокада 45CA2+ приток через N-метил-D-аспартатный рецепторный ионный ионный канал непсихоактивного каннабиноида HU-211». Исследование мозга . 622 (1–2): 79–85. doi : 10.1016/0006-8993 (93) 90804-V . PMID 8242387 . S2CID 36689761 .
- ^ Каракас Э., Симоровский Н., Фурукава Х (июнь 2011 г.). «Расположение субъединиц и связывание фенилэтаноламина в NMDA -рецепторах Glun1/Glun2b» . Природа . 475 (7355): 249–253. doi : 10.1038/nature10180 . PMC 3171209 . PMID 21677647 .
- ^ Glushakov AV, Dennis DM, Morey TE, Sumners C, Cucchiara RF, Seubert CN, Martynyuk AE (2002). «Специфическое ингибирование N-метил-D-аспартатной функции рецептора в нейронах гиппокампа крысы L-фенилаланином в концентрациях, наблюдаемых во время фенилкетонурии» . Молекулярная психиатрия . 7 (4): 359–367. doi : 10.1038/sj.mp.4000976 . PMID 11986979 .
- ^ Glushakov AV, Glushakova O, Varshney M, Bajpai LK, Sumners C, Laipis PJ, et al. (Февраль 2005 г.). «Долгосрочные изменения глутаматергической синаптической передачи при фенилкетонурии» . Мозг . 128 (Pt 2): 300–307. doi : 10.1093/brain/awh354 . PMID 15634735 .
- ^ Клиническое исследование номер NCT00188383 для «влияния антагонизма N -метил-D-аспартата (NMDA) -рецептор на гипералгезию, употребление опиоидов и боль после радикальной простатэктомии» на клинике.
- ^ Ludolphg, Udvarard Pt, Schaaz (Там 2010). Блокатор рецепторов NMDA является клинически возвратной концентрацией . Британский журнал . 160 (2): 283–2 doi : 1111/j.1476-5381.010.010.0707.x . PMC 2874851 . PMID 20423340 .
- ^ Shultz RB, Zhong Y (май 2017 г.). «Миноциклин нацелен на множественные механизмы вторичного повреждения при травматическом повреждении спинного мозга» . Исследование нейронной регенерации . 12 (5): 702–713. doi : 10.4103/1673-5374.206633 . PMC 5461601 . PMID 28616020 .
- ^ Jump up to: а беременный в дюймовый Липтон С.А. (октябрь 2007 г.). «Патологически активированная терапия для нейропротекции». Природные обзоры. Нейробиология . 8 (10): 803–808. doi : 10.1038/nrn2229 . PMID 17882256 . S2CID 34931289 .
- ^ Сколник П., Боже К., Миллер Р., Пеннингтон М., Макчекчини М.Л. (октябрь 1992). «Неконкурентное ингибирование N-метил-D-аспартата с помощью конантокина-G: доказательства аллостерического взаимодействия в полиаминовых сайтах». Журнал нейрохимии . 59 (4): 1516–1521. doi : 10.1111/j.1471-4159.1992.tb08468.x . PMID 1328523 . S2CID 25871948 .
- ^ Huggins DJ, Grant GH (январь 2005 г.). «Функция амино -терминального домена в модуляции рецептора NMDA». Журнал молекулярной графики и моделирования . 23 (4): 381–388. doi : 10.1016/j.jmgm.2004.11.006 . PMID 15670959 .
- ^ Hawasli AH, Benavides DR, Nguyen C, Kansy JW. (Июль 2007 г.). Пластичность через контроль над синаптичностью . Nature Neuroscience 10 (7): 880–8 doi : 10.1038/nn1914 . PMC 391013 . 17529984PMID
- ^ Zhang S, Edelmann L, Liu J, Crandall JE, Morabito MA (январь 2008 г.). «CDK5 регулирует фосфорилирование тирозина 1472 NR2B и поверхностной экспрессии рецепторов NMDA» . Журнал нейробиологии . 28 (2): 415–424. doi : 10.1523/jneurosci.1900-07.2008 . PMC 6670547 . PMID 18184784 .
- ^ Chen Y, Beffert U, Ertunc M, Tang TS, Kavalali ET, Bezprozvanny I, Herz J (сентябрь 2005 г.). «Reelin модулирует активность рецептора NMDA в корковых нейронах» . Журнал нейробиологии . 25 (36): 8209–8216. doi : 10.1523/jneurosci.1951-05.2005 . PMC 6725528 . PMID 16148228 .
- ^ Yu XM, Askalan R, Keil GJ, Salter MW (январь 1997 г.). «Регуляция канала NMDA с помощью канала, ассоциированной с каналом белковой тирозинкиназы SRC». Наука . 275 (5300): 674–678. doi : 10.1126/science.275.5300.674 . PMID 9005855 . S2CID 39275755 .
- ^ Petrouzzle T, Boss F, Texts V, Panacis A, Rose V, Corvin A, et al. (Январь 2022). "Нет + /Что 2+ Обменной изоформа 1 принимает участие в CA 2+ -Сотеденный пробурвивалный путь SOD1 в первичных моторных нейронах, подвергшихся воздействию бета-метиламино-L-аланина » . Клеточная связь и передача сигналов . 20 (1): 8. doi : /S12964-021-00813-Z . PMC 8756626. 10.1186 PMID 35022040 Полем
- ^ Хорнинг MS, Trombley PQ (октябрь 2001 г.). «Цинк и медь влияют на возбудимость нейронов обонятельной луковицы крысы с помощью множественных механизмов». Журнал нейрофизиологии . 86 (4): 1652–1660. doi : 10.1152/jn.2001.86.4.1652 . PMID 11600628 . S2CID 6141092 .
- ^ Neal AP, Stansfield KH, Worley PF, Thompson RE, Guilarte TR (июль 2010 г.). «Воздействие свинца во время синаптогенеза изменяет везикулярные белки и нарушает везикулярное высвобождение: потенциальная роль передачи сигналов BDNF-рецептора NMDA» . Токсикологические науки . 116 (1): 249–263. doi : 10.1093/toxsci/kfq111 . PMC 2886862 . PMID 20375082 .
- ^ Jump up to: а беременный Fourgeaud L, Davenport CM, Tyler CM, Cheng TT, Spencer MB, Boulanger LM (декабрь 2010 г.). «MHC класса I модулирует функцию рецептора NMDA и транспортировку рецепторов AMPA» . Труды Национальной академии наук Соединенных Штатов Америки . 107 (51): 22278–22283. BIBCODE : 2010PNAS..10722278F . doi : 10.1073/pnas.0914064107 . PMC 3009822 . PMID 21135233 .
- ^ Huh GS, Boulanger LM, Du H, Riquelme PA, Brotz TM, Shatz CJ (декабрь 2000 г.). «Функциональные требования для MHC класса I в разработке и пластичности ЦНС» . Наука . 290 (5499): 2155–2159. Bibcode : 2000sci ... 290.2155h . doi : 10.1126/science.290.5499.2155 . PMC 2175035 . PMID 11118151 .
- ^ Нельсон П.А., Шайдж младший, Вуд С.К., Давенпорт С.М., Анагностарас С.Г., Булангер Л.М. (сентябрь 2013 г.). «Иммунные белки MHC класса I имеют решающее значение для гиппокампа-зависимой памяти и GATE NMDAR-зависимой долгосрочной депрессии гиппокампа» . Обучение и память . 20 (9): 505–517. doi : 10.1101/lm.031351.113 . PMC 3744042 . PMID 23959708 .
- ^ Traynelis SF, Cull-Candy SG (май 1990). «Протон-ингибирование N-метил-D-аспартатных рецепторов в мозжечке нейронов». Природа . 345 (6273): 347–350. Bibcode : 1990natur.345..347t . doi : 10.1038/345347a0 . PMID 1692970 . S2CID 4351139 .
- ^ Aizenman E, Lipton SA, Loring RH (март 1989 г.). «Селективная модуляция ответов NMDA путем восстановления и окисления». Нейрон . 2 (3): 1257–1263. doi : 10.1016/0896-6273 (89) 90310-3 . PMID 2696504 . S2CID 10324716 .
- ^ Монаган Д.Т., Джейн Де (2009). «Фармакология рецепторов NMDA» . В Ван Донген ум (ред.). Биология рецептора NMDA . Границы в нейробиологии. Бока Ратон, Флорида: CRC Press. ISBN 978-1-4200-4414-0 Полем PMID 21204415 .
- ^ Jump up to: а беременный в дюймовый Sonkusare SK, Kaul CL, Ramarao P (январь 2005 г.). «Деменция болезни Альцгеймера и других нейродегенеративных расстройств-Мемантин, новая надежда». Фармакологические исследования . 51 (1): 1–17. doi : 10.1016/j.phrs.2004.05.005 . PMID 15519530 .
- ^ Bodhintan K, Li W, et al. (Октябрь 2015). «Фармакологически целевой антагонизм рецептора NMDA с помощью нитромемантина при цереброваскулярных заболеваниях» . Научные отчеты 5 5 : 14781. Bibcode : 2015 Natts ... 514781t doi : 10.1038/ srep1 PMC 4609936 . PMID 2647507 .
- ^ Purves D, Augustine GJ, Fitzpatrick D, Hall WC, Lamantia AS, McNamara JD, White LE (2008). Нейробиология (4 -е изд.). Sinauer Associates. С. 129–131. ISBN 978-0-87893-697-7 Полем Архивировано из оригинала 2011-09-27.
- ^ Варгас-Кабалеро М., Робинсон Х.П. (июль 2004 г.). «Быстрая и медленная зависимая от напряжения динамика блока магния в рецепторе NMDA: асимметричная модель блока захвата» . Журнал нейробиологии . 24 (27): 6171–6180. doi : 10.1523/jneurosci.1380-04.2004 . PMC 6729657 . PMID 15240809 .
- ^ Purves D, Augustine GJ, Fitzpatrick D, Hall WC, Lamantia AS, McNamara JD, White LE (2008). Нейробиология (4 -е изд.). Sinauer Associates. С. 191–195. ISBN 978-0-87893-697-7 Полем Архивировано из оригинала 2011-09-27.
- ^ Nowak L, Bregestovski P, Ascher P, Herbet A, Prochiantz A (февраль 1984 г.). «Магниевые ворота, активируемые глутаматом каналы в центральных нейронах мыши». Природа . 307 (5950): 462–465. Bibcode : 1984natur.307..462n . doi : 10.1038/307462a0 . PMID 6320006 . S2CID 4344173 .
- ^ Wijesinghe R (2014). «Новые методы лечения депрессии устойчивой к лечению» . Ment Health Clin . 4 (5): 56. doi : 10.9740/mhc.n207179 . ISSN 2168-9709 .
- ^ Пун Л. (2014). «Растущие доказательства того, что партийный препарат может помочь тяжелой депрессии» . ЭНЕРГЕТИЧЕСКИЙ ЯДЕРНЫЙ РЕАКТОР.
- ^ Stix G (2014). «От клуба к клинике: врачи выдвигают кетамин вне посадки в качестве быстрого лечения депрессии» . Scientific American.
- ^ Jump up to: а беременный McEwen BS, Chattarji S, Diamond DM, Jay TM, Regan LP, Svenningsson P, Fuchs E (март 2010 г.). «Нейробиологические свойства тианептина (Stablon): от моноаминовой гипотезы до глутаматергической модуляции» . Молекулярная психиатрия . 15 (3): 237–249. doi : 10.1038/mp.2009.80 . PMC 2902200 . PMID 19704408 .
- ^ McEwen BS, Chattarji S (декабрь 2004 г.). «Молекулярные механизмы нейропластичности и фармакологических последствий: пример тианептина». Европейская нейропсихофармакология . 14 (Suppl 5): S497 - S502. doi : 10.1016/j.euroneuro.2004.09.008 . PMID 15550348 . S2CID 21953270 .
- ^ McEwen BS, Olié JP (июнь 2005 г.). «Нейробиология настроения, тревоги и эмоций, как выявили исследования уникального антидепрессанта: тианептина» . Молекулярная психиатрия . 10 (6): 525–537. doi : 10.1038/sj.mp.4001648 . PMID 15753957 .
- ^ Brink CB, Harvey BH, Brand L (январь 2006 г.). «Тианептин: новый нетипичный антидепрессант, который может дать новое понимание биомолекулярной основы депрессии» . Недавние патенты на обнаружение лекарств CNS . 1 (1): 29–41. doi : 10.2174/157488906775245327 . PMID 18221189 . Архивировано с оригинала 2013-04-14 . Получено 2020-04-12 .
{{cite journal}}: Cs1 maint: непредвзятый URL ( ссылка ) - ^ Jump up to: а беременный Kasper S, McEwen BS (2008). «Нейробиологические и клинические эффекты антидепрессантного тианептина». ЦНС лекарства . 22 (1): 15–26. doi : 10.2165/00023210-200822010-00002 . PMID 18072812 . S2CID 30330824 .
- ^ Маунт С, Даунтон С (июль 2006 г.). "Болезнь Альцгеймера: прогресс или прибыль?" Полем Природная медицина . 12 (7): 780–784. doi : 10.1038/nm0706-780 . PMID 16829947 .
- ^ Nice Technology Appraisal 18 января 2011 г. Болезнь Азаймера - Донепезил, Галантамин, Ривастигмин и Мемантин (обзор): Окончательное определение оценки
- ^ Todd A Hardy, Reddel, Barnett, Palace, Lucchinetti, Weinshenker, атипичные воспалительные демиелинизирующие синдромы CNS, неврология Lancet, том 15, выпуск 9, август 2016 г., страницы 967-981, doi: https://doi.org. /10.1016/S1474-4422(16)30043-6 , доступно в [1]
- ^ Lisman JE, Coyle JT, Green RW, Javitt DC, Benes FM, Heckers S, Grace AA (май 2008 г.). «Основанная на схеме структура для понимания нейротрансмиттера и взаимодействия генов риска при шизофрении» . Тенденции в нейронауках . 31 (5): 234–242. doi : 10.1016/j.tins.2008.02.005 . PMC 2680493 . PMID 18395805 .
- ^ Santos E, Olivares-Rivera A, Major S, Sánchez-Porras R, Uhlmann L, Kunzmann K, et al. (Декабрь 2019). «Продолжительный S-кектамин блока распределения деполяризации при субарахноидальном кровоизлиянии: ретроспективное когортное исследование» . Интенсивная помощь . 23 (1): 427. doi : 10.1186/s13054-019-2711-3 . PMC 6937792 . PMID 31888772 .