Цианид водорода
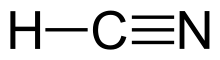
| |||
| |||

| |||
| Имена | |||
|---|---|---|---|
| Имя IUPAC
Формонитрил [ 2 ]
| |||
| Систематическое имя IUPAC
Метанатрил [ 2 ] | |||
Другие имена
| |||
| Идентификаторы | |||
3D model ( JSmol )
|
|||
| 3dmet | |||
| Чеби | |||
| Chemspider | |||
| Echa Infocard | 100.000.747 | ||
| ЕС номер |
| ||
| Кегг | |||
| Сетка | Водород+цианид | ||
PubChem CID
|
|||
| Rtecs номер |
| ||
| НЕКОТОРЫЙ | |||
| Номер | 1051 | ||
Comptox Dashboard ( EPA )
|
|||
| Характеристики | |||
| HCN | |||
| Молярная масса | 27.0253 g/mol | ||
| Появление | Бесцветная жидкость или газ | ||
| Запах | Горький миндальный [ 3 ] | ||
| Плотность | 0,6876 г/см 3 [ 4 ] | ||
| Точка плавления | −13,29 ° C (8,08 ° F; 259,86 K) [ 4 ] | ||
| Точка кипения | 26 ° C (79 ° F; 299 K) [ 4 ] : 4.67 | ||
| Смешиваемая | |||
| Растворимость в этаноле | Смешиваемая | ||
| Давление паров | 100 кПа (25 ° C) [ 4 ] : 6.94 | ||
Закон Генри
постоянная ( K H ) |
75 мкмоль PA −1 кг −1 | ||
| Кислотность (p k a ) | 9.21 (в воде),
12.9 (в DMSO) [ 5 ] | ||
| Основность (P K B ) | 4.79 (цианидный анион) | ||
| Сопряженная кислота | Гидроцианий | ||
| Сопряженная база | Цианид | ||
Показатель преломления ( N D )
|
1.2675 [ 6 ] | ||
| Вязкость | 0,183 МПа · с (25 ° C) [ 4 ] : 6.231 | ||
| Структура | |||
| тетрагональный (> 170 К) Орторомбический (<170 К) [ 7 ] | |||
| C ∞v | |||
| Линейный | |||
| 2,98 г | |||
| Термохимия | |||
Теплоемкость ( с )
|
35,9 JK −1 мол −1 (газ) [ 4 ] : 5.19 | ||
Std Molar
энтропия ( с ⦵ 298 ) |
201.8 JK −1 мол −1 | ||
Энтальпия STD
образование (Δ f h ⦵ 298 ) |
135,1 кДж раз −1 | ||
| Опасности | |||
| GHS Маркировка : | |||
   
| |||
| Опасность | |||
| H225 , H300+H310+H330 , H319 , H336 , H370 , H410 | |||
| P210 , P261 , P305+P351+P338 | |||
| NFPA 704 (Огненная бриллиант) | |||
| точка возгорания | −17,8 ° C (0,0 ° F; 255,3 К) | ||
| 538 ° C (1000 ° F; 811 K) | |||
| Взрывные пределы | 5.6% – 40.0% [ 8 ] | ||
| Смертельная доза или концентрация (LD, LC): | |||
LC 50 ( медианная концентрация )
|
501 м.д. (крыса, 5 мин) 323 ч / млн (мышь, 5 мин) 275 ч / млн (крыса, 15 мин) 170 ч / млн (крыса, 30 мин) 160 ч / млн (крыса, 30 мин) 323 ч / млн (крыса, 5 мин) [ 9 ] | ||
LC LO ( самый низкий опубликован )
|
200 ч / млн (млекопитающее, 5 мин) 36 ч / млн (млекопитающее, 2 часа) 107 ч / млн (человек, 10 минут) 759 ч / млн (кролик, 1 мин) 759 ч / млн (кошка, 1 мин) 357 ч / млн (человек, 2 мин) 179 ч / млн (человек, 1 час) [ 9 ] | ||
| Niosh (пределы воздействия на здоровье США): | |||
Пел (допустимый)
|
TWA 10 ч/млн (11 мг/м 3 ) [кожа] [ 8 ] | ||
Rel (рекомендуется)
|
ST 4,7 ч/млн (5 мг/м 3 ) [кожа] [ 8 ] | ||
IDLH (немедленная опасность)
|
50 ч / млн [ 8 ] | ||
| Связанные соединения | |||
Связанные алканенитрилы
|
|||
За исключением случаев, когда отмечены, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа).
| |||
Цианид водорода (ранее известный как прусскую кислоту ) является химическим соединением с формулой HCN и структурной формулой H - C≡N . Это высокотоксичная и легковоспламеняющаяся жидкость , которая кипит немного выше комнатной температуры , при 25,6 ° C (78,1 ° F). HCN производится в промышленном масштабе и является высоко ценным предшественником многих химических соединений, начиная от полимеров до фармацевтических препаратов. Крупномасштабные применения предназначены для производства цианида калия и адипонитрила , используемых в горнодобывающих и пластмассах соответственно. [ 10 ] Он более токсичен, чем твердые цианидные соединения из -за его нестабильной природы. Раствор цианида водорода в воде , представленном в качестве HCN, называется гидроциановой кислотой . Соли как цианидного аниона известны цианиды .
Является ли цианид водорода органическим соединением или нет, является темой дебатов среди химиков, а мнения варьируются от автора к автору. Традиционно это считается неорганическим со стороны значительного числа авторов. Вопреки этой точке зрения, он считается органичным другими авторами, потому что цианид водорода принадлежит классу органических соединений, известных как нитрилы , которые имеют формулу R - C≡N , где r обычно является органической группой (например, алкил или арилом ) или водородом . [ 11 ] В случае цианида водорода группа R представляет собой водород H, поэтому другие названия цианида водорода являются метанатрилом и форманитрилом. [ 2 ]
Структура и общие свойства
[ редактировать ]Кианид водорода является линейной молекулой с тройной связью между углеродом и азотом . Таутомер HCN - HNC, водород изоцианид . [ Цитация необходима ]
У HCN слабый горький миндальный запах , который некоторые люди не могут обнаружить из -за рецессивной генетической черты . [ 12 ] Летучие . соединения использовалось в качестве вдыхания розенденцидов и человеческого яда, а также для убийства китов [ 13 ] Цианидные ионы мешают железосодержащим респираторным ферментам. [ Цитация необходима ]
Химические свойства
[ редактировать ]Цианид водорода слабо кислый с P K A 9,2. Частично ионизируется в воде , чтобы получить цианидный анион, CN − Полем HCN образует водородные связи с его сопряженным основанием, такими видами, как (Cn − (HCN) n . [ 14 ]
Кианид водорода реагирует с алкенами с получением нитрилов. Преобразование, которое называется гидроцианией , использует никелевые комплексы в качестве катализаторов. [ 15 ]
- Rch = ch 2 + hcn → rch 2 −ch 2 cn
Четыре молекулы HCN будут тетрамеризуются в диаминомалеонитрил . [ 16 ]
Цианиды металлов обычно готовятся метатезом соли из солей цианидов щелочных металлов, но ртутный цианид образуется из водного цианида водорода: [ 17 ]
- Hgo + 2 hcn → hg (cn) 2 + h 2 o
История открытия
[ редактировать ]Кианид водорода был сначала выделен в 1752 году французским химиком Пьером МакКером, который превратил прусский синий в оксид железа плюс летучий компонент, и что их можно использовать для восстановления его. [ 18 ] Новый компонент был тем, что теперь известно как цианид водорода. Впоследствии он был подготовлен из прусского синего шведского химика Карла Вильгельма Шила в 1782 году, [ 19 ] и в конечном итоге было дано немецкое название Blausäure ( горит . На английском языке это стало известно как прусскую кислоту.
В 1787 году французский химик Клод Луи Бертоллет показал, что прусская кислота не содержит кислорода, [ 20 ] Важный вклад в теорию кислоты, которая до сих пор постулировала, что кислоты должны содержать кислород [ 21 ] (Отсюда и название самого кислорода , которое получено из греческих элементов, которые означают «кислотный формер» и также калика в немецком языке как Sauerstoff ). В 1811 году Джозеф Луи Гей-Луссак приготовил чистый, жидкий водород цианид. [ 22 ] В 1815 году гей-Люссак вышел из химической формулы прусной кислоты. [ 23 ] Радикальный цианид в цианиде водорода получил свое название от голубых , не только английское слово для оттенка синего, но и греческого слова для синего цвета ( древнегреческий : κύανος ), опять же из -за его получения от прусского синего.
Производство и синтез
[ редактировать ]Наиболее важным процессом является окисление андруссова, изобретенное Леонидом Андруссоу в IG Farben, при котором метан и аммиак реагируют в присутствии кислорода примерно при 1200 ° C (2190 ° F) над платиновым катализатором: [ 24 ]
- 2 CH 4 + 2 NH 3 + 3 O 2 → 2 HCN + 6 H 2 O
В 2006 году в США было произведено от 500 миллионов до 1 миллиарда фунтов (от 230 000 до 450 000 т). [ 25 ] Кианид водорода производится в больших количествах несколькими процессами и является извлеченным отходом из производства акрилонитрила . [ 10 ]
Меньшее значение имеет процесс ДеГусса ( процесс BMA ), в котором кислород не добавляется, и энергия должна быть косвенно переносится через стенку реактора: [ 26 ]
- CH 4 + NH 3 → HCN + 3H 2
Эта реакция сродни парому реформированию , реакции метана и воды с получением угарного газа и водорода .
В процессе Шавинигана углеводороды , например , пропан реагируют с аммиаком.
В лаборатории небольшие количества HCN продуцируются добавлением кислот к солям цианидов щелочных металлов :
- ЧАС + + Cn − → HCN
Эта реакция иногда является основой случайных отравлений, потому что кислота превращает нелетую цианидную соль в газообразную HCN.
Кианид водорода может быть получен из калия феррицианидом и кислотой:
Исторические методы производства
[ редактировать ]Большая потребность в цианидах для добычи полезных ископаемых в 1890 -х годах была удовлетворена Джорджем Томасом Бейлби , который запатентовал метод производства цианида водорода путем прохождения аммиака над светящимся углем в 1892 году. Этот метод использовался до тех пор, пока Гамильтон Каснер в 1894 году не развил синтез, начавшийся из угля. , аммиак и натрия , получающий цианид натрия , который реагирует с кислотой с образованием газообразного HCN.
Приложения
[ редактировать ]HCN является предшественником цианида натрия и цианида калия , которые используются в основном в добыче золота и серебра , а также для гальванизации этих металлов. Через мелиацию цианогидринов из HCN готовится различные полезные органические соединения, включая мономер метилметакрилат , из ацетона , аминокислотный метионин , через синтез Strecker и хелатирующие агенты EDTA и NTA . Благодаря процессу гидроцианации HCN добавляется в бутадиен , чтобы дать адипонитрил , предшественник нейлона-6,6 . [ 10 ]
HCN используется во всем мире как фумигант против многих видов насекомых -вредителей, которые заражают продукты питания. Как его эффективность, так и метод применения приводят к очень небольшим количествам используемого фумиганта по сравнению с другими токсичными веществами, используемыми для одной и той же цели. [ 29 ] Использование HCN в качестве фумиганта также оказывает меньшее воздействие на окружающую среду по сравнению с некоторыми другими фумигантами, такими как сульфурил -фторид , [ 30 ] и метил бромид . [ 31 ]
Возникновение
[ редактировать ]HCN можно получить от фруктов , которые имеют яму , такой как вишня , абрикосы , яблоки и орехи, такие как горький миндаль , из которого производится миндальное масло и экстракт. Многие из этих ям содержат небольшие количества цианогидринов, таких как манделонитрил и миндалина , которые медленно высвобождают цианид водорода. [ 32 ] [ 33 ] Сто грамм раздавленных семян яблока могут дать около 70 мг HCN. [ 34 ] Корни растений маниоки содержат цианогенные гликозиды , такие как линамарин , которые разкладываются в HCN на урожайности до 370 мг на килограмм свежего корня. [ 35 ] Некоторые Millipedes , такие как Harpaphe Haydeniana , Desmoxytes purpurosea и Apheloria высвобождают водородный цианид как защитный механизм, [ 36 ] Как и некоторые насекомые, такие как мотыльки Бернет и личинки Paropsisterna Eucalyptus . [ 37 ] Цианид водорода содержится в выхлопной газе, а в дыме от сжигания азотных пластиков .
На Титане
[ редактировать ]HCN был измерен в атмосфере Титана четырьмя инструментами на космическом зонде Кассини , на одном инструменте на Voyager и одном инструменте на Земле. [ 38 ] Одним из этих измерений было in situ , где космический корабль Cassini упал от 1000 до 1100 км (620 и 680 миль) над поверхностью Титана, чтобы собрать атмосферный газ для анализа масс -спектрометрии . [ 39 ] Первоначально HCN образуется в атмосфере Титана посредством реакции фотохимически продуцируемых метана и азотных радикалов, которые проходят через промежуточное соединение H 2 CN, например, (CH 3 + N → H 2 CN + H → HCN + H 2 ). [ 40 ] [ 41 ] Ультрафиолетовое излучение разбивает HCN на CN + H; Однако CN эффективно переработана обратно в HCN через реакцию CN + CH 4 → HCN + CH 3 . [ 40 ]
На молодой земле
[ редактировать ]Было постулировано, что углерод из каскада астероидов (известный как поздняя тяжелая бомбардировка ), возникающий в результате взаимодействия Юпитера и Сатурна, взорвал поверхность молодой земли и реагировал с азотом в атмосфере Земли с образованием HCN. [ 42 ]
У млекопитающих
[ редактировать ]Некоторые авторы [ ВОЗ? ] показали, что нейроны могут продуцировать цианид водорода при активации их опиоидных рецепторов эндогенными или экзогенными опиоидами. Они также показали, что выработка нейронов HCN активирует рецепторы NMDA и играет роль в передаче сигнала между нейрональными клетками ( нейротрансмиссия ). Более того, повышенная эндогенная выработка HCN HCN при опиоидах, по -видимому, необходима для адекватной опиоидной анальгезии , поскольку анальгетическое действие опиоидов было ослаблено мусорщиками HCN. Они считали эндогенный HCN как нейромодулятор . [ 43 ]
Также было показано, что при стимулировании мускариновых холинергических рецепторов в культивируемых феохромоцитомы клетках увеличивает выработку HCN в живом организме ( in vivo ) мускариновой холинергической стимуляции фактически снижает выработку HCN. [ 44 ]
Лейкоциты генерируют HCN во время фагоцитоза и могут убивать бактерии , грибы и другие патогены, генерируя несколько различных токсичных химических веществ, одним из которых является цианид водорода. [ 43 ]
Было показано, что вазодилатация , вызванная нитропроссидом натрия, опосредована не только генерацией, но также и эндогенной генерацией цианида, которая добавляет не только токсичность, но и некоторую дополнительную антигипертензивную эффективность по сравнению с нитроглицерином и другими нецианогенными нитратами, которые не вызывают Уровень цианида в крови для повышения. [ 45 ]
HCN является составляющей табачного дыма . [ 46 ]
HCN и происхождение жизни
[ редактировать ]Кианид водорода обсуждался в качестве предшественника аминокислот и нуклеиновых кислот, и предполагается, что он сыграл роль в происхождении жизни . [ 47 ] Хотя взаимосвязь этих химических реакций к происхождению теории жизни остается спекулятивной, исследования в этой области привели к открытиям новых путей к органическим соединениям, полученным из конденсации HCN (например, аденин ). [ 48 ]
В космосе
[ редактировать ]HCN был обнаружен в межзвездной среде [ 49 ] и в атмосферах углеродных звезд . [ 50 ] С тех пор обширные исследования провели исследование формирования и путей разрушения HCN в различных средах и изучали его использование в качестве индикатора для различных астрономических видов и процессов. HCN можно наблюдать из наземных телескопов через ряд атмосферных окон. [ 51 ] J = 1 → 0, J = 3 → 2, J = 4 → 3 и J = 10 → 9 чистых вращательных переходов . [ 49 ] [ 52 ] [ 53 ]
HCN образуется в межзвездных облаках через один из двух основных путей: [ 54 ] через нейтральную реакцию (CH 2 + N → HCN + H) и посредством диссоциативной рекомбинации (HCNH + + и − → HCN + H). Диссоциативный путь рекомбинации является доминирующим на 30%; Однако HCNH + Должен быть в его линейной форме. Диссоциативная рекомбинация со своим структурным изомером, H 2 NC + , исключительно продуцирует изоцианид водорода (HNC).
HCN разрушается в межзвездных облаках через ряд механизмов в зависимости от местоположения в облаке. [ 54 ] В областях, с которыми доминирует фотон (PDR), доминирует фотодиссоциация, создавая CN (HCN + ν → CN + H). На дополнительной глубине доминируют фотодиссоциация космическими лучами, создавая CN (HCN + CR → CN + H). В темном ядре два конкурирующих механизма разрушают его, образуя HCN + и HCNH + (HCN + H. + → HCN + + H; HCN + HCO + → HCNH + + Co). Реакция с HCO + доминирует в коэффициенте ~ 3,5. HCN использовался для анализа различных видов и процессов в межзвездной среде. Это было предложено в качестве индикатора для плотного молекулярного газа [ 55 ] [ 56 ] и в качестве индикатора звездного притока в области звездного образования с высокой массой. [ 57 ] Кроме того, было показано, что соотношение HNC/HCN является отличным методом для различения PDR и областей, преобладающих рентгеновские излучения (XDR). [ 58 ]
11 августа 2014 года астрономы впервые выпустили исследования с использованием Atacama Millimeter/Submillimeter (ALMA) массива , в котором подробно описано распределение HCN, HNC , H 2 CO и пыли внутри кометов C/ 2012 крупного F6 ( Lemmon) и C/2012 S1 (ISON) . [ 59 ] [ 60 ]
в атмосфере горячего супер- было объявлено, что следы цианида водорода были обнаружены В феврале 2016 года земля . [ 61 ]
14 декабря 2023 года астрономы сообщили, что впервые обнаружили, что в пляках Энтеладуса для , луна планеты Сатурн , цианида водорода, возможное химическое вещество, необходимое жизни [ 62 ] Как мы знаем, а также другие органические молекулы , некоторые из которых еще не идентифицированы и поняты. По словам исследователей, «эти [вновь обнаруженные] соединения могут потенциально поддерживать существующие микробные сообщества или стимулировать сложный органический синтез, ведущий к происхождению жизни ». [ 63 ] [ 64 ]
Как яд и химическое оружие
[ редактировать ]В Первой мировой войне цианид водорода использовался французами с 1916 года в качестве химического оружия против центральных держав , а также Соединенными Штатами и Италией в 1918 году. Он не был обнаружен достаточно эффективным из -за погодных условий. [ 65 ] [ 66 ] Газ легче воздуха и быстро рассеивается в атмосферу. Быстрое разбавление сделало свое использование в поле непрактично. Напротив, более плотные агенты, такие как Phosgene или хлор, имели тенденцию оставаться на уровне земли и погрузились в траншеи полях сражений Западного фронта. По сравнению с такими агентами, цианид водорода должен был присутствовать в более высоких концентрациях, чтобы быть смертельным.
Концентрация цианида водорода 100–200 м.д. в дыхательном воздухе убьет человека в течение 10-60 минут. [ 67 ] Концентрация цианида водорода 2000 ч/млн (около 2380 мг/м 3 ) убьет человека примерно через одну минуту. [ 67 ] Токсический эффект вызван действием цианидного иона, который останавливает клеточное дыхание . Он действует в качестве неконкурентного ингибитора для фермента в митохондриях, называемом цитохрома с оксидазой . Таким образом, цианид водорода обычно перечисляется среди химического оружия в качестве агента крови . [ 68 ]
Конвенция о химическом оружии перечисляет его в Приложении 3 как потенциальное оружие, которое имеет крупномасштабное промышленное использование. Подписавшие страны должны объявлять производственные предприятия, которые производят более 30 метрических тонн в год, и обеспечивают проверку организацией на запрет химического оружия .
Возможно, его наиболее печально известным применением является Zyklon B (немецкий: циклон B , с B, который стоит для Blausäure - прусная кислота; также, чтобы отличить его от более раннего продукта, позже известного как Zyklon A), [ 69 ] Используется в нацистских немецких лагерях истребления во время Второй мировой войны , чтобы убить евреев и других преследуемых меньшинств в рамках их окончательной программы геноцида решения. Цианид водорода также использовался в лагерях для раздуманной одежды в попытках искоренить заболевания, переносимые вшами и другими паразитами. Один из оригинальных чешских производителей продолжал делать Zyklon B под торговой маркой "Ураган D2" [ 70 ] до 2015 года. [ 71 ]
Во время Второй мировой войны США рассматривали его использование, наряду с хлоридом цианогена , как часть падения операции , запланированное вторжение в Японию, но президент Гарри Трумэн решил против этого, вместо этого используя атомные бомбы, разработанные Секретным проектом Манхэттена . [ 72 ]
Кианид водорода также был агентом, используемым в судебном исполнении в некоторых штатах США , где он был получен во время исполнения путем действия серной кислоты на цианид натрия или цианид калия . [ 73 ]
Под именем прусской кислоты HCN использовался в качестве агента убийств в китобойных арпунах, хотя он оказался довольно опасным для экипажа, развертывающей его, и он был быстро заброшен. [ 13 ] С середины 18 -го века он использовался в ряде отравления убийствами и самоубийствами. [ 74 ]
Газовый газ водорода в воздухе является взрывоопасным при концентрациях выше 5,6%. [ 75 ]
Ссылки
[ редактировать ]- ^ «Цианид водорода (Chebi: 18407)» . Химические сущности, представляющие биологический интерес . Великобритания: Европейский институт биоинформатики. 18 октября 2009 г. Main . Получено 2012-06-04 .
- ^ Jump up to: а беременный в «Хихоген цианид» . Pubchem . Национальный центр информации о биотехнологии .
- ^ Симеонова, Фина Петрова; Fishbein, Lawrence (2004). Кианид водорода и цианиды: аспекты здоровья человека (отчет). Всемирная организация здравоохранения. ISBN 9241530618 Полем ISSN 1020-6167 .
- ^ Jump up to: а беременный в дюймовый и фон Хейнс, Уильям М., изд. (2011). Справочник по химии и физике CRC (92 -е изд.). CRC Press . ISBN 978-1439855119 .
- ^ Эванс да. «ПКА неорганических и оклосикид» (PDF) . Архивировано (PDF) из оригинала на 2022-10-09 . Получено 19 июня 2020 года .
- ^ Патнаик П. (2002). Справочник неорганических химикатов . МакГроу-Хилл. ISBN 978-0070494398 .
- ^ Шульц, Аксель; Surkau, Jonas (2022-09-21). «Основная группа цианидов: от цианида водорода до цианидо-комплекса» . Обзоры в неорганической химии . 43 (1). Walter de Gruyter GmbH: 49–188. doi : 10.1515/Revic-2021-0044 . ISSN 0193-4929 .
- ^ Jump up to: а беременный в дюймовый Niosh Pocket Guide к химическим опасностям. "#0333" . Национальный институт безопасности и гигиены труда (NIOSH).
- ^ Jump up to: а беременный «Хихоген цианид» . Немедленно опасно для жизни или концентрации в области здоровья (IDLH) . Национальный институт безопасности и гигиены труда (NIOSH).
- ^ Jump up to: а беременный в Gail, E.; Gos, S.; Кулцер, Р.; Lorösch, J.; Рубо, А.; Sauer, M. "Cyano соединений, неорганические". Энциклопедия промышленной химии Уллмана . Вейнхайм: Wiley-VCH. doi : 10.1002/14356007.a08_159.pub2 . ISBN 978-3527306732 .
- ^ «База данных метаболомов человека: показ метабокарт для цианида водорода (HMDB0060292)» .
- ^ «Цианид, неспособность чувствовать запах» . Онлайн Мендельанский наследство в человеке . Получено 2010-03-31 .
- ^ Jump up to: а беременный Лайт Т. "Яд арпуны" . Whalecraft.net . Архивировано с оригинала 2019-02-15.
- ^ Блезинг, Кевин; Harloff, Jörg; Шульц, Аксель; Стофферс, Алрик; Стоер, Филипп; Виллингер, Александр (2020). "Соли HCN-цианида Agregates: [CN (HCN) 2 ] − и [CN (HCN) 3 ] − " . Applied Chemistry International Edition . 59 (26): 10508–10513. : 10.1002 /ani.201915206 . PMC 7317722. DOI PMID 32027458 .
- ^ Leeuwen, Pwnm Van (2004). Гомогенный катализ: понимание искусства . Дордрехт: академические издатели Kluwer. ISBN 1402019998 Полем OCLC 54966334 .
- ^ Ferris, JP; Санчес, Р.А. (1968). «Диаминомалеонитрил (тетрамер цианида водорода)». Органические синтезы . 48 : 60. doi : 10.15227/orgsyn.048.0060 .
- ^ Ф. Вагенкнехт; Р. Джуза (1963). «Меркурий (II) цианид». В G. Brauer (ред.). Справочник по подготовительной неорганической химии . Тол. 2 (2 -е изд.). Нью -Йорк, Нью -Йорк: Академическая пресса.
- ^ Macquer PJ (1756). «Химик блю из Пруссии» [Химическое исследование прусского синего]. Мемуары Королевской академии наук (по -французски): 60–77.
- ^ Scheele CW (1782). «Попытка в отношении раскраски в берлинском синем» [Эксперимент относительно раскраски в Берлинском синем]. Королевская шведская академия наук (Королевская шведская академия наук о разбирательстве (на шведском языке). 3 : 264–275.
Перепечатано на латыни как: Scheele CW, Hebenstreit EB, eds. (1789). «Материал опускается в синий Берлин » . Брошюры Химическое и физику [ Dark Matter Dip Blue Berlin ] (на латыни). Тол. 2. Перевод Schafer GH. (Лейпциг («Нью-Йорк») (Германия): Иоганн Годфрид Мюллер. С. 148-174. - ^ Berthollet CL (1789). «Память на придурной кислоте» [Мемуар на прусской кислоте]. Мемуары Королевской академии наук (по -французски): 148–161.
Перепечатано в: Berthollet CL (1789). «Экстракт из мемуаров на прусскую кислоту» [экстракт мемуаров на прусскую кислоту]. Анналы химии . 1 : 30–39. - ^ Newbold BT (1999-11-01). «Клод Луи Бертоллет: великий химик во французской традиции» . Канадские химические новости . Архивировано с оригинала на 2008-04-20 . Получено 2010-03-31 .
- ^ Gay-Lussac JL (1811). «Обратите внимание на придурную кислоту» [Примечание на прусскую кислоту]. Анналы химии . 44 : 128–133.
- ^ Gay-Lussac JL (1815). «Исследование прусной кислоты» [исследование прусской кислоты]. Анналы химии . 95 : 136–231.
- ^ Андруссоу Л (1935). «Каталитическое оксидация аммиаков-метан-миксеров с цианидом водорода». Angewandte Chemie . 48 (37): 593–595. Bibcode : 1935angch..48..593a . doi : 10.1002/ange.19350483702 .
- ^ «Неконфиденциальные записи IUR в 2006 году по химическим веществам, включая производство, обработку и использование информации» . Эпэ Архивировано из оригинала 2013-05-10 . Получено 2013-01-31 .
- ^ Endter F (1958). «Технический синтез водородной цианы из метана и аммиака без добавления кислорода». Инженер по химии . 30 (5): 305–310. Doi : 10.1002/cite.330300506 .
- ^ «MSDS для калийного феррицианида» (PDF) . Архивировано из оригинала (PDF) 2016-04-18 . Получено 2023-04-17 .
- ^ «Калий -феррицианид» . Pubchem . Национальный центр информации о биотехнологии .
- ^ «Руководство по фумигации для контроля насекомых - космическая фумигация при атмосферном давлении (продолжение)» . Продовольственная и сельскохозяйственная организация .
- ^ «Новый парниковый газ идентифицирован» . News.mit.edu . 11 марта 2009 г.
- ^ «Глава 10: метил бромид» (PDF) . Csl.noaa.gov . Архивировано (PDF) из оригинала на 2022-10-09.
- ^ Веттер Дж (январь 2000 г.). «Цианогенные гликозиды растений». Токсикона . 38 (1): 11–36. Bibcode : 2000txcn ... 38 ... 11V . doi : 10.1016/s0041-0101 (99) 00128-2 . PMID 10669009 .
- ^ Джонс Да (январь 1998 г.). «Почему так много пищевых растений цианогенных?». Фитохимия . 47 (2): 155–162. Bibcode : 1998pchem..47..155J . doi : 10.1016/s0031-9422 (97) 00425-1 . PMID 9431670 .
- ^ "Ядовиты ядовиты?" Полем Обнаженные ученые. 26 сентября 2010 года. Архивировано с оригинала 6 марта 2014 года . Получено 6 марта 2014 года .
- ^ Aregheore EM, Agunbiade OO (июнь 1991 г.). «Токсичные эффекты диеты маниоки (Manihot Esculenta Grantz) на людей: обзор». Ветеринарная и человеческая токсикология . 33 (3): 274–275. PMID 1650055 .
- ^ Blum MS, Woodring JP (октябрь 1962 г.). «Секреция бензальдегида и цианида водорода с помощью Millipede Pachydesmus crassicutis (древесина)». Наука . 138 (3539): 512–513. Bibcode : 1962sci ... 138..512b . doi : 10.1126/science.138.3539.512 . PMID 17753947 . S2CID 40193390 .
- ^ Zagrobelny M, De Castro Ec, Møller BL, Bak S (май 2018). «Цианогенез у членистоногих: от химической войны до брачных подарков» . Насекомые . 9 (2): 51. doi : 10.3390/насекомые9020051 . PMC 6023451 . PMID 29751568 .
- ^ Полем (Февраль 2015 г.). "Атмосфера Титана . Icases . 247 : 218–247. BIBCODE : 2015 ICAR.247.218L . doi : 10.1016/j .
- ^ Маги Б.А., Уэйт Дж. Х., Мандт К.Е., Уэстлейк Дж., Белл Дж., Гелл Д.А. (декабрь 2009 г.). «Полученные из INMS состав верхней атмосферы Титана: методы анализа и сравнение моделей». Планетарная и космическая наука . 57 (14–15): 1895–1916. Bibcode : 2009p & ss ... 57.1895m . doi : 10.1016/j.pss.2009.06.016 .
- ^ Jump up to: а беременный Пирс Б.К., Молавердихани К., Пудриц Р.Е., Хеннинг Т., Хебрард Е. (2020). «Производство HCN в атмосфере Титана: сочетание квантовой химии и неравновесного атмосферного моделирования» . Астрофизический журнал . 901 (2): 110. Arxiv : 2008.04312 . Bibcode : 2020APJ ... 901..110p . doi : 10.3847/1538-4357/abae5c . S2CID 221095540 .
- ^ Пирс Б.К., Айерс П.В., Пудриц Р.Е. (март 2019 г.). «Постоянная сниженная сеть для химии HCN в атмосферах ранней Земли и Титана: квантовые расчеты коэффициентов скорости реакции». Журнал физической химии а . 123 (9): 1861–1873. Arxiv : 1902.05574 . Bibcode : 2019jpca..123.1861p . doi : 10.1021/acs.jpca.8b11323 . PMID 30721064 . S2CID 73442008 .
- ^ Уэйд Н. (2015-05-04). «Имея смысл химии, которая привела к жизни на Земле» . New York Times . Получено 5 мая 2015 года .
- ^ Jump up to: а беременный Borowitz JL, Gunasekar PG, Isom GE (сентябрь 1997 г.). «Генерация цианида водорода с помощью активации рецептора MU-образа: возможная нейромодулирующая роль эндогенного цианида». Исследование мозга . 768 (1–2): 294–300. doi : 10.1016/s0006-8993 (97) 00659-8 . PMID 9369328 . S2CID 12277593 .
- ^ Gunasekar PG, Prabhakaran K, Li L, Zhang L, Isom GE, Borowitz JL (май 2004 г.). «Рецепторные механизмы, опосредующие генерацию цианида в клетках PC12 и мозг крысы». Нейробиологические исследования . 49 (1): 13–18. doi : 10.1016/j.neures.2004.01.006 . PMID 15099699 . S2CID 29850349 .
- ^ Смит Р.П., Крузина Х (январь 1976 г.). «Токсикология некоторых неорганических антигипертензивных анионов». Федерация . 35 (1): 69–72. PMID 1245233 .
- ^ Talhout R, Schulz T, Florek E, Van Benthem J, Wester P, Opperhuizen A (февраль 2011 г.). «Опасные соединения в табачном дыме» . Международный журнал экологических исследований и общественного здравоохранения . 8 (2): 613–628. doi : 10.3390/ijerph8020613 . PMC 3084482 . PMID 21556207 .
- ^ Руис-Бермехо, Марта; Зорзано, Мария-Паз; Осуна-Эстебан, Сусана (2013). «Простая органика и биомономы, идентифицированные в полимерах HCN: обзор» . Жизнь . 3 (3): 421–448. Bibcode : 2013life .... 3..421r . doi : 10.3390/life3030421 . PMC 4187177 . PMID 25369814 .
- ^ Al-Azmi A, Elassar AZ, Booth BL (2003). «Химия диаминомалеонитрила и его полезность в гетероциклическом синтезе». Тетраэдр . 59 (16): 2749–2763. doi : 10.1016/s0040-4020 (03) 00153-4 .
- ^ Jump up to: а беременный Снайдер Л.Е., Буль Д. (1971). «Наблюдения за радиоэмиссией из межзвездного водорода цианида». Астрофизический журнал . 163 : L47 - L52. Bibcode : 1971Apj ... 163L..47S . doi : 10.1086/180664 .
- ^ Jørgensen UG (1997). "Cool Star Models" . В Van Dishoeck Ef (ed.). Молекулы в астрофизике: зонды и процессы . Международный астрономический союз симпозий. Молекулы в астрофизике: зонды и процессы. Тол. 178. Springer Science & Business Media. п. 446. ISBN 978-0792345381 .
- ^ Treffers RR, Larson HP, Fink U, Gautier TN (1978). «Верхние ограничения для отслеживания компонентов в атмосфере Юпитера в результате анализа его спектра 5 мкм». ИКАРС . 34 (2): 331–343. Bibcode : 19788icar ... 34..331t . doi : 10.1016/0019-1035 (78) 90171-9 .
- ^ Bieging JH, Shaked S, Gensheimer PD (2000). «Наблюдения субмиллиметровых и миллиметровых волн SIO и HCN в термозвезетчатых конвертах звезд AGB» . Астрофизический журнал . 543 (2): 897–921. Bibcode : 2000pj ... 543..897b . doi : 10.1086/317129 .
- ^ Schilke P, Menten KM (2003). «Обнаружение второй, сильной субмиллиметровой лазерной линии HCN в направлении углеродных звезд» . Астрофизический журнал . 583 (1): 446–450. Bibcode : 2003Apj ... 583..446S . doi : 10.1086/345099 . S2CID 122549795 .
- ^ Jump up to: а беременный Богир Г.И., Стернберг А. (2005). «CN и HCN в плотных межзвездных облаках». Астрофизический журнал . 632 (1): 302–315. Arxiv : Astro-ph/0506535 . Bibcode : 2005Apj ... 632..302b . doi : 10.1086/432864 . S2CID 118958200 .
- ^ Gao Y, Solomon PM (2004). «Скорость образования звезд и плотный молекулярный газ в галактиках». Астрофизический журнал . 606 (1): 271–290. Arxiv : Astro-ph/0310339 . Bibcode : 2004Apj ... 606..271G . doi : 10.1086/382999 . S2CID 11335358 .
- ^ Gao Y, Olomon PM (2004). «HCN Обследование нормальных спиральных, инфракрасных и ультралярных галактик». Серия астрофизических дневников . 152 (1): 63–80. Arxiv : Astro-ph/0310341 . Bibcode : 2004Apjs..152 ... 63G . doi : 10.1086/383003 . S2CID 9135663 .
- ^ Wu J, Evans NJ (2003). «Показания приточных движений в регионах, образующих массовые звезды». Астрофизический журнал . 592 (2): L79 - L82. Arxiv : Astro-ph/0306543 . Bibcode : 2003Apj ... 592L..79W . doi : 10.1086/377679 . S2CID 8016228 .
- ^ Loenen AF (2007). "Молекулярные свойства (U) Lirgs: Co, HCN, HNC и HCO + " Труды IAU Symposium . 242 : 462–466. Arxiv : 0709.3423 . Bibcode : 2007iaus..242..462L . DOI : 10.1017/S1743921307013609 . S2CID 14398456 .
- ^ Zubritsky E, Neal-Jones N (11 августа 2014 г.). «Выпуск 14-038-3-D исследования комет НАСА показывает химическую фабрику на работе» . НАСА . Получено 12 августа 2014 года .
- ^ Кординер М.А., Ремиджан А.Дж., Боисье Дж., Милам С.Н., Мама М.Дж., Чарнли С.Б. и др. (11 августа 2014 г.). "Сопоставление выпуска Volates во внутренних кометах C/2012 F6 (Lemon) и C/2012 S1 Астрофизический журнал 792 (1): L2 Arxiv : 1408.2458 Bibcode : 2014Apj ... 792L ... 2c Doi : 10.1088/2041-8205/792/1/ l2 26277035S2CID
- ^ «Первое обнаружение суперземной атмосферы» . Информационный центр ESA/Hubble. 16 февраля 2016 года.
- ^ Грин, Хайме (5 декабря 2023 г.). «Что такое жизнь? - Ответ имеет значение в исследовании космоса. Но мы все еще не знаем» . Атлантика . Архивировано из оригинала 5 декабря 2023 года . Получено 15 декабря 2023 года .
- ^ Чанг, Кеннет (14 декабря 2023 г.). «Ядовитый газ намекает на потенциал для жизни на океанской луне Сатурна - исследователь, который изучал Icy World, сказал:« Перспективы развития жизни становятся все лучше и лучше в Enceladus » . New York Times . Архивировано из оригинала 14 декабря 2023 года . Получено 15 декабря 2023 года .
- ^ Питер, Иона С.; и др. (14 декабря 2023 г.). «Обнаружение HCN и разнообразная окислительно -восстановительная химия в шлейпе Enceladus» . Природная астрономия . 8 (2): 164–173. Arxiv : 2301.05259 . Bibcode : 2024natas ... 8..164p . doi : 10.1038/s41550-023-02160-0 . S2CID 255825649 . Архивировано из оригинала 15 декабря 2023 года . Получено 15 декабря 2023 года .
- ^ Schnedlitz, Markus (2008) Химические боевые материалы: история, свойства, эффекты . У Случка Верлаг. п. 13 ISBN 3640233603 .
- ^ Оружие войны - ядовитый газ . firstworldwar.com
- ^ Jump up to: а беременный Экологические и последствия для здоровья архивированы 2012-11-30 на машине Wayback . Cyanidecode.org. Получено на 2012-06-02.
- ^ «Хихоген цианид» . Организация запрета химического оружия . Получено 2009-01-14 .
- ^ Ван Пелт, Роберт Ян ; Dwork, Debórah (1996). Auschwitz, 1270 до настоящего времени . Нортон. п. 443 . ISBN 9780300067552 .
- ^ "Синий фуйм" . Химическая фабрика Draslovka As . Получено 2020-07-06 .
- ^ "Ураган D2" . 2015-07-17. Архивировано с оригинала 2015-07-17 . Получено 2022-10-19 .
- ^ Бинкова (27 апреля 2022 года). «Как бы WW2 исчез, если бы США не использовали ядерные бомбы в Японии?» Полем Youtube.com . Получено 23 июня 2022 года .
- ^ Пилкингтон, изд (28 мая 2021 г.). «Аризона» реконструирует »свою газовую камеру, чтобы подготовиться к казням, показывают документы» . Хранитель . Получено 2022-06-14 .
- ^ «Веб -сайт Poison Garden» . Thepoisongarden.co.uk . Архивировано с оригинала 10 февраля 2020 года . Получено 18 октября 2014 года .
- ^ «Документация для немедленно опасной для жизни или концентраций в области здоровья (IDLHS) - 74908» . Ниош. 2 ноября 2018 года.
Внешние ссылки
[ редактировать ]- Национальный институт исследований и безопасности (1997). « Цианид водорода и водные растворы ». Токсикологический лист № 4 , Париж: INRS, 5pp. (PDF -файл, по -французски )
- Международная карта химической безопасности 0492
- Цианид водорода и цианиды ( CICAD 61)
- Национальный инвентарь загрязняющих веществ: информационный бюллетень цианидных соединений
- Niosh Pocket Guide по химическим опасностям
- Департамент здравоохранения
- Плотность газа цианида водорода



