Фенолы природного происхождения
В биохимии , встречающиеся в природе фенолы представляют собой природные продукты содержащие по крайней мере одну фенольную функциональную группу . [ 1 ] [ 2 ] [ 3 ] Фенольные соединения производятся растениями и микроорганизмами. [ 4 ] Организмы иногда синтезируют фенольные соединения в ответ на экологическое давление, такое как нападение патогенов и насекомых, УФ-излучение и ранения. [ 5 ] Поскольку они присутствуют в пищевых продуктах, потребляемых человеком, и в растениях, используемых в традиционной медицине нескольких культур, их роль в здоровье человека и заболеваниях является предметом исследований. [ 1 ] [ 5 ] [ 6 ] [ 7 ] : 104 Некоторые фенолы обладают бактерицидными свойствами и используются в рецептурах дезинфицирующих средств.


Классификация
[ редактировать ]различные схемы классификации . Могут применяться [ 8 ] : 2 Широко используемая схема основана на количестве атомов углерода и была разработана Джеффри Харборном и Симмондсом в 1964 году и опубликована в 1980 году: [ 8 ] : 2 [ 9 ] [ 10 ]
| Количество атомов углерода | Базовый скелет | Количество фенольных циклов | Сорт | Примеры |
|---|---|---|---|---|
| 6 | CС6 | 1 | Простые фенолы, Бензохиноны | Катехол, гидрохинон, 2,6-диметоксибензохинон |
| 7 | С 6 -С 1 | 1 | Фенольные кислоты , Фенольные альдегиды | Галловая, салициловая кислоты |
| 8 | С 6 -С 2 | 1 | Ацетофеноны , производные тирозина, фенилуксусные кислоты. | 3-Ацетил-6-метоксибензальдегид , Тирозол , п-Гидроксифенилуксусная кислота , Гомогентизиновая кислота |
| 9 | С 6 -С 3 | 1 | Гидроксикоричные кислоты , Аллилбензолы , Кумарины , Изокумарины , Хромоны | Кофейная, феруловая кислоты, миристицин, эвгенол, умбеллиферон, эскулетин, бергенон , эвгенин. |
| 10 | С 6 -С 4 | 1 | Нафтохиноны | Юглон, Пламбагин |
| 13 | С 6 -С 1 -С 6 | 2 | Ксантоноиды | Мангиферин |
| 14 | С 6 -С 2 -С 6 | 2 | Стильбеноиды , Антрахиноны | Ресвератрол, Эмодин |
| 15 | С 6 -С 3 -С 6 | 2 | Халконоиды , Флавоноиды , Изофлавоноиды, Неофлавоноиды | Кверцетин, цианидин, генистеин |
| 16 | С 6 -С 4 -С 6 | 2 | Галогенированные фенольные соединения водорослей | Кавиол А , Колпол |
| 18 | (С 6 -С 3 ) 2 | 2 | Лигнаны , Неолигнаны | Пинорезинол, Эусидерин |
| 30 | (С 6 -С 3 -С 6 ) 2 | 4 | бифлавоноиды | Аментофлавон |
| много | (С 6 -С 3 ) н , (С 6 ) н , (С 6 -С 3 -С 6 ) n |
п > 12 | Лигнины , Катехиновые меланины , флаволаны ( конденсированные дубильные вещества ), Полифенольные белки , Полифенолы |
малиновый эллаготаннин , Дубильная кислота |
C 6 -C 7 -C 6 Диарилгептаноиды не включены в эту классификацию Харборна.
Их также можно классифицировать по количеству фенольных групп. Поэтому их можно назвать простыми фенолами или монофенолами только с одной фенольной группой или ди- ( би- ), три- и олигофенолами с двумя, тремя или несколькими фенольными группами соответственно.
Разнообразное семейство природных фенолов — флавоноиды , включающее несколько тысяч соединений, среди них флавонолы , флавоны , флаван-3ол ( катехины ), флаваноны , антоцианидины и изофлавоноиды . [ 11 ]
Фенольная единица может быть димеризована или дополнительно полимеризована, создавая новый класс полифенолов. Например, эллаговая кислота представляет собой димер галловой кислоты и образует класс эллагитаннинов, или катехин и галлокатехин могут объединяться с образованием красного соединения теафлавина — процесс, который также приводит к образованию большого класса коричневых теарубигинов в чае.
Два природных фенола из двух разных категорий, например флавоноид и лигнан, могут объединяться, образуя гибридный класс, такой как флавонолигнаны .
Номенклатура полимеров :
| Базовый блок: |  Галловая кислота |
 Флавоны |
 Коричная кислота |
|---|---|---|---|
| Класс/Полимер: | Гидролизуемые танины | Флавоноиды , Конденсированные дубильные вещества | Лигнины |
Гибридные химические классы
[ редактировать ]Растения рода Humulus и Cannabis производят терпенофеноленовые метаболиты, соединения, которые являются меротерпенами . [ 12 ] [ 13 ] Фенольные липиды представляют собой длинные алифатические цепи, связанные с фенольным фрагментом.
Хиральность
[ редактировать ]Многие природные фенолы хиральны . Примером таких молекул является катехин . Кавикулярин представляет собой необычный макроцикл, поскольку он был первым выделенным из природы соединением, проявляющим оптическую активность благодаря наличию плоской хиральности и аксиальной хиральности .
УФ-видимое поглощение
[ редактировать ]Природные фенолы проявляют оптические свойства, характерные для бензола, например поглощение при длине волны 270 нм. Согласно правилам Вудворда , часто происходят также батохромные сдвиги , предполагающие наличие делокализованных π-электронов, возникающих в результате сопряжения бензольных и винильных групп. [ 14 ]
Поскольку молекулы с более высокими уровнями сопряжения подвергаются этому явлению батохромного сдвига, часть видимого спектра поглощается. Длины волн, оставшиеся в процессе (обычно в красной части спектра), восстанавливают цвет конкретного вещества. коричными кислотами Ацилирование антоцианидинов сместило тональность цвета ( CIE Lab угол оттенка ) к фиолетовому . [ 15 ]
Вот серия УФ- видимых спектров молекул, классифицированных слева направо в зависимости от уровня их сопряжения: [ нужна ссылка ]
 |
 |
 |
 |
 |
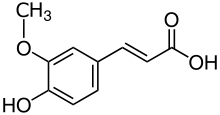 |
 |
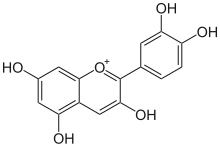 |
Характер поглощения, ответственный за красный цвет антоцианов, может дополнять характер зеленого хлорофилла в фотосинтетически активных тканях, таких как молодые листья Quercus coccifera . [ 16 ]
Окисление
[ редактировать ]
Природные фенолы являются активными веществами в отношении окисления , в частности, сложная смесь фенолов, содержащаяся, например, в продуктах питания, может подвергаться самоокислению в процессе старения. Простые природные фенолы могут приводить к образованию проантоцианидинов типа B в винах. [ 17 ] или в модельных решениях. [ 18 ] [ 19 ] Это коррелирует с неферментативным изменением цвета потемнения, характерным для этого процесса. [ 20 ] Это явление можно наблюдать в таких продуктах, как морковное пюре. [ 21 ]
Потемнение, связанное с окислением фенольных соединений, также считается причиной гибели клеток в каллусах, образующихся в in vitro культурах . Эти фенольные соединения происходят как из тканей эксплантата, так и из секретов эксплантата.
Фенольные соединения
[ редактировать ]Естественное происхождение
[ редактировать ]| Каннабиноиды | активные компоненты конопли |
| Капсаицин | острое соединение перца чили |
| Карвакрол | содержится в орегано ; противомикробное и нейропротекторное средство [ 22 ] |
| Крезол | содержится в каменноугольной смоле и креозоте |
| Эстрадиол | эстроген -гормоны |
| эвгенол | основной компонент масла гвоздики эфирного |
| Галловая кислота | найден в галлах |
| Гуаякол | (2-метоксифенол) – имеет дымный вкус , содержится в жареном кофе , виски и дыме. |
| Метилсалицилат | основной компонент эфирного масла грушанки |
| Малиновый кетон | соединение с интенсивным малины запахом |
| Салициловая кислота | соединение-предшественник аспирина (в производстве используется химический синтез) |
| Серотонин / дофамин / адреналин / норадреналин | естественные нейромедиаторы |
| Тимол | (2-изопропил-5-метилфенол) – содержится в тимьяне ; антисептик , используемый в средствах для полоскания рта |
| Тирозин | аминокислота |
| Сезамол | природное соединение, содержащееся в семенах кунжута |
Синтетический
[ редактировать ]| Фенол | исходное соединение, используемое в качестве дезинфицирующего средства и для химического синтеза. |
| Бисфенол А | и другие бисфенолы, полученные из кетонов и фенола/крезола |
| БХТ | (бутилированный гидрокситолуол) — жирорастворимый антиоксидант и пищевая добавка. |
| 4-нонилфенол | продукт распада моющих средств и ноноксинола-9 |
| Ортофенил фенол | фунгицид , используемый для восковой обработки цитрусовых |
| Пикриновая кислота | (тринитрофенол) – взрывчатое вещество |
| фенолфталеин | индикатор рН |
| Ксиленол | используется в антисептиках и дезинфицирующих средствах |
Биосинтез
[ редактировать ]Фенолы образуются тремя различными путями биосинтеза: (i) путем шикимат/хоризмат или сукцинилбензоат, который дает производные фенилпропаноида (C6–C3); (ii) ацетат/малонатный или поликетидный путь, который продуцирует фенилпропаноиды с удлиненной боковой цепью, включая большую группу флавоноидов (C6–C3–C6) и некоторые хиноны; и (iii) путь ацетат/мевалонат, который производит ароматические терпеноиды, в основном монотерпены, в результате реакций дегидрирования. [ 23 ] [ 24 ] Ароматическая аминокислота фенилаланин , синтезируемая по пути шикимовой кислоты , является распространенным предшественником фенолсодержащих аминокислот и фенольных соединений.
В растениях фенольные звенья этерифицированы или метилированы и подвергаются конъюгации , что означает, что природные фенолы в основном встречаются в форме гликозидов, а не в форме агликонов .
В оливковом масле тирозол образует сложные эфиры с жирными кислотами. [ 25 ] У ржи алкилрезорцины представляют собой фенольные липиды.
Некоторые ацетилирования включают терпены , такие как гераниол . [ 26 ] Эти молекулы называются меротерпенами (химическое соединение, имеющее частичную терпеноидную структуру).
Метилирование может происходить путем образования эфирной связи на гидроксильных группах с образованием O-метилированных полифенолов. В случае О-метилированного флавона тангеритина все пять гидроксилов метилированы, не оставляя свободных гидроксилов фенольной группы. Метилирование также может происходить непосредственно на углероде бензольного кольца, как в случае пориола , C-метилированного флавоноида .
Биодеградация
[ редактировать ]Гриб белой гнили Phanerochaete chrysosporium до 80% фенольных соединений способен удалять из сточных вод коксования . [ 27 ]
Приложения
[ редактировать ]Танины используются в кожевенной промышленности.
Некоторые природные фенолы можно использовать в качестве биопестицидов . Фуранофлавоноиды, такие как каранджин или ротеноиды, используются в качестве акарицидов или инсектицидов . [ 28 ]
Энологические танины являются важными элементами вкуса вина. [ 29 ]
Некоторые фенолы продаются в качестве пищевых добавок . Фенолы исследовались как наркотики. Например, Крофелемер (торговое название Fulyzaq в США) — это препарат, разрабатываемый для лечения диареи, связанной с препаратами против ВИЧ. Кроме того, были созданы производные фенольного соединения комбретастатина А-4 , противораковой молекулы, включающие атомы азота или галогенов, для повышения эффективности лечения. [ 30 ]
Промышленная обработка и анализ
[ редактировать ]Экстракция фенола
[ редактировать ]Экстракция фенола — это технология переработки, используемая для получения фенолов в качестве сырья, соединений или добавок для промышленной обработки древесины и химической промышленности.
Экстракцию можно проводить с использованием различных растворителей. Существует риск того, что полифенолоксидаза (ПФО) ухудшит фенольное содержание образца, поэтому необходимо использовать ингибиторы ППО, такие как дитионит калия (K 2 S 2 O 4 ), или проводить эксперименты с использованием жидкого азота или кипятить образец для несколько секунд ( бланширование ), чтобы инактивировать фермент. Дальнейшее фракционирование экстракта может быть достигнуто с использованием колонн твердофазной экстракции и может привести к выделению индивидуальных соединений.
Восстановление природных фенолов из остатков биомассы является частью биопереработки . [ 31 ]
Разделение
[ редактировать ]PK фенольных соединений можно рассчитать по времени удерживания в жидкостной хроматографии . [ 32 ] [ 33 ]
Аналитические методы
[ редактировать ]В исследованиях по оценке антиоксидантной способности можно использовать электрохимические методы. [ 34 ]
Обнаружение может осуществляться с помощью рекомбинантных люминесцентных бактериальных сенсоров . [ 35 ]
Профилирование
[ редактировать ]Профилирование фенолов можно получить с помощью жидкостной хроматографии-масс-спектрометрии (ЖХ/МС). [ 36 ]
Количественная оценка
[ редактировать ]Методом количественного определения содержания фенолов является объемное титрование . Окисляющий агент, перманганат , используется для окисления стандартных растворов известных концентраций, создавая стандартную кривую . Содержание неизвестных фенолов затем выражается в эквивалентах соответствующего стандарта.
Некоторые методы количественного определения общего содержания фенолов основаны на колориметрических измерениях. Общее количество фенолов (или антиоксидантный эффект) можно измерить с помощью реакции Фолина-Чиокальтеу . Результаты обычно выражаются в эквивалентах галловой кислоты (GAE). на хлорид железа (FeCl 3 Тест ) также является колориметрическим анализом.
Ламейсон и Карне разработали тест для определения общего содержания флавоноидов в образце (метод AlCI 3 ). После надлежащего смешивания образца и реагента смесь инкубируют в течение 10 минут при температуре окружающей среды и измеряют поглощение раствора при 440 нм. Содержание флавоноидов выражается в мг/г кверцетина. [ 37 ]
Результаты количественного анализа, полученные с помощью диодно-детекторной матрицей, , связанной с ВЭЖХ обычно приводятся в виде относительных, а не абсолютных значений, поскольку для каждой фенольной молекулы отсутствуют коммерчески доступные стандарты . Этот метод также можно сочетать с масс-спектрометрией (например, ВЭЖХ-DAD- ESI /MS) для более точной идентификации молекул .
Оценка антиоксидантного эффекта
[ редактировать ]- in vitro Измерения
Другие тесты измеряют антиоксидантную способность фракции. Некоторые используют катион-радикал 2,2'-азино-бис(3-этилбензотиазолин-6-сульфоновая кислота) (ABTS), который реагирует с большинством антиоксидантов, включая фенольные соединения, тиолы и витамин С. [ 38 ] В ходе этой реакции синий катион-радикал ABTS снова превращается в свою бесцветную нейтральную форму. Реакцию можно контролировать спектрофотометрически. Этот анализ часто называют анализом эквивалентной антиоксидантной способности Тролокса (TEAC). Реакционная способность различных протестированных антиоксидантов сравнивается с реактивностью Тролокса , который является витамина Е. аналогом
Другие анализы антиоксидантной способности, в которых в качестве стандарта используется Тролокс, включают анализ дифенилпикрилгидразила (DPPH), способности к поглощению кислородных радикалов (ORAC), способности плазмы восстанавливать железо (FRAP) или ингибирование катализируемого медью in vitro окисления человеческих липопротеинов низкой плотности . [ 39 ]
Также существует анализ клеточной антиоксидантной активности (CAA). Дихлорфлуоресцин представляет собой зонд, который улавливается внутри клеток и легко окисляется до флуоресцентного дихлорфлуоресцеина (DCF). Метод измеряет способность соединений предотвращать образование DCF пероксильными радикалами, генерируемыми 2,2'-азобис(2-амидинопропан)дигидрохлоридом (ABAP), в клетках гепатокарциномы человека HepG2 . [ 40 ]
Другие методы включают бутилгидрокситолуол (BHT), бутилгидроксианизол (BHA), метод Rancimat (оценка прогоркания жира). [ 41 ]
- in vivo Модели
Личинки модельного животного Galleria mellonella , также называемые восковыми червями , могут быть использованы для проверки антиоксидантного эффекта отдельных молекул, использующих борную кислоту в пище для индукции окислительного стресса. [ 42 ] содержание малонового диальдегида , индикатора окислительного стресса, а также активность антиоксидантных ферментов супероксиддисмутазы , каталазы , глутатион-S-трансферазы и глутатионпероксидазы Можно контролировать . Профенолоксидазу также можно получить из насекомого. [ 43 ]
Генетический анализ
[ редактировать ]Фенольные биосинтетические и метаболические пути и ферменты можно изучать посредством трансгенеза генов. Регуляторный ген арабидопсиса , отвечающий за производство антоцианового пигмента 1 (AtPAP1), может экспрессироваться в других видах растений. [ 44 ]
Природные явления
[ редактировать ]Фенолы встречаются в природе, особенно в растительном мире.
Встречаются у прокариот
[ редактировать ]Оробол можно найти в Streptomyces neyagawaensis (актинобактерия). [ нужна ссылка ] Фенольные соединения можно найти в цианобактериях Arthrospira maxima , используемых в пищевой добавке Spirulina . [ 45 ] Три цианобактерии Microcystis aeruginosa , Cylindrospermopsis raciborskie и Oscillatoria sp. являются предметом исследования природного производства бутилированного гидрокситолуола (ВНТ), [ 46 ] антиоксидант, пищевая добавка и промышленный химикат.
Протеобактерия Pseudomonas fluorescens продуцирует флороглюцинол , флороглюцинолкарбоновую кислоту и диацетилфлороглюцинол . [ 47 ] Другим примером фенольных соединений, продуцируемых протеобактериями, является 3,5-дигидрокси-4-изопропил-транс-стильбен , бактериальный стильбеноид, продуцируемый Photorhabdus бактериальными симбионтами нематод Heterorhabditis .
Случаи у грибов
[ редактировать ]Фенольные кислоты содержатся в грибных базидиомицетах . [ 48 ] Например, протокатеховая кислота и пирокатехин обнаружены в Agaricus bisporus. [ 49 ] а также другие фенилированные вещества, такие как фенилуксусная и фенилпировиноградная кислоты . Другие соединения, такие как атроментин и телефоровая кислота, также можно выделить из грибов класса агарикомицетов . Оробол , изофлавон , может быть выделен из Aspergillus niger .
- В дрожжах
Ароматические спирты (пример: тирозол ) производятся дрожжами Candida albicans . [ 50 ] Они также содержатся в пиве . [ 51 ] Эти молекулы являются соединениями , чувствительными к кворуму, для Saccharomyces cerevisiae . [ 52 ]
- Метаболизм
Арилалкогольдегидрогеназа использует ароматический спирт и НАД. + с образованием ароматического альдегида , НАДН и Н. + .
Арилалкогольдегидрогеназа (НАДФ+) использует ароматический спирт и НАДФ. + с образованием ароматического альдегида , НАДФН и H + .
Арилдиалкилфосфатаза (также известная как фосфорорганическая гидролаза, фосфотриэстераза и параоксонгидролаза) использует арилдиалкилфосфат и H 2 O для производства диалкилфосфата и арилового спирта.
Случаи в лишайнике
[ редактировать ]гирофоровая кислота , депсид и орцинол обнаружены В лишайнике . [ 53 ]
Встречаемость в водорослях
[ редактировать ]Зеленая водоросль Botryococcus braunii является объектом исследования естественного производства бутилированного гидрокситолуола (БНТ). [ 46 ] антиоксидант, пищевая добавка и промышленный химикат.
Фенольные кислоты, такие как протокатеховая , п-гидроксибензойная , 2,3-дигидроксибензойная , хлорогеновая , ванилиновая , кофейная , п -кумаровая и салициловая кислоты , коричная кислота и гидроксибензальдегиды, такие как п-гидроксибензальдегид , 3,4-дигидроксибензальдегид , ванилин, были выделены из Культура in vitro пресноводной зелени Водоросль Spongiochromis spongiosa . [ 54 ]
Флоротанины , например экол , обнаружены в бурых водорослях . Видаленолон можно найти в тропической красной водоросли Vidalia sp . [ 55 ]
Встречается у наземных растений (эмбриофитов).
[ редактировать ]Встречается у сосудистых растений
[ редактировать ]Фенольные соединения в основном встречаются в сосудистых растениях (трахеофитах), например, Lycopodiophyta. [ 56 ] (плачуны), Pteridophyta (папоротники и хвощи), покрытосеменные (цветковые растения или магнолиофиты) и голосеменные. [ 57 ] ( хвойные , саговники , гинкго и гнеталесы ). [ нужна ссылка ]
У папоротников такие соединения, как кемпферол и его глюкозид, можно выделить из метанольного экстракта листьев Phegopteris Connectilis. [ 58 ] или кемпферол-3-О-рутинозид , известный флавоноидный гликозид с горьким вкусом, можно выделить из корневищ Selliguea fei . [ 59 ] гипогалловую кислоту , кофейную кислоту , пеонифлорин и пикурозид можно выделить Из пресноводного папоротника Salvinia molesta . [ 60 ]
У хвойных (Pinophyta) фенольные соединения хранятся в клетках полифенольной паренхимы — ткани, которой изобилует флоэма всех хвойных деревьев. [ 61 ]
Водное растение Myriophyllum spicatum производит эллаговую , галловую и пирогалловую кислоты и (+)- катехин . [ 62 ]
Встречаются у однодольных
[ редактировать ]Алкилрезорцины можно найти в злаках. [ нужна ссылка ]
2,4-бис(4-гидроксибензил)фенол — фенольное соединение, обнаруженное в орхидеях Gastrodia elata и Galeola faberi . [ нужна ссылка ]
Встречается у несосудистых растений
[ редактировать ]Фенолы также можно найти в несосудистых наземных растениях ( мохообразных ). Дигидростильбеноиды и бис(дибензилы) встречаются в печеночниках ( Marchantiophyta ), например, макроциклы кавикулярин и риккардин С. Хотя лигнин отсутствует во мхах (Bryophyta) и роголистниках (Anthocerotophyta), некоторые фенольные соединения можно обнаружить в этих двух таксонах. [ 63 ] Например, розмариновая кислота и 3'-O-β-D-глюкозид розмариновой кислоты можно найти в роголистнике Anthoceros agrestis . [ 64 ]
Встречается у других эукариотов
[ редактировать ]Случаи у насекомых
[ редактировать ]отвердение белкового компонента кутикулы насекомых Показано, что происходит за счет дубящего действия вещества, образующегося при окислении фенольного вещества, образующего склеротин . [ нужна ссылка ] При аналогичном отверждении оотеки таракана фенольным веществом является 3:4-дигидроксибензойная кислота ( протокатеховая кислота ). [ 65 ]
Ацетосирингон вырабатывается самцами листовертки ( Leptoglossus phyllopus ) и используется в его системе связи. [ 66 ] [ 67 ] [ 68 ] Гуаякол вырабатывается в кишечнике пустынной саранчи Schistocerca gregaria в результате расщепления растительного материала. Этот процесс осуществляется кишечной бактерией Pantoea agglomerans . [ 69 ] Гваякол – один из основных компонентов феромонов, вызывающих роение саранчи. [ 70 ] Орцинол был обнаружен в «токсичном клее» муравьев вида Camponotus saundersi . [ нужна ссылка ] Rhynchophorusferrugineus (красный пальмовый долгоносик) использует 2-метокси-4-винилфенол для химической передачи сигналов ( феромонов ). [ 71 ] Другие простые и сложные фенолы можно обнаружить у эусоциальных муравьев (таких как Crematogaster ) в качестве компонентов яда. [ 72 ]
Встречается у млекопитающих
[ редактировать ]два соединения: 3-этилфенол и 2-этил-4,5-диметилфенол . У самок слонов в образцах мочи были обнаружены [ 73 ] Исследование секреции височных желез показало наличие фенола , м-крезола и п-крезола (4-метилфенола) во время сусла у слонов- самцов . [ 74 ] [ 75 ] [ 76 ]
п-крезол и о-крезол человека также являются компонентами пота . [ нужна ссылка ] П-крезол также является основным компонентом запаха свиней . [ 77 ]
4-Этилфенол , 1,2-дигидроксибензол , 3-гидроксиацетофенон , 4-метил-1,2-дигидроксибензол , 4-метоксиацетофенон , 5-метоксисалициловая кислота , салициловый альдегид и 3-гидроксибензойная кислота являются компонентами кастореума , экссудата клещевины. мешочки взрослого североамериканского бобра ( Castor canadensis ) и европейского бобра ( Castor fibre ), используемые в парфюмерии. [ 78 ]
Роли
[ редактировать ]В некоторых случаях природные фенолы присутствуют в вегетативной листве , чтобы препятствовать травоядности , например, в случае западного ядовитого дуба . [ 79 ]
Роль в почвах
[ редактировать ]в почвах Предполагается, что большее количество фенолов выделяется в результате разложения растительного опада, а не в результате попадания в какое-либо естественное растительное сообщество. [ нужна ссылка ] что сложные органические соединения медленно окисляются лигниноподобным Разложение отмершего растительного материала приводит к тому , гумусом или распадаются на более простые формы (сахара и аминосахара, алифатические и фенольные органические кислоты), которые в дальнейшем трансформируются в микробную биомассу (микробный гумус) или реорганизуются и далее окисляются в гуминовые комплексы ( фульвовые и гуминовые кислоты), которые связываются с глинистыми минералами и гидроксидами металлов . [ нужна ссылка ] В течение длительного времени ведутся споры о способности растений поглощать гуминовые вещества из корневой системы и метаболизировать их. [ нужна ссылка ] В настоящее время существует консенсус относительно того, что гумус играет гормональную, а не просто питательную роль в физиологии растений. [ нужна ссылка ]
В почве растворимые фенолы сталкиваются с четырьмя разными судьбами. Они могут быть разложены и минерализованы в качестве источника углерода гетеротрофными микроорганизмами ; они могут превращаться в нерастворимые и неподатливые гуминовые вещества в результате реакций полимеризации и конденсации (при участии почвенных организмов); они могут адсорбироваться на глинистых минералах или образовывать хелаты с ионами алюминия или железа; или они могут оставаться в растворенной форме, выщелачиваться просачивающейся водой и, наконец, покидать экосистему в виде растворенного органического углерода (РОУ). [ 4 ]
Выщелачивание — это процесс, при котором катионы, такие как железо (Fe) и алюминий (Al), а также органические вещества удаляются из подстилки и переносятся вниз в почву. Этот процесс известен как оподзоление и особенно интенсивен в бореальных и прохладных лесах умеренного пояса, которые в основном состоят из хвойных сосен, опад которых богат фенольными соединениями и фульвокислотами . [ 80 ]
Роль в выживании
[ редактировать ]Фенольные соединения могут действовать как защитные агенты, ингибиторы, природные токсиканты для животных и пестициды против вторгающихся организмов, т.е. травоядных, нематод, насекомых-фитофагов, а также грибковых и бактериальных патогенов. Запах и пигментация, придаваемые другими фенольными соединениями, могут привлечь симбиотических микробов, опылителей и животных, разносящих плоды. [ 23 ]
Защита от хищников
[ редактировать ]Летучие фенольные соединения содержатся в смоле растений , где они могут привлекать благодетелей, таких как паразитоиды или хищники травоядных животных, нападающих на растение. [ 81 ]
У видов водорослей Alaria Marginata фенольные соединения действуют как химическая защита от травоядных животных. [ 82 ] В тропических видах Sargassum и Turbinaria , которые часто преимущественно потребляются травоядными рыбами и ежами , наблюдается относительно низкий уровень фенольных соединений и дубильных веществ. [ 83 ] Морские аллелохимические вещества обычно присутствуют в большем количестве и разнообразии в тропических регионах, чем в регионах с умеренным климатом. Сообщается, что фенольные соединения морских водорослей являются очевидным исключением из этой биогеографической тенденции. Высокие концентрации фенолов наблюдаются у видов бурых водорослей (отряды Dictyotales и Fucales ) как из умеренных, так и из тропических регионов, что указывает на то, что сама широта не является разумным предиктором концентраций фенолов в растениях. [ 84 ]
Защита от инфекции
[ редактировать ]В Vitis vinifera винограде транс - ресвератрол представляет собой фитоалексин, вырабатываемый против роста грибковых патогенов, таких как Botrytis cinerea. [ 85 ] и дельта-виниферин — еще один фитоалексин виноградной лозы , вырабатываемый после грибковой инфекции Plasmopara viticola . [ 86 ] Пиносильвин представляет собой прединфекционный стильбеноидный токсин (т.е. синтезируется до заражения), в отличие от фитоалексинов , которые синтезируются во время инфекции. Он присутствует сердцевине сосновых в . [ 87 ] Это фунгитоксин, защищающий древесину от грибковой инфекции . [ 88 ]
Сакуранетин представляет собой флаванон , разновидность флавоноида. Его можно найти в Polymnia fruticosa. [ 89 ] и рис , где он действует как фитоалексин против прорастания спор Pyricleria oryzae . [ 90 ] У сорго ген SbF3'H2 , кодирующий флавоноид-3'-гидроксилазу , по-видимому, экспрессируется в патоген 3-дезоксиантоцианидина -специфическом синтезе фитоалексинов . [ 91 ] например, во взаимодействии сорго -Colletotrichum . [ 92 ]
6-Метоксимеллеин представляет собой дигидроизокумарин и фитоалексин, индуцированный в ломтиках моркови УФ-С . [ 93 ] что обеспечивает устойчивость к Botrytis cinerea [ 94 ] и другие микроорганизмы . [ 95 ]
Даниелон – это фитоалексин, содержащийся в плодах папайи . Это соединение показало высокую противогрибковую активность в отношении Colletotrichum gloesporioides , патогенного гриба папайи. [ 96 ]
Стильбены образуются в сидероксилоне эвкалипта в случае поражения патогенами. Такие соединения могут быть связаны с гиперчувствительной реакцией растений. Высокий уровень фенольных соединений в некоторых породах древесины может объяснить их естественную защиту от гниения. [ 97 ]
В растениях VirA представляет собой протеингистидинкиназу , которая воспринимает определенные сахара и фенольные соединения. использует VirA Эти соединения обычно обнаруживаются в поврежденных растениях, и в результате Agrobacterium tumefaciens для обнаружения потенциальных организмов-хозяев для заражения. [ 98 ]
Роль в аллелопатических взаимодействиях
[ редактировать ]Природные фенолы могут участвовать в аллелопатических взаимодействиях, например, в почве. [ 99 ] или в воде. Юглон является примером такой молекулы, подавляющей рост других видов растений вокруг ореховых деревьев. [ нужна ссылка ] Водное сосудистое растение Myriophyllum spicatum продуцирует эллаговую , галловую и пирогалловую кислоты и (+)- катехин , аллелопатические фенольные соединения, подавляющие рост сине-зеленой водоросли Microcystis aeruginosa . [ 62 ]
Фенолы, в частности флавоноиды и изофлавоноиды , могут участвовать в образовании эндомикоризы . [ 100 ]
Ацетосирингон наиболее известен своим участием в распознавании растительных патогенов. [ 101 ] особенно его роль в качестве сигнала, привлекающего и трансформирующего уникальные онкогенные бактерии рода Agrobacterium . [ нужна ссылка ] Ген virA на плазмиде Ti в геноме Agrobacterium tumefaciens и Agrobacterium rhizogenes используется этими почвенными бактериями для заражения растений посредством кодирования рецептора ацетосирингона и других фенольных фитохимических веществ, выделяемых из ран растений. [ 102 ] Это соединение также обеспечивает более высокую эффективность трансформации растений в процедурах трансформации, опосредованных A. tumefaciens, и поэтому имеет важное значение в биотехнологии растений. [ 103 ]
Содержание в пище человека
[ редактировать ]Известные источники натуральных фенолов в питании человека включают ягоды , чай , пиво , оливковое масло , шоколад или какао , кофе , гранаты , попкорн , йерба мате , фрукты и напитки на фруктовой основе (включая сидр, вино и уксус ) и овощи . Травы и специи , орехи (грецкие орехи, арахис) и водоросли также потенциально важны для снабжения некоторыми природными фенолами.
Природные фенолы также можно найти в жирных матрицах, таких как оливковое масло . [ 104 ] Нефильтрованное оливковое масло имеет более высокий уровень фенолов или полярных фенолов, которые образуют сложный фенол-белковый комплекс.
Было показано, что фенольные соединения при использовании в напитках , таких как черносливовый сок , улучшают цвет и сенсорные компоненты, например, уменьшают горечь . [ 105 ]
Некоторые сторонники органического земледелия утверждают, что органически выращенный картофель , апельсины и листовые овощи содержат больше фенольных соединений, и они могут обеспечить антиоксидантную защиту от болезней сердца и рака . [ 106 ] Однако данных о существенных различиях между органическими продуктами питания и обычными продуктами питания недостаточно, чтобы поддержать утверждения о том, что органические продукты питания безопаснее и полезнее, чем обычные продукты питания. [ 107 ] [ 108 ]
Метаболизм человека
[ редактировать ]У животных и человека после приема внутрь природные фенолы становятся частью метаболизма ксенобиотиков . В последующих реакциях фазы II эти активированные метаболиты конъюгируются с заряженными соединениями, такими как глутатион , сульфат , глицин или глюкуроновая кислота . Эти реакции катализируются большой группой трансфераз широкой специфичности. UGT1A6 представляет собой человеческий ген, кодирующий фенол-УДФ-глюкуронозилтрансферазу, активную в отношении простых фенолов. [ 109 ] Фермент, кодируемый геном UGT1A8, обладает глюкуронидазной активностью со многими субстратами, включая кумарины , антрахиноны и флавоны . [ 110 ]
Ссылки
[ редактировать ]- ^ Jump up to: а б Ходдами, А; и др. (2013). «Методика анализа растительных фенольных соединений» . Молекулы . 18 (2): 2328–75. CiteSeerX 10.1.1.386.9960 . дои : 10.3390/molecules18022328 . ПМК 6270361 . ПМИД 23429347 .
- ^ Аморати, Р; Валджимигли, Л. (2012). «Модуляция антиоксидантной активности фенолов путем нековалентных взаимодействий» . Органическая и биомолекулярная химия . 10 (21): 4147–4158. дои : 10.1039/c2ob25174d . ПМИД 22505046 .
- ^ Роббинс, Ребекка Дж (2003). «Фенольные кислоты в пищевых продуктах: обзор аналитической методологии» . Журнал сельскохозяйственной и пищевой химии . 51 (10): 2866–2887. дои : 10.1021/jf026182t . ПМИД 12720366 . Архивировано из оригинала 4 марта 2016 г. Проверено 2 декабря 2018 г.
- ^ Jump up to: а б Хеттеншвилер, Стефан; Витоусек, Питер М. (2000). «Роль полифенолов в круговороте питательных веществ в наземной экосистеме» . Тенденции в экологии и эволюции . 15 (6): 238–243. дои : 10.1016/S0169-5347(00)01861-9 . ПМИД 10802549 .
- ^ Jump up to: а б Клепачка, Дж; и др. (2011). «Фенольные соединения как факторы, определяющие сорта и сорта некоторых растительных продуктов» . Растительная пища Хум Нутр . 66 (1): 64–69. дои : 10.1007/s11130-010-0205-1 . ПМК 3079089 . ПМИД 21243436 .
- ^ Мишра, Б.Б.; Тивари, ВК. (2011). «Натуральные продукты: развивающаяся роль в открытии будущих лекарств» . Eur J Med Chem . 46 (10): 4769–807. дои : 10.1016/j.ejmech.2011.07.057 . ПМИД 21889825 .
- ^ Уайлдман, Роберт ЕС (19 апреля 2016 г.). Справочник по нутрицевтикам и функциональным продуктам питания . ЦРК Пресс. ISBN 9781420006186 .
- ^ Jump up to: а б Вермеррис, Уилфред; Николсон, Ральф (20 февраля 2007 г.). Биохимия фенольных соединений . Springer Science & Business Media. ISBN 9781402051647 .
- ^ Харборн, Дж. Б. (1980). «Растительные фенолы». В Белле, EA; Чарлвуд, Б.В. (ред.). Энциклопедия физиологии растений, том 8: Вторичные растительные продукты . Берлин Гейдельберг Нью-Йорк: Springer-Verlag. стр. 329–395.
- ^ Латтанцио, Винченцо (январь 2013 г.), Рамават, Кишан Гопал; Мерийон, Жан-Мишель (ред.), «Фенольные соединения: Введение» , Натуральные продукты: фитохимия, ботаника и метаболизм алкалоидов, фенолов и терпенов , Берлин, Гейдельберг: Springer, стр. 1543–1580, doi : 10.1007/978- 3-642-22144-6_57 , ISBN 9783642221446
- ^ Джеймисон, Дженнифер Р. (2003). Клиническое руководство по питанию и диетическим добавкам при лечении заболеваний . Черчилль Ливингстон. п. 525. ИСБН 9780443071935 .
- ^ Глава восьмая: «Биосинтез терпенофеноленовых метаболитов в хмеле и каннабисе». Джонатан Э. Пейдж и Яна Нагель, Последние достижения в фитохимии , 2006 г., том 40, стр. 179–210, два : 10.1016/S0079-9920(06)80042-0
- ^ Пейдж, Джонатан Э.; Нагель, Яна (январь 2006 г.). «Глава восьмая - Биосинтез терпенофеноленовых метаболитов в хмеле и каннабисе» . В «Ромео», Джон Т. (ред.). Последние достижения в фитохимии . Интегративная биохимия растений. Том. 40. Эльзевир. стр. 179–210. дои : 10.1016/S0079-9920(06)80042-0 . ISBN 9780080451251 .
- ^ Жанденис, Дж.; Пезет, Р.; Табакки, Р. (2006). «Быстрый анализ стильбенов и производных из листьев винограда, зараженных ложной мучнистой росой, методом жидкостной хроматографии – фотоионизационной масс-спектрометрии при атмосферном давлении». Журнал хроматографии А. 1112 (1–2): 263–8. дои : 10.1016/j.chroma.2006.01.060 . ПМИД 16458906 .
- ^ Стинцинг, ФК; Стинтцинг, А.С.; Карл, Р.; Фрей, Б.; Врольстад, RE (2002). «Цвет и антиоксидантные свойства антоциановых пигментов на основе цианидина» . Журнал сельскохозяйственной и пищевой химии . 50 (21): 6172–6181. дои : 10.1021/jf0204811 . ПМИД 12358498 .
- ^ Карагеоргу, П.; Манетас, Ю. (2006). «Важность красного цвета в молодом возрасте: антоцианы и защита молодых листьев Quercus coccifera от травоядных насекомых и избытка света» . Физиология дерева . 26 (5): 613–621. дои : 10.1093/treephys/26.5.613 . ПМИД 16452075 .
- ^ Сунь, Вэйсин; Миллер, Джек М. (2003). «Тандемная масс-спектрометрия процианидинов B-типа в вине и дегидродикатехинов B-типа в смеси автоокисления (+)-катехина и (-)-эпикатехина» . Журнал масс-спектрометрии . 38 (4): 438–446. Бибкод : 2003JMSp...38..438S . дои : 10.1002/jms.456 . ISSN 1076-5174 . ПМИД 12717756 .
- ^ Он, Ф.; Пан, QH; Ши, Ю.; Чжан, ХТ; Дуань, CQ (2009). «Идентификация олигомеров автоокисления флаван-3-олов в модельных растворах методом ВЭЖХ-МС/МС» . Журнал масс-спектрометрии . 44 (5): 633–640. Бибкод : 2009JMSp...44..633H . дои : 10.1002/jms.1536 . ПМИД 19053150 .
- ^ Силлиерс, JJL; Синглтон, В.Л. (1989). «Неферментативные аутоокислительные реакции фенольного потемнения в модельной системе кофейной кислоты» . Журнал сельскохозяйственной и пищевой химии . 37 (4): 890–896. дои : 10.1021/jf00088a013 .
- ^ Сильерс, Йоханнес Дж.Л.; Синглтон, Вернон Л. (1990). «Неферментативные автоокислительные реакции кофейной кислоты в вине» . Американский журнал энологии и виноградарства . 41 (1): 84–86. дои : 10.5344/aev.1990.41.1.84 . S2CID 83665714 .
- ^ Талкотт, Северная Каролина; Ховард, ЛР (1999). «Фенольное автоокисление ответственно за ухудшение цвета обработанного морковного пюре». Журнал сельскохозяйственной и пищевой химии . 47 (5): 2109–2115. дои : 10.1021/jf981134n . ПМИД 10552504 .
- ^ Ю, Хайлонг; Чжан, Цзэн-Ли; Чен, Цзин; Пей, Айджи; Хуа, Фанг; Цянь, Сюаньчэнь; Он, Цзиньцзян; Лю, Чун-Фэн; Сюй, Синшунь (16 марта 2012 г.). «Карвакрол, пищевая добавка, обеспечивает нейропротекцию при очаговой церебральной ишемии/реперфузионном повреждении у мышей» . ПЛОС ОДИН . 7 (3): e33584. Бибкод : 2012PLoSO...733584Y . дои : 10.1371/journal.pone.0033584 . ISSN 1932-6203 . ПМК 3306416 . ПМИД 22438954 .
- ^ Jump up to: а б Бхаттачарья, А; и др. (2010). «Обзор: Роль растительных фенольных соединений в защите и общении во время заражения Agrobacterium и Rhizobium» . Мол Плант Патол . 11 (5): 705–19. дои : 10.1111/j.1364-3703.2010.00625.x . ПМК 6640454 . ПМИД 20696007 .
- ^ Нэггс, Эндрю Р. (2001). «Биосинтез метаболитов шикимата (1999)». Отчеты о натуральных продуктах . 18 (3): 334–55. дои : 10.1039/b001717p . ПМИД 11476485 .
- ^ Лукас, Рикардо; Комельес, Франциско; Алькантара, Дэвид; Мальдонадо, Оливия С.; Куркуроз, Мелани; Парра, Хосе Л.; Моралес, Хуан К. (2010). «Поверхностно-активные свойства липофильных антиоксидантов тирозола и эфиров жирных кислот гидрокситирозола: потенциальное объяснение нелинейной гипотезы антиоксидантной активности в эмульсиях масло в воде». Журнал сельскохозяйственной и пищевой химии . 58 (13): 8021–6. дои : 10.1021/jf1009928 . hdl : 11441/154173 . ПМИД 20524658 .
- ^ Шмейкал, Карел; Грицова, Ленка; Марек, Радек; Лемьер, Филип; Янковска, Дагмар; Форейтникова, Хана; Ванчо, Ян; Сухи, Вацлав (2007). «C-гераниловые соединения из плодов павловнии войлочной ». Журнал натуральных продуктов . 70 (8): 1244–8. дои : 10.1021/np070063w . ПМИД 17625893 .
- ^ Лу Й; Ян Л; Ван Ю; Чжоу С; Фу Дж; Чжан Дж (июнь 2009 г.). «Биодеградация фенольных соединений сточных вод коксования иммобилизованным грибом белой гнили Phanerochaete chrysosporium». Журнал опасных материалов . 165 (1–3): 1091–7. дои : 10.1016/j.jhazmat.2008.10.091 . ПМИД 19062164 .
- ^ Перумалсами, Харибалан; Чан, Мён Джин; Ким, Джун-Ран; Кадаркарай, Муруган; Ан, Ён Джун (2015). «Ларвицидная активность и возможный механизм действия четырех флавоноидов и двух жирных кислот, выявленных в семенах Millettia pinnata, в отношении трех видов комаров» . Паразиты и переносчики . 8 (1): 237. дои : 10.1186/s13071-015-0848-8 . ISSN 1756-3305 . ПМК 4410478 . ПМИД 25928224 .
- ^ Хилл, Меган; Джефф, Кейн (2007). Рыночный потенциал танинных инноваций в винодельческой отрасли . Департамент первичной промышленности, Библиотечная служба правительства штата Виктория (VGLS). ISBN 9781741998580 . Архивировано из оригинала 05.11.2022.
- ^ Карр, Мириам; Грин, Лиза М.; Нокс, Эндрю Дж.С.; Ллойд, Дэвид Г.; Зистерер, Даниэла М.; Миган, Мэри Дж. (2010). «Идентификация конформационно ограниченных аналогов комбретастатина β-лактамного типа: синтез, антипролиферативная активность и эффекты нацеливания на тубулин». Европейский журнал медицинской химии . 45 (12): 5752–5766. дои : 10.1016/j.ejmech.2010.09.033 . ПМИД 20933304 .
- ^ Вильяверде, Джей Джей; Де Вега, А.; Лигеро, П.; Фрейре, CSR; Нето, КП; Сильвестр, AJD (2010). «Органосольвное фракционирование коры Miscanthus x giganteus: судьба липофильных компонентов и образование ценных фенольных побочных продуктов». Журнал сельскохозяйственной и пищевой химии . 58 (14): 8279–8285. дои : 10.1021/jf101174x . ПМИД 20593898 .
- ^ Ханаи, Т.; Коидзуми, К.; Киношита, Т.; Арора, Р.; Ахмед, Ф. (1997). «Прогнозирование значений pK a фенольных и азотсодержащих соединений с помощью компьютерного химического анализа по сравнению с показателями, измеренными с помощью жидкостной хроматографии». Журнал хроматографии А. 762 (1–2): 55–61. дои : 10.1016/S0021-9673(96)01009-6 . ПМИД 9098965 .
- ^ Бельтран, Дж. (2003). «Спектрофотометрические, потенциометрические и хроматографические значения рК а полифенольных кислот в воде и ацетонитрил-водных средах». Аналитика Химика Акта . 484 (2): 253–264. дои : 10.1016/S0003-2670(03)00334-9 .
- ^ Рене, Алиса; Абаск, Мари-Лоуренс; Ошар, Дидье; Хапио, Филипп (2010). «Как фенольные соединения реагируют на ион супероксида? Простой электрохимический метод оценки антиоксидантной способности». Аналитическая химия . 82 (20): 8703–10. дои : 10.1021/ac101854w . ПМИД 20866027 .
- ^ Лидьярв, А.; Иваск, А.; Вирта, М.; Кару, А. (2006). «Анализ биодоступных фенолов из природных образцов с помощью рекомбинантных люминесцентных бактериальных сенсоров». Хемосфера . 64 (11): 1910–9. Бибкод : 2006Chmsp..64.1910L . doi : 10.1016/j.chemSphere.2006.01.026 . ПМИД 16581105 .
- ^ Стобецкий, М.; Скирич, А.; Керхоас, Л.; Качлицкий, П.; Мут, Д.; Эйнхорн, Дж.; Мюллер-Робер, Б. (2006). «Профилирование фенольных гликозидных конъюгатов в листьях Arabidopsis thaliana с использованием ЖХ/МС». Метаболомика . 2 (4): 197–219. дои : 10.1007/s11306-006-0031-5 . S2CID 39140266 .
- ^ «Основное содержание флавоноидов в цветках Cratageus monogyna Jacq и Cratageus Laevigata (Poiret DC) в зависимости от растительности». Дж. Л. Ламейсон и А. Карне, Plantes Medicinales Phytotherapie , 1991, XXV, страницы 12–16.
- ^ Уокер, Ричард Б.; Эверетт, Джейс Д. (2009). «Сравнительная скорость реакции различных антиоксидантов с катион-радикалом ABTS». Журнал сельскохозяйственной и пищевой химии . 57 (4): 1156–61. дои : 10.1021/jf8026765 . ПМИД 19199590 .
- ^ Мейер, Энн С.; Йи, Ок-Сук; Пирсон, Дебра А.; Уотерхаус, Эндрю Л.; Франкель, Эдвин Н. (1997). «Ингибирование окисления липопротеинов низкой плотности человека в зависимости от состава фенольных антиоксидантов в винограде ( Vitis vinifera )». Журнал сельскохозяйственной и пищевой химии . 45 (5): 1638–1643. дои : 10.1021/jf960721a .
- ^ Вулф, КЛ; Лю, Р.Х. (2007). «Анализ клеточной антиоксидантной активности (CAA) для оценки антиоксидантов, продуктов питания и пищевых добавок». Журнал сельскохозяйственной и пищевой химии . 55 (22): 8896–8907. дои : 10.1021/jf0715166 . ПМИД 17902627 .
- ^ Астрид; фон Гадов, Элизабет Жубер; Хансманн, Крис Ф. (1997). «Сравнение антиоксидантной активности аспалатина с активностью других растительных фенолов чая ройбуш (Aspalathus Linearis), α-токоферола, BHT и BHA». Дж. Агрик. Пищевая хим . 45 (3): 632–638. дои : 10.1021/jf960281n .
- ^ Гиршл, Павел; Бююкгюзель, Эндер; Бююкгюзель, Кемаль (2007). «Влияние окислительного стресса, вызванного борной кислотой, на антиоксидантные ферменты и выживаемость Galleria mellonella». Архив биохимии и физиологии насекомых . 66 (1): 23–31. дои : 10.1002/arch.20194 . ПМИД 17694562 .
- ^ Копачек, Петр; Вайзе, Кристоф; Гетц, Питер (1995). «Профенолоксидаза восковой моли Galleria mellonella: очистка и характеристика профермента». Биохимия насекомых и молекулярная биология . 25 (10): 1081–1091. дои : 10.1016/0965-1748(95)00040-2 . ПМИД 8580908 .
- ^ Ли, Сян; Гао, Мин-Цзюнь; Пан, Хун-Ю; Кюи, Де-Жун; Грубер, Маргарет Ю. (2010). «Фиолетовая канола: ArabidopsisPAP1 увеличивает количество антиоксидантов и фенолов в листьях Brassica napus ». Журнал сельскохозяйственной и пищевой химии . 58 (3): 1639–45. дои : 10.1021/jf903527y . ПМИД 20073469 .
- ^ Производство фенольных соединений микроводорослями Spirulina maxima и их защитные эффекты in vitro на модели гепатотоксичности . Абд Эль-Баки Ханаа Х., Эль Баз Фарук К. и Эль-Бароти Гамаль С., Достижения в области пищевых наук , 2009 г., том 31, номер 1, стр. 8–16, INIST 21511068
- ^ Jump up to: а б Бабу Б.; Ву JT (декабрь 2008 г.). «Производство природного бутилированного гидрокситолуола в качестве антиоксиданта пресноводным фитопланктоном» (PDF) . Журнал психологии . 44 (6): 1447–1454. дои : 10.1111/j.1529-8817.2008.00596.x . ПМИД 27039859 . S2CID 26084768 .
- ^ Ачкар, Джихане; Сиань, Мо; Чжао, Хуэйминь; Фрост, JW (2005). «Биосинтез флороглюцина». Дж. Ам. хим. Соц . 127 (15): 5332–5333. дои : 10.1021/ja042340g . ПМИД 15826166 .
- ^ Баррос, Лилиан; Дуэньяс, Монтсеррат; Феррейра, Изабель CFR; Баптиста, Паула; Сантос-Буэльга, Селестино (2009). «Определение фенольных кислот методом ВЭЖХ-DAD-ESI/MS в шестнадцати различных видах португальских лесных грибов». Пищевая и химическая токсикология . 47 (6): 1076–9. дои : 10.1016/j.fct.2009.01.039 . ПМИД 19425182 .
- ^ Дельсиньор, А; Ромео, Ф; Джаччо, М (1997). «Содержание фенольных веществ в базидиомицетах». Микологические исследования . 101 (5): 552–6. дои : 10.1017/S0953756296003206 .
- ^ Гош, Суман; Кебаара, Бесси В.; Аткин, Одри Л.; Никерсон, Кеннет В. (2008). «Регулирование производства ароматического спирта Candida albicans» . Прикладная и экологическая микробиология . 74 (23): 7211–7218. Бибкод : 2008ApEnM..74.7211G . дои : 10.1128/АЕМ.01614-08 . ПМК 2592902 . ПМИД 18836025 .
- ^ Шлавко, Клара М. (1973). «Тртптофол, тирозол и фенилэтанол — ароматические высшие спирты в пиве» . Журнал Института пивоварения . 79 (4): 283–288. дои : 10.1002/j.2050-0416.1973.tb03541.x .
- ^ Хоган, Дебора А. (2006). «Чувство кворума: алкоголики в социальной ситуации» . Современная биология . 16 (12): 457–458 р. дои : 10.1016/j.cub.2006.05.035 . ПМИД 16782000 . S2CID 3970864 .
- ^ Робике (1829 г.). «Аналитический тест лишайников щавеля». Анналы химии и физики . 42 : 236–257.
- ^ Онофрейова, Л.; Вашичкова Ю.; Клейдус, Б.; Стратил, П.; Мишурцова, Л.; Крачмар, С.; Копецкий, Ю.; Вацек, Дж. (2010). «Биоактивные фенолы в водорослях: применение методов жидкостной и твердофазной экстракции под давлением». Журнал фармацевтического и биомедицинского анализа . 51 (2): 464–470. дои : 10.1016/j.jpba.2009.03.027 . ПМИД 19410410 .
- ^ Йоу, HD; Кетчум, СО; Франция, Д.; Баир, К.; Гервик, WH (2002). «Видаленолон, новый фенольный метаболит тропической красной водоросли Видалиасп». Журнал натуральных продуктов . 65 (1): 51–53. дои : 10.1021/np010319c . ПМИД 11809064 .
- ^ Педерсен, Дж. А.; Оллгаард, Б. (1982). «Фенольные кислоты рода Lycopodium». Биохимическая систематика и экология . 10 :3–9. дои : 10.1016/0305-1978(82)90044-8 .
- ^ Карначан, С.М.; Харрис, Пи Джей (2000). «Феруловая кислота связана с первичными клеточными стенками всех семейств голосеменных». Биохимическая систематика и экология . 28 (9): 865–879. дои : 10.1016/S0305-1978(00)00009-0 . ПМИД 10913848 .
- ^ Адам, КП (1999). «Фенольные компоненты папоротника Phegopteris Connectilis». Фитохимия . 52 (5): 929–934. Бибкод : 1999PChem..52..929A . дои : 10.1016/S0031-9422(99)00326-X .
- ^ Флавоноиды и проантроцианидин из корневищ Selliguea fei. Пэк Нам-Ин, Кеннелли Э.Дж., Кардоно Л.Б.С., Цаури С., Падмавината К., Соехарто Д.Д. и Кингхорн А.Д., Фитохимия , 1994, том. 36, нет. 2, стр. 513–518, ИНИСТ 3300075.
- ^ Чоудхари, Мичиган; Нахид, Н.; Аббасхан А.; Мушарраф, С.Г.; Сиддики, Х.; Атта-Ур-Рахман (2008). «Фенолы и другие компоненты пресноводного папоротника Salvinia molesta». Фитохимия . 69 (4): 1018–1023. Бибкод : 2008PChem..69.1018C . doi : 10.1016/j.phytochem.2007.10.028 . ПМИД 18177906 .
- ^ Крокене, П.; Надь, штат Невада; Креклинг, Т. (2008). «Травматические смоляные протоки и клетки полифенольной паренхимы хвойных деревьев». Индуцированная устойчивость растений к травоядным . п. 147. дои : 10.1007/978-1-4020-8182-8_7 . ISBN 978-1-4020-8181-1 .
- ^ Jump up to: а б Накаи, С. (2000). «Аллелопатические полифенолы, выделяемые Myriophyllum spicatum, ингибируют рост сине-зеленых водорослей Microcystis aeruginosa». Исследования воды . 34 (11): 3026–3032. Бибкод : 2000WatRe..34.3026N . дои : 10.1016/S0043-1354(00)00039-7 .
- ^ Эриксон, М.; Микше, GE (1974). «О наличии лигнина или полифенолов в некоторых мхах и печеночниках». Фитохимия . 13 (10): 2295–2299. Бибкод : 1974PChem..13.2295E . дои : 10.1016/0031-9422(74)85042-9 .
- ^ Фогельсанг, К.; Шнайдер, Б.; Петерсен, М. (2005). «Производство розмариновой кислоты и нового 3'-O-β-D-глюкозида розмариновой кислоты в суспензионных культурах роголистника Anthoceros agrestis Paton». Планта . 223 (2): 369–373. дои : 10.1007/s00425-005-0089-8 . ПМИД 16133208 . S2CID 29302603 .
- ^ Хэкман, Р.Х.; Прайор, МГ; Тодд, Арканзас (1948). «Распространение фенольных веществ у членистоногих» . Биохимический журнал . 43 (3): 474–477. дои : 10.1042/bj0430474 . ПМЦ 1274717 . ПМИД 16748434 .
- ^ Ацетосирингон на www.pherobase.com, база данных по феромонам.
- ^ Олдрич, младший; Блюм, М.С.; Даффи, СС; Фалес, HM (1976). «Специфические мужские натуральные продукты в организме клопа Leptoglossus phyllopus: химия и возможная функция». Журнал физиологии насекомых . 22 (9): 1201–1206. дои : 10.1016/0022-1910(76)90094-9 .
- ^ Олдрич, младший; Блюм, М.С.; Фалес, HM (1979). «Видоспецифические натуральные продукты взрослых самцов листоверток (Hemiptera: Heteroptera)». Журнал химической экологии . 5 : 53–62. дои : 10.1007/BF00987687 . S2CID 34346907 .
- ^ Диллон, Р.Дж.; Веннард, Коннектикут; Чарнли, АК (апрель 2002 г.). «Примечание: кишечные бактерии производят компоненты феромона сплоченности саранчи» . Журнал прикладной микробиологии . 92 (4): 759–763. дои : 10.1046/j.1365-2672.2002.01581.x . ISSN 1364-5072 . ПМИД 11966918 . S2CID 8561972 .
- ^ Диллон, Род Дж.; Веннард, Крис Т.; Чарнли, А. Кейт (2000). «Эксплуатация кишечных бактерий саранчи» . Природа . 403 (6772): 851. дои : 10.1038/35002669 . ПМИД 10706273 . S2CID 5207502 .
- ^ Полухимический - 2-метокси-4-винилфенол , Pherobase.com
- ^ Марлье, Дж.; Кине, Ю.; Дебисо, Ж. (2004). «Защитное поведение и биологическая активность брюшного секрета муравья Crematogaster Scutellaris (Hymenoptera: Myrmicinae)» (PDF) . Поведенческие процессы . 67 (3): 427–40. дои : 10.1016/j.beproc.2004.07.003 . ПМИД 15518992 . S2CID 21599793 .
- ^ Запахи мочевых, височных желез и дыхания азиатских слонов в национальном парке Мудумалай. Л.Л. Расмуссен и В. Кришнамурти, Gajah, Журнал Группы специалистов по азиатским слонам , январь 2001 г., номер 20, страницы 1–8 ( статья )
- ^ Расмуссен, ЛЕЛ; Перрин, Т.Э. (1999). «Физиологические корреляты сусла». Физиология и поведение . 67 (4): 539–49. дои : 10.1016/S0031-9384(99)00114-6 . ПМИД 10549891 . S2CID 21368454 .
- ^ "Сусло у слонов" . Дипа Анант, Печатный журнал Zoo , 15 (5), стр. 259–262 ( статья заархивирована 4 июня 2018 г. в Wayback Machine )
- ^ Адамс, Дж.; Гарсия, А.; Фут, CS (1978). «Некоторые химические составляющие секрета височной железы африканского слона (Loxodonta africana)». Журнал химической экологии . 4 : 17–25. дои : 10.1007/BF00988256 . S2CID 45857570 .
- ^ «Зачем изучать запах свиньи?» .
- ^ Мюллер-Шварце, Д.; Хулихан, PW (1991). «Феромональная активность отдельных компонентов кастореума у бобра Castor canadensis». Журнал химической экологии . 17 (4): 715–34. дои : 10.1007/BF00994195 . ПМИД 24258917 . S2CID 29937875 .
- ^ К.Майкл Хоган (2008) Западный ядовитый дуб: Toxicodendron diversilobum , GlobalTwitcher, изд. Никлас Стромберг «Архивная копия» . Архивировано из оригинала 21 июля 2009 г. Проверено 21 июля 2009 г.
{{cite web}}: CS1 maint: архивная копия в заголовке ( ссылка ) - ^ Биогеохимия: анализ глобальных изменений . 2-е издание. Уильям Х. Шлезингер, Academic Press, 1997, 108, 135, 152–158, 180–183, 191–194.
- ^ Растительные смолы: химия, эволюция, экология и этноботаника , Джин Лангенхайм, Timber Press , Портленд, Орегон. 2003 г.
- ^ Стейнберг, П.Д. (1984). «Химическая защита водорослей от травоядных: выделение фенольных соединений в водорослях Alaria Marginata». Наука . 223 (4634): 405–407. Бибкод : 1984Sci...223..405S . дои : 10.1126/science.223.4634.405 . ПМИД 17829890 . S2CID 36409146 .
- ^ Стейнберг, П.Д. (1986). «Химическая защита и восприимчивость тропических морских бурых водорослей к травоядным». Экология . 69 (4): 628–630. Бибкод : 1986Oecol..69..628S . дои : 10.1007/BF00410374 . ПМИД 28311627 . S2CID 19551247 .
- ^ Таргетт, Нэнси М.; Коэн, Лорен Д.; Бетчер, Энн А.; Таннер, Кристофер Э. (1992). «Биогеографические сравнения полифенолов морских водорослей: свидетельства против широтного тренда». Экология . 89 (4): 464–470. Бибкод : 1992Oecol..89..464T . дои : 10.1007/BF00317150 . JSTOR 4219911 . ПМИД 28311874 . S2CID 5655010 .
- ^ Ф. Фаварон, М. Луккетта, С. Одорицци, А. Т. Паис да Кунья и Л. Селла (2009). «Роль полифенолов винограда в активности транс-ресвератрола против Botrytis cinerea и грибковой лакказы в растворимости предполагаемых белков PR винограда» (PDF) . Журнал патологии растений . 91 (3): 579–588. doi : 10.4454/jpp.v91i3.549 (неактивен 31 января 2024 г.) . Проверено 22 января 2011 г.
{{cite journal}}: CS1 maint: DOI неактивен по состоянию на январь 2024 г. ( ссылка ) CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Тимперио, AM; д'Алессандро, А.; Фаджиони, М.; Магро, П.; Золла, Л. (2012). «Продукция фитоалексинов транс-ресвератрола и дельта-виниферина в двух экономически важных сортах винограда при заражении Botrytis cinerea в полевых условиях». Физиология и биохимия растений . 50 (1): 65–71. дои : 10.1016/j.plaphy.2011.07.008 . ПМИД 21821423 .
- ^ Ховелстад, Х.; Лейрсет, И.; Ойаас, К.; Фиксдал, А. (2006). «Скрининговый анализ пиносильвина стильбенов, смоляных кислот и лигнанов в норвежских хвойных деревьях» . Молекулы . 11 (1): 103–114. дои : 10.3390/11010103 . ПМК 6148674 . ПМИД 17962750 .
- ^ Ли, СК; Ли, HJ; Мин, HY; Парк, Э.Дж.; Ли, К.М.; Ан, Ю.Х.; Чо, Ю.Дж.; Пайи, Дж. Х. (2005). «Антибактериальная и противогрибковая активность пиносильвина, входящего в состав сосны». Фитотерапия . 76 (2): 258–260. дои : 10.1016/j.fitote.2004.12.004 . ПМИД 15752644 .
- ^ «Сакуранетин» . home.ncifcrf.gov . Архивировано из оригинала 3 декабря 2018 г. Проверено 2 декабря 2018 г.
- ^ Сакуранетин, флавононовый фитоалексин из листьев риса, облученных ультрафиолетом, Кодама О., Миякава Дж., Акацука Т. и Кийосава С., Фитохимия , 1992, том 31, номер 11, стр. 3807–3809, INIST 4682303
- ^ Ши, С.-Х.; Чу, ИК; Йип, ВК; Ло, К. (2006). «Дифференциальная экспрессия двух кДНК флавоноид-3'-гидроксилазы, участвующих в биосинтезе антоциановых пигментов и 3-дезоксиантоцианидиновых фитоалексинов в сорго» . Физиология растений и клеток . 47 (10): 1412–1419. дои : 10.1093/pcp/pcl003 . ПМИД 16943219 .
- ^ «Биосинтез и регуляция фитоалексинов 3-дезоксиантоцианидина, индуцированных во время взаимодействия сорго и коллетотрихума : гетерологичная экспрессия в кукурузе». Чопра Суриндер, Гаффур Иффа, Ибрагим Фараг, плакат Американского общества биологов растений ( аннотация заархивирована 25 июля 2011 г. в Wayback Machine )
- ^ Мерсье, Дж.; Арул, Дж.; Поннампалам, Р.; Буле, М. (1993). «Индукция 6-метоксимеллеина и устойчивость к патогенам хранения в ломтиках моркови под воздействием УФ-С». Журнал фитопатологии . 137 : 44–54. дои : 10.1111/j.1439-0434.1993.tb01324.x .
- ^ Хоффман, Р.; Хил, Дж. Б. (1987). «Гибель клеток, накопление 6-метоксимеллеина и индуцированная устойчивость к Botrytis cinerea в кусочках корня моркови». Физиологическая и молекулярная патология растений . 30 : 67–75. дои : 10.1016/0885-5765(87)90083-X .
- ^ Куросаки, Ф.; Ниши, А. (1983). «Выделение и антимикробная активность фитоалексина 6-метоксимеллеина из культивируемых клеток моркови». Фитохимия . 22 (3): 669–672. Бибкод : 1983PChem..22..669K . дои : 10.1016/S0031-9422(00)86959-9 .
- ^ Даниелон, фитоалексин из плодов папайи . Эчеверри Ф., Торрес Ф., Хиноны В., Кардона Г., Арчболд Р., Ролдан Дж., Брито И., Луис Дж.Г. и Лалоу У.Э.-Х., Фитохимия , 1997, том. 44, нет. 2, с. 255–256, ИНИСТ 2558881
- ^ Харт, Джон Х.; Хиллис, МЫ (1974). «Подавление деревогниющих грибов стильбенами и другими полифенолами в сидероксилоне эвкалипта ». Фитопатология . 64 (7): 939–48. дои : 10.1094/Phyto-64-939 .
- ^ Бренчич, Аня; Винанс, Стивен К. (март 2005 г.). «Обнаружение и реагирование на сигналы, участвующие во взаимодействиях хозяина и микроба с помощью растительных бактерий» . Микробиол Мол Биол Rev. 69 (1): 155–194. дои : 10.1128/ммбр.69.1.155-194.2005 . ПМЦ 1082791 . ПМИД 15755957 .
- ^ Блюм, Удо; Шафер, Стивен Р.; Леман, Мэри Э. (1999). «Доказательства ингибирующих аллелопатических взаимодействий с участием фенольных кислот в полевых почвах: концепции и экспериментальная модель». Критические обзоры по наукам о растениях . 18 (5): 673–93. дои : 10.1080/07352689991309441 .
- ^ Моранди, Д. (1996). «Присутствие фитоалексинов и фенольных соединений в эндомикоризных взаимодействиях и их потенциальная роль в биологическом контроле». Растение и почва . 185 (2): 241–305. дои : 10.1007/BF02257529 . S2CID 30091640 .
- ^ «Участие ацетосирингона в распознавании растительных патогенов». Бейкер К. Джейсин, Мок Нортон М., Уитакер Брюс Д., Робертс Дэниел П., Райс Клиффорд П., Дил Кеннет Л. и Аверьянов Андрей А., Связь биохимических и биофизических исследований , 2005, том 328, номер 1 , стр. 130–136, ИНИСТ 16656426.
- ^ Шраммейер, Б.; Бейерсберген, А.; Айдлер, КБ; Мельчерс, Л.С.; Томпсон, Д.В.; Хойкаас, Пи Джей (2000). «Анализ последовательности vir-области плазмиды Agrobacterium tumefaciens Octopine Ti pTi15955» . Журнал экспериментальной ботаники . 51 (347): 1167–1169. дои : 10.1093/jexbot/51.347.1167 . ПМИД 10948245 .
- ^ Шейхолеслам, С.Н.; Уикс, ДП (1987). «Ацетосирингон способствует высокоэффективной трансформации эксплантов Arabidopsis thaliana с помощью Agrobacterium tumefaciens». Молекулярная биология растений . 8 (4): 291–298. дои : 10.1007/BF00021308 . ПМИД 24301191 . S2CID 32005770 .
- ^ Гутфингер, Т. (1981). «Полифенолы в оливковом масле». Журнал Американского общества нефтехимиков . 58 (11): 966–8. дои : 10.1007/BF02659771 . S2CID 85367601 .
- ^ Донован, Дженнифер Л.; Мейер, Энн С.; Уотерхаус, Эндрю Л. (1998). «Фенольный состав и антиоксидантная активность чернослива и черносливового сока (Prunus Domestica)». Журнал сельскохозяйственной и пищевой химии . 46 (4): 1247–1252. дои : 10.1021/jf970831x .
- ^ Асами, Дэнни К. «Сравнение общего содержания фенольной и аскорбиновой кислоты в сублимированной и воздушно-сушеной марионетке, клубнике и кукурузе, выращенных с использованием традиционных, органических и устойчивых методов ведения сельского хозяйства» . Журнал сельскохозяйственной и пищевой химии (Американское химическое общество), 51 (5), 1237–1241, 2003. 10.1021/jf020635c S0021-8561(02)00635-0. Проверено 10 апреля 2006 г.
- ^ Смит-Спенглер, К.; Брандо, ML ; Хантер, GE; Бавингер, Дж. К.; Пирсон, М.; Эшбах, П.Дж.; Сундарам, В.; Лю, Х.; Ширмер, П.; Став, К.; Олькин И.; Бравата, ДМ (4 сентября 2012 г.). «Являются ли органические продукты более безопасными и полезными для здоровья, чем обычные альтернативы?: систематический обзор». Анналы внутренней медицины . 157 (5): 348–366. дои : 10.7326/0003-4819-157-5-201209040-00007 . ПМИД 22944875 . S2CID 21463708 .
- ^ Блэр, Роберт. (2012). Органическое производство и качество продуктов питания: практичный анализ . Уайли-Блэквелл, Оксфорд, Великобритания. ISBN 978-0-8138-1217-5
- ^ «Клонирование и субстратная специфичность человеческой фенол-УДФ-глюкуронозилтрансферазы, экспрессируемой в клетках COS-7» . Дэвид Хардинг, Сильви Фурнель-Жигле, Майкл Р. Джексон и Брайан Берчелл, Proc. Натл. акад. наук. США , ноябрь 1988 г., том 85, стр. 8381–8385, ( аннотация )
- ^ Риттер Дж.К.; Чен Ф.; Шин YY; Тран ХМ; Кимура С.; Йитман М.Т.; Оуэнс И.С. (март 1992 г.). «Новый сложный локус UGT1 кодирует человеческий билирубин, фенол и другие изоферменты УДФ-глюкуронозилтрансферазы с идентичными карбоксильными концами» . J Биол Хим . 267 (5): 3257–61. дои : 10.1016/S0021-9258(19)50724-4 . ПМИД 1339448 .
Книги
[ редактировать ]- Биохимия фенольных соединений , Дж. Б. Харборн, 1964, Academic Press ( Google Книги )
- Растительные фенольные смолы , Паскаль Риберо-Гайон, 1972, Oliver and Boyd Editions ( Google Книги , ISBN 0050025120 , ISBN 9780050025123 )
- Биохимия растительных фенолов , К. Ф. ван Шумер и П. Дж. Леа, Европейское фитохимическое общество, 1985, Clarendon Press ( Google Books , ISBN 9780198541707 )
- Биохимия фенольных соединений , Уилфред Вермеррис и Ральф Николсон, 2006, Springer ( книга Google )
Внешние ссылки
[ редактировать ]Базы данных
[ редактировать ]- Phenol-Explorer ( phenol-explorer.eu ), база данных, посвященная фенолам, обнаруженным в продуктах питания, автор Огюстен Скальберт, INRA Клермон-Ферран, Отдел по питанию человека
- Фенолы в ЧЭБИ (Химические соединения, представляющие биологический интерес)
- ChEMBLdb , база данных биоактивных малых молекул, подобных лекарствам, Европейского института биоинформатики.
- Foodb — база данных соединений, содержащихся в продуктах питания.