COVID-19 вакцина
Эта статья может потребовать очистки Википедии для соответствия стандартам качества . Конкретная проблема заключается в том, что эта статья не соблюдает краткую информацию и похоронит информацию о последних вакцинах. ( Сентябрь 2024 г. ) |
| Описание вакцины | |
|---|---|
| Цель | SARS-Done-2 |
| Тип вакцины | мРНК, вирусная, инактивированная, белок |
| Клинические данные | |
| Маршруты администрация | Внутримышечный |
| Код ATC | |
| Идентификаторы | |
| Chemspider |
|
| Часть серии на |
| COVID-19 пандемия |
|---|
 |
|
|
Вакцина с ковидом-19-летняя вакцина, предназначенная для обеспечения приобретенного иммунитета против тяжелого острого респираторного синдрома коронавируса 2 ( SARS-COV-2 ), вируса, который вызывает болезнь коронавируса 2019 ( Covid-19 ).
Перед пандемией Covid -19 существовал устоявший составой состав знаний о структуре и функции коронавирусов, вызывающих такие заболевания, как тяжелый острый респираторный синдром ( SAR ) и синдром дыхания на Ближнем Востоке ( MERS ). Эти знания ускорили разработку различных вакцинных платформ в начале 2020 года. [ 1 ] Первоначальный центр вакцин SARS-COV-2 был на предотвращении симптома, часто тяжелой болезни. [ 2 ] В 2020 году были разработаны первые вакцины COVID -19 [ 3 ] и условные разрешения. [ 4 ] [ 5 ] Первоначально, большинство вакцин с Covid-19 представляли собой вакцины с двумя дозами, за исключением вакцин с одним дозами Convidecia [ 6 ] и 19 вакцина с ковидом Janssen , [ 3 ] и вакцины с тремя дозами, Razi Cov pars [ 7 ] и суверенный . [ 8 ] Тем не менее, было обнаружено, что иммунитет от вакцин со временем ухудшается, что требует от людей, чтобы получить усилительные дозы вакцины для поддержания защиты от Covid -19. [ 3 ]
Вакцины Covid -19 широко приписываются за их роль в сокращении распространения Covid -19 и снижении тяжести и смерти, вызванной Covid -19. [ 3 ] [ 9 ] Согласно исследованию, проведенному в июне 2022 года, вакцины COVID -19 предотвратили дополнительные смерти от 14,4 до 19,8 млн. В 185 странах и территориях с 8 декабря 2020 года по 8 декабря 2021 года. [ 10 ] Многие страны внедрили поэтапные планы распределения, которые приоритеты в отношении тех, кто подвергается наибольшему риску осложнений, таких как пожилые люди, и те, кто подвергается высокому риску воздействия и передачи, таких как медицинские работники. [ 11 ] [ 12 ]
Общие побочные эффекты вакцин с Covid -19 включают болезненность, покраснение, сыпь, воспаление в месте инъекции, усталость, головную боль, миалгию (мышечную боль) и артралгию (боль в суставах), которые разрешаются без лечения в течение нескольких дней. [ 13 ] [ 14 ] Вакцинация Covid -19 безопасна для беременных людей или кормящих грудью. [ 15 ]
По состоянию на 12 августа 2024 года [update], 13,72 млрд. Доз вакцин в Ковиде -19 были введены по всему миру, основанные на официальных отчетах национальных учреждений общественного здравоохранения . [ 16 ] К декабрю 2020 года странам было предварительно заказано более 10 миллиардов доз вакцины, [ 17 ] Приблизительно половина доз, приобретенных странами с высоким уровнем дохода, составляющих 14% населения мира. [ 18 ]
Несмотря на чрезвычайно быстрое развитие эффективной мРНК и вирусных векторных вакцин , мировой справедливость вакцины не был достигнут. Разработка и использование цельного инактивированного вируса (WIV) и белковых вакцин на основе белков также рекомендовано, особенно для использования в развивающихся странах . [ 19 ] [ 20 ]
2023 года Нобелевская премия в области физиологии или медицины была присуждена Каталин Карико и Дрю Вайсману за развитие эффективных вакцин против мРНК против Covid-19. [ 21 ] [ 22 ] [ 23 ]
Фон
-
Ковид -19 доз вакцины, вводимые континентом по состоянию на 11 октября 2021 года. Для вакцин, которые требуют множественных доз, подсчитывается каждая отдельная доза. Поскольку тот же человек может получить более одной дозы, количество доз может быть выше, чем число людей в населении.
-
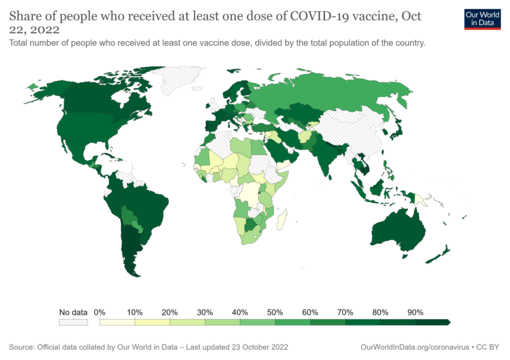
Карта, показывающая долю населения, полностью вакцинированная против COVID-19 по сравнению с общей численностью населения страны [ Примечание 1 ]

До Covid -19 вакцина для инфекционного заболевания никогда не производилась менее чем за несколько лет - и никакой вакцины не существовало для предотвращения инфекции коронавируса у людей. [ 24 ] Тем не менее, вакцины были произведены против нескольких заболеваний животных, вызванных коронавирусами, в том числе (по состоянию на 2003 г.) вируса инфекционного бронхита у птиц, собачьего коронавируса и кошачьего коронавируса . [ 25 ] Предыдущие проекты по разработке вакцин для вирусов в семейных Coronaviridae , которые влияют на людей, были направлены на тяжелый острый респираторный синдром (SARS) и респираторный синдром на Ближнем Востоке (MERS). Вакцины против SARS [ 26 ] и Мерс [ 27 ] были проверены у нечеловеческих животных .
Согласно исследованиям, опубликованным в 2005 и 2006 годах, выявление и разработка новых вакцин и лекарств для лечения SARS была приоритетом для правительств и учреждений общественного здравоохранения по всему миру в то время. [ 28 ] [ 29 ] [ 30 ] Не существует лечения или защитной вакцины, которая оказалась безопасной и эффективной против SARS у людей. [ 31 ] [ 32 ] Также нет проверенной вакцины против MERS. [ 33 ] Когда MERS стал распространенным, считалось, что существующие исследования SARS могут обеспечить полезный шаблон для разработки вакцин и терапии против инфекции MERS-COV. [ 31 ] [ 34 ] По состоянию на март 2020 года была одна (на основе ДНК) вакцина MERS, которая завершила клинические испытания фазы I у людей, [ 35 ] и еще три других, все являются вирусными вакцинами: два аденовирусных вектора (Chadox1-MERS, BVRS-GAMVAC) и один MVA -Vectored (MVA-MERS-S). [ 36 ]
Вакцины, которые используют неактивный или ослабленный вирус, который выращивал в яйцах, обычно занимает более десяти лет. [ 37 ] [ 38 ] Напротив, мРНК - это молекула, которую можно сделать быстро, и исследования мРНК для борьбы с болезнями были начаты за десятилетия до пандемии Covid -19 такими учеными, как Дрю Вайсман и Каталин Карико , которые тестировали на мышах. Moderna начала тестирование на человеческое вакцину против мРНК в 2015 году. [ 37 ] Вирусные векторные вакцины были также разработаны для пандемии Covid -19 после того, как технология была ранее очищена для Эболы. [ 37 ]
Поскольку многочисленные вакцины Covid-19 были разрешены или лицензированы для использования, реальная эффективность вакцины вакцины (RWE) оценивается с использованием контроля случаев и обсервационных исследований. [ 39 ] [ 40 ] Исследование исследует длительную защиту от SARS-COV-2, предоставленной вакцинами против мРНК. [ 41 ] [ 42 ]
Вакцинальные технологии
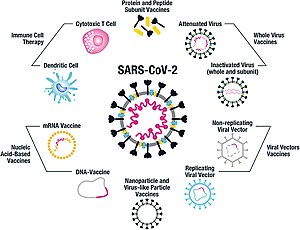
По состоянию на июль 2021 года, по крайней мере, девять различных технологических платформ находились под исследованиями и разработками, чтобы создать эффективную вакцину против Covid -19. [ 44 ] [ 45 ] Большинство платформ кандидатов на вакцинацию в клинических испытаниях сосредоточены на белке коронавируса (белок S) и его вариантах в качестве основного антигена инфекции Covid -19, [ 44 ] Поскольку S-белок запускает сильные B-клеточные и Т-клеточные иммунные ответы. [ 46 ] [ 47 ] Тем не менее, другие белки коронавируса также исследуются для развития вакцины, таких как нуклеокапсид , потому что они также вызывают надежный Т-клеточный ответ, а их гены более консервативны и рекомбинируют реже (по сравнению со Спайком). [ 47 ] [ 48 ] [ 49 ] Будущие поколения вакцин, которые могут нацелиться на более консервативные геномные области, также будут выступать в качестве страхования против проявления катастрофических сценариев, касающихся будущего эволюционного пути SARS-COV-2 или любых подобных эпидемии/пандемии коронавируса. [ 50 ]
Платформы, разработанные в 2020 году, включали нуклеиновых кислот технологии ( модифицированная нуклеозидом РНК и ДНК- мессенджер ), не повторные вирусные векторы , пептиды , рекомбинантные белки , живые вирусы и инактивированные вирусы . [ 24 ] [ 44 ] [ 51 ] [ 52 ]
Многие технологии вакцин, разрабатываемые для Covid-19, не похожи на вакцины против гриппа , а скорее используют стратегии «следующего поколения» для точного нацеливания механизмов инфекции Covid-19. [ 44 ] [ 51 ] [ 52 ] В некоторых из синтетических вакцин используется 2P -мутация, чтобы заблокировать белок Spike в свою конфигурацию, стимулируя адаптивный иммунный ответ на вирус, прежде чем он прикрепляется к клетке человека. [ 53 ] Платформы вакцины в разработке могут повысить гибкость для манипуляций с антигеном и эффективности для механизмов нацеливания инфекции Covid -19 в восприимчивых подгруппах населения, таких как работники здравоохранения, пожилые люди, дети, беременные женщины и люди с ослабленной иммунной системой . [ 44 ] [ 51 ]
вакцины мРНК

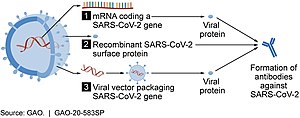
Несколько вакцин Covid -19, такие как вакцины Pfizer -Biontech и Moderna , используют РНК для стимулирования иммунного ответа. При введении в ткани человека вакцина содержит либо самореплицирующуюся РНК, либо РНК-мессенджер (мРНК), что заставляет клетки экспрессировать белок SARS-COV-2 . Это учит организму, как идентифицировать и уничтожить соответствующий патоген. РНК-вакцины часто используют модифицированную нуклеозидом РНК . Доставка , которые мРНК достигается за счет коформы молекулы в наночастицы липидов защищают цепи РНК и помогают их поглощению в клетки. [ 54 ] [ 55 ] [ 56 ] [ 57 ]
РНК -вакцины являются первыми вакцинами Covid -19, которые будут разрешены в Соединенном Королевстве, Соединенных Штатах и Европейском союзе. [ 58 ] [ 59 ] Авторизованные вакцины этого типа включают Pfizer - Biontech
Тяжелые аллергические реакции редки. В декабре 2020 года 1893 360 доз первого введения вакцины Pfizer -Biontech Covid -19 привело к 175 случаям тяжелых аллергических реакций, из которых 21 была анафилаксией . [ 66 ] Для 4041,396 Moderna Covid -19 -й дозы в администрации дозы вакцины в декабре 2020 года и января 2021 года было зарегистрировано только десять случаев анафилаксии. [ 66 ] Липидные наночастицы (LNP), скорее всего, были ответственны за аллергические реакции. [ 66 ]
Аденовирусные векторные вакцины
Эти вакцины являются примерами нереплицирующихся вирусных векторных вакцин с использованием аденовирусной оболочки, содержащей ДНК, которая кодирует белок SARS-COV-2. [ 67 ] [ 68 ] Вирусные вакцины на основе вектора против Covid-19 не повторно, что означает, что они не производят новые частицы вируса, а скорее производят только антиген, который вызывает системный иммунный ответ. [ 67 ]
Уполномоченные вакцины этого типа включают в себя вакцину с Covid -19 Oxford -astrazeneca ,
Convidecia и Janssen-оба вакцины с одним выстрелом, которые предлагают менее сложную логистику и могут храниться под обычным охлаждением в течение нескольких месяцев. [ 75 ] [ 76 ]
Sputnik V использует AD26 для своей первой дозы, которая такая же, как единственная доза Янссена, и AD5 для второй дозы, которая такая же, как только доза Convidecia. [ 77 ]
В августе 2021 года разработчики Sputnik V предложили, с учетом всплеска дела Delta, которые Pfizer проверяют компонент AD26 (называется его «световой» версией) [ 78 ] Как бустерный выстрел. [ 79 ]
Инактивированные вирусные вакцины
Инактивированные вакцины состоят из вирусных частиц, которые выращиваются в культуре , а затем убивают, используя такой метод, как тепло или формальдегид, чтобы потерять способность, производящие заболевание, при этом стимулируя иммунный ответ. [ 80 ]
Инактивированные вирусные вакцины, разрешенные в Китае, включают китайский коронав [ 81 ] [ 82 ] [ 83 ] и Sinopharm bibp
Вакцины субъединиц
Субъединичные вакцины представляют один или несколько антигенов без введения цельных частиц патогена. Антигены часто являются белковыми субъединицами , но они могут быть любым молекулным фрагментом патогена. [ 90 ]
Авторизованные вакцины этого типа включают пептидную вакцину Epivaccorona ,
Вакцина V451 проводилась в клинических испытаниях, которые были прекращены после того, как было обнаружено, что вакцина может потенциально вызвать неправильные результаты для последующего тестирования на ВИЧ.
Вирусные вакцины против частиц
Уполномоченные вакцины этого типа включают вакцину Covid -19 Novavax . [ 19 ] [ 103 ]
Другие типы
Дополнительные виды вакцин, которые находятся в клинических испытаниях, включают в себя множество ДНК -плазмидных вакцин , [ 104 ]
Ученые исследовали, могут ли существующие вакцины для неродственных состояний заполнить иммунную систему и уменьшить тяжесть инфекций Covid -19. [ 113 ] Существуют экспериментальные доказательства того, что вакцина вакцины BCG для туберкулеза оказывает неспецифическое влияние на иммунную систему, но нет никаких доказательств того, что эта вакцина эффективна против Covid-19. [ 114 ]
Список авторизованных вакцин
| Общее название | Тип (технология) | Страна происхождения | Первое разрешение | Примечания |
|---|---|---|---|---|
| Авторизовано в более чем 10 странах и ВОЗ | ||||
| Оксфорд - Оразенека | Аденовирус вектор | Великобритания, Швеция | Декабрь 2020 года | |
| Pfizer - Biontech | РНК | Германия, Соединенные Штаты |
Декабрь 2020 года | Как оригинальные, так и омикронские варианты версии |
| Янссен (Джонсон и Джонсон) | Аденовирус вектор | Соединенные Штаты, Нидерланды |
Февраль 2021 г. | |
| Современный | РНК | Соединенные Штаты | Декабрь 2020 года | Как оригинальные, так и омикронские варианты версии |
| Синофарм Бибп | Инактивировано | Китай | Июль 2020 года | |
| Новавакс | Субъединица / вирусная частица | Соединенные Штаты | Декабрь 2021 года | «Рекомбинантная вакцина против наночастиц» [ 115 ] |
| Коваксин | Инактивировано | Индия | Январь 2021 года | |
| Коронавак | Инактивировано | Китай | Август 2020 | Низкая эффективность в исследованиях репликации и с определенными вариантами |
| Sanofi - GSK | Субъединица | Франция, Великобритания |
Ноябрь 2022 года | На основе бета -варианта |
| Разрешен в более чем 10 странах | ||||
| Sputnik V | Аденовирус вектор | Россия | Август 2020 | |
| Волна | Инактивировано | Франция, Австрия | Апрель 2022 года | |
| Sputnik Light | Аденовирус вектор | Россия | Май 2021 г. | |
| Разрешен в 2–10 странах | ||||
| Приглашен | Аденовирус вектор | Китай | Июнь 2020 года | |
| Sinopharm wibp | Инактивировано | Китай | Февраль 2021 г. | Более низкая эффективность |
| Абдала | Субъединица | Куба | Июль 2021 г. | |
| Epivaccorona |
Субъединица | Россия | Октябрь 2020 года | |
| Зифивакс | Субъединица | Китай | Март 2021 г. | |
| Суверенный 02 | Субъединица | Куба, Иран | Июнь 2021 года | |
| Ковивак | Инактивировано | Россия | Февраль 2021 г. | |
| Медик | Субъединица | Тайвань | Июль 2021 г. | |
| Qazcovid-in | Инактивировано | Казахстан | Апрель 2021 года | |
| Минхай | Инактивировано | Китай | Май 2021 г. | Проведение клинических испытаний |
| Ковиран Боаркат | Инактивировано | Иран | Июнь 2021 года | |
| Sovereign Plus | Субъединица | Куба | Август 2021 | |
| Corbevax |
Субъединица | Индия, США | Декабрь 2021 года | |
| Авторизовано в 1 стране | ||||
| Китайская академия медицинских наук | Инактивировано | Китай | Июнь 2021 года | |
| Zycov-D |
ДНК | Индия | Август 2021 | |
| Fahhravac | Инактивировано | Иран | Сентябрь 2021 г. | |
| Covax-19 | Субъединица | Австралия, Иран | Октябрь 2021 г. | |
| Рази Парс | Субъединица | Иран | Октябрь 2021 г. | |
| Турковац | Инактивировано | Турция | Декабрь 2021 года | |
| Sinopharm Cnbg | Субъединица | Китай | Декабрь 2021 года | На основе оригинальных, бета -версий и каппа вариантов |
| Covlp | Вирусная частица | Канада, Великобритания |
Февраль 2022 года | |
| Нура | Субъединица | Иран | Март 2022 года | |
| Skycovione | Субъединица | Южная Корея | Июнь 2022 года | |
| Walvax | РНК | Китай | Сентябрь 2022 года | В сентябре 2022 года одобрение чрезвычайного использования в Индонезии в сентябре 2022 года |
| интроирование | Аденовирус вектор | Индия | Сентябрь 2022 года | Носовая вакцина |
| V-01 | Субъединица | Китай | Сентябрь 2022 года | |
| Gemcovac | РНК | Индия | Октябрь 2022 года | Самоализация РНК-вакцина |
| Индовак | Субъединица | Индонезия | Октябрь 2022 года | |
| Lunar-Cov19 | РНК | США, Сингапур | Ноябрь 2023 года | Самоализация РНК-вакцина |
Методы доставки
Большинство вакцин против коронавируса вводится в инъекциях, причем дальнейшие методы доставки вакцин изучаются для будущих вакцин вакцин.
Интраназальный
Интраназальные вакцины нацеливаются на иммунитет слизистой оболочки в слизистой оболочке носа , которая является порталом для вирусного въезда в организм. [ 116 ] [ 117 ] Эти вакцины предназначены для стимулирования иммунных факторов назального , таких как IgA . [ 116 ] В дополнение к ингибированию вируса, назальные вакцины обеспечивают простоту введения, поскольку не игл (или игла фобия ). участвует [ 117 ] [ 118 ]
Разнообразные интраназальные вакцины Covid -19 проходят клинические испытания. Первой уполномоченной интраназальной вакциной была Razi COV PARS в Иране в конце октября 2021 года. [ 119 ] Первый вирусный компонент вакцины Sputnik V был уполномочен в России в качестве назала Sputnik в апреле 2022 года. [ 120 ] В сентябре 2022 года Индия и Китай одобрили две на носе вакцины с ковидом ( INCOVACC и Convidecia ), которые могут (как бустеры) [ 121 ] Также уменьшите передачу [ 122 ] [ 123 ] (потенциально через стерилизующий иммунитет). [ 122 ] В декабре 2022 года Китай одобрил вторую интраназальную вакцину в качестве бустера, торгового названия пнеколина . [ 124 ]
Аутологичный
Aivita Biomedical разрабатывает экспериментальный комплект вакцины с ковидом - клетками дендритных клеток , где вакцина готовится и инкубируется в точке медицинской помощи с использованием клеток из предполагаемого реципиента. [ 125 ] Вакцина проходит клинические исследования малой фазы I и II фазы. [ 125 ] [ 126 ] [ 127 ]
Универсальная вакцина
Универсальная вакцина вакцины коронавируса будет эффективной против всех коронавирусов и, возможно, других вирусов. [ 128 ] [ 129 ] Эта концепция была публично одобрена Niaid директором Энтони Фауци , вирологом Джеффри К. Таубенбергером и Дэвидом М. Моренсом. [ 130 ] В марте 2022 года в Белом доме выпустили «Национальный план готовности к национальному циклу», который рекомендовал ускорить развитие универсальной вакцины вакцины для коронавируса. [ 131 ]
Одна попытка такой вакцины разрабатывается в Институте исследований Уолтер Рид . Он использует наночастицу на основе ферритина (SPFN). Эта вакцина начала клиническое испытание на фазе I в апреле 2022 года. [ 132 ] Результаты этого исследования были опубликованы в мае 2024 года. [ 133 ] Другие универсальные вакцины, которые ввели клинические исследования, включают OVX033 (Франция), [ 134 ] Панков (Франция), [ 135 ] Pevac-PS (Великобритания), [ 136 ] и VBI-2902 (Канада). [ 137 ]
Другая стратегия заключается в прикреплении фрагментов вакцины от нескольких штаммов к каркасам наночастиц . Одна теория заключается в том, что более широкий диапазон штаммов может быть вакцинирован путем нацеливания на рецептор-связывающий домен, а не весь белок шипа . [ 138 ]
Формулировка
По состоянию на сентябрь 2020 года [update]Одиннадцать кандидатов на вакцину в клинических разработках используют адъюванты для повышения иммуногенности. [ 44 ] Иммунологический адъювант - это вещество, разработанное с вакциной для повышения иммунного ответа на антиген , такой как вирус Covid -19 или вирус гриппа. [ 139 ] В частности, адъювант может использоваться при формулировании кандидата в вакцину с Covid -19 для повышения его иммуногенности и эффективности для снижения или предотвращения инфекции COVID -19 у людей, вакцинированных. [ 139 ] [ 140 ] Адъюванты, используемые в составах вакцины Covid-19, могут быть особенно эффективными для технологий, использующих инактивированные вирусы Covid-19 и вакцины на основе рекомбинантного белка на основе или вектора. [ 140 ] Алюминиевые соли, известные как « квасцы », были первым адъювантом, используемым для лицензированных вакцин, и являются выбором адъюванта в около 80% адъювантных вакцин. [ 140 ] Адъювант квасцов инициирует различные молекулярные и клеточные механизмы для повышения иммуногенности, включая высвобождение провоспалительных цитокинов. [ 139 ] [ 140 ]
США В июне 2024 года Управление по санитарным и лекарствам (FDA) посоветовало производителям лицензированных и уполномоченных вакцин COVID-19, что вакцины Covid-19 (2024-2025 гг. JN.1 вакцины. [ 141 ]
Планирование и развитие
С января 2020 года развитие вакцин была ускорена благодаря беспрецедентному сотрудничеству в многонациональной фармацевтической промышленности и между правительствами. [ 44 ]
Оцениваются несколько шагов по всему пути разработки, в том числе: [ 24 ] [ 142 ]
- уровень приемлемой токсичности вакцины (ее безопасность),
- нацеливание уязвимых групп населения,
- необходимость в прорывах эффективности вакцины,
- продолжительность защиты от вакцинации,
- Специальные системы доставки (такие как пероральный или носовой, а не инъекция),
- режим дозы,
- стабильность и характеристики хранения,
- разрешение на чрезвычайное использование перед официальным лицензированием,
- оптимальное производство для масштабирования до миллиардов доз и
- Распространение лицензированной вакцины.
Проблемы
Было несколько уникальных проблем с развитием вакцины Covid -19.
Программы общественного здравоохранения [ ВОЗ? ] были описаны как «[А] раса для вакцинированных людей» с вакцинами ранней волны. [ 143 ]
Сроки для проведения клинических исследований - обычно последовательный процесс, требующий лет - сжимаются в испытаниях безопасности, эффективности и дозирования, работающих одновременно в течение нескольких месяцев, что потенциально ставит под угрозу обеспечение безопасности. [ 144 ] [ 145 ] Например, разработчики китайских вакцин и Китайский центр по контролю и профилактике заболеваний начали свои усилия в январе 2020 года, [ 146 ] и к марту они преследовали многочисленных кандидатов на короткие сроки. [ 144 ] [ 147 ]
Ожидалось, что быстрое развитие и срочность производства вакцины для пандемии Covid -19, которые увеличат риски и частоту неудач в обеспечении безопасной, эффективной вакцины. [ 51 ] [ 52 ] [ 148 ] Кроме того, исследования в университетах препятствуют физическому дистанцированию и закрытию лабораторий. [ 149 ] [ 150 ]
Вакцины должны проходить через несколько фаз клинических испытаний для проверки безопасности, иммуногенности , эффективности, уровней дозы и побочных эффектов вакцины кандидата. [ 151 ] [ 152 ] Разработчики вакцины должны инвестировать ресурсы на международном уровне, чтобы найти достаточно участников для клинических испытаний II -III фазы, когда вирус оказался « движущейся целью » изменения скорости передачи в странах и внутри, заставляя компании конкурировать за участников испытания. [ 153 ]
Организаторы клинических испытаний также могут встретить людей, не желающих вакцинировать из -за нерешительности вакцины [ 154 ] или неверие в науку о технологии вакцины и ее способности предотвратить инфекцию. [ 155 ] Поскольку новые вакцины разрабатываются во время пандемии Covid -19 [ ВОЗ? ] Требуется представление полного досье информации о качеством разработки и производства. [ 156 ] [ 157 ] [ 158 ]
Организации
На международном уровне доступ к инструментам COVID -199 Accelerator - это инициатива G20 и Всемирная организация здравоохранения (ВОЗ), объявленная в апреле 2020 года. [ 159 ] [ 160 ] Это структура поддержки междисциплина, позволяющая партнерам делиться ресурсами и знаниями. Он состоит из четырех столбов, каждый из которых управляется двумя -тремя партнерами по сотрудничеству: вакцины (также называемые « Covax »), диагностика, терапевтические и соединительные системы здравоохранения. [ 161 ] ВОЗ апреля 2020 года «НИОКР И НИОКР (для) романа Коронавируса» задокументировал «большую, международную многосайтовую, индивидуально рандомизированную контролируемое клиническое исследование», чтобы позволить «одновременной оценке преимуществ и рисков каждой многообещающей кандидатской вакцины в пределах 3– 6 месяцев, как это было доступно для испытания ». Коалиция вакцины ВОЗ будет расставлять приоритеты, какие вакцины должны проходить в клинические испытания фазы II и III и определять гармонизированные протоколы фазы III для всех вакцин, достигающих ключевой стадии испытания . [ 162 ]
Национальные правительства также участвовали в развитии вакцин. Канада объявила о финансировании 96 проектов по разработке и производству вакцин в канадских компаниях и университетах с планами создания «банка вакцин», который может быть использован, если произойдет другая вспышка коронавируса, [ 163 ] Поддерживать клинические испытания и разработать цепочки производства и поставок для вакцин. [ 164 ]
Китай предоставил низкокачественные кредиты одному разработчику вакцины через свой центральный банк и «быстро сделала землю для компании» для строительства производственных предприятий. [ 145 ] Три китайские вакцинные компании и исследовательские институты поддерживаются правительством для финансирования исследований, проведения клинических испытаний и производства. [ 165 ]
по вакцинам Covid -19 В апреле 2020 года правительство Соединенного Королевства сформировало целевую группу для стимулирования местных усилий по ускоренному развитию вакцины посредством сотрудничества между отраслями, университетами и государственными учреждениями. Великобритании В вакцинации вакцины способствовала каждой фазы разработки, от исследований до производства. [ 166 ]
В Соединенных Штатах Биомедицинское управление по исследованиям и разработкам (BARDA), федеральное агентство, финансирующее технологию борьбы с заболеваниями, объявило о инвестициях в поддержку развития вакцин-вакцины американского COVID-19 и производства наиболее перспективных кандидатов. [ 145 ] [ 167 ] В мае 2020 года правительство объявило о финансировании программы быстрого трека под названием «Скорость Warp» . [ 168 ] [ 169 ] К марту 2021 года Барда профинансировала примерно 19,3 млрд. Долл. США в области развития вакцин. [ 170 ]
Крупные фармацевтические компании с опытом создания вакцин в масштабе, включая Johnson & Johnson , Astrazeneca и Glaxosmithkline (GSK), создали альянсы с биотехнологическими компаниями, правительствами и университетами, чтобы ускорить прогресс в направлении эффективных вакцин. [ 145 ] [ 144 ]
Клинические исследования
Клинические исследования COVID-19 Клинические исследования используют клинические исследования для установления характеристик вакцин COVID-19. Эти характеристики включают эффективность , эффективность и безопасность. С ноября 2022 года [update], 40 вакцин разрешены по крайней мере одним национальным регулирующим органом для общественного пользования: [ 171 ] [ 172 ]
По состоянию на июнь 2022 года [update], 353 кандидаты на вакцину находятся на различных стадиях развития, с 135 в клинических исследованиях , в том числе 38 в исследованиях I фазы , 32 в исследованиях I - II , 39 в исследованиях III фазы и 9 в разработке фазы IV . [ 171 ]Осложнения после вакцинации
Пост вакцинационные эмболические и тромботические события, называемые иммунной тромбоцитопении, вызванной вакциной, иммунной тромбоцитопении (VITT), [ 173 ] [ 174 ] [ 175 ] [ 176 ] [ 177 ] Индуцированная вакциной протромботическая иммунная тромбоцитопения (VIPIT), [ 178 ] тромбоз с синдромом тромбоцитопении (TTS), [ 179 ] [ 176 ] [ 177 ] индуцированная вакцинами иммунная тромбоцитопения и тромбоз (VITT), [ 177 ] или ассоциированная с вакциной тромбоцитопении (VATT), [ 177 ] Редкие типы синдромов свертывания крови , которые первоначально наблюдались у ряда людей, которые ранее получали вакцину с Covid -19 Oxford -astrazeneca (AZD1222) [ А ] Во время ковида -19 пандемии . [ 178 ] [ 184 ] Впоследствии он также был описан в вакцине Janssen Covid -19 (Johnson & Johnson), что привело к приостановлению его использования до тех пор, пока ее безопасность не была переоценена. [ 185 ] 5 мая 2022 года FDA опубликовала бюллетень, ограничивающий использование вакцины вакцины Janssen в очень специфических случаях из -за дальнейшей переоценки рисков TT, хотя FDA также заявил в том же бюллетене, что преимущества вакцины перевешивают риски. [ 186 ]
В апреле 2021 года Astrazeneca и Европейское агентство по лекарственным средствам (EMA) обновили свою информацию для медицинских работников о AZD1222, заявив, что «считается правдоподобным», что существует причинно -следственная связь между вакцинацией и возникновением тромбоза в комбинации с тромбоцитопением и тем, что, что, что, что, что, что, что, что, что, что, что, что, что, что, что, что, что, что, что, что «Хотя такие побочные реакции очень редки, они превысили то, что можно ожидать в общей популяции». [ 184 ] [ 187 ] [ 188 ] [ 189 ] Astrazeneca первоначально отрицал ссылку, сказав: «Мы не согласны с тем, что TTS вызван вакциной на общем уровне». Однако в юридических документах, поданных в феврале 2024 года, Astrazeneca, наконец, признала свою вакцину, «в очень редких случаях вызвать TTS». [ 190 ] [ 191 ]История

SARS-COV-2 (тяжелый острый респираторный синдром Coronavirus 2), вирус, который вызывает Covid-19 , был выделен в конце 2019 года. [ 192 ] Его генетическая последовательность была опубликована 11 января 2020 года, что вызвало срочный международный ответ на подготовку к вспышке и ускорить разработку профилактической вакцины Covid-19. [ 193 ] [ 194 ] [ 195 ] С 2020 года развитие вакцины была ускорена благодаря беспрецедентному сотрудничеству в многонациональной фармацевтической промышленности и между правительствами. [ 196 ] К июню 2020 года корпорации, правительства, международные организации здравоохранения и университетские исследовательские группы инвестировали десятки миллиардов долларов для разработки десятков кандидатов на вакцину и подготовки к глобальным программам вакцинации для иммунизации против инфекции Covid -19. [ 194 ] [ 197 ] [ 198 ] [ 199 ] Согласно Коалиции по инновациям в области готовности к эпидемии (CEPI), географическое распределение развития вакцин -вакцины Covid -19 показывает, что североамериканские организации имеют около 40% деятельности по сравнению с 30% в Азии и Австралии, 26% в Европе и Немногие проекты в Южной Америке и Африке. [ 193 ] [ 196 ]
В феврале 2020 года Всемирная организация здравоохранения (ВОЗ) заявила, что не ожидала, что вакцина против SARS -COV -2 станет доступной менее чем за 18 месяцев. [ 200 ] Вирулог Пол Офит прокомментировал, что в задним численности развитие безопасной и эффективной вакцины в течение 11 месяцев стало замечательным подвигом. [ 201 ] Быстро растущий уровень инфекции в COVID -19 во всем мире в течение 2020 года стимулировал международные альянсы и усилия правительства по срочному организации ресурсов для создания нескольких вакцин по сокращенным срокам, [ 202 ] с четырьмя кандидатами на вакцину, которые проводят оценку человека в марте (см. Ковид-19 вакцина § Суд над судебным процессом и статусом разрешения ). [ 193 ] [ 203 ]
24 июня 2020 года Китай одобрил вакцину Cansino для ограниченного использования в военных и две инактивированные вирусные вакцины для чрезвычайного использования в профессиях высокого риска. [ 204 ] 11 августа 2020 года Россия объявила о одобрении своей вакцины Vputnik V для чрезвычайного использования, хотя через месяц только небольшие количества вакцины были распределены для использования за пределами испытания фазы 3. [ 205 ]
Партнерство Pfizer -Biontech представило запрос на чрезвычайное использование (EUA) в Управление по контролю за продуктами и лекарствами США (FDA) для вакцины вакцины MRNA BNT162B2 (активный ингредиент Tozinameran ) 20 ноября 2020 года. [ 206 ] [ 207 ] в Соединенном Королевстве 2 декабря 2020 года регулирующее агентство по лекарствам и продуктам здравоохранения (MHRA) дало временное одобрение регулирующих органов для вакцины Pfizer -Biontech , [ 208 ] [ 209 ] Стать первой страной, которая одобряет вакцину и первую страну в западном мире , которая одобрит использование любой вакцины в Covid -19. [ 210 ] [ 211 ] [ 212 ] По состоянию на 21 декабря 2020 года многие страны и Европейский союз [ 213 ] уполномочил или одобрил вакцину Covid -19 Pfizer -Biontech. Бахрейн и Объединенные Арабские Эмираты предоставили разрешение на аварийный маркетинг для вакцины Sinopharm BIBP . [ 214 ] [ 215 ] 11 декабря 2020 года FDA предоставило США для вакцины Pfizer - Bibintech - 19. [ 216 ] Неделю спустя они предоставили EUA для мРНК-1273 (активный ингредиент Elasomeran ), вакцину Moderna. [ 217 ] [ 218 ] [ 219 ] [ 220 ]
31 марта 2021 года российское правительство объявило, что зарегистрировало первую вакцину в Covid -19 для животных. [ 221 ] Названный Carnivac-Cov , это инактивированная вакцина для плотоядных животных, включая домашних животных, направленную на предотвращение мутаций, которые происходят во время межвидовой передачи SARS-Cov-2. [ 222 ]
В октябре 2022 года Китай начал вводить пероральную вакцину, разработанную Cansino Biologics, с использованием его аденовирусной модели. [ 223 ]
Несмотря на наличие мРНК и вирусных векторных вакцин , всемирное капитал вакцин не было достигнуто. постоянная разработка и использование цельных инактивированных вирусов (WIV) и белковых Было рекомендовано, что вакцин, особенно для использования в развивающихся странах , ослабить дальнейшие волны пандемии. [ 224 ] [ 225 ]были выпущены полные нуклеотидные последовательности вакцин Astrazeneca и Pfizer/ препаратах В ноябре 2021 года в Великобритании и медицинских Biontech . [ 226 ] [ 227 ]
Эффективность

Доказательства использования вакцины во время пандемии показывают, что вакцинация может снизить инфекцию и наиболее эффективно предотвращает тяжелые симптомы и смерть в COVID-19, но менее хороши в предотвращении мягкого Covid-19. Эффективность со временем уменьшается, но может быть поддержана с помощью бустеров. [ 229 ] В 2021 году CDC сообщил, что невакцинированные люди в 10 раз чаще будут госпитализированы и в 11 раз чаще умирают, чем полностью вакцинированные люди. [ 230 ] [ 231 ]
CDC сообщил, что эффективность вакцины снизилась с 91% против альфа до 66% против Delta. [ 232 ] Один эксперт заявил, что «те, кто заражен после вакцинации, все еще не заболели и не умирают, как происходили до вакцинации». [ 233 ] К концу августа 2021 года на вариант Delta приходился 99 процентов случаев США, и было обнаружено, что он удвоил риск тяжелых заболеваний и госпитализации для тех, кто еще не вакцинирован. [ 234 ]
В ноябре 2021 года исследование, проведенное ECDC, показало, что 470 000 жизней старше 60 лет было спасено с момента начала развертывания вакцинации в Европейском регионе. [ 235 ]
10 декабря 2021 года Агентство по охране здоровья Великобритании сообщило, что ранние данные указывают на снижение нейтрализации в 20-40 раз для омикрона с помощью сыворотки от 2-доз вакцинов Pfizer по сравнению с более ранними штаммами. После бустерной дозы (обычно с вакциной мРНК), [ 236 ] Эффективность вакцины против симптоматического заболевания составляла 70–75% , а эффективность против тяжелого заболевания будет выше. [ 237 ]
Согласно данным CDC в начале декабря 2021 года, «неваничные взрослые были примерно в 97 раз чаще умирать от Covid-19, чем полностью вакцинированные люди, которые получали бустеры». [ 238 ]
Метаанализ, изучающий различия в вакцинах в вакцинах Covid-19 у людей с иммуносупрессией, обнаружил, что люди с ослабленной иммунной системой менее способны производить нейтрализующие антитела. Например, получателям трансплантации органов требуется три вакцины для достижения сероконверсии . [ 239 ] Исследование серологического ответа на вакцины мРНК у пациентов с лимфомой, лейкозом и миеломой показало, что четверка пациентов не производила измеримые антитела, различающиеся по типу рака. [ 240 ]
В феврале 2023 года систематический обзор в Лансете сказал, что защита, обеспечиваемая инфекцией, была сопоставимой с защитой от вакцинации, хотя и с повышенным риском тяжелых заболеваний и смерти от заболевания первоначальной инфекции. [ 241 ]
Исследование, проведенное CDC в январе 2024 года, показало, что оставаться в курсе вакцин может снизить риск инсультов, сгустков крови и сердечных приступов, связанных с Covid-19 у людей в возрасте 65 лет и старше или с условием, которое делает их более уязвимыми для сказанные условия. [ 242 ] [ 243 ]Анализ с участием более 20 миллионов взрослых показал, что у вакцинированных людей был более низкий риск длительного проковида по сравнению с теми, у кого не было вакцины Covid-19. [ 244 ] [ 245 ]
Продолжительность иммунитета
По состоянию на 2021 год имеющиеся данные показывают, что полностью вакцинированные люди и ранее зараженные SARS-COV-2 имеют низкий риск последующей инфекции в течение не менее шести месяцев. [ 246 ] [ 247 ] [ 248 ] Недостаточно данных для определения порога титра антител, который указывает, когда человек защищен от инфекции. [ 246 ] Многочисленные исследования показывают, что титры антител связаны с защитой на уровне населения, но индивидуальные титры защиты остаются неизвестными. [ 246 ] Для некоторых групп населения, таких как пожилые люди и иммунокомпромизированные , уровни защиты могут быть снижены как после вакцинации, так и после инфекции. [ 246 ] Доступные данные указывают на то, что уровень защиты может не быть одинаковым для всех вариантов вируса . [ 246 ]
По состоянию на декабрь 2021 года не существует FDA-авторизованных или утвержденных испытаний, которые поставщики или общественность могут использовать, чтобы определить, защищено ли лицо от инфекции надежно. [ 246 ]
По состоянию на март 2022 года защита пожилых жителей от тяжелых заболеваний, госпитализации и смерти в домах по уходу за английским языком была высокой сразу после вакцинации, но защита значительно снизилась в течение месяцев после вакцинации. [ 249 ] Защита среди сотрудников по уходу на дому, которые были моложе, снизилась намного медленнее. [ 249 ] Рекомендуются регулярные бустеры для пожилых людей, а бустеры для жителей дома каждые шесть месяцев кажутся разумными. [ 249 ]
США Центры по контролю и профилактике заболеваний (CDC) рекомендует четвертую дозу вакцины против мРНК Pfizer по состоянию на март 2022 г. [update] Для «определенных людей с ослабленным иммунитетом и людей старше 50 лет». [ 250 ] [ 251 ]
Иммунное уклонение от вариантов
В отличие от других исследованных предыдущих вариантов, вариант SARS-COV-2 Omicron [ 252 ] [ 253 ] [ 254 ] [ 255 ] [ 256 ] и его Ba.4/5 Subvarariants [ 257 ] уклонялись от иммунитета, вызванного вакцинами, что может привести к прорывным инфекциям, несмотря на недавнюю вакцинацию. Тем не менее, считается, что вакцины обеспечивают защиту от тяжелых заболеваний, госпитализаций и смертей из -за Омикрона. [ 258 ]
Корректировки вакцины
В июне 2022 года Pfizer и Moderna разработали двойные вакцины для защиты от SARS-COV-2 дикого типа и варианта Omicron. Двухвалентные вакцины хорошо переносятся и обеспечивают иммунитет Omicron, превосходящим предыдущие вакцины мРНК. [ 259 ] США В сентябре 2022 года Управление по контролю за продуктами и лекарствами (FDA) уполномочило двувалентные вакцины. [ 260 ] [ 261 ] [ 262 ]
В июне 2023 года FDA посоветовало производителям, что формулировка вакцин вакцин COVID -19 2023–2024 гг. Для использования в США будет обновлена как моновалентная вакцина COVID -19 с использованием линии xbb.1.5 оливного варианта. [ 263 ] [ 264 ] В июне 2024 года FDA посоветовало производителям, что составление вакцин вакцин Covid -19 2024–2025 гг. Для использования в США будет обновлена как моновалентная вакцина Covid -19 с использованием линии JN.1. [ 265 ]Эффективность против передачи
По состоянию на 2022 год, полностью вакцинированные люди с прорывными инфекциями с вариантом дельты SARS-COV-2 (B.1.617.2) имеют пиковую вирусную нагрузку, аналогичную невакцинированной случаях и могут передавать инфекцию в условиях домашних хозяйств. [ 266 ]
Смешать и сочетать
Согласно исследованиям, комбинация двух различных вакцин Covid-19, также называемая гетерологичной вакцинацией , перекрестной вакцинацией или методом смеси и матча, обеспечивает защиту, эквивалентную компоненту мРНК, включая защиту от дельта-варианта . Люди, которые получают комбинацию двух разных вакцин, вызывают сильные иммунные ответы, при этом побочные эффекты не хуже, чем те, которые вызваны стандартными схемами. [ 267 ] [ 268 ]
Неблагоприятные события
Для большинства людей побочные эффекты, также называемые побочными эффектами , от вакцинов Covid -19, являются мягкими и могут управляться дома. Побочные эффекты вакцинации Covid -19 аналогичны эффектам других вакцин, а тяжелые побочные эффекты встречаются редко. [ 269 ] [ 270 ] Побочные эффекты от вакцины выше, чем плацебо, но плацебо вооружений в испытаниях вакцин по -прежнему сообщают о побочных эффектах, которые можно объяснить эффектом Носебо . [ 271 ]
Все вакцины, которые вводится через внутримышечную инъекцию , включая вакцины с Covid -19, имеют побочные эффекты, связанные с легкой травмой, связанной с процедурой, и внедрением инородного вещества в организм. [ 272 ] К ним относятся болезненность, покраснение, сыпь и воспаление в месте инъекции. Другие общие побочные эффекты включают усталость, головную боль, миалгию (мышечную боль) и артралгию (боль в суставах), которые обычно разрешаются без лечения в течение нескольких дней. [ 13 ] [ 14 ] Как и любая другая вакцина, у некоторых людей аллергия на один или несколько ингредиентов в вакцинах Covid -19. Типичные побочные эффекты более сильнее и чаще встречаются у молодых людей и в последующих дозах, и до 20% людей сообщают о разрушительном уровне побочных эффектов после второй дозы вакцины против мРНК. [ 273 ] Эти побочные эффекты менее распространены или слабее в инактивированных вакцинах . [ 273 ] Связанное с COVID-19, связанное с вакцинацией лимфатических узлов , происходит у 11,6% из тех, кто получил одну дозу вакцины, и у 16% из тех, кто получил две дозы. [ 274 ]
Эксперименты на мышах показывают, что внутримышечные инъекции наночастиц липидного наполнения (неактивного вещества, которое служит носителем или средой), приводят к тому, что частицы попадают в плазму крови и многие органы, причем более высокие концентрации обнаружены в печени и более низких концентрациях в селезенке, надпочечниках. и яичники. Самая высокая концентрация наночастиц была обнаружена в самом месте инъекции. [ 275 ]
Вакцинация COVID -19 безопасна для грудного вскармливания людей. [ 15 ] временных изменениях в менструальном цикле Сообщалось о у молодых женщин. Тем не менее, эти изменения «небольшие по сравнению с естественными изменениями и быстро обращаются». [276] In one study, women who received both doses of a two-dose vaccine during the same menstrual cycle (an atypical situation) may see their next period begin a couple of days late. They have about twice the usual risk of a clinically significant delay (about 10% of these women, compared to about 4% of unvaccinated women).[276] Cycle lengths return to normal after two menstrual cycles post-vaccination.[276] Women who received doses in separate cycles had approximately the same natural variation in cycle lengths as unvaccinated women.[276] Other temporary menstrual effects have been reported, such as heavier than normal menstrual bleeding after vaccination.[276]
Serious adverse events associated COVID‑19 vaccines are generally rare but of high interest to the public.[277] The official databases of reported adverse events include
- the World Health Organization's VigiBase;
- the United States Vaccine Adverse Events Reporting System (VAERS);
- the United Kingdom's Yellow Card Scheme;
- the European Medicines Agency's EudraVigilance system, which operates a regular transfer of data on suspected adverse drug reactions occurring in the EU to WHO's Uppsala Monitoring Centre.[278]
Increased public awareness of these reporting systems and the extra reporting requirements under US FDA Emergency Use Authorization rules have increased reported adverse events.[279] Serious side effects are an ongoing area of study, and resources have been allocated to try to better understand them.[280][281][282] Research currently indicates that the rate and type of side effects are lower-risk than infection. For example, although vaccination may trigger some side effects, the effects experienced from an infection could be worse. Neurological side effects from getting COVID‑19 are hundreds of times more likely than from vaccination.[283]
Documented rare serious effects include:
- anaphylaxis, a severe type of allergic reaction.[284] Anaphylaxis affects one person per 250,000 to 400,000 doses administered.[273][285]
- blood clots (thrombosis).[284] These vaccine-induced immune thrombocytopenia and thrombosis are associated with vaccines using an adenovirus system (Janssen and Oxford-AstraZeneca).[284] These affect about one person per 100,000.[273]
- myocarditis and pericarditis, or inflammation of the heart.[284] There is a rare risk of myocarditis (inflammation of the heart muscle) or pericarditis (inflammation of the membrane covering the heart) after the mRNA COVID‑19 vaccines (Moderna or Pfizer-BioNTech). The risk of myocarditis after COVID‑19 vaccination is estimated to be 0.3 to 5 cases per 100,000 persons, with the highest risk in young males.[286] In an Israeli nation-wide population-based study (in which the Pfizer-BioNTech vaccine was exclusively given), the incidence rate of myocarditis was 54 cases out of 2.5 million vaccine recipients, with an overall incidence rate of 2 cases per 100,000 persons, with the highest incidence seen in young males (aged 16 to 29) at 10 cases per 100,000 vaccine recipients. Of the cases of myocarditis seen, 76% were mild in severity, with one case of cardiogenic shock (heart failure) and one death (in a person with a preexisting heart condition) reported within the 83-day follow-up period.[287] COVID‑19 vaccines may protect against myocarditis due to subsequent COVID‑19 infection.[288] The risk of myocarditis and pericarditis is significantly higher (up to 11 times higher with respect to myocarditis) after COVID‑19 infection as compared to COVID‑19 vaccination, with the possible exception of younger men (less than 40 years old) who may have a higher risk of myocarditis after the second Moderna mRNA vaccine (an additional 97 cases of myocarditis per 1 million persons vaccinated).[288]
- thrombotic thrombocytopenia and other autoimmune diseases, which have been reported as adverse events after the COVID‑19 vaccine.[289]
There are rare reports of subjective hearing changes, including tinnitus, after vaccination.[285][290][291][292]
Society and culture
Distribution
Note about the table in this section: number and percentage of people who have received at least one dose of a COVID‑19 vaccine (unless noted otherwise). May include vaccination of non-citizens, which can push totals beyond 100% of the local population. The table is updated daily by a bot.[note 2]
| Location | Vaccinated[b] | Percent[c] | |
|---|---|---|---|
| World[d][e] | 5,645,247,500 | 70.70% | |
| China[f] | 1,318,026,800 | 92.48% | |
| India | 1,027,438,900 | 72.08% | |
| European Union[g] | 338,481,060 | 75.43% | |
| United States[h] | 270,227,170 | 79.12% | |
| Indonesia | 204,419,400 | 73.31% | |
| Brazil | 189,643,420 | 90.17% | |
| Pakistan | 165,567,890 | 67.94% | |
| Bangladesh | 151,507,170 | 89.45% | |
| Japan | 104,740,060 | 83.79% | |
| Mexico | 97,179,496 | 75.56% | |
| Nigeria | 93,829,430 | 42.05% | |
| Vietnam | 90,497,670 | 90.79% | |
| Russia | 89,081,600 | 61.19% | |
| Philippines | 82,684,776 | 72.55% | |
| Iran | 65,199,830 | 72.83% | |
| Germany | 64,876,300 | 77.15% | |
| Turkey | 57,941,052 | 66.55% | |
| Thailand | 57,005,496 | 79.47% | |
| Egypt | 56,907,320 | 50.53% | |
| France | 54,677,680 | 82.50% | |
| United Kingdom | 53,806,964 | 78.92% | |
| Ethiopia | 52,489,510 | 41.86% | |
| Italy[i] | 50,936,720 | 85.44% | |
| South Korea | 44,764,956 | 86.45% | |
| Colombia | 43,012,176 | 83.13% | |
| Myanmar | 41,551,930 | 77.30% | |
| Argentina | 41,529,056 | 91.46% | |
| Spain | 41,351,230 | 86.46% | |
| Canada | 34,742,936 | 89.49% | |
| Tanzania | 34,434,932 | 53.21% | |
| Peru | 30,563,708 | 91.30% | |
| Malaysia | 28,138,564 | 81.10% | |
| Nepal | 27,883,196 | 93.83% | |
| Saudi Arabia | 27,041,364 | 84.04% | |
| Morocco | 25,020,168 | 67.03% | |
| South Africa | 24,210,952 | 38.81% | |
| Poland | 22,984,544 | 59.88% | |
| Mozambique | 22,869,646 | 70.03% | |
| Australia | 22,231,734 | 84.85% | |
| Venezuela | 22,157,232 | 78.54% | |
| Uzbekistan | 22,094,470 | 63.24% | |
| Taiwan | 21,899,240 | 93.51% | |
| Uganda | 20,033,188 | 42.34% | |
| Afghanistan | 19,151,368 | 47.20% | |
| Chile | 18,088,516 | 92.51% | |
| Sri Lanka | 17,143,760 | 75.08% | |
| Democratic Republic of the Congo | 17,045,720 | 16.65% | |
| Angola | 16,550,642 | 46.44% | |
| Ukraine | 16,267,198 | 39.63% | |
| Ecuador | 15,345,791 | 86.10% | |
| Cambodia | 15,316,670 | 89.04% | |
| Sudan | 15,207,452 | 30.79% | |
| Kenya | 14,494,372 | 26.72% | |
| Ghana | 13,864,186 | 41.82% | |
| Ivory Coast | 13,568,372 | 44.64% | |
| Netherlands | 12,582,081 | 70.27% | |
| Zambia | 11,711,565 | 58.11% | |
| Iraq | 11,332,925 | 25.72% | |
| Rwanda | 10,884,714 | 79.74% | |
| Kazakhstan | 10,858,101 | 54.20% | |
| Cuba | 10,805,570 | 97.70% | |
| United Arab Emirates | 9,991,089 | 97.55% | |
| Portugal | 9,821,414 | 94.28% | |
| Belgium | 9,261,641 | 79.55% | |
| Somalia | 8,972,167 | 50.40% | |
| Guatemala | 8,937,923 | 50.08% | |
| Tunisia | 8,896,848 | 73.41% | |
| Guinea | 8,715,641 | 62.01% | |
| Greece | 7,938,031 | 76.24% | |
| Algeria | 7,840,131 | 17.24% | |
| Sweden | 7,775,726 | 74.14% | |
| Zimbabwe | 7,525,882 | 46.83% | |
| Dominican Republic | 7,367,193 | 65.60% | |
| Bolivia | 7,361,008 | 60.95% | |
| Israel | 7,055,466 | 77.51% | |
| Czech Republic | 6,982,006 | 65.42% | |
| Hong Kong | 6,920,057 | 92.69% | |
| Austria | 6,899,873 | 76.12% | |
| Honduras | 6,596,213 | 63.04% | |
| Belarus | 6,536,392 | 71.25% | |
| Hungary | 6,420,354 | 66.30% | |
| Nicaragua | 6,404,524 | 95.15% | |
| Niger | 6,248,483 | 24.69% | |
| Switzerland | 6,096,911 | 69.34% | |
| Burkina Faso | 6,089,089 | 27.05% | |
| Laos | 5,888,649 | 77.90% | |
| Sierra Leone | 5,676,123 | 68.58% | |
| Romania | 5,474,507 | 28.56% | |
| Malawi | 5,433,538 | 26.42% | |
| Azerbaijan | 5,373,253 | 52.19% | |
| Tajikistan | 5,328,277 | 52.33% | |
| Singapore | 5,287,005 | 93.58% | |
| Chad | 5,147,667 | 27.89% | |
| Jordan | 4,821,579 | 42.83% | |
| Denmark | 4,746,522 | 80.41% | |
| El Salvador | 4,659,970 | 74.20% | |
| Costa Rica | 4,650,636 | 91.52% | |
| Turkmenistan | 4,614,869 | 63.83% | |
| Finland | 4,524,288 | 81.24% | |
| Mali | 4,354,292 | 18.87% | |
| Norway | 4,346,995 | 79.66% | |
| South Sudan | 4,315,127 | 39.15% | |
| New Zealand | 4,302,330 | 83.84% | |
| Republic of Ireland | 4,112,237 | 80.47% | |
| Paraguay | 3,995,915 | 59.11% | |
| Liberia | 3,903,802 | 72.65% | |
| Cameroon | 3,753,733 | 13.58% | |
| Panama | 3,746,041 | 85.12% | |
| Benin | 3,697,190 | 26.87% | |
| Kuwait | 3,457,498 | 75.33% | |
| Serbia | 3,354,075 | 49.39% | |
| Syria | 3,295,630 | 14.67% | |
| Oman | 3,279,632 | 69.33% | |
| Uruguay | 3,010,464 | 88.78% | |
| Qatar | 2,852,178 | 98.61% | |
| Slovakia | 2,840,017 | 51.89% | |
| Lebanon | 2,740,227 | 47.70% | |
| Madagascar | 2,710,365 | 8.90% | |
| Senegal | 2,684,696 | 15.21% | |
| Central African Republic | 2,600,389 | 51.01% | |
| Croatia | 2,323,025 | 59.46% | |
| Libya | 2,316,327 | 32.07% | |
| Mongolia | 2,284,018 | 67.45% | |
| Togo | 2,255,579 | 24.81% | |
| Bulgaria | 2,155,863 | 31.58% | |
| Mauritania | 2,103,754 | 43.15% | |
| Palestine | 2,012,767 | 37.94% | |
| Lithuania | 1,958,299 | 69.52% | |
| Botswana | 1,951,054 | 79.96% | |
| Kyrgyzstan | 1,736,541 | 24.97% | |
| Georgia | 1,654,504 | 43.60% | |
| Albania | 1,349,255 | 47.72% | |
| Latvia | 1,346,184 | 71.57% | |
| Slovenia | 1,265,802 | 59.84% | |
| Bahrain | 1,241,174 | 80.94% | |
| Armenia | 1,150,915 | 39.95% | |
| Mauritius | 1,123,773 | 88.06% | |
| Moldova | 1,109,524 | 36.50% | |
| Yemen | 1,050,202 | 2.75% | |
| Lesotho | 1,014,073 | 44.36% | |
| Bosnia and Herzegovina | 943,394 | 29.44% | |
| Kosovo | 906,858 | 52.79% | |
| Timor-Leste | 886,838 | 64.77% | |
| Estonia | 870,202 | 64.46% | |
| Jamaica | 859,773 | 30.28% | |
| North Macedonia | 854,570 | 46.44% | |
| Trinidad and Tobago | 754,399 | 50.43% | |
| Guinea-Bissau | 747,057 | 35.48% | |
| Fiji | 712,025 | 77.44% | |
| Bhutan | 699,116 | 89.52% | |
| Republic of the Congo | 695,760 | 11.53% | |
| Macau | 679,703 | 96.50% | |
| Gambia | 674,314 | 25.58% | |
| Cyprus | 671,193 | 71.37% | |
| Namibia | 629,767 | 21.79% | |
| Eswatini | 526,050 | 43.16% | |
| Haiti | 521,396 | 4.53% | |
| Guyana | 497,550 | 60.56% | |
| Luxembourg | 481,957 | 73.77% | |
| Malta | 478,953 | 90.68% | |
| Brunei | 451,149 | 99.07% | |
| Comoros | 438,825 | 52.60% | |
| Djibouti | 421,573 | 37.07% | |
| Maldives | 399,308 | 76.19% | |
| Papua New Guinea | 382,020 | 3.74% | |
| Cabo Verde | 356,734 | 68.64% | |
| Solomon Islands | 343,821 | 44.02% | |
| Gabon | 311,244 | 12.80% | |
| Iceland | 309,770 | 81.44% | |
| Northern Cyprus | 301,673 | 78.80% | |
| Montenegro | 292,783 | 47.63% | |
| Equatorial Guinea | 270,109 | 14.98% | |
| Suriname | 267,820 | 42.98% | |
| Belize | 258,473 | 64.18% | |
| New Caledonia | 192,375 | 67.00% | |
| Samoa | 191,403 | 88.91% | |
| French Polynesia | 190,908 | 68.09% | |
| Vanuatu | 176,624 | 56.42% | |
| Bahamas | 174,810 | 43.97% | |
| Barbados | 163,853 | 58.04% | |
| Sao Tome and Principe | 140,256 | 61.97% | |
| Curaçao | 108,601 | 58.59% | |
| Kiribati | 100,900 | 77.33% | |
| Aruba | 90,546 | 84.00% | |
| Seychelles | 88,520 | 70.52% | |
| Tonga | 87,375 | 83.17% | |
| Jersey | 84,365 | 81.52% | |
| Isle of Man | 69,560 | 82.67% | |
| Antigua and Barbuda | 64,290 | 69.24% | |
| Cayman Islands | 62,113 | 86.74% | |
| Saint Lucia | 60,140 | 33.64% | |
| Andorra | 57,913 | 72.64% | |
| Guernsey | 54,223 | 85.06% | |
| Bermuda | 48,554 | 74.96% | |
| Grenada | 44,241 | 37.84% | |
| Gibraltar | 42,175 | 112.08% | |
| Faroe Islands | 41,715 | 77.19% | |
| Greenland | 41,227 | 73.60% | |
| Saint Vincent and the Grenadines | 37,532 | 36.77% | |
| Burundi | 36,909 | 0.28% | |
| Saint Kitts and Nevis | 33,794 | 72.32% | |
| Dominica | 32,995 | 49.36% | |
| Turks and Caicos Islands | 32,815 | 71.54% | |
| Sint Maarten | 29,788 | 70.65% | |
| Monaco | 28,875 | 74.14% | |
| Liechtenstein | 26,771 | 68.06% | |
| San Marino | 26,357 | 77.26% | |
| British Virgin Islands | 19,466 | 50.77% | |
| Caribbean Netherlands | 19,109 | 66.69% | |
| Cook Islands | 15,112 | 102.48% | |
| Nauru | 13,106 | 110.87% | |
| Anguilla | 10,858 | 76.45% | |
| Tuvalu | 9,763 | 97.51% | |
| Wallis and Futuna | 7,150 | 62.17% | |
| Saint Helena, Ascension and Tristan da Cunha | 4,361 | 81.23% | |
| Falkland Islands | 2,632 | 74.88% | |
| Tokelau | 2,203 | 95.29% | |
| Montserrat | 2,104 | 47.01% | |
| Niue | 1,638 | 88.83% | |
| Pitcairn Islands | 47 | 100.00% | |
| North Korea | 0 | 0.00% | |
| |||
As of 12 August 2024[update], 13.53 billion COVID-19 vaccine doses have been administered worldwide, with 70.6 percent of the global population having received at least one dose.[294][295] While 4.19 million vaccines were then being administered daily, only 22.3 percent of people in low-income countries had received at least a first vaccine by September 2022, according to official reports from national health agencies, which are collated by Our World in Data.[296]
During a pandemic on the rapid timeline and scale of COVID-19 cases in 2020, international organizations like the World Health Organization (WHO) and Coalition for Epidemic Preparedness Innovations (CEPI), vaccine developers, governments, and industry evaluated the distribution of the eventual vaccine(s).[297] Individual countries producing a vaccine may be persuaded to favor the highest bidder for manufacturing or provide first-class service to their own country.[298][299][300] Experts emphasize that licensed vaccines should be available and affordable for people at the frontlines of healthcare and in most need.[298][300]
In April 2020, it was reported that the UK agreed to work with 20 other countries and global organizations, including France, Germany, and Italy, to find a vaccine and share the results, and that UK citizens would not get preferential access to any new COVID‑19 vaccines developed by taxpayer-funded UK universities.[301] Several companies planned to initially manufacture a vaccine at artificially low prices, then increase prices for profitability later if annual vaccinations are needed and as countries build stock for future needs.[300]
The WHO had set out the target to vaccinate 40% of the population of all countries by the end of 2021 and 70% by mid-2022,[302] but many countries missed the 40% target at the end of 2021.[303][304]-
Share of people who have received at least one dose of a COVID-19 vaccine relative to a country's total population. The date is on the map. Commons source.
-
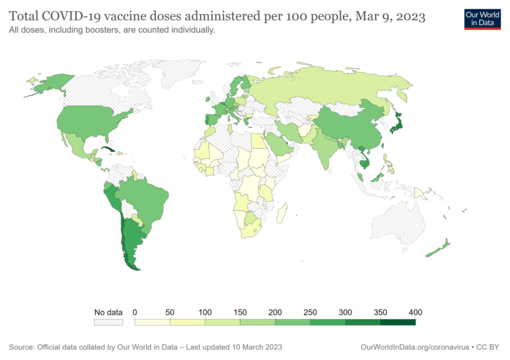
COVID-19 vaccine doses administered per 100 people by country. The date is on the map. Commons source.
Access
Countries have extremely unequal access to the COVID‑19 vaccine. Vaccine equity has not been achieved or even approximated. The inequity has harmed both countries with poor access and countries with good access.[19][20][305]
Nations pledged to buy doses of the COVID‑19 vaccines before the doses were available. Though high-income nations represent only 14% of the global population, as of 15 November 2020, they had contracted to buy 51% of all pre-sold doses. Some high-income nations bought more doses than would be necessary to vaccinate their entire populations.[18]

In January 2021, WHO Director-General Tedros Adhanom Ghebreyesus warned of problems with equitable distribution: "More than 39 million doses of vaccine have now been administered in at least 49 higher-income countries. Just 25 doses have been given in one lowest-income country. Not 25 million; not 25 thousand; just 25."[306]

In March 2021, it was revealed that the US attempted to convince Brazil not to purchase the Sputnik V COVID‑19 vaccine, fearing "Russian influence" in Latin America.[307] Some nations involved in long-standing territorial disputes have reportedly had their access to vaccines blocked by competing nations; Palestine has accused Israel of blocking vaccine delivery to Gaza, while Taiwan has suggested that China has hampered its efforts to procure vaccine doses.[308][309][310]
A single dose of the COVID‑19 vaccines by AstraZeneca would cost 47 Egyptian pounds (EGP), and the authorities are selling them for between 100 and 200 EGP. A report by the Carnegie Endowment for International Peace cited the poverty rate in Egypt as around 29.7 percent, which constitutes approximately 30.5 million people, and claimed that about 15 million Egyptians would be unable to gain access to the luxury of vaccination. A human rights lawyer, Khaled Ali, launched a lawsuit against the government, forcing them to provide vaccinations free of charge to all members of the public.[311]
According to immunologist Anthony Fauci, mutant strains of the virus and limited vaccine distribution pose continuing risks, and he said, "we have to get the entire world vaccinated, not just our own country."[312] Edward Bergmark and Arick Wierson are calling for a global vaccination effort and wrote that the wealthier nations' "me-first" mentality could ultimately backfire because the spread of the virus in poorer countries would lead to more variants, against which the vaccines could be less effective.[313]
In March 2021, the United States, Britain, European Union member states, and some other members of the World Trade Organization (WTO) blocked a push by more than eighty developing countries to waive COVID‑19 vaccine patent rights in an effort to boost production of vaccines for poor nations.[314] On 5 May 2021, the US government under President Joe Biden announced that it supports waiving intellectual property protections for COVID‑19 vaccines.[315] The Members of the European Parliament have backed a motion demanding the temporary lifting of intellectual property rights for COVID‑19 vaccines.[316]

In a meeting in April 2021, the World Health Organization's emergency committee addressed concerns of persistent inequity in global vaccine distribution.[317] Although 9 percent of the world's population lives in the 29 poorest countries, these countries had received only 0.3% of all vaccines administered as of May 2021.[318] In March 2021, Brazilian journalism agency Agência Pública reported that the country vaccinated about twice as many people who declare themselves white than black and noted that mortality from COVID‑19 is higher in the black population.[319]
In May 2021, UNICEF made an urgent appeal to industrialized nations to pool their excess COVID‑19 vaccine capacity to make up for a 125-million-dose gap in the COVAX program. The program mostly relied on the Oxford–AstraZeneca COVID‑19 vaccine produced by the Serum Institute of India, which faced serious supply problems due to increased domestic vaccine needs in India from March to June 2021. Only a limited amount of vaccines can be distributed efficiently, and the shortfall of vaccines in South America and parts of Asia is due to a lack of expedient donations by richer nations. International aid organizations have pointed at Nepal, Sri Lanka, and the Maldives, as well as Argentina, Brazil, and some parts of the Caribbean, as problem areas where vaccines are in short supply. In mid-May 2021, UNICEF was also critical of the fact that most proposed donations of Moderna and Pfizer vaccines were not slated for delivery until the second half of 2021 or early in 2022.[320]

In July 2021, the heads of the World Bank Group, the International Monetary Fund, the World Health Organization, and the World Trade Organization said in a joint statement: "As many countries are struggling with new variants and a third wave of COVID‑19 infections, accelerating access to vaccines becomes even more critical to ending the pandemic everywhere and achieving broad-based growth. We are deeply concerned about the limited vaccines, therapeutics, diagnostics, and support for deliveries available to developing countries."[321][322] In July 2021, The BMJ reported that countries had thrown out over 250,000 vaccine doses as supply exceeded demand and strict laws prevented the sharing of vaccines.[323] A survey by The New York Times found that over a million doses of vaccine had been thrown away in ten U.S. states because federal regulations prohibit recalling them, preventing their redistribution abroad.[324] Furthermore, doses donated close to expiration often cannot be administered quickly enough by recipient countries and end up having to be discarded.[325] To help overcome this problem, the Prime Minister of India, Narendra Modi, announced that they would make their digital vaccination management platform, CoWIN, open to the global community. He also announced that India would also release the source code for the contact tracing app Aarogya Setu for developers around the world. Around 142 countries, including Afghanistan, Bangladesh, Bhutan, the Maldives, Guyana, Antigua and Barbuda, St. Kitts and Nevis, and Zambia, expressed their interest in the application for COVID management.[326][327]
Amnesty International and Oxfam International have criticized the support of vaccine monopolies by the governments of producing countries, noting that this is dramatically increasing the dose price by five times and often much more, creating an economic barrier to access for poor countries.[328][329] Médecins Sans Frontières (Doctors without Borders) has also criticized vaccine monopolies and repeatedly called for their suspension, supporting the TRIPS waiver. The waiver was first proposed in October 2020 and has support from most countries, but was delayed by opposition from the EU (especially Germany; major EU countries such as France, Italy, and Spain support the exemption),[330] the UK, Norway, and Switzerland, among others. MSF called for a Day of Action in September 2021 to put pressure on the WTO Minister's meeting in November, which was expected to discuss the TRIPS IP waiver.[331][332][333]

In August 2021, to reduce unequal distribution between rich and poor countries, the WHO called for a moratorium on booster doses at least until the end of September. However, in August, the United States government announced plans to offer booster doses eight months after the initial course to the general population, starting with priority groups. Before the announcement, the WHO harshly criticized this type of decision, citing the lack of evidence for the need for boosters, except for patients with specific conditions. At this time, vaccine coverage of at least one dose was 58% in high-income countries and only 1.3% in low-income countries, and 1.14 million Americans had already received an unauthorized booster dose. US officials argued that waning efficacy against mild and moderate disease might indicate reduced protection against severe disease in the coming months. Israel, France, Germany, and the United Kingdom have also started planning boosters for specific groups.[334][335][336] In September 2021, more than 140 former world leaders and Nobel laureates, including former President of France François Hollande, former Prime Minister of the United Kingdom Gordon Brown, former Prime Minister of New Zealand Helen Clark, and Professor Joseph Stiglitz, called on the candidates to be the next German chancellor to declare themselves in favor of waiving intellectual property rules for COVID‑19 vaccines and transferring vaccine technologies.[337] In November 2021, nursing unions in 28 countries filed a formal appeal with the United Nations over the refusal of the UK, EU, Norway, Switzerland, and Singapore to temporarily waive patents for COVID‑19 vaccines.[338]
During his first international trip, the President of Peru, Pedro Castillo, spoke at the seventy-sixth session of the United Nations General Assembly on 21 September 2021, proposing the creation of an international treaty signed by world leaders and pharmaceutical companies to guarantee universal vaccine access, arguing that "The battle against the pandemic has shown us the failure of the international community to cooperate under the principle of solidarity."[339][340]
Optimizing the societal benefit of vaccination may benefit from a strategy that is tailored to the state of the pandemic, the demographics of a country, the age of the recipients, the availability of vaccines, and the individual risk for severe disease.[12] In the UK, the interval between prime and booster doses was extended to vaccinate as many people as early as possible.[341] Many countries are starting to give an additional booster shot to the immunosuppressed[342][343] and the elderly,[344] and research predicts an additional benefit of personalizing vaccine doses in the setting of limited vaccine availability when a wave of virus Variants of Concern hits a country.[345]
Despite the extremely rapid development of effective mRNA and viral vector vaccines, vaccine equity has not been achieved.[19] The World Health Organization called for 70 percent of the global population to be vaccinated by mid-2022, but as of March 2022, it was estimated that only one percent of the 10 billion doses given worldwide had been administered in low-income countries.[346] An additional 6 billion vaccinations may be needed to fill vaccine access gaps, particularly in developing countries. Given the projected availability of newer vaccines, the development and use of whole inactivated virus (WIV) and protein-based vaccines are also recommended. Organizations such as the Developing Countries Vaccine Manufacturers Network could help to support the production of such vaccines in developing countries, with lower production costs and greater ease of deployment.[19][347]
While vaccines substantially reduce the probability and severity of infection, it is still possible for fully vaccinated people to contract and spread COVID‑19.[348] Public health agencies have recommended that vaccinated people continue using preventive measures (wear face masks, social distance, wash hands) to avoid infecting others, especially vulnerable people, particularly in areas with high community spread. Governments have indicated that such recommendations will be reduced as vaccination rates increase and community spread declines.[349]
Economics
Moreover, an unequal distribution of vaccines will deepen inequality and exaggerate the gap between rich and poor and will reverse decades of hard-won progress on human development.
— United Nations, COVID vaccines: Widening inequality and millions vulnerable[350]
Vaccine inequity damages the global economy, disrupting the global supply chain.[305] Most vaccines were reserved for wealthy countries; as of September 2021[update],[350] some countries have more vaccines than are needed to fully vaccinate their populations.[18] When people are under-vaccinated, needlessly die, experience disability, and live under lockdown restrictions, they cannot supply the same goods and services. This harms the economies of under-vaccinated and over-vaccinated countries alike. Since rich countries have larger economies, rich countries may lose more money to vaccine inequity than poor ones,[305] though the poor ones will lose a higher percentage of GDP and experience longer-term effects.[351] High-income countries would profit an estimated US$4.80 for every $1 spent on giving vaccines to lower-income countries.[305]
The International Monetary Fund sees the vaccine divide between rich and poor nations as a serious obstacle to a global economic recovery.[352] Vaccine inequity disproportionately affects refuge-providing states, as they tend to be poorer, and refugees and displaced people are economically more vulnerable even within those low-income states, so they have suffered more economically from vaccine inequity.[353][19]
Liability
Several governments agreed to shield pharmaceutical companies like Pfizer and Moderna from negligence claims related to COVID‑19 vaccines (and treatments), as in previous pandemics, when governments also took on liability for such claims.
In the US, these liability shields took effect on 4 February 2020, when the US Secretary of Health and Human Services, Alex Azar, published a notice of declaration under the Public Readiness and Emergency Preparedness Act (PREP Act) for medical countermeasures against COVID‑19, covering "any vaccine, used to treat, diagnose, cure, prevent, or mitigate COVID‑19, or the transmission of SARS-CoV-2 or a virus mutating therefrom". The declaration precludes "liability claims alleging negligence by a manufacturer in creating a vaccine, or negligence by a health care provider in prescribing the wrong dose, absent willful misconduct." In other words, absent "willful misconduct", these companies cannot be sued for money damages for any injuries that occur between 2020 and 2024 from the administration of vaccines and treatments related to COVID‑19.[354] The declaration is effective in the United States through 1 October 2024.[354]
In December 2020, the UK government granted Pfizer legal indemnity for its COVID‑19 vaccine.[355]
In the European Union, the COVID‑19 vaccines were granted a conditional marketing authorization, which does not exempt manufacturers from civil and administrative liability claims.[356] The EU conditional marketing authorizations were changed to standard authorizations in September 2022.[357] While the purchasing contracts with vaccine manufacturers remain secret, they do not contain liability exemptions, even for side effects not known at the time of licensure.[358]
The Bureau of Investigative Journalism, a nonprofit news organization, reported in an investigation that unnamed officials in some countries, such as Argentina and Brazil, said that Pfizer demanded guarantees against costs of legal cases due to adverse effects in the form of liability waivers and sovereign assets such as federal bank reserves, embassy buildings, or military bases, going beyond what was expected from other countries, such as the US.[359] During the pandemic parliamentary inquiry in Brazil, Pfizer's representative said that its terms for Brazil are the same as for all other countries with which it has signed deals.[360]
On 13 December 2022, the governor of Florida, Ron DeSantis, said that he would petition the state supreme court to convene a grand jury to investigate possible violations in respect to COVID‑19 vaccines,[361] and declared that his government would be able to get "the data whether they [the companies] want to give it or not".[362]
On 30 November 2023, the U.S. state of Texas sued Pfizer under section 17.47 of the Texas Deceptive Trade Practices Act, alleging that the company misled the public about its Covid-19 vaccine by hiding risks while making false claims about its effectiveness.[363][364] On 17 June 2024, the U.S. state of Kansas similarly sued Pfizer under the Kansas Consumer Protection Act, making similar allegations.[365]
Controversy
In June 2021, a report revealed that the UB-612 vaccine, developed by the US-based Covaxx, was a for-profit venture initiated by Blackwater founder Erik Prince. In a series of text messages to Paul Behrends, the close associate recruited for the Covaxx project, Prince described the profit-making possibilities of selling the COVID‑19 vaccines. Covaxx provided no data from the clinical trials on safety or efficacy it conducted in Taiwan. The responsibility of creating distribution networks was assigned to an Abu Dhabi-based entity, which was mentioned as "Windward Capital" on the Covaxx letterhead but was actually Windward Holdings. The firm's sole shareholder, who handled "professional, scientific and technical activities", was Erik Prince. In March 2021, Covaxx raised $1.35 billion in a private placement.[366]
Misinformation and hesitancy

In many countries, the dissemination of varied claims and perspectives regarding COVID-19 vaccines has sparked widespread public discussion. These include concerns about potential side effects, differing interpretations of how the immune system responds to vaccination, and debates over the development and distribution of COVID-19 vaccines. Additionally, stories such as COVID-19 being linked to 5G technology and other debated information have also emerged.[368] This spread of information, including content from anti-vaccination advocates, may have influenced people's attitudes towards vaccination. In response, governments and private organizations around the world have introduced measures to encourage or mandate vaccination, such as lotteries,[369] mandates,[370] and free entry to events.[371] These measures have further fueled debates about their legality and effectiveness.[372]
In the US, some prominent biomedical scientists who publicly support vaccination have reported receiving threats and harassment through emails and social media from individuals opposing vaccination.[373]The United States Department of Defense (DoD) undertook a disinformation campaign in the Philippines, later expanded to Central Asia and the Middle East, which sought to discredit China, in particular its Sinovac vaccine, disseminating hashtags of #ChinaIsTheVirus and posts claiming that the Sinovac vaccine contained gelatin from pork and therefore was haram or forbidden for purposes of Islamic law.[374]
See also
Notes
- ^ "(OWID) vaccination maps". Our World in Data. Archived from the original on 21 December 2021. Mathieu E, Ritchie H, Rodés-Guirao L, Appel C, Giattino C, Hasell J, et al. (5 March 2020). "Data FAQ". Our World in Data. Archived from the original on 10 March 2021.
- ^ The table data is automatically updated daily by a bot; see Template:COVID-19 data for more information. Scroll down past the table to find the documentation and the main reference. See also: Category:Automatically updated COVID-19 pandemic table templates.
References
- ^ Li YD, Chi WY, Su JH, Ferrall L, Hung CF, Wu TC (December 2020). "Coronavirus vaccine development: from SARS and MERS to COVID-19". Journal of Biomedical Science. 27 (1): 104. doi:10.1186/s12929-020-00695-2. PMC 7749790. PMID 33341119.
- ^ Subbarao K (July 2021). "The success of SARS-CoV-2 vaccines and challenges ahead". Cell Host & Microbe. 29 (7): 1111–1123. doi:10.1016/j.chom.2021.06.016. PMC 8279572. PMID 34265245.
- ^ Jump up to: a b c d Rogers K (11 May 2022). "COVID-19 vaccine". Encyclopædia Britannica. Archived from the original on 12 June 2022. Retrieved 12 June 2022.
- ^ "Swissmedic grants authorisation for the first COVID-19 vaccine in Switzerland" (Press release). Swiss Agency for Therapeutic Products (Swissmedic). 18 December 2020. Archived from the original on 2 May 2021. Retrieved 5 July 2022.
- ^ "EMA recommends first COVID-19 vaccine for authorisation in the EU". European Medicines Agency (EMA) (Press release). 21 December 2020. Archived from the original on 30 January 2021. Retrieved 21 December 2020.
- ^ "The CanSino Biologics Ad5-nCoV-S [recombinant] COVID-19 vaccine: What you need to know". www.who.int. Retrieved 12 July 2024.
- ^ Dodaran MS, Banihashemi SR, Es-haghi A, Mehrabadi MH, Nofeli M, Mokarram AR, et al. (16 February 2023). "Immunogenicity and Safety of a Combined Intramuscular/Intranasal Recombinant Spike Protein COVID-19 Vaccine (RCP) in Healthy Adults Aged 18 to 55 Years Old: A Randomized, Double-Blind, Placebo-Controlled, Phase I Trial". Vaccines. 11 (2): 455. doi:10.3390/vaccines11020455. PMC 9961243. PMID 36851334.
- ^ Puga-Gómez R, Ricardo-Delgado Y, Rojas-Iriarte C, Céspedes-Henriquez L, Piedra-Bello M, Vega-Mendoza D, et al. (January 2023). "Open-label phase I/II clinical trial of SARS-CoV-2 receptor binding domain-tetanus toxoid conjugate vaccine (FINLAY-FR-2) in combination with receptor binding domain-protein vaccine (FINLAY-FR-1A) in children". International Journal of Infectious Diseases. 126: 164–173. doi:10.1016/j.ijid.2022.11.016. PMC 9673084. PMID 36403819. Retrieved 28 June 2024.
- ^ Mallapaty S, Callaway E, Kozlov M, Ledford H, Pickrell J, Van Noorden R (December 2021). "How COVID vaccines shaped 2021 in eight powerful charts". Nature. 600 (7890): 580–583. Bibcode:2021Natur.600..580M. doi:10.1038/d41586-021-03686-x. PMID 34916666. S2CID 245262732.
- ^ Watson OJ, Barnsley G, Toor J, Hogan AB, Winskill P, Ghani AC (June 2022). "Global impact of the first year of COVID-19 vaccination: a mathematical modelling study". The Lancet Infectious Diseases. 22 (9): 1293–1302. doi:10.1016/s1473-3099(22)00320-6. PMC 9225255. PMID 35753318.
- ^ Beaumont P (18 November 2020). "Covid-19 vaccine: who are countries prioritising for first doses?". The Guardian. ISSN 0261-3077. Archived from the original on 18 January 2021. Retrieved 26 December 2020.
- ^ Jump up to: a b Wang H, Xu R, Qu S, Schwartz M, Adams A, Chen X (October 2021). "Health inequities in COVID-19 vaccination among the elderly: Case of Connecticut". Journal of Infection and Public Health. 14 (10): 1563–1565. doi:10.1016/j.jiph.2021.07.013. PMC 8491089. PMID 34326008. S2CID 236515442.
- ^ Jump up to: a b Background document on the mRNA-1273 vaccine (Moderna) against COVID-19 (Report). World Health Organization (WHO). February 2021. hdl:10665/339218. WHO/2019-nCoV/vaccines/SAGE_recommendation/mRNA-1273/background/2021.1. Archived from the original on 13 June 2021. Retrieved 24 July 2021.
- ^ Jump up to: a b "Background document on the mRNA-1273 vaccine (Moderna) against COVID-19". World Health Organization (WHO). Archived from the original on 26 January 2022. Retrieved 23 January 2022.
- ^ Jump up to: a b "Pregnancy, breastfeeding, fertility and coronavirus (COVID-19) vaccination". NHS. 5 October 2022. Archived from the original on 15 October 2022. Retrieved 15 October 2022.
- ^ Richie H, Ortiz-Ospina E, Beltekian D, Methieu E, Hasell J, Macdonald B, et al. (March 2020). "Coronavirus (COVID-19) Vaccinations – Statistics and Research". Our World in Data. Archived from the original on 10 March 2021. Retrieved 7 February 2021.
- ^ Mullard A (November 2020). "How COVID vaccines are being divvied up around the world". Nature. doi:10.1038/d41586-020-03370-6. PMID 33257891. S2CID 227246811.
- ^ Jump up to: a b c So AD, Woo J (December 2020). "Reserving coronavirus disease 2019 vaccines for global access: cross sectional analysis". BMJ. 371: m4750. doi:10.1136/bmj.m4750. PMC 7735431. PMID 33323376.
- ^ Jump up to: a b c d e f Hotez PJ, Bottazzi ME (January 2022). "Whole Inactivated Virus and Protein-Based COVID-19 Vaccines". Annual Review of Medicine. 73 (1): 55–64. doi:10.1146/annurev-med-042420-113212. ISSN 0066-4219. PMID 34637324. S2CID 238747462.
- ^ Jump up to: a b Ye Y, Zhang Q, Wei X, Cao Z, Yuan HY, Zeng DD (February 2022). "Equitable access to COVID-19 vaccines makes a life-saving difference to all countries". Nature Human Behaviour. 6 (2): 207–216. doi:10.1038/s41562-022-01289-8. PMC 8873023. PMID 35102361.
- ^ "The Nobel Prize in Physiology or Medicine 2023". NobelPrize.org. Archived from the original on 4 October 2023. Retrieved 3 October 2023.
- ^ "Hungarian and US scientists win Nobel for COVID-19 vaccine discoveries". Reuters. 2 October 2023. Archived from the original on 8 October 2023. Retrieved 3 October 2023.
- ^ "The Nobel Prize in Physiology or Medicine 2023". NobelPrize.org. Archived from the original on 4 February 2024. Retrieved 3 October 2023.
- ^ Jump up to: a b c Gates B (30 April 2020). "The vaccine race explained: What you need to know about the COVID-19 vaccine". The Gates Notes. Archived from the original on 14 May 2020. Retrieved 2 May 2020.
- ^ Cavanagh D (December 2003). "Severe acute respiratory syndrome vaccine development: experiences of vaccination against avian infectious bronchitis coronavirus". Avian Pathology. 32 (6): 567–582. doi:10.1080/03079450310001621198. PMC 7154303. PMID 14676007.
- ^ Gao W, Tamin A, Soloff A, D'Aiuto L, Nwanegbo E, Robbins PD, et al. (December 2003). "Effects of a SARS-associated coronavirus vaccine in monkeys". Lancet. 362 (9399): 1895–1896. doi:10.1016/S0140-6736(03)14962-8. PMC 7112457. PMID 14667748.
- ^ Kim E, Okada K, Kenniston T, Raj VS, AlHajri MM, Farag EA, et al. (October 2014). "Immunogenicity of an adenoviral-based Middle East Respiratory Syndrome coronavirus vaccine in BALB/c mice". Vaccine. 32 (45): 5975–5982. doi:10.1016/j.vaccine.2014.08.058. PMC 7115510. PMID 25192975.
- ^ Greenough TC, Babcock GJ, Roberts A, Hernandez HJ, Thomas WD, Coccia JA, et al. (February 2005). "Development and characterization of a severe acute respiratory syndrome-associated coronavirus-neutralizing human monoclonal antibody that provides effective immunoprophylaxis in mice". The Journal of Infectious Diseases. 191 (4): 507–514. doi:10.1086/427242. PMC 7110081. PMID 15655773.
- ^ Tripp RA, Haynes LM, Moore D, Anderson B, Tamin A, Harcourt BH, et al. (September 2005). "Monoclonal antibodies to SARS-associated coronavirus (SARS-CoV): identification of neutralizing and antibodies reactive to S, N, M and E viral proteins". Journal of Virological Methods. 128 (1–2): 21–28. doi:10.1016/j.jviromet.2005.03.021. PMC 7112802. PMID 15885812.
- ^ Roberts A, Thomas WD, Guarner J, Lamirande EW, Babcock GJ, Greenough TC, et al. (March 2006). "Therapy with a severe acute respiratory syndrome-associated coronavirus-neutralizing human monoclonal antibody reduces disease severity and viral burden in golden Syrian hamsters". The Journal of Infectious Diseases. 193 (5): 685–692. doi:10.1086/500143. PMC 7109703. PMID 16453264.
- ^ Jump up to: a b Jiang S, Lu L, Du L (January 2013). "Development of SARS vaccines and therapeutics is still needed". Future Virology. 8 (1): 1–2. doi:10.2217/fvl.12.126. PMC 7079997. PMID 32201503.
- ^ "SARS (severe acute respiratory syndrome)". National Health Service. 5 March 2020. Archived from the original on 9 March 2020. Retrieved 31 January 2020.
- ^ Shehata MM, Gomaa MR, Ali MA, Kayali G (June 2016). "Middle East respiratory syndrome coronavirus: a comprehensive review". Frontiers of Medicine. 10 (2): 120–136. doi:10.1007/s11684-016-0430-6. PMC 7089261. PMID 26791756.
- ^ Butler D (October 2012). "SARS veterans tackle coronavirus". Nature. 490 (7418): 20. Bibcode:2012Natur.490...20B. doi:10.1038/490020a. PMID 23038444.
- ^ Modjarrad K, Roberts CC, Mills KT, Castellano AR, Paolino K, Muthumani K, et al. (September 2019). "Safety and immunogenicity of an anti-Middle East respiratory syndrome coronavirus DNA vaccine: a phase 1, open-label, single-arm, dose-escalation trial". The Lancet. Infectious Diseases. 19 (9): 1013–1022. doi:10.1016/S1473-3099(19)30266-X. PMC 7185789. PMID 31351922.
- ^ Yong CY, Ong HK, Yeap SK, Ho KL, Tan WS (2019). "Recent Advances in the Vaccine Development Against Middle East Respiratory Syndrome-Coronavirus". Frontiers in Microbiology. 10: 1781. doi:10.3389/fmicb.2019.01781. PMC 6688523. PMID 31428074.
- ^ Jump up to: a b c Loftus P, Hopkins JS, Pancevski B (17 November 2020). "Moderna and Pfizer Are Reinventing Vaccines, Starting With Covid". The Wall Street Journal. Archived from the original on 6 November 2021. Retrieved 4 October 2021.
- ^ Sharma O, Sultan AA, Ding H, Triggle CR (14 October 2020). "A Review of the Progress and Challenges of Developing a Vaccine for COVID-19". Frontiers in Immunology. 11: 585354. doi:10.3389/fimmu.2020.585354. PMC 7591699. PMID 33163000.
- ^ Bok K, Sitar S, Graham BS, Mascola JR (August 2021). "Accelerated COVID-19 vaccine development: milestones, lessons, and prospects". Immunity. 54 (8): 1636–1651. doi:10.1016/j.immuni.2021.07.017. PMC 8328682. PMID 34348117.
- ^ Lewis T. "The New COVID Booster Shot Could Save Your Life; Get One Now, FDA Expert Says". Scientific American. Archived from the original on 7 November 2022. Retrieved 8 November 2022.
- ^ Turner JS, O'Halloran JA, Kalaidina E, Kim W, Schmitz AJ, Zhou JQ, et al. (August 2021). "SARS-CoV-2 mRNA vaccines induce persistent human germinal centre responses". Nature. 596 (7870): 109–113. Bibcode:2021Natur.596..109T. doi:10.1038/s41586-021-03738-2. PMC 8935394. PMID 34182569.
- ^ "Pfizer and Moderna Vaccines Likely to Produce Lasting Immunity, Study Finds". The New York Times. 28 June 2021. Archived from the original on 28 June 2021. Retrieved 23 January 2022.
- ^ Flanagan KL, Best E, Crawford NW, Giles M, Koirala A, Macartney K, et al. (2020). "Progress and Pitfalls in the Quest for Effective SARS-CoV-2 (COVID-19) Vaccines". Frontiers in Immunology. 11: 579250. doi:10.3389/fimmu.2020.579250. PMC 7566192. PMID 33123165.
- ^ Jump up to: a b c d e f g Le TT, Cramer JP, Chen R, Mayhew S (October 2020). "Evolution of the COVID-19 vaccine development landscape". Nature Reviews. Drug Discovery. 19 (10): 667–68. doi:10.1038/d41573-020-00151-8. PMID 32887942. S2CID 221503034.
- ^ Jump up to: a b "COVID-19 vaccine tracker (Refresh URL to update)". London School of Hygiene & Tropical Medicine. 12 July 2021. Archived from the original on 11 October 2020. Retrieved 10 March 2021.
- ^ Arbeitman CR, Rojas P, Ojeda-May P, Garcia ME (September 2021). "The SARS-CoV-2 spike protein is vulnerable to moderate electric fields". Nature Communications. 12 (1): 5407. arXiv:2103.12733. Bibcode:2021NatCo..12.5407A. doi:10.1038/s41467-021-25478-7. PMC 8437970. PMID 34518528.
- ^ Jump up to: a b Grifoni A, Weiskopf D, Ramirez SI, Mateus J, Dan JM, Moderbacher CR, et al. (June 2020). "Targets of T Cell Responses to SARS-CoV-2 Coronavirus in Humans with COVID-19 Disease and Unexposed Individuals". Cell. 181 (7): 1489–1501.e15. doi:10.1016/j.cell.2020.05.015. PMC 7237901. PMID 32473127.
- ^ Dutta NK, Mazumdar K, Gordy JT (June 2020). Dutch RE (ed.). "The Nucleocapsid Protein of SARS-CoV-2: a Target for Vaccine Development". Journal of Virology. 94 (13). doi:10.1128/JVI.00647-20. PMC 7307180. PMID 32546606.
- ^ Nikolaidis M, Markoulatos P, Van de Peer Y, Oliver SG, Amoutzias GD (October 2021). Hepp C (ed.). "The neighborhood of the Spike gene is a hotspot for modular intertypic homologous and non-homologous recombination in Coronavirus genomes". Molecular Biology and Evolution. 39: msab292. doi:10.1093/molbev/msab292. PMC 8549283. PMID 34638137.
- ^ Amoutzias GD, Nikolaidis M, Tryfonopoulou E, Chlichlia K, Markoulatos P, Oliver SG (January 2022). "The Remarkable Evolutionary Plasticity of Coronaviruses by Mutation and Recombination: Insights for the COVID-19 Pandemic and the Future Evolutionary Paths of SARS-CoV-2". Viruses. 14 (1): 78. doi:10.3390/v14010078. PMC 8778387. PMID 35062282.
- ^ Jump up to: a b c d Thanh Le T, Andreadakis Z, Kumar A, Gómez Román R, Tollefsen S, Saville M, et al. (May 2020). "The COVID-19 vaccine development landscape". Nature Reviews. Drug Discovery. 19 (5): 305–06. doi:10.1038/d41573-020-00073-5. PMID 32273591.
- ^ Jump up to: a b c Diamond MS, Pierson TC (May 2020). "The Challenges of Vaccine Development against a New Virus during a Pandemic". Cell Host & Microbe. 27 (5): 699–703. doi:10.1016/j.chom.2020.04.021. PMC 7219397. PMID 32407708.
- ^ Cross R (29 September 2020). "The tiny tweak behind COVID-19 vaccines". Chemical & Engineering News. Vol. 98, no. 38. Archived from the original on 16 February 2021. Retrieved 15 April 2021.
- ^ Krammer F (October 2020). "SARS-CoV-2 vaccines in development". Nature. 586 (7830): 516–527. Bibcode:2020Natur.586..516K. doi:10.1038/s41586-020-2798-3. PMID 32967006. S2CID 221887746.
- ^ Park KS, Sun X, Aikins ME, Moon JJ (February 2021). "Non-viral COVID-19 vaccine delivery systems". Advanced Drug Delivery Reviews. 169: 137–151. doi:10.1016/j.addr.2020.12.008. ISSN 0169-409X. PMC 7744276. PMID 33340620.
- ^ Kowalski PS, Rudra A, Miao L, Anderson DG (April 2019). "Delivering the Messenger: Advances in Technologies for Therapeutic mRNA Delivery". Molecular Therapy. 27 (4): 710–728. doi:10.1016/j.ymthe.2019.02.012. PMC 6453548. PMID 30846391.
- ^ Verbeke R, Lentacker I, De Smedt SC, Dewitte H (October 2019). "Three decades of messenger RNA vaccine development". Nano Today. 28: 100766. doi:10.1016/j.nantod.2019.100766. hdl:1854/LU-8628303. S2CID 202221207. Archived from the original on 9 October 2021. Retrieved 17 January 2021.
- ^ "COVID-19 ACIP Vaccine Recommendations". U.S. Centers for Disease Control and Prevention (CDC). Archived from the original on 3 November 2021. Retrieved 18 February 2021.
- ^ "Safe COVID-19 vaccines for Europeans". European Commission. Archived from the original on 4 November 2021. Retrieved 19 February 2021.
- ^ "Regulatory Decision Summary – Pfizer–BioNTech COVID-19 Vaccine". Health Canada, Government of Canada. 9 December 2020. Archived from the original on 30 January 2021. Retrieved 9 December 2020.
- ^ "Study to Describe the Safety, Tolerability, Immunogenicity, and Efficacy of RNA Vaccine Candidates Against COVID-19 in Healthy Adults". ClinicalTrials.gov. 30 April 2020. NCT04368728. Archived from the original on 11 October 2020. Retrieved 14 July 2020.
- ^ "A Multi-site Phase I/II, 2-Part, Dose-Escalation Trial Investigating the Safety and Immunogenicity of four Prophylactic SARS-CoV-2 RNA Vaccines Against COVID-19 Using Different Dosing Regimens in Healthy Adults". EU Clinical Trials Register. 14 April 2020. EudraCT 2020-001038-36. Archived from the original on 22 April 2020. Retrieved 22 April 2020.
- ^ "A Study to Evaluate Efficacy, Safety, and Immunogenicity of mRNA-1273 Vaccine in Adults Aged 18 Years and Older to Prevent COVID-19". ClinicalTrials.gov. 14 July 2020. NCT04470427. Archived from the original on 11 October 2020. Retrieved 27 July 2020.
- ^ Palca J (27 July 2020). "COVID-19 vaccine candidate heads to widespread testing in U.S." NPR. Archived from the original on 11 October 2020. Retrieved 27 July 2020.
- ^ "CureVac Final Data from Phase 2b/3 Trial of First-Generation COVID-19 Vaccine Candidate, CVnCoV, Demonstrates Protection in Age Group of 18 to 60". CureVac (Press release). 30 June 2021. Archived from the original on 12 October 2021. Retrieved 2 July 2021.
- ^ Jump up to: a b c Moghimi SM (March 2021). "Allergic Reactions and Anaphylaxis to LNP-Based COVID-19 Vaccines". Molecular Therapy. 29 (3): 898–900. doi:10.1016/j.ymthe.2021.01.030. PMC 7862013. PMID 33571463.
- ^ Jump up to: a b "What are viral vector-based vaccines and how could they be used against COVID-19?". Gavi, the Vaccine Alliance (GAVI). 2020. Archived from the original on 11 November 2021. Retrieved 26 January 2021.
- ^ "Understanding Viral Vector COVID-19 Vaccines". U.S. Centers for Disease Control and Prevention (CDC). 13 April 2021. Archived from the original on 13 November 2021. Retrieved 19 April 2021.
- ^ "Investigating a Vaccine Against COVID-19". ClinicalTrials.gov. 26 May 2020. NCT04400838. Archived from the original on 11 October 2020. Retrieved 14 July 2020.
- ^ "A Phase 2/3 study to determine the efficacy, safety and immunogenicity of the candidate Coronavirus Disease (COVID-19) vaccine ChAdOx1 nCoV-19". EU Clinical Trials Register. 21 April 2020. EudraCT 2020-001228-32. Archived from the original on 5 October 2020. Retrieved 3 August 2020.
- ^ O'Reilly P (May 2020). "A Phase III study to investigate a vaccine against COVID-19". ISRCTN Registry. doi:10.1186/ISRCTN89951424.
- ^ Corum J, Carl Z (8 January 2021). "How Gamaleya's Vaccine Works". The New York Times. Archived from the original on 20 April 2021. Retrieved 27 January 2021.
- ^ "A Study of Ad26.COV2.S in Adults". 4 August 2020. Archived from the original on 16 September 2020. Retrieved 23 August 2020.
- ^ "A Study of Ad26.COV2.S for the Prevention of SARS-CoV-2-Mediated COVID-19 in Adult Participants". US National Library of Medicine. Archived from the original on 26 September 2020.
- ^ Johnson C, McGinley L. "Johnson & Johnson seeks emergency FDA authorization for single-shot coronavirus vaccine". The Washington Post. Archived from the original on 5 February 2021. Retrieved 10 February 2021.
- ^ "It's not just Johnson & Johnson: China has a single-dose COVID-19 vaccine that's 65% effective". Fortune. Archived from the original on 8 August 2021. Retrieved 28 February 2021.
- ^ Wu S, Zhong G, Zhang J, Shuai L, Zhang Z, Wen Z, et al. (August 2020). "A single dose of an adenovirus-vectored vaccine provides protection against SARS-CoV-2 challenge". Nat Commun. 11 (1): 4081. Bibcode:2020NatCo..11.4081W. doi:10.1038/s41467-020-17972-1. PMC 7427994. PMID 32796842.
- ^ "Single dose vaccine, Sputnik Light, authorized for use in Russia". Sputnik V (Press release). Archived from the original on 14 November 2021. Retrieved 12 August 2021.
- ^ Sputnik V [@sputnikvaccine] (6 May 2021). "Introducing a new member of the Sputnik family - a single dose Sputnik Light! It's a revolutionary 1-shot COVID-19 vaccine with the 80% efficacy - higher than many 2-shot vaccines. Sputnik Light will double vaccination rates and help to handle epidemic peaks https://t.co/BCybe8yYWU" (Tweet). Archived from the original on 8 May 2022. Retrieved 8 December 2022 – via Twitter.
- ^ Petrovsky N, Aguilar JC (October 2004). "Vaccine adjuvants: current state and future trends". Immunology and Cell Biology. 82 (5): 488–496. doi:10.1111/j.0818-9641.2004.01272.x. PMID 15479434. S2CID 154670.
- ^ "Safety and Immunogenicity Study of Inactivated Vaccine for Prevention of SARS-CoV-2 Infection (COVID-19) (Renqiu)". ClinicalTrials.gov. 12 May 2020. NCT04383574. Archived from the original on 11 October 2020. Retrieved 14 July 2020.
- ^ "Clinical Trial of Efficacy and Safety of Sinovac's Adsorbed COVID-19 (Inactivated) Vaccine in Healthcare Professionals (PROFISCOV)". ClinicalTrials.gov. 2 July 2020. NCT04456595. Archived from the original on 11 October 2020. Retrieved 3 August 2020.
- ^ PT. Bio Farma (August 2020). "A Phase III, observer-blind, randomized, placebo-controlled study of the efficacy, safety, and immunogenicity of SARS-COV-2 inactivated vaccine in healthy adults aged 18–59 years in Indonesia". Registri Penyakit Indonesia. Archived from the original on 11 October 2020. Retrieved 15 August 2020.
- ^ Chen W, Al Kaabi N (July 2020). "A Phase III clinical trial for inactivated novel coronavirus pneumonia (COVID-19) vaccine (Vero cells)". Chinese Clinical Trial Registry. Archived from the original on 11 October 2020. Retrieved 15 August 2020.
- ^ Ivanova P (20 February 2021). "Russia approves its third COVID-19 vaccine, CoviVac". Reuters. Archived from the original on 28 February 2021. Retrieved 11 April 2021.
- ^ "Kazakhstan rolls out its own COVID-19 vaccine". Reuters. 27 April 2021. Archived from the original on 4 November 2021. Retrieved 2 July 2021.
- ^ "FarsNews Agency Iran Licenses Emergency Injection of Home-Made Anti-Coronavirus Vaccine". Fars News Agency. 14 June 2021. Archived from the original on 9 October 2021. Retrieved 25 August 2021.
- ^ "VLA2001 COVID-19 Vaccine". Precision Vaccinations. 31 December 2020. Archived from the original on 13 January 2021. Retrieved 11 January 2021.
- ^ "Dose Finding Study to Evaluate Safety, Tolerability and Immunogenicity of an Inactivated Adjuvanted Sars-Cov-2 Virus Vaccine Candidate Against Covid-19 in Healthy Adults". U.S. National Library of Medicine. 30 December 2020. Archived from the original on 14 February 2021. Retrieved 11 January 2021.
- ^ "Module 2 – Subunit vaccines". WHO Vaccine Safety Basics. Archived from the original on 8 August 2021. Retrieved 17 January 2021.
- ^ "Study of the Safety, Reactogenicity and Immunogenicity of "EpiVacCorona" Vaccine for the Prevention of COVID-19 (EpiVacCorona)". ClinicalTrials.gov. 22 September 2020. NCT04368988. Archived from the original on 29 June 2021. Retrieved 16 November 2020.
- ^ "MVC COVID-19 Vaccine Obtains Taiwan EUA Approval". Medigen Vaccine Biologics. Archived from the original on 27 November 2021. Retrieved 7 August 2021.
- ^ Achom D (28 December 2021). "India Clears 2 New Vaccines And Merck's Covid Pill: 10 Points". NDTV.com. Archived from the original on 28 December 2021. Retrieved 19 January 2022.
- ^ Bottazzi ME, Hotez PJ (30 December 2021). "A COVID Vaccine for All". Scientific American. Archived from the original on 30 December 2021. Retrieved 19 January 2022.
- ^ "VidPrevtyn Beta". European Medicines Agency (EMA). 4 November 2022. Archived from the original on 11 November 2022. Retrieved 12 November 2022. Text was copied from this source which is copyright European Medicines Agency. Reproduction is authorized provided the source is acknowledged.
- ^ "EMA recommends approval of VidPrevtyn Beta as a COVID-19 booster vaccine". European Medicines Agency (EMA) (Press release). 10 November 2022. Archived from the original on 12 November 2022. Retrieved 12 November 2022. Text was copied from this source which is copyright European Medicines Agency. Reproduction is authorized provided the source is acknowledged.
- ^ "Iran-Cuba vaccine enters phase three clinical trials". Tehran Times. 26 April 2021. Archived from the original on 19 July 2021. Retrieved 7 September 2021.
- ^ Barrie R (31 March 2023). "Hipra's Covid-19 booster gets EMA nod and enters an uncertain landscape". Pharmaceutical Technology. Archived from the original on 10 April 2023. Retrieved 9 April 2023.
- ^ "Bimervax EPAR". European Medicines Agency. 5 April 2023. Archived from the original on 8 April 2023. Retrieved 9 April 2023.
- ^ "A Study on the Safety, Tolerability and Immune Response of SARS-CoV-2 Sclamp (COVID-19) Vaccine in Healthy Adults". ClinicalTrials.gov. 3 August 2020. NCT04495933. Archived from the original on 11 October 2020. Retrieved 4 August 2020.
- ^ "Australian vaccine trials stopped due to HIV false positives". Deutsche Welle. 11 December 2020. Archived from the original on 26 January 2021. Retrieved 9 January 2023.
- ^ "Covid: Australian vaccine abandoned over false HIV response". BBC News Online. 11 December 2020. Archived from the original on 16 January 2021. Retrieved 9 April 2023.
- ^ "Evaluation of the Safety and Immunogenicity of a SARS-CoV-2 rS (COVID-19) Nanoparticle Vaccine With/Without Matrix-M Adjuvant". ClinicalTrials.gov. 30 April 2020. NCT04368988. Archived from the original on 14 July 2020. Retrieved 14 July 2020.
- ^ "A prospective, randomized, adaptive, phase I/II clinical study to evaluate the safety and immunogenicity of Novel Corona Virus −2019-nCov vaccine candidate of M/s Cadila Healthcare Limited by intradermal route in healthy subjects". India: Clinical Trials Registry. 15 December 2020. CTRI/2020/07/026352. Archived from the original on 22 November 2020.
- ^ "Safety, Tolerability and Immunogenicity of INO-4800 for COVID-19 in Healthy Volunteers". ClinicalTrials.gov. 7 April 2020. NCT04336410. Archived from the original on 11 October 2020. Retrieved 14 July 2020.
- ^ "IVI, INOVIO, and KNIH to partner with CEPI in a Phase I/II clinical trial of INOVIO's COVID‑19 DNA vaccine in South Korea". International Vaccine Institute. 16 April 2020. Archived from the original on 24 September 2020. Retrieved 23 April 2020.
- ^ "Study of COVID-19 DNA Vaccine (AG0301-COVID19)". ClinicalTrials.gov. 9 July 2020. NCT04463472. Archived from the original on 11 October 2020. Retrieved 14 July 2020.
- ^ "Safety and Immunogenicity Study of GX-19, a COVID-19 Preventive DNA Vaccine in Healthy Adults". ClinicalTrials.gov. 24 June 2020. NCT04445389. Archived from the original on 11 October 2020. Retrieved 14 July 2020.
- ^ "S. Korea's Genexine begins human trial of coronavirus vaccine". Reuters. 19 June 2020. Archived from the original on 11 October 2020. Retrieved 25 June 2020.
- ^ Chang LJ (March 2020). "Safety and Immunity of Covid-19 aAPC Vaccine". ClinicalTrials.gov. NCT04299724. Archived from the original on 11 October 2020. Retrieved 14 July 2020.
- ^ "Immunity and Safety of Covid-19 Synthetic Minigene Vaccine". ClinicalTrials.gov. February 2020. NCT04276896. Archived from the original on 11 October 2020. Retrieved 14 July 2020.
- ^ "A Phase I/II Randomized, Multi-Center, Placebo-Controlled, Dose-Escalation Study to Evaluate the Safety, Immunogenicity and Potential Efficacy of an rVSV-SARS-CoV-2-S Vaccine (IIBR-100) in Adults". ClinicalTrials.gov. November 2020. NCT04608305. Archived from the original on 3 May 2021. Retrieved 2 January 2021.
- ^ Johnson CY, Mufson S (11 June 2020). "Can old vaccines from science's medicine cabinet ward off coronavirus?". The Washington Post. ISSN 0190-8286. Archived from the original on 11 June 2020. Retrieved 31 December 2020.
- ^ "Bacille Calmette-Guérin (BCG) vaccination and COVID-19". World Health Organization (WHO). 12 April 2020. Archived from the original on 30 April 2020. Retrieved 1 May 2020.
- ^ "Urgent global health needs addressed by Novavax". Novavax. Archived from the original on 12 May 2021. Retrieved 30 January 2021.
- ^ Jump up to: a b Mudgal R, Nehul S, Tomar S (December 2020). "Prospects for mucosal vaccine: shutting the door on SARS-CoV-2". Human Vaccines & Immunotherapeutics. 16 (12): 2921–2931. doi:10.1080/21645515.2020.1805992. PMC 7544966. PMID 32931361.
- ^ Jump up to: a b Rhee JH (2020). "Current and New Approaches for Mucosal Vaccine Delivery". Mucosal Vaccines. Elsevier. pp. 325–356. doi:10.1016/b978-0-12-811924-2.00019-5. ISBN 9780128119242. PMC 7149853.
- ^ "Live Attenuated Influenza Vaccine [LAIV] (The Nasal Spray Flu Vaccine)". U.S. Centers for Disease Control and Prevention (CDC). 3 August 2021. Archived from the original on 14 October 2019. Retrieved 8 September 2021.
- ^ "Two homegrown vaccines receive emergency use license". Tehran Times. 1 November 2021. Retrieved 5 June 2024.
- ^ Maksimova K. "A scientist at the Gamaleya Center spoke about the benefits of a nasal vaccine against coronavirus". sibmeda.ru. Retrieved 5 June 2024.
- ^ "Two inhaled covid vaccines have been approved—but we don't know yet how good they are". MIT Technology Review. Archived from the original on 21 October 2022. Retrieved 21 October 2022.
- ^ Jump up to: a b Waltz E (September 2022). "China and India approve nasal COVID vaccines - are they a game changer?". Nature. 609 (7927): 450. Bibcode:2022Natur.609..450W. doi:10.1038/d41586-022-02851-0. PMID 36071228. S2CID 252121594.
- ^ Dhama K, Dhawan M, Tiwari R, Emran TB, Mitra S, Rabaan AA, et al. (November 2022). "COVID-19 intranasal vaccines: current progress, advantages, prospects, and challenges". Human Vaccines & Immunotherapeutics. 18 (5): 2045853. doi:10.1080/21645515.2022.2045853. PMC 8935456. PMID 35258416.
- ^ "关于印发新冠病毒疫苗第二剂次加强免疫接种实施方案的通知" (in Chinese). National Health Commission. 14 December 2022. Retrieved 14 December 2022.
- ^ Jump up to: a b Nistor GI, Dillman RO, Robles RM, Langford JL, Poole AJ, Sofro MA, et al. (Август 2022). «Личная вакцина с дендритными клетками Covid-19, сделанная в точке зрения: осуществимость, безопасность и антиген-специфические клеточные иммунные ответы» . Вакцины и иммунотерапевтические средства . 18 (6): 2100189. DOI : 10.1080/21645515.2022.2100189 . PMC 9746383 . PMID 36018753 .
- ^ «Дендритная клеточная вакцина, AV-Covid-19, чтобы предотвратить инфекцию Covid-19» . Clinicaltrials.gov . 30 декабря 2020 года. Архивировано из оригинала 13 мая 2022 года . Получено 5 сентября 2022 года .
- ^ «Профилактическая вакцина с дендритными клетками, AV-Covid-19, у субъектов, не активно инфицированных Covid-19» . Clinicaltrials.gov . 16 августа 2021 года. Архивировано с оригинала 18 июня 2022 года . Получено 5 сентября 2022 года .
- ^ Маллин Е (9 июня 2021 года). «Универсальная» вакцина вакцины для коронавируса для предотвращения следующей пандемии » . Scientific American . Архивировано из оригинала 20 декабря 2021 года . Получено 20 декабря 2021 года .
- ^ JOI P (13 июля 2021 года). "Может ли универсальная вакцина в коронавирусе скоро стать реальностью?" Полем Гави . Архивировано из оригинала 20 декабря 2021 года . Получено 20 декабря 2021 года .
- ^ Буш и (15 декабря 2021 г.). «Fauci стремится к универсальной вакцине вакцины коронавируса» . NBC News . Архивировано из оригинала 20 декабря 2021 года . Получено 20 декабря 2021 года .
- ^ «Национальный план готовности Covid-19» (PDF) . Белый дом. Март 2022 года. С. 9, 21, 29. Архивировано из оригинала (PDF) 26 марта 2022 года . Получено 29 марта 2022 года .
- ^ «Фаза 1 клинические испытания вакцины, разработанной WRAIR, начинается» . 5 апреля 2022 года. Архивировано с оригинала 11 июля 2022 года . Получено 11 июля 2022 года .
- ^ Ober Shepherd BL, Scott PT, Hutter JN, Lee C, McCauley MD, Guzman I, et al. (EID-030 Исследовательская группа) (июнь 2024 г.). «SARS-COV-2 рекомбинантный всплеск ферритина вакцины наночастиц, адъюванте, с составной армейской липосомой, содержащей монофосфорил липид A и QS-21: фаза 1, рандомизированное двойное слепое, плацебо-контролируемое клиническое исследование». Lancet. Микроб . 5 (6): E581 - E593. doi : 10.1016/s2666-5247 (23) 00410-x . PMC 11192176. PMID 38761816 .
- ^ «Первое исследование для оценки безопасности и иммуногенности трех уровней дозы кандидата в вакцину против коронавируса OVX033 у здоровых добровольцев» . Clinicaltrials.gov . Получено 30 августа 2024 года .
- ^ «Безопасность и иммуногенность подразделения белка CD40.RBDV Дволенная вакцина COVID-19, адъювантная или нет, как бустер у добровольцев» . Clinicaltrials.gov . Получено 30 августа 2024 года .
- ^ «Исследование вакцины фазы I вакцины против коронавируса PEVAC-PS» . www.isrctn.com . Получено 30 августа 2024 года .
- ^ «Безопасность, переносимость и иммуногенность кандидата в вакцину вакцины тревальента в коронавирусе VBI-2901A» . Clinicaltrials.gov . Национальные институты здравоохранения . Получено 30 августа 2024 года .
- ^ Haridy R (7 июля 2022 года). «Другие универсальные вакцины вакцины для коронавируса для человеческих испытаний» . Новый Атлас . Архивировано из оригинала 11 июля 2022 года . Получено 11 июля 2022 года .
- ^ Jump up to: а беременный в Tregoning JS, Russell RF, Kinnear E (март 2018 г.). «Адъювантные вакцины против гриппа» . Вакцины и иммунотерапевтические средства . 14 (3): 550–564. doi : 10.1080/216455515.2017.1415684 . PMC 5861793 . PMID 29232151 .
- ^ Jump up to: а беременный в дюймовый Wang J, Peng Y, Xu H, Cui Z, Williams Ro (август 2020 г.). «Раса вакцины Covid-19: проблемы и возможности в составе вакцины» . AAPS PharmScitech . 21 (6): 225. DOI : 10.1208/S12249-020-01744-7 . PMC 7405756 . PMID 32761294 .
- ^ «Обновленные вакцины COVID-19 для использования в Соединенных Штатах, начиная с осени 2024 года» . США Управление по контролю за продуктами и лекарствами (FDA) . 5 июня 2024 года . Получено 19 июня 2024 года .
 Эта статья включает текст из этого источника, который находится в общественном доступе .
Эта статья включает текст из этого источника, который находится в общественном доступе .
- ^ Симпсон С., Кауфманн М.К., Глозман В., Чакрабарти А (май 2020). «Болезнь X: ускорение развития медицинских контрмеров для следующей пандемии» . Lancet. Заразительные заболевания . 20 (5): E108–15. doi : 10.1016/s1473-3099 (20) 30123-7 . PMC 7158580 . PMID 32197097 .
- ^ Забалета Н., Дай В., Бхатт У, Эрате С., Майсоннассе П., Чичестер Дж.А. и др. (Август 2021 г.). «Основанная на AAV вакцина с одной дозой-19 на основе AAV обеспечивает прочную иммуногенность и защиту у нечеловеческих приматов» . Ячейка и микроб . 29 (9): 1437–1453.e8. doi : 10.1016/j.chom.2021.08.002 . PMC 8346325 . PMID 34428428 . S2CID 231676030 .
- ^ Jump up to: а беременный в Сангер Д.Е., Киркпатрик Д.Д., Циммер С., Томас К, Ви С.Л. (2 мая 2020 г.). «С ростом давления глобальная раса за вакцину усиливается» . New York Times . ISSN 0362-4331 . Архивировано из оригинала 11 мая 2020 года . Получено 2 мая 2020 года .
- ^ Jump up to: а беременный в дюймовый Steenhuysen J, Eisler P, Martell A, Nebehay S (27 апреля 2020 года). «Специальный отчет: страны, компании рискуют миллиардами в гонке за вакцину против коронавируса» . Рейтер. Архивировано из оригинала 15 мая 2020 года . Получено 2 мая 2020 года .
- ^ Jeong-ho L, Zheng W, Zhou L (26 января 2020 года). «Китайские ученые мчатся, чтобы развивать вакцину, когда платы за смерть коронавируса» . Южно -Китайский утренний пост . Архивировано из оригинала 26 января 2020 года . Получено 28 января 2020 года .
- ^ Wee SL (4 мая 2020 г.). «Китайский вакцина вакцина в Китае упрощает неспокойную отрасль» . New York Times . ISSN 0362-4331 . Архивировано из оригинала 4 мая 2020 года . Получено 4 мая 2020 года .
- ^ Thorp HH (март 2020 г.). "Underpromise, Overdeliver" . Наука . 367 (6485): 1405. Bibcode : 2020sci ... 367.1405t . doi : 10.1126/science.abb8492 . PMID 32205459 . S2CID 214628067 .
- ^ Блэквелл Т (20 апреля 2020 года). «Исследователи вакцины COVID-19 говорят, что пандемическая блокировка ставит много серьезных препятствий для их работы» . Национальный пост . Архивировано из оригинала 24 апреля 2020 года . Получено 3 мая 2020 года .
- ^ Чен Дж (4 мая 2020 г.). «Covid-19 имеет закрытые лаборатории. Он может поставить в риск поколения исследователей» . Статистика Архивировано из оригинала 6 мая 2020 года . Получено 4 мая 2020 года .
- ^ «Безопасность вакцины - вакцины» . Министерство здравоохранения и социальных служб США. Архивировано из оригинала 22 апреля 2020 года . Получено 13 апреля 2020 года .
- ^ «Процесс разработки лекарств» . США Управление по контролю за продуктами и лекарствами (FDA). 4 января 2018 года. Архивировано с оригинала 22 февраля 2020 года . Получено 12 апреля 2020 года .
- ^ Коэн Дж (июнь 2020 г.). «Пандемические вакцины собираются столкнуться с настоящим тестом» . Наука . 368 (6497): 1295–96. Bibcode : 2020sci ... 368.1295c . doi : 10.1126/science.368.6497.1295 . PMID 32554572 . S2CID 219911109 .
- ^ Dubé E, Laberge C, Guay M, Bramadat P, Roy R, Bettinger J (август 2013 г.). «Вакцинация нерешительности: обзор» . Вакцины и иммунотерапевтические средства . 9 (8): 1763–73. doi : 10.4161/hv.24657 . PMC 3906279 . PMID 23584253 .
- ^ Говард Дж., Стракквалурси V (18 июня 2020 года). «Fauci предупреждает о том, что« антинаучная предвзятость »является проблемой в нас» . CNN . Архивировано из оригинала 21 июня 2020 года . Получено 21 июня 2020 года .
- ^ «Вакцины: процедура аварийного разрешения» . Европейское агентство по лекарственным средствам (EMA). 2020. Архивировано с оригинала 24 сентября 2020 года . Получено 21 августа 2020 года .
- ^ Бирн Дж (19 октября 2020 г.). «Moderna Covid-19 вакцина в рамках процесса обзора Rolling в Канаде, ЕС» . Biopharma-reporter.com, William Reed Business Media Ltd. Архивировал оригинал 25 февраля 2021 года . Получено 25 ноября 2020 года .
- ^ Dangerfield K (20 ноября 2020 г.). «Файлы Pfizer для чрезвычайного использования вакцины вакцины коронавируса в США - как насчет Канады?» Полем Глобальные новости . Архивировано из оригинала 25 января 2021 года . Получено 25 ноября 2020 года .
- ^ «G20 Запускает инициативу для инструментов здравоохранения, необходимых для борьбы с коронавирусом» . Глобус и почта . 25 апреля 2020 года. Архивировано с оригинала 27 апреля 2020 года . Получено 1 февраля 2021 года .
- ^ «Доступ к инструментам COVID-19 (ACT) ускоритель» (PDF) . Всемирная организация здравоохранения (ВОЗ). 24 апреля 2020 года. Архивировано (PDF) из оригинала 25 апреля 2020 года . Получено 1 февраля 2021 года .
- ^ «ACT-Accelerator: часто задаваемые вопросы (FAQ)» . Всемирная организация здравоохранения (ВОЗ). 2020. Архивировано из оригинала 4 мая 2021 года . Получено 16 декабря 2020 года .
- ^ «Обновление о испытании солидарности ВОЗ-ускоряет безопасную и эффективную вакцину COVID-19» . Всемирная организация здравоохранения (ВОЗ). 27 апреля 2020 года. Архивировано с оригинала 30 апреля 2020 года . Получено 2 мая 2020 года .
Очень важно, чтобы мы оценили как можно больше вакцин, поскольку мы не можем предсказать, сколько будет жизнеспособным. Чтобы увеличить шансы на успех (учитывая высокий уровень истощения во время разработки вакцины), мы должны проверить все вакцины кандидатов, пока они не потерпят неудачу. [], Который работает над тем, чтобы у всех них были шансы пройти тестирование на начальном этапе разработки. Результаты для эффективности каждой вакцины ожидаются в течение трех -шести месяцев, и это доказательство в сочетании с данными о безопасности сообщит о решениях о том, можно ли использовать его в более широком масштабе.
- ^ Абеди М (23 марта 2020 г.). «Канада потратить 192 млн долларов на развитие вакцины Covid-19» . Глобальные новости . Архивировано из оригинала 9 апреля 2020 года . Получено 24 марта 2020 года .
- ^ «Правительство Канады на исследования на COVID-19» . Правительство Канады. 23 апреля 2020 года. Архивировано с оригинала 13 мая 2020 года . Получено 4 мая 2020 года .
- ^ Takada N, Satake M (2 мая 2020 г.). «США и Китай выпустят кошельки в гонке за вакцину против коронавируса» . Nikkei Asian Review . Архивировано из оригинала 10 мая 2020 года . Получено 3 мая 2020 года .
- ^ Morriss E (22 апреля 2020 года). «Правительство запускает целевую группу вакцины на коронавирусе, когда начинаются клинические испытания на людях» . Фармафилд. Архивировано из оригинала 26 июня 2020 года . Получено 3 мая 2020 года .
- ^ Kuznia R, Polglase K, Mezzofiore G (1 мая 2020 года). «В поисках вакцины US делает« Big Bet »на компанию с предварительной технологией» . CNN . Архивировано из оригинала 13 мая 2020 года . Получено 2 мая 2020 года .
- ^ Коэн J (май 2020). «Мы из тени выходят из тени» . Наука . 368 (6492): 692–93. Bibcode : 2020sci ... 368..692c . doi : 10.1126/science.368.6492.692 . PMID 32409451 .
- ^ Sink J, Fabian J, Griffin R (15 мая 2020 г.). «Трамп знакомит лидеров« скорости формирования », чтобы ускорить вакцину Covid-19» . Блумберг. Архивировано из оригинала 21 мая 2020 года . Получено 15 мая 2020 года .
- ^ Lahucik K (17 июня 2021 года). «Мы вносят 3 миллиарда долларов США в исследования COVID-19 для разработки противовирусных таблеток в течение года» . Жесткая биотехнология . Архивировано из оригинала 9 октября 2021 года . Получено 11 июля 2021 года .
- ^ Jump up to: а беременный «COVID-19 вакцинам трекер (обновить URL для обновления)» . Vac-lshtm.shinyApps.io . Лондонская школа гигиены и тропической медицины . 12 июля 2021 года . Получено 10 марта 2021 года .
- ^ «Утвержденные вакцины» . Covid 19 вакциновых трекеров, Университет Макгилла. 12 июля 2021 года.
- ^ Ginermaser and, Tike T, Warchesine TE, Weisser K, Kyrtle PA, Eyler Si (июнь 2021 г.). «Тромботическая тромбоцитопения AFT Chadox1 NCOV-19 вакцинация» . Новая Англия Журнал медицины . 384 (22): 2092-101. Doi : 10.1056 / nejmoa2104840 . PMC 80995372 . PMID 33835769 .
- ^ Cines DB, Bussel JB (июнь 2021 г.). «Иммунная тромбоцитопения, вызванная вакциной, индуцированной вакциной, иммунной тромбоцитопении» . Новая Англия Журнал медицины . 384 (23): 2254–2256. doi : 10.1056/nejme2106315 . PMC 8063912 . PMID 33861524 .
- ^ Лю Y, Shao Z, Wang H (декабрь 2021 г.). «Иммунная тромбоцитопения, вызванная вакциной, индуцированной вакциной, иммунной тромбоцитопении» . Исследование тромбоза . 209 : 75–79. doi : 10.1016/j.tromres.2021.12.002 . PMC 8647389 . PMID 34894531 .
- ^ Jump up to: а беременный Klok FA, Pai M, Huisman MV, Makris M (ноябрь 2021 г.). «Индуцированная вакциной иммунной тромботической тромбоцитопении» . Lancet. Гематология . 9 (1): E73 - E80. doi : 10.1016/s2352-3026 (21) 00306-9 . PMC 8585488 . PMID 34774202 .
Хотя изначально несколько терминов были использованы для описания синдрома ... термин, который приобрел широко распространенное использование, является индуцированной вакциной иммунной тромботической тромбоцитопении (VITT). Также использовался тромбоз с синдромом тромбоцитопения, но это более общий термин, который может быть вызван другими условиями
- ^ Jump up to: а беременный в дюймовый Warkentin Te, Pai M (октябрь 2021 г.). «Редакция на Thaler et al. Долгосрочное наблюдение после успешного лечения индуцированной вакциной протромботической иммунной тромбоцитопении. Thromb Res 2021 в прессе». Исследование тромбоза . 207 : 158–160. doi : 10.1016/j.tromres.2021.10.007 . PMID 34757250 . S2CID 239574011 .
Мы считаем, что название «Vitt» работает хорошо… термин явно обозначает ключевые особенности расстройства… обеспечивает полезную мнемонику для распознавания заболеваний в обычной последовательности событий ... не нужно мандатировать, что тромбоз присутствует ... «TTS»… имеет ограниченную клиническую полезность, так как многие условия ... присутствуют с дуадом тромбоза и тромбоцитопении
- ^ Jump up to: а беременный «Использование вакцины Astrazeneca Covid-19 у молодых людей» (пресс-релиз). Здравоохранение Канада. 29 марта 2021 года. Архивировано с оригинала 11 октября 2021 года . Получено 2 апреля 2021 года .
- ^ Long B, Bridwell R, Gottlieb M (ноябрь 2021 г.). «Тромбоз с синдромом тромбоцитопения, связанным с вакцинами Covid-19» . Американский журнал неотложной медицины . 49 : 58–61. doi : 10.1016/j.ajem.2021.05.054 . PMC 8143907 . PMID 34062319 .
- ^ «Вакцина Astrazeneca Covid-19 (AZD1222)» (PDF) . ACIP COVID-19 Экстренное собрание . Astrazeneca. 27 января 2021 года. Архивировано (PDF) от оригинала 27 января 2021 года . Получено 16 апреля 2021 года .
- ^ «Vaxzevria (ранее Covid-19 вакцина Astrazeneca) epar» . Европейское агентство по лекарственным средствам (EMA) . 25 января 2021 года. Архивировано с оригинала 21 апреля 2021 года . Получено 16 апреля 2021 года .
Название вакцины было изменено на Vaxzevria 25 марта 2021 года.
Vaxzevria (вакцина Covid-19 (Chadox1-S Recombinant) EMA/182334/2021 Архивировал 15 апреля 2021 года в текстовом виде машины. текстовом Агентство разрешено при условии, что источник признан. - ^ «Chadox1 NCOV -19 вакцина против вируса короны (рекомбинантный) - Ковишилд» . Сывороточный институт Индии . Архивировано из оригинала 19 апреля 2021 года . Получено 16 апреля 2021 года .
- ^ «Astrazeneca Chadox1-S/NCOV-19 [рекомбинантный], вакцина Covid-19» . Всемирная организация здравоохранения (ВОЗ) . Архивировано из оригинала 28 ноября 2021 года . Получено 28 ноября 2021 года .
- ^ Jump up to: а беременный «Обновление безопасности вакцины COVID-19: vaxzevria» (PDF) . Европейское агентство по лекарственным средствам (EMA). 28 марта 2021 года. Архивировано (PDF) из оригинала 13 апреля 2021 года . Получено 31 марта 2021 года .
- ^ Marks P. «Совместное заявление CDC и FDA о вакцине Johnson & Johnson Covid-19» . Архивировано из оригинала 20 мая 2021 года . Получено 13 апреля 2021 года .
- ^ «Coronavirus (COVID-19) Обновление: FDA ограничивает использование вакцины Janssen Covid-19 для определенных людей» . Управление по контролю за продуктами и лекарствами США . 5 мая 2022 года. Архивировано из оригинала 7 мая 2022 года . Получено 7 мая 2022 года .
- ^ Медицинский директор Astrazeneca AB (13 апреля 2021 года). «Прямое медицинское общение (DHPC): Vaxzevria (ранее вакцина вакцина Covid-19 Astrazeneca): связь между вакциной и возникновением тромбоза в сочетании с тромбоцитопении» (PDF) . Европейское агентство по лекарственным средствам (EMA). Архивировано (PDF) из оригинала 18 июля 2022 года . Получено 13 апреля 2021 года .
- ^ «Исследования и анализ - вакцина вакцины коронавируса - еженедельная резюме отчетности желтых карт» . Регуляторное агентство по лекарствам и продуктам здравоохранения (MHRA). 1 апреля 2021 года. Архивировано с оригинала 20 мая 2021 года . Получено 3 апреля 2020 года .
- ^ EMA (7 апреля 2021 года). EMA Пресс-конференция 7 апреля-Заключение оценки Комитета по оценке риска фармаконадзора (PRAC) вакцины COVID-19 Astrazeneca и тромбоэмболических событий . Европейское агентство по лекарственным средствам (EMA) . Архивировано из оригинала 7 апреля 2021 года . Получено 7 апреля 2021 года - через YouTube.
- ^ Агентства (29 апреля 2024 г.). «Отчет: Astrazeneca призналась в судебном документе, что Covid Vaccine может вызвать редкий побочный эффект [NSTTV] | The New Plaits Times» . NST Online . Архивировано из оригинала 30 апреля 2024 года . Получено 29 апреля 2024 года .
- ^ «В первую очередь Astrazeneca признает, что ее вешанная вакцина может вызвать редкие сгустки крови» . Независимый . 30 апреля 2024 года. Архивировано с оригинала 30 апреля 2024 года . Получено 30 апреля 2024 года .
- ^ «Всемирная организация здравоохранения-Covid-19» . Всемирная организация здравоохранения (ВОЗ). 27 апреля 2020 года. Архивировано с оригинала 29 апреля 2020 года . Получено 2 мая 2020 года .
- ^ Jump up to: а беременный в Тхан Ле Т., Эндридакис З., Кумар А., Гомес Роман Р., Толлефсен С., Савилль М. и др. (Май 2020). «Ландшафт развития вакцины Covid-19» . Природные обзоры. Открытие наркотиков . 19 (5): 305–306. doi : 10.1038/d41573-020-00073-5 . PMID 32273591 .
- ^ Jump up to: а беременный Гейтс Б (февраль 2020 г.). "Отвечая на Covid-19: пандемия раз в веке?" Полем Новая Англия Журнал медицины . 382 (18): 1677–79. doi : 10.1056/nejmp2003762 . PMID 32109012 .
- ^ Fauci AS, Lane HC, Redfield RR (март 2020 г.). «Covid-19: навигация по неизведанному» . Новая Англия Журнал медицины . 382 (13): 1268–69. doi : 10.1056/nejme2002387 . PMC 7121221 . PMID 32109011 .
- ^ Jump up to: а беременный Le TT, Cramer JP, Chen R, Mayhew S (октябрь 2020 г.). «Эволюция ландшафта развития вакцины Covid-19» . Природные обзоры. Открытие наркотиков . 19 (10): 667–668. doi : 10.1038/d41573-020-00151-8 . PMID 32887942 . S2CID 221503034 .
- ^ Weintraub R, Yadav P, Berkley S (2 апреля 2020 года). «Вакцина Covid-19 потребуется справедливое глобальное распределение» . Гарвардский бизнес -обзор . ISSN 0017-8012 . Архивировано из оригинала 9 июня 2020 года . Получено 9 июня 2020 года .
- ^ «Пандемия Covid-19 выявляет риск полагаться на частный сектор для спасительных вакцин, говорит эксперт» . CBC радио . 8 мая 2020 года. Архивировано из оригинала 13 мая 2020 года . Получено 8 июня 2020 года .
- ^ Ахмед Д.Д. (4 июня 2020 года). «Оксфорд, Astrazeneca Covid-19 сделка усиливает« суверенитет вакцины » » . Статистика Архивировано с оригинала 12 июня 2020 года . Получено 8 июня 2020 года .
- ^ Grenfell R, Drew T (14 февраля 2020 года). «Вот почему кто говорит, что вакцина вакцины коронавируса находится в 18 месяцев» . Бизнес -инсайдер . Архивировано из оригинала 5 декабря 2020 года . Получено 11 ноября 2020 года .
- ^ Offit P (13 февраля 2021 года). «Twiv 720: с вакцинами, Offit на нем» . На этой неделе в подкасте вирусологии . Винсент RACANIELLO YouTube Channel. Архивировано из оригинала 25 мая 2021 года . Получено 14 июля 2021 года .
- ^ «Обновление о испытании солидарности ВОЗ-ускоряет безопасную и эффективную вакцину COVID-19» . Всемирная организация здравоохранения (ВОЗ). 27 апреля 2020 года. Архивировано с оригинала 30 апреля 2020 года . Получено 2 мая 2020 года .
Очень важно, чтобы мы оценили как можно больше вакцин, поскольку мы не можем предсказать, сколько будет жизнеспособным. Чтобы увеличить шансы на успех (учитывая высокий уровень истощения во время разработки вакцины), мы должны проверить все вакцины кандидатов, пока они не потерпят неудачу. [], Который работает над тем, чтобы у всех них были шансы пройти тестирование на начальном этапе разработки. Результаты для эффективности каждой вакцины ожидаются в течение трех -шести месяцев, и это доказательство в сочетании с данными о безопасности сообщит о решениях о том, можно ли использовать ее в более широком масштабе.
- ^ Yamey G, Schäferhoff M, Chatchett R, Pate M, Zhao F, McDade KK (май 2020). «Обеспечение глобального доступа к вакцинам Covid -19» . Лансет . 395 (10234): 1405–06. doi : 10.1016/s0140-6736 (20) 30763-7 . PMC 7271264 . PMID 32243778 .
По оценкам CEPI, разработка до трех вакцин в течение следующих 12–18 месяцев потребует инвестиций не менее 2 миллиардов долларов США . Эта оценка включает в себя клинические испытания фазы 1 восьми кандидатов на вакцину, прогрессирование до шести кандидатов в результате испытаний фазы 2 и 3, завершение требований к регулированию и качеству как минимум для трех вакцин, а также повышение глобальной производственной мощности для трех вакцин.
- ^ «Кто« поддерживал аварийное использование Китая »экспериментальных вакцин Covid-19» . Южно -Китайский утренний пост . 25 сентября 2020 года. Архивировано с оригинала 26 сентября 2020 года . Получено 26 сентября 2020 года .
- ^ Крамер А.Е. (19 сентября 2020 г.). «Россия медленно вводит вирусную вакцину, несмотря на одобрение Кремля» . New York Times . ISSN 0362-4331 . Архивировано из оригинала 27 сентября 2020 года . Получено 28 сентября 2020 года .
- ^ «Pfizer и Biontech для подачи запроса на аварийное использование в США сегодня для вакцины COVID-19 для COVID-19» . Pfizer (пресс -релиз). 20 ноября 2020 года. Архивировано с оригинала 29 января 2021 года . Получено 20 ноября 2020 года .
- ^ Парк А (20 ноября 2020 г.). «Эксклюзив: генеральный директор Pfizer обсуждает отправку первого запроса на очистку вакцин Covid-19 в FDA» . Время . Архивировано из оригинала 29 января 2021 года . Получено 20 ноября 2020 года .
- ^ «Информация для медицинских работников о вакцине Pfizer/Biontech Covid-19» . Регулирующее агентство по лекарственным средствам и здравоохранению (MHRA) . 8 декабря 2020 года. Архивировано с оригинала 15 марта 2021 года . Получено 13 декабря 2020 года .
- ^ «Условия авторизации для вакцины Pfizer/Biontech Covid-19» . Регуляторное агентство по лекарствам и продуктам здравоохранения (MHRA) . 3 декабря 2020 года. Архивировано с оригинала 26 февраля 2021 года . Получено 19 декабря 2020 года .
- ^ «Регулятор лекарств в Великобритании дает одобрение для первой вакцины в COVID-19 в Великобритании» . Регулирующее агентство по лекарственным средствам и здравоохранению, правительство Великобритании. 2 декабря 2020 года. Архивировано с оригинала 17 марта 2021 года . Получено 2 декабря 2020 года .
- ^ Мюллер Б (2 декабря 2020 года). «Великобритания одобряет вакцину вакцины Pfizer Coronavirus, первую на западе» . New York Times . Архивировано из оригинала 28 января 2021 года . Получено 2 декабря 2020 года .
- ^ Робертс М (2 декабря 2020 г.). «Covid Pfizer Vaccine утверждена для использования на следующей неделе в Великобритании» . BBC News Online . Архивировано из оригинала 2 декабря 2020 года . Получено 2 декабря 2020 года .
- ^ «Вопросы и ответы: вакцинация Covid-19 в ЕС» . Европейская комиссия . 21 декабря 2020 года. Архивировано с оригинала 29 января 2021 года . Получено 21 декабря 2020 года .
- ^ «Bahrain Second в мире, чтобы утвердить вакцину Covid-19 Pfizer/Biontech» . Агентство Bahrain. 4 декабря 2020 года. Архивировано с оригинала 17 декабря 2020 года . Получено 9 декабря 2020 года .
- ^ «ОАЭ: Министерство здравоохранения объявляет о 86 -процентной эффективности вакцины» . Gulf News . Архивировано из оригинала 24 декабря 2020 года . Получено 9 декабря 2020 года .
- ^ Томас К, Лафраниер С., Вейланд Н., Гудноу А., Хаберман М. (12 декабря 2020 г.). «FDA очищает вакцину против Pfizer, а миллионы доз будут отправлены сразу же» . New York Times . Архивировано из оригинала 12 декабря 2020 года . Получено 12 декабря 2020 года .
- ^ «FDA предпринимает дополнительные действия в борьбе с Covid-19, выпустив разрешение на чрезвычайное использование для второй вакцины Covid-19» . США Управление по контролю за продуктами и лекарствами (FDA) (пресс -релиз). Архивировано из оригинала 17 марта 2021 года . Получено 18 декабря 2020 года .
- ^ Оливер С.Е., Гаргано Дж.В., Марин М., Уоллес М, Курран К.Г., Чемберленд М. и др. (Январь 2021 г.). «Промежуточная рекомендация консультативного комитета по практике иммунизации по использованию вакцины COVID -19 Moderna - Соединенные Штаты, декабрь 2020 года» (PDF) . Ммвр. Еженедельный отчет о заболеваемости и смертности . 69 (5152): 1653–56. doi : 10.15585/mmwr.mm695152e1 . PMC 9191904 . PMID 33382675 . S2CID 229945697 . Архивировано (PDF) из оригинала 9 февраля 2021 года . Получено 18 января 2021 года .
- ^ Lovelace JR B (19 декабря 2020 г.). «FDA одобряет вторую COVID VACCINE для чрезвычайного использования, поскольку она очищает Moderna для распределения США» . CNBC. Архивировано из оригинала 26 января 2021 года . Получено 19 декабря 2020 года .
- ^ Corum J, Zimmer C (17 декабря 2020 г.). «Как работает вакцина против Оксфорд-астразенека» . New York Times . Архивировано из оригинала 5 января 2022 года . Получено 2 мая 2021 года .
- ^ Tétrault-Farber M, Vasilyeva G (31 марта 2021 г.). «Россия регистрирует первую в мире вакцину COVID-19 для животных» . Рейтер . Архивировано из оригинала 17 декабря 2021 года . Получено 4 апреля 2021 года .
- ^ "В России зарегистрировали первую в мире вакцину против COVID-19 для животных" [The world's first COVID-19 vaccine for animals was registered in Russia]. TASS (in Russian). Moscow. 31 March 2021. Archived from the original on 19 May 2021 . Retrieved 19 May 2021 .
- ^ Moritsugu K (26 октября 2022 г.). «Боитесь игл? Китай использует вдыхаемую вакцину с Covid-19» . AP News . Получено 2 ноября 2022 года .
- ^ Hotez PJ, Bottazzi Me (январь 2022 г.). «Целые инактивированные вирус и белковые вакцины на основе белков» . Ежегодный обзор медицины . 73 (1): 55–64. doi : 10.1146/annurev-med-042420-113212 . PMID 34637324 . S2CID 238747462 .
- ^ Ye Y, Zhang Q, Wei X, Cao Z, Yuan HY, Zeng DD (февраль 2022 г.). «Справедливый доступ к вакцинам COVID-19 имеет жизненно важное значение для всех стран» . Природа человеческое поведение . 6 (2): 207–216. doi : 10.1038/s41562-022-01289-8 . PMC 8873023 . PMID 35102361 .
- ^ Ли Проктор, полные нуклеотидные базовые последовательности для всех ковидных вакцин, одобренных MRHA , WathdotheyKnow , Wikidata Q109371097
- ^ Тейлор Р (2 ноября 2021 года). «Последовательности вакцин COVID-19, выпущенные через WhatDotheyKnow» . mysociety . Архивировано из оригинала 5 ноября 2021 года . Получено 2 ноября 2021 года .
- ^ «Данные о смертности COVID-19 с помощью статуса вакцинации» . Наш мир в данных (данные CDC). Апрель 2023 г. Архивировано из оригинала 16 октября 2023 года.
Источник данных: Центры по контролю и профилактике заболеваний, Группа прорывного прорыва/наблюдения и аналитики вакцины.
- ^ Yang Zr, Jiang YW, Li FX, Liu D, Lin TF, Zhao ZY, et al. (Апрель 2023 г.). «Эффективность вакцин вакцин SARS-COV-2 и взаимосвязь дозы-ответа с тремя основными антителами: систематический обзор и метаанализ рандомизированных контролируемых исследований» . Lancet. Микроб . 4 (4): E236 - E246. doi : 10.1016/s2666-5247 (22) 00390-1 . PMC 9974155 . PMID 36868258 .
- ^ Холкомб М., Уолдроп Т (11 сентября 2021 г.). «Исследование CDC: невакцинированное в 11 раз чаще умирает от Covid-19» . CNN . Получено 11 сентября 2021 года .
- ^ Scobie HM, Johnson AG, Suthar AB, Severson R, Alden NB, Balter S, et al. (Сентябрь 2021 г.). «Мониторинг заболеваемости по делам COVID-19, госпитализации и смерти, по статусу вакцинации-13 юрисдикций США, 4 апреля 17 июля 2021 года» (PDF) . Ммвр. Еженедельный отчет о заболеваемости и смертности . 70 (37): 1284–1290. doi : 10.15585/mmwr.mm7037e1 . PMC 8445374 . PMID 34529637 .
- ^ Fowlkes A, Gaglani M, Groover K, Theiese MS, Tyner H, Ellingson K (август 2021 г.). «Эффективность вакцин COVID-19 в предотвращении инфекции SARS-COV-2 среди передовых работников до и во время варианта B.1.617.2 (Delta) преобладает-восемь мест США, декабрь 2020 г.-август 2021» (PDF) . Ммвр. Еженедельный отчет о заболеваемости и смертности . 70 (34): 1167–1169. doi : 10.15585/mmwr.mm7034e4 . PMC 8389394 . PMID 34437521 .
- ^ Schreiber M, Chayka K, Chayka K, Beyerstein L, Beyerstein L, Wilson J, et al. (1 июля 2021 г.). «Срочное послание варианта Delta Covid для Америки» . Новая республика . ISSN 0028-6583 . Архивировано из оригинала 28 августа 2021 года . Получено 28 октября 2021 года .
- ^ «Среди невакцинированного варианта Delta более чем удваивается риск госпитализации» . Los Angeles Times . 28 августа 2021 года. Архивировано с оригинала 8 ноября 2021 года.
- ^ «WHO/ECDC: почти полмиллиона жизней, спасенных за счет вакцинации COVID-19 менее чем за год» . 25 ноября 2021 года.
- ^ «Коронавирус (COVID-19) Booster Vaccine» . NHS . Государственная цифровая служба. 17 сентября 2021 года . Получено 11 декабря 2021 года .
- ^ Варианты SARS-COV-2, вызывающие озабоченность и варианты, исследуемые в Англии, технический брифинг 31 (PDF) (брифинг). Общественное здравоохранение Англия. 10 декабря 2021 года. С. 3–5, 20–22. Правительство-10645. Архивировано (PDF) из оригинала 18 декабря 2021 года . Получено 10 декабря 2021 года .
- ^ Gore D (9 февраля 2022 г.). «Последние данные CDC: взрослые взрослые в 97 раз чаще умирают от COVID-19, чем повышенные взрослые» . Factcheck.org . Получено 11 февраля 2022 года .
- ^ Lee AR, Wong Sy, Chai Ly, Lee SC, Lee MX, Muthiah MD, et al. (Март 2022 г.). «Эффективность вакцин с Covid-19 у пациентов с иммунитетом: систематический обзор и метаанализ» . BMJ . 376 : E068632. doi : 10.1136/bmj-2021-068632 . PMC 8889026 . PMID 35236664 .
- ^ Greenberger LM, Saltzman LA, Senefeld JW, Johnson PW, Degennaro LJ, Nichols GL (август 2021 г.). «Ответ антител на вакцины SARS-COV-2 у пациентов с гематологическими злокачественными новообразованиями» . Раковая клетка . 39 (8): 1031–1033. doi : 10.1016/j.ccell.2021.07.012 . PMC 8295014 . PMID 34331856 .
- ^ Stein C, Nasereldine H, Sorensen RJ, Amlag JO, Bisignano C, Byrne S, et al. (Февраль 2023 г.). «Прошлая защита инфекции SARS-COV-2 от повторного заражения: систематический обзор и метаанализ» . Lancet . 401 (10379): 833–842. doi : 10.1016/s0140-6736 (22) 02465-5 . ISSN 0140-6736 . PMC 9998097 . PMID 36930674 .
- ^ Пейн А.Б. (2024). «Эффективность двувалентных вакцин COVID-19 мРНК в предотвращении ковид-19, связанных с тромбоэмболическими событиями среди участников Medicare, в возрасте ≥65 лет, а также с конечной стадией почечной болезни-Соединенные Штаты, сентябрь 2022-марта 2023 года» . Ммвр. Еженедельный отчет о заболеваемости и смертности . 73 (1): 16–23. doi : 10.15585/mmwr.mm7301a4 . ISSN 0149-2195 . PMC 10794061 . PMID 38206877 . Архивировано из оригинала 14 января 2024 года . Получено 14 января 2024 года .
- ^ Крот B (12 января 2024 г.). «Ковидные выстрелы защищают от связанных с проковидами инсультов, сердечных приступов, обнаруживает исследование» . Ars Technica . Архивировано из оригинала 14 января 2024 года . Получено 14 января 2024 года .
- ^ Каталонский М., Рынок-Бесайвер Н., Колде Р., Ллот Н.Т., Роэл Е., Берн Е. и Ал. (Март 2024). COVID -19 Lancet. Респираторная медицина 12 (3): 225–236. два 10.1016/s2213-2600(23)00414-9: 38219763PMID
- ^ «Вакцины снижают риск длинного проковида» . Доказательства NIHR . 2024. doi : 10.3310/nihrevidence_63203 .
- ^ Jump up to: а беременный в дюймовый и фон «Научная информация: SARS-COV-2-индуцированный и индуцированный иммунитет» . Центры для контроля и профилактики заболеваний (CDC) . 29 октября 2021 года. Архивировано с оригинала 4 декабря 2021 года . Получено 4 декабря 2021 года .
 Эта статья включает текст из этого источника, который находится в общественном доступе .
Эта статья включает текст из этого источника, который находится в общественном доступе .
- ^ Левин Эг, Люстиг Ю., Коэн С., Фрусс Р., Индденбаум В., Амит С. и др. (Декабрь 2021 г.). «Отвратительный иммунный гуморальный ответ на вакцину BNT162B2 COVID-19 в течение 6 месяцев» . Новая Англия Журнал медицины . 385 (24): E84. doi : 10.1056/nejmoa2114583 . PMC 8522797 . PMID 34614326 .
- ^ "Covid-19 Booster Shot" . Центры для контроля и профилактики заболеваний . 29 ноября 2021 года. Архивировано с оригинала 21 августа 2021 года . Получено 4 декабря 2021 года .
- ^ Jump up to: а беременный в Devlin H (18 марта 2022 г.). «Ковидный иммунитет снижается в жителей домах в Англии, учится» . Хранитель . Архивировано из оригинала 23 марта 2022 года . Получено 12 мая 2022 года .
- ^ Kimball S. «CDC рекомендует четвертую доз вакцины Pfizer и Moderna для людей в возрасте 50 лет и старше» . CNBC . Архивировано из оригинала 3 сентября 2022 года . Получено 22 августа 2022 года .
- ^ "Коронавирус заболевание 2019" . Центры для контроля и профилактики заболеваний (пресс -релиз). 29 марта 2022 года. Архивировано с оригинала 1 сентября 2022 года . Получено 22 августа 2022 года .
- ^ Wang R, Chen J, Wei GW (декабрь 2021 г.). «Механизмы эволюции SARS-COV-2, выявляющие устойчивые к вакцинам мутации в Европе и Америке» (PDF) . Журнал писем физической химии . 12 (49): 11850–11857. doi : 10.1021/acs.jpclett.1c03380 . PMC 8672435 . PMID 34873910 . Архивировано (PDF) из оригинала 18 декабря 2021 года . Получено 27 января 2022 года .
- ^ «Результаты исследования показывают, что распространение омикрона может быть приписано иммунной уклонению, а не увеличению передачи» . News-medical.net . 5 января 2022 года. Архивировано с оригинала 21 января 2022 года . Получено 17 января 2022 года .
- ^ Cao Y, Wang J, Jian F, Xiao T, Song W, Yisimayi A, et al. (Февраль 2022 г.). «Омикрон ускользает от большинства существующих нейтрализующих антител SARS-COV-2» . Природа . 602 (7898): 657–663. doi : 10.1038/d41586-021-03796-6 . PMC 8866119 . PMID 35016194 . S2CID 245455422 .
- ^ Liu L, Iketani S, Guo Y, Chan JF, Wang M, Liu L, et al. (Февраль 2022 г.). «Поразительное уклонение от антител проявляется вариантом Omicron SARS-Cov-2» . Природа . 602 (7898): 676–681. doi : 10.1038/d41586-021-03826-3 . PMID 35016198 . S2CID 245462866 .
- ^ Mohsin M, Mahmud S (май 2022). «Omicron SARS-COV-2 вариант беспокойства: обзор его передачи, иммунной уклонения, реинфекции и тяжести» . Лекарство . 101 (19): E29165. doi : 10.1097/md.0000000000029165 . PMC 9276130 . PMID 35583528 . S2CID 248858919 .
- ^ "Как скоро после того, как поймал Covid-19, можете ли вы получить его снова?" Полем ABC News . 2 мая 2022 года. Архивировано с оригинала 9 июля 2022 года . Получено 24 июня 2022 года .
- ^ «Вариант Omicron: что вам нужно знать» . Центры для контроля и профилактики заболеваний . 20 декабря 2021 года. Архивировано с оригинала 27 января 2022 года . Получено 27 января 2022 года .
- ^ Шин Д.Х., Смит Д.М., Чой Дж.Ю. (2022). «SARS-COV-2 Omicron Variant, вызывающий беспокойство: все, что вы хотели знать об Omicron, но боялись спросить» . Йонсеи Медицинский журнал . 63 (11): 977–983. doi : 10.3349/ymj.2022.0383 . PMC 9629902 . PMID 36303305 .
- ^ "Covid-19 вакцин-бустеры" . США Управление по контролю за продуктами и лекарствами (FDA). 27 сентября 2022 года. Архивировано с оригинала 8 октября 2022 года . Получено 8 октября 2022 года .
- ^ «Модерна вакцины Covid-19» . США Управление по контролю за продуктами и лекарствами (FDA) . 7 октября 2022 года. Архивировано с оригинала 7 октября 2022 года . Получено 8 октября 2022 года .
- ^ «Вакцины Pfizer-Biontech Covid-19» . США Управление по контролю за продуктами и лекарствами (FDA) . 3 октября 2022 года. Архивировано с оригинала 8 октября 2022 года . Получено 8 октября 2022 года .
- ^ «Обновленные вакцины COVID-19 для использования в Соединенных Штатах, начиная с осени 2023 года» . США Управление по контролю за продуктами и лекарствами (FDA) . 15 июня 2023 года. Архивировано с оригинала 17 июня 2023 года . Получено 16 июня 2023 года .
 Эта статья включает текст из этого источника, который находится в общественном доступе .
Эта статья включает текст из этого источника, который находится в общественном доступе .
- ^ Рекомендация для формулы вакцин вакцин COVID-19 в США (PDF) ( отчет) (отчет). США Управление по контролю за продуктами и лекарствами (FDA). 16 июня 2023 года. Архивировано с оригинала 16 июня 2023 года . Получено 16 июня 2023 года .
- ^ «Обновленные вакцины COVID-19 для использования в Соединенных Штатах, начиная с осени 2024 года» . США Управление по контролю за продуктами и лекарствами (FDA) . 5 июня 2024 года. Архивировано с оригинала 18 июня 2024 года . Получено 19 июня 2024 года .
 Эта статья включает текст из этого источника, который находится в общественном доступе .
Эта статья включает текст из этого источника, который находится в общественном доступе .
- ^ Синганаягам А., Хакки С., Даннинг Дж., Мадон К.Дж., Крона М.А., Койчева А. и др. (Февраль 2022 г.). «Кинетика передачи сообщества и вирусная нагрузка варианта Delta SARS-COV-2 (B.1.617.2) у вакцинированных и невакцинированных людей в Великобритании: проспективное, продольное, когортное исследование» . Lancet. Заразительные заболевания . 22 (2): 183–195. doi : 10.1016/s1473-3099 (21) 00648-4 . PMC 8554486 . PMID 34756186 .
- ^ Callaway E (октябрь 2021 г.). «Смешивание и матч Covid Vaccines Ace тест на эффективность». Природа . doi : 10.1038/d41586-021-02853-4 . PMID 34675430 . S2CID 239455075 .
- ^ Rashedi R, Samieefar N, Masoumi N, Mohseni S, Rezaei N (апрель 2022 г.). «Вакцины Covid-19 смешиваются: концепция, эффективность и сомнения» . Журнал медицинской вирусологии . 94 (4): 1294–1299. doi : 10.1002/jmv.27463 . PMC 8661746 . PMID 34796525 .
- ^ Kouhpayeh H, Ansari H (август 2022 г.). «Неблагоприятные события после вакцинации COVID-19: систематический обзор и метаанализ» . Международная иммунофармакология . 109 : 108906. DOI : 10.1016/j.intimp.2022.108906 . PMC 9148928 . PMID 35671640 .
- ^ Graña C, Ghosn L, Evreneglou T, Jarde A, Minozzi S, Bergman H, et al. (Декабрь 2022 г.). «Эффективность и безопасность вакцин Covid-19» . Кокрановская база данных систематических обзоров . 12 (12): CD015477. doi : 10.1002/14651858.cd015477 . PMC 9726273 . PMID 36473651 .
- ^ Haas JW, Bender FL, Ballou S, Kelley JM, Wilhelm M, Miller FG, et al. (Январь 2022). «Частота нежелательных явлений в вооружении плацебо в испытаниях вакцины Covid-19: систематический обзор и метаанализ» . Джама сеть открыта . 5 (1): E2143955. doi : 10.1001/jamanetworkopen.2021.43955 . PMC 8767431 . PMID 35040967 .
- ^ Polania Gutierrez JJ, Munakomi S (январь 2020 г.). «Внутримышечная инъекция» . Statpearls . Остров сокровищ (Флорида): Statpearls Publishing. PMID 32310581 . Архивировано из оригинала 8 декабря 2020 года . Получено 24 июля 2021 года .
- ^ Jump up to: а беременный в дюймовый Huang Z, Su Y, Zhang T, Xia N (февраль 2022 г.). «Обзор безопасности и эффективности текущих вакцин Covid-19» . Границы медицины . 16 (1): 39–55. doi : 10.1007/s11684-021-0893-y . PMC 8815389 . PMID 35122210 .
- ^ Tu W, Gierada DS, Joe Bn (май 2021). «Лимфаденопатия, связанная с вакцинацией COVID-19: о чем знать» . Радиология. Визуализация рака . 3 (3): E210038. doi : 10.1148/rycan.2021210038 . PMC 8049171 . PMID 33874733 .
- ^ «Неклиническая оценка отчет: BNT162B2 [мРНК] вакцина COVID-19» (PDF) . Австралийский департамент здравоохранения: Администрация терапевтических товаров . Архивировано (PDF) из оригинала 28 марта 2023 года . Получено 25 марта 2023 года .
- ^ Jump up to: а беременный в дюймовый и Мужчина V (январь 2022 г.). «Менструация и вакцинация вакцинации Covid-19» . BMJ . 376 : O142. doi : 10.1136/bmj.o142 . HDL : 10044/1/94577 . PMID 35082132 . S2CID 246287912 .
- ^ Монтгомери Дж., Райан М., Энглер Р., Хоффман Д., Маккленатан Б., Коллинз Л. и др. (Октябрь 2021 г.). «Миокардит после иммунизации с вакцинами COVID-19 мРНК у военных американских военных» . Джама кардиология . 6 (10): 1202–06. doi : 10.1001/jamacardio.2021.2833 . PMC 8243257 . PMID 34185045 .
- ^ «Всемирная организация здравоохранения (ВОЗ)» . 17 сентября 2018 года. Архивировано с оригинала 4 октября 2023 года . Получено 19 сентября 2023 года .
- ^ Макдональд Дж (23 декабря 2021 г.). «Увеличение отчетов VAERS COVID-19 из-за требований отчетности, интенсивного изучения широко данных вакцин» . Factcheck.org . Архивировано из оригинала 20 мая 2022 года . Получено 20 мая 2022 года .
- ^ «Лечение пост-вак-синромом» . Deutsche Welle . 11 октября 2022 года. Архивировано с оригинала 17 апреля 2023 года.
- ^ «Специальный час консультации после VAX» [Специальная консультация после VAC]. Университетская больница Giessen и Marburg (UKGM) (на немецком языке). Архивировано из оригинала 4 мая 2023 года.
- ^ «Ущерб для вакцинации в короне: Университетская больница Марбург открывает свою собственную машину скорой помощи» [Ущерб для вакцины в короне: больница Университета Марбурга открывает свою собственную амбулаторную клинику]. Франкфуртер Allgemeine Zeitung GmbH (на немецком языке). 3 апреля 2023 года. Архивировано с оригинала 8 марта 2024 года.
- ^ Frontera JA, Tamborska AA, Doheim MF, Garcia-Azorin D, Gezegen H, Guekht A, et al. (Март 2022 г.). «Неврологические события зарегистрированы после вакцин COVID-19: анализ VAER» . Анналы неврологии . 91 (6): 756–771. doi : 10.1002/ana.26339 . PMC 9082459 . PMID 35233819 .
- ^ Jump up to: а беременный в дюймовый Альтманн Д.М., Бойтон Р.Дж. (март 2022 г.). «Вакцинация Covid-19: дорога впереди». Наука . 375 (6585): 1127–1132. Bibcode : 2022sci ... 375.1127a . doi : 10.1126/science.abn1755 . PMID 35271316 . S2CID 247384207 .
- ^ Jump up to: а беременный COVID-19 вакцин Обновление безопасности (PDF) (отчет). Архивировано (PDF) из оригинала 3 августа 2022 года . Получено 6 сентября 2022 года .
- ^ Бассо С (октябрь 2022 г.). "Миокардит". Новая Англия Журнал медицины . 387 (16): 1488–1500. doi : 10.1056/nejmra2114478 . HDL : 11577/3479721 . PMID 36260793 . S2CID 240234869 .
- ^ Witberg G, Barda N, Hoss S, Richter I, Wiessman M, Aviv Y, et al. (Декабрь 2021 г.). «Миокардит после вакцинации Covid-19 в крупной организации здравоохранения» . Новая Англия Журнал медицины . 385 (23): 2132–2139. doi : 10.1056/nejmoa2110737 . PMC 8531986 . PMID 34614329 . S2CID 238421512 .
- ^ Jump up to: а беременный Патоне М., Мей XW, Хандннетти Л., Диксон С., Заккарди Ф., Шанкар-Хари М. и др. (Сентябрь 2022 г.). «Риск миокардита после последовательных доз вакцины Covid-19 и инфекции SARS-COV-2 по возрасту и полу» . Циркуляция . 146 (10): 743–754. doi : 10.1161/circulationaha.122.059970 . PMC 9439633 . PMID 35993236 .
- ^ Chen Y, Xu Z, Wang P, Li XM, Shuai ZW, Ye DQ, et al. (Апрель 2022 г.). «Новые аутоиммунные явления после коврика после коврика» . Иммунология . 165 (4): 386–401. doi : 10.1111/imm.13443 . PMID 34957554 . S2CID 245522029 .
- ^ Jafari Z, Kolb BE, Mohajerani MH (март 2022 г.). «Потеря слуха, шум в ушах и головокружение в Covid-19: систематический обзор и метаанализ» . Канадский журнал неврологических наук . 49 (2): 184–195. doi : 10.1017/cjn.2021.63 . PMC 8267343 . PMID 33843530 .
- ^ Сломски А (май 2022). «Исследования исследуют риск потери слуха после вакцинации COVID-19» . Джама . 327 (17): 1641. DOI : 10.1001/JAMA.2022.6719 . PMID 35503358 . S2CID 248502943 .
- ^ Дорни И., Бобак Л., Оттесон Т., Келбер, округ Колумбия (сентябрь 2022 г.). «Распространенность нового в ушах в ушах после вакцинации COVID-19 с сравнением с другими прививками» . Ларингоскоп . 133 (7): 1722–1725. doi : 10.1002/lary.30395 . PMC 9539087 . PMID 36098476 .
- ^ Матье Э, Ричи Х и к. (2020–2024). "Коронавирус пандемия (Covid-19) " Наш мир в данных Получено 21 сентября
- ^ Матье Э, Ричи Х, (2020). "Коронавирус пандемия (Covid-19) " Наш мир в данных Получено 14 ноября
- ^ Матье Е., Ричи Х, Ортис-Оспина Е., Розер М., Хаселл Дж., Аппель С. и др. (2021). «Глобальная база данных прививок COVID-19» . Природа человеческое поведение . 5 (7): 947–953. doi : 10.1038/s41562-021-01122-8 . PMID 33972767 .
- ^ Ричи Х., Ортис-Оспина Е., Белтекиан Д., Метеу Е., Хаселл Дж., Макдональд Б. и др. (1 сентября 2021 г.). «Вакцинации коронавируса (COVID -19) - статистика и исследования» . Наш мир в данных . Архивировано из оригинала 10 марта 2021 года . Получено 26 января 2021 года .
- ^ «Обновление о испытании солидарности ВОЗ-ускоряет безопасную и эффективную вакцину COVID-19» . Всемирная организация здравоохранения (ВОЗ). 27 апреля 2020 года. Архивировано с оригинала 30 апреля 2020 года . Получено 2 мая 2020 года .
Очень важно, чтобы мы оценили как можно больше вакцин, поскольку мы не можем предсказать, сколько будет жизнеспособным. Чтобы увеличить шансы на успех (учитывая высокий уровень истощения во время разработки вакцины), мы должны проверить все вакцины кандидатов, пока они не потерпят неудачу. Всемирная организация здравоохранения (ВОЗ) работает над тем, чтобы все они имели шанс пройти тестирование на начальном этапе развития. Результаты для эффективности каждой вакцины ожидаются в течение трех -шести месяцев, и это доказательство в сочетании с данными о безопасности сообщит о решениях о том, можно ли использовать ее в более широком масштабе.
- ^ Jump up to: а беременный Гейтс Б (апрель 2020 г.). "Отвечая на Covid-19-пандемия раз в веке?" Полем Новая Англия Журнал медицины . 382 (18): 1677–1679. doi : 10.1056/nejmp2003762 . PMID 32109012 .
- ^ Weintraub R, Yadav P, Berkley S (2 апреля 2020 года). «Вакцина Covid-19 потребуется справедливое глобальное распределение» . Гарвардский бизнес -обзор . ISSN 0017-8012 . Архивировано из оригинала 9 июня 2020 года . Получено 9 июня 2020 года .
- ^ Jump up to: а беременный в Steenhuysen J, Eisler P, Martell A, Nebehay S (27 апреля 2020 года). «Специальный отчет: страны, компании рискуют миллиардами в гонке за вакцину против коронавируса» . Рейтер. Архивировано из оригинала 15 мая 2020 года . Получено 2 мая 2020 года .
- ^ Gartner A, Roberts L (3 мая 2020 г.). «Насколько близко мы к вакцине вакцины на коронавирусе? Последние новости о британских испытаниях» . Телеграф . ISSN 0307-1235 . Архивировано из оригинала 4 мая 2020 года . Получено 3 мая 2020 года .
- ^ «Кто, ООН, изложил шаги для достижения мировых целей вакцинации вещей» . Всемирная организация здравоохранения (ВОЗ). 7 октября 2021 года. Архивировано с оригинала 31 декабря 2021 года . Получено 31 декабря 2021 года .
- ^ «Covid-19: кто призывает страны прививать 70% своего населения к середине 2022 года» . 29 декабря 2021 года. Архивировано с оригинала 31 декабря 2021 года . Получено 31 декабря 2021 года .
- ^ «Вакцинации Covid-19: африканские страны пропускают, кто нацелен» . Би -би -си . 31 декабря 2021 года. Архивировано с оригинала 31 декабря 2021 года . Получено 31 декабря 2021 года .
- ^ Jump up to: а беременный в дюймовый Редакторы инфекционных заболеваний Lancet (сентябрь 2021 г.). «Covid-19 вакцина, справедливость и бустерные дозы» . Lancet инфекционные заболевания . 21 (9): 1193. DOI : 10.1016/S1473-3099 (21) 00486-2 . PMC 8360703 . PMID 34391506 .
- ^ Adhanom Ghebreyesus T (18 января 2021 г.). «Вступительные замечания ВОЗ Генерального директора на 148-й сессии Исполнительного совета» . Всемирная организация здравоохранения (ВОЗ) . Архивировано из оригинала 12 ноября 2021 года . Получено 25 января 2021 года .
- ^ «На США давление на Бразилию, чтобы отказаться от российской вакцины Vputnik V» . Бразильский отчет . 15 марта 2021 года. Архивировано с оригинала 15 марта 2021 года . Получено 21 марта 2021 года .
- ^ Холмс О (16 февраля 2021 г.). «Израиль заблокировал проковидные вакцины от въезда в Газу, скажем, палестинцы» . Хранитель . Архивировано из оригинала 16 февраля 2021 года . Получено 17 февраля 2021 года .
- ^ Расгон А (4 февраля 2021 г.). «Успех вакцины Израиля выпускает дебаты о палестинском неравенстве» . New York Times . Архивировано из оригинала 28 декабря 2021 года . Получено 17 февраля 2021 года .
- ^ Хортон С (17 февраля 2021 года). «Тайвань, касающийся Китая, возможно, заблокировал покупку вакцины» . Блумберг . Архивировано из оригинала 17 февраля 2021 года . Получено 17 февраля 2021 года .
- ^ «Игра в политику с бедностью: стратегия вакцины COVID-19 в COVID-19» . Карнеги -фонд для международного мира . Архивировано из оригинала 28 февраля 2021 года . Получено 25 февраля 2021 года .
- ^ Strazewski L (9 февраля 2021 года). «Доктор Фауци: Варианты показывают вакцинацию COVID-19 как глобальную работу» . Американская медицинская ассоциация . Архивировано из оригинала 10 октября 2021 года . Получено 4 марта 2021 года .
- ^ Bergmark E, Wierson A (26 февраля 2021 года). «Мнение: Без глобального плана вакцины варианты коронавируса могут привести к неисчислимому количеству смертей» . CNN . Архивировано из оригинала 19 октября 2021 года . Получено 4 марта 2021 года .
- ^ Blenkinsop P, Maclean W, Ellis A (10 марта 2021 г.). «Богатые, развивающиеся страны сражаются на велосипедные патенты на вакцину» . Рейтер . Архивировано из оригинала 11 марта 2021 года . Получено 19 июня 2021 года .
- ^ Macias AM, Breuninger K, Franck (5 мая 2021 г.). «Мы поддерживают защиту от патентов для веровых вакцин, ссылаясь на глобальный кризис в области здравоохранения» . CNBC . Архивировано из оригинала 5 мая 2021 года . Получено 5 мая 2021 года .
- ^ Санчес Николас Э (11 июня 2021 года). «Давление накапливается на ЕС, чтобы поддержать отказа от вакцины в ВТО» . Euobserver . Архивировано из оригинала 19 октября 2021 года . Получено 14 июня 2021 года .
- ^ «Кто говорит против доказательства вакцинации COVID-19 для международных поездок» . Южно -Китайский утренний пост . 20 апреля 2021 года. Архивировано с оригинала 3 мая 2021 года . Получено 17 мая 2021 года .
- ^ Гудман П.С., Мандавилли А., Роббинс Р., Стевис-Гриднефф М (15 мая 2021 г.). "Что нужно, чтобы прививать мир против Covid?" Полем New York Times . ISSN 0362-4331 . Архивировано из оригинала 15 мая 2021 года . Получено 17 мая 2021 года .
- ^ Muniz B, Fonseca B, Fernandes L, Pina R (15 марта 2021 г.). «Бразилия записывает в два раза больше белых людей, вакцинированных, чем черные» [Бразилия регистрирует вдвое больше белых людей, вакцинированных, чем чернокожие люди]. Государственное агентство (на бразильском португальском). Архивировано из оригинала 15 марта 2021 года . Получено 28 мая 2021 года .
- ^ Schnirring L (17 мая 2021 г.). «Агентства ООН делают срочную привлекательность к дозам вакцины Covax» . Cidrap . Архивировано из оригинала 31 октября 2021 года . Получено 15 июня 2021 года .
- ^ «Первое собрание целевой группы по вакцинам, терапии и диагностике COVID-19 для развивающихся стран» . Всемирная организация здравоохранения (ВОЗ) . 30 июня 2021 года. Архивировано с оригинала 19 октября 2021 года . Получено 5 июля 2021 года .
- ^ Tapper J, McKie R (3 июля 2021 года). «Вакцины» опережают варианты », которые предупреждают, как Дельта сейчас в 98 странах» . Хранитель . Архивировано из оригинала 21 октября 2021 года . Получено 5 июля 2021 года .
- ^ Махасе Е (июль 2021 г.). «COVID-19: Страны сбрасывают вакцины, так как спрос на спад и совместное использование оказывается трудным» . BMJ . 374 : N1893. doi : 10.1136/bmj.n1893 . PMID 34315725 . S2CID 236457553 .
- ^ Левин Д. (1 августа 2021 г.). «США тратят впустую дозы вакцины, даже когда случаи растут, а другие страны страдают от нехватки» . New York Times . Архивировано из оригинала 9 августа 2021 года . Получено 10 августа 2021 года .
- ^ «Вакцины Covid-19: почему некоторые африканские государства не могут использовать свои вакцины» . BBC News . 8 июня 2021 года. Архивировано с оригинала 14 ноября 2021 года . Получено 20 августа 2021 года .
- ^ Das S (5 июля 2021 года). «Cowin Goes Gober: Индия делает Tech Open Source, 142 страны проявляют интерес» . Бизнес -стандарт Индия . Архивировано из оригинала 25 марта 2022 года . Получено 25 марта 2022 года .
- ^ «Аарогья Сеу теперь с открытым исходным кодом» . pib.gov.in (пресс -релиз). 26 мая 2020 года. Архивировано с оригинала 26 июня 2020 года . Получено 18 июля 2023 года .
- ^ «Поддержка G7 для фармацевтических монополий подвергает риску миллионы жизней» (пресс -релиз). Amnesty International. 10 июня 2021 года. Архивировано с оригинала 19 октября 2021 года . Получено 20 августа 2021 года .
- ^ «Монополии вакцины делают стоимость вакцинации мира против Covid, по крайней мере, в 5 раз дороже, чем это» (пресс -релиз). Oxfam International. 29 июля 2021 года. Архивировано с оригинала 10 января 2022 года . Получено 20 августа 2021 года .
- ^ Стиглиц J (15 декабря 2021 г.). «Если Олаф Шольц серьезно относится к прогрессу, он должен поддержать патентное отказ от веровых вакцин» . Хранитель . Архивировано из оригинала 15 декабря 2021 года . Получено 15 декабря 2021 года .
- ^ «Страны не должны позволять еще одной возможности ускользнуть от глобального отказа от преодоления монополий COVID-19 медицинских инструментов» . Médecins Sans Frontières (MSF)/врачи без границ . 13 сентября 2021 года. Архивировано с оригинала 10 октября 2021 года . Получено 23 сентября 2021 года .
- ^ «MSF требует никаких патентов или спекуляции на лекарства Covid-19 и вакцины / без каких-либо спекуляций на лекарствах и вакцинах COVID-19, говорит MSF» . Médecins Sans Frontières (MSF) International . Архивировано из оригинала 26 ноября 2021 года . Получено 23 сентября 2021 года .
- ^ «Правительства должны действовать быстро на консенсус, поддерживая исторический шаг, чтобы приостановить монополии во время пандемии / COVID-19: правительства должны наращивать консенсус вокруг отказов» . Médecins Sans Frontières (MSF) International . Архивировано из оригинала 23 октября 2021 года . Получено 23 сентября 2021 года .
- ^ «Кто прав, чтобы назвать временную остановку на пиковые бустеры вакцины» . Природа . 596 (7872): 317. август 2021 г. Бибкод : 2021natur.596..317. Полем doi : 10.1038/d41586-021-02219-w . PMID 34404945 . S2CID 237199262 .
- ^ «Кто хлопает в стремление богатых наций к выстрелам в Covid Booster, в то время как миллионы во всем мире не имеют первого удара» . Франция 24 . Agence France-Presse. 18 августа 2021 года. Архивировано с оригинала 2 ноября 2021 года . Получено 21 августа 2021 года .
- ^ Крамер Дж (18 августа 2021 г.). «США планируют разрешить бустеры, но многие уже получили третью дозу» . National Geographic . Архивировано из оригинала 10 октября 2021 года . Получено 21 августа 2021 года .
- ^ «Более 140 бывших руководителей государственных и Нобелевских лауреатов призывают кандидатов на канцлера немецкого языка отказаться от правил интеллектуальной собственности для вакцин COVID-19» . Oxfam International (пресс -релиз). 14 сентября 2021 года. Архивировано с оригинала 19 октября 2021 года . Получено 22 сентября 2021 года .
- ^ Уокер П (29 ноября 2021 г.). «Сестринские союзы по всему миру призывают к действию ООН на патенты на велосипедные вакцины» . Хранитель . Архивировано с оригинала 29 ноября 2021 года . Получено 29 ноября 2021 года .
- ^ Псаледкис Д. (22 сентября 2021 г.). «Призыв развивающихся наций богатым мировым в ООН: остановить накопление вакцины» . Рейтер . Архивировано с оригинала 10 ноября 2021 года . Получено 29 сентября 2021 года .
- ^ Peruvian Company of Services Editoriales SA Editora Perú (21 Septamber 2021). «Перу: Президент предполагает глобальное соглашение в негативном универсальном доступе к вакцинам» . Андский (на испанском). Архивировано из оригинала 30 октября 2021 года . Получено 29 сентября 2021 года .
- ^ Baraniuk C (февраль 2021 г.). «Covid-19: как до сих пор достигал развертывание вакцины в Великобритании» . BMJ . 372 : N421. doi : 10.1136/bmj.n421 . PMID 33602672 . S2CID 231946710 .
- ^ «Дополнительная доза вакцины Covid -19 мРНК для пациентов с иммунитетом» . Центры США по контролю и профилактике заболеваний (CDC) . 13 августа 2021 года. Архивировано с оригинала 7 октября 2021 года . Получено 16 августа 2021 года .
- ^ «Франция планирует развертывание выстрелов из ковидной вакцины - но только для уязвимых» . Франция 24 . 4 августа 2021 года. Архивировано с оригинала 22 октября 2021 года . Получено 16 августа 2021 года .
- ^ «Израиль предложил 3 -й ковид -бустер выстрел пожилым гражданам» . Ассошиэйтед Пресс . 29 июля 2021 года. Архивировано с оригинала 31 октября 2021 года . Получено 16 августа 2021 года .
- ^ Hunziker P (июль 2021 г.). «Персонализированная доза вакцинация Covid-19 в волне вирусных вариантов, вызывающих озабоченность: торговля индивидуальной эффективностью на социальную выгоду» . Точная наномедицина . 4 (3): 805–820. doi : 10.33218/001c.26101 . Архивировано из оригинала 9 октября 2021 года . Получено 16 августа 2021 года .
- ^ «Анализ ООН показывает связь между отсутствием вакцинного капитала и расширением разрыва в бедности» . Новости ООН . 28 марта 2022 года. Архивировано с оригинала 12 апреля 2022 года . Получено 14 апреля 2022 года .
- ^ "DCVMN" . Развивающиеся страны сеть производителей вакцин . Архивировано из оригинала 26 апреля 2022 года . Получено 26 апреля 2022 года .
- ^ Томпсон М.Г., Берджесс Дж.Л., Налеэй А.Л., Тайнер Х.Л., Юн С.К., Мис Дж. И др. (Апрель 2021 г.). «Промежуточные оценки эффективности вакцины вакцины вакцин BNT162B2 и MRNA-1273 COVID-19 в предотвращении инфекции SARS-COV-2 среди медицинских сотрудников, первых респондентов и других основных и передовых работников-восемь мест в США, декабрь 2020 года 2021 года» ( PDF) . MMWR MORB MORTAL WKLY Rep . 70 (13): 495–500. doi : 10.15585/mmwr.mm7013e3 . PMC 8022879 . PMID 33793460 . Архивировано (PDF) из оригинала 28 августа 2021 года . Получено 9 июня 2021 года .
- ^ «Когда вы были полностью вакцинированы» . Центры США по контролю и профилактике заболеваний (CDC) . 11 февраля 2020 года. Архивировано с оригинала 28 июля 2021 года . Получено 29 апреля 2021 года .
- ^ Jump up to: а беременный «Ковидные вакцины: расширение неравенства и уязвимых миллионов» . Объединенные Нации. 19 сентября 2021 года. Архивировано с оригинала 31 декабря 2021 года . Получено 30 октября 2021 года .
- ^ «Влияние неравенства в вакцинации на восстановление экономики» . Программа разработки ООН. Архивировано из оригинала 3 ноября 2021 года . Получено 30 октября 2021 года .
- ^ Elliott L (5 октября 2021 г.). «МВФ сокращает глобальный экономический прогноз как рост пандемии» . Хранитель . Архивировано из оригинала 27 октября 2021 года . Получено 6 октября 2021 года .
- ^ «Беженцы сталкиваются с тяжелыми последствиями от недофинансирования COVID-19, предупреждает УВКБ ООН» . Объединенные Нации. 17 сентября 2021 года. Архивировано с оригинала 30 октября 2021 года . Получено 30 октября 2021 года .
- ^ Jump up to: а беременный Азар А (4 февраля 2020 г.). «Уведомление о декларации в соответствии с Законом о готовности и готовности к чрезвычайным ситуациям для медицинских контрмеров против Covid-19» . Архивировано из оригинала 25 апреля 2020 года . Получено 22 апреля 2020 года .
- ^ Lintern S (2 декабря 2020 г.). «Pfizer предоставил защиту от судебного иска от вакцины вакцины на коронавируса правительством Великобритании» . Независимый . Архивировано из оригинала 5 мая 2021 года . Получено 8 мая 2021 года .
- ^ «Вопросы и ответы: условное авторизация маркетинга вакцин Covid-19 в ЕС» . Европейская комиссия . 11 декабря 2020 года. Вопрос: В чем разница в ответственности между разрешением на условное маркетинг ЕС против разрешений на чрезвычайное использование?. Архивировано из оригинала 4 октября 2021 года . Получено 29 декабря 2020 года .
- ^ «EMA рекомендует стандартные разрешения на маркетинг для Comirnaty и Spikevax COVID-19 вакцин» . Европейское агентство лекарств . 16 сентября 2022 года. Архивировано из оригинала 16 сентября 2022 года . Получено 7 октября 2022 года .
- ^ Haahr T (7 сентября 2020 года). «COVID-19: MEP хотят безопасных вакцин, полной прозрачности и ответственности за компаний» . Европейский парламент . Г-жа Галлина подчеркнула переговоры с компаниями, была трудна, но подчеркнула, что те компании, развивающие и изготовленные вакцины COVID-19, действительно несут ответственность в соответствии с текущими законами, и если что-то пойдет не так, их можно было принять в суд. Это также касается компенсации за скрытые дефекты. Архивировано из оригинала 13 октября 2021 года . Получено 29 декабря 2020 года .
- ^ «Расследование: производитель наркотиков« издевался »латиноамериканских стран» . Аль Джазира . 11 марта 2021 года. Архивировано с оригинала 31 октября 2021 года . Получено 15 июня 2021 года .
- ^ Barcellos R (13 мая 2021 г.). «Карлос Мурильо говорит, что положения, критикованные Бразилией, стоят в 110 странах» [Карлос Мурильо говорит, что критические положения для Бразилии действительны в 110 странах]. CNN Бразилия (на португальском языке). Архивировано из оригинала 28 июня 2021 года . Получено 15 июня 2021 года .
- ^ «Губернатор Рон ДеСантис ходает Верховного суда Флориды по всему государственному большему жюри по вакцинам COVID-19 и объявляет о создании комитета по вопросам целостности общественного здравоохранения» . www.flgov.com . Архивировано из оригинала 14 декабря 2022 года . Получено 14 декабря 2022 года .
- ^ «Губернатор Флориды ищет расследование большого жюри по поводу вакцин с велосипедными вакцинами» . www.theguardian.com . 13 декабря 2022 года. Архивировано с оригинала 13 декабря 2022 года . Получено 14 декабря 2022 года .
- ^ Stempel J (30 ноября 2023 г.). «Pfizer подается в суд на Техас по требованиям Covid Vaccine» . Рейтер .
- ^ Харпер Б.К. (30 ноября 2023 г.). «Генеральный прокурор Техаса влете из Pfizer, утверждая, что вакцины не заканчивали пандемией достаточно быстро» . Texas Tribune .
- ^ Пирсон Б (18 июня 2024 г.). «Канзас обвиняет Pfizer в вводящей в заблуждение общественности в проковидной вакцине в судебном процессе» . Рейтер .
- ^ «Основатель Blackwater Prince играет роль в Covid Vaccine Venture» . Рейтер . 4 июня 2021 года. Архивировано с оригинала 9 октября 2021 года . Получено 4 июня 2021 года .
- ^ Jump up to: а беременный Леонхардт Д. (11 марта 2024 г.). «Четвертая годовщина проклятой пандемии» . New York Times . Архивировано из оригинала 11 марта 2024 года. "Данные исключают Аляску. Источники: CDC Wonder; Edison Research. (Диаграмма) от New York Times . Источники диаграммы кредитов для Эшли Ву.
- ^ Линас М (20 апреля 2020 года). «Covid: 10 лучших теорий заговора» . Альянс для науки . Получено 4 октября 2021 года .
- ^ Бураковский А (28 августа 2021 г.). «Реакция России COVID-19 замедляется от населения, не желая принимать внутреннюю вакцину» . Krqe . Получено 20 сентября 2021 года .
- ^ «Ковидный пропуск берет Францию штурмом» . WLFI News . Архивировано из оригинала 20 сентября 2021 года . Получено 20 сентября 2021 года .
- ^ «MLB предлагает бесплатные билеты на прививки Covid-19» . Крон4. 4 июня 2021 года . Получено 4 октября 2021 года .
- ^ Гор D (10 мая 2021 г.). «Изучение законности мандатов вакцины Covid-19» . factcheck.org . Получено 4 октября 2021 года .
- ^ Hotez PJ (2023). Смертельный рост антинауки: предупреждение ученого . Johns Hopkins University Press. ISBN 978-1421447223 .
- ^ Bing C, Schechtman J (14 июня 2024 г.). «Пентагон провел секретную анти-VAX-кампанию, чтобы подорвать Китай во время пандемии» . Рейтер .
Дальнейшее чтение
- Copaescu AM, Rosa Duque JS, Phillips EJ (июль 2022 г.). «Что мы узнали об аллергенности и побочных реакциях, связанных с тяжелым острым дыхательным синдромом, вакцины коронавируса 2: через год» . Анналы аллергии, астмы и иммунологии . 129 (1): 40–51. doi : 10.1016/j.anai.2022.03.030 . PMC 8979618 . PMID 35390476 .
- Краузе П.Р., Флеминг Т.Р., Лонгини И.М., Пето Р., Бриан С., Хейманн Д.Л. и др. (Июль 2021 г.). «Варианты SARS-COV-2 и вакцины» . N Engl J Med . 385 (2): 179–186. Doi : 10.1056/nejmsr2105280 . PMC 8262623 . PMID 34161052 .
- Kyriakidis NC, López-Cortés A, González EV, Grimaldos AB, Prado EO (февраль 2021 г.). «Стратегии вакцин SARS-COV-2: комплексный обзор кандидатов 3 фазы» . Вакцины NPJ . 6 (1): 28. doi : 10.1038/s41541-021-00292-w . PMC 7900244 . PMID 33619260 .
- Рамсей М, ред. (2020). «Covid-19: зеленая книга, глава 14а» . Иммунизация против инфекционных заболеваний . Лондон: общественное здравоохранение Англия.
- Разработка и лицензирование вакцин для предотвращения COVID-19: Руководство для промышленности (PDF) (отчет). США Управление по контролю за продуктами и лекарствами (FDA). Июнь 2020 года.
Протоколы вакцины
- «Протокол мРНК-1273-P301» (PDF) . Современный . Архивировано из оригинала (PDF) 28 сентября 2020 года . Получено 21 сентября 2020 года .
- «Протокол C4591001 PF-07302048 (вакцины BNT162 на основе РНК-19)» (PDF) . Pfizer . Архивировано из оригинала (PDF) 6 декабря 2021 года . Получено 6 августа 2022 года .
- «Протокол AZD1222 - D8110C00001» (PDF) . Astrazeneca .
- «Протокол VAC31518COV3001; Фаза 3 (ансамбль)» (PDF) . Вакцины и профилактика Janssen .
- «Протокол VAC31518COV3009; Фаза 3 (ансамбль 2)» (PDF) . Вакцины и профилактика Janssen .
- «Протокол VAT00008-Исследование одновалентных и бивалентных рекомбинантных белковых вакцин против COVID-19 у взрослых 18 лет и более старого протокола» (PDF) . Sanofi Pasteur . Архивировано из оригинала (PDF) 23 июля 2021 года . Получено 30 июля 2021 года .
- «Протокол 2019NCOV-301» . Новавакс .
Внешние ссылки
- "Covid-19 вакцинация трекера и ландшафта" . Всемирная организация здравоохранения (ВОЗ).
- Лекция MIT 10: Kizzmekia Corbett, вакцины на YouTube
- Лекция MIT 12: Дэн Баруш, Covid-19 Development на YouTube
- «5 стадий развития вакцин Covid-19: что вам нужно знать о том, как работает клиническое испытание» . Джонсон и Джонсон. Сентябрь 2020 года.
- «Вакцина вакцины коронавируса - еженедельное резюме отчетности желтых карт» . Великобритания лекарственные средства и здравоохранение регулирующее агентство (MHRA).
- «Отчет о безопасности вакцины Covid-19-05-10-2023» . Администрация терапевтических товаров (TGA) . 4 октября 2023 года.
- Kolata G, Mueller B (15 января 2022 г.). «Остановка прогресса и счастливых несчастных случаев: как были сделаны вакцины мРНК» . New York Times . Архивировано из оригинала 15 января 2022 года.

![Карта, показывающая долю населения, полностью вакцинированная против Covid-19 относительно общего числа населения страны [Примечание 1]](http://upload.wikimedia.org/wikipedia/commons/thumb/b/b4/World_map_of_share_of_people_who_received_all_doses_prescribed_by_the_initial_COVID-19_vaccination_protocol.png/510px-World_map_of_share_of_people_who_received_all_doses_prescribed_by_the_initial_COVID-19_vaccination_protocol.png)