Кетон

В органической химии кетон — / ˈ k iː t oʊ n / органическое соединение со структурой R-C(=O)-R' собой различные углеродсодержащие , где R и R' могут представлять заместители . Кетоны содержат карбонильную группу. −C(=O)− (содержит двойную связь углерод-кислород C=O). Самый простой кетон — ацетон (где R и R’ — метил ) с формулой (СН 3 ) 2 СО . Многие кетоны имеют большое значение в биологии и промышленности. Примеры включают многие сахара ( кетозы ), многие стероиды (например, тестостерон ) и растворитель ацетон . [ 1 ]
Номенклатура и этимология
[ редактировать ]Слово «кетон» происходит от Aketon , старого немецкого слова, обозначающего ацетон . [ 2 ] [ 3 ]
Согласно правилам номенклатуры ИЮПАК , названия кетонов получаются путем замены суффикса -ан исходного алкана на -анон . Обычно положение карбонильной группы обозначается числом, но для наиболее важных кетонов, например ацетона и бензофенона , по-прежнему обычно используются традиционные несистематические названия . Эти несистематические названия считаются сохраненными названиями ИЮПАК. [ 4 ] хотя в некоторых вводных учебниках химии для простейшего кетона используются систематические названия, такие как «2-пропанон» или «пропан-2-он» ( C H 3 -C(= O )-CH 3 ) вместо «ацетона».
Производные названия кетонов получаются путем написания отдельно названий двух алкильных групп, присоединенных к карбонильной группе, с последующим отдельным словом «кетон». Традиционно названия алкильных групп записывались в порядке возрастания сложности, например метилэтилкетон . Однако по правилам номенклатуры ИЮПАК алкильные группы пишутся в алфавитном порядке, например этилметилкетон . Если две алкильные группы одинаковы, перед названием алкильной группы добавляется префикс «ди-». Положения остальных групп обозначены греческими буквами , где α-углерод — это атом, соседний с карбонильной группой.
Хотя оксо используется нечасто, он представляет собой номенклатуру ИЮПАК для оксогруппы (=O) и используется в качестве префикса, когда кетон не имеет наивысшего приоритета. Однако используются и другие префиксы. Для некоторых распространенных химических веществ (в основном в биохимии) кето относится к кетоновой функциональной группе .
Структура и свойства
[ редактировать ]
Кетоновый углерод часто называют sp. 2 гибридизированные , описание, которое включает в себя как их электронную, так и молекулярную структуру. Кетоны имеют тригональную плоскую форму вокруг кетонового углерода с валентными углами C–C–O и C–C–C примерно 120 °. Кетоны отличаются от альдегидов тем, что карбонильная группа (C=O) связана с двумя атомами углерода внутри углеродного скелета . В альдегидах карбонил связан с одним углеродом и одним водородом и расположен на концах углеродных цепей. Кетоны также отличаются от других карбонилсодержащих функциональных групп , таких как карбоновые кислоты , сложные эфиры и амиды . [ 5 ]
Карбонильная группа полярна , поскольку электроотрицательность кислорода больше, чем у углерода. Таким образом, кетоны нуклеофильны по кислороду и электрофильны по углероду. Поскольку карбонильная группа взаимодействует с водой посредством водородных связей , кетоны обычно более растворимы в воде, чем родственные метиленовые соединения. Кетоны являются акцепторами водородных связей. Кетоны обычно не являются донорами водородных связей и не могут образовывать водородные связи сами с собой. Из-за своей неспособности служить как донорами, так и акцепторами водородных связей, кетоны не склонны к «самоассоциации» и более летучи, чем спирты и карбоновые кислоты с сопоставимыми молекулярными массами . Эти факторы связаны с распространением кетонов в парфюмерии и в качестве растворителей.
Классы кетонов
[ редактировать ]Кетоны классифицируются на основе их заместителей. Одна широкая классификация подразделяет кетоны на симметричные и несимметричные производные, в зависимости от эквивалентности двух органических заместителей, присоединенных к карбонильному центру. Ацетон и бензофенон ( (C 6 H 5 ) 2 CO ) представляют собой симметричные кетоны. Ацетофенон (C 6 H 5 C(O)CH 3 ) представляет собой несимметричный кетон.
Дикетоны
[ редактировать ]Известно множество видов дикетонов, некоторые из которых обладают необычными свойствами. Самый простой – диацетил. (CH 3 C(O)C(O)CH 3 ) , когда-то использовавшийся в качестве ароматизатора масла в попкорне . Ацетилацетон (пентан-2,4-дион) практически неверное название (неподходящее название), поскольку этот вид существует в основном в виде моноенола. СН 3 С(О)СН=С(ОН)СН 3 . Его енолят — распространенный лиганд в координационной химии .
Ненасыщенные кетоны
[ редактировать ]Кетоны, содержащие алкеновые и алкиновые звенья, часто называют ненасыщенными кетонами. Наиболее широко используемым представителем этого класса соединений является метилвинилкетон . CH 3 C(O)CH=CH 2 , что полезно в реакции аннелирования Робинсона . Чтобы не было путаницы, кетон сам по себе является местом ненасыщенности; то есть его можно гидрировать .
Циклические кетоны
[ редактировать ]Многие кетоны цикличны. Самый простой класс имеет формулу (CH 2 ) n CO , где n варьируется от 2 для циклопропанона ( (CH 2 ) 2 CO ) до десятков. Существуют более крупные производные. Циклогексанон ( (CH 2 ) 5 CO ), симметричный циклический кетон, является важным промежуточным продуктом в производстве нейлона . Изофорон , полученный из ацетона, представляет собой ненасыщенный асимметричный кетон, который является предшественником других полимеров . Мускон , 3-метилпентадеканон, представляет собой феромон животного происхождения . Другой циклический кетон — циклобутанон , имеющий формулу (СН 2 ) 3 СО .
Кето-енольная таутомеризация
[ редактировать ]
Кетоны, содержащие хотя бы один альфа-водород , подвергаются кето-енольной таутомеризации ; таутомер представляет собой енол . Таутомеризация катализируется как кислотами, так и основаниями. Обычно кето-форма более стабильна, чем енольная. получать кетоны путем гидратации алкинов Это равновесие позволяет .
Кислотно-основные свойства кетонов
[ редактировать ]Связи С-Н , прилегающие к карбонилу в кетонах, более кислые (р К а ≈ 20), чем С-Н связи в алкане (p K a ≈ 50). Это различие отражает резонансную стабилизацию енолят -иона , образующегося при депротонировании . Относительная кислотность α-водорода важна в реакциях енолизации кетонов и других карбонильных соединений. Кислотность α-водорода также позволяет кетонам и другим карбонильным соединениям реагировать как нуклеофилы в этом положении как со стехиометрическим , так и с каталитическим основанием. При использовании очень сильных оснований, таких как диизопропиламид лития (LDA, p K a сопряженной кислоты ~36), в неуравновешивающих условиях (–78 °C, 1,1 экв. LDA в ТГФ, к основанию добавляется кетон), менее замещенный кинетический енолят. образуется выборочно, в то время как условия, позволяющие достичь равновесия (более высокая температура, добавление основания к кетону, использование слабых или нерастворимых оснований, например, СН 3 СН 2 ОНа в CH 3 CH 2 OH или NaH ) обеспечивает более замещенный термодинамический енолят .
Кетоны также являются слабыми основаниями и подвергаются протонированию карбонильным кислородом в присутствии кислот Бренстеда . Ионы кетония (т.е. протонированные кетоны) представляют собой сильные кислоты, значения p K a которых оцениваются где-то между –5 и –7. [ 6 ] [ 7 ] Хотя кислоты, встречающиеся в органической химии, редко бывают достаточно сильными, чтобы полностью протонировать кетоны, образование равновесных концентраций протонированных кетонов, тем не менее, является важным этапом в механизмах многих распространенных органических реакций, таких как, например, образование ацеталя. Такие слабые кислоты, как катион пиридиния (как обнаружено в тозилате пиридиния) с ap K a 5,2, могут служить катализаторами в этом контексте, несмотря на крайне неблагоприятную константу равновесия для протонирования ( K eq < 10). −10 ).
Характеристика
[ редактировать ]Альдегид отличается от кетона тем, что к его карбонильной группе присоединен атом водорода, что облегчает окисление альдегидов. Кетоны не имеют атома водорода, связанного с карбонильной группой, и поэтому более устойчивы к окислению. Они окисляются только мощными окислителями , обладающими способностью расщеплять углерод-углеродные связи.
Спектроскопия
[ редактировать ]Кетоны (и альдегиды) сильно поглощают инфракрасный спектр около 1750 см. −1 , что соответствует ν C=O («частота растяжения карбонила»). Энергия пика ниже для ариловых и ненасыщенных кетонов. [ 8 ]
Тогда как 1 H ЯМР Спектроскопия обычно бесполезна для установления присутствия кетона. 13 В спектрах ЯМР 1С наблюдаются сигналы в несколько слабом поле, около 200 м.д., в зависимости от структуры. Такие сигналы обычно слабы из-за отсутствия ядерных эффектов Оверхаузера . Поскольку альдегиды резонируют при одинаковых химических сдвигах , для окончательного различия альдегидов и кетонов используются множественные резонансные эксперименты.
Качественные органические тесты
[ редактировать ]Кетоны дают положительные результаты в тесте Брейди — реакции с 2,4-динитрофенилгидразином с образованием соответствующего гидразона. Кетоны можно отличить от альдегидов, давая отрицательный результат с помощью реактива Толленса или раствора Фелинга . Метилкетоны дают положительные результаты при йодоформной пробе . [ 9 ] Кетоны также дают положительные результаты при обработке м -динитробензолом в присутствии разбавленного гидроксида натрия, придающего фиолетовую окраску.
Синтез
[ редактировать ]Существует множество методов получения кетонов в промышленных масштабах и академических лабораториях. Кетоны также производятся организмами различными способами; см. раздел о биохимии ниже.
В промышленности наиболее важным методом, вероятно, является , часто окисление углеводородов воздухом. Например, миллиард килограммов циклогексанона производится ежегодно в результате аэробного окисления циклогексана . Ацетон получают окислением кумола воздухом .
Для специализированных или мелкомасштабных органических синтетических применений кетоны часто получают окислением вторичных спиртов :
- R 2 CH(OH) + «О» → R 2 C=O + H 2 O
Типичные сильные окислители (источник «О» в приведенной выше реакции) включают перманганат калия или соединение Cr(VI) . В более мягких условиях используют периодинан Десса-Мартина или метод Моффатта-Сверна .
Было разработано множество других методов, примеры включают: [ 10 ]
- Путем гидролиза геминальных галогенидов . [ 11 ]
- Путем гидратации алкинов . [ 12 ] Такие процессы происходят через енолы и требуют присутствия кислоты и сульфата ртути(II) ( HgSO 4 ). Последующая енол-кето-таутомеризация дает кетон. Эта реакция всегда дает кетон, даже с концевым алкином, за исключением гидратации ацетилена , в результате которой образуется ацетальдегид .
- Из амидов Вайнреба с использованием стехиометрических металлоорганических реагентов.
- Ароматические кетоны можно получить ацилированием Фриделя-Крафтса . [ 13 ] родственная реакция Губена-Хеша , [ 14 ] и перегруппировка Фриса . [ 12 ]
- Озонолиз и связанные с ним последовательности дигидроксилирования/окислителя расщепляют алкены с образованием альдегидов или кетонов, в зависимости от характера замещения алкенов. [ 15 ]
- В перегруппировке Корнблюма-ДеЛаМаре кетоны получают из пероксидов и оснований.
- При циклизации Ружички циклические кетоны получаются из дикарбоновых кислот .
- В реакции Нефа кетоны образуются при гидролизе солей вторичных нитросоединений . [ 16 ]
- В реакции Фукуямы кетоны образуются из тиоэфира и цинкорганического соединения.
- Реакцией хлорангидрида с кадмийорганическими соединениями или медьорганическими соединениями .
- Реакция Дакина-Уэста представляет собой эффективный метод получения некоторых метилкетонов из карбоновых кислот. [ 17 ]
- Кетоны можно получить реакцией реактивов Гриньяра с нитрилами с последующим гидролизом. [ 18 ]
- Декарбоксилированием . ангидрида кислоты карбоновой
- Кетоны можно получить из галокетонов восстановительным дегалогенированием галогенкетонов .
- При кетоновом декарбоксилировании из карбоновых кислот получают симметричные кетоны. [ 12 ] [ 19 ]
- Гидролиз ненасыщенных вторичных , амидов [ 20 ] β - эфиры кетокислот , [ 12 ] или β- дикетоны ( синтез ацетоуксусного эфира ).
- Кислотно-катализируемая перегруппировка 1,2 -диолов , [ 12 ] или его окисление по Криджи.
Реакции
[ редактировать ]
Кетоны участвуют во многих органических реакциях . Наиболее важные реакции следуют из восприимчивости карбонильного углерода к нуклеофильному присоединению и тенденции енолятов присоединяться к электрофилам. Нуклеофильные добавки включают в приблизительном порядке их общности: [ 10 ]
- С водой (гидратация) дает геминальные диолы , которые обычно не образуются в заметных (или наблюдаемых) количествах.
- С ацетилидом с образованием α- гидроксиалкина.
- С аммиаком или первичным амином дает имин.
- С вторичным амином дает енамин.
- С реактивами Гриньяра и литийорганическими реактивами для получения после водной обработки третичного спирта.
- Со спиртами или алкоксидами образуется полукеталь или сопряженное с ним основание. С диолом к кеталю . Эта реакция используется для защиты кетонов.
- С амидом натрия, приводящим к разрыву связи C–C с образованием амида RCONH 2 и алкана или арена R'H, происходит реакция, называемая реакцией Халлера-Бауэра. [ 21 ]
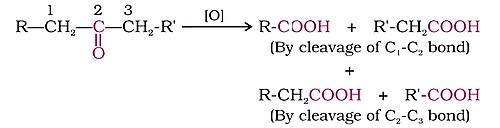
- С сильными окислителями дает карбоновые кислоты . Кетоны обычно окисляются в энергичных условиях, т. е. при использовании сильных окислителей и при повышенных температурах. Их окисление включает разрыв связи углерод-углерод с образованием смеси карбоновых кислот с меньшим количеством атомов углерода, чем исходный кетон.
- Электрофильное присоединение , реакция с электрофилом дает резонансно стабилизированный катион.
- С илидами фосфония в реакции Виттига с образованием алкенов.
- С тиолами с образованием тиоацеталя
- С гидразином или 1-дизамещенными производными гидразина образуют гидразоны .
- С гидридом металла дает соль алкоксида металла, гидролиз которого дает спирт, пример восстановления кетонов.
- С галогенами образуется α- галогенкетон — реакция, протекающая через енол (см. Галоформную реакцию ).
- С тяжелой водой с образованием α- дейтерированного кетона.
- Фрагментация в фотохимической реакции Норриша
- Реакция 1,4-аминодикетонов на оксазолы путем дегидратации в синтезе Робинсона-Габриэля.
- В случае арилалкилкетонов с серой и амином в реакции Виллгеродта образуются амиды.
- С гидроксиламином для получения оксимов
- С восстановителями с образованием вторичных спиртов
- С пероксикислотами с образованием сложных эфиров при окислении Байера-Виллигера.
Биохимия
[ редактировать ]Кетоны широко распространены в природе. Образование органических соединений при фотосинтезе происходит через кетон- рибулозо-1,5-бисфосфат . Многие сахара представляют собой кетоны, известные под общим названием кетозы . Самая известная кетоза — фруктоза ; в основном он существует в виде циклического полукетала , который маскирует функциональную группу кетона. Синтез жирных кислот происходит через кетоны. Ацетоацетат является промежуточным продуктом цикла Кребса , который высвобождает энергию из сахаров и углеводов. [ 22 ]
В медицине ацетон , ацетоацетат и бета-гидроксибутират называются кетоновыми телами , образующимися из углеводов , жирных кислот и аминокислот у большинства позвоночных , включая человека. Кетоновые тела повышаются в крови ( кетоз ) после голодания, включая ночной сон; в крови и моче при голодании ; при гипогликемии , вызванной причинами, отличными от гиперинсулинизма ; при различных врожденных нарушениях обмена веществ , намеренно вызванных кетогенной диетой , а также при кетоацидозе (обычно вследствие сахарного диабета). Хотя кетоацидоз характерен для декомпенсированного или нелеченного диабета 1 типа , при диабете 2 типа при некоторых обстоятельствах кетоз или даже кетоацидоз могут возникать и .
Приложения
[ редактировать ]Кетоны производятся в огромных масштабах в промышленности в качестве растворителей, предшественников полимеров и фармацевтических препаратов. С точки зрения масштаба наиболее важными кетонами являются ацетон , метилэтилкетон и циклогексанон . [ 23 ] Они также распространены в биохимии, но в меньшей степени, чем в органической химии в целом. Сгорание углеводородов представляет собой неконтролируемый процесс окисления, в результате которого образуются кетоны , а также многие другие типы соединений.
Токсичность
[ редактировать ]Хотя трудно сделать общий вывод о токсичности такого широкого класса соединений, простые кетоны, как правило, не очень токсичны. Эта особенность является одной из причин их популярности в качестве растворителей. Исключением из этого правила являются ненасыщенные кетоны, такие как метилвинилкетон с LD 50 7 мг/кг (перорально). [ 23 ]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Раймонд, Кеннет В. (2010). Общая органическая и биологическая химия (3-е изд.). Уайли. п. 297.
- ^ Харпер, Дуглас. «кетон» . Интернет-словарь этимологии .
- ↑ Слово «кетон» было придумано в 1848 году немецким химиком Леопольдом Гмелином . См.: Леопольд Гмелин, изд., Handbuch der Organischen Chemie: Organische Chemie im Allgemeinen … (Справочник по органической химии: Органическая химия вообще…), 4-е изд., (Гейдельберг, (Германия): Карл Винтер, 1848), том 1 , с. 40. Со страницы 40: «Zu diesen Syndesmiden scheinen auch diejenigen Verbindungen zu gehören, die als Acetone im Allegemeinen ( Ketone? ) bezeichnet werden». (К этим синдесмидам*, по-видимому, относятся и те соединения, которые обозначаются вообще как ацетоны ( кетоны? ).) [*Примечание: В 1844 году французский химик Огюст Лоран предложил новую номенклатуру органических соединений. Один из его новым классом соединений стали «синдесмиды», которые представляли собой соединения, образованные соединением двух или более более простых органических молекул (от греческого σύνδεσμος ( синдесмос , объединение) + -ид (указание на группу родственных соединений)). мог образоваться при сухой перегонке ацетатов металлов, поэтому ацетон представлял собой синдесмид двух ацетат-ионов. См.: Лоран, Огюст (1844). «Химическая классификация», Proceedings , 19 : 1089–1100; см. особенно стр. 1097.
- ^ Список сохраненных названий IUPAC. Сохраненные имена IUPAC. Ссылка. Архивировано 9 июля 2023 г. на Wayback Machine.
- ^ Макмерри, Джон Э. (1992), Органическая химия (3-е изд.), Бельмонт: Уодсворт, ISBN 0-534-16218-5
- ^ Эванс, Дэвид А. (4 ноября 2005 г.). «Таблица Эванса ПКа» (PDF) . Сайт группы Эванс . Архивировано из оригинала (PDF) 19 июня 2018 года . Проверено 14 июня 2018 г.
- ^ Смит, Майкл Б. (2013). Продвинутая органическая химия марта (7-е изд.). Хобокен, Нью-Джерси: Уайли. стр. 314–315. ISBN 978-0-470-46259-1 .
- ^ Смит, Брайан. «Облигация C = O, Часть VIII: Обзор» . Спектроскопия . Архивировано из оригинала 13 февраля 2024 года . Проверено 12 февраля 2024 г.
- ^ Мендхэм, Дж.; Денни, RC; Барнс, доктор медицинских наук; Томас, MJK (2000), Количественный химический анализ Фогеля (6-е изд.), Нью-Йорк: Прентис Холл, ISBN 0-582-22628-7
- ^ Перейти обратно: а б Смит, Майкл Б.; Марч, Джерри (2007), Продвинутая органическая химия: реакции, механизмы и структура (6-е изд.), Нью-Йорк: Wiley-Interscience, ISBN 978-0-471-72091-1
- ^ Марвел, CS; Сперри, WM (1928). «Бензофенон». Органические синтезы . 8:26 . дои : 10.15227/orgsyn.008.0026 .
- ^ Перейти обратно: а б с д и Фернисс, Брайан; Ханнафорд, Энтони; Смит, Питер; Тэтчелл, Остин (1996). Учебник практической органической химии Фогеля (5-е изд.). Лондон: Longman Science & Technique. стр. 612–623, 976–977, 982–983. ISBN 9780582462366 .
- ^ Аллен, CFH; Баркер, МЫ (1932). «Дезоксибензоин». Органические синтезы . 12:16 . дои : 10.15227/orgsyn.012.0016 .
- ^ Гулати, КЦ; Сет, СР; Венкатараман, К. (1935). «Флорацетофенон». Органические синтезы . 15:70 . дои : 10.15227/orgsyn.015.0070 .
- ^ Титце, Лутц Ф.; Братц, Матиас (1993). «Диалкилмезоксалаты путем озонолиза диалкилбензалмалонатов: диметилмезоксалат». Органические синтезы . 71 : 214. дои : 10.15227/orgsyn.071.0214 .
- ^ Хайнцельман, Р.В. (1955). «о-Метоксифенилацетон». Органические синтезы . 35 : 74. дои : 10.15227/orgsyn.035.0074 .
- ^ Уайли, Ричард Х.; Борум, Огайо (1953). «3-Ацетамидо-2-бутанон». Органические синтезы . 33 : 1. дои : 10.15227/orgsyn.033.0001 .
- ^ Моффетт, РБ; Шрайнер, Р.Л. (1941). «ω-метоксиацетофенон». Органические синтезы . 21:79 . дои : 10.15227/orgsyn.021.0079 .
- ^ Торп, Дж. Ф.; Кон, ГАР (1925). «Циклопентанон». Органические синтезы . 5 : 37. дои : 10.15227/orgsyn.005.0037 .
- ^ Хербст, РМ; Шемин, Д. (1939). «Фенилпировиноградная кислота». Органические синтезы . 19:77 . дои : 10.15227/orgsyn.019.0077 .
- ^ Реакция Галлера-Бауэра . homeip.net
- ^ Нельсон, DL; Кокс, М.М. (2000) Ленинджер, Принципы биохимии . 3-е изд. Стоит публикации: Нью-Йорк. ISBN 1-57259-153-6 .
- ^ Перейти обратно: а б Сигел, Хардо; Эггерсдорфер, Манфред (2000). «Кетоны». Энциклопедия промышленной химии Ульмана . doi : 10.1002/14356007.a15077 (неактивен 31 января 2024 г.). ISBN 9783527306732 .
{{cite book}}: CS1 maint: DOI неактивен по состоянию на январь 2024 г. ( ссылка )
Внешние ссылки
[ редактировать ] СМИ, связанные с кетонами, на Викискладе?
СМИ, связанные с кетонами, на Викискладе?

